프로게스테론
Progesterone | |
 | |
| 이름들 | |
|---|---|
| IUPAC이름 | |
| 계통 IUPAC명 (1S,3aS,3bS,9aR,9bS,11aS)-1-아세틸-9a,11a-디메틸-1,2,3,3b,4,5,8,9,9a,9b,10,11a-테트라데카하이드로-7H-사이클로펜타[a]페난트렌-7-원 | |
| 기타이름 P4;[1] 프레네디온 | |
| 식별자 | |
3D 모델(JSMO) | |
| ChEBI | |
| 쳄블 | |
| 켐스파이더 | |
| 드럭뱅크 | |
| ECHA 인포카드 | 100.000.318 |
| 케그 | |
펍켐 CID | |
| 유니아이 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C21H30O2 | |
| 어금니 질량 | 314.469g/mol |
| 융점 | 126 |
| 로그 P | 4.04[4] |
| 약리학 | |
| G03DA04 (WHO) | |
| 구강별, 국소/경피, 질, 근육주사, 피하주사, 피하이식 | |
| 약동학: | |
| OMP: <10%[5][6] | |
| • 알부민: 80% • CBG: 18% • SHBG: <1% • 무료 : 1~2%[7][8] | |
| 간(CYP2C19, CYP3A4, CYP2C9, 5α-환원효소, 17α-하이드록실화효소, 21-하이드록실화효소,[9][10] ) | |
| OMP:OMP16-18시간[5][6][11] IM:IM22-26시간[6][12] SC:SC13-18시간[12] | |
| 신장 | |
별도의 언급이 없는 경우를 제외하고, 표준 상태(25 °C [77 °F], 100 kPa에서)의 재료에 대한 데이터가 제공됩니다. | |
프로게스테론(Progesterone, P4)은 인간과 다른 [1][13]종들의 생리 주기, 임신, 배아 생성에 관여하는 내인성 스테로이드 및 프로게스테론 성호르몬입니다.그것은[13] 프로게스토겐이라고 불리는 스테로이드 호르몬 그룹에 속하며 몸의 주요 프로게스토겐입니다.프로게스테론은 몸에 중요한 여러 가지 기능을 가지고 있습니다.그것은 또한 성호르몬과 코르티코스테로이드를 포함한 다른 내인성 스테로이드의 생성에 중요한 대사 중간생성물이며,[14] 신경스테로이드로서 뇌 기능에 중요한 역할을 합니다.
프로게스테론은 천연 호르몬으로서의 역할 외에도 피임을 위한 에스트로겐과의 병용, 자궁암이나 자궁경부암의 위험을 줄이기 위한 호르몬 대체요법, 여성화 호르몬 [15]치료 등의 약물로도 사용되고 있습니다.그것은 1934년에 처음으로 처방되었습니다.[16]
생물학적 활동
프로게스테론은 몸에서 가장 중요한 프로게스토겐입니다.핵 프로게스테론 수용체(nPR)의 강력한 작용제로서(K = 1nM의 친화도를 가짐) 리보솜 전사에 대한 결과적인 효과는 여성 생식의 조절에 중요한 역할을 합니다.또한, 프로게스테론은 더 최근에 발견된 막 프로게스테론 수용체(mPR)[18]의 작용제이며, 그 중 표현은 역할을 [19]추가적으로 정의하기 위해 추가적인 연구가 필요하지만 생식 기능(난모세포 성숙, 노동, 정자 운동)과 암에서 조절 효과를 갖습니다.또한 PGRMC1(progesterone receptor membrane component 1)의 리간드로 작용하여 종양의 진행, 대사 조절 및 신경 [20][21][22]세포의 생존율 조절에 영향을 줍니다.또한 프로게스테론은 시그마 γ1 [23][24]수용체의 길항제, 니코틴성 아세틸콜린 [14]수용체의 음의 알로스테릭 조절제, 그리고 미네랄코르티코이드 수용체(MR)[25]의 강력한 길항제로 알려져 있습니다. 프로게스테론은 알도스테론과 글루코코르티코이드의 친화도를 초과하는 친화도로 이 수용체에 결합함으로써 MR의 활성화를 막습니다.코르티솔과 [25]코르티코스테론과 같은 Oid는 생리학적 농도에서 [26]natriuresis와 같은 항미네랄 코르티코이드 효과를 생성합니다.또한, 프로게스테론은 매우 낮은 효력을50 가지지만 글루코코르티코이드 수용체([27][28]GR)의 부분 작용제로서 결합하고 작용합니다.
프로게스테론은 5α-디하이드로프로게스테론 및 알로피노사놀론과 같은 신경스테로이드 활성 대사 물질을 통해 GABAA [29]수용체의 양성 알로스테릭 조절제로서 간접적으로 작용합니다.
프로게스테론 및 5β-디하이드로프로게스테론과 같은 일부 대사 물질은 약하게나마 임신 X 수용체(PXR)[30]의 작용제입니다(EC50 > 10μM).[31]이에 따라 프로게스테론은 특히 [35]평소보다 농도가 [33][34]훨씬 높은 임신 중에 CYP3A4와 같은 여러 간사이토크롬 P450 [32]효소를 유도합니다.폐경기 여성은 남성과 폐경기 여성에 비해 CYP3A4 활성이 더 큰 것으로 밝혀졌으며, 이는 폐경기 [33]여성에게 존재하는 더 높은 프로게스테론 수치 때문일 수 있다고 추론되었습니다.
프로게스테론은 CatSper(정자의 양이온 채널) 전압 개폐 Ca2+ 채널의 활성을 조절합니다.난자는 프로게스테론을 방출하기 때문에 정자는 프로게스테론을 귀소 신호로 사용하여 난자를 향해 헤엄칠 수 있습니다.그 결과 CatSper 채널에서 프로게스테론 결합 부위를 차단하는 물질이 [36][37]남성 피임에 사용될 가능성이 제기되었습니다.
생물학적 기능

호르몬 상호작용
프로게스테론은 에스트로겐이 존재할 때 증폭되는 많은 생리학적 효과를 가지고 있습니다.에스트로겐 수용체를 통한 에스트로겐은 [39]PR의 발현을 유도하거나 과잉 조절합니다.이것의 한 예는 유방 조직에서인데, 여기서 에스트로겐은 프로게스테론이 로불로알베올의 [40][41][42]발달을 매개하도록 합니다.
프로게스테론의 높은 수준은 잠재적으로 알도스테론의 나트륨 유지 활동을 감소시켜 영양염증과 세포 외 유체 부피 감소를 초래합니다.한편, 프로게스테론의 인출은 알도스테론 생성의 보상적 증가로 인한 나트륨 보유의 일시적인 증가(감소된 나트륨, 세포외 유체 부피의 증가)와 관련이 있으며, 이는 이전에 증가된 수준의 프로게스테론에 [43]의한 미네랄 코르티코이드 수용체의 차단과 싸웁니다.
초기 성분화
프로게스테론은 초기 인간의 성적 [44]분화에 역할을 합니다.태반 프로게스테론은 백도어 경로를 통해 생성되는 5α-디하이드로테스토스테론(DHT)의 공급 원료이며,[45] 반면 이 경로의 결핍은 남성 태아의 불완전한 검증을 초래하여 남성 [46][47]생식기의 불완전한 발달을 초래합니다.DHT는 음경과 음낭을 포함한 남성 생식기의 발달을 담당하는 강력한 안드로겐입니다.
초기 태아 발달 동안 분화되지 않은 생식선은 고환이나 난소로 발달할 수 있습니다.Y 염색체의 존재는 고환의 발달로 이어집니다.그리고 나서 그 고환들은 테스토스테론을 생산하고, 테스토스테론은 5α-환원효소를 통해 DHT로 전환됩니다.DHT는 외부 생식기의 남성화와 전립선의 발달을 담당하는 강력한 안드로겐입니다.임신 중 태반에 의해 생성된 프로게스테론은 백도어 경로를 통해 DHT의 합성을 위한 전구체 분자로서 역할을 함으로써 태아의 성분화에 역할을 합니다.태아 발달 중 적절한 수준의 스테로이드 생성 효소가 없을 경우 DHT 합성을 위한 백도어 경로가 부족해져 남성 태아의 저남성화를 초래할 수 있습니다.이것은 모호한 성기나 심지어 여성 성기를 발달시키는 결과를 낳을 수 있습니다.따라서, DHT와 프로게스테론 모두 초기 태아 성분화에 중요한 역할을 하며, 프로게스테론은 DHT 합성을 위한 전구체 분자로 작용하고 DHT는 남성 [44]생식기의 발달을 촉진합니다.
생식계

프로게스테론은 수정이 일어나기 전에 여성관을 통해 이동할 때 인간 정자에 비유전적 신호 전달을 통해 핵심적인 영향을 미치지만, 수용체는 [48]아직 밝혀지지 않았습니다.프로게스테론에 반응하여 정자에서 발생하는 사건들의 세부적인 특징은 세포 내 칼슘 과도현상을 포함한 특정 사건들을 설명하고 [49]현재 운동을 [51]조절하는 것으로 생각되는 느린 칼슘 [50]진동을 유지했습니다.그것은 [52]난소에 의해 생성됩니다.프로게스테론은 또한 문어 정자에 [53]대한 효과를 입증하는 것으로 나타났습니다.
프로게스테론은 [54]"임신의 호르몬"이라고 불리기도 하며, 태아의 발달과 관련된 많은 역할을 합니다.
- 프로게스테론은 자궁내막을 분비 단계로 전환하여 자궁 삽입을 준비합니다.동시에 프로게스테론은 질 상피와 자궁경부 점액에 영향을 주어, 그것을 두껍고 정자에게 침투하지 못하게 만듭니다.프로게스테론은 자궁내막 상피 세포에서 항미토겐성이므로 [55]에스트로겐의 열대 영향을 완화합니다.임신이 되지 않으면 프로게스테론 수치가 떨어져 월경을 하게 됩니다.정상적인 월경 출혈은 프로게스테론 금단 출혈입니다.배란이 일어나지 않고 황체가 발달하지 않으면 프로게스테론 수치가 낮아져 배란기능장애 자궁출혈이 발생할 수 있습니다.
- 착상과 임신 중에 프로게스테론은 임신 [56]수용을 허용하기 위해 모체 면역 반응을 감소시키는 것으로 보입니다.
- 프로게스테론은 자궁 평활근의 [54]수축력을 감소시킵니다.이 효과는 조기진통 [56]예방에 기여합니다.연구 결과에 따르면 단태아를 임신한 여성의 경우 산전기 무증상으로 자연분만 위험이 높은 경우 질 프로게스테론 제제가 자연분만 예방에 효과가 있는 것으로 나타났습니다.자연분만의 위험이 높은 여성은 자궁경부가 25mm 미만으로 짧거나 이전에 자연분만을 한 적이 있는 사람입니다.비록 조산은 일반적으로 37주 미만으로 간주되지만, 이 연구들은 질 프로게스테론이 34주 [57]미만의 조산보다 적은 수의 조산과 관련이 있다는 것을 발견했습니다.
- 프로게스테론 수치의 감소는 아마도 노동의 시작을 촉진시키는 한 단계일 것입니다.
- 또한, 프로게스테론은 임신 중에 수유를 억제합니다.분만 후 프로게스테론 수치가 떨어지는 것이 우유 생산의 계기 중 하나입니다.
태아는 태반 [45]프로게스테론을 대사시켜 부신 스테로이드를 생산합니다.
젖가슴
로불로아정맥 발달
프로게스테론은 여성의 유방 발달에 중요한 역할을 합니다.프로락틴과 함께 임신 중 유선의 소포체 성숙을 매개하여 모유를 생산하고, 따라서 출산(출산)[58] 후 자손의 수유와 모유 수유를 가능하게 합니다.에스트로겐은 유방 조직에서 PR의 발현을 유도하고, 따라서 프로게스테론은 에스트로겐에 의존하여 로불로알베올의 [40][41][42]발달을 매개합니다.프로게스테론 유도 로불로알베올 [59]성숙의 중요한 하류 매개체임이 밝혀졌습니다.RANKL 녹아웃 마우스는 정상적인 유선관 발달을 포함하여 PR 녹아웃 마우스와 거의 동일한 유선 표현형을 보여주지만 로불로아포 구조 [59]발달의 완전한 실패를 보여줍니다.
도관발달
(ERα를 통해)[60][61] 유선 발달의 주요 매개자인 에스트로겐보다 훨씬 적은 범위이지만, 프로게스테론은 유선의 관 발달에 [62]어느 정도 관여할 수도 있습니다.PR 녹아웃 마우스 또는 PR 길항제 미페프리스톤으로 처리된 마우스는 [62]사춘기에 정상적인 유선관 발달이 지연되었음을 보여줍니다.또한 PRA의 과발현을 갖도록 변형된 마우스는 도관 과형성을 [59]나타내고, 프로게스테론은 마우스 유선에서 [62]도관 성장을 유도합니다.프로게스테론은 주로 암피레굴린(amphiregulin)의 발현 유도를 통해 도관의 발달을 매개하는데, 이는 에스트로겐이 주로 도관의 [62]발달을 매개하도록 유도하는 성장 인자와 동일합니다.이러한 동물의 발견은 완전한 유선관 발달에 필수적이지는 않지만 프로게스테론이 에스트로겐 매개 유선관 [62]발달에 잠재적이거나 가속적인 역할을 하는 것처럼 보인다는 것을 암시합니다.
유방암 위험도
프로게스테론은 유방암의 병태생리에도 관여하는 것으로 보이지만, 그 역할과 유방암 위험의 촉진제인지 억제제인지에 대해서는 아직 완전히 [63][64]밝혀지지 않았습니다.메드록시프로게스테론아세테이트와 같은 대부분의 프로게스틴, 또는 합성 프로게스테론은 갱년기 호르몬 [65][64]치료의 구성 요소로서 에스트로겐과 결합하여 폐경 후 여성의 유방암 위험을 증가시키는 것으로 밝혀졌습니다.천연 경구 프로게스테론 또는 비정형 프로게스틴 디드로게스테론과 에스트로겐의 결합은 프로게스틴과 [66][67][68]에스트로겐보다 유방암의 위험이 적은 것과 관련이 있습니다.그러나 이것은 단순히 경구 프로게스테론으로 [63][69]생성된 낮은 프로게스테론 수준의 인공물일 수 있습니다.유방암에서 [64]프로게스테론의 역할에 대해서는 더 많은 연구가 필요합니다.
피부건강
에스트로겐 수용체와 프로게스테론 수용체는 각질세포와 [70][71]섬유아세포를 포함한 피부에서 검출되었습니다.폐경기 이후 여성 성호르몬의 감소는 피부의 위축, 얇아짐, 그리고 주름의 증가를 초래하고 피부 탄력, 단단함, 그리고 [70][71]힘을 감소시킵니다.이러한 피부 변화는 피부 노화의 가속화를 구성하며 콜라겐 함량의 감소, 표피 피부 세포의 형태 변화의 불규칙성, 피부 섬유 사이의 지상 물질의 감소, 모세혈관 [70][71]및 혈류의 감소 등의 결과로 발생합니다.또한 갱년기에는 피부 수분과 표면 지질(세범 생성)[70]이 감소하여 피부가 더욱 건조해집니다.만성노화, 광노화와 함께 폐경기의 에스트로겐 결핍은 피부노화에 [70]주요한 영향을 미치는 세 가지 주요 요인 중 하나입니다.
에스트로겐 단독 또는 프로게스토겐과 함께 전신 치료로 구성된 호르몬 대체 요법은 폐경기 [70][71]여성의 피부에 잘 기록되어 있고 상당한 유익한 효과가 있습니다.이러한 이점은 피부 콜라겐 함량 증가, 피부 두께 및 탄력, 피부 수분 및 표면 [70][71]지질을 포함합니다.국소 에스트로겐은 [70]피부에 이로운 효과가 비슷한 것으로 밝혀졌습니다.또한 국소 2% 프로게스테론 크림은 피부 탄력과 탱탱함을 유의하게 증가시키고 폐경기와 폐경기 이후 [71]여성의 주름을 관찰할 수 있게 감소시킨다는 연구 결과도 있습니다.반면 피부수분과 표면지질은 국소 프로게스테론에 [71]따라 유의한 변화가 없었습니다.
이러한 연구 결과는 프로게스테론이 에스트로겐과 같이 피부에 유익한 효과를 가지고 있으며, 독립적으로 [71]피부 노화를 예방할 수 있음을 시사합니다.
섹슈얼리티
리비도
프로게스테론과 그의 신경스테로이드 활성 대사 물질인 알로피스타놀론은 [72]여성의 성욕에 중요하게 관여하는 것으로 보입니다.
동성애
포츠머스 대학의 다이애나 플라이슈만 박사와 동료들은 92명의 여성을 대상으로 프로게스테론과 성적 태도 사이의 관계를 조사했습니다.성적 행동 기록 보관소(Archives of Sexual Behavior)에 발표된 그들의 연구는 프로게스테론 수치가 높은 여성들이 동성애 동기를 측정하는 설문지에서 더 높은 점수를 얻었다는 것을 발견했습니다.그들은 또한 프로게스테론 [73][74][75][76]수치가 높은 남성들이 낮은 남성들에 비해 계열적인 자극 후에 호모에로틱 동기부여 점수가 더 높다는 것을 발견했습니다.
신경계
프로게스테론은, 프레네놀론이나 디하이드로에피안드로스테론과 같이, 뉴로스테로이드라고 불리는 중요한 내인성 스테로이드 그룹에 속합니다.그것은 [77]중추신경계의 모든 부분에서 대사될 수 있습니다.
뉴로스테로이드는 신경 조절제이며, 신경 보호적이고, 신경 유전적이며, 신경 전달과 [78]골수화를 조절합니다.신경스테로이드로서의 프로게스테론의 효과는 주로 핵이 아닌 PR, 즉 mPRs 및 PGRMC1과의 상호작용뿐만 아니라 γ1 및 nACH [79]수용체와 같은 특정한 다른 수용체와의 상호작용을 통해 매개됩니다.
뇌손상
이전의 연구들은 프로게스테론이 뇌의 뉴런의 정상적인 발달을 지원하고, 그 호르몬이 손상된 뇌 조직에 대한 보호 효과를 가지고 있다는 것을 보여주었습니다.동물 모델에서 여성들이 외상적인 뇌 손상에 대한 민감성을 감소시켰다는 것이 관찰되었고, 이러한 보호 효과는 [80]여성의 에스트로겐과 프로게스테론의 증가된 순환 수준에 의해 발생한다는 가설이 세워졌습니다.
제안 메커니즘
프로게스테론 보호 효과의 메커니즘은 뇌 외상과 [81][82]출혈에 따르는 염증의 감소일 수 있습니다.
외상성 뇌 손상으로 인한 손상은 부분적으로 집단 탈분극이 흥분 독성으로 이어지는 것으로 추정됩니다.프로게스테론이 이러한 흥분 독성의 일부를 완화하는 데 도움을 주는 한 가지 방법은 신경 전달 물질 [83]방출을 유발하는 전압 의존적 칼슘 채널을 차단하는 것입니다.이 릴리스에 관련된 전사 인자의 신호 경로를 조작함으로써 이를 수행합니다.흥분독성을 줄이기 위한 또 다른 방법은 광범위한 억제성 신경전달물질 [84]수용체인A GABA를 상향 조절하는 것입니다.
프로게스테론은 또한 뇌 [85]손상의 흔한 결과인 뉴런의 세포 자멸을 예방하는 것으로 나타났습니다.활성화된 카스파아제 3 및 시토크롬 c와 같은 미토콘드리아와 관련된 세포사멸 경로에 관여하는 효소를 억제함으로써 수행됩니다.
프로게스테론은 더 이상의 손상을 막는 데 도움을 줄 뿐만 아니라 신경 [86]재생에도 도움을 주는 것으로 나타났습니다.외상성 뇌손상의 심각한 영향 중 하나는 부종을 포함합니다.동물 연구에 따르면 프로게스테론 치료는 손상된 [83][87]조직으로 보내진 대식세포와 미세아교의 농도를 증가시킴으로써 부종 수치를 감소시킨다고 합니다.이는 프로게스테론 치료를 받은 쥐의 2차 회복에서 혈액뇌장벽으로부터의 누출이 감소되는 형태로 관찰되었습니다.또한 프로게스테론은 항산화성을 가지는 것으로 관찰되어 산소 자유 라디칼의 농도가 [84]없는 경우보다 빠르게 감소하는 것으로 나타났습니다.또한 프로게스테론을 첨가하면 외상으로 인해 손상된 축삭을 다시 제거하여 잃어버린 신경 신호 [84]전도를 복구하는 데 도움을 줄 수 있다는 증거도 있습니다.프로게스테론이 재생을 돕는 또 다른 방법은 [88]뇌의 내피 전구 세포의 순환을 증가시키는 것을 포함합니다.이것은 상처 조직 주위에 새로운 혈관이 자라도록 도와 모욕 부위를 치료하는 데 도움이 됩니다.
중독
프로게스테론은 뇌의 세로토닌 수용체의 기능을 향상시켜서, 프로게스테론의 과잉 혹은 결핍은 심각한 신경화학적 문제를 일으킬 가능성이 있습니다.이것은 일부 사람들이 프로게스테론 수치가 최적 수준 [89]이하로 떨어질 때 니코틴, 알코올, 대마초와 같은 세로토닌 활성을 강화시키는 물질에 의존하는 이유에 대한 설명을 제공합니다.
- 호르몬 수준의 성별 차이는 여성이 니코틴에 대해 남성과 다르게 반응하도록 유도할 수 있습니다.여성들이 주기적인 변화를 겪거나 다양한 호르몬 전이 단계(메노페스, 임신, 청소년기)를 겪을 때, 그들의 프로게스테론 [90]수치에 변화가 있습니다.그러므로, 여성들은 남성들에 비해 니코틴의 강화 효과에 대해 증가된 생물학적인 취약성을 가지고 있고, 이러한 강화된 취약성에 대항하기 위해 프로게스테론이 사용될 수 있습니다.이 정보는 프로게스테론이 [89]행동에 영향을 줄 수 있다는 생각을 뒷받침합니다.
- 니코틴과 비슷하게, 코카인은 뇌에서 도파민의 분비를 증가시킵니다.신경전달물질은 보상센터에 관여하며 약물 남용과 의존과 관련된 주요 신경전달물질 중 하나입니다.코카인 사용자들을 대상으로 한 연구에서, 프로게스테론이 코카인에 의해 자극을 받는 느낌과 갈망을 감소시켰다고 보고되었습니다.따라서 프로게스테론은 [91]약물의 도파민 작용을 감소시켜 코카인 갈망을 감소시키는 작용제로 제시되었습니다.
소셜
2012년 암스테르담 대학에서 120명의 여성을 대상으로 한 연구에서, 여성의 황체기(프로게스테론의 높은 수준, 그리고 에스트로겐의 증가하는 수준)는 도박과 수학 대회 시나리오에서 낮은 수준의 경쟁 행동과 상관관계가 있는 반면, 월경 전 단계(프로게스테론의 급격한 감소 수준,그리고 에스트로겐의 감소 수준)은 더 높은 [92]수준의 경쟁 행동과 상관관계가 있었습니다.
기타효과
- 프로게스테론은 또한 피부 탄력과 뼈의 힘, 호흡, 신경 조직 그리고 여성의 성에 있어서의 역할을 가지고 있고, 특정 근육과 지방 조직에 프로게스테론 수용체의 존재는 그것들의 [93][infringing link?]성적 이형성 비율에 있어서의 역할을 암시할 수 있습니다.
- 임신 중 프로게스테론은 자궁 [94]과민성을 감소시킨다고 합니다.
- 임신 중에, 프로게스테론은 태아 항원에 대한 어머니의 면역 반응을 억제하는데 도움을 주고,[94] 이것은 태아에 대한 거부 반응을 막습니다.
- 프로게스테론은 줄기세포의 [95]증식을 유도하고 배양을 유지하는 데 사용되는 종종 사용되는 표피 성장인자-1(EGF-1) 수준을 증가시킵니다.
- 프로게스테론은 [96][97]배란 중 코어 온도(열생성 기능)를 증가시킵니다.
- 프로게스테론은 경련을 줄이고 부드러운 근육을 이완시킵니다.기관지가 넓어지고 점액이 조절됩니다. (PR은 점막하 조직에 널리 존재합니다.)
- 프로게스테론은 소염제 역할을 하며 면역 반응을 조절합니다.
- 프로게스테론은 담낭 [98]활동을 감소시킵니다.
- 프로게스테론은 혈액 응고와 혈관 톤, 아연과 구리 수치, 세포 산소 수치, 에너지를 위한 지방 저장고의 사용을 정상화합니다.
- 프로게스테론은 잇몸 건강에 영향을 미쳐 치은염(잇몸 염증)[99]의 위험을 높일 수 있습니다.
- 프로게스테론은 에스트로겐의 효과를 조절함으로써 자궁내막암을 예방하는 것으로 보입니다.
- 프로게스테론은 인슐린 분비와 췌장 기능의 신호 전달에 중요한 역할을 하며, 당뇨병이나 임신성 [100][101]당뇨병에 대한 민감성에 영향을 줄 수 있습니다.
- 체외수정을 [102]통해 임신한 여성 중 체중이 증가하고 체질량이 증가한 여성에게서 혈중 프로게스테론 수치가 더 낮게 나타났습니다.
- 현재 데이터에 따르면 미세화된 프로게스테론은 여성의 체내에서 생성되는 프로게스테론과 화학적으로 동일하며,갱년기 호르몬 치료에서 에스트로겐과 결합하면 정맥혈전색전증(정맥 내 혈전)과 허혈성 뇌졸중(뇌를 공급하는 혈관이 막혀 뇌로 가는 혈류가 끊기는 것)에 큰 영향을 미치지 않는 것으로 보입니다.다만 미세화된 프로게스테론 단독 요법이나 복합 갱년기 호르몬 요법이 심근경색(심장마비)[103]의 위험을 변화시키는지는 좀 더 많은 연구가 진행될 필요가 있습니다.
- 미세화된 프로게스테론이 [104]갱년기로 인한 탈모에 미치는 영향에 대해서는 아직까지 연구된 바가 없습니다.
- 폐경 후 여성(50세 이상)의 근육량 감소를 예방하기 위해 호르몬 요법을 사용해야 한다는 제안에도 불구하고 에스트로겐 단독 요법 또는 에스트로겐과 프로게스테론을 사용하는 갱년기 호르몬 요법은 근육량을 유지하는 [105]것으로 확인되지 않았습니다.갱년기 호르몬 치료는 또한 체중 감소, BMI 감소, 포도당 [106]대사의 변화를 초래하지 않습니다.
생화학
생합성

포유류의 경우, 다른 모든 스테로이드 호르몬들처럼, 프로게스테론은 콜레스테롤로부터 유래된 프레네놀론으로부터 합성됩니다.
콜레스테롤은 이중 산화를 거쳐 22R-하이드록시콜레스테롤과 20α,22R-디하이드록시콜레스테롤을 생성합니다.이 바이시날 디올은 C22 위치에서 시작되는 측쇄의 손실과 함께 추가로 산화되어 프레네놀론을 생성합니다.이 반응은 시토크롬 P450scc에 의해 촉매됩니다.
임신한 사람이 프로게스테론으로 전환되는 것은 두 단계로 이루어집니다.첫째, 3β-하이드록실기가 케토기로 산화되고, 둘째, 이중결합은 케토/엔올 자동화 [108]반응을 통해 C5에서 C4로 이동됩니다.이 반응은 3β-하이드록시스테로이드 탈수소효소/에폭시-이성질체효소에5-4 의해 촉매됩니다.
프로게스테론은 차례로 미네랄 코르티코이드 알도스테론의 전구체이며, 17α-하이드록시 프로게스테론으로 전환된 후 코르티솔과 안드로스테디온의 전구체입니다.안드로스텐디온은 테스토스테론, 에스트론, 에스트라디올로 전환될 수 있으며, 테스토스테론 합성에서 프로게스테론의 중요한 역할을 강조합니다.
프레네놀론과 프로게스테론은 [109]효모에 의해서도 합성될 수 있습니다.
여성의 경우 하루에 약 25mg의 프로게스테론이 난소에서 분비되는 반면 부신은 하루에 [110]약 2mg의 프로게스테론을 생산합니다.
| 섹스. | 성호르몬 | 생식 단계 | 피 생산율 | 고나달 분비율 | 대사적 정리율 | 기준 범위(세럼 레벨) | |
|---|---|---|---|---|---|---|---|
| SI 단위들 | 비단위SI | ||||||
| 남자들 | 안드로스테네디온 | – | 2.8 mg/일 | 1.6 mg/일 | 2200 L/day | 2.8~7.3nmol/L | 80-210ng/dL |
| 테스토스테론 | – | 6.5 mg/일 | 6.2 mg/일 | 950 L/day | 6.9~34.7nmol/L | 200-1000ng/dL | |
| 에스트론 | – | 하루에 150μg | 110μg/일 | 2050 L/day | 37–250 pmol/L | 10-70 pg/mL | |
| 에스트라디올 | – | 일 60μg | 하루 50μg | 1600 L/day | <37-210pmol/L | 10-57pg/mL | |
| 황산에스트론 | – | 일 80μg | 보잘것없는 | 167 L/day | 600-2500 pmol/L | 200~900pg/mL | |
| 여성들. | 안드로스테네디온 | – | 3.2 mg/일 | 2.8 mg/일 | 2000 L/day | 3.1~12.2 nmol/L | 89–350ng/dL |
| 테스토스테론 | – | 하루 190μg | 일 60μg | 500L/일 | 0.7~2.8nmol/L | 20-81ng/dL | |
| 에스트론 | 난포상 | 110μg/일 | 일 80μg | 2200 L/day | 110-400pmol/L | 30~110pg/mL | |
| 황체상 | 260μg/일 | 하루에 150μg | 2200 L/day | 310-660 pmol/L | 80–180 pg/mL | ||
| 폐경 후 일시정지 | 하루 40μg | 보잘것없는 | 1610 L/일 | 22-230pmol/L | 6–60 pg/mL | ||
| 에스트라디올 | 난포상 | 일 90μg | 일 80μg | 1200 L/day | <37-360pmol/L | 10-98 pg/mL | |
| 황체상 | 일 250μg | 일240μg | 1200 L/day | 699–1250 pmol/L | 190~341pg/mL | ||
| 폐경 후 일시정지 | 1일 6μg | 보잘것없는 | 910 L/일 | <37-140pmol/L | 10~38pg/mL | ||
| 황산에스트론 | 난포상 | 하루 100μg | 보잘것없는 | 146 L/일 | 700-3600 pmol/L | 250-1300 pg/mL | |
| 황체상 | 일 180μg | 보잘것없는 | 146 L/일 | 1100-7300 pmol/L | 400~2600pg/mL | ||
| 프로게스테론 | 난포상 | 하루에 2mg | 1.7 mg/일 | 2100 L/day | 0.3~3nmol/L | 0.1~0.9ng/mL | |
| 황체상 | 하루 25mg | 24mg/일 | 2100 L/day | 19~45nmol/L | 6-14ng/mL | ||
노트 및 소스 참고: "순환에서 스테로이드의 농도는 분비선에서 분비되는 비율, 전구체 또는 호르몬이 스테로이드로 대사되는 비율, 조직에 의해 추출되어 대사되는 비율에 의해 결정됩니다.스테로이드의 분비율은 단위 시간당 분비선으로부터 화합물이 총 분비되는 것을 말합니다.분비율은 시간이 지남에 따라 선으로부터 정맥 배출물을 샘플링하고 동맥 및 말초 정맥 호르몬 농도를 빼냄으로써 평가되었습니다.스테로이드의 대사 제거율은 단위 시간당 호르몬이 완전히 제거된 혈액의 양으로 정의됩니다.스테로이드 호르몬의 생성 속도는 분비선으로부터의 분비와 관심있는 스테로이드로의 프로호르몬의 전환을 포함하여 가능한 모든 원천으로부터 화합물의 혈액으로 들어가는 것을 말합니다.안정적인 상태에서 모든 공급원에서 혈액으로 들어오는 호르몬의 양은 혈액 농도(생산율 = 대사량 클리어런스율 × 농도)에 클리어링 중인 비율(클리어링율)과 같습니다.프로호르몬 대사가 스테로이드의 순환 풀에 거의 기여하지 않는다면, 생산 속도는 분비 속도에 근접할 것입니다."출처:템플릿 참조. | |||||||
분배
프로게스테론은 알부민(50~54%)과 트랜스코르틴(43~48%)[111]을 포함한 혈장 단백질과 광범위하게 결합합니다.PR에 [17]비해 알부민에 대한 친화력이 비슷합니다.
신진대사
프로게스테론의 대사는 빠르고 광범위하며 주로 [112][113][114]간에서 발생하지만, 프로게스테론을 대사하는 효소는 뇌, 피부 및 기타 여러 간외 [77][115]조직에서도 광범위하게 발현됩니다.프로게스테론은 약 5분간만 유통됩니다.[112]프로게스테론의 대사는 복잡하며,[114][116] 경구 섭취 시 35가지의 다양한 비결합 대사 물질을 형성할 수 있습니다.프로게스테론은 (C4와 C5 위치 사이의) 이중 결합과 (C3와 C20 [114]위치의) 두 케톤 때문에 환원효소와 히드록시스테로이드 탈수소효소를 통한 효소 감소에 매우 민감합니다.
프로게스테론의 주요 대사 경로는 각각 5α-환원효소와[77] 5β-환원효소에 [113][114][117][118]의한 이수소화된 5α-디하이드로프로게스테론과 5β-디하이드로프로게스테론으로의 환원입니다.이에 따라, 3α-하이드록시스테로이드 탈수소효소 및 3β-하이드록시스테로이드 탈수소효소를 통해 테트라하이드로겐화된 알로피스타놀론, 임신놀론, 이소피스타놀론 [119][113][114][117]및 에피피스타놀론으로 이러한 대사산물이 추가로 환원됩니다.이어서, 20α-하이드록시스테로이드 탈수소효소 및 20β-하이드록시스테로이드 탈수소효소는 이들 대사물을 상응하는 헥사하이드로겐화된 임부네디올(총 [113][118]8개의 상이한 이성질체)을 형성하도록 환원시키고, 이들은 이어서 글루쿠로나이드화 및/또는 황화를 통해 결합되고, 간으로부터 순환하도록 방출되는,그리고 신장에서 [112][114]소변으로 배설됩니다.소변에서 프로게스테론의 주요 대사산물은 프로게스테론 [17][120]주사의 15~30%를 구성하는 것으로 밝혀진 임신디올 글루쿠로니드의 3α,5β,20α 이성질체입니다.이 경로에서 효소에 의해 형성되는 프로게스테론의 다른 대사 산물로는 3α-디하이드로프로게스테론, 3β-디하이드로프로게스테론, 20α-디하이드로프로게스테론, 20β-디하이드로프로게스테론 및 20β-디하이드로프로게스테론이 있으며, 이들은 이미 [17][114][120][121]언급된 것 외에도 효소들의 다양한 조합 생성물을 포함합니다.또한 프로게스테론은 먼저 하이드록실화되고([114]아래 참조) 환원될 수 있습니다.내인성 프로게스테론은 황체에서 5α-디하이드로프로게스테론으로 약 50%, 간에서 3β-디하이드로프로게스테론으로 35%, 20α-디하이드로프로게스테론으로 [122]약 10%가 대사됩니다.
프로게스테론의 비교적 작은 부분들은 17α-하이드록실라아제(CYP17A1) 및 21-하이드록실라아제(CYP21A2)[116]를 통해 각각 17α-하이드록실라아제 및 11-디옥시코르티코스테론(21-하이드록실라아제)으로 하이드록실화되고, 임신네트리올은 17α-하이드록실화에 [123][124]2차적으로 형성됩니다.더 적은 양의 프로게스테론은 또한 11β-하이드록실레이스(CYP11B1)를 통해 하이드록실화될 수 있으며, 알도스테론 합성효소(CYP11B2)를 통해 11β-하이드록시프로게스테론으로 [125][126][44]더 적은 양으로 하이드록실화될 수 있습니다.또한 프로게스테론은 스테로이드 [127]특이적이지 않은 다른 사이토크롬 P450 효소에 의해 간에서 하이드록실화될 수 있습니다. 주로 CYP3A4에 의해 촉매되는 6β-하이드록실화가 주요 변형이며, 사이토크롬 P450 매개 프로게스테론 [127]대사의 약 70%를 담당합니다.다른 경로로는 6α-,[114] 16α- 및 16β-하이드록실화가 있습니다.그러나 CYP3A4의 강력한 억제제인 케토코나졸로 여성을 치료한 결과 프로게스테론 수치에 미치는 영향이 미미하여 미미한 증가만 초래하였으며, 이는 시토크롬 P450 효소가 프로게스테론 [128]대사에서 작은 역할만을 수행하고 있음을 시사합니다.
레벨들

여성의 경우 프로게스테론 수치는 위의 도표에서 보는 바와 같이 월경주기의 전배란기에는 비교적 낮고 배란 후에는 상승하며 황체기에는 상승합니다.프로게스테론 수치는 배란 전에는 2ng/mL 미만, 배란 후에는 5ng/mL 이상인 경향이 있습니다.임신이 되면 인간 융모성 고나도트로핀이 분비돼 황체를 유지하고 프로게스테론 수치를 유지할 수 있습니다.7주에서 9주 사이에, 태반은 황체-태반 [131]이동이라고 불리는 과정에서 황체 대신 프로게스테론을 생산하기 시작합니다.
황체-태반 이동 후 프로게스테론 수준이 더 높아지기 시작하며, 온도가 100~200ng/mL에 이를 수 있습니다.프로게스테론 수준의 감소가 노동 개시에 중요한지 여부가 주장되어 왔으며 종별로 특이적일 수 있습니다.태반 분만 후와 수유 중에는 프로게스테론 수치가 매우 낮습니다.
프로게스테론 수치는 소아와 폐경 후 [132]여성에서 낮습니다.성인 남성은 월경 주기의 여포기 동안 여성과 비슷한 수치를 가집니다.
| 그룹. | P4 생산. | P4 레벨들 | ||
|---|---|---|---|---|
| 사춘기 전 어린이 | ND | 0.06–0.5 ng/mL | ||
| 사춘기 소녀들 태너 1기(유아기) 태너 2기(8~12세) 태너 3기(10~13세) 태너 4기(11~14세) 태너 5기(12~15세) 여포기(1~14일차) 황체기(15~28일) | ND ND ND ND ND ND | 0.22(<0.10–0.32) ng/mL 0.30 (0.10–0.51) ng/mL 0.36 (0.10–0.75) ng/mL 1.75 (<0.10–25.0) ng/mL 0.35 (0.13–0.75) ng/mL 2.0~25.0ng/mL | ||
| 폐경 전 여성 여포기(1~14일차) 황체기(15~28일) 경구피임제(난소) | 0.75–5.4 mg/일 15–50mg/일 ND | 0.02–1.2 ng/mL 4-30ng/mL 0.1~0.3ng/mL | ||
| 폐경 후의 여성 난공불락 여성 난소절제술을 받은 여성과 부신절제술을 받은 여성 | ND 1.2 mg/일 <0.3 mg/일 | 0.03–0.3ng/mL 0.39ng/mL ND | ||
| 임산부 1학기(1~12주) 2학기(13~26주) 3기(27~40주) 산후조리(24시간) | 55mg/일 92–100 mg/일 190–563mg/일 ND | 9~75ng/mL 17~146ng/mL 55~255ng/mL 19ng/mL | ||
| 남자들 | 0.75–3 mg/일 | 0.1~0.3ng/mL | ||
| 참고: 평균 수준은 단일 값으로 제공되며 범위는 괄호 뒤에 제공됩니다.출처: | ||||
범위
혈액 검사 결과는 항상 결과를 수행한 검사실에서 제공한 기준 범위를 사용하여 해석해야 합니다.아래에 예시적인 기준 범위가 나와 있습니다.
| 인물형 | 혈액검사 기준범위 | ||
|---|---|---|---|
| 하한선 | 상한 | 구성 단위 | |
| 여성 - 생리주기 | (아래 다이어그램 참조) | ||
| 여성 - 폐경 후 | <0.2[142] | 1[142] | ng/mL |
| <0.6[143] | 3[143] | nmol/L | |
| 경구피임제 복용 여성 | 0.34[142] | 0.92[142] | ng/mL |
| 1.1[143] | 2.9[143] | nmol/L | |
| 남자 ≥16세 | 0.27[142] | 0.9[142] | ng/mL |
| 0.86[143] | 2.9[143] | nmol/L | |
| 여성 또는 남성 1-9세 | 0.1[142] | 4.1[142] 또는 4.5[142] | ng/mL |
| 0.3[143] | 13[143] | nmol/L | |

•생물학적 단계에 의해 표시되는 범위는 생물학적 진행의 다른 지표와 관련하여 면밀히 모니터링되는 생리 주기에 사용될 수 있으며, 시간 척도는 각각 얼마나 빠르거나 느린지로 압축되거나 늘어나며 평균 주기에 비해 주기가
진행됩니다.•
주기 간 변동성은 월경의 시작만을 알 수 있는 모니터링 대상이 아닌 주기에서 사용하는 것이 더 적절하지만, 여성이 자신의 평균 주기 길이와 배란 시간을 정확히 알고 있으며, 시간 척도가 여성의 양만큼 압축되거나 늘어나는 등 다소 평균적으로 규칙적이라는 것을 알 수 있습니다.평균 주기 길이는 각각 모집단의 평균보다 짧거나 깁니다.•
여성 간 변이성을 나타내는 범위는 평균 주기 길이와 배란 시간을 알 수 없고 생리 시작만 제공되는 경우에 사용하는 것이 더 적합합니다.
원천
애니멀
프로게스테론은 사춘기가 시작될 때부터 폐경이 될 때까지 난소(황체에 의해)에서 많은 양이 생산되며, 남성과 여성 모두에서 부신이 시작된 후 부신에 의해 더 적은 양이 생산됩니다.프로게스테론은 신경 조직, 특히 뇌에서, 그리고 지방(지방) 조직에서도 덜 생성됩니다.
인간의 임신 중에 난소와 태반에 의해 프로게스테론이 점점 더 많은 양으로 생성됩니다.처음에, 근원은 개념으로부터 인간 융모성 고나도트로핀(hCG)의 존재에 의해 "구제"된 황체입니다.그러나 8주차 이후에는 프로게스테론의 생성이 태반으로 이동합니다.태반은 모체 콜레스테롤을 최초 기질로 이용하며, 생성된 프로게스테론은 대부분 모체 순환에 진입하지만, 일부는 태아 순환에 의해 픽업되어 태아 코르티코스테로이드의 기질로 이용됩니다.태반은 하루에 약 250mg의 프로게스테론을 생산합니다.
프로게스테론의 추가적인 동물 공급원은 우유 제품입니다.유제품 섭취 후 생체이용가능 프로게스테론 수치 [145]상승
식물
적어도 한 공장에서 프로게스테론이 [146]검출되었습니다.또한, 프로게스테론 유사 스테로이드는 디오스코레아 멕시카나에서 발견됩니다.디오스코레아 멕시카나(Dioscorea mexicana)는 멕시코가 [147]원산지인 참마과에 속하는 식물입니다.그것은 식물에서 추출되어 프로게스테론으로 [148]전환되는 디오스게닌이라고 불리는 스테로이드를 포함하고 있습니다.디오스게닌과 프로게스테론은 다른 디오스코레아 종들에서도 발견되며, 페누그릭과 같이 밀접한 관련이 없는 다른 식물들에서도 발견됩니다.
프로게스테론으로 쉽게 전환될 수 있는 물질을 함유하고 있는 또 다른 식물은 대만이 원산지인 Dioscorea pseudo japonica입니다.대만 참마는 사포닌을 함유하고 있다는 연구 결과가 나왔습니다. 사포닌은 디오스게닌으로 전환되고, 그 후 프로게스테론으로 [149]전환될 수 있는 스테로이드입니다.
참마과의 다른 많은 디오스코레아 종들은 프로게스테론이 생성될 수 있는 스테로이달 물질을 함유하고 있습니다.이들 중 가장 주목할 만한 것은 디오스코레아 빌로사와 디오스코레아 폴리고노이데스입니다.한 연구에 따르면 디오스코레아 빌로사는 3.5%[150]의 디오스게닌을 함유하고 있습니다.가스 크로마토그래피-질량분석법에 [151]의하면 디오스코레아 폴리고노이드는 2.64%의 디오세닌을 함유하고 있는 것으로 확인되었습니다.참마과에서 유래한 디오스코레아 종들 중 많은 것들이 열대와 아열대 [152]기후를 가진 나라들에서 자랍니다.
의료용
프로게스테론은 약으로 사용됩니다.주로 갱년기 증상과 여성의 [116][153]성호르몬 수치가 낮은 호르몬 치료에 에스트로겐과 함께 사용됩니다.갱년기 증상 치료를 위해 단독으로 사용할 수도 있습니다.연구에 따르면 경피 프로게스테론(피부 패치)과 경구 미세화 프로게스테론은 혈관운동 증상 또는 [154]VMS라고 불리는 뜨거운 섬광과 야간 땀과 같은 갱년기의 특정 증상에 효과적인 치료법입니다.
또한 여성들에게 임신과 출산을 지원하고 부인과 [155][156][157][158]질환을 치료하는 데에도 사용됩니다.프로게스테론은 현재 임신 초기 1) 질 출혈과 2) [159]이전 유산 병력이 있는 여성의 유산을 예방하는 것으로 나타났습니다.프로게스테론은 [116]입으로, 질을 통해, 근육이나 지방 등에 주사를 통해 섭취할 수 있습니다.
화학

프로게스테론은 자연적으로 발생하는 임신 스테로이드이며, 또한 임신-4-ene-3,[160][161]20-dione라고도 알려져 있습니다.이것은 C4 및 C5 위치와 두 개의 케톤 그룹(3,20-디온) 사이에 이중 결합(4-엔)을 가지고 있으며, 하나는 C3 위치에 있고 다른 하나는 C20 [160][161]위치에 있습니다.
합성
프로게스테론은 반합성에 의해 상업적으로 생산됩니다.두 가지 주요 경로가 사용됩니다: 1940년 마커가 처음 개척한 얌 디오스제닌의 경로와 1970년대에 확장된 콩 피토스테롤을 기반으로 한 경로.프로게스테론의 추가적인 (꼭 경제적이지는 않은) 반합성은 또한 다양한 스테로이드로부터 시작하여 보고되었습니다.예를 들어, 코르티손은 클로로포름에서 아이오도트리메틸실란을 처리하여 C-17 및 C-21 위치에서 동시에 탈산소화되어 11-케토-프로게스테론(케토게스틴)을 생성할 수 있으며, 이는 다시 11 위치에서 감소되어 프로게스테론을 [162]생성할 수 있습니다.
마커 반합성
1940년 러셀 마커에 의해 파크-데이비스 제약회사를 [163]위해 얌에서 분리된 스테로이드 디오스제닌 식물로부터 프로게스테론의 경제적인 반합성이 개발되었습니다.이 합성을 마커 분해라고 합니다.

16-DPA 중간체는 의학적으로 중요한 다른 스테로이드의 합성에 중요합니다.매우 유사한 접근법으로 [164]솔라닌으로부터 16-DPA를 생성할 수 있습니다.
콩 반합성
프로게스테론은 또한 콩기름에서 발견되는 스티그마스테롤로 만들 수 있습니다.퍼시 줄리안.

총합
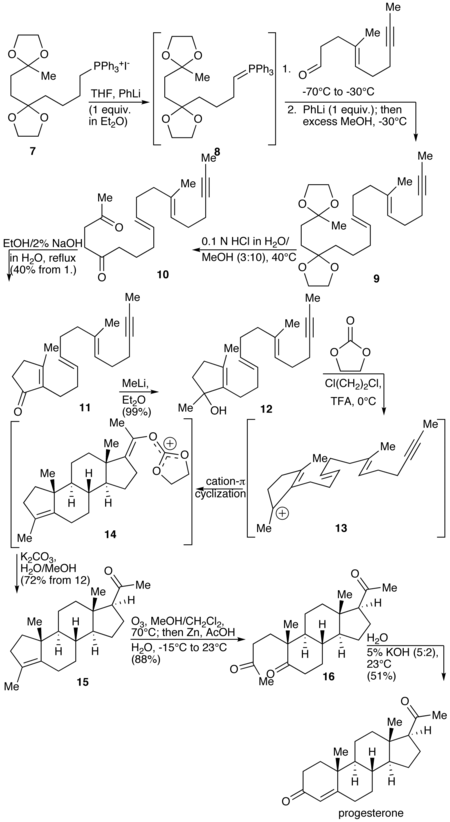
프로게스테론의 전체 합성은 1971년 W.S.[170] Johnson에 의해 보고되었습니다.합성은 포스포늄염 7과 페닐 리튬을 반응시켜 포스포늄일라이드 8을 생성하는 것으로 시작됩니다.일라이드 8은 알데히드와 반응하여 알켄 9를 생성합니다.9개의 케탈 보호 그룹은 가수분해되어 다이케톤(10)을 생성하고, 다이케톤은 사이클화되어 사이클로펜테논(11)을 형성합니다.11의 케톤은 메틸 리튬과 반응하여 3차 알코올(12)을 생성하고, 이것은 다시 산으로 처리되어 3차 양이온(13)을 생성합니다.합성의 핵심 단계는 스테로이드의 B-, C- 및 D-링이 동시에 형성되어 14개를 생성하는 13의 γ-cation 고리화입니다.이 단계는 스테로이드의 생합성에 사용되는 양이온화 고리화 반응과 유사하므로 생체 모방이라고 합니다.다음 단계에서 엔올로토에스테르는 가수분해되어 케톤 15를 생성합니다.사이클로펜텐 A-링은 오존과 산화하여 열리게 되어 16을 생성합니다.마지막으로, 디케톤(17)은 수성 수산화칼륨을 처리하여 프로게스테론을 [170]생성함으로써 분자 내 알돌 축합을 겪습니다.
역사
조지 W. 코너와 윌러드 M. 알렌은 [17][171][172][173]1929년에 프로게스테론의 호르몬 작용을 발견했습니다.1931년부터 1932년까지, 높은 프로게스테론 활성을 가진 거의 순수한 결정성 물질이 동물의 황체로부터 분리되었고, 1934년까지 순수한 결정성 프로게스테론이 정제되어 얻어졌고, 프로게스테론의 화학적 구조가 [17][172]결정되었습니다.이것은 Danzig에 있는 Chemisches Institute of Technical University의 Adolf Butenandt에 의해 달성되었습니다. 그는 수천 리터의 [174]소변으로부터 이 새로운 화합물을 추출했습니다.
스티그마스테롤과 임신디올로부터 프로게스테론의 화학적 합성은 그 [172][175]해 말에 이루어졌습니다.이때까지 코퍼스 루테움 호르몬으로 일반적으로 알려진 프로게스테론은 코퍼스린, 루테인, 루테론, 프로게스틴 [17][176]등 여러 그룹에서 다양한 이름으로 언급되고 있었습니다.1935년 영국 런던에서 열린 제2차 성호르몬 표준화 국제회의 당시, 이 단체들 사이에 타협이 이루어졌고 프로게스테론(progesterone,[17][177] 프로게스테론)이라는 이름이 생겨났습니다.
수의학적 이용
배란을 정확히 파악하기 위해 개 사육에 프로게스테론 검사를 사용하는 것이 점점 더 널리 사용되고 있습니다.여러 가지 검사가 가능하지만 가장 신뢰할 수 있는 검사는 수의사가 채혈하여 실험실로 보내 처리하는 혈액 검사입니다.결과는 보통 24시간에서 72시간으로 얻을 수 있습니다.프로게스테론 검사를 사용하는 이유는 증가된 숫자가 생식선 단백질의 배란 전 급증에 근접하여 시작하여 배란과 발정을 통해 계속된다는 것입니다.프로게스테론 수치가 특정 수준에 도달하면 발정기에 암컷이 있다는 신호를 보낼 수 있습니다.만약 배란일을 안다면, 대기중인 쓰레기의 생년월일을 예측하는 것은 매우 정확할 수 있습니다.강아지들은 대부분의 경우 9주 중 하루나 이틀 정도의 임신을 합니다.그러나 일단 번식이 이루어진 후에는 프로게스테론 검사를 통해 임신 여부를 확인할 수는 없습니다.이것은 개의 경우 발정기 [178]동안 프로게스테론 수치가 계속 상승하기 때문입니다.
가격결정
프로게스테론의 가격은 지역, 보험 적용 범위, 할인 쿠폰, 수량, 부족, 제조업체, 브랜드 또는 일반 버전, 다른 약국 등에 따라 달라질 수 있습니다.현재 CVS Pharmacy의 제네릭 버전인 Prometrium의 30캡슐은 할인이나 보험 적용 없이 40달러 수준입니다.브랜드 버전인 프로게스테론은 할인이나 보험 적용 [179]없이 30캡슐에 450달러 수준입니다.이에 비해 월그린스는 100mg짜리 30캡슐을 일반 버전으로 보험이나 쿠폰 적용 없이 51달러에 제공하고 있습니다.브랜드 이름은 100mg [180]30캡슐에 약 431달러입니다.
참고문헌
- ^ a b Jameson JL, De Groot LJ (25 February 2015). Endocrinology: Adult and Pediatric E-Book. Elsevier Health Sciences. p. 2179. ISBN 978-0-323-32195-2.
- ^ Adler N, Pfaff D, Goy RW (6 Dec 2012). Handbook of Behavioral Neurobiology Volume 7 Reproduction (1st ed.). New York: Plenum Press. p. 189. ISBN 978-1-4684-4834-4. Retrieved 4 July 2015.
- ^ "progesterone (CHEBI:17026)". ChEBI. European Molecular Biology Laboratory-EBI. Retrieved 4 July 2015.
- ^ "Progesterone_msds".
- ^ a b Stanczyk FZ (September 2002). "Pharmacokinetics and potency of progestins used for hormone replacement therapy and contraception". Reviews in Endocrine & Metabolic Disorders. 3 (3): 211–224. doi:10.1023/A:1020072325818. PMID 12215716. S2CID 27018468.
- ^ a b c Simon JA, Robinson DE, Andrews MC, Hildebrand JR, Rocci ML, Blake RE, Hodgen GD (July 1993). "The absorption of oral micronized progesterone: the effect of food, dose proportionality, and comparison with intramuscular progesterone". Fertility and Sterility. 60 (1): 26–33. doi:10.1016/S0015-0282(16)56031-2. PMID 8513955.
- ^ Fritz MA, Speroff L (28 March 2012). Clinical Gynecologic Endocrinology and Infertility. Lippincott Williams & Wilkins. pp. 44–. ISBN 978-1-4511-4847-3.
- ^ Marshall WJ, Bangert SK (2008). Clinical Chemistry. Elsevier Health Sciences. pp. 192–. ISBN 978-0-7234-3455-9.
- ^ Yamazaki H, Shimada T (October 1997). "Progesterone and testosterone hydroxylation by cytochromes P450 2C19, 2C9, and 3A4 in human liver microsomes". Archives of Biochemistry and Biophysics. 346 (1): 161–169. doi:10.1006/abbi.1997.0302. PMID 9328296.
- ^ McKay GA, Walters MR (6 February 2013). Lecture Notes: Clinical Pharmacology and Therapeutics. John Wiley & Sons. p. 33. ISBN 978-1-118-34489-7.
- ^ Zutshi V, Rathore AM, Sharma K (1 January 2005). Hormones in Obstetrics and Gynaecology. Jaypee Brothers Publishers. p. 74. ISBN 978-81-8061-427-9.[영구 데드링크]
- ^ a b Cometti B (November 2015). "Pharmaceutical and clinical development of a novel progesterone formulation". Acta Obstetricia et Gynecologica Scandinavica. 94 (Suppl 161): 28–37. doi:10.1111/aogs.12765. PMID 26342177. S2CID 31974637.
- ^ a b c King TL, Brucker MC (25 October 2010). Pharmacology for Women's Health. Jones & Bartlett Publishers. pp. 372–373. ISBN 978-1-4496-5800-7.
- ^ a b Baulieu E, Schumacher M (2000). "Progesterone as a neuroactive neurosteroid, with special reference to the effect of progesterone on myelination". Steroids. 65 (10–11): 605–612. doi:10.1016/s0039-128x(00)00173-2. PMID 11108866. S2CID 14952168.
- ^ Prior JC (April 2019). "Progesterone Is Important for Transgender Women's Therapy-Applying Evidence for the Benefits of Progesterone in Ciswomen". The Journal of Clinical Endocrinology and Metabolism. 104 (4): 1181–1186. doi:10.1210/jc.2018-01777. PMID 30608551. S2CID 58620122.
Evidence has accrued that normal progesterone (and ovulation), as well as physiological estradiol levels, is necessary during ciswomen's premenopausal menstrual cycles for current fertility and long-term health; transgender women may require progesterone therapy and similar potential physiological benefits
- ^ Fischer J, Ganellin CR (2006). Analogue-based Drug Discovery. John Wiley & Sons. p. 47X. ISBN 9783527607495.
- ^ a b c d e f g h Josimovich JB (11 November 2013). Gynecologic Endocrinology. Springer Science & Business Media. pp. 9, 25–29. ISBN 978-1-4613-2157-6.
- ^ Thomas P, Pang Y (2012). "Membrane progesterone receptors: evidence for neuroprotective, neurosteroid signaling and neuroendocrine functions in neuronal cells". Neuroendocrinology. 96 (2): 162–171. doi:10.1159/000339822. PMC 3489003. PMID 22687885.
- ^ Valadez-Cosmes P, Vázquez-Martínez ER, Cerbón M, Camacho-Arroyo I (October 2016). "Membrane progesterone receptors in reproduction and cancer". Molecular and Cellular Endocrinology. 434: 166–175. doi:10.1016/j.mce.2016.06.027. PMID 27368976. S2CID 3826650.
- ^ Meyer C, Schmid R, Schmieding K, Falkenstein E, Wehling M (February 1998). "Characterization of high affinity progesterone-binding membrane proteins by anti-peptide antiserum". Steroids. 63 (2): 111–116. doi:10.1016/s0039-128x(97)00143-8. PMID 9516722. S2CID 40096058.
- ^ Kabe Y, Handa H, Suematsu M (July 2018). "Function and structural regulation of the carbon monoxide (CO)-responsive membrane protein PGRMC1". Journal of Clinical Biochemistry and Nutrition. 63 (1): 12–17. doi:10.3164/jcbn.17-132. PMC 6064819. PMID 30087538.
- ^ Ryu CS, Klein K, Zanger UM (2017-03-27). "Membrane Associated Progesterone Receptors: Promiscuous Proteins with Pleiotropic Functions - Focus on Interactions with Cytochromes P450". Frontiers in Pharmacology. 8: 159. doi:10.3389/fphar.2017.00159. PMC 5366339. PMID 28396637.
- ^ Maurice T, Urani A, Phan VL, Romieu P (November 2001). "The interaction between neuroactive steroids and the sigma1 receptor function: behavioral consequences and therapeutic opportunities". Brain Research. Brain Research Reviews. 37 (1–3): 116–132. doi:10.1016/s0165-0173(01)00112-6. PMID 11744080. S2CID 44931783.
- ^ Johannessen M, Fontanilla D, Mavlyutov T, Ruoho AE, Jackson MB (February 2011). "Antagonist action of progesterone at σ-receptors in the modulation of voltage-gated sodium channels". American Journal of Physiology. Cell Physiology. 300 (2): C328–C337. doi:10.1152/ajpcell.00383.2010. PMC 3043630. PMID 21084640.
- ^ a b Rupprecht R, Reul JM, van Steensel B, Spengler D, Söder M, Berning B, et al. (October 1993). "Pharmacological and functional characterization of human mineralocorticoid and glucocorticoid receptor ligands". European Journal of Pharmacology. 247 (2): 145–154. doi:10.1016/0922-4106(93)90072-H. PMID 8282004.
- ^ Elger W, Beier S, Pollow K, Garfield R, Shi SQ, Hillisch A (November 2003). "Conception and pharmacodynamic profile of drospirenone". Steroids. 68 (10–13): 891–905. doi:10.1016/j.steroids.2003.08.008. PMID 14667981. S2CID 41756726.
- ^ Attardi BJ, Zeleznik A, Simhan H, Chiao JP, Mattison DR, Caritis SN (December 2007). "Comparison of progesterone and glucocorticoid receptor binding and stimulation of gene expression by progesterone, 17-alpha hydroxyprogesterone caproate, and related progestins". American Journal of Obstetrics and Gynecology. 197 (6): 599.e1–599.e7. doi:10.1016/j.ajog.2007.05.024. PMC 2278032. PMID 18060946.
- ^ Lei K, Chen L, Georgiou EX, Sooranna SR, Khanjani S, Brosens JJ, et al. (2012). "Progesterone acts via the nuclear glucocorticoid receptor to suppress IL-1β-induced COX-2 expression in human term myometrial cells". PLOS ONE. 7 (11): e50167. Bibcode:2012PLoSO...750167L. doi:10.1371/journal.pone.0050167. PMC 3509141. PMID 23209664.
- ^ Paul SM, Purdy RH (March 1992). "Neuroactive steroids". FASEB Journal. 6 (6): 2311–2322. doi:10.1096/fasebj.6.6.1347506. PMID 1347506. S2CID 221753076.
- ^ Kliewer SA, Goodwin B, Willson TM (October 2002). "The nuclear pregnane X receptor: a key regulator of xenobiotic metabolism". Endocrine Reviews. 23 (5): 687–702. doi:10.1210/er.2001-0038. PMID 12372848.
- ^ Lehmann JM, McKee DD, Watson MA, Willson TM, Moore JT, Kliewer SA (September 1998). "The human orphan nuclear receptor PXR is activated by compounds that regulate CYP3A4 gene expression and cause drug interactions". The Journal of Clinical Investigation. 102 (5): 1016–1023. doi:10.1172/JCI3703. PMC 508967. PMID 9727070.
- ^ Meanwell NA (8 December 2014). Tactics in Contemporary Drug Design. Springer. pp. 161–. ISBN 978-3-642-55041-6.
- ^ a b Legato MJ, Bilezikian JP (2004). Principles of Gender-specific Medicine. Gulf Professional Publishing. pp. 146–. ISBN 978-0-12-440906-4.
- ^ Williams DA (24 January 2012). "Drug Metabolism". In Lemke TL, Williams DA (eds.). Foye's Principles of Medicinal Chemistry. Lippincott Williams & Wilkins. p. 164. ISBN 978-1-60913-345-0.
- ^ Estrogens—Advances in Research and Application: 2013 Edition: ScholarlyBrief. ScholarlyEditions. 21 June 2013. pp. 4–. ISBN 978-1-4816-7550-5.
- ^ Strünker T, Goodwin N, Brenker C, Kashikar ND, Weyand I, Seifert R, Kaupp UB (March 2011). "The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm". Nature. 471 (7338): 382–386. Bibcode:2011Natur.471..382S. doi:10.1038/nature09769. PMID 21412338. S2CID 4431334.
- ^ Lishko PV, Botchkina IL, Kirichok Y (March 2011). "Progesterone activates the principal Ca2+ channel of human sperm". Nature. 471 (7338): 387–391. Bibcode:2011Natur.471..387L. doi:10.1038/nature09767. PMID 21412339. S2CID 4340309.
- ^ Prior JC (2020). "Women's reproductive system as balanced estradiol and progesterone actions—A revolutionary, paradigm-shifting concept in women's health". Drug Discovery Today: Disease Models. 32, Part B: 31–40. doi:10.1016/j.ddmod.2020.11.005.
- ^ Kastner P, Krust A, Turcotte B, Stropp U, Tora L, Gronemeyer H, Chambon P (May 1990). "Two distinct estrogen-regulated promoters generate transcripts encoding the two functionally different human progesterone receptor forms A and B". The EMBO Journal. 9 (5): 1603–1614. doi:10.1002/j.1460-2075.1990.tb08280.x. PMC 551856. PMID 2328727.
- ^ a b Cline JM, Wood CE (1 January 2006). "Hormonal effects on the mammary gland of postmenopausal nonhuman primates.". In Hallam SZ, Osuch JR (eds.). Hormones and Breast Cancer in Post-Menopausal Women. p. 61. doi:10.3233/bd-2006-24105. ISBN 978-1-58603-653-9. PMID 16917139.
{{cite book}}:journal=무시됨(도움말) - ^ a b Johnson LR (2003). Essential Medical Physiology. Academic Press. p. 770. ISBN 978-0-12-387584-6.
- ^ a b Coad J, Dunstall M (2011). Anatomy and Physiology for Midwives, with Pageburst online access,3: Anatomy and Physiology for Midwives. Elsevier Health Sciences. p. 413. ISBN 978-0-7020-3489-3.
- ^ Landau RL, Bergenstal DM, Lugibihl K, Kascht ME (October 1955). "The metabolic effects of progesterone in man". The Journal of Clinical Endocrinology and Metabolism. 15 (10): 1194–1215. doi:10.1210/jcem-15-10-1194. PMID 13263410.
- ^ a b c Masiutin M, Yadav M (2023). "Alternative androgen pathways". WikiJournal of Medicine. 10: X. doi:10.15347/WJM/2023.003. S2CID 257943362.
- ^ a b O'Shaughnessy PJ, Antignac JP, Le Bizec B, Morvan ML, Svechnikov K, Söder O, et al. (February 2019). "Alternative (backdoor) androgen production and masculinization in the human fetus". PLOS Biology. 17 (2): e3000002. doi:10.1371/journal.pbio.3000002. PMC 6375548. PMID 30763313.
- ^ Flück CE, Pandey AV (May 2014). "Steroidogenesis of the testis -- new genes and pathways". Annales d'Endocrinologie. 75 (2): 40–47. doi:10.1016/j.ando.2014.03.002. PMID 24793988.
- ^ Zachmann M (February 1996). "Prismatic cases: 17,20-desmolase (17,20-lyase) deficiency". The Journal of Clinical Endocrinology and Metabolism. 81 (2): 457–459. doi:10.1210/jcem.81.2.8636249. PMID 8636249.
- ^ Correia JN, Conner SJ, Kirkman-Brown JC (May 2007). "Non-genomic steroid actions in human spermatozoa. "Persistent tickling from a laden environment"". Seminars in Reproductive Medicine. 25 (3): 208–219. doi:10.1055/s-2007-973433. PMID 17447210. S2CID 260318879.
- ^ Kirkman-Brown JC, Bray C, Stewart PM, Barratt CL, Publicover SJ (June 2000). "Biphasic elevation of [Ca(2+)](i) in individual human spermatozoa exposed to progesterone". Developmental Biology. 222 (2): 326–335. doi:10.1006/dbio.2000.9729. PMID 10837122.
- ^ Kirkman-Brown JC, Barratt CL, Publicover SJ (March 2004). "Slow calcium oscillations in human spermatozoa". The Biochemical Journal. 378 (Pt 3): 827–832. doi:10.1042/BJ20031368. PMC 1223996. PMID 14606954.
- ^ Harper CV, Barratt CL, Publicover SJ (October 2004). "Stimulation of human spermatozoa with progesterone gradients to simulate approach to the oocyte. Induction of [Ca(2+)](i) oscillations and cyclical transitions in flagellar beating". The Journal of Biological Chemistry. 279 (44): 46315–46325. doi:10.1074/jbc.M401194200. PMID 15322137.
- ^ Marieb E (2013). Anatomy & physiology. Benjamin-Cummings. p. 903. ISBN 9780321887603.
- ^ Tosti E, Di Cosmo A, Cuomo A, Di Cristo C, Gragnaniello G (May 2001). "Progesterone induces activation in Octopus vulgaris spermatozoa". Molecular Reproduction and Development. 59 (1): 97–105. doi:10.1002/mrd.1011. PMID 11335951. S2CID 28390608.
- ^ a b Bowen R (2000-08-06). "Placental Hormones". Retrieved 2008-03-12.
- ^ Patel B, Elguero S, Thakore S, Dahoud W, Bedaiwy M, Mesiano S (2014). "Role of nuclear progesterone receptor isoforms in uterine pathophysiology". Human Reproduction Update. 21 (2): 155–173. doi:10.1093/humupd/dmu056. PMC 4366574. PMID 25406186.
- ^ a b Di Renzo GC, Giardina I, Clerici G, Brillo E, Gerli S (July 2016). "Progesterone in normal and pathological pregnancy". Hormone Molecular Biology and Clinical Investigation. 27 (1): 35–48. doi:10.1515/hmbci-2016-0038. PMID 27662646. S2CID 32239449.
- ^ Care A, Nevitt SJ, Medley N, Donegan S, Good L, Hampson L, et al. (February 2022). "Interventions to prevent spontaneous preterm birth in women with singleton pregnancy who are at high risk: systematic review and network meta-analysis". BMJ. 376: e064547. doi:10.1136/bmj-2021-064547. PMC 8845039. PMID 35168930.
- ^ Macias H, Hinck L (2012). "Mammary gland development". Wiley Interdisciplinary Reviews. Developmental Biology. 1 (4): 533–557. doi:10.1002/wdev.35. PMC 3404495. PMID 22844349.
- ^ a b c Hilton HN, Graham JD, Clarke CL (September 2015). "Minireview: Progesterone Regulation of Proliferation in the Normal Human Breast and in Breast Cancer: A Tale of Two Scenarios?". Molecular Endocrinology. 29 (9): 1230–1242. doi:10.1210/me.2015-1152. PMC 5414684. PMID 26266959.
- ^ Barbieri RL (13 September 2013). "The Breast". In Strauss JF, Barbieri RL (eds.). Yen and Jaffe's Reproductive Endocrinology. Elsevier Health Sciences. pp. 236–. ISBN 978-1-4557-2758-2.
- ^ Scaling AL, Prossnitz ER, Hathaway HJ (June 2014). "GPER mediates estrogen-induced signaling and proliferation in human breast epithelial cells and normal and malignant breast". Hormones & Cancer. 5 (3): 146–160. doi:10.1007/s12672-014-0174-1. PMC 4091989. PMID 24718936.
- ^ a b c d e Aupperlee MD, Leipprandt JR, Bennett JM, Schwartz RC, Haslam SZ (May 2013). "Amphiregulin mediates progesterone-induced mammary ductal development during puberty". Breast Cancer Research. 15 (3): R44. doi:10.1186/bcr3431. PMC 3738150. PMID 23705924.
- ^ a b Kuhl H, Schneider HP (August 2013). "Progesterone--promoter or inhibitor of breast cancer". Climacteric. 16 (Suppl 1): 54–68. doi:10.3109/13697137.2013.768806. PMID 23336704. S2CID 20808536.
- ^ a b c Trabert B, Sherman ME, Kannan N, Stanczyk FZ (April 2020). "Progesterone and Breast Cancer". Endocrine Reviews. 41 (2): 320–344. doi:10.1210/endrev/bnz001. PMC 7156851. PMID 31512725.
- ^ Collaborative Group on Hormonal Factors in Breast Cancer (September 2019). "Type and timing of menopausal hormone therapy and breast cancer risk: individual participant meta-analysis of the worldwide epidemiological evidence". Lancet. 394 (10204): 1159–1168. doi:10.1016/S0140-6736(19)31709-X. PMC 6891893. PMID 31474332.
- ^ Stute P, Wildt L, Neulen J (April 2018). "The impact of micronized progesterone on breast cancer risk: a systematic review". Climacteric. 21 (2): 111–122. doi:10.1080/13697137.2017.1421925. PMID 29384406. S2CID 3642971.
- ^ Asi N, Mohammed K, Haydour Q, Gionfriddo MR, Vargas OL, Prokop LJ, et al. (July 2016). "Progesterone vs. synthetic progestins and the risk of breast cancer: a systematic review and meta-analysis". Systematic Reviews. 5 (1): 121. doi:10.1186/s13643-016-0294-5. PMC 4960754. PMID 27456847.
- ^ Gompel A, Plu-Bureau G (August 2018). "Progesterone, progestins and the breast in menopause treatment". Climacteric. 21 (4): 326–332. doi:10.1080/13697137.2018.1476483. PMID 29852797. S2CID 46922084.
- ^ Davey DA (October 2018). "Menopausal hormone therapy: a better and safer future". Climacteric. 21 (5): 454–461. doi:10.1080/13697137.2018.1439915. PMID 29526116. S2CID 3850275.
- ^ a b c d e f g h Raine-Fenning NJ, Brincat MP, Muscat-Baron Y (2003). "Skin aging and menopause : implications for treatment". American Journal of Clinical Dermatology. 4 (6): 371–378. doi:10.2165/00128071-200304060-00001. PMID 12762829. S2CID 20392538.
- ^ a b c d e f g h Holzer G, Riegler E, Hönigsmann H, Farokhnia S, Schmidt JB (September 2005). "Effects and side-effects of 2% progesterone cream on the skin of peri- and postmenopausal women: results from a double-blind, vehicle-controlled, randomized study". The British Journal of Dermatology. 153 (3): 626–634. doi:10.1111/j.1365-2133.2005.06685.x. PMID 16120154. S2CID 6077829.
- ^ King SR (9 November 2012). Neurosteroids and the Nervous System. Springer Science & Business Media. pp. 44–46. ISBN 978-1-4614-5559-2.
- ^ Fleischman DS, Fessler DM, Cholakians AE (July 2015). "Testing the Affiliation Hypothesis of Homoerotic Motivation in Humans: The Effects of Progesterone and Priming". Archives of Sexual Behavior. 44 (5): 1395–1404. doi:10.1007/s10508-014-0436-6. PMID 25420899. S2CID 9864224.
- ^ "Homosexuality may help us bond". UoP News. Archived from the original on 2019-07-02. Retrieved 2019-07-02.
- ^ 동성애적인 생각을 갖는 것은 '인간 진화의 필수적인 부분'이라는 연구 결과가 텔레그래프에 시사합니다.
- ^ 과학자들은 동성애가 인간과 유대감을 형성하는 데 도움이 되기 때문에 인간에게 진화했을 수도 있다고 말합니다.
- ^ a b c Hanukoglu I, Karavolas HJ, Goy RW (April 1977). "Progesterone metabolism in the pineal, brain stem, thalamus and corpus callosum of the female rat". Brain Research. 125 (2): 313–324. doi:10.1016/0006-8993(77)90624-2. PMID 558037. S2CID 35814845.
- ^ Schumacher M, Guennoun R, Robert F, Carelli C, Gago N, Ghoumari A, et al. (June 2004). "Local synthesis and dual actions of progesterone in the nervous system: neuroprotection and myelination". Growth Hormone & IGF Research. 14 (Suppl A): S18–S33. doi:10.1016/j.ghir.2004.03.007. PMID 15135772.
- ^ Singh M, Su C, Ng S (September 2013). "Non-genomic mechanisms of progesterone action in the brain". Frontiers in Neuroscience. 7: 159. doi:10.3389/fnins.2013.00159. PMC 3776940. PMID 24065876.
- ^ Roof RL, Hall ED (May 2000). "Gender differences in acute CNS trauma and stroke: neuroprotective effects of estrogen and progesterone". Journal of Neurotrauma. 17 (5): 367–388. doi:10.1089/neu.2000.17.367. PMID 10833057.
- ^ Pan DS, Liu WG, Yang XF, Cao F (October 2007). "Inhibitory effect of progesterone on inflammatory factors after experimental traumatic brain injury". Biomedical and Environmental Sciences. 20 (5): 432–438. PMID 18188998.
- ^ Jiang C, Zuo F, Wang Y, Wan J, Yang Z, Lu H, et al. (June 2016). "Progesterone exerts neuroprotective effects and improves long-term neurologic outcome after intracerebral hemorrhage in middle-aged mice". Neurobiology of Aging. 42: 13–24. doi:10.1016/j.neurobiolaging.2016.02.029. PMC 4857017. PMID 27143417.
- ^ a b Luoma JI, Stern CM, Mermelstein PG (August 2012). "Progesterone inhibition of neuronal calcium signaling underlies aspects of progesterone-mediated neuroprotection". The Journal of Steroid Biochemistry and Molecular Biology. 131 (1–2): 30–36. doi:10.1016/j.jsbmb.2011.11.002. PMC 3303940. PMID 22101209.
- ^ a b c Stein DG (March 2008). "Progesterone exerts neuroprotective effects after brain injury". Brain Research Reviews. 57 (2): 386–397. doi:10.1016/j.brainresrev.2007.06.012. PMC 2699575. PMID 17826842.
- ^ Espinoza TR, Wright DW (2011). "The role of progesterone in traumatic brain injury". The Journal of Head Trauma Rehabilitation. 26 (6): 497–499. doi:10.1097/HTR.0b013e31823088fa. PMC 6025750. PMID 22088981.
- ^ Jiang C, Zuo F, Wang Y, Lu H, Yang Q, Wang J (January 2016). "Progesterone Changes VEGF and BDNF Expression and Promotes Neurogenesis After Ischemic Stroke". Molecular Neurobiology. 54 (1): 571–581. doi:10.1007/s12035-015-9651-y. PMC 4938789. PMID 26746666.
- ^ Herson PS, Koerner IP, Hurn PD (May 2009). "Sex, sex steroids, and brain injury". Seminars in Reproductive Medicine. 27 (3): 229–239. doi:10.1055/s-0029-1216276. PMC 2675922. PMID 19401954.
- ^ Li Z, Wang B, Kan Z, Zhang B, Yang Z, Chen J, et al. (January 2012). "Progesterone increases circulating endothelial progenitor cells and induces neural regeneration after traumatic brain injury in aged rats". Journal of Neurotrauma. 29 (2): 343–353. doi:10.1089/neu.2011.1807. PMC 3261789. PMID 21534727.
- ^ a b Lynch WJ, Sofuoglu M (December 2010). "Role of progesterone in nicotine addiction: evidence from initiation to relapse". Experimental and Clinical Psychopharmacology. 18 (6): 451–461. doi:10.1037/a0021265. PMC 3638762. PMID 21186920.
- ^ Cosgrove KP, Esterlis I, McKee SA, Bois F, Seibyl JP, Mazure CM, et al. (April 2012). "Sex differences in availability of β2*-nicotinic acetylcholine receptors in recently abstinent tobacco smokers". Archives of General Psychiatry. 69 (4): 418–427. doi:10.1001/archgenpsychiatry.2011.1465. PMC 3508698. PMID 22474108.
- ^ Mello NK, Knudson IM, Kelly M, Fivel PA, Mendelson JH (October 2011). "Effects of progesterone and testosterone on cocaine self-administration and cocaine discrimination by female rhesus monkeys". Neuropsychopharmacology. 36 (11): 2187–2199. doi:10.1038/npp.2011.130. PMC 3176575. PMID 21796112.
- ^ Buser T (2012-06-01). "The impact of the menstrual cycle and hormonal contraceptives on competitiveness". Journal of Economic Behavior & Organization. Gender Differences in Risk Aversion and Competition. 83 (1): 1–10. doi:10.1016/j.jebo.2011.06.006. ISSN 0167-2681.
- ^ Sriram D (2007). Medicinal Chemistry. New Delhi: Dorling Kindersley India Pvt. Ltd. p. 432. ISBN 978-81-317-0031-0.
- ^ a b Blackburn S (14 April 2014). Maternal, Fetal, & Neonatal Physiology. Elsevier Health Sciences. pp. 92–. ISBN 978-0-323-29296-2.
- ^ Faivre EJ, Lange CA (January 2007). "Progesterone receptors upregulate Wnt-1 to induce epidermal growth factor receptor transactivation and c-Src-dependent sustained activation of Erk1/2 mitogen-activated protein kinase in breast cancer cells". Molecular and Cellular Biology. 27 (2): 466–480. doi:10.1128/MCB.01539-06. PMC 1800800. PMID 17074804.
- ^ Nosek TM. "Section 5/5ch9/s5ch9_13". Essentials of Human Physiology. Archived from the original on 2016-03-24.
- ^ Rothchild I (1969), Salhanick HA, Kipnis DM, Wiele RL (eds.), "The Physiologic Basis for the Temperature Raising Effect of Progesterone", Metabolic Effects of Gonadal Hormones and Contraceptive Steroids, Boston, MA: Springer US, pp. 668–675, doi:10.1007/978-1-4684-1782-1_49, ISBN 978-1-4684-1782-1, retrieved 2021-03-22
- ^ Hould FS, Fried GM, Fazekas AG, Tremblay S, Mersereau WA (December 1988). "Progesterone receptors regulate gallbladder motility". The Journal of Surgical Research. 45 (6): 505–512. doi:10.1016/0022-4804(88)90137-0. PMID 3184927.
- ^ "Hormones and Oral Health". WebMD.
- ^ Picard F, Wanatabe M, Schoonjans K, Lydon J, O'Malley BW, Auwerx J (November 2002). "Progesterone receptor knockout mice have an improved glucose homeostasis secondary to beta -cell proliferation". Proceedings of the National Academy of Sciences of the United States of America. 99 (24): 15644–15648. doi:10.1073/pnas.202612199. PMC 137770. PMID 12438645.
- ^ Brănişteanu DD, Mathieu C (March 2003). "Progesterone in gestational diabetes mellitus: guilty or not guilty?". Trends in Endocrinology and Metabolism. 14 (2): 54–56. doi:10.1016/S1043-2760(03)00003-1. PMID 12591170. S2CID 38209977.
- ^ Whynott RM, Summers KM, Jakubiak M, Van Voorhis BJ, Mejia RB (June 2021). "The effect of weight and body mass index on serum progesterone values and live birth rate in cryopreserved in vitro fertilization cycles". F&S Reports. 2 (2): 195–200. doi:10.1016/j.xfre.2021.02.005. PMC 8267385. PMID 34278354.
- ^ Kaemmle LM, Stadler A, Janka H, von Wolff M, Stute P (August 2022). "The impact of micronized progesterone on cardiovascular events - a systematic review". Climacteric. 25 (4): 327–336. doi:10.1080/13697137.2021.2022644. PMID 35112635. S2CID 246487187.
- ^ Gasser S, Heidemeyer K, von Wolff M, Stute P (June 2021). "Impact of progesterone on skin and hair in menopause - a comprehensive review". Climacteric. 24 (3): 229–235. doi:10.1080/13697137.2020.1838476. PMID 33527841. S2CID 231757325.
- ^ Javed AA, Mayhew AJ, Shea AK, Raina P (August 2019). "Association Between Hormone Therapy and Muscle Mass in Postmenopausal Women: A Systematic Review and Meta-analysis". JAMA Network Open. 2 (8): e1910154. doi:10.1001/jamanetworkopen.2019.10154. PMC 6716293. PMID 31461147.
- ^ Coquoz A, Gruetter C, Stute P (April 2019). "Impact of micronized progesterone on body weight, body mass index, and glucose metabolism: a systematic review". Climacteric. 22 (2): 148–161. doi:10.1080/13697137.2018.1514003. PMID 30477366. S2CID 53782622.
- ^ Häggström M, Richfield D (2014). "Diagram of the pathways of human steroidogenesis". WikiJournal of Medicine. 1 (1). doi:10.15347/wjm/2014.005. ISSN 2002-4436.
- ^ Bewick PM (2002). Medicinal natural products: a biosynthetic approach. New York: Wiley. p. 244. ISBN 0-471-49641-3.
- ^ Duport C, Spagnoli R, Degryse E, Pompon D (February 1998). "Self-sufficient biosynthesis of pregnenolone and progesterone in engineered yeast". Nature Biotechnology. 16 (2): 186–189. doi:10.1038/nbt0298-186. PMID 9487528. S2CID 852617.
- ^ Zavod RM (24 January 2012). "Womens's Health". In Lemke TL, Williams DA (eds.). Foye's Principles of Medicinal Chemistry. Lippincott Williams & Wilkins. pp. 1397–. ISBN 978-1-60913-345-0.
- ^ Progesterone - Drugs.com, retrieved 2015-08-23
- ^ a b c Falcone T, Hurd WW (2007). Clinical Reproductive Medicine and Surgery. Elsevier Health Sciences. pp. 22–. ISBN 978-0-323-03309-1.
- ^ a b c d Cupps PT (20 February 1991). Reproduction in Domestic Animals. Elsevier. pp. 101–. ISBN 978-0-08-057109-6.
- ^ a b c d e f g h i Stanczyk FZ (November 2003). "All progestins are not created equal". Steroids. 68 (10–13): 879–890. doi:10.1016/j.steroids.2003.08.003. PMID 14667980. S2CID 44601264.
- ^ Dowd FJ, Johnson B, Mariotti A (3 September 2016). Pharmacology and Therapeutics for Dentistry. Elsevier Health Sciences. pp. 448–. ISBN 978-0-323-44595-5.
- ^ a b c d Kuhl H (August 2005). "Pharmacology of estrogens and progestogens: influence of different routes of administration". Climacteric. 8 (Suppl 1): 3–63. doi:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ a b Plant TM, Zeleznik AJ (15 November 2014). Knobil and Neill's Physiology of Reproduction. Academic Press. pp. 304–. ISBN 978-0-12-397769-4.
- ^ a b Santoro NF, Neal-Perry G (11 September 2010). Amenorrhea: A Case-Based, Clinical Guide. Springer Science & Business Media. pp. 13–. ISBN 978-1-60327-864-5.
- ^ Reddy DS (2010). Neurosteroids: endogenous role in the human brain and therapeutic potentials. Progress in Brain Research. Vol. 186. pp. 113–37. doi:10.1016/B978-0-444-53630-3.00008-7. PMC 3139029. PMID 21094889.
- ^ a b Baulieu E, Kelly PA (30 November 1990). Hormones: From Molecules to Disease. Springer Science & Business Media. pp. 401–. ISBN 978-0-412-02791-8.
- ^ Beranič N, Gobec S, Rižner TL (May 2011). "Progestins as inhibitors of the human 20-ketosteroid reductases, AKR1C1 and AKR1C3". Chemico-Biological Interactions. 191 (1–3): 227–233. doi:10.1016/j.cbi.2010.12.012. PMID 21182831.
- ^ Anderson GD, Odegard PS (October 2004). "Pharmacokinetics of estrogen and progesterone in chronic kidney disease". Advances in Chronic Kidney Disease. 11 (4): 357–360. doi:10.1053/j.ackd.2004.07.001. PMID 15492972.
- ^ Greenblatt JM, Brogan K (27 April 2016). Integrative Therapies for Depression: Redefining Models for Assessment, Treatment and Prevention. CRC Press. pp. 201–. ISBN 978-1-4987-0230-0.
- ^ Graham C (2 December 2012). Reproductive Biology of the Great Apes: Comparative and Biomedical Perspectives. Elsevier. pp. 179–. ISBN 978-0-323-14971-6.
- ^ Strushkevich N, Gilep AA, Shen L, Arrowsmith CH, Edwards AM, Usanov SA, Park HW (February 2013). "Structural insights into aldosterone synthase substrate specificity and targeted inhibition". Molecular Endocrinology. 27 (2): 315–324. doi:10.1210/me.2012-1287. PMC 5417327. PMID 23322723.
- ^ van Rooyen D, Gent R, Barnard L, Swart AC (April 2018). "The in vitro metabolism of 11β-hydroxyprogesterone and 11-ketoprogesterone to 11-ketodihydrotestosterone in the backdoor pathway". The Journal of Steroid Biochemistry and Molecular Biology. 178: 203–212. doi:10.1016/j.jsbmb.2017.12.014. PMID 29277707. S2CID 3700135.
- ^ a b de Azevedo Piccinato C (2008). Regulation of Steroid Metabolism and the Hepatic Transcriptome by Estradiol and Progesterone. pp. 24–25. ISBN 978-1-109-04632-8.[영구 데드링크]
- ^ Akalin S (January 1991). "Effects of ketoconazole in hirsute women". Acta Endocrinologica. 124 (1): 19–22. doi:10.1530/acta.0.1240019. PMID 1825737. S2CID 9831739.
- ^ Aufrère MB, Benson H (June 1976). "Progesterone: an overview and recent advances". Journal of Pharmaceutical Sciences. 65 (6): 783–800. doi:10.1002/jps.2600650602. PMID 945344.
- ^ Stricker R, Eberhart R, Chevailler MC, Quinn FA, Bischof P, Stricker R (2006). "Establishment of detailed reference values for luteinizing hormone, follicle stimulating hormone, estradiol, and progesterone during different phases of the menstrual cycle on the Abbott ARCHITECT analyzer". Clinical Chemistry and Laboratory Medicine. 44 (7): 883–887. doi:10.1515/CCLM.2006.160. PMID 16776638. S2CID 524952.
- ^ Csapo AI, Pulkkinen MO, Wiest WG (March 1973). "Effects of luteectomy and progesterone replacement therapy in early pregnant patients". American Journal of Obstetrics and Gynecology. 115 (6): 759–765. doi:10.1016/0002-9378(73)90517-6. PMID 4688578.
- ^ NIH Clinical Center (2004-08-16). "Progesterone Historical Reference Ranges". United States National Institutes of Health. Archived from the original on 2009-01-09. Retrieved 2008-03-12.
- ^ Aufrère MB, Benson H (June 1976). "Progesterone: an overview and recent advances". J Pharm Sci. 65 (6): 783–800. doi:10.1002/jps.2600650602. PMID 945344.
- ^ Chernecky CC, Berger BJ (31 October 2012). Laboratory Tests and Diagnostic Procedures - E-Book. Elsevier Health Sciences. pp. 908–. ISBN 978-1-4557-4502-9.
- ^ Becker KL (2001). Principles and Practice of Endocrinology and Metabolism. Lippincott Williams & Wilkins. pp. 889, 940. ISBN 978-0-7817-1750-2.
- ^ Josimovich J (11 November 2013). Gynecologic Endocrinology. Springer Science & Business Media. pp. 9, 25–29, 139. ISBN 978-1-4613-2157-6.
- ^ van Keep P, Utian W (6 December 2012). The Premenstrual Syndrome: Proceedings of a workshop held during the Sixth International Congress of Psychosomatic Obstetrics and Gynecology, Berlin, September 1980. Springer Science & Business Media. pp. 51–52. ISBN 978-94-011-6255-5.
- ^ Strauss JF, Barbieri RL (2009). Yen and Jaffe's Reproductive Endocrinology: Physiology, Pathophysiology, and Clinical Management. Elsevier Health Sciences. pp. 807–. ISBN 978-1-4160-4907-4.
- ^ Bajaj L, Berman S (1 January 2011). Berman's Pediatric Decision Making. Elsevier Health Sciences. pp. 160–. ISBN 978-0-323-05405-8.
- ^ Lauritzen, Christian (1988). "Natürliche und Synthetische Sexualhormone – Biologische Grundlagen und Behandlungsprinzipien" [Natural and Synthetic Sexual Hormones – Biological Basis and Medical Treatment Principles]. In Hermann P. G. Schneider; Christian Lauritzen; Eberhard Nieschlag (eds.). Grundlagen und Klinik der Menschlichen Fortpflanzung [Foundations and Clinic of Human Reproduction] (in German). Walter de Gruyter. pp. 229–306. ISBN 978-3110109689. OCLC 35483492.
- ^ 리틀, A. B., & Billiar, R. B. (1983).프로게스타젠.임신내분비학, 제3판 (pp. 92–111)하퍼와 로우 필라델피아.https://scholar.google.com/scholar?cluster=2512291948467467634
- ^ a b c d e f g h i 프로게스테론 기준 범위, Bethesda MD, 03Feb09 국립보건원 임상 센터에서 수행됨
- ^ a b c d e f g h 314.46 g/mol의 몰 질량을 사용하여 질량 값으로 환산함
- ^ Häggström M (2014). "Reference ranges for estradiol, progesterone, luteinizing hormone and follicle-stimulating hormone during the menstrual cycle". WikiJournal of Medicine. 1 (1). doi:10.15347/wjm/2014.001. ISSN 2002-4436.
- ^ Goodson III WH, Handagama P, Moore II DH, Dairkee S (2007-12-13). "Milk products are a source of dietary progesterone". 30th Annual San Antonio Breast Cancer Symposium. pp. abstract # 2028. Retrieved 2008-03-12.
- ^ Pauli GF, Friesen JB, Gödecke T, Farnsworth NR, Glodny B (March 2010). "Occurrence of progesterone and related animal steroids in two higher plants". Journal of Natural Products. 73 (3): 338–345. doi:10.1021/np9007415. PMID 20108949. S2CID 26467578.
- ^ Applezweig N (May 1969). "Steroids". Chemical Week. 104: 57–72. PMID 12255132.
- ^ Noguchi E, Fujiwara Y, Matsushita S, Ikeda T, Ono M, Nohara T (September 2006). "Metabolism of tomato steroidal glycosides in humans". Chemical & Pharmaceutical Bulletin. 54 (9): 1312–1314. doi:10.1248/cpb.54.1312. PMID 16946542.
- ^ Yang DJ, Lu TJ, Hwang LS (October 2003). "Isolation and identification of steroidal saponins in Taiwanese yam cultivar (Dioscorea pseudojaponica Yamamoto)" (PDF). Journal of Agricultural and Food Chemistry. 51 (22): 6438–6444. doi:10.1021/jf030390j. PMID 14558759.
- ^ "Final report of the amended safety assessment of Dioscorea Villosa (Wild Yam) root extract". International Journal of Toxicology. 23 (Suppl 2): 49–54. 2004. doi:10.1080/10915810490499055. PMID 15513824. S2CID 962216.
- ^ Niño J, Jiménez DA, Mosquera OM, Correa YM (2007). "Diosgenin quantification by HPLC in a Dioscorea polygonoides tuber collection from colombian flora". Journal of the Brazilian Chemical Society. 18 (5): 1073–1076. doi:10.1590/S0103-50532007000500030.
- ^ Myoda T, Nagai T, Nagashima T (2005). Properties of starches in yam (Dioscorea spp.) tuber. pp. 105–114. ISBN 81-308-0003-9.
{{cite book}}:journal=무시됨(도움말) - ^ Wesp LM, Deutsch MB (March 2017). "Hormonal and Surgical Treatment Options for Transgender Women and Transfeminine Spectrum Persons". The Psychiatric Clinics of North America. 40 (1): 99–111. doi:10.1016/j.psc.2016.10.006. PMID 28159148.
- ^ Dolitsky SN, Cordeiro Mitchell CN, Stadler SS, Segars JH (November 2020). "Efficacy of progestin-only treatment for the management of menopausal symptoms: a systematic review". Menopause. 28 (2): 217–224. doi:10.1097/GME.0000000000001676. PMID 33109992. S2CID 225100434.
- ^ Ruan X, Mueck AO (November 2014). "Systemic progesterone therapy--oral, vaginal, injections and even transdermal?". Maturitas. 79 (3): 248–255. doi:10.1016/j.maturitas.2014.07.009. PMID 25113944.
- ^ Filicori M (November 2015). "Clinical roles and applications of progesterone in reproductive medicine: an overview". Acta Obstetricia et Gynecologica Scandinavica. 94 (Suppl 161): 3–7. doi:10.1111/aogs.12791. PMID 26443945.
- ^ Ciampaglia W, Cognigni GE (November 2015). "Clinical use of progesterone in infertility and assisted reproduction". Acta Obstetricia et Gynecologica Scandinavica. 94 (Suppl 161): 17–27. doi:10.1111/aogs.12770. PMID 26345161. S2CID 40753277.
- ^ Choi SJ (September 2017). "Use of progesterone supplement therapy for prevention of preterm birth: review of literatures". Obstetrics & Gynecology Science. 60 (5): 405–420. doi:10.5468/ogs.2017.60.5.405. PMC 5621069. PMID 28989916.
- ^ Coomarasamy A, Harb HM, Devall AJ, Cheed V, Roberts TE, Goranitis I, et al. (June 2020). "Progesterone to prevent miscarriage in women with early pregnancy bleeding: the PRISM RCT". Health Technology Assessment. 24 (33): 1–70. doi:10.3310/hta24330. PMC 7355406. PMID 32609084.
- ^ a b Elks J (14 November 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. pp. 1024–. ISBN 978-1-4757-2085-3.
- ^ a b Index Nominum 2000: International Drug Directory. Taylor & Francis. January 2000. pp. 880–. ISBN 978-3-88763-075-1.
- ^ Numazawa M, Nagaoka M, Kunitama Y (September 1986). "Regiospecific deoxygenation of the dihydroxyacetone moiety at C-17 of corticoid steroids with iodotrimethylsilane". Chemical & Pharmaceutical Bulletin. 34 (9): 3722–3726. doi:10.1248/cpb.34.3722. PMID 3815593.
- ^ a b Marker RE, Krueger J (1940). "Sterols. CXII. Sapogenins. XLI. The Preparation of Trillin and its Conversion to Progesterone". J. Am. Chem. Soc. 62 (12): 3349–3350. doi:10.1021/ja01869a023.
- ^ Goswami A, Kotoky R, Rastogi RC, Ghosh AC (1 May 2003). "A One-Pot Efficient Process for 16-Dehydropregnenolone Acetate". Organic Process Research & Development. 7 (3): 306–308. doi:10.1021/op0200625.
- ^ Heyl FW (1950). "Progesterone from 3-Acetoxybisnor-5-cholenaldehyde and 3-Ketobisnor-4-cholenaldehyde". Journal of the American Chemical Society. 72 (6): 2617–2619. doi:10.1021/ja01162a076.
- ^ Slomp G (1958). "Ozonolysis. II. 1 The Effect of Pyridine on the Ozonolysis of 4,22-Stigmastadien-3-one 2". Journal of the American Chemical Society. 80 (4): 915–921. doi:10.1021/ja01537a041.
- ^ Sundararaman P, Djerassi C (October 1977). "A convenient synthesis of progesterone from stigmasterol". The Journal of Organic Chemistry. 42 (22): 3633–3634. doi:10.1021/jo00442a044. PMID 915584.
- ^ "Nova Transcripts: Forgotten Genius". PBS.org. February 6, 2007.
- ^ "Giants of the Past". lipidlibrary.aocs.org. Archived from the original on 2012-04-15.
- ^ a b c Johnson WS, Gravestock MB, McCarry BE (August 1971). "Acetylenic bond participation in biogenetic-like olefinic cyclizations. II. Synthesis of dl-progesterone". Journal of the American Chemical Society. 93 (17): 4332–4334. doi:10.1021/ja00746a062. PMID 5131151.
- ^ Corner GW, Allen WM (1929-03-01). "Physiology of the corpus luteum". American Journal of Physiology. Legacy Content. 88 (2): 326–339. doi:10.1152/ajplegacy.1929.88.2.326. ISSN 0002-9513.
- ^ a b c Coutinho EM, Segal SJ (1999). Is Menstruation Obsolete?. Oxford University Press. pp. 31–. ISBN 978-0-19-513021-8.
- ^ Walker A (7 March 2008). The Menstrual Cycle. Routledge. pp. 49–. ISBN 978-1-134-71411-7.
- ^ Piosik R (2003). "Adolf Butenandt und sein Wirken an der Technischen Hochschule Danzig". Chemkon. 10 (3): 135–138. doi:10.1002/ckon.200390038.
- ^ Ginsburg B (6 December 2012). Premenstrual Syndrome: Ethical and Legal Implications in a Biomedical Perspective. Springer Science & Business Media. pp. 274–. ISBN 978-1-4684-5275-4.
- ^ Rolleston HD (1936). The Endocrine Organs in Health and Disease: With an Historical Review. Oxford University Press, H. Milford. p. 406.
- ^ Allen WM (October 1970). "Progesterone: how did the name originate?". Southern Medical Journal. 63 (10): 1151–1155. doi:10.1097/00007611-197010000-00012. PMID 4922128. S2CID 35867375.
- ^ Refsal K (February 2009). "Interpretation of Serum Progesterone Results for Management of Breeding in Dogs" (PDF). Webcd.endo.ref.
- ^ "Progesterone Prices, Coupons & Savings Tips - GoodRx". www.goodrx.com. Retrieved 2023-08-01.
- ^ "Progesterone Prices, Coupons & Savings Tips - GoodRx". www.goodrx.com. Retrieved 2023-08-01.
외부 링크
- 프로게스테론 MS 스펙트럼
- 미국 국립 의학 도서관 의학 주제 제목(MeSH)의 Progesterone
- Kimball JW (2007-05-27). "Progesterone". Kimball's Biology Pages. Archived from the original on 2008-06-18. Retrieved 2008-06-18.



