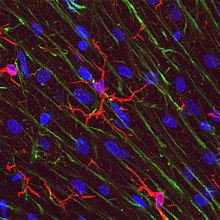
마이크로글리아
Microglia| 마이크로글리아 | |
|---|---|
 외상성 뇌손상 전 쥐피질에서 정지상태의 미세글리아(HRP로 염색된 레틴) | |
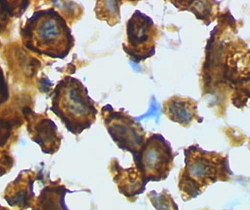 미세글리아/대식세포 – 외상성 뇌손상 후 쥐피질에서 활성화된 형태(HRP로 염색된 레틴) | |
| 세부 사항 | |
| 전구체 | 원시노른자당유래대식세포 |
| 시스템. | 중추신경계 |
| 식별자 | |
| 메쉬 | D017628 |
| TH | H2.006.2.00004, H2.006.2.01025 |
| FMA | 54539 |
| 미세해부술의 해부학적 용어 | |
미세아교세포는 뇌와 [1]척수 전체에 위치한 신경아교세포의 한 종류이다.마이크로글리아는 [2]뇌에서 발견되는 모든 세포의 10-15%를 차지한다.상주 대식세포로서, 그들은 중추신경계에서 [3]활동적인 면역 방어의 첫 번째이자 주된 형태로 작용합니다.미세글리아(및 성상세포를 포함한 다른 신경글리아)는 CNS [4][5]전체에 걸쳐 겹치지 않는 큰 영역에 분포한다.마이크로글리아는 뇌 전체의 유지에 중요한 세포입니다.그 세포는 CNS에서 플라크, 손상되거나 불필요한 뉴런과 시냅스,[6] 그리고 감염원을 끊임없이 찾아냅니다.이러한 프로세스는 치명적일 수 있는 손상을 방지하기 위해 효율적일 필요가 있기 때문에 마이크로글리아는 CNS의 [7]작은 병리학적 변화에도 매우 민감합니다.이러한 민감성은 부분적으로 세포 외 [6]칼륨의 작은 변화에도 반응하는 독특한 칼륨 채널의 존재에 의해 달성된다.최근의 증거는 또한 마이크로글리아가 건강한 [8]조건에서 정상적인 뇌 기능을 유지하는데 중요한 역할을 한다는 것을 보여준다.마이크로글리아는 또한 직접적인 체세포 접촉을 통해 신경 기능을 지속적으로 모니터링하고 필요할 [9]때 신경 보호 효과를 발휘한다.
CNS를 구성하는 뇌와 척수는 혈액-뇌 장벽 또는 BBB로 알려진 일련의 내피 세포 때문에 보통 신체 순환의 병원성 요인에 의해 직접적으로 접근되지 않는다.BBB는 대부분의 감염이 취약한 신경 조직에 도달하는 것을 막는다.감염제가 뇌에 직접 도입되거나 혈액-뇌 장벽을 넘는 경우, 미소교세포는 민감한 신경조직을 손상시키기 전에 염증을 줄이고 감염제를 파괴하기 위해 빠르게 반응해야 한다.신체의 나머지 부분으로부터 항체가 부족하기 때문에(수십 개의 항체는 혈액-뇌 장벽을 넘을 정도로 작음) 마이크로글리아는 이물질을 인식하고 삼키고 T세포를 활성화하는 항원 제시 세포 역할을 해야 한다.
폼
마이크로글리아 셀은 매우 가소성이 높으며 위치와 시스템 요구에 따라 다양한 구조적 변화를 겪습니다.이 수준의 가소성은 마이크로글리아가 수행하는 다양한 기능을 수행하기 위해 필요합니다.변환 능력은 정기적으로 대체되어야 하는 대식세포와 미세글리아를 구별하고 면역학적 [6]교란 없이 극히 짧은 시간에 CNS를 방어할 수 있는 능력을 제공한다.마이크로글리아는 그들이 [10]검출한 국소적인 조건과 화학적 신호에 반응하여 특정한 형태 또는 표현형을 채택합니다.
센섬 유전학
마이크로글리아 센섬은 신경 발달과 신경 퇴화에 큰 역할을 하는 것으로 보이는 비교적 새로운 생물학적 개념이다.센섬은 리간드와 미생물을 감지하는 데 사용되는 단백질 전사체의 독특한 그룹을 말한다.다시 말해, 센섬은 몸 안의 분자를 감지하는 데 사용되는 단백질에 필요한 유전자를 나타낸다.센섬은 qPCR, RNA-seq, 마이크로어레이 분석, 직접 RNA 배열 분석 등 다양한 방법으로 분석할 수 있습니다.신경세포에 비해 미세글리아에서 더 많이 발현되는 혈장막의 수용체 및 막 통과 단백질에 대한 감각 코드에 포함된 유전자.핵, 미토콘드리아 및 소포체와 [11]같은 막 결합 소기관 특유의 분비 단백질 또는 막 통과 단백질은 포함하지 않습니다.복수의 식별된 감각 유전자는 패턴 인식 수용체를 코드하지만, 다양한 포함 유전자가 존재한다.마이크로글리아는 다른 대식세포와 유사한 감각을 공유하지만, 그들은 22개의 고유한 유전자를 포함하고 있으며, 그 중 16개는 내생 리간드와의 상호작용에 사용된다.이러한 차이는 P2ry12와 HEXB를 포함한 40개 이상의 유전자를 포함하는 고유한 마이크로글리아 바이오마커를 만듭니다.DAP12(TYROBP)는 시그널링 어댑터 [11]및 조절 단백질로 작용하며 감각 단백질 상호작용에 중요한 역할을 하는 것으로 보인다.
감각 내 유전자의 조절은 잠재적인 해악에 반응하기 위해 변화할 수 있어야 한다.마이크로글리아는 이러한 [12]위험에 직면하기 위해 신경 보호 또는 신경 독성의 역할을 할 수 있다.이러한 이유로, 감각은 신경 퇴화에 역할을 하는 것으로 의심된다.노화에 따라 조절되는 센섬 유전자는 대부분 감염성 미생물 배위자를 감지하는 데 관여하는 반면, 조절되지 않는 것들은 대부분 내인성 [11]배위자를 감지하는 데 관여한다.이 분석은 자연 신경 변성에서의 신경 보호를 선호하는 글리알 특이적 조절을 시사한다.이것은 신경변성 질환에서 나타나는 신경독성으로의 이동과는 대조적이다.
감각은 또한 신경 발달에도 역할을 할 수 있다.초기 뇌 감염은 나중에 면역 자극에 과민한 미세글리아를 일으킨다.감염에 노출되면, 신경염증과 관련된 감각적 유전자의 상향 조절과 [13]신경가소성과 관련된 유전자의 하향 조절이 있다.그러나 신경발달을 변화시키는 감각의 능력은 질병과 싸울 수 있을 것이다.레트증후군 설치류 모델에서 고도로 발현된 감각 유전자인 CX3CL1이 제거되면서 건강이 개선되고 수명이 [14]길어졌다.레트 증후군이 없는 사람의 Cxcr1의3 하향 조절은 정신 [15]분열증과 유사한 증상과 관련이 있다.이는 센섬이 다양한 발달장애에 관여할 뿐만 아니라 질병이 없는 상태를 유지하기 위해서는 엄격한 규제가 필요하다는 것을 시사한다.
라미네이트
이러한 형태의 미세교세포는 이물질이나 죽어가는 세포가 없을 때 뇌와 척수 전체의 특정 위치에서 흔히 발견됩니다.이 "쉬고 있는" 형태의 마이크로글리아는 긴 가지 과정과 작은 세포체로 구성되어 있습니다.아메보이드 형태의 마이크로글리아와는 달리, 라미네이트 형태의 세포체는 가지가 끊임없이 움직이고 주변을 조사하면서 제자리에 남아 있다.가지는 생리적 상태의 작은 변화에 매우 민감하며 [10]체외에서 관찰하기 위해 매우 특정한 배양 조건을 필요로 한다.
활성 또는 아메바이드 마이크로글리아와 달리, 라미네이트된 마이크로글리아는 식세포를 생성하지 않고 더 적은 수의 면역 분자(MHC 클래스 I/II 단백질 포함)를 분비한다.이 상태의 마이크로글리아는 [16][17][18]CNS에서 항상성을 유지하면서 면역 위협을 검색하고 식별할 수 있습니다.비록 이것이 정지상태라고 여겨지지만, 이 형태의 마이크로글리아는 여전히 화학적으로 환경을 조사하는 데 매우 활발하다.라미네이트 마이크로글리아는 부상이나 위협에 [10]대응하여 언제든지 활성화된 형태로 변형될 수 있습니다.
리액티브(액티브)
역사적으로 자주 사용되었지만, "활성화" 마이크로글리아라는 용어는 "반응성" 마이크로글리아로 [19]대체해야 합니다.실제로, 명백히 대기 상태의 마이크로글리아는 활성 기능이 없는 것은 아니며, "활성화"라는 용어는 세포 반응성의 "전부 또는 무" 분극화를 나타내는 경향이 있기 때문에 오해를 불러일으킨다.반응성 미세글리아에서 상향 조절되는 마커 Iba1은 이러한 [20]세포를 시각화하기 위해 종종 사용됩니다.
비식세포성
이 상태는 사실 미세글리아가 분쇄된 형태에서 완전히 활동적인 식세포 형태로 이동할 때 단계적 반응의 일부입니다.마이크로글리아는 소염성 사이토카인, 세포괴사인자, 리포다당류 및 세포외 칼륨의 변화(세포파열을 나타낸다)를 포함한 다양한 요인에 의해 활성화될 수 있다.일단 활성화되면 세포는 가지의 비후화 및 수축, MHC 클래스 I/II 단백질의 흡수, 면역분자의 발현, 세포독성인자의 분비, 모집분자의 분비 및 소염증 신호 분자의 분비를 포함한 몇 가지 중요한 형태학적 변화를 겪는다(결과적으로 프로염증 신호 c).액세스)활성화된 비식세포 미세글리아는 일반적으로 완전한 식세포 변환 연속체를 따라 얼마나 멀리 떨어져 있는지에 따라 "부시", "로드" 또는 작은 아메보이드로 나타납니다.또한 마이크로글리아는 그 수를 늘리기 위해 빠르게 증식한다.엄밀한 형태학적 관점에서, 연속체를 따라 일어나는 미세글리아 형태의 변화는 형태학적 복잡성의 변화와 관련되며, 프랙탈 분석의 방법을 사용하여 정량화될 수 있다. 프랙탈 분석 방법은 다른 병리학적 형태와 관련된 미묘하고 시각적으로 감지할 수 없는 변화에 민감하다는 것이 증명되었다.를 [6][16][17][21]참조해당됩니다.
식세포의
활성화된 식세포 미세글리아는 면역반응이 가장 큰 형태의 미세글리아이다.이러한 세포들은 일반적으로 큰 아메바이드 형태를 띠지만, 약간의 차이가 관찰되었다.활성화된 비식세포 미세글리아의 항원 제시, 세포독성 및 염증 매개 시그널링을 갖는 것 외에 이물질을 식세포화하여 T세포 활성화를 위한 면역분자를 표시할 수 있다.식세포성 미세글리아는 손상 부위로 이동해 유해 물질을 삼키고 더 많은 세포가 증식하도록 촉진하기 위해 소염 인자를 분비한다.활성화된 식세포 마이크로글리아는 또한 건강한 [6][16]뇌세포에 대한 최소한의 손상으로 가능한 한 빨리 감염이나 염증을 물리치기 위해 성세포 및 신경세포와 상호작용합니다.
아메로이드
이 모양은 신경 조직 전체에 걸쳐 미세글리아가 자유롭게 움직일 수 있게 해주며, 이것은 소기 세포로서의 역할을 수행할 수 있게 해줍니다.아메보이드 마이크로글리아는 파편을 식세포화할 수 있지만 활성화된 마이크로글리아와 동일한 항원 제시 및 염증 역할을 수행하지는 않습니다.아메보이드 미세글리아는 특히 뇌의 발달과 재배선 중에 많이 발생하는데, 이것은 제거해야 할 세포 외 파편과 아포토시스 세포가 다량 존재하는 경우이다.이러한 형태의 미세글리아 세포는 주로 "마이크로글리아 [6][17][22]샘"으로 알려진 뇌량의 신생아 주변 백질 영역 내에서 발견됩니다.
지터 셀
기터 세포는 감염 물질이나 세포 부스러기의 미세아교세포의 식세포작용의 최종 결과물이다.결국 일정량의 물질을 삼킨 후 식세포 미세글리아 세포는 더 이상의 물질을 식세포화할 수 없게 된다.그 결과 생기는 세포 덩어리는 과립상 소립자로 알려져 있으며, 그 '알갱이' 모양에서 이름이 붙여졌다.기터 세포를 드러내기 위해 얼룩진 조직을 보면 병리학자는 감염 [23]후 치유된 부위를 시각화할 수 있다.
혈관 주위의
위에 언급된 다른 종류의 미세글리아와는 달리, "혈관계" 미세글리아는 세포의 형태/기능이 아닌 위치를 가리킵니다.혈관주위 미세글리아는 주로 기저층 벽 안에서 발견된다.이들은 정상적인 미세글리아 기능을 수행하지만 일반 미세글리아와 달리 정기적으로 골수유래 전구세포로 대체되며 환경에 관계없이 MHC 2급 항원을 발현한다.또한 혈관주위 미세글리아는 대식세포 분화 [6]항원에 강하게 반응한다.이 미세글리아는 허혈성 망막증에 대한 리터의 실험과 관찰에서 알 수 있듯이 혈관벽의 복구에 필수적인 것으로 나타났다.혈관주위의 미세글리아는 내피세포 증식을 촉진하여 새로운 혈관을 형성하고 손상된 혈관을 수리할 수 있게 한다.이 과정에서 골수세포의 모집과 미세교세포로의 분화가 매우 가속화되어 이러한 [24]과제를 달성할 수 있다.
병렬 혈관
혈관주위의 미세글리아와 마찬가지로, 주로 그 위치에 의해 혈관주위의 미세글리아를 구별할 수 있다.혈관 기저층 벽과 직접 접촉하는 혈관 미세글리아는 발견되지만 벽 안에는 발견되지 않는다.혈관 주변 세포처럼 염증성 사이토카인 활성의 낮은 수준에서도 MHC 클래스 II 단백질을 발현합니다.혈관주위세포와 달리, 그러나 상주 미세글리아와 유사하게, 병맥 미세글리아는 정기적으로 [6]골수성 전구세포로 빠르게 회전하거나 대체되지 않는다.
기능들

미세아교세포는 주로 면역반응과 항상성 유지와 관련된 CNS 내의 다양한 작업을 수행한다.다음은 이들 [citation needed]셀에 의해 실행되는 주요 알려진 기능 중 몇 가지입니다.
청소
환경의 작은 변화에 매우 민감할 뿐만 아니라, 각 마이크로글리아 셀은 정기적으로 도메인을 물리적으로 조사합니다.이 작업은 아메바이드 및 정지 상태에서 수행됩니다.설정된 영역을 이동하는 동안, 마이크로글리아 세포가 이물질, 손상된 세포, 아포토시스 세포, 신경섬유 엉킴, DNA 조각 또는 플라크 등을 발견하면 활성화되고 해당 물질 또는 세포를 식세포화시킵니다.이러한 방식으로 마이크로글리아 세포는 무작위 세포 부스러기를 [16]청소하는 "하우스키퍼" 역할도 합니다.뇌의 발달적 배선 동안, 미세아교세포는 신경 전구세포의 수를 조절하고 아포토시스 뉴런을 제거하는 큰 역할을 합니다.마이크로글리아가 시냅스를 [25]집어삼키고 제거함으로써 시냅스 회로를 정교하게 만들 수 있다는 증거도 있다.발달 후, 죽은 세포나 아포토시스 세포의 대부분은 대뇌피질과 피질하백질에서 발견됩니다.이것은 대부분의 아메보이드 미세교세포가 대뇌피질의 [22]"소교세포분수" 내에서 발견되는 이유를 설명할 수 있다.
식세포증
미세글리아의 주요 역할인 식세포증은 다양한 물질을 삼키는 것을 포함한다.삼켜진 물질은 일반적으로 비증기 상태의 세포 잔해, 지질 및 아포토시스 세포와 염증 상태의 바이러스, 박테리아 또는 기타 이물질로 구성됩니다.일단 마이크로글리아 세포가 가득 차면 식세포 활동을 멈추고 상대적으로 반응하지 않는 기터 [26]세포로 변한다.
세포외 시그널링
뇌에서 미세교세포의 역할 중 상당 부분은 감염되지 않은 부위의 항상성을 유지하고 감염되거나 손상된 조직의 염증을 촉진하는 것이다.마이크로글리아는 다른 마이크로글리아, 성세포, 신경, T세포 및 골수 전구 세포와 통신할 수 있도록 하는 매우 복잡한 세포외 신호 분자를 통해 이것을 달성합니다.위와 같이 사이토카인 IFN-γ를 사용하여 미세글리아세포를 활성화 할 수 있다.또한 IFN-γ에 의해 활성화 된 후 마이크로글리아는 세포외 공간에 더 많은 IFN-γ를 방출한다.이것은 더 많은 미세글리아를 활성화하고 근처의 모든 미세글리아를 빠르게 활성화하는 사이토카인 유도 활성화 캐스케이드를 시작합니다.마이크로글리아가 생성하는 TNF-α는 신경 조직에 아포토시스를 일으켜 염증을 증가시킨다.IL-8은 B세포의 성장과 분화를 촉진하여 미립자가 감염과 싸우는 것을 돕는다.또 다른 사이토카인 IL-1은 항원 제시 및 소염 신호를 하향 조정하는 사이토카인 IL-10 및 TGF-β를 억제한다.MDC, IL-8, MIP-3β 등의 화학분자의 미세글라이얼 생성을 통해 부상부위로 추가 수지상세포 및 T세포를 모집한다.마지막으로2 PGE 및 기타 프로스타노이드는 미소교감염증반응을 억제하고 Th1(T-helper cell)반응을 [16]다운조절함으로써 만성염증을 예방한다.
항원 제시
이상과 같이 상주하는 비활성 마이크로글리아는 MHC 등급 I/II 단백질이 부족하여 항원 제시 세포로서 기능하지 않는다.활성화 시 MHC 등급 I/II 단백질을 신속하게 발현하고 신속하게 효율적인 항원 제시자가 된다.경우에 따라서는 IFN-γ에 의해 마이크로글리아가 활성화되어 항원을 나타낼 수도 있지만, MHC 클래스 I/II 단백질의 흡수를 거친 것처럼 효과적으로 기능하지는 않는다.염증이 일어나는 동안, T세포는 특별한 표면 마커 덕분에 혈액-뇌 장벽을 넘고 항원을 받기 위해 마이크로글리아에 직접 결합합니다.일단 항원이 제시되면, T세포는 소염제 도입, 면역모리의 형성, 세포독성 물질의 분비, 그리고 이물질의 [6][16]혈장막에 대한 직접적인 공격 등 다양한 역할을 수행한다.
세포독성
미세글리아는 식세포증을 통해 세포간 접촉을 통해 감염성 유기체를 파괴할 수 있을 뿐만 아니라 다양한 세포독성 [27]물질을 방출할 수도 있다.배양물의 마이크로글리아는 '호흡 버스트'라고 알려진 과정에서 다량의 과산화수소와 일산화질소를 분비합니다.이 두 가지 화학 물질 모두 직접적으로 세포를 손상시키고 신경 세포 사멸을 초래할 수 있다.마이크로글리아에 의해 분비되는 단백질 분해효소는 직접적인 세포 손상을 일으키는 특정 단백질을 분해하는 반면, IL-1과 같은 사이토카인은 신경 축삭의 탈수화를 촉진한다.마지막으로 마이크로글리아는 글루탐산, 아스파르트산, 퀴놀린산을 분비함으로써 NMDA 수용체 매개 과정을 통해 뉴런을 손상시킬 수 있다.세포독성 분비는 감염된 뉴런, 바이러스, 박테리아를 파괴하는 것을 목적으로 하지만 많은 양의 부수적인 신경 손상을 일으킬 수도 있다.결과적으로, 만성적인 염증 반응은 침입한 [6]감염을 파괴하기 위해 미소글리아가 뇌를 파괴하기 때문에 대규모 신경 손상을 초래할 수 있다.래디칼 스캐빈저인 에다라본은 활성화된 미세글리아에 [28]의해 촉진되는 산화성 신경독성을 예방합니다.
시냅스 스트리핑
1968년 Blinzinger와 Kreutzberg에 의해 척추 병변에서 처음 발견된 현상으로, 소염 후 미세글리아는 손상된 조직 근처의 신경에서 가지를 제거한다.이는 손상된 신경 회로의 [6]재생 및 재매핑을 촉진하는 데 도움이 됩니다.또한 마이크로글리아는 뇌의 [29]발달 과정에서 시냅스 가지치기 과정에 관여하는 것으로 나타났다.
수리의 촉진
소염 후 미세글리아는 신경조직의 재생을 촉진하기 위해 여러 단계를 거친다.여기에는 시냅스 박리, 항염증성 사이토카인 분비, 손상된 부위에 뉴런과 성상세포의 유입, 기터세포의 형성이 포함된다.미세아교세포가 재생되지 않으면 CNS의 거주지역은 상당히 느려지고 뇌와 [6][24]눈을 둘러싼 많은 혈관시스템에서는 거의 불가능하다.최근 연구에 따르면 미세아교 과정이 특수한 체세포 접합을 통해 신경세포의 기능을 지속적으로 감시하고 신경세포의 웰빙을 감지하는 것으로 확인됐다.이 세포간 통신 경로를 통해 마이크로글리아는 강력한 신경 보호 효과를 발휘할 수 있으며, 뇌 [30]손상 후 회복에 크게 기여합니다.
발전
오랫동안 미세아교세포는 골수에서 모든 혈액세포의 조상인 조혈모세포와 구별된다고 여겨졌다.그러나 최근 연구에 따르면 미세글리아는 현저하게 제한된 배아기 동안 노른자 주머니에서 발생하며 뇌간엽을 채운다.또한 말초 단구 [31]전구체의 보충 없이 지속적으로 자가 재생하고 평생 지속된다.
단구들은 또한 골수상 수상세포와 말초 시스템에서 대식세포로 분화할 수 있다.몸의 다른 부분에 있는 대식세포와 마찬가지로, 미세글리아는 이물질을 파괴하기 위해 식세포와 세포독성 메커니즘을 사용한다.마이크로글리아와 대식세포는 모두 항원 제시 세포로 작용하여 면역 반응에 기여하고, 사이토카인과 다른 신호 [32]분자를 분비함으로써 몸 안의 염증과 항상성 메커니즘을 촉진한다.
하향 조절된 형태에서, 마이크로글리아는 MHC 클래스 I/MHC 클래스 II 단백질, IFN-γ 사이토카인, CD45 항원 및 정상적인 대식세포를 구별하는 항원 제시, 식세포 및 세포독성 역할에 필요한 다른 많은 표면 수용체가 부족하다.마이크로글리아는 또한 정확한 면역 [16]반응을 유지하기 위해 공간적으로나 시간적으로 훨씬 더 엄격하게 조절된다는 점에서 대식세포와 다르다.
미세글리아와 골수 전구 세포와 구별되는 다른 세포들 사이의 또 다른 차이점은 회전 속도이다.대식세포와 수지상세포는 지속적으로 사용되어 필요한 유형으로 분화하는 골수성 전구세포로 대체된다.혈액-뇌 장벽 때문에, 신체가 지속적으로 미세글리아를 대체하는 것은 상당히 어려울 것이다.따라서, 골수성 전구 세포로 지속적으로 대체되는 대신, 미세글리아는 정지 상태에서 상태를 유지하고, 활성화되면, 숫자를 유지하기 위해 빠르게 증식한다.그러나 뼈 키메라 연구는 극단적인 감염의 경우 혈액-뇌 장벽이 약해지고 미세글리아는 골수유래 세포, 즉 골수 전구 세포와 대식세포로 대체된다는 것을 보여주었다.감염이 감소하면 말초 시스템과 중앙 시스템 간의 연결이 다시 확립되고 회복 및 재생 [33]기간 동안 미소글리아만 존재합니다.
에이징
미소아교세포는 부상 중에 유사분열 활동이 폭발적으로 일어난다; 이 증식은 세포수를 [34]베이스라인으로 되돌리기 위해 세포자멸을 수반한다.마이크로글리아 활성화는 활성화 된 마이크로글리아를 비활성화 [34]세포보다 빨리 죽게 하는 세포의 아나볼릭 및 이화성 기계에 부하를 준다.시간 경과에 따른 미세교감 손실을 보상하기 위해, 미세교감세포는 유사분열 과정을 거치고 골수유래 전구세포는 수막과 [34]혈관 구조를 통해 뇌로 이동한다.
정상적인 노화 중에 발생하는 경미한 신경 손상의 축적은 미세글리아를 확대되고 활성화된 [35]세포로 바꿀 수 있다.이러한 만성적이고 나이와 관련된 미세글리아 활성화 및 IL-1 발현 증가는 민감한 [35]환자의 신경성 플라크 형성을 선호함으로써 나이가 들수록 알츠하이머병의 위험 증가에 기여할 수 있다.DNA 손상은 노화와 관련된 미세아교 활성화에 기여할 수 있다.또 다른 요인은 [35]노화와 함께 축적되는 고급 당화 최종 산물의 축적일 수 있다.이러한 단백질은 단백질 분해 과정에 강한 내성을 가지고 단백질 가교 연결을 [35]촉진합니다.
연구는 인간의 미세글리아를 발견하였습니다."이러한 세포들은 탈아미화, 위축, 단편화 또는 비정상적으로 구부러진 과정과 같은 세포질 구조의 이상에 의해 특징지어지며, 종종 구상 또는 구근의 [34]팽창을 일으킨다."디스트로피드 마이크로글리아 발병률은 [34]노화와 함께 증가한다.프리온병, 정신분열증, 알츠하이머병 연구에서 미세글라이어 퇴화와 사망이 보고되고 있어 미세글라이어 퇴화는 신경변성 [34]질환과 관련이 있을 수 있음을 시사하고 있다.이 이론의 복잡성은 인간의 [34]뇌에서 "활성화"와 "비영양화"를 구별하는 것이 어렵다는 사실이다.
생쥐의 경우 CD22 차단이 [36]노화뇌의 항상성 미세아교세포증을 회복시키는 것으로 나타났다.
임상적 의의
마이크로글리아는 말초 대식세포와 유사한 중추신경계의 1차 면역세포이다.그들은 형태학을 바꾸고 감염/부상 현장으로 이동하여 병원균을 파괴하고 손상된 세포를 제거함으로써 병원균과 부상에 대응한다.그들의 반응의 일부로서 그들은 면역 반응을 지시하는 데 도움을 주는 사이토카인, 케모카인, 프로스타글란딘, 그리고 반응성 산소 종을 분비합니다.또한 항염증성 사이토카인의 생성을 통해 염증 반응을 분해하는 데 중요한 역할을 한다.마이크로글리아는 또한 심장병, 녹내장, 바이러스 및 세균 감염뿐만 아니라 알츠하이머, 파킨슨병, 다발성 경화증과 같은 신경 변성 질환에서 해로운 역할을 하는 것으로 광범위하게 연구되어 왔다.면역 조절 장애는 연쇄상구균 감염과 관련된 강박증, 투렛 증후군, 소아 자가면역신경정신장애의 병태생리학에 기여한다는 증거가 축적되어 있다.[37]
마이크로글리아는 중추신경계의 항상성의 미세한 변화에도 빠르게 반응하기 때문에 신경학적 기능 장애나 [38]장애의 센서로 볼 수 있다.뇌병리학의 경우 마이크로글리아 표현형은 확실히 [38]변화한다.따라서 미세글리아 분석은 주어진 조직 [38]검체의 중추신경계 장애를 진단하고 특징짓는 민감한 도구가 될 수 있습니다.특히 미세글리아 세포 밀도, 세포 모양, 분포 패턴, 구별되는 미세글리아 표현형 및 다른 세포 유형과의 상호작용을 [38]평가해야 한다.
역사
마이크로글리아를 포함한 다른 신경 세포를 보고 특징짓는 능력은 1880년 니슬 염색법이 프란츠 니슬에 의해 개발되었을 때 시작되었습니다.Franz Nissl과 William Ford Robertson은 조직학 실험에서 처음으로 미세아교세포에 대해 설명했습니다.1880년대의 세포 염색 기술은 마이크로글리아가 대식세포와 관련이 있다는 것을 보여주었다.미세글리아의 활성화와 분쇄된 미세글리아 클러스터 형성은 1897년 광견병 사례를 연구하던 중 빅터 베이브쉬에 의해 처음 발견되었다.Babesh는 그 세포들이 다양한 바이러스 뇌 감염에서 발견되었다고 언급했지만 그가 본 미세글리아가 무엇인지 [39]알지 못했다.스페인의 과학자 산티아고 라몬 이 카할은 뉴런과 성세포 [40]외에 "제3의 원소"를 정의했다.산티아고 라몬 이 카할의 학생인 피오 델 리오 오르테가는 1920년경 이 세포를 "마이크로글리아"라고 처음 불렀다.그는 1927년 뇌 병변에 대한 미세교동 반응을 특징짓고 1932년 뇌량 및 다른 신생아 주변 백질 영역에 존재하는 "소교동 분수"에 주목했다.오랜 연구 끝에 리오 호테가는 일반적으로 "마이크로글리아의 [41][42]아버지"로 여겨지게 되었다.오랫동안 마이크로글리아에 대한 우리의 지식은 거의 개선되지 않았다.그 후 1988년 히키와 키무라는 혈관주위의 미세글리아 세포가 골수 유도체이며 항원제시에 사용되는 MHC Class II 단백질의 높은 수치를 발현한다는 것을 보여주었다.이는 식세포증 및 항원 [citation needed]제시를 수행함으로써 미세글리아 세포가 대식세포와 유사하게 기능한다는 피오 델 리오-호르테가의 가정을 확인했다.
「 」를 참조해 주세요.
레퍼런스
- ^ Ginhoux F, Lim S, Hoeffel G, Low D, Huber T (2013). "Origin and differentiation of microglia". Frontiers in Cellular Neuroscience. 7: 45. doi:10.3389/fncel.2013.00045. PMC 3627983. PMID 23616747.
- ^ Lawson LJ, Perry VH, Gordon S (1992). "Turnover of resident microglia in the normal adult mouse brain". Neuroscience. 48 (2): 405–415. doi:10.1016/0306-4522(92)90500-2. PMID 1603325. S2CID 42655833.
- ^ Filiano AJ, Gadani SP, Kipnis J (August 2015). "Interactions of innate and adaptive immunity in brain development and function". Brain Research. 1617: 18–27. doi:10.1016/j.brainres.2014.07.050. PMC 4320678. PMID 25110235.
- ^ Kreutzberg GW (March 1995). "Microglia, the first line of defence in brain pathologies". Arzneimittel-Forschung. 45 (3A): 357–360. PMID 7763326.
- ^ Bushong EA, Martone ME, Jones YZ, Ellisman MH (January 2002). "Protoplasmic astrocytes in CA1 stratum radiatum occupy separate anatomical domains". The Journal of Neuroscience. 22 (1): 183–192. doi:10.1523/JNEUROSCI.22-01-00183.2002. PMC 6757596. PMID 11756501.
- ^ a b c d e f g h i j k l Gehrmann J, Matsumoto Y, Kreutzberg GW (March 1995). "Microglia: intrinsic immuneffector cell of the brain". Brain Research. Brain Research Reviews. 20 (3): 269–287. doi:10.1016/0165-0173(94)00015-H. PMID 7550361. S2CID 22708728.
- ^ Dissing-Olesen L, Ladeby R, Nielsen HH, Toft-Hansen H, Dalmau I, Finsen B (October 2007). "Axonal lesion-induced microglial proliferation and microglial cluster formation in the mouse". Neuroscience. 149 (1): 112–122. doi:10.1016/j.neuroscience.2007.06.037. PMID 17870248. S2CID 36995129.
- ^ Kierdorf와 Prinz, J Clin Invest. 2017;201~3209.https://doi.org/10.1172/JCI90602
- ^ Cserép C, Pósfai B, Lénárt N, Fekete R, László ZI, Lele Z, et al. (January 2020). "Microglia monitor and protect neuronal function through specialized somatic purinergic junctions". Science. 367 (6477): 528–537. Bibcode:2020Sci...367..528C. doi:10.1126/science.aax6752. PMID 31831638. S2CID 209343260.
- ^ a b c Verkhratsky A, Butt A (2013). Glial physiology and pathophysiology. Chicester: John Wiley & Sons. ISBN 978-1118402054.[페이지 필요]
- ^ a b c Hickman SE, Kingery ND, Ohsumi TK, Borowsky ML, Wang LC, Means TK, El Khoury J (December 2013). "The microglial sensome revealed by direct RNA sequencing". Nature Neuroscience. 16 (12): 1896–1905. doi:10.1038/nn.3554. PMC 3840123. PMID 24162652.
- ^ Block, M.L., Zecca, L. & Hong, J.S. Microglia 매개 신경독성: 분자 메커니즘을 밝혀냅니다.Neurosci 목사. 8, 57~69 (2007).
- ^ Ji P, Schachtschneider KM, Schook LB, Walker FR, Johnson RW (May 2016). "Peripheral viral infection induced microglial sensome genes and enhanced microglial cell activity in the hippocampus of neonatal piglets". Brain, Behavior, and Immunity. 54: 243–251. doi:10.1016/j.bbi.2016.02.010. PMC 4828316. PMID 26872419.
- ^ Horiuchi M, Smith L, Maezawa I, Jin LW (February 2017). "CX3CR1 ablation ameliorates motor and respiratory dysfunctions and improves survival of a Rett syndrome mouse model". Brain, Behavior, and Immunity. 60: 106–116. doi:10.1016/j.bbi.2016.02.014. PMC 5531048. PMID 26883520.
- ^ Bergon A, Belzeaux R, Comte M, Pelletier F, Hervé M, Gardiner EJ, et al. (October 2015). "CX3CR1 is dysregulated in blood and brain from schizophrenia patients". Schizophrenia Research. 168 (1–2): 434–443. doi:10.1016/j.schres.2015.08.010. PMID 26285829. S2CID 205073822.
- ^ a b c d e f g Aloisi F (November 2001). "Immune function of microglia". Glia. 36 (2): 165–179. doi:10.1002/glia.1106. PMID 11596125. S2CID 25410282.
- ^ a b c Christensen RN, Ha BK, Sun F, Bresnahan JC, Beattie MS (July 2006). "Kainate induces rapid redistribution of the actin cytoskeleton in ameboid microglia". Journal of Neuroscience Research. 84 (1): 170–181. doi:10.1002/jnr.20865. PMID 16625662. S2CID 34491558.
- ^ Davis EJ, Foster TD, Thomas WE (1994). "Cellular forms and functions of brain microglia". Brain Research Bulletin. 34 (1): 73–78. doi:10.1016/0361-9230(94)90189-9. PMID 8193937. S2CID 22596219.
- ^ Eggen BJ, Raj D, Hanisch UK, Boddeke HW (September 2013). "Microglial phenotype and adaptation". Journal of Neuroimmune Pharmacology. 8 (4): 807–823. doi:10.1007/s11481-013-9490-4. PMID 23881706. S2CID 15283939.
- ^ Lan X, Han X, Li Q, Yang QW, Wang J (July 2017). "Modulators of microglial activation and polarization after intracerebral haemorrhage". Nature Reviews. Neurology. 13 (7): 420–433. doi:10.1038/nrneurol.2017.69. PMC 5575938. PMID 28524175.
- ^ Jelinek HF, Karperien A, Bossomaier T, Buchan A (1975). "Differentiating grades of microglia activation with fractal analysis" (PDF). Complexity International. 12 (18): 1713–7. Archived from the original (PDF) on 2008-12-17.
- ^ a b Ferrer I, Bernet E, Soriano E, del Rio T, Fonseca M (1990). "Naturally occurring cell death in the cerebral cortex of the rat and removal of dead cells by transitory phagocytes". Neuroscience. 39 (2): 451–458. doi:10.1016/0306-4522(90)90281-8. PMID 2087266. S2CID 23457378.
- ^ Rissi DR, Oliveira FN, Rech RR, Pierezan F, Lemos RA, Barros CS (2006). "Epidemiologia, sinais clínicos e distribuição das lesões encefálicas em bovinos afetados por meningoencefalite por herpesvírus bovino-5" [Epidemiology, clinical signs and distribution of the encephalic lesions in cattle affected by meningoencephalitis caused by bovine herpesvirus-5]. Pesquisa Veterinária Brasileira (in Portuguese). 26 (2): 123–32. doi:10.1590/S0100-736X2006000200010.
- ^ a b Ritter MR, Banin E, Moreno SK, Aguilar E, Dorrell MI, Friedlander M (December 2006). "Myeloid progenitors differentiate into microglia and promote vascular repair in a model of ischemic retinopathy". The Journal of Clinical Investigation. 116 (12): 3266–3276. doi:10.1172/JCI29683. PMC 1636693. PMID 17111048.
- ^ Chung WS, Welsh CA, Barres BA, Stevens B (November 2015). "Do glia drive synaptic and cognitive impairment in disease?". Nature Neuroscience. 18 (11): 1539–1545. doi:10.1038/nn.4142. PMC 4739631. PMID 26505565.
- ^ Galloway DA, Phillips AE, Owen DR, Moore CS (2019). "Phagocytosis in the Brain: Homeostasis and Disease". Frontiers in Immunology. 10: 790. doi:10.3389/fimmu.2019.00790. PMC 6477030. PMID 31040847.
- ^ Wolf A, Herb M, Schramm M, Langmann T (June 2020). "The TSPO-NOX1 axis controls phagocyte-triggered pathological angiogenesis in the eye". Nature Communications. 11 (1): 2709. Bibcode:2020NatCo..11.2709W. doi:10.1038/s41467-020-16400-8. PMC 7264151. PMID 32483169.
- ^ Banno M, Mizuno T, Kato H, Zhang G, Kawanokuchi J, Wang J, et al. (February 2005). "The radical scavenger edaravone prevents oxidative neurotoxicity induced by peroxynitrite and activated microglia". Neuropharmacology. 48 (2): 283–290. doi:10.1016/j.neuropharm.2004.10.002. PMID 15695167. S2CID 25545853.
- ^ Soteros BM, Sia GM (November 2021). "Complement and microglia dependent synapse elimination in brain development". WIREs Mechanisms of Disease: e1545. doi:10.1002/wsbm.1545. PMID 34738335.
- ^ Cserép C, Pósfai B, Lénárt N, Fekete R, László ZI, Lele Z, et al. (January 2020). "Microglia monitor and protect neuronal function through specialized somatic purinergic junctions". Science. 367 (6477): 528–537. Bibcode:2020Sci...367..528C. doi:10.1126/science.aax6752. PMID 31831638. S2CID 209343260.
- ^ Ginhoux F, Prinz M (July 2015). "Origin of microglia: current concepts and past controversies". Cold Spring Harbor Perspectives in Biology. 7 (8): a020537. doi:10.1101/cshperspect.a020537. PMC 4526747. PMID 26134003.
- ^ Zhu H, Wang Z, Yu J, Yang X, He F, Liu Z, et al. (July 2019). "Role and mechanisms of cytokines in the secondary brain injury after intracerebral hemorrhage". Progress in Neurobiology. 178: 101610. doi:10.1016/j.pneurobio.2019.03.003. PMID 30923023. S2CID 85495400.
- ^ Gehrmann J (1996). "Microglia: a sensor to threats in the nervous system?". Research in Virology. 147 (2–3): 79–88. doi:10.1016/0923-2516(96)80220-2. PMID 8901425.
- ^ a b c d e f g Streit WJ (September 2006). "Microglial senescence: does the brain's immune system have an expiration date?". Trends in Neurosciences. 29 (9): 506–510. doi:10.1016/j.tins.2006.07.001. PMID 16859761. S2CID 8874596.
- ^ a b c d Mrak RE, Griffin WS (March 2005). "Glia and their cytokines in progression of neurodegeneration". Neurobiology of Aging. 26 (3): 349–354. doi:10.1016/j.neurobiolaging.2004.05.010. PMID 15639313. S2CID 33152515.
- ^ Pluvinage JV, Haney MS, Smith BA, Sun J, Iram T, Bonanno L, et al. (April 2019). "CD22 blockade restores homeostatic microglial phagocytosis in ageing brains". Nature. 568 (7751): 187–192. Bibcode:2019Natur.568..187P. doi:10.1038/s41586-019-1088-4. PMC 6574119. PMID 30944478.
- ^ Frick L, Pittenger C (2016). "Microglial Dysregulation in OCD, Tourette Syndrome, and PANDAS". Journal of Immunology Research. 2016: 8606057. doi:10.1155/2016/8606057. PMC 5174185. PMID 28053994.
- ^ a b c d Schwabenland M, Brück W, Priller J, Stadelmann C, Lassmann H, Prinz M (December 2021). "Analyzing microglial phenotypes across neuropathologies: a practical guide". Acta Neuropathologica (published October 2021). 142 (6): 923–936. doi:10.1007/s00401-021-02370-8. PMC 8498770. PMID 34623511.
 이 문서에는 CC BY 4.0 라이센스로 제공되는 텍스트가 포함되어 있습니다.
이 문서에는 CC BY 4.0 라이센스로 제공되는 텍스트가 포함되어 있습니다. - ^ Babeş, VM (1892). "Certains caractères des lesions histologiques de la rage" [Certain characteristics of the histological lesions of rabies]. Annales de l'Institut Pasteur (in French). 6: 209–23.
- ^ Sierra, Amanda; de Castro, Fernando; del Río-Hortega, Juan; Rafael Iglesias-Rozas, José; Garrosa, Manuel; Kettenmann, Helmut (2016-09-16). "The "Big-Bang" for modern glial biology: Translation and comments on Pío del Río-Hortega 1919 series of papers on microglia: 1919 Río-Hortega Papers on Microglia". Glia. 64 (11): 1801–1840. doi:10.1002/glia.23046.
{{cite journal}}: CS1 유지보수: 날짜 및 연도(링크) - ^ del Río Hortega P, Penfield W (1892). "Cerebral Cicatrix: the Reaction of Neuroglia and Microglia to Brain Wounds". Bulletin of the Johns Hopkins Hospital. 41: 278–303.
- ^ del Rio-Hortega F (1937). "Microglia". Cytology and Cellular Pathology of the Nervous System: 481–534.
추가 정보
- Rock RB, Gekker G, Hu S, Sheng WS, Cheeran M, Lokensgard JR, Peterson PK (October 2004). "Role of microglia in central nervous system infections". Clinical Microbiology Reviews. 17 (4): 942–64, table of contents. doi:10.1128/CMR.17.4.942-964.2004. PMC 523558. PMID 15489356.
- Han X, Li Q, Lan X, El-Mufti L, Ren H, Wang J (September 2019). "Microglial Depletion with Clodronate Liposomes Increases Proinflammatory Cytokine Levels, Induces Astrocyte Activation, and Damages Blood Vessel Integrity". Molecular Neurobiology. 56 (9): 6184–6196. doi:10.1007/s12035-019-1502-9. PMC 6684378. PMID 30734229.
외부 링크
- 마이크로글리아의 마이크로글리아 홈페이지그물
- 머릿속에 살금살금 - Microglia에 대한 간단한 소개 - Science Creative Quarterly 리뷰
- "Immune Scavengers Target Alzheimer's Plaques". April 6, 2007.
- 위키다양성 신경과학부
- NIF 검색 - 신경과학 정보 프레임워크를 통한 마이크로글리아 세포