벤젠
Benzene
| |||
 공간 채우기 모델 | |||
| 이름 | |||
|---|---|---|---|
| 우선 IUPAC 이름 벤젠[1] | |||
| 기타 이름 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 체비 | |||
| 첸블 | |||
| 켐스파이더 | |||
| ECHA 정보 카드 | 100.000.685 | ||
| EC 번호 |
| ||
| 케그 | |||
PubChem CID | |||
| RTECS 번호 |
| ||
| 유니 | |||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| C6H6 | |||
| 몰 질량 | 78.19g/140−1 | ||
| 외모 | 무색 액체 | ||
| 냄새 | 달콤한 방향제 | ||
| 밀도 | 0.8765(20) g/cm3[2] | ||
| 녹는점 | 5.53 °C (41.95 °F, 278.68 K) | ||
| 비등점 | 80.1 °C (176.2 °F, 353.2 K) | ||
| 1.53g/L(0°C) 1.81g/L(9°C) 1.79g/L(15°[3][4][5]C) 1.84g/L(30°C) 2.26g/L(61°C) 3.94g/L(100°C) 21.7 g/kg (200 °C, 6.5 MPa) 17.8 g/kg (200 °C, 40 MPa)[6] | |||
| 용해성 | 알코올, CHCl3, CCl4, 디에틸에테르, 아세톤, 아세트산에[6] 가용성 | ||
| 에탄디올의 용해성 | 5.83g/100g(20°C) 6.61 g/100 g (40 °C) 7.61 g/100 g (60 °C)[6] | ||
| 에탄올의 용해성 | 20 °C, 물에 담근 용액: 1.2 mL/L(20 % v/v)[7] | ||
| 아세톤의 용해성 | 20 °C, 물에 담근 용액: 7.69 mL/L (38.46 % v/v) 49.4 mL/L (62.5 % v/v)[7] | ||
| 디에틸렌 글리콜의 용해성 | 52g/100g(20°C)[6] | ||
| 로그 P | 2.13 | ||
| 증기압 | 12.7kPa(25°C) 24.4 kPa (40 °C) 181kPa(100°[8]C) | ||
| 켤레산 | 벤제늄 | ||
| UV-vis (µmax) | 255 nm | ||
자화율(δ) | - 54.8 · 10−6 cm3 / 세로 | ||
굴절률(nD) | 1.5011 (20 °C) 1.4948(30°[6]C) | ||
| 점성 | 0.7528cP(10°C) 0.6076cP(25°C) 0.4965 cP (40 °C) 0.3075 cP (80 °C) | ||
| 구조. | |||
| 삼각 평면 | |||
| 0 D | |||
| 열화학 | |||
열용량 (C) | 134.8 J/mol·K | ||
표준 어금니 엔트로피 (S | 173.26 J/mol·K[8] | ||
표준 엔탈피/ 형성 (δHf⦵298) | 48.7 kJ/mol | ||
표준 엔탈피/ 연소 (δHc⦵298) | - 3267.6 kJ/mol[8] | ||
| 위험 요소 | |||
| 산업안전보건(OHS/OSH): | |||
주요 위험 요소 | 잠재적 직업성 발암 물질, 인화성 물질 | ||
| GHS 라벨링: | |||
     [9] [9] | |||
| 위험. | |||
| H225, H302, H304, H305, H315, H319, H340, H350, H372, H410[9] | |||
| P201, , , , , , | |||
| NFPA 704(파이어 다이아몬드) | |||
| 플래시 포인트 | -11.63 °C (11.07 °F, 261.52 K) | ||
| 497.78°C(928.00°F, 770.93K) | |||
| 폭발 한계 | 1.2–7.8% | ||
| 치사량 또는 농도(LD, LC): | |||
LD50(중간선량) | 80,8 mg/kg (랫드, 경구)[11] | ||
LCLo(최저 공개) | 44,000ppm (표준, 30분) 44,923 장/분 (개) 52,308ppm (고양이) 20,000ppm (인체, 5분)[12] | ||
| NIOSH(미국 건강 노출 제한): | |||
PEL(허용) | TWA 1ppm, ST 5ppm[10] | ||
REL(권장) | Ca TWA 0.1ppm ST 1ppm[10] | ||
IDLH(즉시 위험) | 500ppm[10] | ||
| 안전 데이터 시트(SDS) | HMDB | ||
| 관련 화합물 | |||
관련 화합물 | 톨루엔 보라진 | ||
| 보충 데이터 페이지 | |||
| 벤젠(데이터 페이지) | |||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
벤젠은 분자식이66 CH인 유기 화합물이다.벤젠 분자는 6개의 탄소 원자가 평면 고리에 결합되어 있고 각각에 수소 원자가 하나씩 붙어 있습니다.벤젠은 탄소와 수소 원자만을 포함하고 있기 때문에 [13]탄화수소로 분류된다.
벤젠은 원유의 천연 성분이며 기본적인 석유 화학 물질 중 하나입니다.탄소원자간의 순환연속파이 결합에 의해 벤젠은 방향족 탄화수소로 분류된다.PhH로 줄여서 부르기도 한다.벤젠은 무색하고 인화성이 매우 높은 액체로 달콤한 냄새를 가지고 있으며, 부분적으로 주유소 주변의 향에 영향을 미칩니다.그것은 주로 에틸벤젠과 쿠멘과 같이 더 복잡한 구조의 화학 물질 제조의 전조로 사용되며, 그 중 수십억 킬로그램이 연간 생산된다.벤젠은 주요 공업용 화학물질이지만 [14]독성 때문에 소비재에서 사용이 제한적이다.
역사
검출
벤젠이라는 [15]단어는 16세기부터 동남아시아의 산물로 유럽의 약사와 향료업자들에게 알려진 방향족 수지인 '검벤조인'(벤조인 수지)에서 유래했다.산성 물질은 승화에 의해 벤조인으로부터 파생되었고, "벤조인의 꽃" 또는 벤조산으로 명명되었다.벤조산으로부터 파생된 탄화수소는 벤진, 벤졸 또는 [16]벤젠이라는 이름을 얻었다.마이클 패러데이는 1825년 조명 가스의 생성에서 파생된 기름 잔여물로부터 벤젠을 처음 분리하여 확인하였고,[17][18] 이 벤젠은 수소 중탄화수소라는 이름을 얻었다.1833년, 아일하르트 미첼리치는 벤조산과 라임을 증류하여 그것을 생산했다.그는 그 화합물에 벤진이라는 [19]이름을 붙였다.1836년, 프랑스의 화학자 오귀스트 로랑은 이 물질을 "phene"[20]이라고 명명했다; 이 단어는 영어 단어 "phenol"의 어원이 되었고, 이는 히드록실화된 벤젠과 벤젠으로부터 수소 원자의 추상화에 의해 형성된 라디칼 "phenyl"의 어원이 되었다.


1845년, 어거스트 빌헬름 폰 호프만 밑에서 일하던 찰스 맨스필드는 [21]콜타르로부터 벤젠을 분리했다.4년 후 맨스필드는 콜타르법에 [22][23]기초한 벤젠의 첫 산업 규모 생산을 시작했다.점차적으로, 화학자들 사이에서 많은 물질들이 벤젠과 화학적으로 관련이 있고, 다양한 화학 제품군을 구성한다는 인식이 발달했다.1855년, 호프만은 많은 [24]구성원들의 특징적인 특성 뒤에 이러한 가족 관계를 나타내기 위해 "향기"라는 단어를 사용했다.1997년에는 [25]깊은 우주에서 벤젠이 검출되었다.
링 공식
벤젠의 경험적 공식은 오랫동안 알려져 있었지만, 탄소 원자마다 수소 원자가 하나씩 있는 그것의 높은 다불포화 구조는 결정하기 어려웠다.1858년의 Archibald Scott Couper와 1861년의[32] Johann Josef Loschmidt는 다중 이중 결합 또는 다중 고리를 포함하는 가능한 구조를 제안했지만, 화학자들이 특정 구조를 결정하는 데 도움을 줄 수 있는 증거가 너무 적었다.
1865년, 독일의 화학자 프리드리히 아우구스트 케쿨레는 프랑스어로 된 논문을 발표했는데, 그 당시 그는 벨기에 프랑코폰에서 가르치고 있었기 때문에 이 구조에는 단결합과 이중결합이 번갈아 존재하는 6개의 탄소 원자의 고리가 포함되어 있다는 것을 암시했다.이듬해 그는 같은 주제에 대해 [33][34]훨씬 더 긴 독일어로 논문을 발표했다.케쿨레는 벤젠의 단량체 중 항상 하나의 이성질체만 존재하며, 모든 이치환 유도체의 정확히 세 개의 이성질체(지금은 오르토, 메타 및 파라 치환 패턴에 해당하는 것으로 이해됨)가 항상 있다는 증거를 사용하여 논쟁했다.그가 제안한 [35]구조를 지지하기 위해케쿨레의 대칭 고리는 벤젠의 1:1 탄소-수소 비율뿐만 아니라 이러한 신기한 사실들을 설명할 수 있다.
벤젠과 그에 따른 모든 방향족 화합물에 대한 새로운 이해는 순수 화학과 응용 화학 모두에 매우 중요한 것으로 증명되었고, 1890년 독일 화학 협회는 그의 첫 벤젠 논문의 25주년을 기념하여 케쿨레를 기리는 정교한 감사를 조직했습니다.여기서 케쿨레는 그 이론의 창시자에 대해 이야기했다.그는 뱀이 자신의 꼬리를 잡는 몽상이나 꿈을 꾸고 벤젠 [36]분자의 고리 모양을 발견했다고 말했다.그는 이 비전이 탄소-탄소 결합의 성질을 수년간 연구한 끝에 그에게 나타났다고 말했다.이것은 그가 탄소 원자가 최대 4개의 다른 원자와 동시에 결합할 수 있는 문제를 해결한 지 7년 후였다.흥미롭게도 벤젠에 대한 유사하고 유머러스한 묘사가 1886년 베리히테 데 뒤르스티겐 케미셴 게셀샤프트라는 제목의 팜플렛에 등장했는데, 베리히테 데 도이첸 케미셴 게셀샤프트를 패러디한 것은 키울케의 일화가 아니라 원 안에서 서로 잡아채는 원숭이들뿐이었다.몇몇 [37]역사학자들은 그 패러디가 뱀의 일화를 풍자한 것이라고 주장했고,[16] 비록 아직 인쇄되지 않았더라도 아마도 구두 전달을 통해 이미 잘 알려져 있을 것이다.이 일화가 등장한 케쿨레의 1890년[38] 연설은 영어로 [39]번역됐다.만약 그 일화가 실제 사건의 기억이라면, 그 이야기에서 언급된 상황들은 그것이 [40]1862년 초에 일어났을 것이라는 것을 암시한다.
1929년, 결정학자 캐슬린 론즈데일에 의해 X선 [41][42]회절법을 사용하여 벤젠의 순환 특성이 마침내 확인되었다.론스데일은 6개의 탄소 원자의 동일한 핵심을 가진 벤젠 유도체인 헥사메틸벤젠의 큰 결정을 사용하여 회절 패턴을 얻었다.론즈데일은 30개 이상의 매개변수를 계산함으로써 벤젠 고리가 평평한 육각형일 수 없다는 것을 증명했고 [43]분자 내의 모든 탄소-탄소 결합에 정확한 거리를 제공했습니다.
명명법
독일 화학자 빌헬름 쾨르너는 1867년에 디 치환된 벤젠 유도체를 구별하기 위해 접두사 Ortho, meta, para-를 제안했다. 그러나 그는 벤젠 고리 위의 [44][45]치환기의 상대적 위치를 구별하기 위해 접두사를 사용하지 않았다.1869년에 치환된 방향족 고리(viz, 나프탈렌)[46]에서 치환기의 특정 상대적 위치를 나타내기 위해 접두어 ortho, meta, para-를 처음 사용한 사람은 독일의 화학자 Karl Grébe였다.1870년, 독일의 화학자 빅토르 마이어는 처음으로 [47]벤젠에 Grébe의 명명법을 적용했다.
초기 응용 프로그램
19세기와 20세기 초에 벤젠은 향긋한 냄새 때문에 애프터 쉐이브 로션으로 사용되었다.1920년대 이전에는 벤젠이 산업용 용매, 특히 금속의 그리스를 제거하는 데 자주 사용되었습니다.벤젠의 독성이 명백해짐에 따라 벤젠은 다른 용제, 특히 유사한 물리적 특성을 가지지만 발암성이 없는 톨루엔(메틸벤젠)으로 대체되었다.
1903년, 루드비히 로즐리우스는 커피를 탈카페인하기 위해 벤젠을 사용하는 것을 대중화했다.이 발견은 산카의 생산으로 이어졌다.이 과정은 나중에 중단되었다.벤젠은 역사적으로 리퀴드 렌치, 여러 페인트 스트리퍼, 고무 시멘트, 스폿 리무버 및 기타 제품과 같은 많은 소비자 제품에서 중요한 성분으로 사용되었습니다.리퀴드 렌치는 1970년대 [48]후반까지 상당한 양의 벤젠을 계속 함유하고 있었지만 벤젠 함유 제제의 제조는 1950년경에 중단되었다.
발생.
미량의 벤젠은 석유와 석탄에서 발견됩니다.그것은 많은 물질의 불완전 연소의 부산물이다.상업적으로 사용하기 위해, 제2차 세계 대전까지 대부분의 벤젠은 철강 산업을 위한 코크스 생산(또는 "코크 오븐 경질유")의 부산물로 획득되었습니다.그러나 1950년대에 특히 성장하는 폴리머 산업의 벤젠에 대한 수요 증가는 석유로부터 벤젠을 생산해야 했다.오늘날, 대부분의 벤젠은 석유화학 산업에서 생산되며,[49] 석탄에서 생산되는 것은 극히 일부분에 불과하다.벤젠 분자가 [50][51][52]화성에서 발견되었다.
구조.
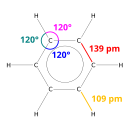
X선 회절은 벤젠의 탄소-탄소 결합 6개 모두가 길이가 140피코미터([53]pm)로 동일함을 보여줍니다.C-C 결합 길이는 이중 결합(135pm)보다 크지만 단일 결합(147pm)보다 짧습니다.이 중간 거리는 전자 비국재화에 의해 발생합니다. 즉, C=C 결합을 위한 전자는 6개의 탄소 원자 사이에 균등하게 분포됩니다.벤젠은 6개의 수소 원자를 가지고 있는데, 이는 14개의 알칸을 가진 모체인 헥산보다 적은 수치입니다.벤젠과 시클로헥산은 유사한 구조를 가지고 있는데, 단지 탈국재 전자의 고리와 탄소당 1개의 수소의 손실만이 시클로헥산과 구별됩니다.분자는 [54]평면이다.분자 궤도 기술은 6개의 탄소 원자 모두에 걸친 3개의 비국재화 δ 궤도의 형성을 수반하는 반면, 원자가 결합 기술은 공명 [55][56][57][58]구조의 중첩을 수반한다.이러한 안정성은 방향족으로 알려진 독특한 분자 및 화학적 특성에 기여할 수 있습니다.결합의 성질을 정확하게 반영하기 위해, 벤젠은 탄소 원자의 육각형 배열 안에 원으로 종종 묘사됩니다.
벤젠의 유도체는 유기 분자의 성분으로 충분히 자주 발생하므로 유니코드 컨소시엄은 Miscellaneous Technical Block에 코드 U+232C())와 코드 U+23E3())를 할당하여 3개의 이중 [59]결합으로 표현하고 비국재화 버전은 [60]U+23E3())로 표현하였다.
벤젠 유도체
많은 중요한 화학성분들은 벤젠의 수소 원자 중 하나 이상을 다른 작용기로 대체함으로써 벤젠으로부터 얻어진다.단순 벤젠 유도체의 예로는 페놀, 톨루엔, 아닐린(약칭 PhOH, PhMe, PhNH2)이 있다.벤젠 고리를 연결하면 비페닐, CH65–CH가65 생성됩니다.수소의 추가 손실은 나프탈렌, 안트라센, 페넌트렌 및 피렌과 같은 "융착된" 방향족 탄화수소를 생성합니다.핵융합 과정의 한계는 수소가 없는 탄소 동위원소인 흑연이다.
헤테로사이클에서는 벤젠고리 내의 탄소원자가 다른 원소로 치환된다.가장 중요한 변종에는 질소가 포함되어 있습니다.1개의 CH를 N으로 치환하면 화합물인 피리딘, CHN이55 생성됩니다.벤젠과 피리딘은 구조적으로 관련이 있지만 벤젠은 피리딘으로 바뀔 수 없다.두 번째 CH 결합을 N으로 치환하면 두 번째 N의 위치에 따라 피리다진,[61] 피리미딘 또는 피라진이 생긴다.
생산.
네 가지 화학 과정이 산업용 벤젠 생산에 기여합니다: 촉매 개질, 톨루엔 수소 탈알킬화, 톨루엔 불균형, 증기 균열.벤젠에 대한 ATSDR 독성 프로파일에 따르면 1978년부터 1981년 사이에 촉매 개질제는 미국 전체 벤젠 [49]생산량의 약 44~50%를 차지했습니다.
촉매 개질
촉매 개질에서는 끓는점이 60~200°C인 탄화수소의 혼합물을 수소 가스와 혼합한 후 500~525°C에서 2관능성 염화 백금 또는 염화 레늄 촉매에 노출하고 압력은 8~50atm이다.이러한 조건에서 지방족 탄화수소는 고리를 형성하고 수소를 손실하여 방향족 탄화수소가 됩니다.그리고 나서 반응의 방향족 생성물은 디에틸렌 글리콜 또는 술폴란을 포함한 많은 용제 중 하나를 추출하여 반응 혼합물로부터 분리되고(또는 리폼산염), 벤젠은 증류에 의해 다른 방향족으로부터 분리된다.리폼ate에서 방향족 추출 단계는 가장 낮은 비방향성 성분으로 방향족을 생산하도록 설계되었다.일반적으로 BTX(벤젠, 톨루엔 및 자일렌 이성질체)라고 불리는 방향족 회수에는 이러한 추출 및 증류 단계가 포함됩니다.
UOP와 BP는 이 촉매 개질과 유사한 방식으로 LPG(주로 프로판 및 부탄)에서 방향족에 이르는 방법을 상용화했습니다.
톨루엔 하이드로데알킬화
톨루엔 하이드로데알킬화는 톨루엔을 벤젠으로 변환한다.이 수소 집약적 공정에서 톨루엔은 수소와 혼합된 후 500~650°C 및 20~60atm 압력으로 크롬, 몰리브덴 또는 백금 산화물 촉매 위를 통과합니다.촉매 대신 더 높은 온도가 사용되는 경우가 있습니다(동일한 반응 조건에서).이러한 조건에서 톨루엔은 벤젠과 메탄으로 탈알킬화된다.
이 불가역적 반응은 더 높은 온도에서 비페닐(일명 디페닐)을 생성하는 평형 측면 반응을 동반합니다.
- 2
6
6 CH † H
2 + CH
6
5 -C
6H
5
원료 스트림에 비방향성 성분(파라핀 또는 나프텐)이 많이 포함되어 있으면 메탄과 같은 낮은 탄화수소로 분해되어 수소 소비가 증가할 수 있습니다.
일반적인 반응 수율은 95%를 초과합니다.톨루엔 대신 자일렌과 무거운 방향제를 사용하기도 하는데, 그 효율이 비슷합니다.
이것은 종종 벤젠을 생산하기 위한 "의도적" 방법론이라고 불리는데, 이는 기존의 BTX(벤젠 톨루엔 자일렌) 추출 과정과 비교된다.
톨루엔 불균형
톨루엔 불균형(TDP)은 톨루엔을 벤젠과 자일렌으로 변환하는 것이다.
파라자일렌(p-xylene)의 수요가 다른 자일렌 이성질체의 수요를 크게 초과한다는 점을 감안하여 선택적 TDP(STDP)라고 하는 TDP 공정의 정제법을 사용할 수 있다.이 과정에서 TDP 장치에서 나오는 자일렌 스트림은 약 90% p-자일렌입니다.일부 시스템에서는 벤젠 대 자일렌비도 자일렌에 유리하도록 수정된다.
증기 균열
증기 균열은 지방족 탄화수소로부터 에틸렌과 다른 알켄을 생산하는 과정이다.올레핀을 생산하는 데 사용되는 공급 원재료에 따라, 증기 균열은 열분해 가솔린이라고 불리는 벤젠이 풍부한 액체 부산물을 생산할 수 있습니다.열분해 휘발유는 가솔린 첨가물로 다른 탄화수소와 혼합하거나 추출 과정을 통해 BTX 방향족(벤젠, 톨루엔 및 자일렌)을 회수할 수 있습니다.
기타 방법
상업적인 의미는 없지만 벤젠으로 가는 다른 경로가 많이 존재합니다.페놀과 할로벤젠은 금속으로 환원할 수 있다.벤조산과 그 소금들은 벤젠으로 탈탄산화된다.아닐린에서 유래한 디아조늄 화합물과 하이포인산의 반응은 벤젠을 생성한다.아세틸렌의 알킨 삼량화는 벤젠을 생성한다.
사용하다
벤젠은 다른 화학 물질, 특히 에틸벤젠(및 다른 알킬벤젠), 쿠멘, 시클로헥산, 니트로벤젠을 만드는 중간체로 주로 사용됩니다.1988년 미국화학회 목록에 있는 모든 화학물질의 3분의 2가 적어도 하나의 벤젠 [62]고리를 포함하고 있다고 보고되었다.전체 벤젠 생산의 절반 이상이 폴리스티렌과 같은 폴리머와 플라스틱을 만드는 데 사용되는 스티렌의 전구체인 에틸벤젠으로 가공됩니다.벤젠 생산량의 약 20%는 쿠멘 생산에 사용되며, 이는 레진 및 접착제용 페놀 및 아세톤을 생산하는 데 필요합니다.시클로헥산은 전 세계 벤젠 생산량의 약 10%를 소비합니다. 주로 나일론 섬유의 제조에 사용되며 섬유 및 엔지니어링 플라스틱으로 가공됩니다.소량의 벤젠은 고무, 윤활유, 염료, 세제, 약품, 폭발물, 살충제를 만드는데 사용된다.2013년 벤젠의 최대 소비국은 중국, 그 다음은 미국이며, 현재 중동과 아프리카에서는 벤젠 생산이 확대되고 있는 반면 서유럽과 북미에서는 생산능력이 [63]정체되어 있다.
톨루엔은 현재 벤젠의 대체재로, 예를 들어 연료 첨가물로 자주 사용되고 있습니다.두 가지 용제의 특성은 비슷하지만 톨루엔은 독성이 적고 액체 범위가 넓다.톨루엔은 [64]벤젠으로도 가공된다.
가솔린 성분
가솔린(가솔린) 첨가제로서 벤젠은 옥탄 정격을 높이고 노킹을 줄입니다.그 결과, 1950년대 이전에 휘발유는 종종 몇 퍼센트의 벤젠을 함유하고 있었는데, 이때 테트라에틸 납은 가장 널리 사용되는 안티녹 첨가물로 대체되었다.세계적으로 납 휘발유의 단계적 폐지로 벤젠은 일부 국가에서 가솔린 첨가제로 부활했다.미국에서는 건강에 미치는 악영향과 벤젠의 지하수 유입 가능성에 대한 우려로 인해 휘발유 벤젠 함량을 엄격하게 규제하고 있으며, 일반적으로 [65]약 1%의 제한을 두고 있습니다.유럽의 휘발유 사양은 현재 벤젠 함량에 대해 1%의 동일한 제한을 포함하고 있습니다.미국 환경보호국은 2011년 휘발유 중 벤젠 함량을 0.62%[66]로 낮춘 새로운 규정을 도입했다.많은 유럽 언어에서 석유 또는 휘발유를 뜻하는 단어는 "벤젠"[citation needed]의 정확한 어원을 가지고 있습니다.
반응
벤젠의 가장 일반적인 반응은 다른 [67]그룹에 의한 양성자의 치환을 포함한다.친전자성 방향족 치환은 벤젠을 유도하는 일반적인 방법이다.벤젠은 충분히 친핵성이 있어 아실륨 이온과 알킬 카보시온에 의해 치환되어 치환된 유도체를 얻을 수 있다.
이 반응의 가장 널리 알려진 예는 벤젠의 에틸화이다.
1999년에는 [68]약 2,470,000톤이 생산되었다.매우 유익하지만 산업적으로 훨씬 덜 중요한 것은 강력한 루이스 산 촉매가 존재하는 상태에서 알킬 할로겐을 사용하는 벤젠(및 많은 다른 방향족 고리)의 프리델-크래프트 알킬화입니다.마찬가지로 Friedel-Crafts 아실화는 친전자성 방향족 치환의 관련 예이다.반응에는 염화알루미늄 또는 염화철(III)과 같은 강력한 루이스산 촉매를 사용하여 벤젠(또는 다른 많은 방향족 고리)을 아실 염화물로 아실화하는 과정이 포함됩니다.
술폰화, 염소화, 질화
친전자성 방향족 치환을 사용하여 벤젠 프레임워크에 많은 관능기가 도입됩니다.벤젠의 술폰화는 황산과 삼산화황의 혼합물인 오륨을 사용하는 것을 포함한다.술폰화 벤젠 유도체는 유용한 세제이다.질화에서 벤젠은 황산과 질산을 결합하여 생성되는 강한 전자 친일인 니트로늄 이온(NO2+)과 반응합니다.니트로벤젠은 아닐린의 전구체이다.염소로 염소화하면 삼염화알루미늄과 같은 루이스산 촉매의 존재 하에서 클로로벤젠을 얻을 수 있다.
수소화
수소화를 통해 벤젠과 그 유도체는 시클로헥산과 유도체로 변환됩니다.이 반응은 미세하게 분할된 니켈과 같은 이종 촉매가 존재하는 상태에서 수소의 고압을 사용함으로써 달성됩니다.알켄은 실온 부근에서 수소화할 수 있는 반면 벤젠 및 관련 화합물은 100°C 이상의 온도를 필요로 하는 보다 꺼림칙한 기질이다.이 반응은 산업적으로 대규모로 행해지고 있다.촉매가 없을 때 벤젠은 수소에 침투하지 않는다.시클로헥센이나 시클로헥사디엔은 우수한 기질이기 때문에 수소화를 멈출 수 없다.그러나 비촉매 과정인 버치 환원은 벤젠을 선택적으로 디엔으로 수소화한다.
금속 착화체
벤젠은 저가의 금속 유기 금속 화학에서 뛰어난 배위자이다.중요한 예로는 각각 Cr(CH66)2와 [RuCl2(CH66)]2가 있습니다.
건강에 미치는 영향
벤젠은 발암물질로 분류돼 암 등 질병의 위험을 높이며 골수 기능 부전의 악명 높은 원인이기도 하다.상당한 양의 역학, 임상 및 실험실 데이터는 벤젠을 재생불량성 빈혈, 급성 백혈병, 골수 이상 및 심혈관 [69][70][71]질환과 연결시킨다.벤젠과 관련된 특정 혈액학적 악성 종양은 급성 골수성 백혈병(AML), 재생불량성 빈혈, 골수성 증후군(MDS), 급성 림프구성 백혈병(ALL), 만성 골수성 백혈병(CML)[72]이다.
1948년 미국석유협회(API)는 "일반적으로 벤젠의 가장 안전한 농도는 [73]0으로 여겨진다"고 밝혔다.안전한 노출 수준은 없습니다. 아주 적은 양이라도 [74]해를 끼칠 수 있습니다.미국 보건복지부(DHHS)는 벤젠을 인간 발암물질로 분류하고 있다.공기 중 벤젠의 과도한 수치에 장기간 노출되면 백혈병이 발생하는데, 백혈병은 잠재적으로 치명적인 혈액 형성 기관의 암이다.특히 급성 골수성 백혈병 또는 급성 비림프구성 백혈병(AML & ANLL)은 [75]벤젠에 의해 발생한다.IARC는 벤젠을 "인간에 발암성이 있는 것으로 알려져 있다"(그룹 1)고 평가했다.
벤젠은 어디에서나 사용되고 있는 가솔린과 탄화수소 연료에 흔하기 때문에 벤젠에 대한 인간의 노출은 세계적인 건강 문제이다.벤젠은 간, 신장, 폐, 심장, 뇌를 표적으로 하며 DNA 가닥이 끊어지고 염색체 손상을 일으킬 수 있다.벤젠은 인간을 포함한 동물에게 암을 유발한다.벤젠은 다양한 [76][77]경로를 통해 노출되는 여러 종류의 실험동물의 양성 모두에서 암을 유발하는 것으로 나타났다.
벤젠 피폭
독성 물질 및 질병 등록 기관 (ATSDR) (2007)에 따르면, 벤젠은 화산 폭발, 산불, 페놀과 같은 화학 물질의 합성, 합성 섬유의 생산, 그리고 고무, 윤활제, 살충제, 의약품의 제조를 포함한 공정에서 합성되고 자연적으로 발생하는 화학 물질이다.nd 염료벤젠 노출의 주요 원천은 담배 연기, 자동차 정비소, 자동차 배기가스, 산업용 배기가스입니다. 그러나 벤젠의 섭취와 피부 흡수는 오염된 물과 접촉함으로써 발생할 수도 있습니다.벤젠은 간에서 대사되어 소변으로 배출된다.벤젠의 공기 및 수위 측정은 활성탄 튜브를 통해 수집되며, 이 튜브는 가스 크로마토그래프로 분석됩니다.인간의 벤젠 측정은 소변, 혈액, 그리고 호흡 검사를 통해 이루어질 수 있다; 그러나 벤젠은 [78]인체에서 빠르게 대사되기 때문에 이 모든 것들은 한계를 가지고 있다.
벤젠에 노출되면 재생불량성 빈혈, 백혈병, 다발성 골수종에 점진적으로 [79]걸릴 수 있다.
OSHA는 직장 [80]내 벤젠 수치를 조절한다.주 8시간 근무, 주 40시간 근무 중 작업실 공기 중 벤젠의 최대 허용량은 1ppm입니다.NIOSH는 벤젠이 암을 유발할 수 있기 때문에 권장 노출 한계치인 [81]0.1ppm을 초과하여 벤젠에 노출될 가능성이 있는 경우 모든 근로자가 특수 호흡 장비를 착용할 것을 권고한다.
벤젠 노출 한계
미국 환경 보호국은 미국 국립 1차 식수 [82]규정을 통해 공표된 음용수 벤젠의 최대 오염 물질 수준(MCL)을 0.005mg/L(5ppb)로 설정했습니다.이 규제는 벤젠 백혈병 발생을 예방하는 것에 기초하고 있다.부작용 예방을 위한 적절한 안전 여유를 허용하는 강제할 수 없는 건강 목표인 최대 오염 물질 수준 목표(MCLG)는 먹는 물에 벤젠 농도가 0인 것입니다.EPA는 10파운드(4.5kg) 이상의 벤젠을 환경에 흘리거나 실수로 방출하는 것을 보고하도록 요구하고 있습니다.
미국 산업안전보건국(OSHA)은 하루 8시간 근무, 주 40시간 근무 중 작업장 내 공기 중 100만분의 1(1ppm)당 벤젠의 허용 피폭 한도를 설정했다.공기 중 벤젠의 단기 노출 한도는 15분 [83]동안 5ppm입니다.이러한 법적 제한은 벤젠에 노출된 근로자들의 건강 위험에 대한 설득력 있는 증거를 보여주는 연구에 기초했다.작업 수명 동안 1ppm 노출로 인한 위험은 노출된 직원 1,000명당 5명의 초과 백혈병 사망으로 추정되었다.(이 추정치는 벤젠의 발암 효과에 대한 임계값이 없다고 가정합니다.)OSHA는 또한 직장에서 [84]더 낮은 피폭을 장려하기 위해 0.5ppm의 작용 수준을 설정했다.
미국 국립산업안전보건연구소(NIOSH)는 벤젠 농도의 즉시위험치(IDLH)를 500ppm으로 수정했다.IDLH 조건에 대한 현재 NIOSH 정의는, NIOSH 호흡기 선택 논리에서 주어진 바와 같이, 노출이 사망이나 즉각적 또는 지연된 영구적 건강상의 악영향을 야기하거나 그러한 환경으로부터의 탈출을 막을 가능성이 있을 때 공기 중 오염물질에 노출될 위험을 제기하는 것이다[NIOSH 2004].한 IDLH 가치를 구성하는 목적은(1)은 그 근로자 지정된 오염된 환경에서 호흡 보호 장비의 실패와(2)의 행사에 탈출할 수 있는 최대 수준을 상부만 높은 신뢰성의 호흡 장치 최대 근로자 보호를 제공하는 것으로 간주된다[NIOSH2004년 85-LSB-]해결을 허용된다 보장하는 것이다.[86]1995년 9월 NIOSH는 발암물질을 포함한 물질에 대한 권장노출한계(RELs) 개발을 위한 새로운 정책을 발표했다.NIOSH는 벤젠이 암을 유발할 수 있기 때문에 모든 근로자가 REL(10시간)[87]을 초과하는 벤젠에 노출될 가능성이 있을 때 특수 호흡기를 착용할 것을 권고하고 있다.NIOSH 단기 노출 한계(STEL – 15분)는 1ppm이다.
미국정부산업위생사회의(ACGIH)는 벤젠의 임계값 한계치(TLV)를 0.5ppm TWA와 2.5ppm STEL로 채택했다.
독물학
노출의 바이오마커
벤젠에 대한 노출은 몇 가지 테스트를 통해 확인할 수 있습니다.벤젠 자체는 호흡, 혈액 또는 소변으로 측정될 수 있지만, 그러한 테스트는 보통 노출 후 첫 24시간으로 제한됩니다. 이는 호흡이나 생체변환에 의해 상대적으로 빠르게 화학물질을 제거하기 때문입니다.선진국의 대부분의 사람들은 그들의 혈액 속에 벤젠과 다른 방향족 석유 탄화수소의 측정 가능한 기준 수치를 가지고 있다.벤젠을 무콘산, 페닐메르캅투르산, 페놀, 카테콜, 하이드로퀴논 및 1,2,4-트리히드록시벤젠을 포함한 일련의 산화물로 효소적으로 변환한다.이러한 대사물의 대부분은 노출의 범위와 기간에 비례하여 소변에 축적되고 노출이 중단된 후에도 며칠 동안 계속 존재할 수 있기 때문에 인체 노출의 바이오마커로서 어느 정도 가치가 있다.업무상 피폭에 대한 현재 ACGIH 생물학적 피폭 한계는 무콘산의 경우 500μg/g 크레아티닌, 페닐메르캅투르산의 경우 25μg/g 크레아티닌이다.[88][89][90][91]
생물 변환
벤젠은 일반적인 대사 기질이 아니더라도 세균과 진핵생물 양쪽에 의해 산화될 수 있다.세균 중 디옥시게나아제 효소는 고리에 산소를 첨가할 수 있으며 불안정한 생성물은 즉시 2개의 이중결합을 가진 고리형 디올로 환원되어 방향성을 파괴한다.다음으로 디올은 NADH에 의해 카테콜로 새롭게 환원된다.카테콜은 아세틸 CoA와 숙시닐 CoA로 대사되며, 이는 에너지 생산을 위해 주로 구연산 회로에 있는 유기체에 의해 사용된다.
벤젠의 대사 경로는 복잡하고 간에서 시작됩니다.몇 가지 효소가 관련되어 있다.시토크롬 P450 2E1(CYP2E1), 키닌산화환원효소(NQ01 또는 DT-디아포라아제 또는 NAD(P)H탈수소효소(퀴논1), GSH 및 미엘로페르옥시다아제(MPO)를 포함한다.CYP2E1은 벤젠을 옥세핀(산화벤젠), 페놀을 하이드로퀴논으로, 하이드로퀴논을 벤제네트리올과 카테콜로 변환하는 여러 단계에 관여합니다.하이드로퀴논, 벤제네트리올 및 카테콜은 폴리페놀로 변환된다.골수에서 MPO는 이러한 폴리페놀을 벤조퀴논으로 변환합니다.이러한 중간체 및 대사물은 토포이소머라아제 II의 억제(염색체 구조를 유지), 미세관 파괴(세포 구조와 조직을 유지), 점 돌연변이로 이어질 수 있는 산소 없는 라디칼(불안정종)의 생성, 산화물 증가를 포함한 여러 메커니즘에 의해 유전독성을 유도한다.ve 스트레스, DNA 가닥 파괴 유도, DNA 메틸화 변화(유전자 발현에 영향을 미칠 수 있음)NQ01과 GSH는 신진대사를 독성으로부터 멀어지게 합니다.NQ01은 벤조퀴논을 폴리페놀로 대사한다(MPO의 효과에 대항한다).GSH는 페닐메르캅투르산의 [72][92]형성에 관여한다.
이러한 효소의 유전적 다형성은 기능 상실 또는 기능 향상을 유도할 수 있다.예를 들어, CYP2E1의 돌연변이는 활성을 증가시키고 독성 대사물의 생성을 증가시킨다.NQ01 돌연변이는 기능 상실을 초래하고 해독을 감소시킬 수 있습니다.미엘로페르옥시다아제 돌연변이는 기능 상실을 초래하고 독성 대사물의 생성을 감소시킬 수 있다.GSH 돌연변이 또는 결실은 기능 상실을 초래하고 해독을 감소시킵니다.이들 유전자는 벤젠 [93]독성에 대한 유전자 검사의 표적이 될 수 있다.
분자독물학
벤젠의 독성학적 평가 패러다임은 근본적인 생물학적 메커니즘을 더 잘 이해할 수 있게 해주기 때문에 분자독성학 분야로 옮겨가고 있다.글루타치온은 벤젠에 의해 유발되는 DNA 파괴로부터 보호함으로써 중요한 역할을 하는 것으로 보이며 노출과 효과를 [94]위한 새로운 바이오마커로 확인되고 있다.벤젠은 말초혈액 백혈구와 골수에 염색체 이상을 일으켜 만성노출로 인한 백혈병과 다발성 골수종의 높은 발병률을 설명한다.이러한 이상현상은 DNA 프로브와 함께 형광성 현장 교배(FISH)를 사용하여 혈독성 [95]표지자로서의 혈액학적 테스트와 함께 벤젠의 영향을 평가할 수 있습니다.벤젠 대사는 다형성 유전자에 의해 코드화된 효소를 포함한다.연구결과에 따르면 이 장소의 유전자형은 벤젠 노출의 독성 효과에 영향을 미칠 수 있다.NAD(P)H:퀴논산화환원효소 1(NQO1), 마이크로솜에폭시드 가수분해효소(EPHX) 및 글루타티온S-전달효소 T1(GST1)의 결실을 가진 개인은 DNA 단일가닥 [96]파괴의 빈도가 높았다.
생물학적 산화 및 발암 활성
벤젠의 발암 효과를 이해하는 한 가지 방법은 생물학적 산화 생성물을 조사하는 것입니다.예를 들어, 순수한 벤젠은 에폭시드, 벤젠 산화물을 만들기 위해 체내에서 산화되는데, 이것은 쉽게 배설되지 않고 해로운 돌연변이를 만들기 위해 DNA와 상호작용할 수 있다.
노출 경로
흡입
실외 공기에는 자동차 정비소에서 나오는 낮은 수준의 벤젠, 목재 연기, 담배 연기, 휘발유의 이동, 자동차 배기가스 및 산업용 [97]배기가스가 포함될 수 있습니다.전국적으로 벤젠에 노출되는 약 50%는 흡연 또는 담배 [98]연기에 노출됩니다.하루에 32개비를 피운 후, 흡연자는 약 1.8밀리그램의 벤젠을 섭취하게 된다.이 양은 비흡연자들의 [99]하루 평균 벤젠 섭취량의 약 10배이다.
흡입된 벤젠은 주로 내쉬기를 통해 변경되지 않고 배출됩니다.인간 연구에서 보유 벤젠의 16.4~41.6%는 47~110ppm에 2~3시간 노출한 후 5~7시간 이내에 폐를 통해 제거되었으며, 나머지 벤젠의 0.07~0.2%만 소변에 변함이 없이 배설되었다.벤젠 63~405mg/m에3 1~5시간 피폭 후 23~50시간에 걸쳐 51~87%가 페놀로 소변에 배설되었다.또 다른 인체 연구에서는 간에서 주로 대사되는 흡수된 피부 도포 벤젠의 30%가 [100]소변에서 페놀로 배설되었다.
청량음료 노출
특정 조건 및 다른 화학 물질의 존재 하에서 벤조산(방부제)과 아스코르브산(비타민 C)이 상호작용하여 벤젠을 생성할 수 있습니다.2006년 3월, 영국의 식품표준청은 150개의 청량음료 브랜드를 대상으로 조사를 실시했습니다.그것은 4개의 벤젠 수치가 세계보건기구(WHO)의 한계치를 초과한다는 것을 발견했다.해당 묶음은 판매에서 제외되었다.비슷한 문제들이 미국에서 [101]FDA에 의해 보고되었다.
상수도 오염
2005년, 거의 9백만 명의 인구가 살고 있는 중국 하얼빈 시의 수도 공급이 벤젠 노출로 [102]인해 중단되었다.벤젠은 2005년 11월 13일 지린(吉林)시에 있는 중국석유공사(CNPC) 공장에서 폭발이 일어난 후 쑹화강으로 유출되었다.
플라스틱 수도관이 높은 열에 노출되면 물이 [103]벤젠에 오염될 수 있습니다.
대량 학살
나치는 많은 [104][105]살상 방법 중 하나로 주사에 의해 투여된 벤젠을 사용했다.
「 」를 참조해 주세요.
- BTEX
- 산업연합부 대 미국석유협회 사건
- 하나의 탄소가 다른 원소로 치환된 6원 방향족 고리: 보라벤젠, 실라벤젠, 게르마벤젠, 스타나벤젠, 피리딘, 인광체, 아르사벤젠, 비스마벤젠, 피릴륨, 티오피릴륨, 셀레노피릴륨, 텔루프로필륨
설명 메모
- ^ 비평가들은 케쿨레의 벤젠 원래(1865년) 구조에 문제가 있다고 지적했다.벤젠이 Ortho 위치에서 치환될 때마다 치환기가 부착된 탄소 원자 사이에 이중 결합 또는 단일 결합이 존재하는지 여부에 따라 구별 가능한 두 이성체가 생성되어야 했지만, 그러한 이성체는 관찰되지 않았다.1872년, 케쿨레는 벤젠이 두 개의 상보적인 구조를 가지고 있고 이것들이 빠르게 상호 변환되어 만약 한 순간에 탄소 원자 쌍 사이에 이중 결합이 있다면, 그 이중 결합은 다음 순간에 단일 결합이 될 것이라고 제안했다.변환 과정을 위한 메커니즘을 제공하기 위해, Kekulé는 원자의 원자가가 분자 내의 이웃들과 충돌하는 빈도에 의해 결정된다고 제안했다.벤젠 고리의 탄소 원자가 서로 충돌하면서, 각 탄소 원자는 주어진 간격 동안 한 이웃과 두 번 충돌하고 다음 간격 동안 다른 이웃과 두 번 충돌합니다.따라서 첫 번째 인터벌에서는 한쪽 네이버와 다음 인터벌에서는 다른 쪽 네이버와 더블본드가 존재합니다.따라서 벤젠의 탄소 원자 사이에는 고정된 (즉, 일정)과 구별되는 단일 또는 이중 결합이 없었다. 대신, 탄소 원자 사이의 결합은 동일했다.86-89페이지 오귀스트 케쿨레(1872)의 웨이백 머신에서 보관된 2020-03-20 "알데히드의 일부 응축 제품에 대하여" (알데히드의 일부 응축 제품에 대하여), Liebig의 Annalen der Chemie und Pharmacie, 162-12–320 77.4를 참조하십시오.89페이지부터 : "Das einfachste Mittel aller Stöeeines Kohlenstoffatoms ergiebt sich der Sume der Stöee der beiden ersten Zeitinheiten, die sich dan permischederholen perisch. ... man sieth daher, da'jedes Kohlenstoffatom mit den beiden anderen, … da'e diese Verschiedenheit nur eine sheinbare, aber keine wirkliche ist." (벤젠 내 탄소 원자의 충돌의 최초 두 단위 중 가장 단순한 평균은 그 후 반복됩니다.)따라서 각 탄소 원자는 충돌하는 두 개의 다른 원자와 동등하게 자주 충돌하므로 두 개의 이웃 원자와 정확히 같은 관계에 있습니다.벤젠의 일반적인 구조식은 물론 한 시간 단위, 즉 한 단계 동안 발생하는 충돌만 표현하므로, [벤젠의] 이중 치환 유도체는 [벤젠 고리의] 위치 1,2와 1,6에서 달라야 한다는 견해가 대두됩니다.방금 제시된 아이디어(또는 유사한 아이디어)가 올바른 것으로 간주될 수 있다면, 그 결과 [위치 1,2 및 1,6에 있는 결합 사이의] 차이는 실제 [1]이 아니라 명백한 [1]에 불과하다는 것을 알 수 있다.
레퍼런스
- ^ a b Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. pp. 10, 22, 204, 494, 577. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Arnold, D.; Plank, C.; Erickson, E.; Pike, F. (1958). "Solubility of Benzene in Water". Industrial & Engineering Chemistry Chemical & Engineering Data Series. 3 (2): 253–256. doi:10.1021/i460004a016.
- ^ Breslow, R.; Guo, T. (1990). "Surface tension measurements show that chaotropic salting-in denaturants are not just water-structure breakers". Proceedings of the National Academy of Sciences of the United States of America. 87 (1): 167–9. Bibcode:1990PNAS...87..167B. doi:10.1073/pnas.87.1.167. PMC 53221. PMID 2153285.
- ^ Coker, A. Kayode; Ludwig, Ernest E. (2007). Ludwig's Applied Process Design for Chemical And Petrochemical Plants. Vol. 1. Elsevier. p. 114. ISBN 978-0-7506-7766-0. Archived from the original on 2016-03-12. Retrieved 2012-05-31.
- ^ a b c d e "Benzol". Archived from the original on 2014-05-29. Retrieved 2014-05-29.
- ^ a b Atherton Seidell; William F. Linke (1952). Solubilities of Inorganic and Organic Compounds: A Compilation of Solubility Data from the Periodical Literature. Supplement. Van Nostrand. Archived from the original on 2020-03-11. Retrieved 2015-06-27.
- ^ a b c Linstrom의 Benzen, Peter J.; Mallard, William G. (ed.); NIST 화학 WebBook, NIST 표준 참조 데이터베이스 번호 69, 국립 표준 기술 연구소, Gaithersburg(MD), http://webbook.nist.gov (2014-05-29)
- ^ a b c Sigma-Aldrich Co., Benzen 2016-12-01 Wayback Machine에 보관.2014년 5월 29일 취득.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. "#0049". National Institute for Occupational Safety and Health (NIOSH).
- ^ 벤젠, 독성
- ^ "Benzene". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ "Benzene - an overview ScienceDirect Topics". www.sciencedirect.com. Archived from the original on 2021-02-08. Retrieved 2020-11-25.
- ^ Folkins, Hillis O. (2000). "Benzene". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a03_475.
- ^ "벤조인"이라는 단어는 아랍어 표현인 "루반 자위" 또는 "자바의 프랑킨센스"에서 유래했습니다.Morris, Edwin T. (1984). Fragrance: The Story of Perfume from Cleopatra to Chanel. Charles Scribner's Sons. p. 101. ISBN 978-0684181950.
- ^ a b Rocke, A. J. (1985). "Hypothesis and Experiment in the Early Development of Kekule's Benzene Theory". Annals of Science. 42 (4): 355–81. doi:10.1080/00033798500200411.
- ^ 패러데이, M.(1825년)."탄소와 수소의 새로운 혼합물, 그리고 정확한 다른 제품에 석유의 분해 과정 동안 열에 의해 입수".왕립 협회의 철학적 거래. 115:440–466. doi:10.1098/rstl.1825.0022. JSTOR 107752.그 2020-11-21에 원래에서 Archived.2012-01-15 Retrieved.페이지 443–450일, 패러데이"수소의 bicarburet"(벤젠)에 대해 논한다.449-450페이지에서, 그는 벤젠의 경험식이 CH라는66 것을 보여주지만, 비록 그는 (그 당시 대부분의 화학자들과 마찬가지로) 탄소에 잘못된 원자량을 사용했기 때문에 그것을 깨닫지 못한다.
- ^ Kaiser, R. (1968). "Bicarburet of Hydrogen. Reappraisal of the Discovery of Benzene in 1825 with the Analytical Methods of 1968". Angewandte Chemie International Edition in English. 7 (5): 345–350. doi:10.1002/anie.196803451.
- ^ Mitscherlich, E.(1834년)."Über 다쓰 Benzol 팟스 Säuren 해부 Oel- und Talgarten 죽는다"[산의 benzol과 다른 기름기 있는이나 지방이 많은 종류에].Annalen하는 Pharmacie.9(1):39–48. doi:10.1002/jlac.18340090103.그 2015-11-23에 원래에서 Archived.2015-06-27 Retrieved.때문에 그 접미사"-in", 반면에 접미사"-ol"benzene은 그것이 지성을 제안하는 benzene 것은 알칼로이드(예:Chinin(키니네))을 제안 페이지 43에 대한 각주에는 리비히, 그 저널의 편집자, 벤젠(즉,"벤젠")"벤젠"기 위해 Mitscherlich의 원래 이름을 바꾸는 것을 제안한다.따라서 44페이지에서 미첼리치는 다음과 같이 말하고 있다: "Da diese Flussigkeit aus der Benzoersaure gewonnen wird, und wahrscheinlich mit den Benzoylverbungen im Zussamenhamenht, da da da da der Schurschur.quid [benzene]는 벤조산에서 얻으며 아마도 벤조일 화합물과 관련이 있을 것이며, 벤조일 화합물의 가장 좋은 이름은 "benzol"이다. 왜냐하면 "benzonn"이라는 이름은 이미 Liebig와 Wöhler에 의해 비터 아몬드[벤조알데히드]의 오일과 이성질 화합물에 대해 선택되었기 때문이다.)
- ^ Laurent, Ouguste(1836) "Sur la chlorophénise et les clorophénisique et clorophénésique", Annales de Chemie et de Ficture, vol. 63, 페이지 27–45, 웨이백 머신에 보관된 2015-03-20 "Je donne le nom de Phénes attes attes attes" 참조: "프란데시데스 aphents aphents aphé aphents aphent aph나이." (나는 앞의 산의 기본 래디칼에 "phene"(βαδδδ, 조명)이라는 이름을 붙인다. 왜냐하면 벤젠은 조명 가스에서 발견되기 때문이다.)
- ^ Hofmann, A. W.(1845) "Uber eine sichere reaction auf Benzol" 2015-11-22를 Wayback Machine, Annalen der Chemie und Pharmacie, vol. 55, 페이지 200–205, 타르벤젠 오일에서 발견된 Hofmann에 보관.
- ^ Mansfield Charles Blachford (1849). "Untersuchung des Steinkohlentheers". Annalen der Chemie und Pharmacie. 69 (2): 162–180. doi:10.1002/jlac.18490690203. Archived from the original on 2015-10-27. Retrieved 2015-06-27.
- ^ 찰스 맨스필드는 (1847년 11월 11일) 출원하여 (1848년 5월) 콜타르의 부분 증류 특허(11,960호)를 받았다.
- ^ 호프만, 오거스터스 W(1856년)."insolinic 산에".왕립 협회의 회보.8:1–3. doi:10.1098/rspl.1856.0002.insolinic 산성의 형성의 존재와 모드 1염기의 향기로운 산의 일련의, Cn2Hn2-8O4의 가장 낮은 알려진 용어는 벤조 산, 쌓이다 참고:증명한다.는 호프만의 기사(페이지의 주 3)에 나타나는 유기 화합물을 경험적인 공식 6(12마리 대신에)의 탄소의 원자 질량과 산소의 8(16대신). 해결의 원자 질량에 근거하고 있습니다.
- ^ Cernicharo, José; et al. (1997), "Infrared Space Observatory's Discovery of C4H2, C6H2, and Benzene in CRL 618", Astrophysical Journal Letters, 546 (2): L123–L126, Bibcode:2001ApJ...546L.123C, doi:10.1086/318871
- ^ Claus, Adolph K.L. (1867) "Theoretische Betractungen und der Anwendungen zur Systematik der Organischen Chemie" (유기화학 분류 체계에 대한 이론적 고려사항과 적용), Ber die Handlungen der Naturfturfturftschenzuchellschezuchezuchellsche" (유기화학 분류 체계화학과)Fic Society of Freiburg in Breisgau), 4:116-381.아로마티셴 베르빈둥겐(방향족 화합물) 섹션 315-347페이지에서 클라우스는 벤젠에 대한 케쿨레의 가설 구조를 제시하고, 이에 대한 이의를 제기하고, 대체 기하학을 제시하고, 그의 대안이 옳다고 결론짓습니다(p.326).페이지 354 또는 페이지 379의 그림도 참조하십시오.
- ^ Dewar James (1867). "On the oxidation of phenyl alcohol, and a mechanical arrangement adapted to illustrate structure in the non-saturated hydrocarbons". Proceedings of the Royal Society of Edinburgh. 6: 82–86. doi:10.1017/S0370164600045387. Archived from the original on 2015-11-24. Retrieved 2015-06-27.
- ^ Ladenburg Albert (1869). "Bemerkungen zur aromatischen Theorie" [Observations on the aromatic theory]. Berichte der Deutschen Chemischen Gesellschaft. 2: 140–142. doi:10.1002/cber.18690020171. Archived from the original on 2015-11-22. Retrieved 2015-06-27.
- ^ Armstrong Henry E (1887). "An explanation of the laws which govern substitution in the case of benzenoid compounds". Journal of the Chemical Society. 51: 258–268 [264]. doi:10.1039/ct8875100258. Archived from the original on 2015-10-22. Retrieved 2015-06-27.
- ^ Tielle, Johannes (1899) "불포화합물에 대한 우리의 지식에 대하여" (Jur Kenntnis der ungesetten Verbindungen), Justus Liebig의 Annalen der Chemie 306: 87–142; "VIII"를 참조하십시오. 베르빈둥겐을 죽여라. 다스 벤졸. (VIII). 방향족 화합물. 벤젠). 페이지 125–129.Wayback Machine에 보관된 2020-03-10 자세한 내용은 다음을 참조하십시오.Tielle(1901) "Zur Kenntnis der ungettigen Verbindungen", 2021-12-26년 Wayback Machine Justus Liebig의 Annalen der Chemie, 319: 129–143에 보관되어 있습니다.
- ^ 암스트롱은 1890년 논문에서 벤젠 핵 안에 "중심"이라는 단어의 줄임말인 "C"자를 넣어 다환 벤제노이드 내의 벤젠 핵을 표현했다.탄소 원자의 지정된 사이클 내에서 중심 친화력(즉, 결합)이 작용한다.페이지 102부터: "…벤젠은, 이 견해에 의하면, 실제로는 이중 고리로 나타낼 수 있다."참조:
- Armstrong, H.E. (1890). "The structure of cycloid hydrocarbons". Proceedings of the Chemical Society. 6: 101–105. Archived from the original on 2021-11-16. Retrieved 2018-02-17.
- Armit, James Wilson; Robinson, Robert (1925). "Polynuclear heterocyclic aromatic types. Part II. Some anhydronium bases". Journal of the Chemical Society, Transactions. 127: 1604–1618. doi:10.1039/ct9252701604.
- Balaban, Alexandru T.; Schleyer, Paul v. R.; Rzepa, Henry S. (2005). "Crocker, Not Armit and Robinson, Begat the Six Aromatic Electrons". Chemical Reviews. 105 (10): 3436–3447. doi:10.1021/cr0300946. PMID 16218557.
- ^ Loschmidt, J. (1861). Chemische Studien (in German). Vienna, Austria-Hungary: Carl Gerold's Sohn. pp. 30, 65. Archived from the original on 2016-05-07. Retrieved 2015-06-27.
- ^ Kekulé, F. A. (1865). "Sur la constitution des substances aromatiques". Bulletin de la Société Chimique de Paris. 3: 98–110. Archived from the original on 2015-11-14. Retrieved 2015-06-27. 페이지 100에서, 케쿨레는 벤젠의 탄소 원자가 "샤네 페르메"를 형성할 수 있다고 제안합니다.
- ^ Kekulé, F. A. (1866). "Untersuchungen über aromatische Verbindungen (Investigations of aromatic compounds)". Liebigs Annalen der Chemie und Pharmacie. 137 (2): 129–36. doi:10.1002/jlac.18661370202. Archived from the original on 2021-12-26. Retrieved 2021-12-25.
- ^ 를 클릭합니다Rocke, A. J. (2010). Image and Reality: Kekule, Kopp, and the Scientific Imagination. University of Chicago Press. pp. 186–227. ISBN 978-0226723358. Archived from the original on 2020-07-27. Retrieved 2020-05-15..
- ^ Read, John (1995). From alchemy to chemistry. New York: Dover Publications. pp. 179–180. ISBN 9780486286907.
- ^ 영어 번역
- ^ Kekulé, F. A. (1890). "Benzolfest: Rede". Berichte der Deutschen Chemischen Gesellschaft. 23: 1302–11. doi:10.1002/cber.189002301204. Archived from the original on 2007-05-16. Retrieved 2007-03-12.
- ^ Benfey O. T. (1958). "August Kekulé and the Birth of the Structural Theory of Organic Chemistry in 1858". Journal of Chemical Education. 35 (1): 21–23. Bibcode:1958JChEd..35...21B. doi:10.1021/ed035p21.
- ^ Gillis Jean (1966). "Auguste Kekulé et son oeuvre, réalisée à Gand de 1858 à 1867". Mémoires de la Classe des Sciences - Académie Royale des Sciences, des Lettres et des Beaux-arts de Belgique. 37 (1): 1–40.
- ^ Lonsdale, K. (1929). "The Structure of the Benzene Ring in Hexamethylbenzene". Proceedings of the Royal Society. 123A (792): 494–515. Bibcode:1929RSPSA.123..494L. doi:10.1098/rspa.1929.0081.
- ^ Lonsdale, K. (1931). "An X-Ray Analysis of the Structure of Hexachlorobenzene, Using the Fourier Method". Proceedings of the Royal Society. 133A (822): 536–553. Bibcode:1931RSPSA.133..536L. doi:10.1098/rspa.1931.0166. Archived from the original on 2021-03-19. Retrieved 2007-03-12.
- ^ Ramos-Figueroa, Josseline (2021-05-21). "Meet Kathleen Lonsdale, the physicist and prison reformer who cracked benzene's code". Massive Science. Retrieved 2022-03-01.
- ^ Wilhelm Körner(1867년) "Faits pour servir dé la détermination du lieu chimique la série aromatique" 웨이백 머신에 2017-07년 보관(향기 시리즈의 화학적 위치를 결정하는 데 사용되는 팩트), Bulletin de l'L'Academemie roy royale des - des - des - des - des - des - 。페이지 169페이지 169부터: "연장기능 ces trois séries, dans les dérives bihydroxyliques on leurs terms ces trois séries, dans les décelles bihydroxyliques eta-" (디히드록시 유도체에는 메타어, para-, para-, para-, para-, para-)라는 용어가 대응하는 용어로 쉽게 구별된다.
- ^ Herman von Fehling, ed., Neues Handwörterbuch der Chemie [새로운 간결한 화학사전] (Braunschweig, 독일:Friedrich Vieweg und Son, 1874), 제1권, 1142쪽.
- ^ Graebe(1869) "Uber die Configuration des Napthalins" 아카이브에 2015-11-28 아카이브.오늘 (나프탈렌 구조에 대하여), Annalen der Chemie und Pharmacie, 149:20-28. 특히 페이지 26을 참조하십시오.
- ^ Victor Meyer(1870) "Untersuchungen über die Configuration der zweifach-substituirten Benzole" 아카이브에 2015-10-23(치환 벤젠 구조 조사), Annalen der Chemie und Pharmacie, 156.5–301; 특히 페이지 299 참조.
- ^ Williams, P.R.D.; Knutsen, J.S.; Atkinson, C.; Madl, A.K.; Paustenbach, D.J. (2007). "Airborne Concentrations of Benzene Associated with the Historical Use of Some Formulations of Liquid Wrench". Journal of Occupational and Environmental Hygiene. 4 (8): 547–561. doi:10.1080/15459620701446642. PMID 17558801. S2CID 32311057.
- ^ a b Hillis O. Folkins (2005). "Benzene". Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a03_475. ISBN 978-3527306732.
- ^ Chang, Kenneth (June 7, 2018). "Life on Mars? Rover's Latest Discovery Puts It 'On the Table'". The New York Times. Archived from the original on May 28, 2019. Retrieved June 8, 2018.
The identification of organic molecules in rocks on the red planet does not necessarily point to life there, past or present, but does indicate that some of the building blocks were present.
- ^ ten Kate, Inge Loes (June 8, 2018). "Organic molecules on Mars". Science. 360 (6393): 1068–1069. Bibcode:2018Sci...360.1068T. doi:10.1126/science.aat2662. PMID 29880670. S2CID 46952468.
- ^ Eigenbrode, Jennifer L.; et al. (June 8, 2018). "Organic matter preserved in 3-billion-year-old mudstones at Gale crater, Mars" (PDF). Science. 360 (6393): 1096–1101. Bibcode:2018Sci...360.1096E. doi:10.1126/science.aas9185. PMID 29880683. S2CID 46983230. Archived (PDF) from the original on August 25, 2021. Retrieved January 4, 2021.
- ^ Bacon, G. E.; Curry, N.; Wilson, S. (May 12, 1964). "A Crystallographic Study of Solid Benzene by Neutron Diffraction". Proceedings of the Royal Society of London. Series A, Mathematical and Physical Sciences. 279 (1376): 98–110. Bibcode:1964RSPSA.279...98B. doi:10.1098/rspa.1964.0092. JSTOR 2414835. S2CID 94432897.
- ^ Moran D, Simmonett AC, Leach FE, Allen WD, Schleyer PV, Schaefer HF (2006). "Popular Theoretical Methods Predict Benzene and Arenes To Be Nonplanar". Journal of the American Chemical Society. 128 (29): 9342–3. doi:10.1021/ja0630285. PMID 16848464.
- ^ Cooper, David L.; Gerratt, Joseph; Raimondi, Mario (1986). "The electronic structure of the benzene molecule". Nature. 323 (6090): 699–701. Bibcode:1986Natur.323..699C. doi:10.1038/323699a0. S2CID 24349360.
- ^ Pauling, Linus (1987). "Electronic structure of the benzene molecule". Nature. 325 (6103): 396. Bibcode:1987Natur.325..396P. doi:10.1038/325396d0. S2CID 4261220.
- ^ Messmer, Richard P.; Schultz, Peter A. (1987). "The electronic structure of the benzene molecule". Nature. 329 (6139): 492. Bibcode:1987Natur.329..492M. doi:10.1038/329492a0. S2CID 45218186.
- ^ Harcourt, Richard D. (1987). "The electronic structure of the benzene molecule". Nature. 329 (6139): 491–492. Bibcode:1987Natur.329..491H. doi:10.1038/329491b0. S2CID 4268597.
- ^ "Unicode Character 'BENZENE RING' (U+232C)". fileformat.info. Archived from the original on 2009-02-19. Retrieved 2009-01-16.
- ^ "Unicode Character 'BENZENE RING WITH CIRCLE' (U+23E3)". fileformat.info. Archived from the original on 2009-07-03. Retrieved 2009-01-16.
- ^ "Heterocyclic Chemistry: Heterocyclic Compounds". Michigan State University, Department of Chemistry. Archived from the original on 2016-04-06. Retrieved 2016-07-08.
- ^ Browne, Malcolm W. (August 16, 1988), "A pervasive molecule is captured in a photograph", The New York Times, archived from the original on August 12, 2021, retrieved August 13, 2021
- ^ "Market Study: Benzene (2nd edition), Ceresana, August 2014". ceresana.com. Archived from the original on 2017-12-21. Retrieved 2015-02-10.
- ^ "Market Study: Toluene, Ceresana, January 2015". ceresana.com. Archived from the original on 2017-04-29. Retrieved 2015-02-10.
- ^ Kolmetz, Gentry, BTX 리뉴얼 가이드라인, AIChE 2007 스프링 컨퍼런스
- ^ "Control of Hazardous Air Pollutants From Mobile Sources". U.S. Environmental Protection Agency. 2006-03-29. p. 15853. Archived from the original on 2008-12-05. Retrieved 2008-06-27.
- ^ Stranks, D. R.; M. L. Heffernan; K. C. Lee Dow; P. T. McTigue; G. R. A. Withers (1970). Chemistry: A structural view. Carlton, Victoria: Melbourne University Press. p. 347. ISBN 978-0-522-83988-3.
- ^ Welch, Vincent A.; Fallon, Kevin J.; Gelbke, Heinz-Peter (2005). "Ethylbenzene". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a10_035.pub2. ISBN 3527306730.
- ^ Kasper, Dennis L.et.(2004) Harrison's Principle of Internal Medicine, 제16판, McGrow-Hill Professional, 페이지 618, ISBN 0071402357.
- ^ Merck Manual, Home Edition 2011-09-29 Wayback Machine에 보관된 "백혈병 개요"
- ^ Bard, D (2014). "Traffic-related air pollution and the onset of myocardial infarction: disclosing benzene as a trigger? A small-area case-crossover study". PLOS ONE. 9 (6): 6. Bibcode:2014PLoSO...9j0307B. doi:10.1371/journal.pone.0100307. PMC 4059738. PMID 24932584.
- ^ a b Smith, Martyn T. (2010). "Advances in understanding benzene health effects and susceptibility". Annu Rev Public Health. 31: 133–48. doi:10.1146/annurev.publhealth.012809.103646. PMC 4360999. PMID 20070208.
- ^ 미국석유학회, API 독성학 리뷰, 벤젠, 1948년 9월, 보건 및 인간 서비스부 독성 물질 및 질병 등록국
- ^ Smith, Martyn T. (2010-01-01). "Advances in Understanding Benzene Health Effects and Susceptibility". Annual Review of Public Health. 31 (1): 133–148. doi:10.1146/annurev.publhealth.012809.103646. PMC 4360999. PMID 20070208.
- ^ WHO. 국제암연구기구, IARC 인간에 대한 발암 위험 평가, 발암성 종합 평가: Wayback Machine에서 아카이브된 2008-03-06 IARC 모노그래프 업데이트, Volume 1~42, 부록 7
- ^ Huff J (2007). "Benzene-induced cancers: abridged history and occupational health impact". Int J Occup Environ Health. 13 (2): 213–21. doi:10.1179/oeh.2007.13.2.213. PMC 3363002. PMID 17718179.
- ^ Rana SV; Verma Y (2005). "Biochemical toxicity of benzene". J Environ Biol. 26 (2): 157–68. PMID 16161967.
- ^ 독성 물질 및 질병 등록 기관(2007).벤젠: 환자 정보 시트.Wayback Machine에서 2014-12-15년 아카이브 완료
- ^ Yardley-Jones, A.; Anderson, D.; Parke, D. V. (1991). "The toxicity of benzene and its metabolism and molecular pathology in human risk assessment". British Journal of Industrial Medicine. 48 (7): 437–44. doi:10.1136/oem.48.7.437. PMC 1035396. PMID 1854646.
- ^ 산업 안전 및 건강 표준, 독성 및 유해 물질, 1910.1028 웨이백 기계에서 2015-06-29 보관.Osha.gov 를 참조해 주세요.2011-11-23에 취득.
- ^ 벤젠 공중위생보고서, 독성물질 및 질병등록청(2007년 8월). 벤젠: 환자 정보 시트 2010-05-28년 웨이백 머신에 보관.Atsdr.cdc.gov (2011-03-03)2011-11-23에 취득.
- ^ 먹는물 오염물질 유기화학물질 2015-02-02 웨이백 머신에 보관된 벤젠.Water.epa.gov 를 참조해 주세요.2014-04-17에 취득.
- ^ 2015-06-29 웨이백 머신에 보관된 화학 샘플링 정보 벤젠.Osha.gov 를 참조해 주세요.2011-11-23에 취득.
- ^ 벤젠 독성: 표준 및 규정 ATSDR – Environmental Medicine & Environmental Health Education – CSEM.Atsdr.cdc.gov(2000-06-30).2010년 10월 9일에 취득.
- ^ NIOSH 인공호흡기 선택 로직 Wayback Machine에서 2017-08-29 아카이브(2004년 10월).신시내티, 오호주: 미국 보건복지부, 공중보건부, 질병통제센터, 국립산업안전보건연구소, DHHS(National Institute for Safety and Health)간행물 제2005-100호
- ^ 즉시 생명 또는 건강 농도에 대한 문서(IDLH): 2019-04-01년 웨이백 머신에 보관된 소개.Cdc.gov 를 참조해 주세요.2011-11-23에 취득.
- ^ "Public Health Statement for Benzene". Agency for Toxic Substances and Disease Registry. U.S. Department of Health and Human Services, Public Health Service, Centers for Disease Control, National Institute for Occupational Safety and Health. August 2007. Archived from the original on 2012-01-20. Retrieved 2011-11-23 – via Atsdr.cdc.gov.
- ^ Ashley, DL; Bonin, MA; Cardinali, FL; McCraw, JM; Wooten, JV (1994). "Blood concentrations of volatile organic compounds in a nonoccupationally exposed US population and in groups with suspected exposure" (PDF). Clinical Chemistry. 40 (7 Pt 2): 1401–4. doi:10.1093/clinchem/40.7.1401. PMID 8013127. Archived (PDF) from the original on 2011-11-22. Retrieved 2010-08-25.
- ^ Fustinoni S, Buratti M, Campo L, Colombi A, Consonni D, Pesatori AC, Bonzini M, Farmer P, Garte S, Valerio F, Merlo DF, Bertazzi PA (2005). "Urinary t,t-muconic acid, S-phenylmercapturic acid and benzene as biomarkers of low benzene exposure". Chemico-Biological Interactions. 153–154: 253–6. doi:10.1016/j.cbi.2005.03.031. PMID 15935823.
- ^ ACGIH(2009년).2009년 TLV 및 BEI미국 정부 산업 위생사 회의, 오하이오 신시내티.
- ^ Baselt, R. (2008) 인체 독성 약물 및 화학 폐기, 제8판, 생물의학 간행물, 포스터 시티, CA, 페이지 144–148, ISBN 09652377.
- ^ Snyder, R; Hedli, C.C. (1996). "An overview of benzene metabolism". Environ Health Perspect. 104 (Suppl 6): 1165–1171. doi:10.1289/ehp.96104s61165. PMC 1469747. PMID 9118888.
- ^ Dougherty, D; Garte, S; Barchowsky, A; Zmuda, J; Taioli, E (2008). "NQO1, MPO, CYP2E1, GSTT1 and STM1 polymorphisms and biological effects of benzene exposure—a literature review". Toxicology Letters. 182 (1–3): 7–17. doi:10.1016/j.toxlet.2008.09.008. PMID 18848868.
- ^ Fracasso ME, Doria D, Bartolucci GB, Carrieri M, Lovreglio P, Ballini A, Soleo L, Tranfo G, Manno M (2010). "Low air levels of benzene: Correlation between biomarkers of exposure and genotoxic effects". Toxicol Lett. 192 (1): 22–8. doi:10.1016/j.toxlet.2009.04.028. PMID 19427373.
- ^ Eastmond, D.A.; Rupa, DS; Hasegawa, LS (2000). "Detection of hyperdiploidy and chromosome breakage in interphase human lymphocytes following exposure to the benzene metabolite hydroquinone using multicolor fluorescence in situ hybridization with DNA probes". Mutat Res. 322 (1): 9–20. doi:10.1016/0165-1218(94)90028-0. PMID 7517507.
- ^ Garte, S; Taioli, E; Popov, T; Bolognesi, C; Farmer, P; Merlo, F (2000). "Genetic susceptibility to benzene toxicity in humans". J Toxicol Environ Health A. 71 (22): 1482–1489. doi:10.1080/15287390802349974. PMID 18836923. S2CID 36885673.
- ^ 벤젠의 ToxFAQs, 독성물질 및 질병등록청, 보건복지부 2008-03-09 Wayback Machine 아카이브
- ^ 2010-05-28 벤젠에 대한 ToxGuide 아카이브 2010-05-28 미국 보건복지부 유해물질 및 질병등록청 웨이백 머신
- ^ 공중위생에 관한 성명. 벤젠, Wayback Machine 2010-05-27, 독성 및 환경의학 부문, 2007년 8월
- ^ 벤젠, CASRN: 71-43-2 웨이백 머신에서 2011-10-22 아카이브 완료.위험 물질 데이터 뱅크, 미국 국립 의학 도서관미국 국립 보건원
- ^ "FDA: Too Much Benzen In Some Drinks" 2007-02-18 아카이브, CBS 뉴스, 2006년 5월 19일.2006년 7월 11일 취득.
- ^ "100 tonnes of pollutants spilled into Chinese river". The Guardian. 25 November 2005. Archived from the original on 10 March 2020. Retrieved 7 January 2020.
- ^ Isaacson, Kristofer P.; Proctor, Caitlin R.; Wang, Q. Erica; Edwards, Ethan Y.; Noh, Yoorae; Shah, Amisha D.; Whelton, Andrew J. (2021). "Drinking water contamination from the thermal degradation of plastics: Implications for wildfire and structure fire response". Environmental Science: Water Research & Technology. 7 (2): 274–284. doi:10.1039/D0EW00836B.
- ^ "Selections and lethal injections". Auschwitz-Birkenau State Museum. Archived from the original on May 9, 2020. Retrieved May 15, 2020.
- ^ "A Former Nazi Labor Camp in Austria, Now Billed as a Tourist Site". Haaretz. May 3, 2019. Archived from the original on May 11, 2019. Retrieved May 11, 2019.
외부 링크
- 주기율표의 벤젠 (노팅엄 대학교)
- 국제 화학 안전 카드 0015
- 벤젠 독성 USEPA 요약
- NIOSH 화학적 위험에 대한 포켓 가이드
- PubChem의 벤젠
- 보건·휴먼서비스부: TR-289: 벤젠의 독성과 발암 연구
- 1991년 패러데이 이후 벤젠에 대한 강의를 하는 존 캐도건 경의 비디오 팟캐스트
- 물질 프로필
- 화학 중의 벤젠IDplus 데이터베이스
- NLM 유해물질 데이터뱅크 – 벤젠