어원디올디아세테이트
Etynodiol diacetate | |
| 임상 데이터 | |
|---|---|
| 상호 | Continuein, Demulen, Femulen, Luteonorm, Luto-Metrodiol, Metrodiol, Ovulen, 기타 |
| 기타 이름 | 에티노디올디아세테이트, 노르에틴드롤디아세테이트, 3β-히드록시노레스티론3β, 17β-디아세테이트,[1] CB-8080, SC-11800 |
| 루트 행정부. | 입으로 |
| 약물 클래스 | 프로게스토겐, 프로게스틴, 프로게스토겐에스테르 |
| ATC 코드 | |
| 법적 상태 | |
| 법적 상태 |
|
| 식별자 | |
| |
| CAS 번호 |
|
| PubChem CID | |
| PubChem SID | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 첸블 | |
| CompTox 대시보드 (EPA ) | |
| ECHA 정보 카드 | 100.005.496 |
| 화학 및 물리 데이터 | |
| 공식 | C24H32O4 |
| 몰 질량 | 384.516 g/120−1 |
| 3D 모델(JSmol) | |
| |
| |
데물렌과 페물렌이라는 상표명으로 판매되는 어원노디올 디아세테이트 또는 에티노디올 디아세테이트는 피임약에 [2][3][4]사용되는 프로게스틴 약물이다.그 약은 [5]에스트로겐과 조합해서만 구할 수 있다.입으로 [6]먹는 거예요.
어원디올디아세테이트는 프로게스틴 또는 합성 프로게스토겐이며, 따라서 프로게스테론과 [7][8]같은 프로게스토겐의 생물학적 표적인 프로게스테론 수용체의 작용제이다.그것은 안드로겐과 에스트로겐의 활동이 약하고 다른 중요한 호르몬 [9][10][11]활동은 없다.이 약물은 체내 노르에스티론의 프로드러그이며,[7][8][12] 어원디올은 중간체로서 발생한다.
1954년 어원디올이 발견됐고 1965년 [13][14]어원디올 디아세테이트가 의료용으로 도입됐다.이 약은 현재 미국, 캐나다 및 기타 일부 [4][5]국가에서만 구입할 수 있습니다.
의료 용도
어원노디올 디아세테이트는 [6]여성용 경구 피임약에서 에티닐에스트라디올이나 메스트라놀과 같은 에스트로겐과 함께 사용된다.
부작용
약리학
어원노디올디아세테이트는 프로게스테론 및 안드로겐 수용체에 대한 친화력 측면에서 사실상 비활성이며,[7][8][12] 어원노디올이 중간체로 발생하는 노르에스티론의 급속 변환 프로드러그 역할을 한다.경구투여 및 간의 퍼스트패스 대사 중에 어원디올 디아세테이트는 에스테라아제에 의해 어원디올로 [12]빠르게 전환되고, 이어서 C3 하이드록실기의 산소화를 통해 노르에스티스테론을 [8]생성한다.어원디올 디아세테이트는 프로게스틴과 달리 안드로겐 [9][10]활성이 약하지만 노르에스티론 및 노르에티노드렐과 [15]유사하게 에스트로겐 [10][11]활성이 있다.
| 컴파운드 | 유형a | PR | AR | ER | GR | MR | SHBG | CBG |
|---|---|---|---|---|---|---|---|---|
| 노르에스티스토론 | – | 67–75 | 15 | 0 | 0–1 | 0–3 | 16 | 0 |
| 5α-디히드로노레스티론 | 대사물 | 25 | 27 | 0 | 0 | ? | ? | ? |
| 3α,5α-테트라히드로노레스티론 | 대사물 | 1 | 0 | 0–1 | 0 | ? | ? | ? |
| 3α,5β-테트라히드로노레스티론 | 대사물 | ? | 0 | 0 | ? | ? | ? | ? |
| 3β,5α-테트라히드로노레스티론 | 대사물 | 1 | 0 | 0–8 | 0 | ? | ? | ? |
| 에티닐에스트라디올 | 대사물 | 15–25 | 1–3 | 112 | 1–3 | 0 | 0.18 | 0 |
| 아세트산노레티스테론 | 프로드러그 | 20 | 5 | 1 | 0 | 0 | ? | ? |
| 에난트산노레티스테론 | 프로드러그 | ? | ? | ? | ? | ? | ? | ? |
| 노레티노드렐 | 프로드러그 | 6 | 0 | 2 | 0 | 0 | 0 | 0 |
| 어원노디올 | 프로드러그 | 1 | 0 | 11–18 | 0 | ? | ? | ? |
| 어원디올디아세테이트 | 프로드러그 | 1 | 0 | 0 | 0 | 0 | ? | ? |
| 린에스트레놀 | 프로드러그 | 1 | 1 | 3 | 0 | 0 | ? | ? |
| 주의: 값은 백분율(%)입니다.참조 리간드(100%)는 의 경우 프로메게스톤, 의 경우 메트리볼론, 의 경우 에스트라디올, 의 경우 덱사메타손, 의 경우 알도스테론, 의 경우 디히드로테스토스테론, 의 경우 코르티솔이었다. 각주: = 활성/비활성 대사물, 프로드러그 또는 노르에스테론은 모두 해당되지 않았다.출처:"템플릿"을 참조해 주세요. | ||||||||
화학
에스테론 3β-히드록시-17α-에티닐-19-노르테스토스테론 3β, 17β-디아세테이트, 3β-히드록시노레스티론 3β, 17β-디아세테이트 또는 17α-에티닐스테론 4β-3β, 17β-디올 3β, 17β-아세테이트로도 알려진 에스테론 3β-아세테이트특히 19-노르테스토스테론 및 17α-에티닐테스토스테론의 유도체 또는 C3β 하이드록실기로 탈수소되어 C3β 및 C17β [3][4]위치에 아세트산에스테르가 부착된 노르에스티론(17α-에티닐-19-노르테스토스테론)의 유도체이다.어원디올 디아세테이트는 어원디올(17α-ethynylstr-4-ene-3β, 17β-diol)[3][4]의 3β, 17β-디아세테이트 에스테르이다.
합성
어원디올 디아세테이트의 화학 합성물이 발표되었다.[16]
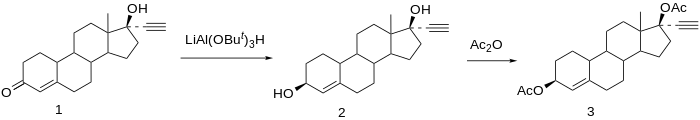
노르에스티론(1)을 환원하면 3,17-디올을 얻을 수 있다.바람직한 생성물은 3β-히드록시 화합물이며, 스테레오 방향 근위 치환기가 상대적으로 없기 때문에 C3에서의 반응은 C17에서의 반응과 같은 거의 입체선택성을 보이지 않기 때문에 원하는 이성질체의 형성은 부피가 큰 환원제인 리튬 트리-터-부티알루민 하이드라이드를 사용하여 유발된다.3β, 17β-diol의 아세틸화는 어원디올 디아세테이트(3)[17]를 제공한다.
역사
어원노디올은 1954년 노르에스티론 환원을 통해 처음 합성됐으며 [13][14]어원노디올 디아세테이트는 1965년 의료용으로 도입됐다.
사회와 문화
일반명
에티노디올 디아세테이트는 에티노디올 디아세테이트, 에티노디올 디아세테이트는 에티노디올, [3][4][5]에티노디올 디아세테이트의 총칭이다.이전 개발 코드명 CB-8080과 SC-11800으로도 [3][4][5]알려져 있습니다.
브랜드명
어원노디올 디아세테이트는 Conova, Continuin, Demulen, Femulen, Kelnor, Luteonorm, Luto-Metrodiol, Metrodiol, Ovulen, Soluna, Zovia [3][4][5]등의 브랜드명으로 판매되고 있습니다.
유용성
어원노디올 디아세테이트는 미국, 캐나다, 아르헨티나, [5]오만 등 일부 국가에서만 판매되고 있습니다.
레퍼런스
- ^ a b Schindler, Adolf E; Campagnoli, Carlo; Druckmann, René; Huber, Johannes; Pasqualini, Jorge R; Schweppe, Karl W; Thijssen, Jos HH (2003). "Classification and pharmacology of progestins". Maturitas. 46: 7–16. doi:10.1016/j.maturitas.2003.09.014. ISSN 0378-5122. PMID 14670641.
- ^ Donna Shoupe; Florence P. Haseltine (6 December 2012). Contraception. Springer Science & Business Media. pp. 21–. ISBN 978-1-4612-2730-4.
- ^ a b c d e f g J. Elks (14 November 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. pp. 522–. ISBN 978-1-4757-2085-3.
- ^ a b c d e f g h Index Nominum 2000: International Drug Directory. Taylor & Francis US. 2000. p. 422. ISBN 978-3-88763-075-1. Retrieved 30 May 2012.
- ^ a b c d e f https://www.drugs.com/international/etynodiol.html
- ^ a b Robert W. Blum (22 October 2013). Adolescent Health Care: Clinical Issues. Elsevier Science. pp. 216–. ISBN 978-1-4832-7738-7.
- ^ a b c Hammerstein J (1990). "Prodrugs: advantage or disadvantage?". Am. J. Obstet. Gynecol. 163 (6 Pt 2): 2198–203. doi:10.1016/0002-9378(90)90561-K. PMID 2256526.
- ^ a b c d IARC Working Group on the Evaluation of Carcinogenic Risks to Humans; World Health Organization; International Agency for Research on Cancer (2007). Combined Estrogen-progestogen Contraceptives and Combined Estrogen-progestogen Menopausal Therapy. World Health Organization. pp. 146–. ISBN 978-92-832-1291-1.
- ^ a b Armen H. Tashjian; Ehrin J. Armstrong (21 July 2011). Principles of Pharmacology: The Pathophysiologic Basis of Drug Therapy. Lippincott Williams & Wilkins. pp. 523–. ISBN 978-1-4511-1805-6.
- ^ a b c Kenneth L. Becker (24 April 2001). Principles and Practice of Endocrinology and Metabolism. Lippincott Williams & Wilkins. p. 1004. ISBN 978-0-7817-1750-2. Retrieved 30 May 2012.
- ^ a b Allan H. Goroll; Albert G. Mulley (27 January 2009). Primary Care Medicine: Office Evaluation and Management of the Adult Patient. Lippincott Williams & Wilkins. p. 876. ISBN 978-0-7817-7513-7. Retrieved 30 May 2012.
- ^ a b c Stanczyk FZ (2002). "Pharmacokinetics and potency of progestins used for hormone replacement therapy and contraception". Rev Endocr Metab Disord. 3 (3): 211–24. doi:10.1023/A:1020072325818. PMID 12215716. S2CID 27018468.
- ^ a b Progress in Medicinal Chemistry. Butterworth-Heinemann. 21 September 2011. pp. 180–. ISBN 978-0-08-086256-9.
- ^ a b William Andrew Publishing (22 October 2013). Pharmaceutical Manufacturing Encyclopedia, 3rd Edition. Elsevier. pp. 1516–. ISBN 978-0-8155-1856-3.
- ^ Benno Clemens Runnebaum; Thomas Rabe; Ludwig Kiesel (6 December 2012). Female Contraception: Update and Trends. Springer Science & Business Media. pp. 36–. ISBN 978-3-642-73790-9.
- ^ a b Die Gestagene. Springer-Verlag. 27 November 2013. pp. 14–15, 286. ISBN 978-3-642-99941-3.
- ^ a b Klimstra, P.; Colton, F. (1967). "The synthesis of 3β-hydroxyestr-4-en-17-one and 3β-hydroxiandrost-4-en-17-one". Steroids. 10 (4): 411–424. doi:10.1016/0039-128X(67)90119-5. PMID 6064262.
- ^ Sondheimer, F.; Klibansky, Y. (1959). "Synthesis of 3β-hydroxy analogues of steroidal hormones, a biologically active class of compounds". Tetrahedron. 5: 15–26. doi:10.1016/0040-4020(59)80066-1.