대식세포
Macrophage| 대식세포 | |
|---|---|
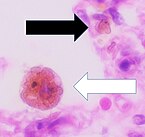
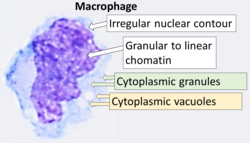 전형적인 특징을 가진 대식세포의 세포학. 라이트 얼룩. | |
| 세부 사항 | |
| 발음 | /ˈmakrə(ʊ)feɪdʒ/ |
| 시스템. | 면역계 |
| 기능. | Phagocytosis |
| 식별자 | |
| 라틴어 | 대식세포 |
| 머리글자 | 엠φ, 엠φ |
| MeSH | D008264 |
| TH | H2.00.03.0.01007 |
| FMA | 63261 |
| 미세해부학의 해부학 용어 | |
대식세포(Macrophage, 약칭 Mφ, Mφ 또는 MP)(그리스어: 큰 음식을 먹는 사람, 그리스어의 μα κρός(makrós) = 큰 음식을 먹는 φα γεῖν(phagein) = 먹는 것)는 암세포, 미생물, 세포 파편 및 이물질과 같은 병원체를 집어삼키고 소화시키는 선천성 면역계의 백혈구의 일종입니다. 건강한 신체 세포에 특이적인 단백질이 표면에 없습니다.[1][2] 이 과정은 감염과 부상으로부터 숙주를 방어하는 작용을 하는 식균작용이라고 합니다.[3]
대식세포는 기본적으로 모든 조직에서 발견되며,[4] 여기서 그들은 아메보이드 이동에 의해 잠재적인 병원체를 순찰합니다. 이들은 신체 전반에 걸쳐 다양한 형태(예: 조직구, 쿠퍼 세포, 폐포 대식세포, 미세아교세포 등)를 취하지만, 모두 단핵 식세포 시스템의 일부입니다. 이들은 식균작용 외에도 비특이적 방어(본태 면역)에 중요한 역할을 하며, 또한 림프구와 같은 다른 면역 세포를 모집하여 특정 방어 메커니즘(적응 면역)을 시작하는 데 도움을 줍니다. 예를 들어, 그들은 T 세포에 대한 항원 제시자로서 중요합니다. 사람의 경우, 기능 장애가 있는 대식세포는 만성 육아종성 질환과 같은 중증 질환을 유발하여 빈번한 감염을 초래합니다.
또한 대식세포는 염증을 증가시키고 면역체계를 자극하는 것을 넘어 중요한 항염증 역할을 하며 사이토카인 방출을 통해 면역반응을 감소시킬 수 있습니다. 염증을 촉진하는 대식세포를 M1 대식세포라고 하고, 염증을 감소시키고 조직의 회복을 촉진하는 대식세포를 M2 대식세포라고 합니다.[5] 이 차이는 대사에 반영됩니다; M1 대식세포는 아르기닌을 "살인자" 분자 산화질소로 대사하는 독특한 능력을 가지고 있는 반면, M2 대식세포는 아르기닌을 "수리" 분자 오르니틴으로 대사하는 독특한 능력을 가지고 있습니다.[6] 그러나 이 이분법은 최근에 더 복잡한 문제가 발견되면서 의문이 제기되고 있습니다.[7]
인간의 대식세포는 직경이[8] 약 21마이크로미터(0.00083인치)이며 조직 내 단핵구의 분화에 의해 생성됩니다. 이들은 CD14, CD40, CD11b, CD64, F4/80(마우스)/EMR1(인간), 리소자임 M, MAC-1/MAC-3 및 CD68과 같은 단백질의 특이적 발현에 의해 유세포 분석 또는 면역조직화학 염색을 사용하여 식별할 수 있습니다.[9]
대식세포는 1884년 러시아 제국의 동물학자인 엘리 메치니코프에 의해 처음으로 발견되고 이름 지어졌습니다.[10][11]
구조.
종류들
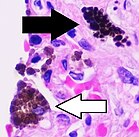
대부분의 대식세포는 미생물 침입이나 이물질 입자 축적이 발생하기 쉬운 전략적 지점에 위치합니다. 이 세포들은 하나의 그룹으로 함께 단핵 식세포 시스템으로 알려져 있으며 이전에는 세망 내피 시스템으로 알려져 있었습니다. 위치에 따라 결정되는 각 대식세포 유형에는 다음과 같은 특정 이름이 있습니다.
| 셀 이름 | 해부학적 위치 |
| 지방조직 대식세포 | 지방조직(지방) |
| 단핵구 | 골수/혈액 |
| 쿠퍼 세포 | 간 |
| 부비동조직구 | 림프절 |
| 폐포 대식세포(분진세포) | 폐포 |
| 거대 세포로 이어지는 조직 대식세포(조직구) | 결합조직 |
| 미세아교세포 | 중추신경계 |
| 호프바우어 세포 | 태반 |
| 사구체내중상세포[12] | 신장 |
| 파골세포 [13] | 뼈. |
| 랑게르한스 세포 | 피부. |
| 상피세포 | 육아종 |
| 붉은펄프 대식세포(sinusoid lining cell) | 비장의 붉은 과육 |
| 복막대식세포 | 복강 |
| 라이소맥[14] | 파이어판 |
| 혈관주위 대식세포[15] | 혈관과 밀접한 관련이 있는 |
쿠퍼 세포에 대한 조사는 인간의 경우 쿠퍼 세포가 생검이나 부검에서 면역조직화학적 분석에만 접근할 수 있기 때문에 방해를 받고 있습니다. 쥐와 쥐에서 분리하기 어렵고, 정제 후에는 쥐 한 마리에서 약 500만 개의 세포만 얻을 수 있습니다.
대식세포는 기관 내에서 파라크린 기능을 발현할 수 있습니다:) 그 기관의 기능에 고유한 기능입니다. 예를 들어, 고환에서 대식세포는 이웃 레이디그 세포에 의해 테스토스테론으로 전환될 수 있는 옥시스테롤인 25-하이드록시콜레스테롤을 분비함으로써 레이디그 세포와 상호작용할 수 있는 것으로 나타났습니다.[16] 또한 고환 대식세포는 고환 내 면역특권 환경을 조성하고, 고환 염증 시 불임을 중재하는 데 참여할 수 있습니다.
심장 상주 대식세포는 심장 근세포와의 갭 접합 통신을 통해 전기 전도에 참여합니다.[17]
대식세포는 기본적인 기능과 활성화에 따라 분류할 수 있습니다. 이 그룹에 따라 고전적으로 활성화된(M1) 대식세포, 상처 치유 대식세포(대체 활성화된(M2) 대식세포라고도 함) 및 조절 대식세포(Mregs)가 있습니다.[18]
발전
성인 건강 조직에 존재하는 대식세포는 순환하는 단핵구에서 유래하거나 출생 전에 확립된 후 단핵구와 독립적으로 성인 생활 동안 유지됩니다.[19][20] 대조적으로, 병든 부위에 축적되는 대부분의 대식세포는 일반적으로 순환하는 단핵구에서 유래합니다.[21] 백혈구 유출은 단핵구가 대식세포가 되면서 혈관의 내피를 통해 손상된 조직으로 들어가는 것을 말합니다. 단핵구는 화학 물질에 의해 손상된 부위에 끌리는데, 이는 이미 그 부위에 있는 대식세포에 의해 방출되는 손상된 세포, 병원균 및 사이토카인을 포함한 다양한 자극에 의해 촉발됩니다. 고환과 같은 일부 부위에서 대식세포는 증식을 통해 장기를 채우는 것으로 나타났습니다.[22] 단명 호중구와 달리 대식세포는 체내에서 수개월까지 더 오래 생존합니다.
기능.
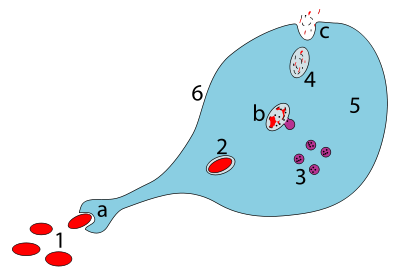
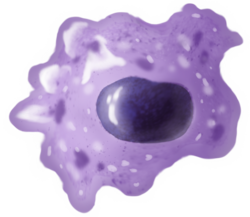
a.식균작용을 통해 섭취하면 식균체가 형성됩니다.
b.리소좀과 식세포의 융합은 식세포를 형성하는데, 이 병원체는 효소에 의해 분해됩니다.
c.폐기물이 배출되거나 동화되는 경우(후자는 그림에 표시되지 않음)
부품:
1.병원체
2.파고솜
3.리소좀
4.폐자재
5.세포질
6.세포막
Phagocytosis
대식세포는 전문 식세포로 죽거나 죽은 세포와 세포 파편을 제거하는 데 매우 전문적입니다. 염증의 초기 단계는 호중구에 의해 지배되기 때문에 만성 염증에서 이 역할은 중요합니다(이 과정에 대한 설명은 CD31 참조).[23]
호중구는 처음에 그들 또는 그들의 호중구 세포외 트랩이 대식세포에 의해 식균되기 전에 그들이 기능을 수행하고 죽는 부위로 유인됩니다.[23][24] 현장에 있을 때, 노화 과정 후와 처음 48시간 후에 호중구의 첫 번째 파동은 대식세포의 출현을 자극하여 이러한 대식세포가 노화된 호중구를 섭취합니다.[23]
죽어가는 세포를 제거하는 것은 더 큰 범위에서 고정 대식세포에 의해 처리되며, 고정 대식세포는 폐, 간, 신경 조직, 뼈, 비장 및 결합 조직과 같은 전략적 위치에 머물며 병원체와 같은 이물질을 섭취하고 필요한 경우 추가 대식세포를 모집합니다.[25]
대식세포가 병원체를 섭취하면 병원체는 식세포에 갇히게 되고, 식세포는 리소좀과 융합합니다. 파골리소좀 내에서 효소와 독성 과산화물이 병원체를 소화시킵니다. 그러나 결핵균과 같은 일부 박테리아는 이러한 소화 방법에 내성을 갖게 되었습니다. 장티푸스 살모넬라균은 생체 내에서 숙주 대식세포에 의한 자신의 식균작용을 유도하고, 리소좀 작용에 의한 소화를 억제하여 자신의 복제를 위해 대식세포를 사용하고 대식세포의 세포자멸사를 일으킵니다.[26] 대식세포는 100개 이상의 박테리아를 소화시킬 수 있으며, 이 박테리아들은 자신의 소화 화합물 때문에 마침내 죽을 수 있습니다.
선천성 면역반응에서의 역할
병원체가 침입하면 조직에 상주하는 대식세포가 가장 먼저 반응하는 세포 중 하나입니다.[27] 조직 상주 대식세포의 주요 역할 중 두 가지는 유입되는 항원을 식균하고 염증을 유발하는 염증성 사이토카인을 분비하여 다른 면역 세포를 부위로 모집하는 것입니다.[28]
병원체의 식균작용

대식세포는 수용체 매개 식균작용을 통해 항원을 내재화할 수 있습니다.[29] 대식세포는 병원체로부터 미생물 관련 분자 패턴(MAMP)을 인식할 수 있는 다양한 패턴 인식 수용체(PRR)를 가지고 있습니다. 톨 유사 수용체(TLR), 스캐빈저 수용체(SR), C형 렉틴 수용체 등과 같은 많은 PRR은 식균 작용에 대한 병원체를 인식합니다.[29] 또한 대식세포는 병원체에 붙어 식균작용을 표시하는 분자인 옵소닌을 통해 간접적으로 식균작용에 대한 병원체를 인식할 수 있습니다.[30] 옵소닌은 식균 작용 동안 대식세포와 병원체 사이에 더 강한 접착력을 유발할 수 있으므로 옵소닌은 대식세포의 식균 활성을 향상시키는 경향이 있습니다.[31] 보체 단백질과 항체 모두 항원과 결합하여 옵소닌화할 수 있습니다. 대식세포는 병원체 결합 보체 단백질 C3b 및 iC3b를 각각 인식하는 보체 수용체 1(CR1) 및 3(CR3)뿐만 아니라, 항원 결합 면역글로불린 G(IgG) 항체의 단편 결정화 가능(Fc) 영역을 인식하는 단편 결정화 γ 수용체(Fc γRs)를 구비하고 있는 것을 특징으로 하는 세포. 병원체를 식균하고 소화시킬 때, 대식세포는 더 많은 산소가 소비되어 활성산소종(ROS)과 소비된 병원체를 소화시키는 다른 항균성 분자를 생성하는 데 필요한 에너지를 공급하는 호흡 파열을 겪습니다.[28][33]
사이토카인 분비
PRR에 의한 MAMP의 인식은 조직 상주 대식세포를 활성화하여 다른 면역 세포를 모집하는 염증성 사이토카인을 분비할 수 있습니다. PRR 중 TLR은 사이토카인 생성으로 이어지는 신호 전달에 중요한 역할을 합니다.[29] TLR에 대한 MAMP의 결합은 결국 전사 인자 NF-κB를 활성화하고 IL-1β, IL-6, TNF-α, IL-12B 및 IFN-α 및 IFN-β와 같은 유형 I 인터페론을 포함한 여러 전염증성 사이토카인에 대한 유전자의 전사를 초래하는 일련의 다운스트림 이벤트를 유발합니다. 전신적으로 IL-1β, IL-6, TNF-α는 발열을 유도하고 간에서 급성기 단백질을 분비하는 급성기 반응을 시작합니다.[27][28][35] 국소적으로 IL-1β와 TNF-α는 혈관 상피세포 사이의 간격이 넓어지는 혈관확장을 일으키고, 상피세포에서 세포 표면 부착 분자의 상향 조절을 통해 백혈구 유출을 유도합니다.[27][28]
호중구는 대식세포가 혈액을 유출시켜 감염 부위에 도달하는 첫 번째 면역세포 중 하나입니다.[35] 대식세포는 CXCL1, CXCL2, CXCL8(IL-8)과 같은 많은 케모카인을 분비하여 호중구를 감염 부위로 유인합니다.[27][35] 호중구는 면역반응이 끝나면 식균작용을 마치고 항원을 제거한 후 세포자멸사를 거치며 대식세포를 혈액 단핵구에서 모집하여 세포자멸사 파편을 제거하는 데 도움을 줍니다.[36]
또한 대식세포는 CCL2, CCL4, CCL5, CXCL8, CXCL9, CXCL10, CXCL11과 같은 케모카인을 통해 단핵구, 수지상세포, 자연살해세포, 호산구, T세포 등 다른 면역세포를 모집합니다.[27][35] 대식세포는 수지상세포와 함께 I형 인터페론(IFN-α, IFN-β)과 IL-12 분비를 통해 자연살해(NK) 세포 활성화에 도움을 줍니다. IL-12는 IL-18과 함께 작용하여 적응 면역계가 활성화되기 전에 IFN- γ의 중요한 공급원 역할을 하는 NK 세포에 의한 전염증성 사이토카인 인터페론 감마(IFN- γ)의 생성을 자극합니다. IFN- γ은 대식세포에서 더 공격적인 표현형을 유도하여 대식세포가 병원체를 더 효율적으로 죽일 수 있도록 함으로써 선천성 면역 반응을 향상시킵니다.
대식세포에서 분비되는 T세포 화학유인물질로는 CCL5, CXCL9, CXCL10, CXCL11 등이 있습니다.[27]
적응 면역의 역할

CD4+ T Helper Cell과의 상호작용
대식세포는 전문 항원 제시 세포(APC)이며, 이는 T 헬퍼 세포의 세포 표면에 있는 주요 조직적합성 복합체(MHC) II 분자에 식균된 항원의 펩티드를 제시할 수 있음을 의미합니다.[39] 조직에 상주하는 대식세포는 ï에 상주하는 대식세포가 ï에 상주하는 림프절로 이동하지 않기 때문에 대식세포는 이전에 활성화된 적이 없는 신생아 T 도우미 세포의 주요 활성화제가 아닙니다. 대식세포는 림프절과 같은 2차 림프 기관에서도 발견되지만 T세포 영역에 존재하지 않고 ï T 도우미 세포를 활성화하는 데 효과적이지 않습니다. 림프 조직의 대식세포는 항원을 섭취하고 혈액으로 들어가는 것을 방지하는 데 더 많이 관여할 뿐만 아니라 세포자멸사 림프구의 파편을 흡수합니다.[40][42] 따라서 대식세포는 대부분 림프절을 떠나 감염 부위에 도착한 이전에 활성화된 T 헬퍼 세포 또는 조직 상주 기억 T 세포와 상호 작용합니다.[41]
대식세포는 T helper cell 활성화에 필요한 두 가지 신호를 모두 공급합니다: 1) 대식세포는 항원 펩타이드가 결합된 MHC class II 분자를 제시하여 해당 T cell receptor(TCR)에 의해 인식되도록 합니다. 및 2) PRR에 의한 병원체의 인식은 대식세포가 공동자극 신호를 공급하기 위해 T 헬퍼 세포 상의 CD28에 결합하는 공동자극 분자 CD80 및 CD86(일명 B7)을 상향 조절하도록 유도합니다.[35][39] 이러한 상호 작용을 통해 T 헬퍼 세포는 완전한 이펙터 기능을 달성하고 T 헬퍼 세포가 TCR 신호 전달 부족으로 인해 세포자멸사를 겪는 것을 방지하는 지속적인 생존 및 분화 신호를 제공할 수 있습니다.[39] 예를 들어, T 세포에서 IL-2 신호전달은 항-아포토틱 단백질 Bcl-2의 발현을 상향 조절하지만, IL-2의 T 세포 생산과 고친화성 IL-2 수용체 IL-2RA는 모두 MHC 결합 항원의 TCR 인식으로부터 지속적인 신호를 필요로 합니다.[35][43]
활성화
대식세포는 T1H 및 T2와H 같은 T 도우미 세포의 다른 하위 집합과의 상호 작용을 통해 다양한 활성화 표현형을 달성할 수 있습니다.[18] 대식세포 활성화 표현형에는 광범위한 스펙트럼이 있지만 일반적으로 인정되는 두 가지 주요 표현형이 있습니다.[18] 고전적으로 활성화된 대식세포 또는 M1 대식세포와 대안적으로 활성화된 대식세포 또는 M2 대식세포입니다. M1 대식세포는 염증을 유발하는 반면, M2 대식세포는 대부분 항염증을 유발합니다.[18]
고전적인
T1H 세포는 숙주 세포 내에서 생존하고 복제할 수 있는 세포 내 병원체(예: 세포 내 박테리아), 특히 대식세포에 의해 식균된 후에도 복제되는 병원체에 대한 제1형 면역 반응의 일부로서 고전적인 대식세포 활성화에 중요한 역할을 합니다.[44] T1 세포의 TCR이 대식세포에서 특정 항원 펩티드 결합 MHC 클래스 II 분자를 인식한 후, T1 세포는 IFN-γ를 분비하고 2) 대식세포에서 CD40에 결합하는 CD40 리간드(CD40L)의 발현을 상향 조절합니다. 이 2개의 신호는 대식세포를 활성화시키고 산화질소(NO)와 과산화질소(O2-)와 같은 항균성 분자의 생성 증가를 통해 세포 내 병원체를 죽이는 능력을 향상시킵니다.[27][35] 이러한 T1H 세포에 의한 대식세포의 항균력 향상을 고전적 대식세포 활성화라고 하며, 활성화된 대식세포는 고전적 활성화 대식세포, 즉 M1 대식세포라고 합니다. M1 대식세포는 차례로 B7 분자와 MHC 그룹 II 분자를 통한 항원 제시를 상향 조절하여 T 세포에 도움을 주는 신호를 제공합니다.[45] T1 및 M1 대식세포의 활성화는 양의 피드백 루프이며, T1 세포의 IFN- γ은 대식세포의 CD40 발현을 상향 조절합니다. 대식세포의 CD40과 T 세포의 CD40L 사이의 상호작용은 대식세포를 활성화하여 IL-12를 분비하고 IL-12는 T1 세포의 IFN- γ 분비를 촉진합니다. 대식세포 항원 결합 MHC II와 TCR의 초기 접촉은 T세포 상의 IFN- γ 분비와 CD-40L의 대부분이 집중되는 두 세포 사이의 접점 역할을 하므로 T1 세포와 직접 상호 작용하는 대식세포만이 활성화될 가능성이 높습니다.
T1H 세포는 M1 대식세포를 활성화하는 것 외에도 Fas 리간드(FasL)와 림프독신 베타(Limphotoxin beta, LT-β)를 발현하여 더 이상 병원체를 죽일 수 없는 만성 감염 대식세포를 사멸시키는 데 도움을 줍니다.[35] 만성적으로 감염된 대식세포의 사멸은 다른 활성화된 대식세포에 의해 사멸될 수 있는 병원체를 세포외 공간으로 방출합니다.[35] T1H 세포는 또한 대식세포의 전구체인 더 많은 단핵구를 감염 부위로 모집하는 데 도움이 됩니다. T1은H TNF-α와 LT-α를 분비하여 단핵구가 쉽게 혈관에 결합하고 빠져나올 수 있도록 합니다.[35] 단핵구의 화학유인으로서 CCL2의 T1H 분비 T1H 세포에 의해 방출되는 IL-3와 GM-CSF는 골수에서 더 많은 단핵구 생성을 자극합니다.[35]
결핵균처럼 세포 내 병원체를 제거할 수 없을 때는 활성화된 T세포로 둘러싸인 감염된 대식세포의 응집체인 육아종 형성을 통해 병원체를 담게 됩니다.[46] 활성화된 림프구와 경계를 이루는 대식세포는 융합하여 T1세포와H 근접하여 항균력이 증가한 것으로 보이는 다핵 거대세포를 형성하는 경우가 많지만, 시간이 지남에 따라 중심부의 세포들은 죽기 시작하여 괴사조직을 형성합니다.[41][46]
대안
T2H 세포는 기생충과 같은 큰 세포외 병원체에 대한 제2형 면역 반응의 일부로서 대체 대식세포 활성화에 중요한 역할을 합니다.[35][47] T2H 세포는 IL-4와 IL-13을 분비하여 대식세포를 활성화하여 M2 대식세포가 됩니다.[47][48] M2 대식세포는 아르기닌을 오르니틴과 요소로 전환시키는 효소인 아르기나아제-1을 발현합니다.[47] 오르니틴은 부드러운 근육 수축을 증가시켜 벌레를 배출하는 데 도움이 되며 조직 및 상처 복구에도 참여합니다. 오르니틴은 콜라겐 합성에 필수적인 프롤린으로 더 대사될 수 있습니다.[47] M2 대식세포는 또한 다운스트림 염증 신호(IL-1RII)로 이어지지 않는 IL-1 수용체 길항제(IL-1RA)와 IL-1 수용체를 생성하여 염증을 감소시킬 수 있습니다.[35][49]
CD8+ 세포독성 세포와의 상호작용
적응 면역 활성화의 또 다른 부분은 MHC 그룹 I 분자에서 항원 펩티드의 교차 제시를 통해 CD8을+ 자극하는 것을 포함합니다. 연구에 따르면 전염증성 대식세포는 MHC 그룹 I 분자에서 항원의 교차 제시가 가능하지만 대식세포 교차 제시가 순진한 ï 또는 기억 CD8 T 세포 활성화에 역할을 하는지 여부는 여전히 불분명합니다.
B세포와의 상호작용
대식세포는 혈장 세포 동형 전환에 중요한 사이토카인 BAPF와 APRIL을 분비하는 것으로 나타났습니다. 골수에서 대식세포 전구체에 의해 분비되는 APRIL과 IL-6는 골수에 수용된 형질세포의 생존을 유지하는 데 도움이 됩니다.[51]
하위유형
활성화된 대식세포에는 여러 가지 형태가 있습니다.[18] 대식세포를 활성화하는 다양한 방법에도 불구하고, M1과 M2로 지정된 두 개의 주요 그룹이 있습니다. M1 대식세포는 앞서 언급했듯이(이전에는 고전적으로 활성화된 대식세포라고 함),[53] M1 "킬러" 대식세포는 LPS와 IFN-감마에 의해 활성화되고, 높은 수준의 IL-12와 낮은 수준의 IL-10을 분비합니다. M1 대식세포는 전염증, 살균 및 식세포 기능을 가지고 있습니다.[54] 이와 대조적으로 M2 "수리" 지정(대체 활성화된 대식세포라고도 함)은 상처 치유 및 조직 복구와 같은 건설적인 과정에서 기능하는 대식세포와 IL-10과 같은 항염증성 사이토카인을 생성하여 손상된 면역계 활성화를 차단하는 대식세포를 광범위하게 의미합니다. M2는 상주하는 조직 대식세포의 표현형으로 IL-4에 의해 더욱 상승될 수 있습니다. M2 대식세포는 높은 수준의 IL-10, TGF-베타 및 낮은 수준의 IL-12를 생성합니다. 종양 관련 대식세포는 주로 M2 표현형이며, 종양 성장을 적극적으로 촉진하는 것으로 보입니다.[55]
대식세포는 상처 성숙에 어떤 역할을 하는지에 따라 결정되는 다양한 표현형으로 존재합니다. 표현형은 주로 M1과 M2의 두 가지 주요 범주로 나눌 수 있습니다. M1 대식세포는 염증의 초기 단계에서 관찰되는 지배적인 표현형이며 인터페론 γ(IFN- γ), 종양 괴사 인자(TNF) 및 손상 관련 분자 패턴(DAMP)의 네 가지 주요 매개체에 의해 활성화됩니다. 이러한 매개체 분자는 친염증 반응을 일으켜 인터루킨-6 및 TNF와 같은 친염증성 사이토카인을 생성합니다. M1 대식세포와 달리 M2 대식세포는 인터류킨-4 또는 인터류킨-13의 첨가를 통해 항염증 반응을 분비합니다. 그들은 또한 상처 치유에 역할을 하며 재혈관 형성 및 재봉합에 필요합니다. M2 대식세포는 역할에 따라 M2a, M2b, M2c, M2d의 4가지 주요 유형으로 나뉩니다. M2 표현형이 어떻게 결정되는지는 아직 논의의 여지가 있지만 연구에 따르면 M2 표현형이 상처를 효율적으로 치유하는 데 가장 적합한 표현형에 적응할 수 있습니다.[54]
혈관 안정을 위해서는 M2 대식세포가 필요합니다. 그들은 혈관 내피 성장 인자-A와 TGF-β1을 생성합니다.[54] 급성 상처에서는 M1에서 M2 대식세포로의 표현형 이동이 있지만 만성 상처에서는 이러한 이동이 손상됩니다. 이러한 조절 장애는 M2 대식세포와 상처 복구에 도움이 되는 그에 상응하는 성장 인자를 불충분하게 만듭니다. 이러한 성장인자/항염증성 사이토카인의 부족과 M1 대식세포로부터의 전염증성 사이토카인의 과잉으로 만성적인 상처는 적시에 치유될 수 없습니다. 일반적으로 호중구가 파편/병원체를 먹은 후 세포자멸사를 수행하여 제거됩니다. 이 시점에서 염증이 필요하지 않고 M1은 M2(항염증)로 전환됩니다. 그러나 M1 대식세포가 세포자멸사를 겪은 호중구를 식균할 수 없거나 식균하지 않아 대식세포 이동과 염증이 증가함에 따라 조절 장애가 발생합니다.[54]
M1 및 M2 대식세포는 모두 죽상동맥경화증을 촉진하는 역할을 합니다. M1 대식세포는 염증에 의해 죽상경화증을 촉진합니다. M2 대식세포는 혈관에서 콜레스테롤을 제거할 수 있지만, 콜레스테롤이 산화되면 M2 대식세포는 죽상동맥경화증의 죽상동맥 플라크에 기여하는 세포자멸사 거품 세포가 됩니다.[56][57]
근육 재생의 역할
근육의 복구, 성장 및 재생에 있어 대식세포의 중요성을 이해하기 위한 첫 번째 단계는 손상 가능한 근육 사용의 시작과 함께 근육의 복구에 직접적인 영향을 미치지 않는 두 가지 "파동"의 대식세포가 있다는 것입니다. 초기 파동은 근육막 용해 및 막 염증을 유발하기에 충분한 근육 사용 증가 기간 동안 동반되는 식세포 집단으로, 손상된 근육 섬유의 내용물이 들어가 분해될 수 있습니다.[58][59][60] 이러한 조기 침윤성 식세포 대식세포는 어떤 형태의 근육세포 손상 또는 재장전이 시작된 후 약 24시간 후에 최고 농도에 도달합니다.[61] 48시간이 지나면 농도가 급격히 낮아집니다.[59] 두 번째 그룹은 재생 섬유 근처에 분포하는 비식세포 유형입니다. 이는 2일에서 4일 사이에 최고조에 달하고 근육 조직이 재건되는 동안 며칠 동안 상승 상태를 유지합니다.[59] 첫 번째 하위 집단은 근육을 회복하는 데 직접적인 이점이 없는 반면, 두 번째 비식세포 집단은 근육을 회복하는 데 직접적인 이점이 없습니다.
대식세포는 근육의 증식, 분화, 성장, 회복, 재생에 영향을 미치는 가용성 물질을 방출한다고 생각되지만, 현재 이러한 영향을 매개하기 위해 생성되는 인자는 알려져 있지 않습니다.[61] 대식세포가 조직의 회복을 촉진하는 데 관여하는 것은 근육 특이적인 것이 아니라, 부상 후 치유 과정 단계에서 다양한 조직에 축적되는 것으로 알려져 있습니다.[62]
상처 치유의 역할
대식세포는 상처 치유에 필수적입니다.[63] 그들은 다형핵 호중구를 부상 후 2일째에 상처에서 우세한 세포로 대체합니다.[64] 혈소판과 다른 세포에서 방출되는 성장인자에 의해 상처 부위로 유인된 혈류의 단핵구는 혈관벽을 통해 해당 부위로 들어갑니다.[65] 상처의 단핵구 수는 상처가 발생한 지 1일에서 1일 반 후에 최고조에 달합니다. 일단 상처 부위에 있으면, 단핵구는 대식세포로 성숙합니다. 비장에는 손상된 조직에 배치할 준비가 된 신체 단핵구의 절반이 비축되어 있습니다.[66][67]
대식세포의 주된 역할은 세균과 손상된 조직을 식균하는 것이고,[63] 이들은 단백질분해효소를 방출하여 손상된 조직을 제거하기도 합니다.[68] 대식세포는 또한 특히 상처 후 3일과 4일 동안 성장 인자 및 기타 사이토카인과 같은 많은 인자를 분비합니다. 이러한 요인들은 치유의 증식 단계에 관여하는 세포들을 그 부위로 끌어들입니다.[69] 또한 대식세포는 수축 단계를 억제할 수 있습니다.[70] 대식세포는 주변의 산소 함량이 낮아 자극을 받아 혈관신생을[71] 유도하고 속도를 높이는 인자를 만들고, 상처를 재상피화하고 육아조직을 만들고 새로운 세포외 기질을 깔아주는 세포도 자극합니다.[72][better source needed] 이러한 요인을 분비함으로써 대식세포는 상처 치유 과정을 다음 단계로 밀어내는 데 기여합니다.
사지 재생의 역할
과학자들은 물질의 잔해를 먹어 치울 뿐만 아니라 대식세포가 도롱뇽의 전형적인 사지 재생에 관여한다는 것을 밝혀냈습니다.[73][74] 그들은 도롱뇽에서 대식세포를 제거하는 것이 사지 재생의 실패와 흉터 반응을 초래한다는 것을 발견했습니다.[73][74]
철 항상성의 역할
위에서 설명한 바와 같이, 대식세포는 죽거나 죽은 세포와 세포 파편을 제거하는 데 핵심적인 역할을 합니다. 적혈구는 평균 120일의 수명을 가지므로 비장과 간의 대식세포에 의해 지속적으로 파괴되고 있습니다. 또한 대식세포는 거대분자를 집어삼킬 것이므로 비경구 철분의 약동학에서 중요한 역할을 합니다.[citation needed]
헤모글로빈에서 방출된 철은 내부적으로 페리틴에 저장되거나 페로포르틴을 통해 순환으로 방출됩니다. 전신 철분 수치가 상승하거나 염증이 있는 경우, 상승된 헵시딘 수치가 대식세포 페로포르틴 채널에 작용하여 대식세포 내에 철분이 잔류하게 됩니다.[citation needed]
색소 보유 역할

멜라노파지는 세포외 공간에서 유기체에 고유하거나 외인성(문신과 같은) 색소를 흡수할 수 있는 조직 상주 대식세포의 하위 집합입니다. 멜라노좀을 합성하고 다양한 발달 단계를 포함하는 수지상 접합 멜라닌 세포와 달리, 멜라노파지는 리소좀과 유사한 식세포에 식세포화된 멜라닌만을 축적합니다.[75][76] 이것은 죽은 진피 대식세포의 색소가 그들의 후계자에 의해 식균되어 문신이 같은 장소에 보존됨에 따라 반복적으로 발생합니다.[77]
조직 항상성의 역할
모든 조직은 스트로마 및 기능적 조직과 상호 연결을 즐기는 고유한 상주 대식세포 집단을 가지고 있습니다.[78][79] 이러한 상주하는 대식세포는 무균 상태(비이동성)이며 조직의 생리적 기능을 지원하는 필수 성장 인자(예: 내장의 대식세포-신경 교차)를 제공하고 [80]염증 손상으로부터 조직을 적극적으로 보호할 수 있습니다.[81]
신경관련 대식세포
신경 관련 대식세포 또는 NAM은 신경과 관련된 조직 상주 대식세포입니다. 이들 중 일부는 200μm에 이르는 길쭉한 형태를 가진 것으로 알려져 있습니다.
임상적 의의
대식세포는 식균 작용의 역할로 인해 면역계의 많은 질병에 관여합니다. 예를 들어, 그들은 많은 수의 질병으로 인해 발생할 수 있는 염증성 병변인 육아종의 형성에 참여합니다. 예를 들어, 대부분 드문, 비효과적인 식균 작용 및 대식세포 기능의 일부 장애가 설명되었습니다.[83]
세포내 병원체의 숙주로서
식세포 면역 세포로서의 역할에서 대식세포는 병원체를 집어삼켜 병원체를 파괴하는 역할을 합니다. 일부 병원체는 이 과정을 전복시키고 대신 대식세포 내부에 삽니다. 이는 병원체가 면역체계로부터 가려져 복제할 수 있는 환경을 제공합니다.[citation needed]
이러한 유형의 행동을 보이는 질병에는 결핵(Mycobacterium tuberculosis) 및 리슈마니아증(Leishmania species)이 있습니다.[citation needed]
대식세포는 세포 내 세균의 숙주가 될 가능성을 최소화하기 위해 미생물에 독성이 [84]있는 산화질소 및 활성산소 중간체 유도와 같은 방어 메커니즘을 진화시켰습니다. 또한 대식세포는 미생물의 영양소 공급을 제한하고 자가포식을 유도하는 능력을 발전시켰습니다.[85]
결핵
결핵의 원인균인 결핵균은 대식세포에 일단 휩싸이면 [86]세포 방어를 피하고 세포를 이용해 복제를 합니다. 최근의 증거는 결핵균의 폐 감염에 대한 반응으로 말초 대식세포가 M1 표현형으로 성숙함을 시사합니다. 대식세포 M1 표현형은 전염증성 사이토카인(IL-1β, TNF-α 및 IL-6)의 분비 증가와 감염 제거에 필수적인 해당 활성 증가를 특징으로 합니다.[1]
리슈마니아증
대식세포에 의한 식균작용이 일어나면 레이시마니아 기생충은 식균 액포에 있게 됩니다. 정상적인 상황에서 이 식세포 액포는 리소좀으로 발달하여 내용물이 소화됩니다. 레이시마니아는 이 과정을 바꾸고 파괴되는 것을 피합니다. 대신에 그들은 액포 안에 집을 만듭니다.[citation needed]
Chikungunya
관절에서 대식세포의 감염은 치쿤구니아(CHIKV 또는 치쿤구니아 바이러스에 의해 유발됨)의 급성기 동안 및 그 이후에 국소 염증과 관련이 있습니다.[87]
다른이들
아데노바이러스(분홍색 눈의 가장 흔한 원인)는 숙주 대식세포에 잠복해 있을 수 있으며, 초기 감염 후 6-18개월 동안 바이러스가 계속 배출됩니다.[citation needed]
Brucella spp. 식세포-리소좀 융합의 억제를 통해 대식세포에 잠복할 수 있으며, 브루셀라증(불응성 발열)을 유발합니다.[citation needed]
레지오넬라 폐렴의 원인균인 레지오넬라 뉴모필라도 대식세포 내에 거주합니다.[citation needed]
심장병
대식세포는 죽상동맥경화증의 진행성 플라크 병변을 만드는 데 관여하는 주요 세포입니다.[88]
대식세포의 초점 모집은 급성 심근경색이 발생한 후에 발생합니다. 이 대식세포는 찌꺼기, 세포 사멸 세포를 제거하고 조직 재생을 준비하는 기능을 합니다.[89] 대식세포는 저칼륨혈증 생쥐의 허혈성 심실 빈맥으로부터 보호합니다.[90]
HIV 감염
대식세포는 인간 면역결핍 바이러스(HIV) 감염에도 역할을 합니다. T 세포와 마찬가지로 대식세포도 HIV에 감염될 수 있으며, 심지어 몸 전체에서 지속적인 바이러스 복제의 저장소가 될 수 있습니다. HIV는 gp120이 CD4에 결합하고 두 번째 막 수용체인 CCR5(chemokine receptor)가 결합하여 대식세포로 들어갈 수 있습니다. 순환하는 단핵구와 대식세포 모두 바이러스의 저장소 역할을 합니다.[91] 대식세포는 CD4+ T 세포보다 HIV-1에 의한 감염에 더 잘 저항할 수 있지만, HIV 감염에 대한 민감도는 대식세포 아형에 따라 다릅니다.[92]
암
대식세포는 종양세포의 증식과 침입을 촉진하고, 종양혈관형성을 촉진하며, 항종양 면역세포를 억제함으로써 종양의 성장과 진행에 기여할 수 있습니다.[93][94] 대식세포에서 방출되는 종양괴사인자(TNF)-알파와 같은 염증성 화합물은 유전자 스위치 핵인자-카파 B를 활성화시킵니다. NF-κB는 종양 세포의 핵으로 들어가 세포자멸사를 멈추고 세포의 증식과 염증을 촉진하는 단백질의 생산을 켭니다. 또한, 대식세포는 혈관 내피 인자(VEGF), 종양 괴사 인자-알파(TNF-alpha), 대식세포 집락 자극 인자(M-CSF/CSF1) 및 IL-1 및 IL-6을 포함한 많은 친혈관생성 인자의 소스 역할을 [96]하여 종양 성장에 더 기여합니다.
대식세포는 많은 종양에 침투하는 것으로 나타났습니다. 그들의 수는 유방암, 자궁경부암, 방광암, 뇌암, 전립선암을 포함한 특정 암의 나쁜 예후와 상관관계가 있습니다.[97][98] 일부 종양은 종양 내 대식세포의 증폭 및 동원을 유발하는 M-CSF/CSF1, MCP-1/CCL2 및 Angiotensin II를 포함한 인자를 생성할 수도 있습니다.[99][100][101] 또한 종양을 배출하는 림프절의 피막하 동 대식세포는 종양 유래 물질의 확산을 억제하여 암의 진행을 억제할 수 있습니다.[102]
암치료법
실험 연구에 따르면 대식세포는 수술, 화학 요법, 방사선 요법, 면역 요법 및 표적 요법을 포함한 모든 치료 양식에 영향을 미칠 수 있습니다.[94][103][104] 대식세포는 치료 결과에 긍정적이고 부정적인 영향을 미칠 수 있습니다. 대식세포는 다양한 방식으로 보호할 수 있습니다: 이러한 세포를 죽이는 치료법에 따라 죽은 종양 세포를 제거할 수 있습니다(식세포작용이라고 불리는 과정에서). 일부 항암제의 약물 저장소 역할을 할 수 있습니다;[105] 또한 항종양 면역을 촉진하는 일부 치료법에 의해 활성화될 수 있습니다.[106] 대식세포는 또한 여러 가지 방법으로 해로울 수 있습니다. 예를 들어, 다양한 화학 요법,[107][108] 방사선[109][110] 요법 및 면역 요법을 억제할 수 있습니다.[111][112] 현재 암 환자들은 대식세포가 종양의 진행을 조절할 수 있기 때문에 이들 세포의 수를 줄이거나 표현형을 조작하는 치료 전략을 연구하고 있습니다.[113][114] 그러나 대식세포는 항체 매개 세포독성(ADCC)에도 관여하며 이 메커니즘은 특정 암 면역치료 항체에 중요한 것으로 제안되었습니다.[115]
비만
비만 지방 조직 내 친염증성 대식세포의 증가는 인슐린 저항성 및 제2형 당뇨병을 포함한 비만 합병증의 원인이 되는 것으로 관찰되었습니다.[116]
따라서 지방 조직 대식세포의 염증 상태 조절은 비만 관련 질병을 치료하기 위한 가능한 치료 표적으로 간주되어 왔습니다.[117] 지방조직 대식세포는 교감신경에 의해 항염증 항상성 조절을 받지만, ADRB2 유전자 녹아웃 마우스를 이용한 실험은 이러한 효과가 직접적인 베타-2 아드레날린 수용체 활성화가 아닌 지방세포 기능의 조절을 통해 간접적으로 발휘된다는 것을 나타냅니다. 대식세포의 아드레날린 자극이 지방 조직 염증에 영향을 미치거나 비만의 기능에 영향을 미치기에 충분하지 않을 수 있음을 시사합니다.[118]
CCR2 결핍 마우스의 지방(지방) 조직 내에서, 에오시노필의 수가 증가하고, 더 큰 대체 대식세포 활성화 및 제2형 사이토카인 발현 경향이 있습니다. 게다가, 이 효과는 쥐들이 고지방 식단으로 비만이 되었을 때 과장되었습니다.[119] 이는 부분적으로 지방세포(지방세포)의 괴사에 의해 유도된 대식세포의 표현형 전환에 의해 발생합니다. 비만인 개인에서 일부 지방 세포는 파열되어 괴사를 겪으며, 이로 인해 거주 M2 대식세포가 M1 표현형으로 전환됩니다. 이는 비만과 연관된 저등급 전신 만성 염증 상태의 원인 중 하나입니다.[120][121]
장내대식세포
장 대식세포는 조직 대식세포와 구조가 매우 유사하지만 소화관에 있는 자연 환경을 고려하여 특정 특성과 기능을 진화시켜 왔습니다. 대식세포와 장내 대식세포는 높은 가소성을 가지고 있어 환경에 따라 표현형이 변경됩니다.[122] 장 대식세포와 마찬가지로 장 대식세포도 분화된 단핵구이지만 장 대식세포는 장내 미생물군집과 공존해야 합니다. 이것은 장에서 발견되는 박테리아가 "자기"로 인식되지 않고 대식세포에 의한 식균작용의 잠재적인 표적이 될 수 있다는 점을 고려할 때 도전입니다.[123]
장내 세균의 파괴를 막기 위해 장내 대식세포는 다른 대식세포와 비교하여 핵심적인 차이점을 발전시켰습니다. 일차적으로 장내 대식세포는 염증 반응을 유도하지 않습니다. 조직 대식세포가 IL-1, IL-6 및 TNF-α와 같은 다양한 염증성 사이토카인을 방출하는 반면, 장 대식세포는 염증성 사이토카인을 생성하거나 분비하지 않습니다. 이러한 변화는 직접적으로 장내 대식세포 환경에 의해 발생합니다. 주변 장 상피세포는 TGF-β를 방출하는데, 이는 전염증성 대식세포에서 비염증성 대식세포로의 변화를 유도합니다.[123]
장 대식세포에서 염증 반응이 하향 조절됨에도 불구하고 식균 작용은 여전히 수행됩니다. 장내 대식세포가 세균인 S. typhimurium과 E. coli를 효과적으로 식균할 수 있기 때문에 식균 효율이 떨어지지 않지만, 장내 대식세포는 식균 후에도 여전히 사이토카인을 방출하지 않습니다. 또한 장내 대식세포는 지질다당류(LPS), IgA, IgG 수용체를 발현하지 않습니다.[124] LPS 수용체의 부족은 장내 대식세포가 장내 미생물군집의 미생물 관련 분자 패턴(MAPS/PAMS)을 감지하지 못하기 때문에 장에 중요합니다. 또한 IL-2 및 IL-3 성장 인자 수용체를 발현하지 않습니다.[123]
질병에서의 역할
장내 대식세포는 크론병(CD)과 궤양성 대장염(UC)과 같은 염증성 장질환(IBD)에 역할을 하는 것으로 나타났습니다. 건강한 장에서는 장내 대식세포가 장내 염증 반응을 제한하지만, 질병 상태에서는 장내 대식세포 수와 다양성이 변경됩니다. 이로 인해 장에 염증이 생기고 IBD의 질병 증상이 나타납니다. 장내 대식세포는 장내 항상성을 유지하는 데 중요합니다. 염증이나 병원체의 존재는 이 항상성을 변화시키고 동시에 장내 대식세포를 변화시킵니다.[125] 새로운 단핵구의 모집 또는 이미 존재하는 장 대식세포의 변화에 의한 장 대식세포의 변화에 대한 메커니즘은 아직 결정되지 않았습니다.[124]
또한 새로운 연구에 따르면 대식세포는 세포외 소포를 방출하여 박테리아에 대한 철 접근을 제한하여 패혈증 결과를 개선합니다.[126]
미디어
역사
이 구간은 확장이 필요합니다. 추가하면 도움을 줄 수 있습니다. (2018년 3월) |
대식세포는 19세기 말 엘리 메치니코프에 의해 처음 발견되었습니다.[127]엘리 메치니코프(Elie Metchnikoff)는 철학적 통찰과 생명체에 대한 진화 연구를 결합하여 대식세포의 가지에 혁명을 일으켰습니다.[128] 나중에 1960년대에 Van Furth는 성인의 순환하는 혈액 단핵구가 모든 조직 대식세포의 기원을 허용한다는 아이디어를 제안했습니다.[129] 최근 몇 년 동안 대식세포에 대한 출판으로 사람들은 다수의 상주 조직 대식세포가 배아 발달 단계에서 형성되기 때문에 혈액 단핵구와 독립적이라고 믿게 되었습니다.[130] 21세기 내에, (조직에 존재하는) 대식세포의 기원에 관한 모든 생각들은 생리학적으로 복잡한 유기체가 혈액 단핵구에 의존할 필요가 없는 메커니즘에 의해 독립적으로 대식세포를 형성한다는 것을 암시하기 위해 함께 편찬됩니다.[131]
참고 항목
참고문헌
- ^ a b Mahla RS, Kumar A, Tutill HJ, Krishnaji ST, Sathyamoorthy B, Noursadeghi M, et al. (January 2021). "NIX-mediated mitophagy regulate metabolic reprogramming in phagocytic cells during mycobacterial infection". Tuberculosis. 126 (January): 102046. doi:10.1016/j.tube.2020.102046. PMID 33421909. S2CID 231437641.
- ^ "Regenerative Medicine Partnership in Education". Archived from the original on 25 April 2015. Retrieved 7 May 2015.
- ^ Nahrendorf M, Hoyer FF, Meerwaldt AE, van Leent MM, Senders ML, Calcagno C, et al. (October 2020). "Imaging Cardiovascular and Lung Macrophages With the Positron Emission Tomography Sensor 64Cu-Macrin in Mice, Rabbits, and Pigs". Circulation: Cardiovascular Imaging. 13 (10): e010586. doi:10.1161/CIRCIMAGING.120.010586. PMC 7583675. PMID 33076700.
- ^ Ovchinnikov DA (September 2008). "Macrophages in the embryo and beyond: much more than just giant phagocytes". Genesis. 46 (9): 447–462. doi:10.1002/dvg.20417. PMID 18781633. S2CID 38894501.
Macrophages are present essentially in all tissues, beginning with embryonic development and, in addition to their role in host defense and in the clearance of apoptotic cells, are being increasingly recognized for their trophic function and role in regeneration.
- ^ Mills CD (2012). "M1 and M2 Macrophages: Oracles of Health and Disease". Critical Reviews in Immunology. 32 (6): 463–488. doi:10.1615/CritRevImmunol.v32.i6.10. PMID 23428224.
- ^ Murphy K, Weaver C (2006). Janeway's immunobiology. Garland Science, New York. pp. 464, 904. ISBN 978-0-8153-4551-0.
- ^ Ransohoff RM (July 2016). "A polarizing question: do M1 and M2 microglia exist?". Nature Neuroscience. 19 (8): 987–991. doi:10.1038/nn.4338. PMID 27459405. S2CID 27541569.
- ^ Krombach F, Münzing S, Allmeling AM, Gerlach JT, Behr J, Dörger M (September 1997). "Cell size of alveolar macrophages: an interspecies comparison". Environmental Health Perspectives. 105 (Suppl 5): 1261–1263. doi:10.2307/3433544. JSTOR 3433544. PMC 1470168. PMID 9400735.
- ^ Khazen W, M'bika JP, Tomkiewicz C, Benelli C, Chany C, Achour A, et al. (October 2005). "Expression of macrophage-selective markers in human and rodent adipocytes". FEBS Letters. 579 (25): 5631–5634. doi:10.1016/j.febslet.2005.09.032. PMID 16213494. S2CID 6066984.
- ^ Zalkind S (2001). Ilya Mechnikov: His Life and Work. Honolulu, Hawaii: University Press of the Pacific. pp. 78, 210. ISBN 978-0-89875-622-7.
- ^ Shapouri-Moghaddam A, Mohammadian S, Vazini H, Taghadosi M, Esmaeili SA, Mardani F, et al. (September 2018). "Macrophage plasticity, polarization, and function in health and disease". Journal of Cellular Physiology. 233 (9): 6425–6440. doi:10.1002/jcp.26429. PMID 29319160. S2CID 3621509.
- ^ Lote CJ. Principles of Renal Physiology, 5th edition. Springer. p. 37.
- ^ Shirazi S, Ravindran S, Cooper LF (December 2022). "Topography-mediated immunomodulation in osseointegration; Ally or Enemy". Biomaterials. 291: 121903. doi:10.1016/j.biomaterials.2022.121903. PMC 10148651. PMID 36410109.
- ^ Bonnardel J, Da Silva C, Henri S, Tamoutounour S, Chasson L, Montañana-Sanchis F, et al. (May 2015). "Innate and adaptive immune functions of peyer's patch monocyte-derived cells". Cell Reports. 11 (5): 770–784. doi:10.1016/j.celrep.2015.03.067. PMID 25921539.
- ^ Siret C, van Lessen M, Bavais J, Jeong HW, Reddy Samawar SK, Kapupara K, et al. (2022). "Deciphering the heterogeneity of the Lyve1+ perivascular macrophages in the mouse brain". Nature Communications. 13 (1): 7366. Bibcode:2022NatCo..13.7366S. doi:10.1038/s41467-022-35166-9. PMC 9712536. PMID 36450771.
- ^ Nes WD, Lukyanenko YO, Jia ZH, Quideau S, Howald WN, Pratum TK, et al. (March 2000). "Identification of the lipophilic factor produced by macrophages that stimulates steroidogenesis". Endocrinology. 141 (3): 953–958. doi:10.1210/endo.141.3.7350. PMID 10698170.
- ^ Hulsmans M, Clauss S, Xiao L, Aguirre AD, King KR, Hanley A, et al. (April 2017). "Macrophages Facilitate Electrical Conduction in the Heart". Cell. 169 (3): 510–522.e20. doi:10.1016/j.cell.2017.03.050. PMC 5474950. PMID 28431249.
- ^ a b c d e Mosser DM, Edwards JP (December 2008). "Exploring the full spectrum of macrophage activation". Nature Reviews. Immunology. 8 (12): 958–969. doi:10.1038/nri2448. PMC 2724991. PMID 19029990.
- ^ Perdiguero EG, Geissmann F (January 2016). "The development and maintenance of resident macrophages". Nature Immunology. 17 (1): 2–8. doi:10.1038/ni.3341. PMC 4950995. PMID 26681456.
- ^ Ginhoux F, Guilliams M (March 2016). "Tissue-Resident Macrophage Ontogeny and Homeostasis". Immunity. 44 (3): 439–449. doi:10.1016/j.immuni.2016.02.024. PMID 26982352.
- ^ Pittet MJ, Nahrendorf M, Swirski FK (June 2014). "The journey from stem cell to macrophage". Annals of the New York Academy of Sciences. 1319 (1): 1–18. Bibcode:2014NYASA1319....1P. doi:10.1111/nyas.12393. PMC 4074243. PMID 24673186.
- ^ Wang M, Yang Y, Cansever D, Wang Y, Kantores C, Messiaen S, et al. (January 2021). "Two populations of self-maintaining monocyte-independent macrophages exist in adult epididymis and testis". Proceedings of the National Academy of Sciences of the United States of America. 118 (1): e2013686117. Bibcode:2021PNAS..11813686W. doi:10.1073/pnas.2013686117. PMC 7817195. PMID 33372158.
- ^ a b c Eming SA, Krieg T, Davidson JM (March 2007). "Inflammation in wound repair: molecular and cellular mechanisms". The Journal of Investigative Dermatology. 127 (3): 514–25. doi:10.1038/sj.jid.5700701. PMID 17299434.
=Monocytes/macrophages. Unless stimuli for neutrophil recruitment persist at the wound site, the neutrophil infiltration ceases after few days, and expended neutrophils are themselves phagocytosed by macrophages, which are present at the wound side within 2 days after injury.
- ^ Monteith AJ, Miller JM, Maxwell CN, Chazin WJ, Skaar EP (September 2021). "Neutrophil extracellular traps enhance macrophage killing of bacterial pathogens". Science Advances. 7 (37): eabj2101. Bibcode:2021SciA....7.2101M. doi:10.1126/sciadv.abj2101. PMC 8442908. PMID 34516771.
- ^ Verma N, Saraf S (15 November 2017). "A Role of Macrophages: An Overview". Journal of Drug Delivery and Therapeutics. 7 (6): 91–103. doi:10.22270/jddt.v7i6.1521. ISSN 2250-1177.
- ^ YashRoy RC (2000). "Hijacking of Macrophages by Salmonella (310r) Through 'Types III' Secretion Like Exocytotic Signalling : A Mechanism for Infection of Chicken Ileum". Indian Journal of Poultry Science. 35 (3): 276–281.
- ^ a b c d e f g Arango Duque G, Descoteaux A (7 October 2014). "Macrophage cytokines: involvement in immunity and infectious diseases". Frontiers in Immunology. 5: 491. doi:10.3389/fimmu.2014.00491. PMC 4188125. PMID 25339958.
- ^ a b c d e Punt J, Stranford S, Jones P, Owen J (25 May 2018). Kuby Immunology (8th ed.). New York, New York: W. H. Freeman. ISBN 978-1-4641-8978-4.
- ^ a b c Fu YL, Harrison RE (29 April 2021). "Microbial Phagocytic Receptors and Their Potential Involvement in Cytokine Induction in Macrophages". Frontiers in Immunology. 12: 662063. doi:10.3389/fimmu.2021.662063. PMC 8117099. PMID 33995386.
- ^ a b Hirayama D, Iida T, Nakase H (December 2017). "The Phagocytic Function of Macrophage-Enforcing Innate Immunity and Tissue Homeostasis". International Journal of Molecular Sciences. 19 (1): 92. doi:10.3390/ijms19010092. PMC 5796042. PMID 29286292.
- ^ Uribe-Querol E, Rosales C (2 June 2020). "Phagocytosis: Our Current Understanding of a Universal Biological Process". Frontiers in Immunology. 11: 1066. doi:10.3389/fimmu.2020.01066. PMC 7280488. PMID 32582172.
- ^ Law SK (1 January 1988). "C3 receptors on macrophages". Journal of Cell Science. Supplement. 9 (Supplement_9): 67–97. doi:10.1242/jcs.1988.Supplement_9.4. PMID 2978518. S2CID 29387085.
- ^ Forman HJ, Torres M (December 2002). "Reactive oxygen species and cell signaling: respiratory burst in macrophage signaling". American Journal of Respiratory and Critical Care Medicine. 166 (12 Pt 2): S4–S8. doi:10.1164/rccm.2206007. PMID 12471082. S2CID 22246117.
- ^ Liu T, Zhang L, Joo D, Sun SC (14 July 2017). "NF-κB signaling in inflammation". Signal Transduction and Targeted Therapy. 2 (1): 17023–. doi:10.1038/sigtrans.2017.23. PMC 5661633. PMID 29158945.
- ^ a b c d e f g h i j k l m n o p q r Murphy K, Weaver C, Berg L (2022). Janeway's Immunobiology (10th ed.). New York, New York: W. W. Norton & Company. ISBN 978-0-393-88487-6.
- ^ Eming SA, Krieg T, Davidson JM (March 2007). "Inflammation in wound repair: molecular and cellular mechanisms". The Journal of Investigative Dermatology. 127 (3): 514–525. doi:10.1038/sj.jid.5700701. PMID 17299434.
- ^ Mezouar S, Mege JL (July 2020). "Changing the paradigm of IFN-γ at the interface between innate and adaptive immunity: Macrophage-derived IFN-γ". Journal of Leukocyte Biology. 108 (1): 419–426. doi:10.1002/JLB.4MIR0420-619RR. PMID 32531848. S2CID 219622032.
- ^ Kress H, Stelzer EH, Holzer D, Buss F, Griffiths G, Rohrbach A (July 2007). "Filopodia act as phagocytic tentacles and pull with discrete steps and a load-dependent velocity". Proceedings of the National Academy of Sciences of the United States of America. 104 (28): 11633–11638. Bibcode:2007PNAS..10411633K. doi:10.1073/pnas.0702449104. PMC 1913848. PMID 17620618.
- ^ a b c Guerriero JL (2019). "Macrophages: Their Untold Story in T Cell Activation and Function". International Review of Cell and Molecular Biology. 342. Elsevier: 73–93. doi:10.1016/bs.ircmb.2018.07.001. ISBN 978-0-12-815381-9. PMID 30635094.
- ^ a b c Itano AA, Jenkins MK (August 2003). "Antigen presentation to naive CD4 T cells in the lymph node". Nature Immunology. 4 (8): 733–739. doi:10.1038/ni957. PMID 12888794. S2CID 10305140.
- ^ a b c Murphy K, Weaver C (2016). Janeway's Immunobiology (9th ed.). New York, New York: Garland Science. pp. 363–364. ISBN 978-0-8153-4505-3.
- ^ a b Gray EE, Cyster JG (2012). "Lymph node macrophages". Journal of Innate Immunity. 4 (5–6): 424–436. doi:10.1159/000337007. PMC 3574571. PMID 22488251.
- ^ Abbas AK (September 2020). "The Surprising Story of IL-2". The American Journal of Pathology. 190 (9): 1776–1781. doi:10.1016/j.ajpath.2020.05.007. PMID 32828360. S2CID 221280663.
- ^ Annunziato F, Romagnani C, Romagnani S (March 2015). "The 3 major types of innate and adaptive cell-mediated effector immunity". The Journal of Allergy and Clinical Immunology. 135 (3): 626–635. doi:10.1016/j.jaci.2014.11.001. PMID 25528359.
- ^ a b c Cai H, Zhang Y, Wang J, Gu J (23 June 2021). "Defects in Macrophage Reprogramming in Cancer Therapy: The Negative Impact of PD-L1/PD-1". Frontiers in Immunology. 12: 690869. doi:10.3389/fimmu.2021.690869. PMC 8260839. PMID 34248982.
- ^ a b Hilhorst M, Shirai T, Berry G, Goronzy JJ, Weyand CM (2014). "T cell-macrophage interactions and granuloma formation in vasculitis". Frontiers in Immunology. 5: 432. doi:10.3389/fimmu.2014.00432. PMC 4162471. PMID 25309534.
- ^ a b c d Rolot M, Dewals BG (2 July 2018). "Macrophage Activation and Functions during Helminth Infection: Recent Advances from the Laboratory Mouse". Journal of Immunology Research. 2018: 2790627. doi:10.1155/2018/2790627. PMC 6051086. PMID 30057915.
- ^ Gordon S (January 2003). "Alternative activation of macrophages". Nature Reviews. Immunology. 3 (1): 23–35. doi:10.1038/nri978. PMID 12511873. S2CID 23185583.
- ^ Peters VA, Joesting JJ, Freund GG (August 2013). "IL-1 receptor 2 (IL-1R2) and its role in immune regulation". Brain, Behavior, and Immunity. 32: 1–8. doi:10.1016/j.bbi.2012.11.006. PMC 3610842. PMID 23195532.
- ^ Muntjewerff EM, Meesters LD, van den Bogaart G (8 July 2020). "Antigen Cross-Presentation by Macrophages". Frontiers in Immunology. 11: 1276. doi:10.3389/fimmu.2020.01276. PMC 7360722. PMID 32733446.
- ^ Xu W, Banchereau J (January 2014). "The antigen presenting cells instruct plasma cell differentiation". Frontiers in Immunology. 4: 504. doi:10.3389/fimmu.2013.00504. PMC 3880943. PMID 24432021.
- ^ Cotran RS, Kumar V, Collins T (1999). Robbins Pathologic Basis of Disease. Philadelphia: W.B Saunders Company. ISBN 978-0-7216-7335-6.
- ^ "The lymphocyte story". New Scientist (1605). Retrieved 13 September 2007.
- ^ a b c d Hesketh M, Sahin KB, West ZE, Murray RZ (July 2017). "Macrophage Phenotypes Regulate Scar Formation and Chronic Wound Healing". International Journal of Molecular Sciences. 18 (7): 1545. doi:10.3390/ijms18071545. PMC 5536033. PMID 28714933.
- ^ Galdiero MR, Garlanda C, Jaillon S, Marone G, Mantovani A (July 2013). "Tumor associated macrophages and neutrophils in tumor progression". Journal of Cellular Physiology. 228 (7): 1404–1412. doi:10.1002/jcp.24260. PMID 23065796. S2CID 41189572.
- ^ Hotamisligil GS (April 2010). "Endoplasmic reticulum stress and atherosclerosis". Nature Medicine. 16 (4): 396–399. doi:10.1038/nm0410-396. PMC 2897068. PMID 20376052.
- ^ Oh J, Riek AE, Weng S, Petty M, Kim D, Colonna M, et al. (April 2012). "Endoplasmic reticulum stress controls M2 macrophage differentiation and foam cell formation". The Journal of Biological Chemistry. 287 (15): 11629–11641. doi:10.1074/jbc.M111.338673. PMC 3320912. PMID 22356914.
- ^ Krippendorf BB, Riley DA (January 1993). "Distinguishing unloading- versus reloading-induced changes in rat soleus muscle". Muscle & Nerve. 16 (1): 99–108. doi:10.1002/mus.880160116. PMID 8423838. S2CID 23012375.
- ^ a b c St Pierre BA, Tidball JG (July 1994). "Differential response of macrophage subpopulations to soleus muscle reloading after rat hindlimb suspension". Journal of Applied Physiology. 77 (1): 290–297. doi:10.1152/jappl.1994.77.1.290. PMID 7961247.
- ^ Tidball JG, Berchenko E, Frenette J (April 1999). "Macrophage invasion does not contribute to muscle membrane injury during inflammation". Journal of Leukocyte Biology. 65 (4): 492–498. doi:10.1002/jlb.65.4.492. PMID 10204578. S2CID 23315528.
- ^ a b Schiaffino S, Partridge T (2008). Skeletal Muscle Repair and Regeneration. Advances in Muscle Research. Vol. 3.
- ^ Bréchot N, Gomez E, Bignon M, Khallou-Laschet J, Dussiot M, Cazes A, et al. (2008). "Modulation of macrophage activation state protects tissue from necrosis during critical limb ischemia in thrombospondin-1-deficient mice". PLOS ONE. 3 (12): e3950. Bibcode:2008PLoSO...3.3950B. doi:10.1371/journal.pone.0003950. PMC 2597179. PMID 19079608.
- ^ a b 데 라 토레 J., 숄라 A. (2006). 상처 치유: 만성적인 상처. Emedicine.com . 2008년 1월 20일 접속.
- ^ "The phases of cutaneous wound healing" (PDF). Expert Reviews in Molecular Medicine. 5. Cambridge University Press. 21 March 2003. Archived from the original (PDF) on 17 December 2008.
- ^ Lorenz HP, Longaker MT (2003). "Wounds: biology, pathology, and management." (PDF). In Li M, Norton JA, Bollinger RR, Chang AE, Lowry SF, Mulvihill SJ, Pass HI, Thompson RW (eds.). Essential practice of surgery. New York, NY: Springer. pp. 77–88. ISBN 978-0-387-22744-3. Archived from the original (PDF) on 31 October 2005.
- ^ Swirski FK, Nahrendorf M, Etzrodt M, Wildgruber M, Cortez-Retamozo V, Panizzi P, et al. (July 2009). "Identification of splenic reservoir monocytes and their deployment to inflammatory sites". Science. 325 (5940): 612–616. Bibcode:2009Sci...325..612S. doi:10.1126/science.1175202. PMC 2803111. PMID 19644120.
- ^ Jia T, Pamer EG (July 2009). "Immunology. Dispensable but not irrelevant". Science. 325 (5940): 549–550. Bibcode:2009Sci...325..549J. doi:10.1126/science.1178329. PMC 2917045. PMID 19644100.
- ^ Deodhar AK, Rana RE (1997). "Surgical physiology of wound healing: a review". Journal of Postgraduate Medicine. 43 (2): 52–56. PMID 10740722.
- ^ 로젠버그 L., 드 라 토레 J. (2006). 상처 치유, 성장 인자. Emedicine.com . 2008년 1월 20일 접속.
- ^ Newton PM, Watson JA, Wolowacz RG, Wood EJ (August 2004). "Macrophages restrain contraction of an in vitro wound healing model". Inflammation. 28 (4): 207–214. doi:10.1023/B:IFLA.0000049045.41784.59. PMID 15673162. S2CID 9612298.
- ^ Greenhalgh DG (September 1998). "The role of apoptosis in wound healing". The International Journal of Biochemistry & Cell Biology. 30 (9): 1019–1030. doi:10.1016/S1357-2725(98)00058-2. PMID 9785465.
- ^ Stashak TS, Farstvedt E, Othic A (June 2004). "Update on wound dressings: Indications and best use". Clinical Techniques in Equine Practice. 3 (2): 148–163. doi:10.1053/j.ctep.2004.08.006.
- ^ a b Souppouris A (23 May 2013). "Scientists identify cell that could hold the secret to limb regeneration". the verge.com.
Researchers have identified a cell that aids limb regrowth in Salamanders. Macrophages are a type of repairing cell that devour dead cells and pathogens, and trigger other immune cells to respond to pathogens.
- ^ a b Godwin JW, Pinto AR, Rosenthal NA (June 2013). "Macrophages are required for adult salamander limb regeneration". Proceedings of the National Academy of Sciences of the United States of America. 110 (23): 9415–9420. Bibcode:2013PNAS..110.9415G. doi:10.1073/pnas.1300290110. PMC 3677454. PMID 23690624.
- ^ Mishima Y (October 1967). "Lysosomes in malanin phagocytosis and synthesis". Nature. 216 (5110): 67. Bibcode:1967Natur.216...67M. doi:10.1038/216067a0. PMID 6050674. S2CID 4285140.
- ^ Mishima Y (January 1966). "Cellular and subcellular differentiation of melanin phagocytosis and synthesis by lysosomal and melanosomal activity". The Journal of Investigative Dermatology. 46 (1): 70–75. doi:10.1038/jid.1966.11. PMID 5905254.
- ^ Baranska A, Shawket A, Jouve M, Baratin M, Malosse C, Voluzan O, et al. (April 2018). "Unveiling skin macrophage dynamics explains both tattoo persistence and strenuous removal". The Journal of Experimental Medicine. 215 (4): 1115–1133. doi:10.1084/jem.20171608. PMC 5881467. PMID 29511065.
- ^ Okabe Y, Medzhitov R (May 2014). "Tissue-specific signals control reversible program of localization and functional polarization of macrophages". Cell. 157 (4): 832–844. doi:10.1016/j.cell.2014.04.016. PMC 4137874. PMID 24792964.
- ^ Gosselin D, Link VM, Romanoski CE, Fonseca GJ, Eichenfield DZ, Spann NJ, et al. (December 2014). "Environment drives selection and function of enhancers controlling tissue-specific macrophage identities". Cell. 159 (6): 1327–1340. doi:10.1016/j.cell.2014.11.023. PMC 4364385. PMID 25480297.
- ^ Muller PA, Koscsó B, Rajani GM, Stevanovic K, Berres ML, Hashimoto D, et al. (July 2014). "Crosstalk between muscularis macrophages and enteric neurons regulates gastrointestinal motility". Cell. 158 (2): 300–313. doi:10.1016/j.cell.2014.04.050. PMC 4149228. PMID 25036630.
- ^ Uderhardt S, Martins AJ, Tsang JS, Lämmermann T, Germain RN (April 2019). "Resident Macrophages Cloak Tissue Microlesions to Prevent Neutrophil-Driven Inflammatory Damage". Cell. 177 (3): 541–555.e17. doi:10.1016/j.cell.2019.02.028. PMC 6474841. PMID 30955887.
- ^ Kolter J, Kierdorf K, Henneke P (January 2020). "Origin and Differentiation of Nerve-Associated Macrophages". Journal of Immunology. 204 (2): 271–279. doi:10.4049/jimmunol.1901077. PMID 31907269. S2CID 210043405.
- ^ Wolf AJ, Underhill DM (2014). "Phagocytosis". Macrophages: Biology and Role in the Pathology of Diseases. Springer New York. pp. 91–109. doi:10.1007/978-1-4939-1311-4_5. ISBN 978-1-4939-1310-7.
- ^ Herb M, Schramm M (February 2021). "Functions of ROS in Macrophages and Antimicrobial Immunity". Antioxidants. 10 (2): 313. doi:10.3390/antiox10020313. PMC 7923022. PMID 33669824.
- ^ Weiss G, Schaible UE (March 2015). "Macrophage defense mechanisms against intracellular bacteria". Immunological Reviews. 264 (1): 182–203. doi:10.1111/imr.12266. PMC 4368383. PMID 25703560.
- ^ Ryan KJ, Ray CG, eds. (2004). Sherris Medical Microbiology (4th ed.). McGraw Hill. ISBN 978-0-8385-8529-0.
- ^ Dupuis-Maguiraga L, Noret M, Brun S, Le Grand R, Gras G, Roques P (2012). "Chikungunya disease: infection-associated markers from the acute to the chronic phase of arbovirus-induced arthralgia". PLOS Neglected Tropical Diseases. 6 (3): e1446. doi:10.1371/journal.pntd.0001446. PMC 3313943. PMID 22479654.
- ^ Lucas AD, Greaves DR (November 2001). "Atherosclerosis: role of chemokines and macrophages". Expert Reviews in Molecular Medicine. 3 (25): 1–18. doi:10.1017/S1462399401003696. PMID 14585150. S2CID 8952545.
- ^ Frantz S, Nahrendorf M (May 2014). "Cardiac macrophages and their role in ischaemic heart disease". Cardiovascular Research. 102 (2): 240–248. doi:10.1093/cvr/cvu025. PMC 3989449. PMID 24501331.
- ^ Grune J, Lewis AJ, Yamazoe M, Hulsmans M, Rohde D, Xiao L, et al. (July 2022). "Neutrophils incite and macrophages avert electrical storm after myocardial infarction". Nature Cardiovascular Research. 1 (7): 649–664. doi:10.1038/s44161-022-00094-w. PMC 9410341. PMID 36034743. S2CID 250475623.
- ^ Bol SM, Cobos-Jiménez V, Kootstra NA, van't Wout AB (February 2011). "Macrophage". Future Virology. 6 (2): 187–208. doi:10.2217/fvl.10.93.
- ^ Koppensteiner H, Brack-Werner R, Schindler M (October 2012). "Macrophages and their relevance in Human Immunodeficiency Virus Type I infection". Retrovirology. 9 (1): 82. doi:10.1186/1742-4690-9-82. PMC 3484033. PMID 23035819.
- ^ Qian BZ, Pollard JW (April 2010). "Macrophage diversity enhances tumor progression and metastasis". Cell. 141 (1): 39–51. doi:10.1016/j.cell.2010.03.014. PMC 4994190. PMID 20371344.
- ^ a b Engblom C, Pfirschke C, Pittet MJ (July 2016). "The role of myeloid cells in cancer therapies". Nature Reviews. Cancer. 16 (7): 447–462. doi:10.1038/nrc.2016.54. PMID 27339708. S2CID 21924175.
- ^ Stix G (July 2007). "A malignant flame. Understanding chronic inflammation, which contributes to heart disease, Alzheimer's and a variety of other ailments, may be a key to unlocking the mysteries of cancer". Scientific American. 297 (1): 60–67. Bibcode:2007SciAm.297a..60S. doi:10.1038/scientificamerican0707-60. PMID 17695843.
- ^ Lin EY, Li JF, Gnatovskiy L, Deng Y, Zhu L, Grzesik DA, et al. (December 2006). "Macrophages regulate the angiogenic switch in a mouse model of breast cancer". Cancer Research. 66 (23): 11238–11246. doi:10.1158/0008-5472.can-06-1278. PMID 17114237. S2CID 12722658.
- ^ 빙글 L, 브라운 NJ, 루이스 CE. 종양 진행에서 종양 관련 대식세포의 역할: 새로운 항암 치료법에 대한 시사점. J Pathol 2002; 196:254–65.
- ^ de Groot AE (July 2018). "In vitro human tumor-associated macrophage model implicates macrophage proliferation as a mechanism for maintaining tumor-associated macrophage populations". Cancer Research. 78 (13 Supplement): 4060. doi:10.1158/1538-7445.AM2018-4060. S2CID 80769044.
- ^ Lin EY, Nguyen AV, Russell RG, Pollard JW (March 2001). "Colony-stimulating factor 1 promotes progression of mammary tumors to malignancy". The Journal of Experimental Medicine. 193 (6): 727–740. doi:10.1084/jem.193.6.727. PMC 2193412. PMID 11257139.
- ^ Qian BZ, Li J, Zhang H, Kitamura T, Zhang J, Campion LR, et al. (June 2011). "CCL2 recruits inflammatory monocytes to facilitate breast-tumour metastasis". Nature. 475 (7355): 222–225. doi:10.1038/nature10138. PMC 3208506. PMID 21654748.
- ^ Cortez-Retamozo V, Etzrodt M, Newton A, Ryan R, Pucci F, Sio SW, et al. (February 2013). "Angiotensin II drives the production of tumor-promoting macrophages". Immunity. 38 (2): 296–308. doi:10.1016/j.immuni.2012.10.015. PMC 3582771. PMID 23333075.
- ^ Pucci F, Garris C, Lai CP, Newton A, Pfirschke C, Engblom C, et al. (April 2016). "SCS macrophages suppress melanoma by restricting tumor-derived vesicle-B cell interactions". Science. 352 (6282): 242–246. Bibcode:2016Sci...352..242P. doi:10.1126/science.aaf1328. PMC 4960636. PMID 26989197.
- ^ Mantovani A, Allavena P (April 2015). "The interaction of anticancer therapies with tumor-associated macrophages". The Journal of Experimental Medicine. 212 (4): 435–445. doi:10.1084/jem.20150295. PMC 4387285. PMID 25753580.
- ^ De Palma M, Lewis CE (March 2013). "Macrophage regulation of tumor responses to anticancer therapies". Cancer Cell. 23 (3): 277–286. doi:10.1016/j.ccr.2013.02.013. PMID 23518347.
- ^ Miller MA, Zheng YR, Gadde S, Pfirschke C, Zope H, Engblom C, et al. (October 2015). "Tumour-associated macrophages act as a slow-release reservoir of nano-therapeutic Pt(IV) pro-drug". Nature Communications. 6: 8692. Bibcode:2015NatCo...6.8692M. doi:10.1038/ncomms9692. PMC 4711745. PMID 26503691.
- ^ Klug F, Prakash H, Huber PE, Seibel T, Bender N, Halama N, et al. (November 2013). "Low-dose irradiation programs macrophage differentiation to an iNOS⁺/M1 phenotype that orchestrates effective T cell immunotherapy". Cancer Cell. 24 (5): 589–602. doi:10.1016/j.ccr.2013.09.014. PMID 24209604.
- ^ Ruffell B, Chang-Strachan D, Chan V, Rosenbusch A, Ho CM, Pryer N, et al. (November 2014). "Macrophage IL-10 blocks CD8+ T cell-dependent responses to chemotherapy by suppressing IL-12 expression in intratumoral dendritic cells". Cancer Cell. 26 (5): 623–637. doi:10.1016/j.ccell.2014.09.006. PMC 4254570. PMID 25446896.
- ^ DeNardo DG, Brennan DJ, Rexhepaj E, Ruffell B, Shiao SL, Madden SF, et al. (June 2011). "Leukocyte complexity predicts breast cancer survival and functionally regulates response to chemotherapy". Cancer Discovery. 1 (1): 54–67. doi:10.1158/2159-8274.CD-10-0028. PMC 3203524. PMID 22039576.
- ^ Shiao SL, Ruffell B, DeNardo DG, Faddegon BA, Park CC, Coussens LM (May 2015). "TH2-Polarized CD4(+) T Cells and Macrophages Limit Efficacy of Radiotherapy". Cancer Immunology Research. 3 (5): 518–525. doi:10.1158/2326-6066.CIR-14-0232. PMC 4420686. PMID 25716473.
- ^ Kozin SV, Kamoun WS, Huang Y, Dawson MR, Jain RK, Duda DG (July 2010). "Recruitment of myeloid but not endothelial precursor cells facilitates tumor regrowth after local irradiation". Cancer Research. 70 (14): 5679–5685. doi:10.1158/0008-5472.CAN-09-4446. PMC 2918387. PMID 20631066.
- ^ Arlauckas SP, Garris CS, Kohler RH, Kitaoka M, Cuccarese MF, Yang KS, et al. (May 2017). "In vivo imaging reveals a tumor-associated macrophage-mediated resistance pathway in anti-PD-1 therapy". Science Translational Medicine. 9 (389): eaal3604. doi:10.1126/scitranslmed.aal3604. PMC 5734617. PMID 28490665.
- ^ Zhu Y, Knolhoff BL, Meyer MA, Nywening TM, West BL, Luo J, et al. (September 2014). "CSF1/CSF1R blockade reprograms tumor-infiltrating macrophages and improves response to T-cell checkpoint immunotherapy in pancreatic cancer models". Cancer Research. 74 (18): 5057–5069. doi:10.1158/0008-5472.CAN-13-3723. PMC 4182950. PMID 25082815.
- ^ Ries CH, Cannarile MA, Hoves S, Benz J, Wartha K, Runza V, et al. (June 2014). "Targeting tumor-associated macrophages with anti-CSF-1R antibody reveals a strategy for cancer therapy". Cancer Cell. 25 (6): 846–859. doi:10.1016/j.ccr.2014.05.016. PMID 24898549.
- ^ Ruffell B, Coussens LM (April 2015). "Macrophages and therapeutic resistance in cancer". Cancer Cell. 27 (4): 462–472. doi:10.1016/j.ccell.2015.02.015. PMC 4400235. PMID 25858805.
- ^ Sharma N, Vacher J, Allison JP (May 2019). "TLR1/2 ligand enhances antitumor efficacy of CTLA-4 blockade by increasing intratumoral Treg depletion". Proceedings of the National Academy of Sciences of the United States of America. 116 (21): 10453–10462. Bibcode:2019PNAS..11610453S. doi:10.1073/pnas.1819004116. PMC 6534983. PMID 31076558.
- ^ Weisberg SP, McCann D, Desai M, Rosenbaum M, Leibel RL, Ferrante AW. 비만은 지방 조직의 대식세포 축적과 관련이 있습니다." Journal of Clinical Investigation 2003; 112:1796–808.
- ^ Guilherme A, Henriques F, Bedard AH, Czech MP (April 2019). "Molecular pathways linking adipose innervation to insulin action in obesity and diabetes mellitus". Nature Reviews. Endocrinology. 15 (4): 207–225. doi:10.1038/s41574-019-0165-y. PMC 7073451. PMID 30733616.
- ^ Petkevicius K, Bidault G, Virtue S, Newland SA, Dale M, Dugourd A, et al. (June 2021). "Macrophage beta2-adrenergic receptor is dispensable for the adipose tissue inflammation and function". Molecular Metabolism. 48: 101220. doi:10.1016/j.molmet.2021.101220. PMC 8086137. PMID 33774223.
- ^ Bolus WR, Gutierrez DA, Kennedy AJ, Anderson-Baucum EK, Hasty AH (October 2015). "CCR2 deficiency leads to increased eosinophils, alternative macrophage activation, and type 2 cytokine expression in adipose tissue". Journal of Leukocyte Biology. 98 (4): 467–477. doi:10.1189/jlb.3HI0115-018R. PMC 4763864. PMID 25934927.
- ^ Boutens L, Stienstra R (May 2016). "Adipose tissue macrophages: going off track during obesity". Diabetologia. 59 (5): 879–894. doi:10.1007/s00125-016-3904-9. PMC 4826424. PMID 26940592.
- ^ Cinti S, Mitchell G, Barbatelli G, Murano I, Ceresi E, Faloia E, et al. (November 2005). "Adipocyte death defines macrophage localization and function in adipose tissue of obese mice and humans". Journal of Lipid Research. 46 (11): 2347–2355. doi:10.1194/jlr.M500294-JLR200. PMID 16150820.
- ^ Kühl AA, Erben U, Kredel LI, Siegmund B (7 December 2015). "Diversity of Intestinal Macrophages in Inflammatory Bowel Diseases". Frontiers in Immunology. 6: 613. doi:10.3389/fimmu.2015.00613. PMC 4670857. PMID 26697009.
- ^ a b c Smythies LE, Sellers M, Clements RH, Mosteller-Barnum M, Meng G, Benjamin WH, et al. (January 2005). "Human intestinal macrophages display profound inflammatory anergy despite avid phagocytic and bacteriocidal activity". The Journal of Clinical Investigation. 115 (1): 66–75. doi:10.1172/JCI19229. PMC 539188. PMID 15630445.
- ^ a b Mowat AM, Bain CC (2011). "Mucosal macrophages in intestinal homeostasis and inflammation". Journal of Innate Immunity. 3 (6): 550–564. doi:10.1159/000329099. PMC 3224516. PMID 22025201.
- ^ Bain CC, Mowat AM (July 2014). "Macrophages in intestinal homeostasis and inflammation". Immunological Reviews. 260 (1): 102–117. doi:10.1111/imr.12192. PMC 4141699. PMID 24942685.
- ^ Weiss G (January 2023). "Macrophage vesicles starve bacteria of iron". Nature Metabolism. 5 (1): 10–12. doi:10.1038/s42255-022-00719-1. PMID 36658401. S2CID 256030791.
- ^ Epelman S, Lavine KJ, Randolph GJ (July 2014). "Origin and functions of tissue macrophages". Immunity. 41 (1): 21–35. doi:10.1016/j.immuni.2014.06.013. PMC 4470379. PMID 25035951.
- ^ Mass E, Lachmann N (September 2021). "From macrophage biology to macrophage-based cellular immunotherapies". Gene Therapy. 28 (9): 473–476. doi:10.1038/s41434-021-00221-5. PMC 8455330. PMID 33542457.
- ^ Epelman S, Lavine KJ, Randolph GJ (July 2014). "Origin and functions of tissue macrophages". Immunity. 41 (1): 21–35. doi:10.1016/j.immuni.2014.06.013. PMC 4470379. PMID 25035951.
- ^ Italiani P, Boraschi D (August 2015). "New Insights Into Tissue Macrophages: From Their Origin to the Development of Memory". Immune Network. 15 (4): 167–176. doi:10.4110/in.2015.15.4.167. PMC 4553254. PMID 26330802.
- ^ Lazarov T, Juarez-Carreño S, Cox N, Geissmann F (June 2023). "Physiology and diseases of tissue-resident macrophages". Nature. 618 (7966): 698–707. Bibcode:2023Natur.618..698L. doi:10.1038/s41586-023-06002-x. PMC 10649266. PMID 37344646.