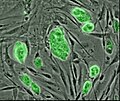
줄기세포
Stem cell| 줄기세포 | |
|---|---|
 | |
| 세부 사항 | |
| 식별자 | |
| 라틴어 | 대초원숭이 |
| 메슈 | D013234 |
| TH | H1.00.01.0.00028, H2.00.01.0.00001 |
| FMA | 63368 |
| 해부학적 용어 | |
다세포 유기체에서 줄기세포는 분화되지 않거나 부분적으로 분화된 세포로, 다양한 유형의 세포로 분화하여 무한히 증식하여 동일한 줄기세포의 더 많은 양을 생산할 수 있다.그것들은 세포 혈통에서 가장 초기 형태의 세포다.[1]그것들은 배아 유기체와 성체 유기체 모두에서 발견되지만 각각의 성질은 약간 다르다.이들은 보통 무한정 나눌 수 없는 조생세포와 보통 하나의 세포형으로 분화하는데 헌신하는 전구세포나 발파세포와 구별된다.
포유류에서 약 50–150개의 세포가 배아 발달의 배반포시 단계 동안 내부 세포 덩어리를 구성하고 있다.이것들은 줄기세포 능력을 가지고 있다.체내에서는 결국 신체의 모든 세포 유형으로 분화한다(전능을 갖게 한다).이 과정은 식욕 단계에서 세 가지 세균 층인 엑토더럼, 중간층, 내분층으로 분화하면서 시작된다.그러나 이들이 격리되어 체외 배양되었을 때 줄기세포 단계에 보관될 수 있으며 배아줄기세포(ESC)로 알려져 있다.
성체줄기세포는 골수나 생식샘과 같은 틈새라고 알려진 몸 안의 몇몇 선별된 위치에서 발견된다.그것들은 빠르게 소실된 세포 유형을 보충하기 위해 존재하며 다기능적이거나 전지전능하지 못하며, 이는 그들이 단지 몇 개의 세포 유형이나 하나의 세포 유형으로만 분화한다는 것을 의미한다.포유류 중에서는 혈액과 면역세포를 보충하는 조혈모세포, 피부 상피를 유지하는 기저세포, 뼈, 연골, 근육, 지방세포를 유지하는 중피줄기세포 등이 있다.성체줄기세포는 세포의 소수에 지나지 않는다; 그것들은 그들이 분화하는 생식기 세포와 종말적으로 분화된 세포들에 의해 훨씬 수적으로 우세하다.[1]
줄기 세포에 대한 연구는 1960년대 토론토 대학과 온타리오 암 연구소의 캐나다 생물학자 어니스트 맥컬로치, 제임스 틸, 앤드류 J. 베커에 의한 발견으로부터 성장했다.[2][3]2016년[update] 현재 줄기세포를 이용한 유일한 치료법은 조르주 마테 프랑스 종양학자가 1958년 처음 시행한 [4]조혈모세포 이식이다.그러나 1998년 이후 인간 배아줄기세포(줄기세포선)의 배양과 분화가 가능해졌다.이 세포들을 분리하는 과정은 전형적으로 배아를 파괴하는 결과를 낳기 때문에 논란이 되어왔다.유럽 일부 국가와 캐나다에서는 ESC를 분리하기 위한 출처가 제한됐지만 영국과 중국 등 일부 국가에서는 연구를 추진했다.[5]체세포 핵이식은 줄기세포 치료에 배아줄기세포를 사용할 복제배아를 만드는 데 사용할 수 있는 복제 방법이다.[6]야마나카 신야가 이끄는 일본 연구팀은 2006년 성숙한 체세포를 다시 줄기세포로 전환하는 방법을 발견했다.이것들은 유도 만능줄기세포(iPSC)라고 불렸다.[7]
역사
줄기세포라는 용어는 19세기 말에 테오도르 보베리와 발렌틴 해커에 의해 만들어졌다.[8]혈액줄기세포 이론의 선구적인 연구는 20세기 초에 아르투르 파펜하임, 알렉산더 막시모우, 프란츠 에른스트 크리스티안 노이만 등에 의해 수행되었다.[8]
줄기세포의 주요 성질은 1960년대 초 토론토 대학과 온타리오 암 연구소의 어니스트 맥컬로치와 제임스 틸에 의해 처음 정의되었다.그들은 쥐에 대한 선구적인 연구를 통해 혈액형 줄기세포인 조혈모세포(HSC)를 발견했다.맥컬로치와 틸은 조사된 쥐에 골수세포를 주입하는 일련의 실험을 시작했다.그들은 주사된 골수 세포의 수에 선형적으로 비례하는 쥐의 스플렌에서 덩어리를 관찰했다.그들은 각각의 덩어리(콜론)가 단일 골수 세포(줄기 세포)에서 생성된 클론이라는 가설을 세웠다.이후, 대학원생 앤드류 존 베커와 수석 과학자 루이스 시미노비치(Louis Siminovitch)가 합류한 맥컬로치와 틸은 각각의 덩어리가 실제로 하나의 세포에서 발생한다는 것을 확인했다.그들의 결과는 1963년에 네이처에 발표되었다.같은 해, 시미노비치는 식민지를 형성하는 세포가 스스로 재생할 수 있다는 것을 발견한 연구의 수석 조사관으로, 틸과 맥컬로치가 이론화했던 줄기세포의 속성을 정의하는 핵심이다.[9]
줄기세포를 이용한 첫 치료법은 1958년 프랑스 종양학자 조르주 마테가 중대 사고로 피해를 본 유고슬라비아 빈차 원자력 연구소 근로자 5명을 대상으로 실시한 골수 이식이다.노동자들은 모두 살아남았다.[10]
1981년 배아줄기세포(ES)는 영국 생물학자 마틴 에반스와 매튜 카우프만에 의해 쥐 배반포를 이용해 처음 분리돼 배양에 성공했다.이를 통해 병리학에서 쥐의 기능을 연구하기 위해 쥐의 유전자를 삭제하거나 변형하는 시스템인 머린 유전자 모델이 형성될 수 있었다.1998년까지 배아줄기세포는 미국 생물학자 제임스 톰슨에 의해 처음으로 격리되어 새로운 치료법을 시험하기 위한 새로운 이식방법이나 다양한 세포형을 가질 수 있게 되었다.2006년, 일본 교토에 있는 야마나카 신야 교수팀은 단 4개의 유전자의 발현을 수정하여 섬유블라스트를 전능 줄기세포로 변환시켰다.이 위업은 iPS 세포로 알려진 유도 만능 줄기세포의 기원을 나타낸다.[7]
2011년, 트럭에 치인 암컷 갈비늑대가 동물원 브라질리아에서 줄기세포 치료를 받았는데, 이것은 야생 동물의 부상을 치료하기 위해 줄기세포를 사용한 최초의 사례로 기록되었다.[11][12]
특성.
줄기세포의 고전적 정의는 줄기세포가 다음 두 가지 성질을 가질 것을 요구한다.
- 자기 재생: 세포 증식이라고 알려진 세포 증식과 세포 분열의 수많은 순환을 거치면서 미분화 상태를 유지할 수 있는 능력이다.
- 효력: 전문화된 세포 유형으로 분화할 수 있는 능력.가장 엄격한 의미에서, 이것은 줄기세포가 전능적이거나 전능적일 것을 요구한다. 다기능적이거나 전지전능하지 않은 세포들을 줄기세포라고 부르기도 하지만, 어떤 성숙한 세포형태를 발생시킬 수 있도록 말이다.이와 별개로 줄기세포 기능은 피드백 메커니즘에서 규제된다고 한다.
자기갱신
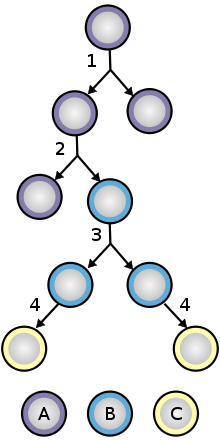
두 가지 메커니즘을 통해 줄기세포 모집단이 유지됨(크기가 줄어들지 않음):
1. 비대칭 세포분열: 줄기세포는 원래 줄기세포와 동일한 모세포와 또 다른 딸세포로 나뉘는데, 이는 구별된다.
줄기세포가 스스로 재생될 때 분열되어 미분화 상태를 흐트러뜨리지 않는다.이 자가 재생은 세포 주기의 통제와 더불어 모든 것이 줄기세포에 의존하는 다중성 또는 다중성의 유지를 요구한다.[13]
2. 확률적 분화: 한 줄기 세포가 성장하여 분화된 두 개의 딸 세포로 분열하면 다른 줄기 세포는 유사분열을 겪으며 원본과 동일한 두 개의 줄기 세포를 생산한다.
줄기세포는 말단소립을 복원하는 단백질인 텔로머레이즈를 사용해 DNA를 보호하고 세포분할 한계(헤이플릭 한계)를 연장한다.[14]
효력 의미
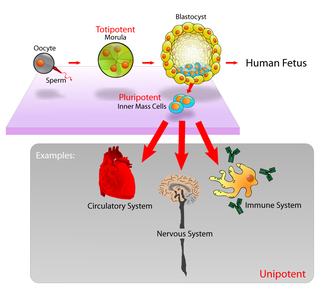
효력은 줄기세포의 분화 가능성(다른 세포 유형으로 분화할 수 있는 가능성)을 지정한다.[15]
- 전능(전능) 줄기세포는 배아 세포와 배아 세포로 분화할 수 있다.그러한 세포들은 완전하고 실행 가능한 유기체를 만들 수 있다.[15]이 세포들은 난자와 정자 세포의 융합으로 만들어진다.수정란의 처음 몇 개의 분할에 의해 생산된 세포도 전능하다.[16]
- 전지전능 줄기세포는 전지전능 세포의 자손이며 거의 모든 세포,[15] 즉 세 가지 세균층 중 하나에서 파생된 세포로 분화할 수 있다.[17]
- 다발성 줄기세포는 여러 종류의 세포로 분화할 수 있지만, 세포를 밀접하게 연관시킨 세포 계열의 세포만 분화시킬 수 있다.[15]
- 과두 줄기세포는 림프나 골수 줄기세포와 같은 몇 가지 유형의 세포로만 분화할 수 있다.[15]
- 전지전능 세포는 자신의 세포인 하나의 세포형만 생산할 수 있지만,[15] 비줄기세포(예: 자생할 수 없는 조생세포)와 구별되는 자기갱생의 성질을 가지고 있다.
식별
실제로 줄기세포는 조직을 재생할 수 있는가에 의해 확인된다.예를 들어, 골수나 조혈모세포(HSC)에 대한 정의 테스트는 HSC 없이 세포를 이식하고 개인을 구할 수 있는 능력이다.이것은 세포가 장기적으로 새로운 혈구를 생산할 수 있다는 것을 보여준다.또한 줄기세포가 스스로 HSC 없이 다른 개인에게 이식될 수 있는 이식된 개인으로부터 줄기세포를 분리하는 것도 가능해져 줄기세포가 스스로 재생될 수 있었음을 증명해야 한다.
줄기세포의 성질은 단일 세포가 분화 및 자가 재생 능력을 평가받는 클로네제닉 분석 등의 방법을 사용하여 체외에서 설명할 수 있다.[18][19]줄기세포는 또한 세포 표면 표지의 독특한 세트를 소유함으로써 분리될 수 있다.그러나 체외 배양조건은 세포의 행동을 변화시킬 수 있어 세포가 체내에서 유사한 방식으로 행동해야 하는지를 불분명하게 만든다.몇몇 제안된 성인 세포가 진짜 줄기세포인지에 대해서는 상당한 논쟁이 있다.[20]
배아
배아줄기세포(ESCs)는 자궁에 착상하기 전에 형성된 배반세포의 내부 세포질량이다.[21]인간 배아 발달에서 배반포성 단계는 수정 후 4~5일 후에 도달하며, 그 때 배반포성은 50-150개의 세포로 구성된다.ESC는 전능하며 개발 중에 ectoderm, endoderm, mesoderm의 세 가지 세균 층의 모든 파생상품에 발생한다.즉, 특정 세포 유형에 대해 충분하고 필요한 자극을 주었을 때 성인 신체의 200개 이상의 세포 유형으로 각각 발달할 수 있다.그들은 자궁외막이나 태반에는 기여하지 않는다.
배아 발달 동안 내세포 질량의 세포는 지속적으로 분열되고 더욱 전문화된다.예를 들어 배아의 등측부 외측두엽의 일부는 미래의 중추신경계가 될 '신경계'로 전문화되어 있다.[22]나중에 발달하면 신경세포가 신경관을 형성하게 된다.신경관 단계에서 앞부분은 뇌의 기본 형태를 생성하거나 '패턴'하기 위해 뇌화 과정을 거친다.이 발달 단계에서 CNS의 주세포형은 신경줄기세포로 간주된다.
신경줄기세포는 스스로 재생되며 어느 순간 방사형 글라이알 조제세포(RGP)로 이행된다.초기형 RGP는 대칭적 분할에 의해 자가 재생되어 발전기 세포의 저장조 그룹을 형성한다.이러한 세포들은 신경유전 상태로 전환하여 비대칭적으로 분열하기 시작하여 각각 고유한 유전자 발현, 형태학적, 기능적 특성을 지닌 많은 다양한 뉴런 타입의 다양성을 생성하기 시작한다.방사상 활엽세포에서 뉴런을 생성하는 과정을 신경생성이라고 한다.레이디얼 글라이얼 셀은 신경관 벽의 두께에 걸쳐 고도로 긴 공정을 가진 독특한 양극성 형태학을 가지고 있다.그것은 몇몇 활엽 특성을 공유하는데, 가장 두드러지게는 활엽세동산성단백질(GFAP)의 발현이다.[23][24]방사상 활엽세포는 발달하는 척추동물 CNS의 1차 신경줄기세포로 세포체는 발달하는 심실계에 인접한 심실존에 있다.신경줄기세포는 뉴런 라인(뉴런, 아스트로시테스, 올리고덴드로시테스)에 전도되어 그 효력이 제한된다.[22]
현재까지 거의 모든 연구가 초기 내세포 질량에서 유래한 쥐 배아줄기세포(mES)나 인간 배아줄기세포(hES)를 활용했다.둘 다 필수적인 줄기세포 특성을 가지고 있지만, 구분되지 않은 상태를 유지하기 위해서는 매우 다른 환경이 필요하다.마우스 ES 세포는 세포외 매트릭스(지원용)로서 젤라틴 층에서 성장하며 혈청 매체에 백혈병 억제 인자(LIF)가 있어야 한다.GSK3B에 대한 억제제와 2i라고 불리는 MAPK/ERK 경로에 대한 억제제를 함유한 약물 칵테일도 줄기세포 배양에 있어 순항력을 유지하는 것으로 나타났다.[25]인간 ESC는 생쥐 배아 섬유화합물의 공급층에서 성장하며 기초 섬유화합물 성장인자(bFGF 또는 FGF-2)가 필요하다.[26]최적의 배양 조건이나 유전자 조작이 없다면 배아줄기세포는 빠르게 분화할 것이다.[27]
인간 배아줄기세포는 여러 전사와 세포표면 단백질의 표현으로도 정의된다.10월-4일, 나노그, 삭스2는 분화를 초래하는 유전자의 억제와 유행을 보장하는 핵심 규제 네트워크를 형성한다.[28]hES 세포 식별에 가장 많이 사용되는 세포표면 항원은 글리콜리피드 단계별 배아 항원 3과 4이며, 케라탄 황산염 항원은 Tra-1-60과 Tra-1-81이다.줄기세포의 분자적 정의는 훨씬 더 많은 단백질을 포함하고 있으며 계속해서 연구 주제가 되고 있다.[29]
인간 배아줄기세포를 이용해 연구실에서 신경세포나 심장세포와 같은 전문화된 세포를 만들어냄으로써 과학자들은 환자의 조직을 빼앗지 않고도 성인 인간세포를 접할 수 있다.그리고 나서 그들은 질병의 합병증을 식별하기 위해 또는 제안된 신약에 대한 세포 반응을 연구하기 위해 이러한 전문화된 성인 세포를 자세히 연구할 수 있다.
배아줄기세포는 무한확장 능력과 유연성이 결합돼 있어 이론적으로 부상이나 질병 후 재생의학과 조직교체의 잠재적 원천으로 남아 있지만 현재 ES세포를 이용한 승인된 치료법은 없다.[30]첫 번째 인간 재판은 2009년 1월 미국 식품의약국(FDA)의 승인을 받았다.[31]그러나 인간 실험은 2010년 10월 13일에야 애틀랜타에서 척수 손상 연구를 위해 시작되었다.2011년 11월 14일, 시험을 실시하는 회사(제론 주식회사)는 줄기세포 프로그램의 추가 개발을 중단한다고 발표했다.[32]이식 거부를 피하면서 ES 세포를 사용 가능한 세포로 구분하는 것은 배아 줄기세포 연구자들이 여전히 직면하고 있는 장애물 중 일부에 불과하다.[33]배아줄기세포는 전능하기 때문에 정확한 분화를 위한 특정 신호를 필요로 한다 – 만약 다른 체내에 직접 주입된다면, ES세포는 많은 다른 종류의 세포로 분화하여 기형종을 유발할 것이다.태음인 조직 사용에 대한 윤리적 고려는 배아줄기세포를 이용한 승인된 치료법이 부족한 또 다른 이유다.많은 나라들은 현재 인간 ES 세포 연구나 새로운 인간 ES 세포 라인의 생산에 대해 모르토리아나 한계를 가지고 있다.
중간 줄기 세포
중피줄기세포(MSC)는 다발성으로 알려져 있는데, 예를 들어 근육, 간, 골수 등에서 성체 조직에서 발견될 수 있다.중피줄기세포는 보통 위에서 언급한 바와 같이 다양한 장기의 구조적 지지대 역할을 하며, 물질의 이동을 조절한다.MSC는 중피층에 의해 파생된 아디프로모세포, 골세포, 연골세포의 삽화로서 수많은 세포 범주로 분화할 수 있다.[34]중층층이 연골이나 뼈와 관련된 것과 같은 신체의 골격 요소를 증가시키는 경우."메소"란 그리스어에서 유래한 중간 주입을 말하며, 중피세포가 외피층 및 내피층 중 초기 배아 성장기에 범위와 이동이 가능하다는 것을 의미한다.이 메커니즘은 공간을 채우는 데 도움을 주므로 진피(피부), 뼈 또는 근육의 중피 세포와 관련이 있는 성인 유기체의 상처를 치료하는 열쇠가 된다.[35]
중피줄기세포는 재생의학에 필수적인 것으로 알려져 있다.그것들은 임상 실험에서 광범위하게 연구된다.쉽게 격리되고 높은 수율을 얻을 수 있기 때문에 염증을 촉진하고 세포 성장을 촉진할 수 있는 높은 가소성, 세포 분화, 면역억제 및 면역억제로부터 파생된 조직 복원 등이 가능하다.MSC는 골수에서 나오는데, 이는 격리된 세포의 양과 질을 격리시킬 때 공격적인 절차가 필요하며, 기증자의 연령에 따라 달라진다.골수 흡인체와 골수 스트로마의 MSC 비율을 비교할 때, 흡인체는 스트로마보다 MSC 비율이 더 낮은 경향이 있다.MSC는 이질적인 것으로 알려져 있으며 배아줄기세포와 같은 다른 종류의 줄기세포와 비교했을 때 높은 수준의 만능 표지를 표현한다.[34]
셀 사이클 제어
배아줄기세포(ESC)는 세포주기 조절의 전문 메커니즘을 통해 가능한, 자신의 플뤼리포텐도를 유지하면서 무한정 분열할 수 있는 능력을 갖고 있다.[36]체세포가 증식하는 것에 비해 ESC는 G1상 단축에 의한 급속한 세포분열, G0상 부재, 세포주기 체크포인트의 변형 등 고유한 세포주기 특성을 가지고 있어 세포는 어느 때든 대부분 S상(S상)[36][37]ESCs의 급속한 분열은 8~10시간의 짧은 두 배 시간으로 입증되는 반면 체세포는 약 20시간 이상의 두 배 이상의 시간을 갖는다.[38]세포가 분화함에 따라 이러한 성질은 변한다: G1과 G2 상이 길어져 세포 분열 주기가 길어진다.이는 특정 셀 사이클 구조가 플뤼리포텐시(pluripotency)의 확립에 기여할 수 있음을 시사한다.[36]
특히 G1 위상은 세포가 분화에 대한 민감도를 높인 단계이기 때문에 G1 단축은 ESC의 주요 특성 중 하나로, 미분화 표현형을 유지하는 데 중요한 역할을 한다.비록 정확한 분자 메커니즘이 부분적으로만 이해되고 있지만, 몇몇 연구는 ESC가 G1과 잠재적으로 다른 단계를 통해 어떻게 그렇게 빠르게 진행되는지에 대한 통찰력을 보여주었다.[37]
세포주기는 사이클린, 사이클린 의존 키나제(Cdk), 사이클린 의존 키나제 억제제(Cdkn), 레티노보플라스마(Rb) 계열의 포켓 단백질 및 기타 부속 인자의 복잡한 네트워크에 의해 조절된다.[38]ESC 세포 주기의 독특한 규제에 대한 기초적인 통찰은 마우스 ESCs (mescs)에 대한 연구에 의해 얻어졌다.[37] mESCs는 매우 축약된 G1 단계를 가진 세포 주기를 보여주었고, 이것은 세포가 M 위상과 S 위상을 빠르게 교대할 수 있게 했다.체세포 주기에서는 Cyclin-Cdk 콤플렉스의 진동 활성이 순차 작용으로 관찰되며, 이는 셀 사이클의 중요한 조절기를 제어하여 위상 간 단방향 전환을 유도한다.G1단계에서는 사이클린 D와 Cdk4/6이, G1후기와 S단계에서는 사이클린 E와 Cdk2가, S단계와 G2에서는 사이클린 A와 Cdk2가, G2·M단계에서는 사이클린 B와 Cdk1이 활성화되어 있다.[38]그러나 mESC에서는 일반적으로 이러한 주문 및 사이클린-Cdk 단지의 진동 활성이 부재하다.오히려 사이클린 E/Cdk2 콤플렉스는 레티노블레스토마단백질(pRb) 고인산화(hyperphosphorylated)를 유지하여 주기 내내 구성적으로 활성화되어 있어 비활성이 있다.이를 통해 M상으로부터 G1상 후반으로 직접 전환이 가능해져 D형 사이클린이 없어져 G1상 단축이 가능하다.[37]Cdk2 활동은 mESC에서 세포 주기 규제와 세포 운명에 관한 의사결정에 매우 중요하다; Cdk2 활동의 하향 조절은 G1 위상 진행을 연장시키고 체세포와 같은 세포 주기를 확립하며 분화 표지의 발현을 유도한다.[39]
인간 ESC(Human ESC)에서는 G1의 지속시간이 극적으로 단축된다.이는 G1 관련 사이클린 D2 및 Cdk4 유전자의 mRNA 수치가 높고 p21CipP1, p27Kip1, p57Kip2 등 G1에서 세포주기 진행을 억제하는 세포주기 규제단백질이 낮기 때문으로 분석됐다.[36][40]또한 잉크 억제제 계열(p15, p16, p18, p19)의 구성원과 같은 Cdk4 및 Cdk6 활동의 규제자는 낮은 수준으로 표현되거나 전혀 표현되지 않는다.따라서, mESC와 유사하게 hESC는 높은 Cdk 활동을 보여주며, Cdk2는 가장 높은 키나제 활동을 보여준다.또한 mESC와 유사하게, hESC는 G1에서 S로의 전환이 Cdk2 활동이 억제되면 지연되고, Cdk2가 쓰러지면 G1이 구속됨을 보여줌으로써 G1 단계 규제에서 Cdk2의 중요성을 입증한다.[36]그러나 mESC와 달리 hESC는 기능 G1 단계가 있다.HESCs는 사이클린 E/Cdk2와 사이클린 A/Cdk2 단지의 활동이 세포 주기에 따라 달라지며 G1의 Rb 체크포인트가 기능한다는 것을 보여준다.[38]
G1 체크포인트가 게놈 안정성 유지에 필수적임에도 불구하고 ESC는 G1 체크포인트 비기능성으로도 특징적이다.DNA 손상에 대응해 ESC는 DNA 손상을 복구하기 위해 G1에서 멈추지 않고 대신 S와 G2/M 검문소에 의존하거나 사멸을 겪는다.ESC에 G1 체크포인트가 없어 DNA가 손상된 세포를 제거할 수 있어 부정확한 DNA 수리로 인한 잠재적 돌연변이를 피할 수 있다.[36]이 아이디어와 일관되게 ESC는 다음 세대에 전달되는 돌연변이를 최소화하기 위해 DNA 손상에 과민반응한다.[38]
태아
태아의 장기에 위치한 원시 줄기세포를 태아줄기세포라고 한다.[41]
태아 줄기세포에는 두 가지 유형이 있다.
- 태아의 적절한 줄기세포는 태아의 적절한 조직에서 나오며 일반적으로 낙태 후에 얻는다.이들 줄기세포는 불멸이 아니라 분열이 높고 다발성이다.
- 자궁외 태아 줄기세포는 자궁외막에서 추출되며, 일반적으로 성체 줄기세포와 구별되지 않는다.이러한 줄기세포는 출생 후 획득되며, 불멸이 아니라 세포분열이 높고, 전능하다.[42]
성인
성체줄기세포는 체세포(그리스어 Ω ματκκó, "몸의")라고도 하며, 발견된 조직을 유지·보수하는 줄기세포다.[43]그들은 어른들뿐만 아니라 어린이들에서도 발견될 수 있다.[44]
인간에게 자폐성 성인 줄기세포의 접근 가능한 출처는 다음과 같이 세 가지로 알려져 있다.
- 수확에 의한 채취가 필요한 골수는 대개 수술을 통해 골반뼈에서 채취한다.[45]
- 지방흡입에 의한 추출이 필요한 지방조직(지방세포)이다.[46]
- 혈액, 즉 기증자로부터 혈액을 뽑아내는 (헌혈과 유사하게) 용액을 통해 추출해야 하는 혈액, 줄기세포를 추출해 혈액의 다른 부분을 기증자에게 돌려주는 기계를 통과한다.[citation needed]
줄기세포는 태어난 직후 탯줄혈액에서도 채취할 수 있다.모든 줄기세포 유형 중에서 자가 수확은 가장 적은 위험을 수반한다.정의에 따르면 선택적 수술 절차를 위해 자신의 혈액을 축적할 수 있는 것처럼 자기 몸에서 자가세포를 얻는다.[citation needed]
전능한 성인줄기세포는 드물고 일반적으로 수가 적지만 탯줄혈액과 다른 조직에서 발견할 수 있다.[47]골수는 성체 줄기세포의 풍부한 공급원으로 간경변[50], 만성 사지 허혈,[49] 말기 심부전 등 여러 질환을 치료하는데 이용되어 왔다.[48][51]골수 줄기세포의 양은 나이가 들수록 감소하고 생식기 동안 여성보다 남성에게서 더 많다.[52]지금까지 많은 성인 줄기세포 연구는 그들의 효능과 자기 재생 능력을 특징짓는 것을 목표로 하고 있다.[53]DNA 손상은 줄기세포와 줄기세포 환경을 구성하는 세포 모두에서 나이가 들면서 누적된다.이러한 축적은 최소한 부분적으로는 노화와 함께 줄기세포 기능 장애를 증가시키는 데 책임이 있는 것으로 간주된다(노화의 DNA 손상 이론 참조).[54]
대부분의 성체줄기세포는 혈통제한(만능불능)이며 일반적으로 조직원(메스킨피 줄기세포, 지방유래 줄기세포, 내피 줄기세포, 치과펄프 줄기세포 등)으로 언급된다.[55][56]뮤즈 세포(다선 분화 응력 지속 세포)는 지방질, 피부 섬유질, 골수 등 여러 성인 조직에서 최근 발견된 전능 줄기세포 유형이다.드물기는 하지만 뮤즈 세포는 미분화 줄기세포의 표식인 SSEA-3와 CD105와 같은 일반 중피 줄기세포 표식기의 표현으로 식별할 수 있다.단일 세포 서스펜션 배양에 따라 세포는 형태학에서 발생체체와 유사한 성단을 생성하며, 표준적 플뤼리포텐시 표식기 옥트4, 삭스2, 나노그도 포함된다.[57]
성인 줄기세포 치료는 골수 이식을 통해 백혈병 및 관련 골수/혈액암 치료에 수년간 성공적으로 사용되어 왔다.[58]성체줄기세포는 말의 힘줄과 인대손상을 치료하기 위해 수의학에도 쓰인다.[59]
성체줄기세포의 생산은 배아의 파괴를 요구하지 않기 때문에 연구와 치료에 성체줄기세포를 사용하는 것만큼 논란이 되지 않는다.또한 성인 줄기세포가 의도된 수령인으로부터 획득되는 경우(자동 추출) 거부 위험은 본질적으로 존재하지 않는다.결과적으로, 성체 줄기세포 연구에 더 많은 미국 정부 자금이 제공되고 있다.[60]
연구 목적과 임상 목적 모두를 위한 인간 성인 줄기세포의 수요가 증가함에 따라(일반적으로 체중의 kg 당 100만~500만개의 세포가 치료당 필요) 시험관내 세포의 확장 필요성과 복제성 노화 요인의 활용 능력 사이의 간격을 메우는 것이 가장 중요해졌다.성체 줄기세포는 체외 배양 시 수명이 제한되어 있으며 체외 배양 시 거의 눈에 띄지 않는 복제 노화에 들어가는 것으로 알려져 있다.[61]
양수적
이 다발성 줄기세포는 양수와 탯줄혈액에서도 발견된다.이 줄기 세포들은 매우 활동적이고, 피더 없이 광범위하게 확장되며 종양 유전자가 아니다.양수줄기세포는 다기능성이 없으며 지방유전자, 골유전자, 내피세포, 간세포 및 신경세포에서도 분화할 수 있다.[62]양수 줄기세포는 활발한 연구의 주제다.
양수에서 줄기세포를 사용하는 것은 인간 배아를 세포의 원천으로 사용하는 것에 대한 윤리적 반대를 극복한다.로마 가톨릭의 가르침은 배아줄기세포를 실험에 사용하는 것을 금지하고 있다. 따라서 바티칸 신문 "오세르바토레 로마노"는 양수줄기세포를 "의학의 미래"[63]라고 불렀다.
기증자나 자가용을 위한 양수줄기세포 채취가 가능한데, 바이오셀센터 주식회사가 2009년 미국 최초의[64][65] 양수줄기세포은행이[66][67][68] 미국 MA주 메드포드에 문을 열고 전 세계 여러 병원과 대학과 협력한다.[69]
유도 만능
성체줄기세포는 배아줄기세포(ESC)와 달리 세 가지 세균층 모두에서 세포로 분화할 수 없어 역량에 한계가 있다.이와 같이, 그들은 다기능 장애자로 간주된다.
그러나 재프로그래밍을 통해 성인 세포에서 유도 만능 줄기세포(iPSC)를 만들 수 있다.이것들은 성인 줄기세포가 아니라, 전지전능한 능력을 가진 세포를 생기게 하기 위해 재프로그래밍된 체세포(상피세포 등)이다.단백질 전사 인자가 포함된 유전적 재프로그래밍을 이용해 ESC와 같은 기능을 가진 만능 줄기세포가 도출됐다.[70][71][72]유도 만능줄기세포의 첫 시연은 야마나카 신야와 교토대 동료들이 맡았다.[73]그들은 10월 3일/4일, 삭스2, c-Myc, 그리고 Klf4를 사용하여 생쥐 섬유소 세포들을 전지전능 세포로 재프로그래밍했다.[70][74]그 이후의 연구는 인간의 섬유질 세포에 플뤼피포턴성을 유도하기 위해 이러한 요소들을 이용했다.[75]주닝 유, 제임스 톰슨, 그리고 위스콘신-매디슨 대학의 동료들은 10월4일, 삭스2, 나노그, 린28이라는 다른 요인들을 사용했고, 인간의 포피에서 나온 세포를 이용하여 실험을 수행했다.[70][76]그러나 인간 세포의 플루리포텐시 유도가 가능하다는 야마나카 씨의 연구 결과를 그대로 재현할 수 있었다.
유도 만능줄기세포는 배아줄기세포와 다르다.이들은 플루리포텐시 및 분화 잠재력, 플루리포텐시 유전자의 표현, 후생유전학적 패턴, 발생체 및 테라토마 형성, 실행 가능한 키메라 형성 등 많은 유사한 성질을 공유하지만,[73][74] 이러한 성질 내에는 많은 차이가 있다.iPSC의 염색질은 ESC의 염색체보다 더 "폐쇄"되거나 메틸화 되어 있는 것으로 보인다.[73][74]마찬가지로 ESC와 iPSC, 또는 iPSC 사이의 유전자 발현 패턴은 서로 다른 기원에서 비롯되었다.[73]따라서 재프로그래밍의 "완전성"과 유도 만능 줄기세포의 체적 기억력에 대한 의문이 제기된다.그럼에도 불구하고 체세포를 전능화하도록 유도하는 것은 실행 가능한 것으로 보인다.
이러한 실험의 성공으로 최초의 복제 동물인 돌리를 만드는 것을 도왔던 이안 윌머트는 연구의 한 길로 체세포 핵 이전을 포기하겠다고 발표했다.[77]
IPSC는 질병을 치료할 수 있는 수많은 방법을 찾아냄으로써 의학 분야에 큰 도움을 주었다.인간 IPSCc는 독소와 병원체 발생을 연구하는 체외 모델을 만들 수 있는 이점을 주었기 때문이다.[78]
게다가, 유도 만능 줄기세포는 몇 가지 치료상의 이점을 제공한다.ESC처럼 그들은 전능하다.따라서 그들은 큰 분화 잠재력을 가지고 있다; 이론적으로 그들은 인체 내에서 어떤 세포도 생산할 수 있다. (만약 플뤼리포텐시 재프로그래밍이 "완전"[73]이라면)게다가 ESC와는 달리, 그들은 잠재적으로 의사들이 개별 환자에 대해 만능 줄기세포 라인을 만들 수 있도록 할 수 있다.[79]냉동 혈액 샘플은 유도 만능 줄기세포의 귀중한 원천으로 사용될 수 있다.[80]환자맞춤형 줄기세포는 약물치료 전 부작용 검사와 함께 이식 거부반응 위험이 감소한다.[79]현재 치료법의 제한적인 사용에도 불구하고, iPSC는 향후의 치료와 연구에 큰 잠재력을 가지고 있다.
셀 사이클 제어
세포 주기를 제어하는 핵심 요소도 플루리포텐도를 조절한다.따라서 관련 유전자의 조작은 전능성을 유지하고 체세포를 유도 전능 상태로 재프로그래밍할 수 있다.[38]그러나 체세포의 재프로그래밍은 효율성이 낮고 확률적으로 간주되는 경우가 많다.[81]
보다 빠른 셀 사이클이 플뤼리포텐시의 핵심 요소라는 생각으로, 재프로그래밍 효율을 향상시킬 수 있다.셀 사이클 규제자의 조작을 통한 플뤼도 향상 방법으로는 키클린 D/Cdk4의 과다압축, S39와 S253의 Sox2의 인산화, 사이클린 A와 사이클린 E의 과다압축, Rb의 녹다운, Cip/Kip 계열이나 잉크 계열의 멤버의 녹다운 등이 있다.[38]또한 재프로그래밍 효율성은 오래되거나 느린 다이빙 셀의 재프로그래밍 효율성이 증가하는 비효율성에 의해 제시되는 확률적 단계에서 발생한 셀 분할 수와 상관관계가 있다.[82]
리니지
리니지는 태아의 발달을 분석하는 중요한 절차다.세포 선은 각 분열에 있는 세포들 사이의 관계를 보여주기 때문이다.이것은 줄기세포의 효과, 수명, 그리고 다른 요소들을 인식하는 데 도움이 되는 방법으로 줄기세포의 선들을 분석하는데 도움을 준다.세포 혈통 돌연변이 유전자의 기술로 유전자의 경로에 도움을 줄 수 있는 줄기세포 복제 유전자를 분석할 수 있다.이러한 경로는 줄기세포의 성능을 조절할 수 있다.[83]
자가 갱신을 보장하기 위해 줄기세포는 두 가지 유형의 세포 분열을 겪는다(줄기세포 분열과 분화 다이어그램 참조).대칭분할은 둘 다 줄기세포 특성을 가진 동일한 두 개의 딸 세포를 낳는다.반면 비대칭분할은 줄기세포 1개와 자기갱신 잠재력이 제한적인 조제세포 1개만 생산한다.유전자 조작자는 성숙한 세포로 종말적으로 분화하기 전에 세포분열을 여러 차례 겪을 수 있다.대칭 분열과 비대칭 분열의 분자 구분이 딸 세포간 세포막 단백질(수용체 등)의 차등분리에 있을 가능성이 있다.[84]
또 다른 이론은 줄기세포가 특정 틈새에서 환경적인 단서 때문에 구별되지 않은 채로 남아 있다는 것이다.줄기세포는 틈새에서 벗어나거나 더 이상 신호를 받지 못할 때 분화한다.드로필라 게르마륨의 연구는 제르마륨 줄기 세포가 분화하는 것을 막는 데카펜타플렉틱과 아델렌 결합의 신호를 확인했다.[85][86]
치료법
줄기세포 치료는 질병이나 상태를 치료하거나 예방하기 위해 줄기세포를 사용하는 것이다.골수이식은 임상시험에서 효과가 입증돼 수년 전부터 사용해온 줄기세포 치료제의 일종이다.[87][88]
줄기세포 이식술은 심장 좌뇌를 강화하는 것은 물론 과거 심장마비로 고생한 환자들에게 심장조직을 유지하는 데 도움이 될 수 있다.[89]
이점
줄기세포 치료는 치료 중인 질병이나 질환의 증상을 낮출 수 있다.증상을 낮추면 환자들이 그 질병이나 상태의 약물 섭취를 줄일 수 있을 것이다.줄기세포 치료는 또한 사회가 줄기 세포에 대한 이해와 미래의 치료를 더 많이 할 수 있도록 지식을 제공할 수 있다.[90]의사들의 신념은 어떤 부상도 일으키지 않는 것이 될 것이고, 줄기 세포는 그것을 이전보다 더 단순하게 만들 것이다.그들의 성격에 의한 수술 과정은 해롭다.성공적인 결과를 얻기 위한 방법으로 휴지를 떨어뜨려야 한다.줄기세포를 이용한 외과적 개입의 위험성을 막을 수 있다.게다가, 질병의 가능성이 있고, 수술이 실패하든, 추가 수술이 필요할 수도 있다.마취와 관련된 위험도 줄기세포로 제거할 수 있다.[91]게다가, 줄기 세포는 환자의 몸에서 채취되어 그들이 원하는 곳에 재배치되었다.환자 자신의 몸에서 나오기 때문에 이를 자가 치료라고 한다.자가 치료법이 가장 안전한 것으로 생각되는데, 왜냐하면 기증자 물질 거부 가능성이 거의 없기 때문이다.
단점들
줄기세포 치료는 사람의 이전 세포를 제거하기 위해 이식 전 방사선의 필요조건이나 환자의 면역체계가 줄기세포의 표적을 겨냥할 수 있기 때문에 면역억제가 필요할 수 있다.두 번째 가능성을 피하기 위한 한 가지 접근법은 치료를 받고 있는 동일한 환자의 줄기세포를 사용하는 것이다.
특정 줄기세포에 대한 순응성은 특정 세포 유형을 얻는 것을 어렵게 만들 수도 있다.모집단의 모든 세포가 균일하게 분화하는 것은 아니기 때문에 필요한 정확한 세포 유형을 얻는 것도 어렵다.분화되지 않은 세포는 원하는 유형이 아닌 다른 조직을 만들 수 있다.[92]
일부 줄기세포는 이식 후 종양을 형성한다.[93] 특히 배아줄기세포, 태아적합성줄기세포, 유도만능줄기세포에서 플뤼포텐성은 종양 형성과 관련이 있다.태아의 적절한 줄기세포는 다발성에도 불구하고 종양을 형성한다.[94]
배아줄기세포를 이용하거나 연구하는 관행에 대해서도 윤리적 우려가 제기된다.배반포구에서 세포를 채취하면 배반포구가 사망한다.관심사는 배반구균을 인간의 생명체로 봐야 하느냐 마느냐다.[95]이 문제에 대한 논쟁은 주로 철학적인 것이지 과학적인 토론이 아니다.
줄기세포 관광
줄기세포 관광은 환자(그리고 때때로 그들의 가족)가 줄기세포 시술을 받기 위해 다른 관할로 여행하는 산업으로, 승인되지는 않았지만 입증된 치료법으로 인터넷에 광고되고 있다.[96]
최근 몇 년간[when?] 미국은 "줄기세포 클리닉"[citation needed]이 폭발적으로 증가했다.줄기세포 시술은 클리닉에게 매우 유익하다.광고는 권위적으로 들리지만 절차의 효과와 안전성은 입증되지 않았다.환자들은 때때로[97] 척추 종양이나 죽음과 같은 합병증을 경험한다.높은 비용은 또한 재정적인 파탄으로 이어질 수 있다.[97]연구원들에 따르면, 대중, 환자, 의사들에게 이 문제에 대해 교육할 필요가 있다고 한다.[98]
줄기세포 연구를 옹호하는 최대 학술단체인 국제줄기세포연구회에 따르면 줄기세포 치료법은 현재 개발 중이며 아직 입증되지 않았다고 한다.[99][100]의사들은 임상시험이 이러한 치료법이 안전하고 효과적인지 여부를 계속 조사하지만 비윤리적인 클리닉이 이를 입증된 것으로 제시한다는 사실을 환자에게 알려야 한다.[101]
리서치
인간 배아줄기세포를 다루는 기본 특허 중 일부는 위스콘신 동문연구재단(WARF)이 소유하고 있는데 이들은 제임스 A가 발명한 특허 5,843,780,6200,806,7029,913명이다. 톰슨.WARF는 이러한 특허들을 학계 과학자들에게 강요하는 것이 아니라, 기업에 대해 강제한다.[102]
2006년, 미국 특허청(USPTO)에 3개의 특허에 대한 재심의를 의뢰한 것은 공익특허재단에서 의뢰인인 비영리 특허감시단체인 Consumer Watchdog Group Consumer Watchdog(옛 납세자 및 소비자권리재단)를 대표해 청구한 것이다.[102]는 토론의 미국 특허청은며 양당 사자 간에 여러 차례의 검토 과정에서 미국 특허청은 처음에 소비자 Watchdog과 하지만 반응에, 전시 소요 보충제원들이 더 좁은 만들 수 있으며, 2008년 미국 특허청은 개정된 cla을 발견했다 모든 3특허의 주장을 개정하였다 모든 3patents,[103]의 모든 주장을 동의했다.나는s 세 가지 특허 모두 특허를 획득할 수 있다.특허권 중 하나에 대한 결정(702만9913건)은 항소할 수 있는 반면 나머지 2건에 대한 결정은 그렇지 않았다.[104][105]소비자감시원은 상소를 허가한 미국 특허청의 특허심판원(BPAI)에 '913 특허권 부여에 항소했고, 2010년 BPAI는 '913 특허권'의 개정된 청구권은 특허를 받을 수 없다고 결정했다.[106]그러나 WARF는 이 사건에 대한 재공소를 할 수 있었고, 이를 통해 '913 특허'의 주장을 다시 수정하여 범위를 좁혔으며, 2013년 1월 개정 청구가 허용되었다.[107]
2013년 7월 소비자감시원은 '913 특허'의 청구를 특허 사건을 심리하는 연방항소법원(CAFC)에 허용하기로 한 결정에 항소하겠다고 발표했다.[108]CAFC는 2013년 12월 청문회에서 소비자 감시기구가 상소할 법적 근거가 있는지에 대해 문제를 제기했는데, 이 문제가 해결될 때까지 이 사건은 진행될 수 없었다.[109]
조사
줄기세포 치료를 연구하고 있는 질병 및 조건은 다음과 같다.
- 당뇨병[110]
- 안드로겐성 탈모증 및 탈모증[111][112]
- 류마티스 관절염[110]
- 파킨슨병[110]
- 알츠하이머병[110]
- 골관절염.[110]
- 뇌졸중 및 외상성 뇌손상 치료[113]
- 선천성 장애로[114] 인한 학습 장애
- 척수 손상 수리[115]
- 심근경색[116]
- 항암치료[113]
- 대머리 반전[117]
- 누락된 톱니[118] 교체
- 수리 청력[119]
- 시력[120] 회복 및 각막[121] 손상 복구
- 근위축성 측경화증[122]
- 크론병[123]
- 상처 치유[124]
- 정조세포의 부재로 인한 남성 불임.[125]최근의 연구에서, 과학자들은 세포를 재프로그래밍하여 정자문으로 바꾸는 방법으로 이 문제를 해결할 수 있는 방법을 찾아냈다.다른 연구들은 쥐 고환에 인간 iPSC 세포를 도입함으로써 정조세포의 복원을 증명했다.이것은 아즈오즈페르증의 종말을 의미할 수 있다.[126]
- 여성 불임: 배아줄기세포로 만든 난모세포.과학자들이 난소에서 발견된 희귀한 유형의 세포(0.014%)인 난소줄기세포를 발견했다.불임뿐만 아니라 조기 난소 부족에도 치료제로 쓰일 수 있다.[127]
줄기세포를 위한 다양한 원천을 개발하고, 신경퇴행성 질환과 질환, 당뇨병, 심장질환, 기타 질환에 줄기세포 치료를 적용하기 위한 연구가 진행 중이다.[128]줄기세포를 이용한 오르가노이드 생성에 관한 연구도 진행 중이며, 이를 통해 인간 발달, 유기생식, 인간 질병 모델링 등에 대한 이해를 높일 수 있을 것으로 보인다.[129]
최근 들어 배아줄기세포를 분리하고 배양하는 과학자의 능력과 체세포 핵이식을 이용한 줄기세포의 생성 능력, 유도 만능줄기세포의 생성 기법 등으로 인해 낙태 정치와 인간복제와 관련된 논란이 슬금슬금 일어나고 있다.[citation needed]
간독성 및 약물유발성 간손상은 개발 및 시장 철수 시 신약의 실패가 상당수를 차지하며, 약물 개발 과정 초기에 독성을 검출할 수 있는 줄기세포 유래 간세포 유사 세포와 같은 검사 검사의 필요성을 강조한다.[130]
주목할 만한 연구
2021년 8월, 대학 건강 네트워크의 프린세스 마거릿 암 센터의 연구원들은 향후 암 치료법을 개발하는 데 도움을 줄 수 있는 주요 줄기세포의 숙영 메커니즘을 발견했다고 발표했다.[131]
참고 항목
참조
- ^ a b Atala A, Lanza R (2012-12-31). Handbook of Stem Cells. Academic Press. p. 452. ISBN 978-0-12-385943-3.
- ^ Becker AJ, McCulloch EA, Till JE (February 1963). "Cytological demonstration of the clonal nature of spleen colonies derived from transplanted mouse marrow cells". Nature. 197 (4866): 452–4. Bibcode:1963Natur.197..452B. doi:10.1038/197452a0. hdl:1807/2779. PMID 13970094. S2CID 11106827.
- ^ Siminovitch L, McCulloch EA, Till JE (December 1963). "The distribution of colony-forming cells among spleen colonies". Journal of Cellular and Comparative Physiology. 62 (3): 327–36. doi:10.1002/jcp.1030620313. hdl:1807/2778. PMID 14086156. S2CID 43875977.
- ^ Müller AM, Huppertz S, Henschler R (July 2016). "Hematopoietic Stem Cells in Regenerative Medicine: Astray or on the Path?". Transfusion Medicine and Hemotherapy. 43 (4): 247–254. doi:10.1159/000447748. PMC 5040947. PMID 27721700.
- ^ Ralston, Michelle (17 July 2008). "Stem Cell Research Around the World". Pew Research Center's Religion & Public Life Project.
- ^ Tuch, B. E. (September 2006). "Stem cells: a clinical update". Australian Family Physician. 35 (9): 719–721. doi:10.3316/informit.362157097178530 (inactive 28 February 2022). PMID 16969445. ProQuest 216301343.
{{cite journal}}: CS1 maint : 2022년 2월 현재 DOI 비활성화(링크) - ^ a b Ferreira L (2014-01-03). "Stem Cells: A Brief History and Outlook". Stem Cells: A Brief History and Outlook - Science in the News. WordPress. Retrieved 3 December 2019.
- ^ a b Ramalho-Santos, Miguel; Willenbring, Holger (June 2007). "On the Origin of the Term 'Stem Cell'". Cell Stem Cell. 1 (1): 35–38. doi:10.1016/j.stem.2007.05.013. PMID 18371332.
- ^ MacPherson C. "The Accidental Discovery of Stem Cells". USask News. University of Saskatchewan. Retrieved 3 December 2019.
- ^ 빈카 원자로 사고, 1958년 1월 27일 Wm이 편찬한 웨이백 기계에 보관.로버트 존스턴
- ^ 보일, 레베카다친 브라질 늑대는 줄기세포로 치료된 최초의 야생동물이다.Popular Science, 2011년 1월 15일.2021-08-07 검색됨
- ^ 트라타멘토.Conselho Federal de Medicina Vetersharia, 2011-11-01 (포르투갈어)2021-08-07 검색됨
- ^ 선후이, H. E. 나카다, D. & 모리슨, S. J. (2009)줄기세포 자가 재생의 메커니즘.연간 세포 및 발달 검토, 25, 377–406.
- ^ Cong YS, Wright WE, Shay JW (September 2002). "Human telomerase and its regulation". Microbiology and Molecular Biology Reviews. 66 (3): 407–25, table of contents. doi:10.1128/MMBR.66.3.407-425.2002. PMC 120798. PMID 12208997.
- ^ a b c d e f Schöler HR (2007). "The Potential of Stem Cells: An Inventory". In Nikolaus Knoepffler, Dagmar Schipanski, Stefan Lorenz Sorgner (eds.). Humanbiotechnology as Social Challenge. Ashgate Publishing. p. 28. ISBN 978-0-7546-5755-2.
- ^ Mitalipov S, Wolf D (2009). "Totipotency, pluripotency and nuclear reprogramming". Engineering of Stem Cells. Advances in Biochemical Engineering/Biotechnology. Vol. 114. pp. 185–99. Bibcode:2009esc..book..185M. doi:10.1007/10_2008_45. ISBN 978-3-540-88805-5. PMC 2752493. PMID 19343304.
- ^ Ulloa-Montoya F, Verfaillie CM, Hu WS (July 2005). "Culture systems for pluripotent stem cells". Journal of Bioscience and Bioengineering. 100 (1): 12–27. doi:10.1263/jbb.100.12. PMID 16233846.
- ^ Friedenstein AJ, Deriglasova UF, Kulagina NN, Panasuk AF, Rudakowa SF, Luriá EA, Ruadkow IA (1974). "Precursors for fibroblasts in different populations of hematopoietic cells as detected by the in vitro colony assay method". Experimental Hematology. 2 (2): 83–92. PMID 4455512. INIST:PASCAL7536501060 NAID 10025700209.
- ^ Friedenstein AJ, Gorskaja JF, Kulagina NN (September 1976). "Fibroblast precursors in normal and irradiated mouse hematopoietic organs". Experimental Hematology. 4 (5): 267–74. PMID 976387.
- ^ Sekhar L, Bisht N (2006-09-01). "Stem Cell Therapy". Apollo Medicine. 3 (3): 271–276. doi:10.1016/S0976-0016(11)60209-3.
- ^ Thomson JA, Itskovitz-Eldor J, Shapiro SS, Waknitz MA, Swiergiel JJ, Marshall VS, Jones JM (November 1998). "Embryonic stem cell lines derived from human blastocysts". Science. 282 (5391): 1145–7. Bibcode:1998Sci...282.1145T. doi:10.1126/science.282.5391.1145. PMID 9804556.
- ^ a b Gilbert, Scott F. (2014). Developmental Biology. Sinauer Associates. ISBN 978-0-87893-978-7.[페이지 필요]
- ^ Rakic P (October 2009). "Evolution of the neocortex: a perspective from developmental biology". Nature Reviews. Neuroscience. 10 (10): 724–35. doi:10.1038/nrn2719. PMC 2913577. PMID 19763105.
- ^ Noctor SC, Flint AC, Weissman TA, Dammerman RS, Kriegstein AR (February 2001). "Neurons derived from radial glial cells establish radial units in neocortex". Nature. 409 (6821): 714–20. Bibcode:2001Natur.409..714N. doi:10.1038/35055553. PMID 11217860. S2CID 3041502.
- ^ Ying QL, Wray J, Nichols J, Batlle-Morera L, Doble B, Woodgett J, Cohen P, Smith A (May 2008). "The ground state of embryonic stem cell self-renewal". Nature. 453 (7194): 519–23. Bibcode:2008Natur.453..519Y. doi:10.1038/nature06968. PMC 5328678. PMID 18497825.
- ^ "Culture of Human Embryonic Stem Cells (hESC)". National Institutes of Health. Archived from the original on 2010-01-06. Retrieved 2010-03-07.
- ^ Chambers I, Colby D, Robertson M, Nichols J, Lee S, Tweedie S, Smith A (May 2003). "Functional expression cloning of Nanog, a pluripotency sustaining factor in embryonic stem cells". Cell. 113 (5): 643–55. doi:10.1016/S0092-8674(03)00392-1. hdl:1842/843. PMID 12787505. S2CID 2236779.
- ^ Boyer LA, Lee TI, Cole MF, Johnstone SE, Levine SS, Zucker JP, Guenther MG, Kumar RM, Murray HL, Jenner RG, Gifford DK, Melton DA, Jaenisch R, Young RA (September 2005). "Core transcriptional regulatory circuitry in human embryonic stem cells". Cell. 122 (6): 947–56. doi:10.1016/j.cell.2005.08.020. PMC 3006442. PMID 16153702.
- ^ Adewumi O, Aflatoonian B, Ahrlund-Richter L, Amit M, Andrews PW, Beighton G, et al. (The International Stem Cell Initiative) (July 2007). "Characterization of human embryonic stem cell lines by the International Stem Cell Initiative". Nature Biotechnology. 25 (7): 803–16. doi:10.1038/nbt1318. PMID 17572666. S2CID 13780999.
- ^ Mahla RS (2016). "Stem Cells Applications in Regenerative Medicine and Disease Therapeutics". International Journal of Cell Biology. 2016 (7): 1–24. doi:10.1155/2016/6940283. PMC 4969512. PMID 27516776.
- ^ Winslow R, Mundy A (23 January 2009). "First Embryonic Stem-Cell Trial Gets Approval from the FDA". The Wall Street Journal.
- ^ "Embryonic Stem Cell Therapy At Risk? Geron Ends Clinical Trial". ScienceDebate.com. Retrieved 2011-12-11.
- ^ Wu DC, Boyd AS, Wood KJ (May 2007). "Embryonic stem cell transplantation: potential applicability in cell replacement therapy and regenerative medicine". Frontiers in Bioscience. 12 (8–12): 4525–35. doi:10.2741/2407. PMID 17485394. S2CID 6355307.
- ^ a b Zomer HD, Vidane AS, Gonçalves NN, Ambrósio CE (2015-09-28). "Mesenchymal and induced pluripotent stem cells: general insights and clinical perspectives". Stem Cells and Cloning: Advances and Applications. 8: 125–34. doi:10.2147/SCCAA.S88036. PMC 4592031. PMID 26451119.
- ^ Caplan AI (September 1991). "Mesenchymal stem cells". Journal of Orthopaedic Research. 9 (5): 641–50. doi:10.1002/jor.1100090504. PMID 1870029. S2CID 22606668.
- ^ a b c d e f Koledova Z, Krämer A, Kafkova LR, Divoky V (November 2010). "Cell-cycle regulation in embryonic stem cells: centrosomal decisions on self-renewal". Stem Cells and Development. 19 (11): 1663–78. doi:10.1089/scd.2010.0136. PMID 20594031.
- ^ a b c d Barta T, Dolezalova D, Holubcova Z, Hampl A (March 2013). "Cell cycle regulation in human embryonic stem cells: links to adaptation to cell culture". Experimental Biology and Medicine. 238 (3): 271–5. doi:10.1177/1535370213480711. PMID 23598972. S2CID 2028793.
- ^ a b c d e f g Zaveri L, Dhawan J (2018). "Cycling to Meet Fate: Connecting Pluripotency to the Cell Cycle". Frontiers in Cell and Developmental Biology. 6: 57. doi:10.3389/fcell.2018.00057. PMC 6020794. PMID 29974052.
- ^ Koledova Z, Kafkova LR, Calabkova L, Krystof V, Dolezel P, Divoky V (February 2010). "Cdk2 inhibition prolongs G1 phase progression in mouse embryonic stem cells". Stem Cells and Development. 19 (2): 181–94. doi:10.1089/scd.2009.0065. PMID 19737069.
- ^ Becker KA, Ghule PN, Therrien JA, Lian JB, Stein JL, van Wijnen AJ, Stein GS (December 2006). "Self-renewal of human embryonic stem cells is supported by a shortened G1 cell cycle phase". Journal of Cellular Physiology. 209 (3): 883–93. doi:10.1002/jcp.20776. PMID 16972248. S2CID 24908771.
- ^ Ariff Bongso; Eng Hin Lee, eds. (2005). "Stem cells: their definition, classification and sources". Stem Cells: From Benchtop to Bedside. World Scientific. p. 5. ISBN 978-981-256-126-8. OCLC 443407924.
- ^ Moore, Keith L.; Persaud, T. V. N.; Torchia, Mark G. (2013). Before We are Born: Essentials of Embryology and Birth Defects. Saunders/Elsevier. ISBN 978-1-4377-2001-3.[페이지 필요]
- ^ "What is a stem cell". anthonynolan.org. Anthony Nolan. Retrieved 17 February 2022.
- ^ Jiang Y, Jahagirdar BN, Reinhardt RL, Schwartz RE, Keene CD, Ortiz-Gonzalez XR, Reyes M, Lenvik T, Lund T, Blackstad M, Du J, Aldrich S, Lisberg A, Low WC, Largaespada DA, Verfaillie CM (July 2002). "Pluripotency of mesenchymal stem cells derived from adult marrow". Nature. 418 (6893): 41–9. Bibcode:2002Natur.418...41J. doi:10.1038/nature00870. PMID 12077603. S2CID 47162269.
- ^ "Bone marrow (stem cell) donation: MedlinePlus Medical Encyclopedia". medlineplus.gov. Retrieved 2021-10-17.
- ^ Coughlin RP, Oldweiler A, Mickelson DT, Moorman CT (October 2017). "Adipose-Derived Stem Cell Transplant Technique for Degenerative Joint Disease". Arthroscopy Techniques. 6 (5): e1761–e1766. doi:10.1016/j.eats.2017.06.048. PMC 5795060. PMID 29399463.
- ^ Ratajczak MZ, Machalinski B, Wojakowski W, Ratajczak J, Kucia M (May 2007). "A hypothesis for an embryonic origin of pluripotent Oct-4(+) stem cells in adult bone marrow and other tissues". Leukemia. 21 (5): 860–7. doi:10.1038/sj.leu.2404630. PMID 17344915.
- ^ Narasipura SD, Wojciechowski JC, Charles N, Liesveld JL, King MR (January 2008). "P-Selectin coated microtube for enrichment of CD34+ hematopoietic stem and progenitor cells from human bone marrow". Clinical Chemistry. 54 (1): 77–85. doi:10.1373/clinchem.2007.089896. PMID 18024531.
- ^ Terai S, Ishikawa T, Omori K, Aoyama K, Marumoto Y, Urata Y, Yokoyama Y, Uchida K, Yamasaki T, Fujii Y, Okita K, Sakaida I (October 2006). "Improved liver function in patients with liver cirrhosis after autologous bone marrow cell infusion therapy". Stem Cells. 24 (10): 2292–8. doi:10.1634/stemcells.2005-0542. PMID 16778155. S2CID 5649484.
- ^ Subrammaniyan R, Amalorpavanathan J, Shankar R, Rajkumar M, Baskar S, Manjunath SR, Senthilkumar R, Murugan P, Srinivasan VR, Abraham S (September 2011). "Application of autologous bone marrow mononuclear cells in six patients with advanced chronic critical limb ischemia as a result of diabetes: our experience". Cytotherapy. 13 (8): 993–9. doi:10.3109/14653249.2011.579961. PMID 21671823.
- ^ Madhusankar N (2007). "Use of Bone Marrow derived Stem Cells in Patients with Cardiovascular Disorders". Journal of Stem Cells and Regenerative Medicine. 3 (1): 28–9. PMC 3908115. PMID 24693021.
- ^ Dedeepiya VD, Rao YY, Jayakrishnan GA, Parthiban JK, Baskar S, Manjunath SR, Senthilkumar R, Abraham SJ (2012). "Index of CD34+ Cells and Mononuclear Cells in the Bone Marrow of Spinal Cord Injury Patients of Different Age Groups: A Comparative Analysis". Bone Marrow Research. 2012: 1–8. doi:10.1155/2012/787414. PMC 3398573. PMID 22830032.
- ^ Gardner RL (March 2002). "Stem cells: potency, plasticity and public perception". Journal of Anatomy. 200 (Pt 3): 277–82. doi:10.1046/j.1469-7580.2002.00029.x. PMC 1570679. PMID 12033732.
- ^ Behrens A, van Deursen JM, Rudolph KL, Schumacher B (March 2014). "Impact of genomic damage and ageing on stem cell function". Nature Cell Biology. 16 (3): 201–7. doi:10.1038/ncb2928. PMC 4214082. PMID 24576896.
- ^ Barrilleaux B, Phinney DG, Prockop DJ, O'Connor KC (November 2006). "Review: ex vivo engineering of living tissues with adult stem cells". Tissue Engineering. 12 (11): 3007–19. CiteSeerX 10.1.1.328.2873. doi:10.1089/ten.2006.12.3007. PMID 17518617.
- ^ Gimble JM, Katz AJ, Bunnell BA (May 2007). "Adipose-derived stem cells for regenerative medicine". Circulation Research. 100 (9): 1249–60. doi:10.1161/01.RES.0000265074.83288.09. PMC 5679280. PMID 17495232.
- ^ Kuroda Y, Kitada M, Wakao S, Nishikawa K, Tanimura Y, Makinoshima H, Goda M, Akashi H, Inutsuka A, Niwa A, Shigemoto T, Nabeshima Y, Nakahata T, Nabeshima Y, Fujiyoshi Y, Dezawa M (May 2010). "Unique multipotent cells in adult human mesenchymal cell populations". Proceedings of the National Academy of Sciences of the United States of America. 107 (19): 8639–43. Bibcode:2010PNAS..107.8639K. doi:10.1073/pnas.0911647107. PMC 2889306. PMID 20421459.
- ^ "Bone Marrow Transplant". ucsfchildrenshospital.org.
- ^ Kane, Ed (2008-05-01). "Stem-cell therapy shows promise for horse soft-tissue injury, disease". DVM Newsmagazine. Retrieved 2008-06-12.
- ^ "Stem Cell FAQ". US Department of Health and Human Services. 2004-07-14. Archived from the original on 2009-01-09.
- ^ Oliveira PH, da Silva CL, Cabral JM (2014). "Genomic Instability in Human Stem Cells: Current Status and Future Challenges". Stem Cells. 32 (11): 2824–2832. doi:10.1002/stem.1796. PMID 25078438. S2CID 41335566.
- ^ De Coppi P, Bartsch G, Siddiqui MM, Xu T, Santos CC, Perin L, Mostoslavsky G, Serre AC, Snyder EY, Yoo JJ, Furth ME, Soker S, Atala A (January 2007). "Isolation of amniotic stem cell lines with potential for therapy". Nature Biotechnology. 25 (1): 100–6. doi:10.1038/nbt1274. PMID 17206138. S2CID 6676167.
- ^ "Vatican newspaper calls new stem cell source 'future of medicine'". Catholic News Agency. 3 February 2010.
- ^ "European Biotech Company Biocell Center Opens First U.S. Facility for Preservation of Amniotic Stem Cells in Medford, Massachusetts". Reuters. 2009-10-22. Archived from the original on 2009-10-30. Retrieved 2010-03-14.
- ^ "Europe's Biocell Center opens Medford office – Daily Business Update". The Boston Globe. 2009-10-22. Retrieved 2010-03-14.
- ^ "The Ticker". BostonHerald.com. 2009-10-22. Retrieved 2010-03-14.
- ^ "Biocell Center opens amniotic stem cell bank in Medford". Mass High Tech Business News. 2009-10-23. Archived from the original on 2012-10-14. Retrieved 2012-08-26.
- ^ "World's First Amniotic Stem Cell Bank Opens In Medford". wbur.org. Retrieved 2010-03-14.
- ^ "Biocell Center Corporation Partners with New England's Largest Community-Based Hospital Network to Offer a Unique..." Medford, Mass.: Prnewswire.com. Retrieved 2010-03-14.
- ^ a b c "Making human embryonic stem cells". The Economist. 2007-11-22.
- ^ Brand M, Palca J, Cohen A (2007-11-20). "Skin Cells Can Become Embryonic Stem Cells". National Public Radio.
- ^ "Breakthrough Set to Radically Change Stem Cell Debate". News Hour with Jim Lehrer. 2007-11-20.
- ^ a b c d e Kimbrel EA, Lanza R (December 2016). "Pluripotent stem cells: the last 10 years". Regenerative Medicine. 11 (8): 831–847. doi:10.2217/rme-2016-0117. PMID 27908220.
- ^ a b c Takahashi K, Yamanaka S (August 2006). "Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors". Cell. 126 (4): 663–76. doi:10.1016/j.cell.2006.07.024. hdl:2433/159777. PMID 16904174. S2CID 1565219.
- ^ Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K, Yamanaka S (November 2007). "Induction of pluripotent stem cells from adult human fibroblasts by defined factors". Cell. 131 (5): 861–72. doi:10.1016/j.cell.2007.11.019. hdl:2433/49782. PMID 18035408. S2CID 8531539.
- ^ Yu J, Vodyanik MA, Smuga-Otto K, Antosiewicz-Bourget J, Frane JL, Tian S, Nie J, Jonsdottir GA, Ruotti V, Stewart R, Slukvin II, Thomson JA (December 2007). "Induced pluripotent stem cell lines derived from human somatic cells". Science. 318 (5858): 1917–20. Bibcode:2007Sci...318.1917Y. doi:10.1126/science.1151526. PMID 18029452. S2CID 86129154.
- ^ "그의 영감 교수 야마나카 신야 교토 대학교는 일이 극도로 공급 부족에 있고 난자, 필요성 및 필요성과 파괴도 전 프로 생활 운동이 반대한다 인간 복제 배아를 생성하기 위해 없이 인간 배아 줄기 세포를 만들기를 제안의 연구 성과에서 나온다.".Highfield R(2007-11-16)."돌리 창시자 교수인 이언 윌머트는 복제를 싫어하".텔레 그래프.런던.그 2009-07-30에 원래에서 Archived.
- ^ Maldonado M, Luu RJ, Ico G, Ospina A, Myung D, Shih HP, Nam J (September 2017). "Lineage- and developmental stage-specific mechanomodulation of induced pluripotent stem cell differentiation". Stem Cell Research & Therapy. 8 (1): 216. doi:10.1186/s13287-017-0667-2. PMC 5622562. PMID 28962663.
- ^ a b Robinton DA, Daley GQ (January 2012). "The promise of induced pluripotent stem cells in research and therapy". Nature. 481 (7381): 295–305. Bibcode:2012Natur.481..295R. doi:10.1038/nature10761. PMC 3652331. PMID 22258608.
- ^ Staerk J, Dawlaty MM, Gao Q, Maetzel D, Hanna J, Sommer CA, Mostoslavsky G, Jaenisch R (July 2010). "Reprogramming of human peripheral blood cells to induced pluripotent stem cells". Cell Stem Cell. 7 (1): 20–4. doi:10.1016/j.stem.2010.06.002. PMC 2917234. PMID 20621045. Lay summary – ScienceDaily.
{{cite journal}}:Cite는 사용되지 않는 매개 변수를 사용한다.lay-url=(도움말) - ^ Chen X, Hartman A, Guo S (2015-09-01). "Choosing Cell Fate Through a Dynamic Cell Cycle". Current Stem Cell Reports. 1 (3): 129–138. doi:10.1007/s40778-015-0018-0. PMC 5487535. PMID 28725536.
- ^ Hindley C, Philpott A (April 2013). "The cell cycle and pluripotency". The Biochemical Journal. 451 (2): 135–43. doi:10.1042/BJ20121627. PMC 3631102. PMID 23535166.
- ^ Fox, D.T.; Morris, L.X.; Nystul, T.; Spradling, A.C. (2008). "Lineage analysis of stem cells". StemBook. doi:10.3824/stembook.1.33.1. PMID 20614627.
- ^ Beckmann, Julia; Scheitza, Sebastian; Wernet, Peter; Fischer, Johannes C.; Giebel, Bernd (15 June 2007). "Asymmetric cell division within the human hematopoietic stem and progenitor cell compartment: identification of asymmetrically segregating proteins". Blood. 109 (12): 5494–5501. doi:10.1182/blood-2006-11-055921. PMID 17332245.
- ^ Xie, Ting; Spradling, Allan C (July 1998). "decapentaplegic Is Essential for the Maintenance and Division of Germline Stem Cells in the Drosophila Ovary". Cell. 94 (2): 251–260. doi:10.1016/s0092-8674(00)81424-5. PMID 9695953. S2CID 11347213.
- ^ Song, X.; Zhu, CH; Doan, C; Xie, T (7 June 2002). "Germline Stem Cells Anchored by Adherens Junctions in the Drosophila Ovary Niches". Science. 296 (5574): 1855–1857. Bibcode:2002Sci...296.1855S. doi:10.1126/science.1069871. PMID 12052957. S2CID 25830121.
- ^ 줄기세포 탐사를 위한 이안 머너건업데이트됨: 2013년 12월 16일 줄기세포 이식을 수행하는 이유
- ^ 국립암연구소 자료표 웹사이트에서 골수이식 및 말초혈액줄기세포이식.베데스다, MD: 미국 보건복지부 국립보건원, 2010.2010년 8월 24일 인용
- ^ Stamm C, Westphal B, Kleine HD, Petzsch M, Kittner C, Klinge H, et al. (January 2003). "Autologous bone-marrow stem-cell transplantation for myocardial regeneration". Lancet. 361 (9351): 45–6. doi:10.1016/S0140-6736(03)12110-1. PMID 12517467. S2CID 23858666.
- ^ Master Z, McLeod M, Mendez I (March 2007). "Benefits, risks and ethical considerations in translation of stem cell research to clinical applications in Parkinson's disease". Journal of Medical Ethics. 33 (3): 169–73. doi:10.1136/jme.2005.013169. JSTOR 27719821. PMC 2598267. PMID 17329391.
- ^ "Comprehensive Stem Cell Training Course". R3 Medical Training. Retrieved 2021-05-15.
- ^ Moore KL, Persaud TV, Torchia MG (2013). Before We Are Born: Essentials of Embryology and Birth Defects. Philadelphia, PA: Saunders, Elsevier.
- ^ 버나딘 힐리, M.D."왜 배아줄기세포가 쓸모없는가" US News and World Reports.2015년 8월 17일에 검색됨.
- ^ "Fetal Stem Cells Cause Tumor in a Teenage Boy".
- ^ Lo, Bernard; Parham, Lindsay (May 2009). "Ethical Issues in Stem Cell Research". Endocrine Reviews. NIH. 30 (3): 204–213. doi:10.1210/er.2008-0031. PMC 2726839. PMID 19366754.
- ^ Bauer, G; Elsallab, M; Abou-El-Enein, M (September 2018). "Concise Review: A Comprehensive Analysis of Reported Adverse Events in Patients Receiving Unproven Stem Cell-Based Interventions". Stem Cells Translational Medicine. 7 (9): 676–685. doi:10.1002/sctm.17-0282. PMC 6127222. PMID 30063299.
- ^ a b Berkowitz, Aaron L.; Miller, Michael B.; Mir, Saad A.; Cagney, Daniel; Chavakula, Vamsidhar; Guleria, Indira; Aizer, Ayal; Ligon, Keith L.; Chi, John H. (14 July 2016). "Glioproliferative Lesion of the Spinal Cord as a Complication of 'Stem-Cell Tourism'". New England Journal of Medicine. 375 (2): 196–198. doi:10.1056/NEJMc1600188. PMID 27331440.
- ^ Bowman, Michelle; Racke, Michael; Kissel, John; Imitola, Jaime (1 November 2015). "Responsibilities of Health Care Professionals in Counseling and Educating Patients With Incurable Neurological Diseases Regarding 'Stem Cell Tourism': Caveat Emptor". JAMA Neurology. 72 (11): 1342–1345. doi:10.1001/jamaneurol.2015.1891. PMID 26322563.
- ^ "Communicating About Unproven Stem Cell Treatments to the Public".
- ^ Tsou, Amy (February 2015). "Ethical Considerations When Counseling Patients About Stem Cell Tourism". CONTINUUM: Lifelong Learning in Neurology. 21 (1 Spinal Cord Disorders): 201–205. doi:10.1212/01.CON.0000461094.76563.be. PMID 25651226.
- ^ Du, Li; Rachul, Christen; Guo, Zhaochen; Caulfield, Timothy (9 March 2016). "Gordie Howe's 'Miraculous Treatment': Case Study of Twitter Users' Reactions to a Sport Celebrity's Stem Cell Treatment". JMIR Public Health and Surveillance. 2 (1): e8. doi:10.2196/publichealth.5264. PMC 4869214. PMID 27227162.
- ^ a b 레갈라도, 안토니오, 데이비드 P.해밀턴(2006년 7월)."한 대학의 특허가 줄기세포 연구자를 어떻게 제한할 수 있는가."월스트리트 저널.2006년 7월 24일에 회수되었다.
- ^ Stephen Jenei, 특허 바리스타스, 2007년 4월 3일 WARF 줄기세포 특허 1라운드에서 탈락
- ^ 2008년 3월 3일 특허 바리스타스의 스테판 제니! WARF, 줄기세포 특허 보유로 2라운드 우승
- ^ Constance Holden for Science Now.2008년 3월 12일 WARF 특허 3점 3점 획득
- ^ Stephen G. Kunin for 특허 포스트 그랜트.2010년 5월 10일 BPAI가 부품 간 재심사 항소에서 WARF 줄기세포 특허청구를 기각함
- ^ 미국 특허청.Board Of 특허심판 및 간섭.납세자 및 소비자 권리를 위한 재단, 요청자 및 상소인 V. 위스콘신 동문 연구 재단, 특허 소유자 및 응답자.2012-011693, 재검사 제어 95/000,154에 항고하십시오.특허 7,029,913 웨이백 머신에 보관된 2013-02-20 항소에 대한 결정
- ^ GenomeWeb 직원, 2013년 7월 03일 소비자 감시 단체, PPF, WARF의 줄기세포 특허 무효화 모색
- ^ 개인 맞춤형 의학 게시판용 앙투아네트 콘스키.2014년 2월 3일 미국 정부와 USPTO, 연방 서킷에 줄기세포 항고 기각 촉구
- ^ a b c d e 줄기세포 기본 사항: 인간 줄기 세포의 잠재적 사용과 이러한 잠재적 사용이 실현되기 전에 극복해야 할 장애물은 무엇인가?줄기세포 정보 월드 와이드 웹 사이트.베데스다(Bethesda, MD: National Institute of Health, 2009, 미국 보건 및 휴먼 서비스 부서). 2009년 4월 26일 일요일을 인용했다.
- ^ "Treating Hair Loss with Stem Cell & PRP Therapy". Stem Cells LA. 2019-02-20. Retrieved 2020-05-30.
- ^ Gentile, Pietro; Garcovich, Simone; Bielli, Alessandra; Scioli, Maria Giovanna; Orlandi, Augusto; Cervelli, Valerio (November 2015). "The Effect of Platelet-Rich Plasma in Hair Regrowth: A Randomized Placebo-Controlled Trial". Stem Cells Translational Medicine. 4 (11): 1317–1323. doi:10.5966/sctm.2015-0107. ISSN 2157-6564. PMC 4622412. PMID 26400925.
- ^ a b Steinberg, Douglas (26 November 2000). "Stem Cells Tapped to Replenish Organs". The Scientist Magazine.
- ^ 이스라엘 과학자들은 2008년 12월 25일 줄기세포를 이용해 뇌의 선천성 결함을 역전시킨다. (이스라엘 예루살렘-하다사 의학 교수 연구).요제프 야나이)
- ^ Kang KS, Kim SW, Oh YH, Yu JW, Kim KY, Park HK, Song CH, Han H (2005). "A 37-year-old spinal cord-injured female patient, transplanted of multipotent stem cells from human UC blood, with improved sensory perception and mobility, both functionally and morphologically: a case study". Cytotherapy. 7 (4): 368–73. doi:10.1080/14653240500238160. PMID 16162459. S2CID 33471639.
- ^ Strauer BE, Schannwell CM, Brehm M (April 2009). "Therapeutic potentials of stem cells in cardiac diseases". Minerva Cardioangiologica. 57 (2): 249–67. PMID 19274033.
- ^ DeNoon, Daniel J. (4 November 2004). "Hair Cloning Nears Reality as Baldness Cure". WebMD.
- ^ Yen AH, Sharpe PT (January 2008). "Stem cells and tooth tissue engineering". Cell and Tissue Research. 331 (1): 359–72. doi:10.1007/s00441-007-0467-6. PMID 17938970. S2CID 23765276.
- ^ "Gene therapy is first deafness 'cure'". New Scientist. February 14, 2005.
- ^ "Stem cells used to restore vision". BBC News. 2005-04-28.
- ^ Hanson C, Hardarson T, Ellerström C, Nordberg M, Caisander G, Rao M, Hyllner J, Stenevi U (March 2013). "Transplantation of human embryonic stem cells onto a partially wounded human cornea in vitro". Acta Ophthalmologica. 91 (2): 127–30. doi:10.1111/j.1755-3768.2011.02358.x. PMC 3660785. PMID 22280565.
- ^ Vastag B (April 2001). "Stem cells step closer to the clinic: paralysis partially reversed in rats with ALS-like disease". JAMA. 285 (13): 1691–3. doi:10.1001/jama.285.13.1691. PMID 11277806.
- ^ Anderson, Querida (15 June 2008). "Osiris Trumpets Its Adult Stem Cell Product". Genetic Engineering and Biotechnology News. 28 (12).
- ^ Gurtner, Geoffrey C.; Callaghan, Matthew J.; Longaker, Michael T. (February 2007). "Progress and Potential for Regenerative Medicine". Annual Review of Medicine. 58 (1): 299–312. doi:10.1146/annurev.med.58.082405.095329. PMID 17076602.
- ^ 한나 V, Gassei K, Orwig 대한 항공(2015년)."줄기 세포 Therapies 남성 불임에 관한우리가 이제 여긴 어디요?" 간다.Carrell D, 슐레겔 P, Racowsky C, Gianaroli 나는(eds.)에서.비엔날레 리뷰 이상의.를 대신하여 서명함. 17–39. doi:10.1007/978-3-319-17849-3_3.아이 에스비엔 978-3-319-17849-3.골수 이식, 2009년 기준은 줄기 세포의 겨우 설립된 사용이다.
- ^ Valli H, Phillips BT, Shetty G, Byrne JA, Clark AT, Meistrich ML, Orwig KE (January 2014). "Germline stem cells: toward the regeneration of spermatogenesis". Fertility and Sterility. 101 (1): 3–13. doi:10.1016/j.fertnstert.2013.10.052. PMC 3880407. PMID 24314923.
- ^ White YA, Woods DC, Takai Y, Ishihara O, Seki H, Tilly JL (February 2012). "Oocyte formation by mitotically active germ cells purified from ovaries of reproductive-age women". Nature Medicine. 18 (3): 413–21. doi:10.1038/nm.2669. PMC 3296965. PMID 22366948.
- ^ Bubela T, Li MD, Hafez M, Bieber M, Atkins H (November 2012). "Is belief larger than fact: expectations, optimism and reality for translational stem cell research". BMC Medicine. 10: 133. doi:10.1186/1741-7015-10-133. PMC 3520764. PMID 23131007.
- ^ Ader M, Tanaka EM (December 2014). "Modeling human development in 3D culture". Current Opinion in Cell Biology. 31: 23–8. doi:10.1016/j.ceb.2014.06.013. PMID 25033469.
- ^ Greenhough, Sebastian; Hay, David C. (April 2012). "Stem Cell-Based Toxicity Screening: Recent Advances in Hepatocyte Generation". Pharmaceutical Medicine. 26 (2): 85–89. doi:10.1007/BF03256896. S2CID 15893493.
- ^ García-Prat, Laura; Kaufmann, Kerstin B.; Schneiter, Florin; Voisin, Veronique; Murison, Alex; Chen, Jocelyn; Chan-Seng-Yue, Michelle; Gan, Olga I.; McLeod, Jessica L.; Smith, Sabrina A.; Shoong, Michelle C.; Parris, Darrien; Pan, Kristele; Zeng, Andy G.X.; Krivdova, Gabriela; Gupta, Kinam; Takayanagi, Shin-Ichiro; Wagenblast, Elvin; Wang, Weijia; Lupien, Mathieu; Schroeder, Timm; Xie, Stephanie Z.; Dick, John E. (August 2021). "TFEB-mediated endolysosomal activity controls human hematopoietic stem cell fate". Cell Stem Cell. 28 (10): 1838–1850.e10. doi:10.1016/j.stem.2021.07.003. PMID 34343492. S2CID 236915618.
추가 읽기
- Manzo, Carlo; Torreno-Pina, Juan A.; Massignan, Pietro; Lapeyre, Gerald J.; Lewenstein, Maciej; Garcia Parajo, Maria F. (25 February 2015). "Weak Ergodicity Breaking of Receptor Motion in Living Cells Stemming from Random Diffusivity". Physical Review X. 5 (1): 011021. arXiv:1407.2552. Bibcode:2015PhRvX...5a1021M. doi:10.1103/PhysRevX.5.011021. S2CID 73582473.
외부 링크
| 위키미디어 커먼즈에는 줄기세포와 관련된 미디어가 있다. |
| 라이브러리 리소스 정보 줄기세포 |