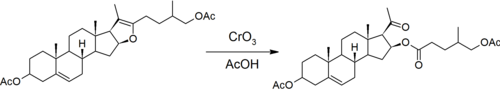마커 열화
Marker degradation마커 분해는 1938-40년 미국 화학자 러셀 얼 마커에 의해 개발된 스테로이드 화학의 3단계 합성 경로이다.식물 스테로이드로부터 코티손과 포유류의 성호르몬(프로게스테론, 에스트라디올 등)을 생산하기 위해 사용되며, [1]제2차 세계대전 직후에는 멕시코가 스테로이드 생산의 세계적 중심지로 자리매김했다.Marker 분해의 발견은 처음으로 상당한 양의 스테로이드 호르몬을 생산할 수 있게 해주었으며, 피임약과 코르티코스테로이드 항염증제 개발의 기본이었다.1999년, 미국 화학 협회와 소시에다드 퀴미카 데 멕시코는 이 길을 국제 화학 [1]랜드마크로 지정했다.
1943년 러셀 얼 마커가 참마 10톤을 수집해 [1]프로게스테론 3kg(6.6파운드)을 합성했을 때 이 루트는 처음으로 대규모로 적용되었다.이 단일 배지는 합성 당시 [1]미화 240,000달러[2](2009년 약 300만달러)의 가치를 가지고 있었습니다.
Marker 분해의 발견은 멕시코에서 정밀 화학 산업의 발전으로 이어졌습니다. 이 산업은 처음부터 시작하여 10년도 채 되지 않아 미국에서 판매되는 인간 성호르몬의 절반 이상을 공급했습니다.산업 호황은 멕시코에서 화학 교육의 큰 확대를 야기했다.
초기 개발
펜실베니아 주립 대학(현 펜실베니아 주립 대학)에서의 Marker의 연구는 "상대적으로 저렴한 시작 물질"[3]에서 스테로이드 호르몬으로 가는 합성 경로를 찾는 것을 목표로 했습니다.반면 식물 스테로이드의 일련 sapogenins에서 일하고, 그는 하나의는 혼합물이, sarsasapogenin변 chain[노트 1]의 구조가 잘못되문학에 묘사되어 왔다:차라리 비반응성"double-tetrahydrofuran"곁 사슬을 갖는 것보다, 실제로 그것은 훨씬 더 반응적인"케톤 스피로 acetal"곁 사슬이라는 것을 깨달았다..[3]케톤 스피로 아세탈은 기본 또는 중성 조건에서는 반응하지 않지만 산성 조건에서는 분해될 수 있습니다. 실제로 Marker는 케톤 스피로 아세탈을 "비정상 반응"[3]이라고 설명했습니다.사사포게닌 측쇄의 본질을 보여주면서, Marker는 Marker 분해로 알려지게 될 첫 번째 단계를 발견했다.
사사포게닌은 다른 스테로이드제의 상업적 전조가 되기에는 너무 비쌌다. 그래서 마커는 프로게스테론과 더 가까운 사포게닌의 풍부한 공급원을 찾기 시작했다.그는 이전에 일본 참마(Dioscorea tokoro)[1][4]에서 발견되었던 디오스게닌이라고 불리는 사포게닌인 트릴륨 에렉툼(Beth root 또는 Wake-robin)에서 한 후보자를 확인했다.마커는 사사포게닌과 디오스게닌이 프로게스테론과[5] 다른 스테로이드 [6][note 2]호르몬으로 전환될 수 있다는 것을 보여주었다.T. 에렉툼에서 추출할 수 있는 디오스게닌의 양은 여전히 만족스럽지 못했기 때문에 Marker는 더 풍부한 공급원을 찾았다.그는 마침내 카베자 데 [note 3]니그로라고 알려진 멕시코산 참마인 디오스코레아의 또 다른 종을 발견했다. 이 참마는 덩이줄기의 [1]무게가 100kg까지 자라는 것으로 보고되었다.
디오스게닌으로부터의 루트
많은 스테로이드 화학과 마찬가지로, 마커 분해는 (상대적으로) 스테로이드 핵의 유사한 기능군을 영향을 받지 않으면서 사포게닌 측쇄를 분해하기 위해 운동 제어에 크게 의존한다.
첫 번째 단계는 사포게닌이 측쇄에 [7]케톤 스피로 아세탈 구조를 가지고 있다는 것을 Marker가 발견하게 한 반응입니다.아세탈은 기본 조건에서는 불활성이지만 산성 조건에서는 가수 분해될 수 있습니다.마커는 아세트산 무수물을 사용하여 6원 피란환을 [8]개방함으로써 형성되는 수산기를 차단한다.
그 후 5원짜리 푸란 고리는 크롬산과 함께 산화적으로 개방된다.이것은 스테로이드 핵에서 프로게스테론의 아세틸 측쇄와 에스테르화된 수산기를 형성한다.
그런 다음 에스테르를 강한 기본 조건에서 가수 분해합니다.에탄올계 수산화나트륨의 사용은 이중 결합을 형성하기 위한 물의 제거로 이어진다.
이 1939년판 Marker 분해의 결과는 16-dehydrop encrenolone(3-hydropregna-5,16-dien-20-one,16-DP)[5]이다.1940년, 최종 가수분해 단계가 아세트산을 사용하도록 변경되어 보다 친숙한 16-데히드로페놀론 아세트산(16-DPA)[9]이 생성되었다.
다운스트림 제품
16-DP는 2단계로 프로게스테론으로 변환할 수 있습니다.먼저 링 D의 이중결합을 수소화시킨 후 오페나우어 산화와 나머지 올레핀을 링 B에서 링 A로 동시에 이동하여 위치 [5]3에서 케톤 카르보닐기와 결합한다.또는 Br, CrO3 및 Zn/HOc를 포함한2 3단계 절차를 사용한다.[1]
16-DP는 테스토스테론, 하류 생성물인 에스트론, 에스트라디올로도 [1][6]전환될 수 있다.
멕시코 스테로이드 산업
Marker의 초기 개발 작업은 현재 화이자의 [1]일부인 미국의 주요 제약회사인 Parke-Davis의 지원을 받았다.그러나 마커는 원재료에 가까운 멕시코에서 스테로이드를 생산하는 것이 상업적으로 더 타당하다는 것을 깨달았다(멕시코 Dioscorea sp;D. compithita는 미국으로 덩이줄기를 돌려보내는 것보다 선호하는[1] 종이 될 것이다.파르케 데이비스는 멕시코에서 훌륭한 화학제품 생산 시설을 운영하는 것이 과학적으로 가능하다고 믿지 않았고, 그 협력은 [1]무산되었다.대신, 마커는 직접 멕시코 파트너를 찾기로 결심했고 [1]1943년 12월 1일 그의 학술 직책을 사임했다.이 분할의 결과 중 하나는 Marker 열화가 [1]특허를 받은 적이 없다는 것입니다.
Marker는 1944년 초에 두 명의 멕시코 투자자 Emeric Somlo와 Federico Lehmann과 협력하여 멕시코 회사인[note 4] Syntex를 설립했습니다.Marker는 Syntex의 지분 40%를 프로게스테론으로 [1]일부 지불했으며, 그 후 가격은 [1]그램당 약 80달러였다고 한다.올해 안에 Syntex는 프로게스테론을 [1]그램당 50달러에 판매했다.그러나 마커는 1945년 5월 이익 문제로 그의 파트너들과 갈라섰고, 나중에 게단 리히터 주식회사에 매각되어 호르모신스([1]이후 디신스)로 이름이 바뀌었다.
멕시코의 미세 화학 제품 제조의 어려움은 실로 상당했다: 훈련된 화학자가 심각하게 부족했고 멕시코 어느 대학에도 화학 박사 프로그램이 없었다.Marker가 Syntex를 떠났을 때, 그의 동료들은 생산 공정에 대한 지침과 [1]코드 라벨이 붙은 시약 병을 찾지 못했습니다.그들은 [1]마커의 후임으로 미국의 제2차 세계대전 참전으로 쿠바에 발이 묶인 ETH 취리히(스위스 연방공과대학)에서 훈련받은 헝가리 유기화학자인 조지 로젠크란츠를 고용했다.로젠크란츠는 디오스게닌에서 프로게스테론의 생산 공정을 사실상 재창조해야 할 것이다.그는 또한 멕시코 [1]국립자율대학에 화학연구소를 설립했는데, 최초의 연구생 중 한 명은 루이스 E였다. Miramontes, 나중에 Syntex의 중추적인 연구원이 되었습니다.
로젠크란츠는 또한 오스트리아계 유대인 난민 칼 제라시와 우루과이계 알레한드로 자파로니를 포함한 외국인 인재들을 Syntex에 고용했다.1951년 제라시, 미라몬테스 및 로젠크란즈는 신텍스에서 노르에스티스테론을 합성했는데, 이는 최초의 경구 피임약의 [10]중요한 성분이며 경구 활성 프로게스테론 유사체입니다.이때까지 Syntex와 멕시코 경쟁업체(미국 국립과학아카데미 최초의 흑인 화학자 Percy Lavon Julian 포함)는 미국에서 [note 5]판매되는 인간 성호르몬의 절반 이상을 공급했고 프로게스테론의 가격은 그램당 [1]2달러로 떨어졌다.Fortune은 같은 해(1951)에 "Syntex는 국경 이남에서 들어본 것 중 가장 큰 기술적 붐을 일으킨다"라는 제목의 기사를 실었다: 1999년까지, 그리고 나중에 생각해보면, 이것은 미국 화학 협회에 의해 절제된 표현으로 여겨졌는데, 특히 Syntex 생산과 [1]연구의 진정한 세계적인 영향 때문이었다.Syntex 연구의 영향은 루이스와 메리 [11]피저에 의한 권위 있는 1959년 논문 스테로이드에서 확인할 수 있다.Syntex는 산업 [1]연구소에서 인용한 모든 논문의 30%를 차지했습니다.1959년 Syntex는 파나마 법인으로 재지명하고 본사를 [12]미국 캘리포니아의 Palo Alto로 이전했습니다.
주 및 참고 자료
메모들
- ^ 스테로이드제는 탄소 원자의 4개의 융합 고리(3개의 6원 고리 및 1개의 5원 고리)로 특징지어진다.많은 스테로이드들은 또한 탄소 원자의 "측쇄"를 가지고 있으며, 보통 5원 고리에 부착되어 있다.
- ^ 그 당시에는 알려지지 않았지만, 프로게스테론의 다른 스테로이드 호르몬의 전구체로서의 사용은 생합성 경로를 매우 모방했다.인간 남성은 테스토스테론의 전구체로서 프로게스테론을 합성하고, 인간 여성은 다양한 에스트로겐의 전구체로서 테스토스테론을 합성한다.코르티손은 또한 Marker 분해 발견 후 발달한 산업 공정에서와 같이 인체에서 프로게스테론으로부터 사이징된다.
- ^ 카베자 드 니그로 또는 일라마(Annona purpurea)로 알려진 과일과 혼동하지 마십시오.
- ^ 지금은 호프만 라 로슈의 일부입니다.
- ^ 값싼 프로게스테론의 (상대적인) 대량으로 구할 수 있는 것은 시장을 만들었고, 다른 제조업체들이 스테로이드 호르몬의 생산 과정을 개선하도록 자극하는 효과를 가져왔다: 이것은 Merck의 원래 36단계 합성이 경쟁력을 유지하기 위해 개선되었던 코티손의 경우에서 가장 잘 나타난다.멕시칸 참마로 만든 코르티손.
레퍼런스
- ^ a b c d e f g h i j k l m n o p q r s t u v w "Russell Marker and the Mexican Steroid Hormone Industry". American Chemical Society. Retrieved June 5, 2012.
- ^ "The Inflation Calculator". Archived from the original on 2011-07-18. Retrieved 2010-03-06.
- ^ a b c 를 클릭합니다Marker, Russell E.; Rohrmann, Ewald (1939), "Sterols. LIII. The Structure of the Side Chain of Sarsasapogenin", J. Am. Chem. Soc., 61 (4): 846–51, doi:10.1021/ja01873a020.
- ^ Tsukamoto; Ueno; Ohta (1936), "Glycosides of Dioscorea tokoro I. Diocin, dioscoreasapooxin and diosgenin", J. Pharm. Soc. Jpn., 56: 135.
- ^ a b c 마커, 러셀 E.Rohrmann, 에발(1939년),"스테롤.Sarsasapogenin의 Pregnanediol-3(α),20(α)", J. 오전에 LXXXI. 전환.화학. 속짱, 61(12):3592–93, doi:10.1021/ja01267a513.마커, 러셀 E.Rohrmann, 에발(1940년),"스테롤.LXXXVIII.Pregnanediols Sarsasapogenin", J.Am.화학. 속짱., 62(3):518–20, doi:10.1021/ja01860a017.마커, 러셀 E.쓰카모토, 다케오, 터너, D.L.,"(1940년)스테롤.CDiosgenin", J.Am.화학. 속짱., 62(9):2525–32, doi:10.1021/ja01866a072.
- ^ a b 를 클릭합니다Marker, Russell E. (1940), "Sterols. CV. The Preparation of Testosterone and Related Compounds from Sarsasapogenin and Diosgenin", J. Am. Chem. Soc., 62 (9): 2543–47, doi:10.1021/ja01866a077.
- ^ 를 클릭합니다Myers, Rusty L.; Myers, Richard L. (2007), The 100 most important chemical compounds: a reference guide, Westport, Conn: Greenwood Press, pp. 205–8, ISBN 978-0-313-33758-1.
- ^ 를 클릭합니다Dewick, P. M. (2009), Medicinal natural products: a biosynthetic approach, New York: Wiley, pp. 281–83, ISBN 978-0-470-74167-2.
- ^ Marker RE, Krueger J (1940). "Sterols. CXII. Sapogenins. XLI. The Preparation of Trillin and its Conversion to Progesterone". J. Am. Chem. Soc. 62 (12): 3349–3350. doi:10.1021/ja01869a023.
- ^ US 2744122, 제라시, 칼; 미라몬테스, 루이스 & 로젠크란츠, 조지, "δ-19-nor-17α-ethinylandrosten-17β-ol-3-one4 and process", 1956-05-10에 의해 Syntex에 할당되었다.
- ^ 를 클릭합니다Fieser, Louis F.; Fieser, Mary P. (1959), Steroids, New York: Van Nostrand Reinhold, ISBN 0-278-91709-7.
- ^ Gereffi, Gary (1983). The Pharmaceutical Industry and Dependency in the Third World (2017 reprint ed.). Princeton University Press: Princeton. p. 110. ISBN 9781400886227. Retrieved 11 January 2021.