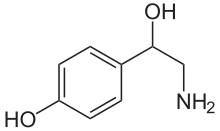
노르에피네프린
Norepinephrine 노르아드레날린의 골격식 | |
 | |
| 임상자료 | |
|---|---|
| 기타이름 |
|
| 생리학적 자료 | |
| 원천조직 | 코에룰레우스자리; 교감신경계; 부신수질 |
| 대상조직 | 체계적인 |
| 수용체 | α1,α2,β1,β3 |
| 아고니스트 | 교감신경계 약물, 클로니딘, 이소프레날린 |
| 길항제 | 삼환계 항우울제, 베타 차단제, 항정신병약 |
| 전조 | 도파민 |
| 생합성 | 도파민β-모노옥시게나제 |
| 신진대사 | MAO-A; COMT |
| 식별자 | |
| |
| CAS 번호 | |
| 펍켐 CID | |
| IUPAR/BPS | |
| 드럭뱅크 | |
| 켐스파이더 | |
| 유니아이 | |
| KEGG | |
| ChEBI | |
| CHEMBL | |
| CompTox 대시보드 (EPA) | |
| ECHA 인포카드 | 100.000.088 |
| 화학물질 및 물리적 데이터 | |
| 공식 | C8H11NO3 |
| 어금니 질량 | 169.180g·mol−1 |
| 3D 모델(Jsmol) | |
| |
| |
노르아드레날린(NA) 또는 노르아드레날린(noradrenalin)이라고도 불리는 노르에피네프린(NE)은 카테콜아민 계열의 유기 화학 물질로 뇌와 신체에서 호르몬과 신경 전달 물질로 기능합니다. 노르아드레날린("noradrenaline")이라는 이름은 영국에서 더 흔하게 사용되는 반면, 노르에피네프린("norepinephrine")은 고대 그리스 ἐπῐ́("epí")에서 온("upon"), νεφρός("nephós")에서 온("kidney")이라는 이름은 미국에서 일반적으로 선호됩니다. "노레피네프린"은 이 약에 부여된 국제적인 비영리 명칭이기도 합니다.[3] 물질 자체에 어떤 이름을 쓰든 간에, 신체에서 생성되거나 영향을 받는 부분을 노르아드레날린이라고 합니다.
노르에피네프린의 일반적인 기능은 뇌와 신체를 활동에 동원하는 것입니다. 노르에피네프린 방출은 수면 중에 가장 낮고, 각성 중에 증가하며, 스트레스나 위험 상황, 이른바 투쟁 혹은 비행 반응에서 훨씬 높은 수준에 도달합니다. 뇌에서 노르에피네프린은 각성과 경계심을 증가시키고, 경계심을 촉진하고, 기억의 형성과 회복을 향상시키며, 주의를 집중시키고, 불안과 불안을 증가시킵니다. 신체의 나머지 부분에서 노르에피네프린은 심박수와 혈압을 증가시키고 에너지 저장에서 포도당의 방출을 유발하며 골격근으로의 혈류를 증가시키고 위장계로의 혈류를 감소시키며 방광의 배뇨와 위장 운동을 억제합니다.
뇌에서 노르아드레날린은 작지만 다른 뇌 영역에 강력한 영향을 미치는 핵에서 생성됩니다. 이 핵들 중 가장 중요한 것은 pons에 위치한 locus coeruleus입니다. 노르에피네프린은 척수 근처나 복부에 위치한 교감신경절은 물론 피부에 위치한 메르켈세포에 의해 신경전달물질로 사용됩니다. 또한 부신에 의해 직접 혈류로 방출됩니다. 노르에피네프린은 세포 표면에 위치한 아드레날린 수용체와 결합해 활성화함으로써 어떤 방법과 장소를 불문하고 표적 세포에 작용하지 않습니다.
의학적으로 중요한 다양한 약물은 노르아드레날린 시스템의 작용을 변경함으로써 작동합니다. 노르아드레날린 자체가 위중한 저혈압 치료를 위한 주사제로 많이 사용되고 있습니다. 자극제는 종종 노르에피네프린의 작용제를 증가시키거나 강화시키거나 또는 그렇지 않으면 작용합니다. 코카인과 메틸페니데이트와 같은 약물은 노르에피네프린의 재흡수 억제제 역할을 하며, SNRI 클래스와 같은 일부 항우울제도 마찬가지입니다. 흥분제 클래스에서 주목할 만한 약물 중 하나는 도파민과 노르에피네프린 유사체, 재흡수 억제제 역할을 하는 암페타민뿐만 아니라 시냅스의 수송체를 역전시켜 신경계 전체에 걸쳐 글로벌 카테콜아민 신호 전달량을 증가시키는 작용제입니다. 베타 차단제는 수용체를 차단하여 노르아드레날린의 일부 효과에 대항하는 것으로 녹내장, 편두통 및 다양한 심혈관 질환을 치료하는 데 자주 사용됩니다. 노르아드레날린 효과의 다른 세트에 대항하는 알파 차단제는 여러 심혈관 및 정신 질환을 치료하는 데 사용됩니다. 알파-2 작용제는 진정 효과가 있는 경우가 많으며, 일반적으로 수술뿐만 아니라 약물이나 알코올 의존증의 치료에 마취 증진제로 사용됩니다. 여전히 불분명한 이유로, 구안파신과 같은 일부 알파-2 약물은 불안 장애와 ADHD 치료에도 효과가 있는 것으로 나타났습니다. 많은 중요한 정신 의학 약물들은 뇌의 노르아드레날린 시스템에 강한 영향을 주어 도움이 될 수도 있고 해로울 수도 있는 부작용을 초래합니다.
구조.
노르에피네프린은 카테콜아민과 페네틸아민입니다.[4] 에피네프린은 질소에 메틸기가 붙어 있는 반면 노르에피네프린은 수소원자로 치환되어 있다는 점에서 에피네프린과 구조가 다릅니다.[4] 접두사 nor-는 탈메틸화 화합물을 나타내는 데 사용되는 "normal"이라는 단어의 약어로 파생되었습니다.[5] 노르에피네프린은 카테콜 부분(메타-파라 위치에 2개의 인접한 하이드록시기를 갖는 벤젠 고리)과 벤질 위치에 결합된 하이드록시기로 구성된 에틸아민 측쇄로 구성됩니다.[6][7]
생화학적 메커니즘
생합성
노르에피네프린은 교감신경계의 부신수질과 강절 후 신경세포에서 일련의 효소 단계에 의해 아미노산 티로신으로부터 합성됩니다. 티로신의 도파민으로의 전환은 주로 세포질에서 일어나는 반면, 도파민 β-모노옥시게나제에 의한 도파민의 노르에피네프린으로의 전환은 주로 신경전달물질 소포 내부에서 일어납니다.[11] 대사 경로는 다음과 같습니다.
- 페닐알라닌 → 티로신 → L-DOPA → 도파민 → 노르에피네프린
따라서 노르에피네프린의 직접적인 전구체는 도파민이며, 도파민은 필수 아미노산인 페닐알라닌 또는 비필수 아미노산인 티로신으로부터 간접적으로 합성됩니다.[11] 이 아미노산들은 거의 모든 단백질에서 발견되며, 따라서 단백질을 함유한 음식을 섭취하면 제공되며, 티로신이 가장 일반적입니다.
페닐알라닌은 효소 페닐알라닌 하이드록실화효소에 의해 티로신으로 전환되며, 분자 산소(O2)와 테트라하이드로비오프테린을 보조인자로 합니다. Tyrosine은 Tyrosine 하이드록실화효소에 의해 L-DOPA로 전환되며, Tetrahydrobiopterin, O2 및 아마도 철(Fe2+)을 보조인자로 사용합니다.[11] 티로신의 L-DOPA로의 전환은 티로신 유사체인 Metyrosine에 의해 억제됩니다. L-DOPA는 효소 방향족 L-아미노산 탈카복실화효소(DOPA 탈카복실화효소라고도 함)에 의해 도파민으로 전환되며, 피리독살 포스페이트는 보조인자로 사용됩니다.[11] 그리고 나서 도파민은 효소 도파민 β-모노옥시게나제(Dopamin β-hydroxylase)에 의해 노르에피네프린으로 전환되고, O와2 아스코르브산이 보조인자로 작용합니다.[11]
노르에피네프린 자체는 보조인자로서 S-아데노실-L-메티오닌을 갖는 효소 페닐에탄올아민 N-메틸트랜스퍼라제에 의해 에피네프린으로 더 전환될 수 있습니다.[11]
열화
포유류에서 노르에피네프린은 다양한 대사산물로 빠르게 분해됩니다. 분해의 초기 단계는 모노아민 산화효소(주로 모노아민 산화효소 A) 또는 COMT에 의해 촉매될 수 있습니다.[12] 거기에서 분해는 다양한 경로로 진행될 수 있습니다. 주요 최종 생성물은 바닐릴만델산 또는 접합된 형태의 MHPG이며, 둘 다 생물학적으로 비활성인 것으로 간주되어 소변으로 배출됩니다.[13]

기능들
세포효과
| 가족 | 수용체 | 유형 | 메카니즘 |
|---|---|---|---|
| 알파 | α1 | G커플q. | IP와3 칼슘을 증가시킵니다. 인지질분해효소 C를 활성화합니다. |
| α2 | Gi/G 커플o. | 다음으로 cAMP 감소 아데닐산 사이클라제 억제. | |
| 베타. | β1 | G커플s. | 다음으로 cAMP 증가 아데닐산 사이클라제 활성화. |
| β2 | |||
| β3 |
노르에피네프린은 다른 많은 생물학적 활성 물질과 마찬가지로 세포 표면에 위치한 수용체와 결합하여 활성화함으로써 그 효과를 발휘합니다. 노르에피네프린 수용체는 알파 및 베타 아드레날린 수용체로 알려진 두 개의 광범위한 계열이 확인되었습니다.[13] 알파 수용체는 아형 α와1 α로2 구분되고, 베타 수용체는 아형 β1, β2, β로3 구분됩니다.[13] 이 모든 것은 복잡한 두 번째 메신저 시스템을 통해 효과를 발휘하는 G 단백질 결합 수용체로 기능합니다.[13] 알파-2 수용체는 대개 억제 효과가 있지만, 많은 수용체들이 시냅스 전에 (즉, 노르에피네프린을 방출하는 세포의 표면에) 위치하기 때문에 알파-2 활성화의 순 효과는 종종 노르에피네프린 방출량의 감소입니다.[13] 알파-1 수용체와 세 종류의 베타 수용체는 보통 모두 흥분 효과가 있습니다.[13]
저장, 릴리스 및 재이용

뇌의 노르에피네프린은 신경전달물질로서 기능하며, 모든 모노아민 신경전달물질에 공통적인 일련의 메커니즘에 의해 조절됩니다. 합성 후 노르에피네프린은 소포체 모노아민 수송체(VMAT)에 의해 세포질에서 시냅스 소포체로 운반됩니다.[14] 레세르핀은 신경전달물질 저장을 감소시켜 VMAT를 억제할 수 있습니다. 노르에피네프린은 시냅스 틈새로 분출될 때까지 이러한 소포에 저장됩니다. 일반적으로 활동 전위로 인해 소포가 내용물을 시냅스 틈새로 직접 방출하도록 하는 엑소사이토시스(exocytosis)라고 불리는 과정을 통해 생성됩니다.[13]
일단 시냅스에 들어가면 노르에피네프린은 수용체와 결합하여 활성화합니다. 노르에피네프린 분자는 활동전위 후 수용체로부터 빠르게 결합되지 않습니다. 그리고 나서 그들은 주로 노르에피네프린 수송체(NET)에 의해 매개되는 재흡수를 통해 시냅스 전 세포로 다시 흡수됩니다.[15] 세포질로 돌아가면 노르에피네프린은 모노아민 산화효소에 의해 분해되거나 VMAT에 의해 소포로 재포장되어 나중에 방출될 수 있습니다.[14]
교감신경계

노르에피네프린은 교감신경계가 사용하는 주요 신경전달물질로, 척수 옆에 위치한 약 24개의 교감신경절과 가슴과 복부에 위치한 한 세트의 전척추신경절로 구성되어 있습니다.[16] 이러한 교감신경절은 눈, 침샘, 심장, 폐, 간, 담낭, 위, 장, 신장, 방광, 생식기관, 근육, 피부, 부신 등 다양한 장기와 연결되어 있습니다.[16] 부신의 교감신경 활성화는 부신수질이라는 부분이 부신수질의 노르에피네프린(에피네프린 뿐만 아니라 부신수질)을 혈류로 방출하게 하고, 이로부터 호르몬의 기능을 수행하여 다양한 조직에 접근할 수 있게 합니다.[16]
일반적으로, 노르에피네프린이 각 표적 기관에 미치는 영향은 종종 에너지 사용 증가와 마모 증가의 비용으로 신체의 활발한 움직임에 더 도움이 되는 방식으로 그 상태를 수정하는 것입니다.[17] 이것은 부교감 신경계의 아세틸콜린 매개 효과와 대조될 수 있는데, 이는 대부분의 동일한 장기를 음식의 휴식, 회복, 소화에 더 도움이 되는 상태로 변형시키고, 일반적으로 에너지 소비 측면에서 더 비용이 적게 듭니다.[17]
노르에피네프린의 교감 작용은 다음과 같습니다.
- 눈에는 눈물의 생성이 증가하여 눈을 더욱 촉촉하게 [18]만들고 홍채 확장기의 수축을 통한 동공 확장이 있습니다.
- 심장에서는 혈액의 양이 증가합니다.[19]
- 갈색 지방 조직에서는 칼로리의 증가가 몸의 열을 발생시키기 위해 연소됩니다.[20]
- 면역체계에 여러 가지 영향을 미칩니다. 교감신경계는 면역계와 뇌 사이의 주요한 상호작용 경로이며, 흉선, 비장, 림프절을 포함한 여러 요소가 교감신경을 공급받습니다. 그러나 어떤 면역 과정은 활성화되고 다른 면역 과정은 억제되는 등 효과가 복잡합니다.[21]
- 동맥에서는 혈관이 수축되어 혈압이 상승하게 됩니다.[22]
- 신장에서 레닌의 방출과 혈류 중 나트륨의 보유.[23]
- 간에서는 식사 후 글리코겐 분해나 최근 음식을 섭취하지 않은 경우 포도당신생합성에 의해 포도당 생산이 증가합니다.[23] 포도당은 대부분의 조건에서 신체의 주요 에너지원입니다.
- 췌장에서 글루카곤의 분비가 증가하는데, 글루카곤은 간의 포도당 생산을 증가시키는 것이 주요 효과입니다.[23]
- 골격근에서는 포도당 섭취가 증가합니다.[23]
- 지방 조직(즉, 지방 세포)에서 지방 분해의 증가, 즉 근육 및 기타 조직에 의해 직접 에너지원으로 사용될 수 있는 물질로의 지방의 전환.[23]
- 위와 장에서 소화 활동의 감소. 이것은 전반적으로 노르에피네프린이 장 신경계에 미치는 영향을 억제하여 위장의 이동성, 혈류량, 소화 물질의 분비량을 감소시키는 결과를 초래합니다.[24]
노르아드레날린과 ATP는 교감성 공동 전달 물질입니다. 엔도카나비노이드 아난다미드와 칸나비노이드 WIN 55,212-2가 교감신경 자극에 대한 전반적인 반응을 수정할 수 있음이 밝혀졌으며, 이는 기능전 CB1 수용체가 교감신경 억제 작용을 매개한다는 것을 나타냅니다. 따라서 칸나비노이드는 교감 신경 전달의 노르아드레날린 성분과 퓨린 성분을 모두 억제할 수 있습니다.[25]
중추신경계

뇌의 노르아드레날린 뉴런은 활성화되면 뇌의 넓은 영역에 영향을 미치는 신경전달물질 시스템을 형성합니다. 그 효과는 경각심, 각성, 행동 준비 상태로 나타납니다.
노르아드레날린성 뉴런(즉, 주요 신경전달물질이 노르에피네프린인 뉴런)은 그 수가 상대적으로 적고, 세포체는 비교적 작은 뇌 영역에 국한되어 있지만, 다른 많은 뇌 영역에 프로젝션을 보내고 표적에 강력한 효과를 발휘합니다. 이 노르아드레날린 세포군은 1964년에 Annica Dahlström과 Kjell Fuxe에 의해 처음 지도에 그려졌고, 그들은 A자로 시작하는 라벨을 부여했습니다.[26] 그들의 계획에서, A1 내지 A7 영역은 신경 전달 물질인 노르에피네프린(A8 내지 A14는 도파민을 포함함)을 포함합니다. 노르아드레날린 세포군 A1은 연수의 꼬리 복측부에 위치하며 체액 대사 조절 역할을 합니다.[27] 노르아드레날린 세포 그룹 A2는 단핵이라고 불리는 뇌간 영역에 위치해 있습니다. 이 세포들은 음식 섭취 조절과 스트레스에 대한 반응을 포함한 다양한 반응과 관련이 있습니다.[28] 세포군 A5와 A7은 주로 척수에 투영됩니다.[29]
뇌에서 노르에피네프린의 가장 중요한 공급원은 노르아드레날린 세포군 A6을 포함하고 세포군 A4와 인접한 유전자좌입니다. 영장류에서 코에룰레우스자리는 절대적인 면에서 매우 작습니다. 그것은 뇌의 뉴런의 백만 분의 일보다 적은 약 15,000개의 뉴런을 포함하는 것으로 추정됩니다. 그러나 그것은 뇌의 모든 주요 부분과 척수에도 투사를 보냅니다.[30]
locus coeruleus의 활동 수준은 경계 및 반응 속도와 광범위하게 상관관계가 있습니다. LC 활동은 수면 중에는 낮고 REM(꿈꾸는) 상태에서는 거의 아무것도 되지 않습니다.[31] 각성 중에는 기준선 수준에서 실행되지만, 사람이 관심을 끄는 어떤 종류의 자극을 받으면 일시적으로 증가합니다. 통증, 호흡 곤란, 방광 팽창, 열 또는 추위와 같은 불쾌한 자극은 더 큰 증가를 발생시킵니다. 극심한 공포나 극심한 통증과 같은 극도로 불쾌한 상태는 매우 높은 수준의 LC 활동과 관련이 있습니다.[30]
코에룰레우스(locus coeruleus)가 분비하는 노르에피네프린(norepinephrine)은 다양한 방식으로 뇌 기능에 영향을 줍니다. 감각 입력의 처리를 강화하고 주의력을 강화하며 장기 및 작업 기억의 형성과 검색을 강화하며 전전두엽 피질 및 기타 영역의 활동 패턴을 변경하여 입력에 반응하는 뇌의 능력을 향상시킵니다.[32] 각성 수준의 조절은 약물에 의한 LC 억제가 강력한 진정 효과를 가질 정도로 강력합니다.[31]
뇌의 코헤룰러스(locus coeruleus)를 활성화시키는 상황과 주변부의 교감신경계를 활성화시키는 상황 사이에는 큰 유사성이 있습니다. LC는 기본적으로 뇌를 활동에 동원하고 교감신경계는 몸을 동원합니다. 이러한 유사성은 둘 다 동일한 뇌 구조, 특히 거대 세포핵이라고 불리는 뇌간의 한 부분에 의해 크게 조절되기 때문에 발생한다고 주장되어 왔습니다.[30]
피부.
노르에피네프린은 또한 체세포 감각 시스템의 일부인 메르켈 세포에 의해 생성됩니다. 구심성 감각 뉴런을 활성화합니다.[33]
약리학
많은 중요한 약들이 뇌나 신체의 노르에피네프린계와 상호작용을 함으로써 그 효과를 발휘합니다. 그들의 용도에는 심혈관 문제, 쇼크 및 다양한 정신 의학적 상태의 치료가 포함됩니다. 이러한 약물은 교감 신경계에 의해 방출되는 노르에피네프린의 효과 중 적어도 일부를 모방하거나 향상시키는 공감 모방 약물과 대조적으로 공감 분해 약물은 적어도 일부 효과를 차단합니다.[34] 이 두 가지 모두 정확하게 어떤 효과가 향상되거나 차단되는지에 따라 용도가 다양한 대규모 그룹입니다.[34]
노르에피네프린 자체는 교감신경계 약물로 분류되는데, 정맥주사를 통해 심박수와 힘을 증가시키고 혈관을 수축시킴으로써 그 효과가 치명적인 저혈압을 수반하는 의료 응급 상황을 치료하는 데 매우 유용합니다.[34] 살아남은 패혈증 캠페인은 유체 소생술에 반응하지 않는 패혈성 쇼크를 치료할 때 norepinephrine을 1차 약제로 권장했으며, vasopressin과 epinephrine을 보충했습니다. 도파민 사용은 고도로 선택된 환자에게만 제한됩니다.[35]
길항제
베타차단제
알파 수용체에는 거의 또는 전혀 영향을 주지 않으면서 베타 아드레날린 수용체의 영향을 차단하는 공감 분해 약물입니다. 고혈압, 심방세동, 울혈성 심부전을 치료하는 데 사용되기도 하지만, 최근의 리뷰는 다른 종류의 약물이 대개 그러한 목적에 더 뛰어나다는 결론을 내렸습니다.[36][37] 그러나 베타 차단제는 협심증 및 마르판 증후군을 포함한 다른 심혈관 질환에 대한 실행 가능한 선택이 될 수 있습니다.[38] 또한 녹내장을 치료하는 데 널리 사용되며, 가장 일반적으로 점안액의 형태로 사용됩니다.[39] 불안 증상과 떨림을 감소시키는 효과 때문에 때때로 공연 불안을 줄이기 위해 연예인, 대중 연설가, 운동선수들에 의해 사용되어 왔지만, 그 목적으로 의학적으로 승인되지 않았고 국제 올림픽 위원회에 의해 금지되었습니다.[40][41]
그러나 베타 차단제의 유용성은 심박수의 느려짐, 혈압의 저하, 천식 및 반응성 저혈당을 포함한 다양한 심각한 부작용에 의해 제한됩니다.[39] 당뇨병이 있는 사람들에게 특히 부정적인 영향이 심할 수 있습니다.[36]
알파 차단기
베타 수용체에는 거의 또는 전혀 영향을 주지 않으면서 아드레날린성 알파 수용체의 영향을 차단하는 공감 분해 약물입니다.[42] 그러나 이 그룹에 속하는 약물은 주로 알파-1 수용체를 막느냐, 알파-2 수용체를 막느냐, 아니면 둘 다 막느냐에 따라 매우 다른 효과를 볼 수 있습니다. 이 글의 다른 곳에서 설명한 바와 같이, 알파-2 수용체는 노르에피네프린 방출 뉴런 자체에 위치하여 억제 효과를 갖는 경우가 많으며, 따라서 알파-2 수용체의 차단은 일반적으로 노르에피네프린 방출을 증가시킵니다.[42] 알파-1 수용체는 대개 표적 세포에 위치하여 흥분 효과를 갖는데, 결과적으로 알파-1 수용체가 막히면 노르에피네프린의 효과가 일부 차단됩니다.[42] 두 종류의 수용체에 모두 작용하는 펜톨아민과 같은 약물은 두 효과의 복합적인 조합을 생성할 수 있습니다. 대부분의 경우 알파 차단제라는 용어를 자격 없이 사용하는 경우 선택적 알파-1 길항제를 말합니다.
선택적 알파-1 차단제는 다양한 용도를 가지고 있습니다. 그 효과 중 하나가 전립선의 평활근 수축을 억제하는 것이기 때문에 양성 전립선 비대증의 증상을 치료하는 데 자주 사용됩니다.[43] 알파 차단제는 또한 사람들이 신장 결석을 통과하는 데 도움이 될 것입니다.[44] 중추신경계에 미치는 영향은 전신불안장애, 공황장애, 외상 후 스트레스 장애를 치료하는 데 유용합니다.[45] 그러나 혈압 저하를 포함하여 심각한 부작용을 일으킬 수 있습니다.[42]
일부 항우울제는 부분적으로 선택적인 알파-2 차단제의 기능을 하지만, 그 부류에서 가장 잘 알려진 약물은 아프리카 요힘베 나무의 껍질에서 추출한 요힘빈입니다.[46] 요힘빈은 남성 효능 증진제 역할을 하지만 불안과 불면증을 포함한 심각한 부작용으로 인해 유용성이 제한됩니다.[46] 과다복용은 혈압의 위험한 상승을 유발할 수 있습니다.[46] 요힘빈은 많은 나라에서 금지되어 있지만, 미국에서는 화학적 합성이 아닌 식물에서 추출하기 때문에 영양제로 처방전 없이 판매되고 있습니다.[47]
알파-2 작용제
이것들은 알파-2 수용체를 활성화시키거나 효과를 향상시키는 공감 모방 약물입니다.[48] 알파-2 수용체는 억제성이고 많은 수용체가 노르에피네프린 방출 세포에 시냅스 전에 위치하기 때문에, 이러한 약물의 순 효과는 대개 노르에피네프린 방출량을 줄이는 것입니다.[48] 뇌로 들어갈 수 있는 이 그룹의 약물은 종종 강력한 진정 효과를 갖는데, 이는 국소 코에룰루스에 대한 억제 효과 때문입니다.[48] 예를 들어 클로니딘과 구안파신은 불안장애와 불면증 치료에 사용되며, 수술을 앞둔 환자를 위한 진정제로도 사용됩니다.[49] 이 그룹의 또 다른 약물인 자일라진 또한 강력한 진정제이며 동물 수술을 위한 일반 마취제로 케타민과 함께 사용되는 경우가 많습니다. 미국에서는 사람에게 사용이 승인되지 않았습니다.[50]
흥분제 및 항우울제
이것들은 다른 신경전달물질 시스템(흥분제의 도파민, 항우울제의 세로토닌)에 의해 매개되는 것으로 생각되는 약이지만, 많은 약들은 또한 뇌의 노르에피네프린 수치를 증가시킵니다.[51] 예를 들어 암페타민은 도파민뿐만 아니라 노르에피네프린의 방출을 증가시키는 자극제입니다.[52] 모노아민 산화효소 A 억제제(MAO-A)는 노르에피네프린은 물론 세로토닌과 도파민의 대사 분해를 억제하는 항우울제입니다.[53] 노르에피네프린 매개 효과를 다른 신경전달물질과 관련된 효과와 구별하기 어려운 경우도 있습니다.[citation needed]
질병과 장애
많은 중요한 의학적 문제들은 뇌나 신체의 부신수질호르몬 시스템의 기능 장애를 포함합니다.
교감신경과활성화
교감신경계의 과활성화는 그 자체로 인식되는 상태는 아니지만, 교감신경계 약물을 복용할 경우 나타날 수 있는 결과뿐만 아니라 다양한 상태의 구성요소입니다. 그것은 통증과 통증, 빠른 심장 박동, 혈압 상승, 땀 흘림, 두근거림, 불안, 두통, 창백함, 혈당 강하를 포함한 독특한 증상을 유발합니다. 교감 활동이 장기간 상승하면 체중 감소 및 스트레스와 관련된 신체 변화를 유발할 수 있습니다.
교감신경과활성화를 일으킬 수 있는 질환 목록에는 심각한 뇌손상,[54] 척수손상,[55] 심부전,[56] 고혈압,[57] 신장질환,[58] 각종 스트레스 등이 포함됩니다.
갈색세포종
갈색세포종은 유전적 요인이나 특정 유형의 암에 의해 발생하는 부신수질의 거의 발생하지 않는 종양입니다. 그 결과 노르에피네프린과 에피네프린이 혈류로 방출되는 양이 크게 증가합니다. 가장 명백한 증상은 교감신경과활성화 증상으로, 특히 치명적인 수치에 도달할 수 있는 혈압 상승을 포함합니다. 가장 효과적인 치료법은 종양을 외과적으로 제거하는 것입니다.
스트레스
생리학자에게 스트레스는 신체의 지속적인 안정과 기능을 위협하는 모든 상황을 의미합니다.[59] 스트레스는 매우 다양한 신체 시스템에 영향을 미칩니다:[59] 가장 지속적으로 활성화되는 두 가지는 시상하부-뇌하수체-부신 축과 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 부신 많은 종류의 스트레스 요인들은 노르아드레날린 활동의 증가를 유발하는데, 이는 위협에 대처하기 위해 뇌와 신체를 동원합니다.[59] 만성적인 스트레스는 오래 지속되면 신체의 많은 부분을 손상시킬 수 있습니다. 손상의 상당 부분은 지속적인 노르에피네프린 방출의 영향에 기인하며, 노르에피네프린의 일반적인 기능은 유지, 재생 및 번식으로부터 벗어나 능동적인 운동에 필요한 시스템으로 유도합니다. 그 결과는 (어린이의) 성장 둔화, 불면증, 성욕 상실, 위장 문제, 질병 저항성 손상, 부상 치유 속도 둔화, 우울증, 중독에 대한 취약성 증가를 포함할 수 있습니다.[59]
ADHD
주의력결핍 과잉행동장애는 주의력, 과잉행동, 충동성의 문제를 수반하는 정신과적 질환입니다.[60] 뇌의 도파민 수치를 높이는 것이 일차적인 효과인 메틸페니데이트(Ritalin)와 같은 흥분제 약물을 사용하여 가장 흔하게 치료되지만, 이 그룹의 약물은 일반적으로 노르에피네프린의 뇌 수치를 증가시키며, 이러한 작용이 임상적 가치에 관여하는지 여부를 판단하기 어려웠습니다. ADHD를 앓고 있는 많은 사람들이 변화된 노르에피네프린 처리와 관련된 바이오마커를 보여준다는 실질적인 증거도 있습니다.[61] 구안파신, 클로니딘, 아토목세틴 등 노르에피네프린에 일차적인 영향을 미치는 여러 약물들이 ADHD 치료제로 시도되었고, 각성제와 비슷한 효과를 가지고 있는 것으로 밝혀졌습니다.[62][63]
자율고장
파킨슨병, 당뇨병, 이른바 순수 자율신경부전을 포함한 여러 질환은 교감신경계의 노르에피네프린 분비 뉴런의 손실을 일으킬 수 있습니다. 그 증상은 광범위한데, 가장 심각한 것은 심박수의 감소와 휴식 혈압의 극단적인 하락으로, 심각한 영향을 받은 사람들은 실신 없이 몇 초 이상 서 있을 수 없습니다. 치료에는 식이 변화나 약물이 포함될 수 있습니다.[64]
렘수면부족
노르에피프레핀은 REM 수면을 방해하지 않으며, REM 수면 부족은 ROC coeruleus의 생성을 중단하지 않기 때문에 노르아드레날린 분비를[65] 증가시킵니다. 며칠 동안 손실이 지속되면 신경퇴행을 유발합니다.[66]
비교생물학과 진화
노르에피네프린은 원생동물,[67] 플라코조아 및 크니다리아(젤리피쉬 및 관련 종)[68]를 포함한 매우 다양한 동물 종에 존재하지만 신경계가 다른 동물과 크게 다른 ctenophore(콤 젤리)에는 존재하지 않는 것으로 보고되었습니다.[69] 일반적으로 중생동물(척추동물 등)에 존재하지만, 원시동물(절지동물, 연체동물, 편충, 선충, 애널리드 등)에서는 합성 경로가 밀접한 밀접한 화학물질인 옥토파민으로 대체됩니다.[67] 곤충에서 옥토파민은 척추동물의 노르에피네프린의 기능과 상응하는(적어도 대략적으로) 경보 및 활성화 기능을 가지고 있습니다.[70] 옥토파민이 노르에피네프린을 대체하도록 진화했다는 주장이 있지만, 암피옥서스의 신경계에는 옥토파민이 포함되어 있지만 노르에피네프린은 포함되어 있지 않은 것으로 보고되어 있어 이 가설에 어려움이 있습니다.[67]
역사
20세기 초, 몸을 싸움과 도망에 대비시키는 동정자 부신 시스템의 아이디어를 대중화시킨 월터 캐넌과 그의 동료 아르투로 로젠블루스는 이러한 행동을 담당하는 두 동정자, 즉 공감자 E(흥분적)와 공감자 I(억제적)에 대한 이론을 개발했습니다.[71] 1934년과 1938년 사이에 캐나다와 미국의 약리학자들뿐만 아니라 벨기에의 약리학자 제논 바크는 노르아드레날린이 동정적인 전달자가 될 수 있다고 제안했습니다.[71] 1939년 헤르만 블라슈코와 피터 홀츠는 각각 독립적으로 척추동물의 노르에피네프린의 생합성 메커니즘을 밝혀냈습니다.[72][73] 1945년 울프 폰 오일러는 신경전달물질로서 노르에피네프린의 역할을 확립한 일련의 논문들 중 첫 번째를 발표했습니다.[74] 그는 교감 신경 조직과 뇌에서 노르에피네프린의 존재를 입증했고, 그것이 캐넌과 로젠블루스의 교감체라는 증거를 제시했습니다.
스탠리 피어트는 교감신경 자극 후 노르아드레날린이 방출되는 것을 최초로 입증했습니다.
참고문헌
- ^ Andersen AM (1975). "Structural studies of metabolic products of dopamine. IV. Crystal and molecular structure of (-)-noradrenaline". Acta Chemica Scandinavica B. 29 (8): 871–876. doi:10.3891/acta.chem.scand.29b-0871. PMID 1202890.
- ^ Aronson JK (February 2000). "'Where name and image meet'—the argument for 'adrenaline'". British Medical Journal. 320 (7233): 506–509. doi:10.1136/bmj.320.7233.506. PMC 1127537. PMID 10678871.
- ^ "(−)-noradrenaline". IUPHAR database. International Union of Basic and Clinical Pharmacology. Retrieved 2 January 2016.
- ^ a b "Norepinephrine". PubChem. Retrieved 6 November 2015.
- ^ Gaddum JH (June 1956). "The Prefix 'Nor' in Chemical Nomenclature". Nature. 177 (1046): 1046. Bibcode:1956Natur.177.1046G. doi:10.1038/1771046b0. S2CID 4284979.
- ^ Mittal R, Debs LH, Patel AP, Nguyen D, Patel K, O'Connor G, et al. (September 2017). "Neurotransmitters: The Critical Modulators Regulating Gut-Brain Axis". Journal of Cellular Physiology. 232 (9): 2359–2372. doi:10.1002/jcp.25518. PMC 5772764. PMID 27512962.
- ^ Ritter J, Flower RJ, Henderson G, Loke YK, MacEwan DJ, Rang HP (2020). Rang and Dale's pharmacology (Ninth ed.). Edinburgh: Elsevier. ISBN 978-0-7020-8060-9. OCLC 1081403059.
- ^ Broadley KJ (March 2010). "The vascular effects of trace amines and amphetamines". Pharmacology & Therapeutics. 125 (3): 363–375. doi:10.1016/j.pharmthera.2009.11.005. PMID 19948186.
- ^ Lindemann L, Hoener MC (May 2005). "A renaissance in trace amines inspired by a novel GPCR family". Trends in Pharmacological Sciences. 26 (5): 274–281. doi:10.1016/j.tips.2005.03.007. PMID 15860375.
- ^ Wang X, Li J, Dong G, Yue J (February 2014). "The endogenous substrates of brain CYP2D". European Journal of Pharmacology. 724: 211–218. doi:10.1016/j.ejphar.2013.12.025. PMID 24374199.
- ^ a b c d e f g Musacchio JM (2013). "Chapter 1: Enzymes involved in the biosynthesis and degradation of catecholamines". In Iverson L (ed.). Biochemistry of Biogenic Amines. Springer. pp. 1–35. ISBN 978-1-4684-3171-1.
- ^ Griffith RK (2013). "Chapter 10: Adrenergic Receptors and Drugs Affecting Adrenergic Neurotransmission". In Lemke TL, Williams DA, Zito SW, Roche VF (eds.). Foye's Principles of Medicinal Chemistry (7th ed.). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. p. 343. ISBN 978-1-60913-345-0.
- ^ a b c d e f g h i Rang HP, Ritter JM, Flower R, Henderson G (2014). "Chapter 14: Noradrenergic transmission". Rang & Dale's Pharmacology. Elsevier Health Sciences. pp. 177–196. ISBN 978-0-7020-5497-6.
- ^ a b Eiden LE, Schäfer MK, Weihe E, Schütz B (2004). "The vesicular amine transporter family (SLC18): amine/proton antiporters required for vesicular accumulation and regulated exocytotic secretion of monoamines and acetylcholine". Pflügers Archiv: European Journal of Physiology. 447 (5): 636–640. doi:10.1007/s00424-003-1100-5. PMID 12827358. S2CID 20764857.
- ^ Torres GE, Gainetdinov RR, Caron MG (2003). "Plasma membrane monoamine transporters: structure, regulation and function". Nature Reviews Neuroscience. 4 (1): 13–25. doi:10.1038/nrn1008. PMID 12511858. S2CID 21545649.
- ^ a b c Hamill RW, Shapiro RE, Vizzard MA (2012). "Peripheral Autonomic Nervous System". In Robertson D, Biaggioni I, et al. (eds.). Primer on the Autonomic Nervous System. Academic Press. pp. 17–20. ISBN 978-0-12-386525-0.
- ^ a b Schacter D, Gilbert D, Wegner D, Hood B (2011). Psychology: European Edition. Palgrave Macmillan. p. 93. ISBN 978-0-230-34367-2.
- ^ Dartt DA (May 2009). "Neural regulation of lacrimal gland secretory processes: relevance in dry eye diseases". Progress in Retinal and Eye Research. 28 (3): 155–177. doi:10.1016/j.preteyeres.2009.04.003. PMC 3652637. PMID 19376264.
- ^ Tank AW, Lee Wong D (January 2015). "Peripheral and central effects of circulating catecholamines". Comprehensive Physiology. 5 (1): 1–15. doi:10.1002/cphy.c140007. ISBN 9780470650714. PMID 25589262.
- ^ Bahler L, Molenaars RJ, Verberne HJ, Holleman F (September 2015). "Role of the autonomic nervous system in activation of human brown adipose tissue: A review of the literature". Diabetes & Metabolism. 41 (6): 437–445. doi:10.1016/j.diabet.2015.08.005. PMID 26404650.
- ^ Kenney MJ, Ganta CK (July 2014). "Autonomic nervous system and immune system interactions". Comprehensive Physiology. 4 (3): 1177–1200. doi:10.1002/cphy.c130051. ISBN 9780470650714. PMC 4374437. PMID 24944034.
- ^ Chistiakov DA, Ashwell KW, Orekhov AN, Bobryshev YV (2015). "Innervation of the arterial wall and its modification in atherosclerosis". Autonomic Neuroscience. 193: 7–11. doi:10.1016/j.autneu.2015.06.005. PMID 26164815. S2CID 8150131.
- ^ a b c d e Thorp AA, Schlaich MP (2015). "Relevance of Sympathetic Nervous System Activation in Obesity and Metabolic Syndrome". Journal of Diabetes Research. 2015: 1–11. doi:10.1155/2015/341583. PMC 4430650. PMID 26064978.
- ^ Konturek SJ, Konturek JW, Pawlik T, Brzozowski T (2004). "Brain–gut axis and its role in the control of food intake" (PDF). Journal of Physiology and Pharmacology. 55 (1 Pt 2): 137–154. PMID 15082874.
- ^ Pakdeechote P, Dunn WR, Ralevic V (November 2007). "Cannabinoids inhibit noradrenergic and purinergic sympathetic cotransmission in the rat isolated mesenteric arterial bed". British Journal of Pharmacology. 152 (5): 725–733. doi:10.1038/sj.bjp.0707397. PMC 2190027. PMID 17641668.
- ^ Dahlstroem A, Fuxe K (1964). "Evidence for the existence of monoamine-containing neurons in the central nervous system. I. Demonstration of monoamines in the cell bodies of brain stem neurons". Acta Physiologica Scandinavica Supplementum. 232 (Supplement 232): 1–55. PMID 14229500.
- ^ Antunes-Rodrigues J, de Castro M, Elias LL, Valença MM, McCann SM (January 2004). "Neuroendocrine control of body fluid metabolism" (PDF). Physiological Reviews. 84 (1): 169–208. doi:10.1152/physrev.00017.2003. PMID 14715914. S2CID 14046. Archived from the original (PDF) on 6 March 2019.
- ^ Rinaman L (February 2011). "Hindbrain noradrenergic A2 neurons: diverse roles in autonomic, endocrine, cognitive, and behavioral functions". American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 300 (2): R222–R235. doi:10.1152/ajpregu.00556.2010. PMC 3043801. PMID 20962208.
- ^ Bruinstroop E, Cano G, Vanderhorst VG, Cavalcante JC, Wirth J, Sena-Esteves M, Saper CB (June 2012). "Spinal projections of the A5, A6 (locus coeruleus), and A7 noradrenergic cell groups in rats". The Journal of Comparative Neurology. 520 (9): 1985–2001. doi:10.1002/cne.23024. PMC 3508755. PMID 22173709.
- ^ a b c Sara SJ, Bouret S (2012). "Orienting and reorienting: the locus coeruleus mediates cognition through arousal". Neuron. 76 (1): 130–141. doi:10.1016/j.neuron.2012.09.011. PMID 23040811.
- ^ a b Berridge CW, Schmeichel BE, España RA (2012). "Noradrenergic modulation of wakefulness/arousal". Sleep Medicine Reviews. 16 (2): 187–197. doi:10.1016/j.smrv.2011.12.003. PMC 3278579. PMID 22296742.
- ^ Sara SJ (2015). "Locus Coeruleus in time with the making of memories". Current Opinion in Neurobiology. 35: 87–94. doi:10.1016/j.conb.2015.07.004. PMID 26241632. S2CID 206952441.
- ^ Feng J, Hu H (December 2019). "A novel player in the field: Merkel disc in touch, itch and pain". Experimental Dermatology. 28 (12): 1412–1415. doi:10.1111/exd.13945. PMC 6800577. PMID 31001848.
- ^ a b c Gardenhire DS (2013). Rau's Respiratory Care Pharmacology. Elsevier Health Sciences. p. 88. ISBN 978-0-323-27714-3.
- ^ Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. (March 2017). "Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016" (PDF). Critical Care Medicine. 45 (3): 486–552. doi:10.1097/CCM.0000000000002255. PMID 28098591. S2CID 52827184. Archived from the original (PDF) on 1 March 2021.
We recommend norepinephrine as the first-choice vasopressor (strong recommendation, moderate quality of evidence).
- ^ a b Deedwania PC (2015). "Management of Patients With Stable Angina and Type 2 Diabetes". Reviews in Cardiovascular Medicine. 16 (2): 105–113. doi:10.3909/ricm0742. PMID 26198557. S2CID 22137234.
- ^ Mareev Y, Cleland JG (2015). "Should β-Blockers Be Used in Patients With Heart Failure and Atrial Fibrillation?". Clinical Therapeutics. 37 (10): 2215–2224. doi:10.1016/j.clinthera.2015.08.017. PMID 26391145. S2CID 3393256.
- ^ Kumar A, Agarwal S (2014). "Marfan syndrome: An eyesight of syndrome". Meta Gene. 2: 96–105. doi:10.1016/j.mgene.2013.10.008. PMC 4287801. PMID 25606393.
- ^ a b Inoue K (2014). "Managing adverse effects of glaucoma medications". Clinical Ophthalmology. 8: 903–913. doi:10.2147/OPTH.S44708. PMC 4025938. PMID 24872675.
- ^ Brugués AO (2011). "Music performance anxiety. Part 2. A review of treatment options". Medical Problems of Performing Artists. 26 (3): 164–171. doi:10.21091/mppa.2011.3026. PMID 21987072.
- ^ Fitch K (2012). "Proscribed drugs at the Olympic Games: permitted use and misuse (doping) by athletes". Clinical Medicine. 12 (3): 257–260. doi:10.7861/clinmedicine.12-3-257. PMC 4953490. PMID 22783779.
- ^ a b c d Lilley LL, Collins SR, Snyder JS (2014). Pharmacology and the Nursing Process (7th ed.). Elsevier Health Sciences. pp. 313–316. ISBN 978-0-323-29361-7.
- ^ Hollingsworth JM, Wilt TJ (August 2014). "Lower urinary tract symptoms in men". BMJ. 349: g4474. doi:10.1136/bmj.g4474. PMC 4688452. PMID 25125424.
- ^ Campschroer T, Zhu X, Vernooij RW, Lock MT (April 2018). "Alpha-blockers as medical expulsive therapy for ureteral stones". The Cochrane Database of Systematic Reviews. 2018 (4): CD008509. doi:10.1002/14651858.CD008509.pub3. PMC 6494465. PMID 29620795.
- ^ Green B (July 2014). "Prazosin in the treatment of PTSD". Journal of Psychiatric Practice. 20 (4): 253–259. doi:10.1097/01.pra.0000452561.98286.1e. PMID 25036580. S2CID 40069887.
- ^ a b c Corazza O, Martinotti G, Santacroce R, Chillemi E, Di Giannantonio M, Schifano F, Cellek S (2014). "Sexual enhancement products for sale online: raising awareness of the psychoactive effects of yohimbine, maca, horny goat weed, and Ginkgo biloba". BioMed Research International. 2014: 1–13. doi:10.1155/2014/841798. PMC 4082836. PMID 25025070.
- ^ EFSA Panel on Food Additives and Nutrient Sources Added to Food (2013). "Scientific Opinion on the evaluation of the safety in use of Yohimbe". EFSA Journal. 11 (7): 3302. doi:10.2903/j.efsa.2013.3302.
- ^ a b c Lemke KA (2004). "Perioperative use of selective alpha-2 agonists and antagonists in small animals". The Canadian Veterinary Journal. 45 (6): 475–480. PMC 548630. PMID 15283516.
- ^ Belkin MR, Schwartz TL (2015). "Alpha-2 receptor agonists for the treatment of posttraumatic stress disorder". Drugs in Context. 4: 1–5. doi:10.7573/dic.212286. PMC 4544272. PMID 26322115.
- ^ Greene SA, Thurmon JC (1988). "Xylazine—a review of its pharmacology and use in veterinary medicine". Journal of Veterinary Pharmacology and Therapeutics. 11 (4): 295–313. doi:10.1111/j.1365-2885.1988.tb00189.x. PMID 3062194.
- ^ Sofuoglu M, Sewell RA (April 2009). "Norepinephrine and stimulant addiction". Addiction Biology. 14 (2): 119–129. doi:10.1111/j.1369-1600.2008.00138.x. PMC 2657197. PMID 18811678.
- ^ Heal DJ, Smith SL, Gosden J, Nutt DJ (June 2013). "Amphetamine, past and present—a pharmacological and clinical perspective". Journal of Psychopharmacology. 27 (6): 479–496. doi:10.1177/0269881113482532. PMC 3666194. PMID 23539642.
- ^ Finberg JP, Rabey JM (2016). "Inhibitors of MAO-A and MAO-B in Psychiatry and Neurology". Frontiers in Pharmacology. 7: 340. doi:10.3389/fphar.2016.00340. PMC 5067815. PMID 27803666.
Selective inhibition of MAO-A leads to increased levels of neurotransmitter within noradrenergic (NA-ergic) and 5-HT-ergic neurons of the CNS, and clinical antidepressant action, while inhibition of MAO-B leads to increased levels of DA in the Parkinsonian brain...
- ^ Lump D, Moyer M (2014). "Paroxysmal sympathetic hyperactivity after severe brain injury". Current Neurology and Neuroscience Reports. 14 (11): 494. doi:10.1007/s11910-014-0494-0. PMID 25220846. S2CID 10849388.
- ^ Amzallag M (1993). "Autonomic hyperreflexia". International Anesthesiology Clinics. 31 (1): 87–102. doi:10.1097/00004311-199331010-00009. PMID 8440534. S2CID 32173637.
- ^ McCrink KA, Brill A, Lymperopoulos A (2015). "Adrenal G protein-coupled receptor kinase-2 in regulation of sympathetic nervous system activity in heart failure". World Journal of Cardiology. 7 (9): 539–543. doi:10.4330/wjc.v7.i9.539. PMC 4577680. PMID 26413230.
- ^ Malpas SC (2010). "Sympathetic nervous system overactivity and its role in the development of cardiovascular disease". Physiological Reviews. 90 (2): 513–557. doi:10.1152/physrev.00007.2009. PMID 20393193.
- ^ Ksiazek A, Załuska W (2008). "Sympathetic overactivity in uremia". Journal of Renal Nutrition. 18 (1): 118–121. doi:10.1053/j.jrn.2007.10.024. PMID 18089457.
- ^ a b c d Chrousos GP (2009). "Stress and disorders of the stress system". Nature Reviews Endocrinology. 5 (7): 374–381. doi:10.1038/nrendo.2009.106. PMID 19488073. S2CID 2259451.
- ^ Kooij SJ, Bejerot S, Blackwell A, Caci H, Casas-Brugué M, Carpentier PJ, et al. (2010). "European consensus statement on diagnosis and treatment of adult ADHD: The European Network Adult ADHD". BMC Psychiatry. 10: 67. doi:10.1186/1471-244X-10-67. PMC 2942810. PMID 20815868.
- ^ Faraone SV, Bonvicini C, Scassellati C (2014). "Biomarkers in the diagnosis of ADHD—promising directions". Current Psychiatry Reports. 16 (11): 497. doi:10.1007/s11920-014-0497-1. PMID 25298126. S2CID 36702503.
- ^ Bello NT (2015). "Clinical utility of guanfacine extended release in the treatment of ADHD in children and adolescents". Patient Preference and Adherence. 9: 877–885. doi:10.2147/PPA.S73167. PMC 4494608. PMID 26170637.
- ^ Clemow DB, Bushe CJ (2015). "Atomoxetine in patients with ADHD: A clinical and pharmacological review of the onset, trajectory, duration of response and implications for patients". Journal of Psychopharmacology. 29 (12): 1221–1230. doi:10.1177/0269881115602489. PMID 26349559. S2CID 22649093.
- ^ Shibao C, Okamoto L, Biaggioni I (2012). "Pharmacotherapy of autonomic failure". Pharmacology & Therapeutics. 134 (3): 279–286. doi:10.1016/j.pharmthera.2011.05.009. PMC 3358114. PMID 21664375.
- ^ Mehta R, Giri S, Mallick BN (December 2020). "REM sleep loss-induced elevated noradrenaline could predispose an individual to psychosomatic disorders: a review focused on proposal for prediction, prevention, and personalized treatment". The EPMA Journal. 11 (4): 529–549. doi:10.1007/s13167-020-00222-1. PMC 7680499. PMID 33240449.
- ^ Somarajan BI, Khanday MA, Mallick BN (2016). "Rapid Eye Movement Sleep Deprivation Induces Neuronal Apoptosis by Noradrenaline Acting on Alpha1 Adrenoceptor and by Triggering Mitochondrial Intrinsic Pathway". Frontiers in Neurology. 7: 25. doi:10.3389/fneur.2016.00025. PMC 4779900. PMID 27014180.
- ^ a b c Pflüger HJ, Stevensonb PA (2005). "Evolutionary aspects of octopaminergic systems with emphasis on arthropods". Arthropod Structure & Development. 34 (3): 379–396. doi:10.1016/j.asd.2005.04.004.
- ^ Kass-Simon G, Pierobon P (2007). "Cnidarian chemical neurotransmission, an updated overview". Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 146 (1): 9–25. doi:10.1016/j.cbpa.2006.09.008. PMID 17101286.
- ^ Moroz LL (2015). "Convergent evolution of neural systems in ctenophores". Journal of Experimental Biology. 218 (Pt 4): 598–611. doi:10.1242/jeb.110692. PMC 4334147. PMID 25696823.
- ^ Verlinden H, Vleugels R, Marchal E, Badisco L, Pflüger HJ, Blenau W, Broeck JV (2010). "The role of octopamine in locusts and other arthropods". Journal of Insect Physiology. 56 (8): 854–867. doi:10.1016/j.jinsphys.2010.05.018. PMID 20621695.
- ^ a b Bacq ZM (1983). "Chemical transmission of nerve impulses". In Parnham MJ, Bruinvels J (eds.). Discoveries in Pharmacology, Volume 1. Amsterdam: Elsevier. pp. 49–103. ISBN 978-0-444-80493-8.
- ^ Blaschko H (1987). "A half-century of research on catecholamine biosynthesis". Journal of Applied Cardiology: 171–183.
- ^ Holtz P (1939). "Dopadecarboxylase". Die Naturwissenschaften (in German). 27 (43): 724–725. Bibcode:1939NW.....27..724H. doi:10.1007/bf01494245. S2CID 260483975.
- ^ von Euler US (1945). "A sympathomimetic pressor substance in animal organ extracts". Nature. 156 (3949): 18–19. Bibcode:1945Natur.156...18V. doi:10.1038/156018b0. S2CID 4100718.
외부 링크
 위키미디어 커먼즈의 노르에피네프린 관련 미디어
위키미디어 커먼즈의 노르에피네프린 관련 미디어