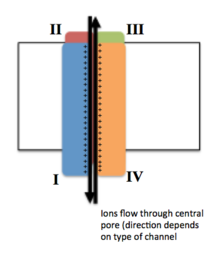
전압 게이트 이온 채널
Voltage-gated ion channel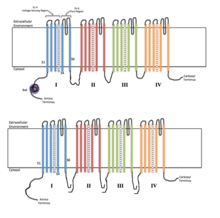 4개의 상동 도메인은 각각 이온 채널의 서브유닛을 구성한다.S4 전압 감지 세그먼트(+ 기호로 표시됨)는 충전된 것으로 표시됩니다. | |
| 식별자 | |
|---|---|
| 기호. | VIC |
| 빠맘 클랜 | CL0030 |
| TCDB | 1. A.1 |
| OPM 슈퍼 패밀리 | 8 |
| OPM단백질 | 2a79 |
전압 개폐 이온 채널은 채널 근처의 전기막 전위의 변화에 의해 활성화되는 이온 채널을 형성하는 막 통과 단백질의 한 종류입니다.막 전위는 채널 단백질의 구조를 변화시켜 단백질의 개폐를 조절합니다.세포막은 일반적으로 이온에 침투하지 않기 때문에 막 통과 단백질 채널을 통해 막을 통해 확산되어야 합니다.그들은 신경세포와 근육조직과 같은 흥분하기 쉬운 세포에서 중요한 역할을 하며, 전압변화에 대한 반응으로 빠르고 조정된 탈분극을 가능하게 한다.축삭을 따라 시냅스에서 볼 수 있는 전압 게이트 이온 채널은 전기 신호를 방향으로 전파합니다.전압 개폐 이온 채널은 일반적으로 이온 특이적이며 나트륨(Na+), 칼륨+(K), 칼슘2+(Ca), 염화물−(Cl) 이온에 고유한 채널이 확인되었다.[1]채널의 개폐는 세포막의 [2]측면 사이의 이온 농도, 즉 전하 구배 변화에 의해 트리거됩니다.
구조.
전압 개폐 이온 채널은 일반적으로 이온이 전기화학적 구배를 따라 이동할 수 있는 중앙 기공이 있는 방식으로 배열된 여러 개의 서브유닛으로 구성됩니다.채널은 이온에 특화된 경향이 있지만 크기가 비슷하고 충전된 이온이 채널을 통과할 수도 있습니다.전압 게이트 이온 채널의 기능은 전압 센서, 공극 또는 전도 경로, [3]게이트의 세 가지 주요 이산 장치에 기인합니다.Na+, K+, Ca2+ 채널은 중심공 주위에 배치된 4개의 막 통과 도메인으로 구성되며, 대부분의+ Na 및2+ Ca 채널의 경우 이들 4개의 도메인은 단일 α-서브유닛의 일부이며, 대부분의+ K [4]채널에는 각각 하나의 막 통과 도메인에 기여하는 4개의 α-서브유닛이 있다.S1-S6로 명명된 막 스패닝 세그먼트는 모두 특수 기능을 가진 알파 나선 형태를 취한다.제5 및 제6막 통과 세그먼트(S5, S6)와 기공 루프는 채널의 게이트와 기공을 구성하는 이온 전도의 주요 역할을 하며, S1-S4는 전압 감지 [3]영역이다.4개의 서브유닛은 동일하거나 서로 다를 수 있습니다.4개의 중심α-서브유닛 외에 세포막의 내면에 위치하여 막과 교차하지 않는 산화환원효소 활성을 가진 조절β-서브유닛이 있으며, 이 조절β-서브유닛은 내플라스민 망막에서 [5]α-서브유닛과 결합되어 있다.
메커니즘
칼륨 채널의 결정학적 구조 연구는 막 위에 전위차가 도입될 때 관련된 전기장이 칼륨 채널의 구조 변화를 유도한다는 것을 보여주었다.구조 변화는 채널 단백질의 형태를 충분히 왜곡시켜 공동 또는 채널이 열려 막을 통해 유입 또는 유출이 발생할 수 있습니다.이온이 농도 구배 아래로 이동하면 세포막을 탈분극시키기에 충분한 전류가 생성됩니다.
전압 개폐 나트륨 채널과 칼슘 채널은 4개의 상동 도메인을 가진 단일 폴리펩타이드로 구성됩니다.각 도메인은 알파나선을 가로지르는 6개의 막을 포함한다.이러한 나선형 중 하나인 S4는 전압 감지 [6]나선형이다.S4 세그먼트에는 셀 외부의 높은 양의 전하가 나선을 밀어내고 채널을 닫힌 상태로 유지하는 등 많은 양의 전하가 포함되어 있습니다.
일반적으로 이온채널의 전압검출부는 채널의 개폐를 트리거하는 막전위의 변화를 검출하는 역할을 한다.일반적으로 S1-4 알파 나선은 이러한 역할을 하는 것으로 생각된다.칼륨 및 나트륨 채널에서 전압검출 S4 헬리스는 정전하 리신 또는 아르기닌 잔기를 반복 [3]모티브로 함유한다.정지상태에서는 각 S4나선의 절반이 세포세포에 접촉한다.탈분극 시 S4 도메인에서 양전하 잔류물은 막의 외형질 표면을 향해 이동한다.처음 4개의 아르기닌은 막 탈분극에 반응하여 채널 활성화 시 세포외 용매 쪽으로 이동하는 게이트 전류를 설명하는 것으로 생각된다.이러한 단백질 결합 양전하의 10~12의 [4]이동은 채널을 여는 구조 변화를 유발합니다.이 움직임이 일어나는 정확한 메커니즘은 현재 합의되지 않았지만, 표준, 트랜스포터, 패들 및 트위스트 모델은 현재 [7]이론의 예입니다.
전압 센서의 이동은 전도 경로의 게이트의 구조 변화를 유발하여 [3]채널을 통과하는 이온의 흐름을 제어합니다.
이러한 채널의 전압 민감 단백질 영역의 주요 기능 부분은 일반적으로 다양한 세포와 종에 걸쳐 교환 가능한 보존 배열로 보이는 모양 때문에 "패들"로 알려진 S3b 및 S4 헬리크로 구성된 영역을 포함합니다.유사한 전압 센서 패들 또한 다양한 [8]종류의 전압 민감 포스파타아제 제품군에서 발견되었습니다.화산에 사는 고세균 종에서 쥐의 뇌 칼륨 채널로 가는 패들 영역의 유전 공학은 온전한 패들 전체가 [9]교체되는 한 완전히 기능하는 이온 채널을 만든다.이러한 "모듈성"을 통해 단순하고 저렴한 모델 시스템을 사용하여 이 지역의 기능, 질병에서의 역할, 그리고 그 행동의 제약 제어를 연구할 수 있으며, 이는 불충분하게 특성화되거나 비용이 많이 [10]들거나 준비물을 연구하기 어려운 것에 국한되지 않는다.
전압 개폐 이온 채널은 일반적으로 막 탈분극에 의해 활성화되지만, 내부 정류기 칼륨 이온 채널과 같은 일부 채널은 과분극에 의해 활성화된다.
게이트는 채널의 전압 감지 영역에 연결된 것으로 생각되며 이온 [11]흐름에 대한 기계적 장애물을 포함하는 것으로 보입니다.S6 도메인은 이 장애물로 작용하는 세그먼트로 합의되었지만, 그 정확한 메커니즘은 알려지지 않았다.가능한 설명으로는 S6 세그먼트는 이온을 [12]통과시키는 가위 모양의 움직임을 하거나,[13] S6 세그먼트는 채널을 통과시키는 2개의 세그먼트로 분할되거나, 게이트 [14]자체의 역할을 하는 S6 채널 등이 있습니다.S4 세그먼트의 움직임이 S6에 영향을 미치는 메커니즘은 아직 밝혀지지 않았지만, [3]S6의 개방을 가능하게 하는 S4-S5 링커가 있다는 것이 이론이다.
이온 채널은 개방 후 밀리초 이내에 비활성화됩니다.불활성화는 [15]세포 내부에 있는 모공의 개방을 제어하는 세포 내 게이트에 의해 매개되는 것으로 생각된다.이 문은 유연한 체인에 묶인 공 모양으로 만들어졌다.비활성화 시 체인은 스스로 접히고 볼은 [16]채널을 통과하는 이온의 흐름을 차단합니다.빠른 불활성화는 S4의 움직임과 불활성화 게이트의 결합을 연결하는 메커니즘은 알 수 없지만 S4 세그먼트의 [17]망내 이동에 의해 발생하는 활성화와 직접 관련된다.
다른 종류
나트륨(Na+) 채널
나트륨 채널은 많은 다른 종류의 세포에 걸쳐 유사한 기능적 특성을 가지고 있습니다.나트륨 채널을 코드하는 10개의 인간 유전자가 확인되었지만, 그들의 기능은 전형적으로 종과 다른 세포 [17]유형 사이에 보존된다.
칼슘(Ca2+) 채널
인간의 칼슘 채널에 대해 확인된 16개의 서로 다른 유전자와 함께, 이러한 유형의 채널은 세포 유형마다 기능이 다릅니다.Ca2+ 채널은 일부 뉴런에서 Na 채널과 유사하게+ 활동 전위를 생성한다.그들은 또한 시냅스 전 신경 말단에서 신경전달물질 방출에 역할을 한다.대부분의 세포에서, Ca 채널은2+ 세포2+ 내 Ca [13]농도를 조절하는 역할로 인해 다양한 생화학적 과정을 조절한다.
칼륨(K+) 채널
칼륨 채널은 가장 크고 다양한 전압 게이트 채널로 100개 이상의 인간 유전자를 암호화합니다.이러한 유형의 채널은 게이트 특성이 크게 다릅니다. 어떤 채널은 매우 느리게 비활성화되고 다른 채널은 매우 빠르게 비활성화됩니다.이 활성화 시간의 차이는 활동 전위 발화의 지속 시간과 속도에 영향을 미치며, 이는 축삭을 따라 전기 전도 및 시냅스 전달에 큰 영향을 미칩니다.칼륨 채널은 4개의 개별 폴리펩타이드 서브유닛을 포함하고, 다른 채널은 4개의 상동 도메인을 포함하지만 단일 폴리펩타이드 유닛을 [7]포함하고 있다는 점에서 다른 채널과 구조가 다르다.
염화물(Cl−) 채널
염화물 채널은 모든 종류의 뉴런에 존재한다.흥분성을 제어하는 주요 책임으로, 염화물 채널은 세포 휴지 전위 유지에 기여하고 세포 부피를 [1]조절하는 데 도움을 줍니다.
프로톤(H+) 채널
전압 개폐 양성자 채널은 수소 이온에 의해 매개되는 전류를 하이드로늄 형태로 전달하고 pH 의존적인 탈분극에 의해 활성화된다.그것들은 [18][19][20]세포에서 산을 제거하는 기능을 한다.
계통학
박테리아에서 발현되는 단백질의 계통학적 연구는 전압 게이트 나트륨 [21]채널의 슈퍼패밀리의 존재를 밝혀냈다.다음 연구는 다른 이온 채널과 대형 다양한 계통 발생적으로. 마음 속으로 K+ 채널의 시정 등을 포함한voltage-gated 이온 채널 ryanodine-inositol 1,4,5-triphosphate 수용체성 칼슘 채널, 일시적 수용기 전위성 칼슘 채널 polycystin 양이온 채널 glutamate-gated 이온 chann과 관련된 것을 보여 주었습니다.els,칼슘 의존성 염화물 채널, 1가 양이온: 항균제, 1형 및 칼륨 수송체.[22]
「 」를 참조해 주세요.
레퍼런스
- ^ a b Purves D, Augustine GJ, Fitzpatrick D, Katz LC, LaMantia A, McNamara JO, Williams SM (2001). "Voltage-Gated Ion Channels". Neuroscience (2nd ed.). Sunderland, Mass: Sinauer Associates. ISBN 978-0-87893-742-4.
- ^ Catterall WA (April 2000). "From ionic currents to molecular mechanisms: the structure and function of voltage-gated sodium channels". Neuron. 26 (1): 13–25. doi:10.1016/S0896-6273(00)81133-2. PMID 10798388.
- ^ a b c d e Bezanilla F (March 2005). "Voltage-gated ion channels". IEEE Transactions on NanoBioscience. 4 (1): 34–48. doi:10.1109/tnb.2004.842463. PMID 15816170. S2CID 8212388.
- ^ a b Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J (2000). "Section 21.3, Molecular Properties of Voltage-Gated Ion Channels". Molecular Cell Biology (4th ed.). New York: Scientific American Books. ISBN 978-0-7167-3136-8.
- ^ Gulbis JM, Mann S, MacKinnon R (June 1999). "Structure of a voltage-dependent K+ channel beta subunit". Cell. 97 (7): 943–52. doi:10.1016/s0092-8674(00)80805-3. PMID 10399921.
- ^ Catterall WA (2010). "Ion channel voltage sensors: structure, function, and pathophysiology". Neuron. 67 (6): 915–28. doi:10.1016/j.neuron.2010.08.021. PMC 2950829. PMID 20869590.
- ^ a b Sands Z, Grottesi A, Sansom MS (2005). "Voltage-gated ion channels". Current Biology. 15 (2): R44–7. doi:10.1016/j.cub.2004.12.050. PMID 15668152.
- ^ Murata Y, Iwasaki H, Sasaki M, Inaba K, Okamura Y (June 2005). "Phosphoinositide phosphatase activity coupled to an intrinsic voltage sensor". Nature. 435 (7046): 1239–43. Bibcode:2005Natur.435.1239M. doi:10.1038/nature03650. PMID 15902207. S2CID 4427755.
- ^ Alabi AA, Bahamonde MI, Jung HJ, Kim JI, Swartz KJ (November 2007). "Portability of paddle motif function and pharmacology in voltage sensors". Nature. 450 (7168): 370–5. Bibcode:2007Natur.450..370A. doi:10.1038/nature06266. PMC 2709416. PMID 18004375.
- ^ Long SB, Tao X, Campbell EB, MacKinnon R (November 2007). "Atomic structure of a voltage-dependent K+ channel in a lipid membrane-like environment". Nature. 450 (7168): 376–82. Bibcode:2007Natur.450..376L. doi:10.1038/nature06265. PMID 18004376. S2CID 4320272.
- ^ Yellen G (August 1998). "The moving parts of voltage-gated ion channels". Quarterly Reviews of Biophysics. 31 (3): 239–95. doi:10.1017/s0033583598003448. PMID 10384687.
- ^ Perozo E, Cortes DM, Cuello LG (July 1999). "Structural rearrangements underlying K+-channel activation gating". Science. 285 (5424): 73–8. doi:10.1126/science.285.5424.73. PMID 10390363. S2CID 26775433.
- ^ a b Jiang Y, Lee A, Chen J, Cadene M, Chait BT, MacKinnon R (May 2002). "Crystal structure and mechanism of a calcium-gated potassium channel". Nature. 417 (6888): 515–22. Bibcode:2002Natur.417..515J. doi:10.1038/417515a. PMID 12037559. S2CID 205029269.
- ^ Webster SM, Del Camino D, Dekker JP, Yellen G (April 2004). "Intracellular gate opening in Shaker K+ channels defined by high-affinity metal bridges". Nature. 428 (6985): 864–8. Bibcode:2004Natur.428..864W. doi:10.1038/nature02468. PMID 15103379. S2CID 1329210.
- ^ Armstrong CM (July 1981). "Sodium channels and gating currents". Physiological Reviews. 61 (3): 644–83. doi:10.1152/physrev.1981.61.3.644. PMID 6265962.
- ^ Vassilev P, Scheuer T, Catterall WA (October 1989). "Inhibition of inactivation of single sodium channels by a site-directed antibody". Proceedings of the National Academy of Sciences of the United States of America. 86 (20): 8147–51. Bibcode:1989PNAS...86.8147V. doi:10.1073/pnas.86.20.8147. PMC 298232. PMID 2554301.
- ^ a b Bénitah JP, Chen Z, Balser JR, Tomaselli GF, Marbán E (March 1999). "Molecular dynamics of the sodium channel pore vary with gating: interactions between P-segment motions and inactivation". The Journal of Neuroscience. 19 (5): 1577–85. doi:10.1523/JNEUROSCI.19-05-01577.1999. PMC 6782169. PMID 10024345.
- ^ Cherny, V.V.; Markin, V.S.; DeCoursey, T.E. (1995), "The voltage-activated hydrogen ion conductance in rat alveolar epithelial cells is determined by the pH gradient", Journal of General Physiology (published June 1995), vol. 105, no. 6, pp. 861–896, doi:10.1085/jgp.105.6.861, PMC 2216954, PMID 7561747
- ^ DeCoursey, T.E. (2003), "Voltage-gated proton channels and other proton transfer pathways", Physiological Reviews, vol. 83, no. 2, pp. 475–579, doi:10.1152/physrev.00028.2002, OCLC 205658168, PMID 12663866
- ^ Ramsey, I. Scott; Mokrab, Younes; Carvacho, Ingrid; Sands, Zara A.; Sansom, Mark S.P.; Clapham, David E. (2010). "An aqueous H+ permeation pathway in the voltage-gated proton channel Hv1". Nature Structural & Molecular Biology. 17 (7): 869–875. doi:10.1038/nsmb.1826. PMC 4035905. PMID 20543828.
- ^ Koishi R, Xu H, Ren D, Navarro B, Spiller BW, Shi Q, Clapham DE (March 2004). "A superfamily of voltage-gated sodium channels in bacteria". The Journal of Biological Chemistry. 279 (10): 9532–8. doi:10.1074/jbc.M313100200. PMID 14665618.
- ^ Chang, Abraham B.; Lin, Ron; Studley, W. Keith; Tran, Can V.; Saier, Milton H., Jr. (2004). "Phylogeny as a guide to structure and function of membrane transport proteins". Mol Membr Biol. 21 (3): 171–181. doi:10.1080/09687680410001720830. PMID 15204625. S2CID 45284885.
외부 링크
- IUPHAR-DB 전압 게이트 이온 채널 서브 유닛
- IUPHAR 2005 전압 게이트 이온 채널 개요
- 미국 국립 의학 도서관 의학 주제 제목(MeSH)의 전압 의존 + 음이온 + 채널