융점
Melting point
물질의 녹는점(또는 드물게 액화점)은 고체에서 액체로 상태가 변하는 온도입니다.녹는점에서 고체와 액체 상은 평형 상태로 존재합니다.물질의 녹는점은 압력에 따라 다르며, 일반적으로 1기압 또는 100 kPa와 같은 표준 압력에서 지정됩니다.
액체에서 고체로의 역변화의 온도로 간주될 때, 그것은 동결점 또는 결정화점이라고 불립니다.물질의 과냉각 능력 때문에 빙점이 실제 값보다 낮게 보일 수 있습니다.물질의 '특성 어는점'이 결정될 때, 사실 실제 방법론은 거의 항상 "얼음의 형성, 즉 융점보다 소멸을 관찰하는 원리"입니다.[1]
예

대부분의 물질에서 녹는점과 어는점은 거의 같습니다.예를 들어, 수은의 녹는점과 어는점은 234.32 켈빈(-38.83 °C; -37.89 °F)입니다.[2]그러나 어떤 물질들은 서로 다른 고체-액체 전이 온도를 가지고 있습니다.예를 들어, 한천은 85°C(185°F; 358K)에서 녹고 31°C(88°F; 304K)에서 응고됩니다. 이러한 방향 의존성을 히스테리시스라고 합니다.압력 1기압에서 얼음이 녹는점은 0°C(32°F; 273K)에 매우 가깝습니다[3]. 이 점을 빙점이라고도 합니다.핵물질이 존재하는 경우 물의 어는점이 녹는점과 항상 같은 것은 아닙니다.원자력 발전기가 없을 경우 물은 냉동 전에 -48.3°C(-54.9°F; 224.8K)까지 과냉각된 액체로 존재할 수 있습니다.[citation needed]
녹는점이 가장 높은 금속은 텅스텐으로 3,414°C(6,177°F; 3,687K)입니다.[4] 이러한 특성으로 인해 텅스텐은 백열등에서 전기 필라멘트로 사용하기에 탁월합니다.종종 인용되는 탄소는 주변 압력에서 녹지 않고 약 3,700 °C (6,700 °F; 4,000 K)에서 서브라임을 합니다. 액체 상은 10 MPa (99 atm) 이상의 압력에서만 존재하며 추정되는 4,030–4,430 °C (7,290–8,010 °F; 4,300–4,700 K)입니다 (탄소 상 도표 참조).탄화 하프늄(HfCN)은 현재까지 알려진 물질 중 가장 높은 녹는점을 가진 내화성 화합물이며 주변 압력에서 4,273 K (4,000 °C; 7,232 °F) 이상의 녹는점을 가진 것으로 확인된 유일한 화합물입니다.양자역학 컴퓨터 시뮬레이션은 이 합금(HfNC0.380.51)이 약 4,400 K의 녹는점을 가질 것이라고 예측했습니다.[5]이 예측은 나중에 실험을 통해 확인되었지만 정확한 녹는점의 정확한 측정은 아직 확인되지 않았습니다.[6]척도의 반대쪽 끝에서는 절대영도에 임의로 가까운 온도에서도 헬륨이 정상압력에서 전혀 얼지 않습니다. 정상기압의 20배 이상의 압력이 필요합니다.
| 일반 화학물질 목록 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 케미컬[I] | 밀도 (g/cm3) | 녹이기(K)[7] | 끓이다. (K) | |||||||||
| 물 @STP | 1 | 273 | 373 | |||||||||
| 납땜 (Pb60Sn40) | 461 | |||||||||||
| 코코아 버터 | 307.2 | - | ||||||||||
| 파라핀 왁스 | 0.9 | 310 | 643 | |||||||||
| 수소 | 0.00008988 | 14.01 | 20.28 | |||||||||
| 헬륨 | 0.0001785 | —[II] | 4.22 | |||||||||
| 베릴륨 | 1.85 | 1,560 | 2,742 | |||||||||
| 카본 | 2.267 | —[III][8] | 4,000[III][8] | |||||||||
| 질소 | 0.0012506 | 63.15 | 77.36 | |||||||||
| 산소 | 0.001429 | 54.36 | 90.20 | |||||||||
| 나트륨 | 0.971 | 370.87 | 1,156 | |||||||||
| 마그네슘 | 1.738 | 923 | 1,363 | |||||||||
| 알루미늄 | 2.698 | 933.47 | 2,792 | |||||||||
| 유황 | 2.067 | 388.36 | 717.87 | |||||||||
| 염소 | 0.003214 | 171.6 | 239.11 | |||||||||
| 칼륨 | 0.862 | 336.53 | 1,032 | |||||||||
| 티타늄 | 4.54 | 1,941 | 3,560 | |||||||||
| 철 | 7.874 | 1,811 | 3,134 | |||||||||
| 니켈 | 8.912 | 1,728 | 3,186 | |||||||||
| 구리 | 8.96 | 1,357.77 | 2,835 | |||||||||
| 아연 | 7.134 | 692.88 | 1,180 | |||||||||
| 갈륨 | 5.907 | 302.9146 | 2,673 | |||||||||
| 실버 | 10.501 | 1,234.93 | 2,435 | |||||||||
| 카드뮴 | 8.69 | 594.22 | 1,040 | |||||||||
| 인듐 | 7.31 | 429.75 | 2,345 | |||||||||
| 요오드 | 4.93 | 386.85 | 457.4 | |||||||||
| 탄탈룸 | 16.654 | 3,290 | 5,731 | |||||||||
| 텅스텐 | 19.25 | 3,695 | 5,828 | |||||||||
| 플래티넘 | 21.46 | 2,041.4 | 4,098 | |||||||||
| 골드 | 19.282 | 1,337.33 | 3,129 | |||||||||
| 수성. | 13.5336 | 234.43 | 629.88 | |||||||||
| 이끌다 | 11.342 | 600.61 | 2,022 | |||||||||
| 비스무트 | 9.807 | 544.7 | 1,837 | |||||||||
융점측정

녹는점을 측정하기 위한 많은 실험실 기술이 존재합니다.코플러 벤치(Kofler bench)는 온도 구배(실내 온도에서 300 °C까지)가 있는 금속 스트립입니다.어떤 물질이든 스트립의 한 부분에 놓일 수 있으며, 그 지점의 온도에서 열 거동을 드러냅니다.시차 주사 열량 측정법은 융해 엔탈피와 함께 융점에 대한 정보를 제공합니다.

결정성 고체 분석을 위한 기본 융점 장치는 투명한 창(가장 기본적인 설계: 티엘 튜브)과 단순한 확대기가 있는 오일조로 구성됩니다.여러 개의 고체 알갱이를 얇은 유리관에 넣고 오일통에 부분적으로 담급니다.오일 배스는 가열(및 교반)되며, 확대기(및 외부 광원)의 도움으로 특정 온도에서 개별 결정이 녹는 것을 관찰할 수 있습니다.오일 배스 대신 금속 블록을 사용할 수도 있습니다.일부 현대 악기들은 자동 광학 탐지 기능을 갖추고 있습니다.
또한 작동 프로세스를 사용하여 측정을 연속적으로 수행할 수도 있습니다.예를 들어, 정유회사는 디젤 연료의 동결점을 "온라인"으로 측정하는데, 이는 샘플이 공정에서 추출되어 자동으로 측정된다는 것을 의미합니다.이렇게 하면 검체를 수동으로 채취하여 원격 검사실로 가져갈 필요가 없기 때문에 더 자주 측정할 수 있습니다.[citation needed]
내화재료 기술
내화 재료(예: 백금, 텅스텐, 탄탈륨, 일부 탄화물 및 질화물 등)의 경우, 극도로 높은 녹는점(일반적으로 1,800 °C 이상으로 간주됨)은 검은색 차체 용해로에서 재료를 가열하고 광학계로 흑체 온도를 측정하여 결정할 수 있습니다.가장 높은 용융 물질의 경우, 수백도의 외삽이 필요할 수 있습니다.백열체에서 나오는 스펙트럼 복사는 온도의 함수로 알려져 있습니다.광열량계는 연구 중인 물체의 광도와 이전에 온도 함수로 보정된 소스의 광도를 일치시킵니다.이런 식으로 방사선 세기의 절대 크기 측정은 불필요합니다.그러나 알려진 온도를 사용하여 파이로미터의 보정을 확인해야 합니다.소스의 교정 범위를 초과하는 온도의 경우 외삽 기술을 사용해야 합니다.이 외삽은 플랑크의 복사법칙을 이용하여 이루어집니다.이 식의 상수는 정확도가 충분하지 않아 온도가 높을수록 외삽의 오류가 커집니다.그러나 이 외삽을 수행하기 위한 표준 기술이 개발되었습니다.[citation needed]
금을 소스로 사용하는 경우를 고려합니다(mp = 1,063 °C).이 기술에서, 필라멘트의 빛의 세기가 금의 녹는점에서 흑체의 빛의 세기와 일치할 때까지 파이로미터의 필라멘트를 통과하는 전류가 조정됩니다.이를 통해 1차 보정 온도가 결정되며, 파이로미터 램프를 통해 전류로 표현할 수 있습니다.동일한 전류 설정에서 다른 흑체에서 더 높은 온도에서 파이로미터가 관측됩니다.알려진 전달의 흡수 매체가 파이로미터와 이 블랙 바디 사이에 삽입됩니다.그런 다음 흑체의 온도는 그 강도와 파이로미터 필라멘트의 강도 사이에 일치할 때까지 조정됩니다.흑체의 진정한 높은 온도는 플랑크의 법칙에 의해 결정됩니다.그런 다음 흡수 매체를 제거하고 필라멘트를 통과하는 전류를 조정하여 필라멘트 강도를 블랙 바디의 강도와 일치시킵니다.그러면 파이로미터에 대한 두 번째 보정 지점이 설정됩니다.이 단계를 반복하여 보정을 더 높은 온도로 운반합니다.이제, 온도와 그에 상응하는 파이로미터 필라멘트 전류가 알려져 있고, 온도 대 전류의 곡선이 그려질 수 있습니다.그러면 이 곡선은 매우 높은 온도로 외삽될 수 있습니다.
이 방법에 의해 내화물의 융점을 결정할 때, 흑체 상태를 갖거나 측정되는 물질의 방사율을 알아야 합니다.고용융 물질을 액체 상태로 포함하는 것은 실험적인 어려움을 초래할 수 있습니다.따라서 일부 내화 금속의 용융 온도는 폭보다 훨씬 긴 고체 금속 표본의 검은색 체강에서 나오는 방사선을 관찰함으로써 측정되었습니다.이러한 공동을 형성하기 위해, 재료의 로드의 중심에 장축과 수직으로 구멍을 천공합니다.그리고 나서 이 막대들은 매우 큰 전류를 통과시킴으로써 가열되고, 구멍에서 방출되는 방사선은 광학계로 관측됩니다.녹는점은 액체 상태가 나타날 때 구멍이 어두워져 흑체 상태가 파괴되는 것으로 나타납니다.오늘날 빠른 열측정기 및 분광열측정기와 결합된 용기 없는 레이저 가열 기술은 샘플이 극한 온도에서 보관되는 시간을 정확하게 제어할 수 있도록 하기 위해 사용됩니다.2초 미만의 지속 시간에 대한 이러한 실험은 샘플 기화 및 용기와의 반응과 같은 매우 높은 온도에서 수행되는 보다 전통적인 융점 측정과 관련된 몇 가지 과제를 해결합니다.
열역학
고체가 녹기 위해서는 온도를 녹는점까지 올리기 위한 열이 필요합니다.그러나 용융이 일어나기 위해서는 추가적인 열이 공급되어야 합니다. 이것은 융해열이라고 불리며 잠열의 한 예입니다.[citation needed]
열역학적 관점에서 볼 때, 물질의 깁스 자유 에너지 ( δG)의 변화는 0이지만 물질의 엔탈피 (H)와 엔트로피 (S)는 증가하고 있습니다 ( δH, δS > 0).용융현상은 액체의 깁스 자유에너지가 그 물질의 고체보다 낮아질 때 발생합니다.다양한 압력에서 특정 온도에서 이 현상이 발생합니다.다음을 나타낼 수도 있습니다.
여기서 T, δS 및 δH는 각각 녹는점에서의 온도, 녹는 엔트로피의 변화 및 녹는 엔탈피의 변화입니다.
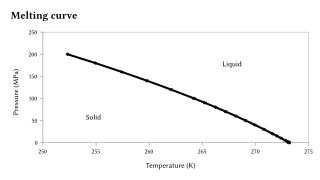
녹는점은 압력의 극도로 큰 변화에 민감하지만 일반적으로 이 민감도는 끓는점보다 작은 크기입니다. 왜냐하면 고체-액체 전이는 부피의 작은 변화만을 나타내기 때문입니다.[9][10]대부분의 경우에서 관찰되는 것처럼 물질이 액체 상태보다 고체에서 더 밀도가 높은 경우, 압력이 증가함에 따라 녹는점이 증가합니다.그렇지 않으면 역방향 동작이 발생합니다.특히 오른쪽에 그래프로 나타낸 것처럼 물의 경우도 그렇지만 Si, Ge, Ga, Bi의 경우도 마찬가지입니다.압력의 변화가 매우 큰 경우, 녹는점의 상당한 변화가 관찰됩니다.예를 들어 주변 압력(0.1 MPa)에서 실리콘의 녹는점은 1415°C이지만 10GPa를 초과하는 압력에서는 1000°C로 감소합니다.[11]
융점은 종종 유기 및 무기 화합물을 특성화하고 순도를 확인하는 데 사용됩니다.순수한 물질의 녹는점은 항상 높고 불순한 물질의 녹는점 또는 더 일반적으로 혼합물의 녹는점보다 작은 범위를 갖습니다.다른 구성 요소의 양이 많을수록 녹는점은 낮아지고 녹는점 범위는 넓어집니다. 흔히 "페이스티 범위"라고 불립니다.혼합물의 용융이 시작되는 온도는 고체로 알려져 있고 용융이 완료되는 온도는 액체로 불립니다.공융학은 단상처럼 작용하는 특수한 유형의 혼합물입니다.그들은 일정한 온도에서 급격히 녹아 같은 구성의 액체를 형성합니다.또는 공융 조성을 가진 액체를 냉각할 때 동일한 조성을 가진 작은(세립) 혼합 결정이 균일하게 분산되어 응고됩니다.
결정성 고체와는 달리, 유리는 녹는 점이 없습니다. 가열하면 유리가 점성 액체로 부드럽게 전환됩니다.추가 가열이 이루어지면 점차 연화되며, 이는 특정 연화점으로 특징지어질 수 있습니다.
빙점저울기
다른 화합물을 첨가하면 용매의 어는점이 낮아지는데, 이는 용액이 순수 용매보다 어는점이 낮다는 것을 의미합니다.이 현상은 예를 들어 물에 소금 또는 에틸렌 글리콜을 첨가함으로써 동결을 방지하기 위한 기술적 응용에 사용됩니다.[citation needed]
카넬리의 법칙
유기화학에서, 1882년 토마스 카넬리에 의해 확립된 카넬리의 법칙은 높은 분자 대칭이 높은 융점과 관련이 있다고 말합니다.[12]Carnelley는 그의 규칙을 15,000개의 화합물에 대한 조사에 근거했습니다.예를 들어, 분자식 CH를512 갖는 3개의 구조적 이성질체의 경우 아이소펜탄 -160 °C (113 K) n-펜탄 -129.8 °C (143 K) 및 네오펜탄 -16.4 °C (256.8 K) 시리즈에서 녹는점이 증가합니다.[13]자일렌과 디클로로벤젠에서도 마찬가지로 메타, 오르토, 파라 순으로 녹는점이 증가합니다.피리딘은 벤젠보다 대칭성이 낮아서 녹는점이 낮지만, 디아진과 트리아진으로 다시 녹는점이 증가합니다.높은 대칭성을 갖는 아다만탄 및 큐베인과 같은 많은 케이지(cage)형 화합물은 비교적 높은 융점을 갖습니다.
높은 융점은 높은 융해열, 낮은 융해엔트로피 또는 둘 다의 조합으로 발생합니다.매우 대칭적인 분자에서 결정상은 많은 효율적인 분자간 상호작용으로 밀집되어 있으며, 이로 인해 용융 시 엔탈피 변화가 더 높아집니다.

물질의 녹는점 예측 (린데만의 기준)
결정성 물질의 대량 용융점을 예측하려는 시도는 1910년 프레드릭 린데만에 의해 처음 이루어졌습니다.[15]이론의 배경에는 온도가 증가함에 따라 열 진동의 평균 진폭이 증가한다는 관측이 있었습니다.인접한 원자가 부분적으로 같은 공간을 차지할 수 있을 정도로 진동 진폭이 커지면 용융이 시작됩니다.린데만 기준은 진동 루트 평균 제곱 진폭이 임계값을 초과할 때 용융이 예상된다는 것입니다.
결정의 모든 원자가 같은 진동수 ν로 진동한다고 가정하면, 평균 열에너지는 등분 정리를 사용하여 다음과 같이 추정할 수 있습니다.
여기서 m은 원자 질량, ν는 주파수, u는 평균 진동 진폭, k는 볼츠만 상수, T는 절대 온도입니다.만약 u의2 임계 값이 ca이고22 c가 린데만 상수이고 a가 원자 간격이라면, 녹는점은 다음과 같이 추정됩니다.
평균 열 에너지의 추정치에 따라 추정된 용융 온도에 대한 몇 가지 다른 식을 얻을 수 있습니다.린데만 기준에 대해 일반적으로 사용되는 또 다른 표현은 다음과[17] 같습니다.
ν의 데바이 주파수에 대한 표현에서 볼 때,
여기서 θ는 데비 온도이고 h는 플랑크 상수입니다.대부분의 재료에서 c의 값은 0.15에서 0.3 사이입니다.[18]
융점예측
2011년 2월 Alfa Aesar는 카탈로그에서 10,000개 이상의 화합물을 공개 데이터로 공개했습니다.이 데이터 세트는 이제 자유롭게 사용할 수 있는 융점 예측을 위한 랜덤 포레스트 모델을 만드는 데 사용되었습니다.[19]개방형 융점 데이터는 Nature Precedings에서도 사용할 수 있습니다.[20]Tetko et al. 은 특허에서 채굴된 고품질 데이터와 이 데이터로 개발된 모델을[21] 발표했습니다.[22]
요소의 융점
| 그룹 → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ↓ 기간 | |||||||||||||||||||||
| ① | ㅇ213.99K (-259.16°C) | 그0.95K (-272.20°C) | |||||||||||||||||||
| ② | 리453.65K (180.50°C) | 있다1560K (1287 °C) | B 2349K (2076 °C) | C | ㄴ263.23 K (-209.86°C) | 오254.36 K (-218.79°C) | 바253.48K (-219.67°C) | 네24.56K (-248.59°C) | |||||||||||||
| ③ | 나370.944 K (97.794°C) | Mg923K (650°C) | 알933.47K (660.32°C) | 시1687K (1414 °C) | P 317.3K (44.15°C) | S 388.36 K (115.21 °C) | Cl2171.6K (-101.5°C) | 아르83.81 K (-189.34°C) | |||||||||||||
| ④ | K 336.7K (63.5°C) | 카1115K (842°C) | Sc1814 K (1541°C) | 티1941 K (1668°C) | V 2183K (1910 °C) | 씨알2180K (1907 °C) | 음1519K (1246°C) | Fe1811K (1538 °C) | 코1768K (1495 °C) | 니1728K (1455 °C) | CU1357.77K (1084.62°C) | Zn692.68K (419.53°C) | 가302.9146K (29.7646 °C) | 게1211.40K (938.25°C) | ~하듯이 | 세494K (221°C) | Br2265.8K (-7.2°C) | Kr115.78K (-157.37°C) | |||
| ⑤ | Rb312.45K (39.30°C) | Sr1050K (777 °C) | Y 1799K (1526 °C) | Zr2128K (1855 °C) | Nb2750K (2477 °C) | 모2896K (2623 °C) | Tc2430K (2157 °C) | 루2607K (2334°C) | Rh2237K (1964 °C) | 피디1828.05 K (1554.9 °C) | Ag1234.93 K (961.78°C) | 씨디594.22 K (321.07 °C) | 인429.7485K (156.5985 °C) | Sn505.08K (231.93°C) | 누군가903.78K (630.63°C) | 테722.66K (449.51°C) | 나는2386.85K (113.7 °C) | 쎄161.40K (-111.75°C) | |||
| ⑥ | Cs301.7K (28.5°C) | 바1000K (727°C) | 루1925 K (1652 °C) | Hf2506K (2233°C) | 타3290K (3017 °C) | W 3695K (3422°C) | 리3459K (3186 °C) | 오스3306K (3033°C) | Ir2719K (2446°C) | Pt2041.4K (1768.3°C) | 아우1337.33 K (1064.18 °C) | Hg234.3210K (-38.8290°C) | Tl577K (304°C) | Pb600.61K (327.46°C) | 바이544.7K (271.5 °C) | 포527K (254°C) | 앳575K (302°C) | Rn202K (-71°C) | |||
| ⑦ | Fr300K (27°C) | 라973K (700°C) | Lr1900K (1627 °C) | Rf2400K (2100 °C) | Db | Sg | Bh | 허스 | Mt | 디에스 | Rg | Cn283±11K (10±11°C) | Nh700K (430°C) | Fl200K (-73°C) | 맥씨670K (400°C) | Lv637–780K (364–507°C) | Ts623–823K (350–550°C) | 오그325±15K (52±15°C) | |||
| 라1193K (920°C) | 쎄1068K (795°C)6 | Pr1208K (935°C) | Nd1297K (1024°C) | pm1315K (1042°C) | 스엠1345K (1072°C) | 에우1099K (826°C) | Gd1585K (1312 °C) | Tb1629K (1356 °C) | 다이1680K (1407 °C) | 호1734K (1461°C) | 음.정말1802K (1529 °C) | Tm1818K (1545°C) | Yb1097K (824°C) | ||||||||
| 아크1500K (1227 °C) | Th2023 K (1750°C) | 파1841 K (1568°C) | U 1405.3K (1132.2°C) | Np912±3K (639±3°C) | 푸912.5K (639.4°C) | 암1449K (1176 °C) | cm1613K (1340°C) | Bk1259K (986 °C) | Cf1173K (900°C) | 에스1133K (860°C) | Fm1800K (1527 °C) | Md1100K (827°C) | 아니요.1100K (827°C) | ||||||||
| 전설 | |||||||||||||||||||||
| 값은 켈빈 K 및 섭씨 °C이며, 반올림됩니다. | |||||||||||||||||||||
| 화씨 °F의 등가물은 다음을 참조하십시오. 요소의 녹는점(데이터 페이지) | |||||||||||||||||||||
| 일부 값은 예측값입니다. | |||||||||||||||||||||
참고 항목
참고문헌
인용문
- ^ Ramsay, J. A. (1 May 1949). "A New Method of Freezing-Point Determination for Small Quantities". Journal of Experimental Biology. 26 (1): 57–64. doi:10.1242/jeb.26.1.57. PMID 15406812.
- ^ 헤인즈, 페이지 4.122.
- ^ 정수의 녹는점은 0.002519 ± 0.000002°C로 측정되었습니다.
- ^ 헤인즈, 페이지 4.123.
- ^ Hong, Q.-J.; van de Walle, A. (2015). "Prediction of the material with highest known melting point from ab initio molecular dynamics calculations". Phys. Rev. B. 92 (2): 020104(R). Bibcode:2015PhRvB..92b0104H. doi:10.1103/PhysRevB.92.020104.
- ^ Buinevich, V.S.; Nepapushev, A.A.; Moskovskikh, D.O.; Trusov, G.V.; Kuskov, K.V.; Vadchenko, S.G.; Rogachev, A.S.; Mukasyan, A.S. (March 2020). "Fabrication of ultra-high-temperature nonstoichiometric hafnium carbonitride via combustion synthesis and spark plasma sintering". Ceramics International. 46 (10): 16068–16073. doi:10.1016/j.ceramint.2020.03.158. S2CID 216437833.
- ^ Holman, S. W.; Lawrence, R. R.; Barr, L. (1 January 1895). "Melting Points of Aluminum, Silver, Gold, Copper, and Platinum". Proceedings of the American Academy of Arts and Sciences. 31: 218–233. doi:10.2307/20020628. JSTOR 20020628.
- ^ a b "Carbon". rsc.org.
- ^ 정확한 관계는 클라우지우스와 클라페이롱의 관계로 표현됩니다.
- ^ "J10 Heat: Change of aggregate state of substances through change of heat content: Change of aggregate state of substances and the equation of Clapeyron-Clausius". Archived from the original on 28 February 2008. Retrieved 19 February 2008.
- ^ Tonkov, E. Yu. and Ponyatovsky, E. G. (2005) 고압 하에서 요소의 상변환, CRC Press, Boca Raton, p. 98 ISBN 0-8493-3367-9
- ^ Brown, R. J. C. & R. F. C. (2000). "Melting Point and Molecular Symmetry". Journal of Chemical Education. 77 (6): 724. Bibcode:2000JChEd..77..724B. doi:10.1021/ed077p724.
- ^ 헤인즈, 6.153-155쪽
- ^ Gilman, H.; Smith, C. L. (1967). "Tetrakis(trimethylsilyl)silane". Journal of Organometallic Chemistry. 8 (2): 245–253. doi:10.1016/S0022-328X(00)91037-4.
- ^ Lindemann FA (1910). "The calculation of molecular vibration frequencies". Phys. Z. 11: 609–612.
- ^ Sorkin, S., (2003), 점 결함, 격자 구조 및 용융 이스라엘 웨이백 머신, 테제, 테크니온에서 2016년 10월 5일 아카이브.
- ^ Philip Hofmann (2008). Solid state physics: an introduction. Wiley-VCH. p. 67. ISBN 978-3-527-40861-0. Retrieved 13 March 2011.[영구 데드링크]
- ^ Nelson, D. R., (2002), 응축물질물리학의 결함과 기하학, Cambridge University Press, ISBN 0-521-00400-4
- ^ 스마일즈에서 녹는점을 예측합니다.Qsardb.org .2013년 9월 13일 회수.
- ^ Bradley, Jean-Claude; Lang, Andrew; Williams, Antony; Curtin, Evan (11 August 2011). "ONS Open Melting Point Collection". Nature Precedings. doi:10.1038/npre.2011.6229.1.
- ^ OCHEM 융점 모델.ochem.eu .2016년 6월 18일 회수.
- ^ Tetko, Igor V; m. Lowe, Daniel; Williams, Antony J (2016). "The development of models to predict melting and pyrolysis point data associated with several hundred thousand compounds mined from PATENTS". Journal of Cheminformatics. 8: 2. doi:10.1186/s13321-016-0113-y. PMC 4724158. PMID 26807157.
원천
- 인용작품
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.








