담즙산
Bile acid담즙산은 주로 포유류와 다른 척추동물의 담즙에서 발견되는 스테로이드산이다.다양한 담즙산이 [1]간에서 합성된다.담즙산은 타우린 또는 글리신 잔기와 결합되어 [2][3][4]담즙염이라고 불리는 음이온을 생성한다.
1차 담즙산은 간에 의해 합성된 것이다.2차 담즙산은 대장의 세균 작용에서 발생한다.사람의 경우 타우로콜산과 글리코콜산(콜산의 유도체)과 타우로케노데옥시콜산과 글리코케노데옥시콜산(체노데옥시콜산의 유도체)이 주요 담즙염이다.그들의 [5]집중력은 거의 같다.이들의 7-α-탈히드록실화 유도체인 디옥시콜산과 리토콜산의 염분도 발견되며, 콜릭산,[5] 체노데옥시콜산 및 디옥시콜산의 유도체가 인간 담즙산의 90% 이상을 차지한다.
담즙산은 담즙에 있는 유기 화합물의 약 80%를 차지한다.[5]담즙산 분비가 증가하면 담즙의 흐름이 증가한다.담즙산은 식이성 지방과 기름의 소화를 돕는다.그들은 미셀을 형성하는 계면활성제 역할을 하며, 영양분을 캡슐화하여 흡수를 [6]촉진합니다.이 미셀들은 더 처리하기 전에 카이엠에 현탁된다.담즙산은 또한 특히 파르네소이드 X 수용체와 GPBAR1([7]TGR5로도 알려져 있음)을 통해 몸 전체에 호르몬 작용을 한다.

생산.
일차 담즙산
담즙산 합성은 간세포에서 일어나며, 간세포는 시토크롬 P450 매개 콜레스테롤 산화를 통해 1차 담즙산(인간의 콜산과 체노데옥시콜산)을 합성한다.대변에서 손실된 담즙산을 대체하기 위해 매일 약 600mg의 담즙염이 합성되지만, 아래에 설명된 바와 같이 훨씬 더 많은 양이 분비되고 장에서 재흡수되고 재활용됩니다.
합성 속도 제한 단계는 콜레스테롤 7 알파-히드록실화효소에 의해 스테로이드 핵의 7번째 위치에 있는 수산기를 추가하는 것이다.이 효소는 콜산에 의해 하향 조절되고 콜레스테롤에 의해 상향 조절되며 회장 호르몬 FGF15/[2][3]19의 작용에 의해 억제됩니다.
담즙산(1차 또는 2차, 아래 참조)을 분비하기 전에 간세포는 그것들을 글리신 또는 타우린과 결합하여 총 8개의 가능한 복합담즙산을 형성한다.이러한 복합 담즙산은 종종 담즙염이라고 불린다.비결합담즙산의 pKa는 5~6.5,[4] 십이지장의 pH는 3~5이므로 비결합담즙산이 십이지장에 있을 때는 거의 항상 양성자화(HA)되어 물에 비교적 불용성이다.담즙산과 아미노산을 결합시키면 담즙산/아미노산 결합체의 pKa가 1~4로 낮아진다.따라서 켤레 담즙산은 십이지장에서 거의 항상 탈양성자(A-) 형태로 존재하며, 이는 그것들을 훨씬 더 수용성으로 만들고 유화 [8][9]지방의 생리적인 기능을 훨씬 더 잘 수행할 수 있게 한다.
이차 담즙산
일단 장의 내강으로 분비되면 담즙염은 장내 세균에 의해 변형된다.그것들은 부분적으로 탈옥실화되어 있다.글리신 및 타우린 그룹은 2차 담즙산, 디옥시콜산 및 리소콜산을 생성하기 위해 제거된다.콜산은 디옥시콜산으로, 첸노데옥시콜산은 리소콜산으로 전환된다.이 4개의 담즙산은 모두 장간 [2][3]순환으로 알려진 과정에서 재활용됩니다.
기능들
지질 소화
소수성 및 친수성 영역을 가진 분자로서, 복합 담즙염은 지질/수면에 위치하며, 오른쪽 농도 이상에서 미셀을 [9]형성한다.복합담즙염의 첨가된 용해성은 소장에서 수동적인 재흡수를 방지함으로써 그 기능을 돕는다.그 결과, 소장의 담즙산/염수 농도는 미셀을 형성하고 지질을 가용화할 수 있을 정도로 높다."임계 미셀 농도"는 담즙산 자체의 고유 특성과 미셀의 [9]자발적이고 역동적인 형성에 필요한 담즙산의 양을 모두 의미한다.담즙산이 함유된 미셀은 지질 소화를 도와 장내 브러시 경계막 근처로 가져와 지방 [6]흡수를 일으킨다.
담즙산의 합성은 인간을 제외한 대부분의 종에서 콜레스테롤 대사의 주요 경로이다.우리 몸은 하루에 약 800mg의 콜레스테롤을 생산하며, 그 중 약 절반은 매일 400~600mg을 생성하는 담즙산 합성에 사용된다.인간 성인은 매일 12에서 18g의 담즙산을 식후에 장에 분비한다.담즙산 풀의 크기는 4~6g으로, 담즙산은 매일 여러 번 재활용됩니다.담즙산의 약 95%는 회장 내 활성 운반에 의해 재흡수되고 담도와 담낭으로 더 많은 분비를 위해 간으로 재활용됩니다.담즙산의 이러한 장간 순환은 낮은 합성 속도를 허용하며, 하루에 0.3g/일에 불과하지만 많은 양이 [5]장으로 분비된다.
담즙산은 체내 콜레스테롤 제거, 특정 이화물(빌리루빈 포함)을 제거하기 위한 담즙의 흐름 촉진, 흡수를 가능하게 하기 위한 지용성 비타민 유화, 운동성 및 [5]소장과 담도에서 발견되는 세균의 감소 등을 포함한 다른 기능을 가지고 있다.
셀 시그널링
담즙산은 호르몬과 유사한 체내 대사 작용을 하며, 파르네소이드 X 수용체와 G 단백질 결합 담즙산 수용체/TGR5라는 [7][10]두 가지 특정 수용체를 통해 작용한다.그것들은 일부 다른 수용체와 덜 특이적으로 결합하고 특정 효소와 이온 채널의 활성과 내인성 지방산 에탄올아미드를 [13]포함한 다양한 물질의 합성을 조절하는 것으로 보고되었다.[14]
구조 및 합성
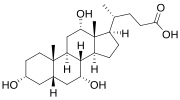
- 주요 인간 담즙산의 구조
담즙염은 4개의 고리를 가진 스테로이드 구조, 카르본산으로 종단하는 5탄소 또는 8탄소의 측쇄 [1]및 특정 담즙염의 수와 방향이 다른 여러 수산기로 이루어진 대분자군을 구성한다.4개의 링은 A, B, C 및 D로 분류되며, 카르복실기가 있는 측쇄에 가장 먼 곳부터 가장 가까운 곳까지 라벨이 붙어 있습니다.D링은 다른 3개보다 1개의 탄소만큼 작습니다.이 구조는 일반적으로 왼쪽에 A, 오른쪽에 D로 그려집니다.하이드록실기는 위쪽(또는 바깥쪽), 베타(β; 종종 실선으로 그려짐) 또는 아래쪽(α; 점선으로 표시됨)의 두 가지 구성 중 하나입니다.모든 담즙산은 3-히드록실기를 가지고 있으며, 3-히드록실기는 부모 분자 콜레스테롤로부터 [1]파생된다.
담즙산의 간 합성 경로의 첫 단계는 7α-히드록시콜레스테롤을 형성하는 콜레스테롤 7α-히드록시효소(CYP7A1)에 의해 7α 히드록시기를 효소적으로 추가하는 것이다.그런 다음 7α-히드록시-4-콜레스텐-3-온으로 대사된다.총 14개의 효소가 필요한 담즙산 합성에는 여러 단계가 있다.[3]이는 처음 두 개의 스테로이드 고리(A와 B) 사이의 결합을 변화시켜 분자를 구부리게 한다. 이 과정에서 3-히드록실기는 α 방향으로 변환된다.가장 단순한 24-탄소 담즙산은 위치 3α와 7α에 두 개의 수산기가 있습니다.이것은 3α,7α-디히드록시-5β-콜란-24-oic산, 또는 일반적으로는 chenodeoxycholic acid이다.이 담즙산은 처음에 가축 거위로부터 분리되었고, 여기서 이름의 "체노" 부분이 유래되었다. (그리스어: χνν= = 거위)이름에 있는 5β는 스테로이드 핵의 고리 A와 B 사이의 결합 방향(이 경우 구부러짐)을 나타낸다."콜란"이라는 용어는 24개의 탄소로 이루어진 특정 스테로이드 구조를 나타내며, "24-oic acid"는 카르본산이 측쇄 끝의 위치 24에서 발견됨을 나타낸다.Chenodeoxycholic acid는 많은 종에 의해 만들어지며, 전형적인 기능성 담즙산이다.[2][3]
담즙산 합성의 대체(산) 경로는 간에서 발현되는 미토콘드리아 스테롤 27-히드록실화효소(CYP27A1)와 대식세포 및 기타 조직에 의해 개시된다.CYP27A1은 스테롤 측쇄 산화를 촉매하여 총담즙산 합성에 크게 기여하고, 그 후 과산화섬 내의 3탄소 단위의 분열이 C24 담즙산을 형성한다.간에서 25-히드록실화효소에 의해 개시되는 소경로 및 뇌에서 24-히드록실화효소에 의해 개시되는 소경로도 담즙산 합성에 기여할 수 있다.7α-히드록실화효소(CYP7B1)는 옥시스테롤을 생성하며, 옥시스테롤은 간에서 CDCA로 [2][3]추가로 전환될 수 있다.
콜산(3α,7α,12α-트리히드록시-5β-콜란-24-oic acid)은 사람과 다른 많은 종에서 가장 풍부한 담즙산이다.3개의 수산기(3α, 7α 및 12α)를 가진 3-히드록시-빌레산이다.간에서의 합성에서는 CYP8B1의 부가작용에 의해 12α 수산화된다.이미 설명한 바와 같이, chenodeoxcholic acid (2개의 하이드록실기를 가진)의 발견은 이 새로운 담즙산이 cholic [2][3]acid보다 1개 적은 하이드록실기를 가진다는 점에서 이 새로운 담즙산을 "deoxycholic acid"로 만들었다.
디옥시콜산은 7-탈수소화에 의해 콜산으로부터 형성되어 2개의 수산기(3α, 12α)가 된다.chenodeoxycholic acid를 사용한 이 과정은 3α 하이드록실기만을 가진 담즙산을 생성하며, rithocholic acid(litho = 돌)는 송아지의 담석에서 먼저 확인되었다.수용성이 떨어지고 세포에 [2][3]독성이 있다.
다른 척추동물군은 스테로이드 핵과 담즙산 구조의 측쇄에 대부분의 위치의 수정을 사용하도록 진화해왔다.리소콜산의 생산과 관련된 문제들을 피하기 위해, 대부분의 종들은 제3의 수산기를 체노데옥시콜산에 첨가한다.장내 세균에 의한 7α 하이드록실기의 후속 제거는 독성은 떨어지지만 여전히 기능적인 디히드록시 담즙산을 발생시킨다.척추동물의 진화 과정에서 제3의 히드록실기를 배치하기 위해 많은 위치가 선택되었다.처음에는 특히 조류에서 16α의 위치가 선호되었다.이후 이 위치는 12α 위치를 선택하는 많은 종으로 대체되었다.영장류(인간 포함)는 세 번째 수산기 위치에 12α를 사용하여 콜산을 생성한다.생쥐 및 기타 설치류에서 6β 히드록실화는 뮤리콜산을 형성한다(7개의 히드록실 위치에 따라 α 또는 β).돼지는 히오콜산(3α, 6α, 7α-트리히드록시-5β-콜라노산)에 6α의 히드록실화를 가지며, 다른 종은 측쇄의 위치 23에 히드록실기를 가진다.
많은 다른 담즙산들은 종종 소량의 세균 효소나 다른 변형으로 인해 설명되었다."iso-" 에피머는 β 위치에 3-히드록실기를 가진다."알로" 에피머는 5α 구성을 가지며, 이로 인해 A [1]및 B 링의 상대적 위치가 변경됩니다.
우르소데옥시콜산은 곰담즙에서 처음 분리되었고, 곰담즙은 수세기 동안 약용으로 사용되어 왔다.그 구조는 체노데옥시콜산과 유사하지만 7-히드록실기가 β [1]위치에 있다.
오베티콜산, 6α-에틸-케노데옥시콜산은 FXR 작용제로서 활성이 높은 반합성 담즙산이며, 특정 간질환의 [15]약제로서 개발되어 왔다.
호르몬 작용
담즙산은 또한 간에서 분비되고 장에서 흡수되며 NR1H4라는 [16][17][18]유전자명으로도 알려진 핵 수용체 파르네소이드 X 수용체를 통해 체내에서 다양한 직접 대사 작용을 하는 스테로이드 호르몬으로 작용한다.또 다른 담즙산 수용체는 G단백질 결합 담즙산 수용체 1 또는 TGR5로 알려진 세포막 수용체이다.TGR5는 대사,[7][19] 내분비 및 신경학적 기능에 관여할 수 있는 반면, 간과 장에서 신호 분자로서의 많은 기능은 FXR을 활성화하는 것이다.
합성 조절
계면활성제나 세제로서 담즙산은 세포에 독성이 있을 수 있기 때문에 그 농도는 엄격하게 규제된다.간에서 FXR의 활성화는 담즙산 합성을 저해하며, 담즙산 수치가 너무 높을 때 피드백 제어의 메커니즘 중 하나이다.둘째, 장내 흡수 중 담즙산에 의한 FXR 활성화는 FGF19의 전사 및 합성을 증가시켜 [20]간에서 담즙산 합성을 저해한다.
대사 기능
새로운 증거는 FXR 활성화를 트리글리세리드 대사, 포도당 대사 및 간 성장과 [7][21][19]연관짓는다.
기타 상호작용
담즙산은 호르몬 수용체(FXR 및 TGR5)와 운반체 외에 다른 단백질과 결합합니다.이들 단백질 타깃 중 N-acyl 포스파티딜레타놀라민특이 포스폴리파아제D(NAPE-PLD)는 스트레스, 통증반응, 식욕 및 수명을 포함한 여러 생리경로에서 중요한 역할을 하는 생체활성 지질아미드(예를 들어 내인성 칸나비노이드 아난다미드)를 생성한다.NAPE-PLD는 지질아미드 신호와 담즙산 [13][14]생리학 사이의 직접적인 교잡 대화를 관장한다.
임상적 의의
고지혈증
담즙산은 내인성 콜레스테롤로 만들어지기 때문에 담즙산의 장간 순환이 방해되면 콜레스테롤이 낮아진다.담즙산 격리제는 장에서 담즙산을 결합시켜 재흡수를 막는다.이렇게 하면 더 많은 내인성 콜레스테롤이 담즙산 생성에 투입되어 콜레스테롤 수치를 낮출 수 있다.격리된 담즙산은 [22]대변으로 배출된다.
콜레스트시스
담즙산에 대한 테스트는 임신의 간내 담즙 적출증, 포토시스템식 분로, [23]개의 간 미세혈관 이형성과 같은 여러 가지 상태를 진단하는 데 도움이 되기 때문에 인간과 수의학 모두에서 유용합니다.담도 시스템의 구조적 또는 기능적 이상은 혈중 빌리루빈(황달)과 담즙산의 증가를 초래한다.담즙산은 1차 담도 간경변증(PBC), 1차 경화성 담관염 또는 [24]임신의 간내 담즙저하증 등과 같은 담즙성 질환에서 흔히 나타나는 가려움증(가려움)과 관련이 있다.이러한 콜레스테롤 [25][26]질환에서는 수년 동안 우르소데옥시콜산에 의한 치료가 사용되어 왔다.
담석
담석을 생성하기 위한 담즙산과 담즙의 콜레스테롤 포화 및 콜레스테롤 침전과의 관계는 광범위하게 연구되어 왔다.담석은 콜레스테롤이나 빌리루빈의 포화도가 증가하거나 담즙이 정지하여 발생할 수 있다.담즙에 함유된 담즙산이나 인지질의 농도가 낮으면 콜레스테롤 용해성이 저하되고 미결정 형성이 발생합니다.콜레스테롤 담석을 [27][28][29]용해하기 위해 체노데옥시콜산 및/또는 우르소데옥시콜산을 사용한 경구 요법이 사용되어 왔다.치료를 중단하면 결석이 재발할 수 있습니다.담즙산 요법은 비만 수술 [30]후와 같은 특정 상황에서 결석을 예방하는 데 유용할 수 있습니다.
담즙산 설사
대장의 과도한 담즙산 농도는 만성 설사의 원인이다.크론병처럼 회장에 이상이 있거나 수술로 제거되거나 설사-소화성 과민성 대장 증후군(IBS-D)과 유사한 상태를 일으킬 때 흔히 볼 수 있다.이러한 담즙산 설사/담즙산 흡수 불량 상태는 SeHCAT 테스트로 진단할 수 있으며 담즙산 격리제로 [31]치료할 수 있습니다.
담즙산과 대장암
Bile은 대장 암의 발전의 어떤 중요할 수 있다.[32]Deoxycholic 산성(초산 데스 옥시 코티 코스 테론)인간의 결장의 내용에 고지방 다이어트에 대응하여 증가한다.[33]대장 암의 발생률이 높은 인구에, 담즙산의 배설물 농도와 이 협회에는 암의 발달에 역할을 할 수 있는 bile에 결장의 노출 증가를 제안하는 higher,[34][35] 있다.하나의 특정 비교해 볼 때, 원주민 아프리카인들에 남 아프리카 공화국의 배설물 초산 데스 옥시 코티 코스 테론 농도(는 저지방 식단을 먹는다)은 아프리카 미국인들(상급 지방의 식단을 먹는다)다 7시 30분 vs. 37.51nmol/g 습윤 중량 의자에 비유되어 진다.[36]원주민 아프리카인들은 남 아프리카에서 채 1의 대장 암의 낮은 발생률:100,000,[37]수컷 아프리카 미국인들은 72의 높은 발생률:10만으로 비유했다.[38]
실험적 연구들 또한 대장 암 담즙산에 대한 대책을 제안한다.결장 세포의 높은 초산 데스 옥시 코티 코스 테론 농도에 노출되면, 산화 스트레스를 야기시키고, 또한 DNA손상을 활성 산소의 형성을 증가시킨다.[39]쥐는 추가 유통 비용 분석합니다 고지방 다이어트의 직장 종양 형성을 참조하여 인간의 결장의 초산 데스 옥시 코티 코스 테론 수치를 모방함과, 평편과adenocarcinomas(암)등, 다이어트도 먹여 주고 쥐들과는 전혀 다른 조절식의 직장 유통 코스트 분석이 없는 수의 직장 neoplasia다 십분의 1수준을 생산하고 품어 주었어.[40][41]
우루소 데옥시콜산(UDCA)의 대장 암의 위험을 수식하는의 효과에 초등 sclerosing 담관염과 염증성 장질환 특히 다양한 결과 부분적으로 복용량과 관련된 여러 연구들을 조사해 왔다.[42][43]키 담즙 산 합성 효소 CYP7A1에 유전자 변이 큰 재판에서 UDCA의 대장 선종 예방에 효율성에 영향을 미쳤다.[44]
피부과
Bile은 피하 주사의 원치 않는 지방(Mesotherapy 보)을 제거하는 데 사용될 수 있다.한 injectable로Deoxycholic 산성 FDA승인 이하 지방을 용해시켜 받았다.[45]비록 많은 과목이 가벼운 불리한 반응을 보였다고 무엇보다 재판,,, 감각 마비, 홍반, 결단성을 가하여 약물 처치를 받은 지역 주변의 통증 부어 오른 것이 중요한 반응을 보였다.[46][47]
레퍼런스
- ^ a b c d e Hofmann AF, Hagey LR, Krasowski MD (February 2010). "Bile salts of vertebrates: structural variation and possible evolutionary significance". J. Lipid Res. 51 (2): 226–46. doi:10.1194/jlr.R000042. PMC 2803226. PMID 19638645.
- ^ a b c d e f g Russell DW (2003). "The enzymes, regulation, and genetics of bile acid synthesis". Annu. Rev. Biochem. 72: 137–74. doi:10.1146/annurev.biochem.72.121801.161712. PMID 12543708.
- ^ a b c d e f g h Chiang JY (October 2009). "Bile acids: regulation of synthesis". J. Lipid Res. 50 (10): 1955–66. doi:10.1194/jlr.R900010-JLR200. PMC 2739756. PMID 19346330.
- ^ a b Carey, MC.; Small, DM. (Oct 1972). "Micelle formation by bile salts. Physical-chemical and thermodynamic considerations". Arch Intern Med. 130 (4): 506–27. doi:10.1001/archinte.1972.03650040040005. PMID 4562149.
- ^ a b c d e Hofmann AF (1999). "The continuing importance of bile acids in liver and intestinal disease". Arch. Intern. Med. 159 (22): 2647–58. doi:10.1001/archinte.159.22.2647. PMID 10597755.
- ^ a b Hofmann AF, Borgström B (February 1964). "The intraluminal phase of fat digestion in man: the lipid content of the micellar and oil phases of intestinal content obtained during fat digestion and absorption". J. Clin. Invest. 43 (2): 247–57. doi:10.1172/JCI104909. PMC 289518. PMID 14162533.
- ^ a b c d Fiorucci S, Mencarelli A, Palladino G, Cipriani S (November 2009). "Bile-acid-activated receptors: targeting TGR5 and farnesoid-X-receptor in lipid and glucose disorders". Trends Pharmacol. Sci. 30 (11): 570–80. doi:10.1016/j.tips.2009.08.001. PMID 19758712.
- ^ '의료생화학요강, 리버맨, 마크스, 스미스, eds, p432, 2007'
- ^ a b c Hofmann AF (October 1963). "The function of bile salts in fat absorption. The solvent properties of dilute micellar solutions of conjugated bile salts". Biochem. J. 89: 57–68. doi:10.1042/bj0890057. PMC 1202272. PMID 14097367.
- ^ Li T, Chiang JY (2014). "Bile acid signaling in metabolic disease and drug therapy". Pharmacol. Rev. 66 (4): 948–83. doi:10.1124/pr.113.008201. PMC 4180336. PMID 25073467.
- ^ Nagahashi M, Takabe K, Liu R, Peng K, Wang X, Wang Y, Hait NC, Wang X, Allegood JC, Yamada A, Aoyagi T, Liang J, Pandak WM, Spiegel S, Hylemon PB, Zhou H (2015). "Conjugated bile acid-activated S1P receptor 2 is a key regulator of sphingosine kinase 2 and hepatic gene expression". Hepatology. 61 (4): 1216–26. doi:10.1002/hep.27592. PMC 4376566. PMID 25363242.
- ^ Wiemuth D, Sahin H, Falkenburger BH, Lefevre CM, Wasmuth HE, Grunder S (2012). "BASIC--a bile acid-sensitive ion channel highly expressed in bile ducts". FASEB J. 26 (10): 4122–30. doi:10.1096/fj.12-207043. PMID 22735174.
- ^ a b Magotti P, Bauer I, Igarashi M, Babagoli M, Marotta R, Piomelli D, Garau G (2015). "Structure of Human N-Acylphosphatidylethanolamine-Hydrolyzing Phospholipase D: Regulation of Fatty Acid Ethanolamide Biosynthesis by Bile Acids". Structure. 23 (3): 598–604. doi:10.1016/j.str.2014.12.018. PMC 4351732. PMID 25684574.
- ^ a b Margheritis, E, Castellani B, Magotti P, Peruzzi S, Romeo E, Natali F, Mostarda S, Gioiello A, Piomelli D, Garau G (2016). "Bile Acid Recognition by NAPE-PLD". ACS Chemical Biology. 11 (10): 2908–2914. doi:10.1021/acschembio.6b00624. PMC 5074845. PMID 27571266.
- ^ Kulkarni AV, Tevethia HV, Arab JP, Candia R, Premkumar M, Kumar P, Sharma M, Reddy DN, Padaki NR (May 2021). "Efficacy and safety of obeticholic acid in liver disease-A systematic review and meta-analysis". Clinics and Research in Hepatology and Gastroenterology. 45 (3): 101675. doi:10.1016/j.clinre.2021.101675. PMID 33722778.
- ^ Makishima M, Okamoto AY, Repa JJ, et al. (May 1999). "Identification of a nuclear receptor for bile acids". Science. 284 (5418): 1362–5. Bibcode:1999Sci...284.1362M. doi:10.1126/science.284.5418.1362. PMID 10334992.
- ^ Parks DJ, Blanchard SG, Bledsoe RK, et al. (May 1999). "Bile acids: natural ligands for an orphan nuclear receptor". Science. 284 (5418): 1365–8. Bibcode:1999Sci...284.1365P. doi:10.1126/science.284.5418.1365. PMID 10334993.
- ^ Wang H, Chen J, Hollister K, Sowers LC, Forman BM (May 1999). "Endogenous bile acids are ligands for the nuclear receptor FXR/BAR". Mol. Cell. 3 (5): 543–53. doi:10.1016/s1097-2765(00)80348-2. PMID 10360171.
- ^ a b Chiang JY, Ferrell JM (March 2020). "Bile acid receptors FXR and TGR5 signaling in fatty liver diseases and therapy". American Journal of Physiology. Gastrointestinal and Liver Physiology. 318 (3): G554–G573. doi:10.1152/ajpgi.00223.2019. PMC 7099488. PMID 31984784.
- ^ Kim, I; Ahn, SH; Inagaki, T; Choi, M; Ito, S; Guo, GL; Kliewer, SA; Gonzalez, FJ (2007). "Differential regulation of bile acid homeostasis by the farnesoid X receptor in liver and intestine". Journal of Lipid Research. 48 (12): 2664–72. doi:10.1194/jlr.M700330-JLR200. PMID 17720959.
- ^ Shapiro, Hagit; Kolodziejczyk, Aleksandra A.; Halstuch, Daniel; Elinav, Eran (2018-01-16). "Bile acids in glucose metabolism in health and disease". Journal of Experimental Medicine. 215 (2): 383–396. doi:10.1084/jem.20171965. ISSN 0022-1007. PMC 5789421. PMID 29339445.
- ^ Davidson MH (2011). "A systematic review of bile acid sequestrant therapy in children with familial hypercholesterolemia". J Clin Lipidol. 5 (2): 76–81. doi:10.1016/j.jacl.2011.01.005. PMID 21392720.
- ^ Allen L, Stobie D, Mauldin GN, Baer KE (January 1999). "Clinicopathologic features of dogs with hepatic microvascular dysplasia with and without portosystemic shunts: 42 cases (1991-1996)". J. Am. Vet. Med. Assoc. 214 (2): 218–20. PMID 9926012.
- ^ Pusl T, Beuers U (2007). "Intrahepatic cholestasis of pregnancy". Orphanet J Rare Dis. 2: 26. doi:10.1186/1750-1172-2-26. PMC 1891276. PMID 17535422.
- ^ Poupon RE, Balkau B, Eschwège E, Poupon R (May 1991). "A multicenter, controlled trial of ursodiol for the treatment of primary biliary cirrhosis. UDCA-PBC Study Group". N. Engl. J. Med. 324 (22): 1548–54. doi:10.1056/NEJM199105303242204. PMID 1674105.
- ^ Glantz A, Marschall HU, Lammert F, Mattsson LA (December 2005). "Intrahepatic cholestasis of pregnancy: a randomized controlled trial comparing dexamethasone and ursodeoxycholic acid". Hepatology. 42 (6): 1399–405. doi:10.1002/hep.20952. PMID 16317669.
- ^ Danzinger RG, Hofmann AF, Schoenfield LJ, Thistle JL (January 1972). "Dissolution of cholesterol gallstones by chenodeoxycholic acid". N. Engl. J. Med. 286 (1): 1–8. doi:10.1056/NEJM197201062860101. PMID 5006919.
- ^ Thistle JL, Hofmann AF (September 1973). "Efficacy and specificity of chenodeoxycholic acid therapy for dissolving gallstones". N. Engl. J. Med. 289 (13): 655–9. doi:10.1056/NEJM197309272891303. PMID 4580472.
- ^ Petroni ML, Jazrawi RP, Pazzi P, et al. (January 2001). "Ursodeoxycholic acid alone or with chenodeoxycholic acid for dissolution of cholesterol gallstones: a randomized multicentre trial. The British-Italian Gallstone Study group". Aliment. Pharmacol. Ther. 15 (1): 123–8. doi:10.1046/j.1365-2036.2001.00853.x. PMID 11136285.
- ^ Uy MC, Talingdan-Te MC, Espinosa WZ, Daez ML, Ong JP (December 2008). "Ursodeoxycholic acid in the prevention of gallstone formation after bariatric surgery: a meta-analysis". Obes Surg. 18 (12): 1532–8. doi:10.1007/s11695-008-9587-7. PMID 18574646. S2CID 207302960.
- ^ Pattni, S; Walters, JR (2009). "Recent advances in the understanding of bile acid malabsorption". British Medical Bulletin. 92: 79–93. doi:10.1093/bmb/ldp032. PMID 19900947.
- ^ Degirolamo C, Modica S, Palasciano G, Moschetta A (2011). "Bile acids and colon cancer: Solving the puzzle with nuclear receptors". Trends Mol Med. 17 (10): 564–72. doi:10.1016/j.molmed.2011.05.010. PMID 21724466.
- ^ Reddy BS, Hanson D, Mangat S, et al. (September 1980). "Effect of high-fat, high-beef diet and of mode of cooking of beef in the diet on fecal bacterial enzymes and fecal bile acids and neutral sterols". J. Nutr. 110 (9): 1880–7. doi:10.1093/jn/110.9.1880. PMID 7411244.
- ^ Hill MJ (May 1990). "Bile flow and colon cancer". Mutat. Res. 238 (3): 313–20. doi:10.1016/0165-1110(90)90023-5. PMID 2188127.
- ^ Cheah PY (1990). "Hypotheses for the etiology of colorectal cancer--an overview". Nutr Cancer. 14 (1): 5–13. doi:10.1080/01635589009514073. PMID 2195469.
- ^ Ou J, DeLany JP, Zhang M, Sharma S, O'Keefe SJ (2012). "Association between low colonic short-chain fatty acids and high bile acids in high colon cancer risk populations". Nutr Cancer. 64 (1): 34–40. doi:10.1080/01635581.2012.630164. PMC 6844083. PMID 22136517.
- ^ O'Keefe SJ, Kidd M, Espitalier-Noel G, Owira P (May 1999). "Rarity of colon cancer in Africans is associated with low animal product consumption, not fiber". Am. J. Gastroenterol. 94 (5): 1373–80. PMID 10235221.
- ^ 미국 암 학회암 사실과 그림 2009.http://www.cancer.org/Research/CancerFactsFigures/cancer-facts-figures-2009
- ^ Bernstein H, Bernstein C, Payne CM, Dvorak K (July 2009). "Bile acids as endogenous etiologic agents in gastrointestinal cancer". World J. Gastroenterol. 15 (27): 3329–40. doi:10.3748/wjg.15.3329. PMC 2712893. PMID 19610133.
- ^ Bernstein C, Holubec H, Bhattacharyya AK, et al. (August 2011). "Carcinogenicity of deoxycholate, a secondary bile acid". Arch. Toxicol. 85 (8): 863–71. doi:10.1007/s00204-011-0648-7. PMC 3149672. PMID 21267546.
- ^ Prasad AR, Prasad S, Nguyen H, Facista A, Lewis C, Zaitlin B, Bernstein H, Bernstein C (Jul 2014). "Novel diet-related mouse model of colon cancer parallels human colon cancer". World J Gastrointest Oncol. 6 (7): 225–43. doi:10.4251/wjgo.v6.i7.225. PMC 4092339. PMID 25024814.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Singh S, Khanna S, Pardi DS, Loftus EV, Talwalkar JA (2013). "Effect of ursodeoxycholic acid use on the risk of colorectal neoplasia in patients with primary sclerosing cholangitis and inflammatory bowel disease: a systematic review and meta-analysis". Inflamm. Bowel Dis. 19 (8): 1631–8. doi:10.1097/MIB.0b013e318286fa61. PMID 23665966. S2CID 39918727.
- ^ Eaton JE, Silveira MG, Pardi DS, Sinakos E, Kowdley KV, Luketic VA, Harrison ME, McCashland T, Befeler AS, Harnois D, Jorgensen R, Petz J, Lindor KD (2011). "High-dose ursodeoxycholic acid is associated with the development of colorectal neoplasia in patients with ulcerative colitis and primary sclerosing cholangitis". Am. J. Gastroenterol. 106 (9): 1638–45. doi:10.1038/ajg.2011.156. PMC 3168684. PMID 21556038.
- ^ Wertheim BC, Smith JW, Fang C, Alberts DS, Lance P, Thompson PA (2012). "Risk modification of colorectal adenoma by CYP7A1 polymorphisms and the role of bile acid metabolism in carcinogenesis". Cancer Prev Res (Phila). 5 (2): 197–204. doi:10.1158/1940-6207.CAPR-11-0320. PMC 3400261. PMID 22058145.
- ^ "Deoxycholic acid injection". Medline plus. Retrieved 26 August 2015.
- ^ Ascher B, Hoffmann K, Walker P, Lippert S, Wollina U, Havlickova B (2014). "Efficacy, patient-reported outcomes and safety profile of ATX-101 (deoxycholic acid), an injectable drug for the reduction of unwanted submental fat: results from a phase III, randomized, placebo-controlled study". J Eur Acad Dermatol Venereol. 28 (12): 1707–15. doi:10.1111/jdv.12377. PMC 4263247. PMID 24605812.
- ^ Wollina U, Goldman A (2015). "ATX-101 for reduction of submental fat". Expert Opin Pharmacother. 16 (5): 755–62. doi:10.1517/14656566.2015.1019465. PMID 25724831. S2CID 23094631.