노레티노드렐
Noretynodrel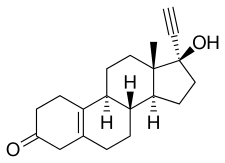 | |
 | |
| 임상 데이터 | |
|---|---|
| 상호 | Enovid(메스트라놀 포함), 기타 |
| 기타 이름 | 노레티노드렐, 노레티노드렐, 뉴욕주, SC-4642, NSC-15432, 5(10)-노레티스테론, 17α-에티닐-19-노르-5(10)-테스토스테론, 17α-에티닐-19-γ-19-노르티스테론5(10), 17α-에티노스테론 |
| 루트 행정부. | 입으로 |
| 약물 클래스 | 프로게스토겐, 프로게스틴, 에스트로겐 |
| ATC 코드 | |
| 약동학 데이터 | |
| 단백질 결합 | Noretynodrel: 알부민으로, 알부민으로, 알부민으로, 알부민으로, 또는 |
| 대사 | 간, 장(히드록실화, 이성질화, 결합)[1][3] |
| 대사물 | • 3α-히드록시노레티노드렐[2] • 3β-히드록시노레티노드렐[2] • 노레스티론[2][1][3] • 에티닐에스트라디올[3][4]·복합체[3] |
| 반감기 제거 | 초단시간(30분 [5]미만) |
| 배설물 | 모유 : [6]1% |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 첸블 | |
| CompTox 대시보드 (EPA ) | |
| ECHA 정보 카드 | 100.000.620 |
| 화학 및 물리 데이터 | |
| 공식 | C20H26O2 |
| 몰 질량 | 298.426 g/120−1 |
| 3D 모델(JSmol) | |
| |
| |
| (표준) | |
노레티노드렐, 즉 노레티노드렐은 Enovid라는 상표명으로 판매되고 있는 프로게스틴 약물로, 이전에는 피임약과 산부인과 질환 치료에 사용되었지만, 현재는 더 이상 [3][6][7][8]판매되지 않는다.그것은 단독으로도 사용할 수 있고 [7][8][9]에스트로겐과 함께 사용할 수 있었다.약은 [7]입으로 먹는다.
노르에티노드렐은 프로게스틴 또는 합성 프로게스토겐으로 프로게스테론과 [3]같은 프로게스테론의 생물학적 표적인 프로게스테론 수용체의 작용제이다.그것은 상대적으로 약한 프로게스토겐이다.[10]그 약은 에스트로겐 활성은 약하고 안드로겐 활성은 없거나 매우 약하며 다른 중요한 호르몬 [3][8][11][12]활성은 없습니다.노르에스티론 등 [3][13]체내 다양한 활성 대사물의 프로드러그입니다.
노르티노드렐은 1957년에 의료용으로 [8]도입되었다.산부인과 및 생리 [8]장애의 치료를 위해 메스트라놀과 조합하여 이번에 특별히 승인되었습니다.그 후 1960년에 이 제제는 피임약으로 [8][14]사용이 승인되었다.그것은 최초로 도입된 피임약이었고,[8][14][15] 얼마 지나지 않아 노르에스티스톤과 다른 프로게스틴이 함유된 피임약이 그 뒤를 이었다.노레티노드렐은 상대적으로 약한 프로게스토겐이라는 특성 때문에 더 이상 [10]약에 사용되지 않는다.그 때문에,[6][16] 그것은 더 이상 판매되지 않습니다.
의료 용도
Noretynodrel은 이전에 에스트로겐 메스트라놀과 함께 산부인과 및 월경 장애 치료에 사용되었으며 복합 [8][14]피임약으로 사용되었습니다.또한 하루에 [17]40~100mg의 높은 용량으로 자궁내막증 치료에도 사용되고 있다.그 약은 단종되었고 [10][16][18]더 이상 의학적으로 판매되거나 사용되지 않는다.
금지 사항
산모가 노르티노드렐로 [6]치료받은 모유 수유 영아에게서 어떠한 부작용도 관찰되지 않았다.이 때문에 미국 소아과학회는 노르티노드렐이 보통 모유 [6]수유와 양립할 수 있다고 생각해 왔다.
부작용
임신 [6][19][20]중 유산위협으로 어머니가 노르티노드렐 치료를 받은 여성 영아에게서 남성화의 징후가 보고된 사례가 있다.
과다 복용
상호 작용
약리학
약역학
노르에티노드렐은 약한 프로게스토겐 활성, 약한 에스트로겐 활성, 약한 안드로겐 활성이 없거나 매우 약한 안드로겐 [3]활성을 가지고 있다.프로드러그로 간주되며, 이러한 이유로 노르티노드렐의 대사물은 생물학적 활성에 [3]중요한 역할을 한다.이와 같이 노르에티노드렐의 약리역학은 그 [3]대사에 관계하지 않고서는 이해할 수 없다.
노르에티노드렐은 노르에티스테론,[2][21] 티볼론은 각각4 노르에티노드렐의 γ-이성체, 7α-메틸유도체이다.노르에스티스테론의 신진대사는 다르지만 티볼론과 매우 유사한 방식으로 대사된다.[2]노레티노드렐 및 티볼론은 모두 3α- 및 3β-히드록실화 대사물 및 γ-이성체4 대사물([2][21]노레티노드렐의 경우 이는 노레티스테론)로 변환되는 반면, 노레티스테론은 3α-4 또는 3β-히드록실화 대사물을 형성하지 않는다.노르에티노드렐의 주요 대사물은 각각 3α-히드록시노레트렐과 3β-히드록시스테로이드 탈수소효소(AKR1C1–4)에 의해 형성되는 3β-히드록시노레트렐이며, γ-이성질4 노르에스테로이드 탈수소효소([2]AKR1–4)에 의해 형성되는 미량 대사물이다.
티볼론은 3α- 및 3β-히드록실화 [2]및 γ-이성화4 대사물 모두의 프로드러그로 간주된다.노르에티노드렐은 또한 프로게스테론 수용체(PR)[2][5][13]에 대한 상대적 친화력이 매우 약하지만 극소량에서만 노르에스티론(Noretisterone)을 형성하는 것으로 보이기 때문에 프로드러그인 것으로 생각된다.
| 컴파운드 | 코드명 | PR | AR | ER | GR | MR | SHBG | CBG |
|---|---|---|---|---|---|---|---|---|
| 노레티노드렐 | – | 6 | 0 | 2 | 0 | 0 | 0 | 0 |
| 노르에스티스테론()δ4-NYD | – | 67–75 | 15 | 0 | 0–1 | 0–3 | 16 | 0 |
| 3α-히드록시노레틸 | – | ? | ? | ? | ? | ? | ? | ? |
| 3β-히드록시노레트렐 | – | ? | ? | ? | ? | ? | ? | ? |
| 에티닐에스트라디올 | – | 15–25 | 1–3 | 112 | 1–3 | 1 미만 | 0.18 | 0.1 미만 |
| 티볼론()7α-Me-NYD | ORG-OD-14 | 6 | 6 | 1 | ? | ? | ? | ? |
| δ-티볼론4 | ORG-OM-38 | 90 | 35 | 1 | 0 | 2 | 1 | 0 |
| 3α-히드록시티볼론 | ORG-4094 | 0 | 3 | 4–6 | 0 | ? | ? | ? |
| 3β-히드록시티볼론 | ORG-301260 | 0 | 4 | 3–29 | 0 | ? | ? | ? |
| 7α-메틸에티닐에스트라디올 | – | ? | ? | ? | ? | ? | ? | ? |
| 주의: 값은 백분율(%)입니다.참조 리간드(100%)는 의 경우 프로메게스톤, 의 경우 메트리볼론, 의 경우 알도스테론, 의 경우 코르티솔이었습니다. 출처:"템플릿"을 참조해 주세요. | ||||||||
| 컴파운드 | 유형a | PR | AR | ER | GR | MR | SHBG | CBG |
|---|---|---|---|---|---|---|---|---|
| 노르에스티스토론 | – | 67–75 | 15 | 0 | 0–1 | 0–3 | 16 | 0 |
| 5α-디히드로노레스티론 | 대사물 | 25 | 27 | 0 | 0 | ? | ? | ? |
| 3α,5α-테트라히드로노레스티론 | 대사물 | 1 | 0 | 0–1 | 0 | ? | ? | ? |
| 3α,5β-테트라히드로노레스티론 | 대사물 | ? | 0 | 0 | ? | ? | ? | ? |
| 3β,5α-테트라히드로노레스티론 | 대사물 | 1 | 0 | 0–8 | 0 | ? | ? | ? |
| 에티닐에스트라디올 | 대사물 | 15–25 | 1–3 | 112 | 1–3 | 0 | 0.18 | 0 |
| 아세트산노레티스테론 | 프로드러그 | 20 | 5 | 1 | 0 | 0 | ? | ? |
| 에난트산노레티스테론 | 프로드러그 | ? | ? | ? | ? | ? | ? | ? |
| 노레티노드렐 | 프로드러그 | 6 | 0 | 2 | 0 | 0 | 0 | 0 |
| 어원노디올 | 프로드러그 | 1 | 0 | 11–18 | 0 | ? | ? | ? |
| 어원디올디아세테이트 | 프로드러그 | 1 | 0 | 0 | 0 | 0 | ? | ? |
| 린에스트레놀 | 프로드러그 | 1 | 1 | 3 | 0 | 0 | ? | ? |
| 주의: 값은 백분율(%)입니다.참조 리간드(100%)는 의 경우 프로메게스톤, 의 경우 메트리볼론, 의 경우 에스트라디올, 의 경우 덱사메타손, 의 경우 알도스테론, 의 경우 디히드로테스토스테론, 의 경우 코르티솔이었다. 각주: = 활성/비활성 대사물, 프로드러그 또는 노르에스테론은 모두 해당되지 않았다.출처:"템플릿"을 참조해 주세요. | ||||||||
프로게스토겐 활성
노르에티노드렐은 상대적으로 약한 프로게스토겐으로 노르에스티스테론의 [10]프로게스토겐 활성의 약 10분의 1에 불과하다.노르에티노드렐의 배란 억제 용량은 4.0mg/일이며, 노르에티스테론의 [1]경우 0.4mg/일이다.반대로 노르에티노드렐의 자궁내막변환량은 사이클당 150mg이며,[1] 노르에티스테론은 사이클당 120mg이다.PR에 있어서 노르테노드렐은 PR에A 대한 노르테스테론 친화력의 약 6~19%밖에 가지지 않지만, PR에B 대한 두 약물의 친화력은 유사하다(노레테노드렐은 [21]PR에B 대한 노르테론 친화력의 94%를 차지한다).티볼론의 티볼론 및 γ-이성체4 대사물은 각각 노르에티노드렐 및 노르에스티론으로서 PR에 대한 친화력이 유사하지만 티볼론의 3α- 및 3β-히드록실화 대사물은 PR에 [21]대한 친화력이 사실상 결여되어 있다.때문에 구조적으로 관련androgen/anabolic 스테로이드 trestolone(7α-methyl-19-nortestosterone)강력한 progestogen,[22]은 7α-methyl 대체progestogenic 활동을 방해하지 않는다면서, 3α-과3β-hydroxynoretynodrel 가능성이 홍보를 위해 친화력의 마찬가지로 3α-과3β-hydroxylated metaboli에 결여되어 있는 것으로 알려졌다.tes티볼론의.[21]
안드로겐 활성
노레티노드렐은 안드로겐 활성이 없거나 [8][11][12]매우 약한 것으로 알려져 있다.이는 경미하지만 유의미한 [8][3]안드로겐성을 보이는 노르에스티론과는 대조적이다.노르에스티스테론에 비해 노르에티노드렐은 안드로겐 수용체(AR)[21]에 대해 45~81% 낮은 친화력을 가진다.이에 따라 자궁내막증이 있는 여성의 치료에서 장기간(9-12개월) 동안(예: 60mg/일) 많은 용량으로 사용되었을 때에도 노르에노드렐과 함께 안드로겐 효과(예: 다모증,[23] 음핵확대 또는 음성변화)가 관찰되지 않았다.또한 에티스테론, 노르에스티스테론 및 노르에스티론 아세테이트를 포함한 [24]다른 테스토스테론 유래 프로게스틴과 달리 노르에티노드렐은 여성 태아를 남성화하는 것으로 발견되지 않았다.그러나, 노르티노드렐에 [20]의한 것으로 생각되는 의사 헤르마프로디즘(미화 생식기)의 사례가 적어도 1건 관찰되고 있다.티볼론의 γ-이성체4 대사물은 노르에스티론 및 노르에티노드렐에 비해 AR에 대한 친화력이 극적으로 증가(노레티스테론보다 5.7~18.5배 높음)하여 티볼론의 7α-메틸기가 안드로겐 활성을 현저하게 증가시키고 더 크고 더 큰 산소와 관련이 있음을 나타낸다.노르티노드렐과 [21]관련된 티볼론의 외측부위.
에스트로겐 활성
노레티노드렐은 대부분의 프로게스틴과 달리 어원디올 디아세테이트와 비슷하게 에스트로겐 [11]활성을 가지고 있다.다른 19-노르테스토스테론 프로게스틴에 비해 노르테노드렐은 훨씬 더 강한 에스트로겐 [5]활성을 가진 것으로 알려져 있다.동물의 에스트로겐성에 대한 Allen-Doisy 테스트에서,[3] Noretynodrel은 Noretisterone보다 100배 더 많은 에스트로겐 활성을 가지고 있는 것으로 보고되었습니다.노레티스테론은 에스트로겐 수용체(ERs)에 대한 친화력이 사실상 없는 반면, 노레티노드렐은 ERα와 ERβ 모두에 대해 매우 약하지만 일부 친화력을 보인다(상대 결합 친화력 측면에서 각각 [21][25]에스트라디올의 0.7%, 0.22%).3α- 및 3β-히드록시노레티노드렐의 에스트로겐 활성은 [2]평가되지 않았다.단, 티볼론은 노레티노드렐과 유사한 ER 친화력을 보이는 반면 티볼론의 3α- 및 3β-히드록실화 대사물은 ER에 [2][21]대해 몇 배 높은 친화력을 가진다.이와 같이 노르에티노드렐의 3α- 및 3β-히드록실화 대사물도 에스트로겐 활성 증가를 보일 수 있으며,[2][21] 이는 노르에티노드렐의 알려진 에스트로겐 효과를 설명할 수 있다.
티볼론의 γ-이성체는4 노르에스티론처럼 ER에 [21]대한 친화력이 사실상 결여되어 있다.티볼론 및 그 대사물 모두 방향족화되지 않은 반면, 트레스톨론은 테스토스테론 및 19-노르테스토스테론과 유사하게 방향족화되기 쉬우며, 이러한 이유로 노르에티노드렐 또는 그 대사물도 [26]노르에스티스테론 이외의 방향족화되지 않을 가능성이 높다.따라서 방향족화는 티볼론이나 노르티노드렐의 [26]에스트로겐 활성에 관여하지 않을 수 있다.그러나, 이 문제에 대한 논란이 존재하며, 다른 연구자들은 티볼론과 노르티노드렐이 소량 매우 강력한 에스트로겐(각각 [27][28]에티닐에스트라디올과 그 7α-메틸 유도체)으로 방향족화될 수 있다고 제안했다.
약동학
노르에티노드렐은 경구 투여 시 빠르게 흡수되고 빠르게 대사되어 30분 [29][5]이내에 혈액에서 사라집니다.혈장단백질결합에 있어서 노르에노드렐은 알부민과 결합하고 있으며, 성호르몬결합글로불린 또는 코르티코스테로이드결합글로불린에 [1]대하여 친화력을 보이지 않는다.그러나 [3]노르에스티론 같은 대사물의 혈장 단백질 결합은 다를 수 있다.
noretynodrel의 순환의 주요 대사 물질 있3α-hydroxynoretynodrel(3α-HSD에 의해 형성된)고 더 작은 한도로 3β-hydroxynoretynodrel(3β-HSD에 의해 형성된), 그리고 noretynodrel의 더 사소한 대사 물질이 노르에 티스 테론(δ5-4-isomerase에 의해 형성된)과 가능한(방향화 효소나 혹은 가능하면 다른 시토 크롬 P450 효소에 의해 형성되 ethinylestradiol.개최일 m오녹시게나아제).[3][2][4][29]노르에티노드렐은 매우 짧은 제거 반감기와 수용체 결합 측정에서 스테로이드 호르몬 수용체에 대한 친화력이 낮기 때문에 경구 [1][3][5][13]투여 후 장과 간에서 활성 대사물로 빠르게 변환되는 프로드러그로 간주된다.몇몇 연구자들은 그것이 특히 노르에스티론의 [1][3][13]프로드러그라고 말했다.그러나 다른 연구원들에 따르면, 연구 부족으로 인해,[13] 이것이 현재 사실이라는 것을 명백하게 입증하기에는 자료가 불충분하다고 한다.
노르티노드렐의 경구 투여량의 약 1%가 [6]모유에서 검출된다.
화학
17α-에티닐-γ-19-노르테스토스테론5(10) 또는 17α-에티닐스트르-5(10)-en-17β-ol-3-one이라고도 하는 노르에티노드렐은 합성 에스트란 스테로이드로 [18][31]테스토스테론의 유도체이다.특히 C17α 위치에서 에틸화, C19 위치에서 탈메틸화, C5 및 C10 [18][31]위치 사이에서 탈수소(즉, 이중 결합을 가지고 있음)된 테스토스테론의 유도체이다.이와 같이 노르테노드렐은 난드로론(19-노르테스토스테론)과 에스티스테론(17α-에티닐테스토스테론)[18][31]의 조합 유도체이다.또한 C4 이중결합이 C5와 C10 위치 [18][31]사이의 이중결합으로 치환된 노르에스티스테론(17α-에티닐-19-노르테스토스테론) 이성질체이다.이 때문에 노르테노드렐은 5(10)-[18][31]노레티스테론으로도 알려져 있다.다른 19-노르테스토스테론 프로게스틴은 노레티노드렐의 C5(10) 이중결합을 공유하는 경우는 거의 없지만, 티볼론, 노레티노드렐의 [18][31]C7α메틸유도체(즉 7α-메틸노레티노드렐) 및 노레티노드렐의 C17비닐유도체인 노르게스테론을 포함한다.
합성
노레티노드렐의 화학적 합성물이 발표되었다.[31][30]
역사
노르티노드렐은 프랭크 B에 의해 처음 합성되었다. 1952년 G.D. Searle & Company의 Colton, 그리고 이것은 루이스 E에 의한 노르에스티론 합성이 선행되었다. 1951년 [8]Syntex의 Miramontes와 Carl Jerassi.1957년, 노르티노드렐과 노르에스티스테론은 메스트라놀과 함께 미국에서 생리장애 치료에 [15]대해 승인되었다.1960년 노르티노드렐은 메스트라놀(Enovid)과 함께 미국에서 첫 경구피임약으로 소개되었고, 1963년 노르티스테론과 메스트라놀의 조합이 두 번째 [15]경구피임약으로 소개되었다.1988년, 에노비드는 에스트로겐을 많이 함유한 다른 경구 피임약과 함께 사용이 [32][33]중단되었다.
Noretynodrel은 1961년 자궁내막증 치료에서 처음 연구되었으며 이 [17]질환의 치료를 위해 조사된 최초의 프로게스틴이었다.
사회와 문화
일반명
Noretynodrel은 약의 약인 반면 Noretynodrel은 약과 입니다.[6][16][18][31]개발 코드명 SC-4642로도 [6][16][18][31]알려져 있다.
브랜드명
Noretynodrel은 Enidrel, Orgametril 및 Previson이라는 브랜드명으로 단독으로 판매되고 있으며, Conovid, Enavid, Enavid, Enovid, Norolen [9]및 Singestol이라는 브랜드명으로 메스트라놀과 조합하여 판매되고 있습니다.
유용성
Noretynodrel은 미국에서 더 이상 어떤 제조물에서도 판매되지 않으며 다른 국가에서도 [16][18]여전히 판매되고 있는 것으로 보이지 않습니다.[34]
「 」를 참조해 주세요.
레퍼런스
- ^ a b c d e f g h Kuhl H (September 1990). "Pharmacokinetics of oestrogens and progestogens". Maturitas. 12 (3): 171–97. doi:10.1016/0378-5122(90)90003-O. PMID 2170822.
- ^ a b c d e f g h i j k l m Jin Y, Duan L, Chen M, Penning TM, Kloosterboer HJ (2012). "Metabolism of the synthetic progestogen norethynodrel by human ketosteroid reductases of the aldo-keto reductase superfamily". J. Steroid Biochem. Mol. Biol. 129 (3–5): 139–44. doi:10.1016/j.jsbmb.2011.12.002. PMC 3303946. PMID 22210085.
- ^ a b c d e f g h i j k l m n o p q Kuhl H (2005). "Pharmacology of estrogens and progestogens: influence of different routes of administration" (PDF). Climacteric. 8 Suppl 1: 3–63. doi:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ a b Kuhl H (2011). "Pharmacology of Progestogens" (PDF). J Reproduktionsmed Endokrinol. 8 (1): 157–177.
- ^ a b c d e Hammerstein J (1990). "Prodrugs: advantage or disadvantage?". Am. J. Obstet. Gynecol. 163 (6 Pt 2): 2198–203. doi:10.1016/0002-9378(90)90561-K. PMID 2256526.
- ^ a b c d e f g h i Sweetman, Sean C., ed. (2009). "Sex hormones and their modulators". Martindale: The Complete Drug Reference (36th ed.). London: Pharmaceutical Press. pp. 2120–2121. ISBN 978-0-85369-840-1.
- ^ a b c Jucker (21 December 2013). Progress in Drug Research / Fortschritte der Arzneimittelforschung / Progrès des recherches pharmaceutiques. Birkhäuser. pp. 85–88. ISBN 978-3-0348-7065-8.
- ^ a b c d e f g h i j k Lara Marks (2010). Sexual Chemistry: A History of the Contraceptive Pill. Yale University Press. pp. 74–75. ISBN 978-0-300-16791-7.
- ^ a b IARC Working Group on the Evaluation of the Carcinogenic Risk of Chemicals to Man (1974). IARC Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Man: Sex Hormones (PDF). World Health Organization. p. 88,191. ISBN 9789283212065.
- ^ a b c d David A. Williams; William O. Foye; Thomas L. Lemke (January 2002). Foye's Principles of Medicinal Chemistry. Lippincott Williams & Wilkins. pp. 700–. ISBN 978-0-683-30737-5.
- ^ a b c Benno Clemens Runnebaum; Thomas Rabe; Ludwig Kiesel (6 December 2012). Female Contraception: Update and Trends. Springer Science & Business Media. pp. 36–. ISBN 978-3-642-73790-9.
- ^ a b Ethel Sloane (2002). Biology of Women. Cengage Learning. pp. 426–. ISBN 978-0-7668-1142-3.
- ^ a b c d e Stanczyk, Frank Z. (Sep 2002). "Pharmacokinetics and Potency of Progestins used for Hormone Replacement Therapy and Contraception". Reviews in Endocrine and Metabolic Disorders. 3 (3): 211–224. doi:10.1023/A:1020072325818. ISSN 1389-9155. PMID 12215716. S2CID 27018468.
Although there is no convincing evidence for the in vivo transformation of norethynodrel to norethindrone, data from receptor-binding tests and bioassays suggest that norethynodrel is also a prodrug.
- ^ a b c Mannfred A. Hollinger (19 October 2007). Introduction to Pharmacology, Third Edition. CRC Press. pp. 160–. ISBN 978-1-4200-4742-4.
- ^ a b c Enrique Ravina (11 January 2011). The Evolution of Drug Discovery: From Traditional Medicines to Modern Drugs. John Wiley & Sons. pp. 190–. ISBN 978-3-527-32669-3.
- ^ a b c d e https://www.drugs.com/international/noretynodrel.html
- ^ a b Eric J. Thomas; J. Rock (6 December 2012). Modern Approaches to Endometriosis. Springer Science & Business Media. pp. 223–. ISBN 978-94-011-3864-2.
- ^ a b c d e f g h i j Index Nominum 2000: International Drug Directory. Taylor & Francis. January 2000. pp. 1–. ISBN 978-3-88763-075-1.
- ^ WILKINS L (March 1960). "Masculinization of female fetus due to use of orally given progestins". Problems of Birth Defects. J Am Med Assoc. Vol. 172. pp. 1028–32. doi:10.1007/978-94-011-6621-8_31. ISBN 978-94-011-6623-2. PMID 13844748.
- ^ a b Korn GW (1961). "The use of norethynodrel (enovid) in clinical practice". Can Med Assoc J. 84: 584–7. PMC 1939348. PMID 13753182.
Pseudohermaphroditism should not be a problem in these patients as it appears that norethynodrel does not possess androgenic properties, but it is believed that Wilkins has now found one such case in a patient who has been on norethynodrel therapy.
- ^ a b c d e f g h i j k de Gooyer ME, Deckers GH, Schoonen WG, Verheul HA, Kloosterboer HJ (2003). "Receptor profiling and endocrine interactions of tibolone". Steroids. 68 (1): 21–30. doi:10.1016/s0039-128x(02)00112-5. PMID 12475720. S2CID 40426061.
- ^ Beri, Ripla; Kumar, Narender; Savage, T.; Benalcazar, L.; Sundaram, Kalyan (1998). "Estrogenic and progestational activity of 7α-methyl-19-nortestosterone, a synthetic androgen". The Journal of Steroid Biochemistry and Molecular Biology. 67 (3): 275–283. doi:10.1016/S0960-0760(98)00114-9. ISSN 0960-0760. PMID 9879986. S2CID 21302338.
- ^ Kistner RW (1964). "Steroid compounds with progestational activity". Postgrad Med. 35 (3): 225–32. doi:10.1080/00325481.1964.11695038. PMID 14129897.
This difference is important clinically since no androgenic effects (hirsutism, enlarged clitoris, voice change) have been reported even with large dosages of norethynodrel (60 mg. daily) continued from 9 to 12 months in patients with endometriosis.
- ^ Simpson, Joe Leigh; Kaufman, Raymond H. (1998). "Fetal effects of estrogens, progestogens and diethylstilbestrol". In Fraser, Ian S. (ed.). Estrogens and Progestogens in Clinical Practice (3rd ed.). London: Churchill Livingstone. pp. 533–53. ISBN 978-0-443-04706-0.
- ^ Kuiper GG, Carlsson B, Grandien K, Enmark E, Häggblad J, Nilsson S, Gustafsson JA (1997). "Comparison of the ligand binding specificity and transcript tissue distribution of estrogen receptors alpha and beta". Endocrinology. 138 (3): 863–70. doi:10.1210/endo.138.3.4979. PMID 9048584.
- ^ a b de Gooyer, Marcel E.; Oppers-Tiemissen, Hendrika M.; Leysen, Dirk; Verheul, Herman A.M.; Kloosterboer, Helenius J. (2003). "Tibolone is not converted by human aromatase to 7α-methyl-17α-ethynylestradiol (7α-MEE)". Steroids. 68 (3): 235–243. doi:10.1016/S0039-128X(02)00184-8. ISSN 0039-128X. PMID 12628686. S2CID 29486350.
- ^ Kuhl, H.; Wiegratz, I. (2009). "Can 19-nortestosterone derivatives be aromatized in the liver of adult humans? Are there clinical implications?". Climacteric. 10 (4): 344–353. doi:10.1080/13697130701380434. ISSN 1369-7137. PMID 17653961. S2CID 20759583.
- ^ Kloosterboer, H. J. (2009). "Tibolone is not aromatized in postmenopausal women". Climacteric. 11 (2): 175–176. doi:10.1080/13697130701752087. ISSN 1369-7137. PMID 18365860. S2CID 37940652.
- ^ a b G. Seyffart (6 December 2012). Drug Dosage in Renal Insufficiency. Springer Science & Business Media. pp. 423–. ISBN 978-94-011-3804-8.
- ^ a b Die Gestagene. Springer-Verlag. 27 November 2013. pp. 15, 285. ISBN 978-3-642-99941-3.
- ^ a b c d e f g h i J. Elks (14 November 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. pp. 886–. ISBN 978-1-4757-2085-3.
- ^ Reuters News Service (1988-04-15). "Searle, 2 others to stop making high-estrogen pill". St. Louis Post-Dispatch. pp. 7D. Retrieved 2009-08-29.
- ^ "High-estrogen 'pill' going off market". San Jose Mercury News. 1988-04-15. Retrieved 2009-08-29.
- ^ "Drugs@FDA: FDA Approved Drug Products". United States Food and Drug Administration. Retrieved 27 November 2016.


