성적 동기 및 호르몬
Sexual motivation and hormones성적 동기는 테스토스테론, 에스트로겐, 프로게스테론, 옥시토신, 바소프레신 등의 호르몬에 의해 영향을 받는다. 대부분의 포유류 종에서 성호르몬은 성행위를 하는 능력과 동기를 조절한다.
성적 동기 측정
성적 동기는 다양한 기법을 사용하여 측정할 수 있다. 성욕 목록과 같은 자기 보고 조치는 일반적으로 인간의 성적 동기 수준을 감지하는 데 사용된다. 가짜 파이프라인과 같은 자기 보고 기법은 개인이 사회적으로 바람직한 결과를 나타내기 위해 자신의 답변을 조작하지 않도록 하는 데 사용될 수 있다. 성적 동기 또한 자위행위를 포함한 성행위의 빈도를 통해 암묵적으로 조사할 수 있다.
호르몬
테스토스테론
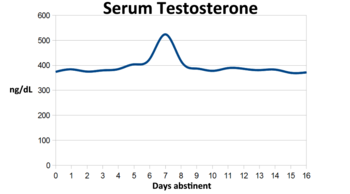
테스토스테론은 인간을 포함한 수컷 영장류에서 성적 동기 부여에 주요한 요인으로 보인다. 성인기에 테스토스테론이 제거되면서 수컷과 수컷 영장류 모두에서 성적 동기부여가 감소하는 것으로 나타났다.[1] GnRH 길항제 표시로 고환기능을 억제한 남성들은 시술 후 2주가 지나면 성욕과 자위행위가 감소한다.[2] 수컷 붉은털원숭이의 연구는 성적인 동기를 증가시키기 위한 테스토스테론 기능을 제안하며, 따라서 수컷들이 성적인 파트너에 접근하기 위해 경쟁하도록 동기를 부여한다. 수컷 붉은털원숭이에게 테스토스테론의 동기부여 효과는 성공적인 성 경쟁을 촉진하고 특히 낮은 등급의 수컷들에게 중요한 동기부여 도구가 될 수 있다고 가정한다.[2] 영장류에서 테스토스테론의 제거는 교미 능력을 감소시키는 것이 아니라 교미 동기를 감소시킨다는 점에 유의해야 한다.
남성의 테스토스테론 수치는 여성의 배란 상태에 따라 달라지는 것으로 나타났다. 배란 여성의 향기에 노출된 남성은 비배란 여성의 향기에 노출된 남성보다 테스토스테론 수치가 높았다.[3] 여성 배란 신호에 노출되면 테스토스테론이 증가할 수 있으며, 이는 다시 남성들의 성행위에 대한 동기부여를 증가시키고 성행동을 시작하게 할 수 있다. 궁극적으로, 이러한 높은 수준의 테스토스테론은 여성의 배란 단서에 노출된 수컷의 생식 성공을 증가시킬 수 있다.
테스토스테론과 여성의 성적 동기 사이의 관계는 다소 모호하다. 연구에 따르면 테스토스테론과 같은 안드로겐은 여성들에게 성적 동기를 유발하기에 그 자체로는 충분하지 않다고 한다. 특히, 붉은색 마카크를 사용한 연구는 테스토스테론이 여성의 성적 동기 수준의 변화와 유의하게 관련이 없다는 것을 관찰했다.[2] 그러나 인간이 아닌 영장류를 대상으로 한 일부 연구는 여성의 성행위에 안드로겐의 역할을 시사하고 있다. 부신절제된 암컷 붉은털원숭이는 여성의 성적 수용성이 저하되는 것을 보였다.[4] 이후 연구들은 이러한 성적 수용성의 감소는 에스트로겐으로 전환될 수 있는 안드로겐의 제거에 특정된다는 것을 밝혀냈다.[5]
테스토스테론의 수준은 자신이 관여하는 관계의 유형과 관련이 있다는 제안도 있다. 다원적 관계에 관계된 남성들은 단일 파트너 관계나 독신 관계에 관계된 남성들보다 더 높은 수준의 테스토스테론을 보인다.[6] 다원성 여성은 독신 여성이나 독신 여성보다 테스토스테론 수치가 높고 성욕 측정값도 높은 것으로 나타났다.[6]
에스트로겐과 프로게스테론
에스트로겐과 프로게스테론은 호르몬과 여성의 성적 동기 사이의 관계가 잘 이해되지는 않지만, 일반적으로 포유류 종의 여성들에게 성적 행동을 하도록 동기를 조절한다. 특히 에스트로겐은 여성의 성적 동기부여가 증가하는 것과 긍정적인 상관관계가 있는 것으로 나타났으며, 프로게스테론은 여성의 성적 동기부여가 감소하는 것과 관련이 있다.[7][8] 여성 생리 주기의 순환 기간은 여성의 수용성 및 성적 동기 증가와 관련이 있는 경우가 많다.[8] 주기의 이 단계에서 에스트로겐은 암컷에서 상승하고 프로게스테론 수치는 낮다. 이때 짝짓기는 여성 임신을 유발할 가능성이 높다.
월경 주기의 다른 단계에 있는 여성들은 성적 매력에 있어서 차이를 보이는 것으로 나타났다. 배란 중인 피임약을 사용하지 않는 이성애 여성(에스트로겐 수치가 높음)은 변동성 비대칭성이 낮은 남성의 향기를 선호한다.[9] 이성애자를 배란하는 여성들도 남성적인 얼굴에 대한 선호를 보이며 현재 파트너 말고도 남성들에게 더 큰 성적 매력을 보고한다.[10] 진화론적 관점에서 볼 때, 여성의 비옥한 기간 동안 에스트로겐의 증가는 선호 유전자를 가진 남성에게 성적 동기를 유발할 수 있다(좋은 유전자 가설).
자연적이거나 외과적으로 유발된 폐경 이후, 많은 여성들은 성적 동기부여가 감소하는 것을 경험한다.[11] 폐경기는 안드로겐의 꾸준한 감소율뿐만 아니라 에스트로겐의 급격한 감소와 관련이 있다.[12] 에스트로겐과 안드로겐 수준의 감소는 비록 직접적인 관계가 잘 이해되지는 않지만 폐경 후 여성의 성욕과 동기부여의 낮은 수준을 설명한다고 여겨진다.
옥시토신과 바소프레신
옥시토신과 바소프레신 호르몬은 남성과 여성의 성적 동기부여를 조절하는데 관여한다. 옥시토신은 오르가즘에 분비되며 성적 쾌락과 정서적 유대관계 형성과 모두 연관된다.[13] 성적 동기부여의 쾌락 모델에 근거해 옥시토신 방출에 따른 성적인 쾌락 증가가 향후 성행위에 대한 동기부여를 촉진할 수 있다. 정서적 친밀감은 특히 여성의 성적 동기에 대한 강력한 예측 변수가 될 수 있으며, 불충분한 옥시토신 방출은 결과적으로 여성의 성적 흥분과 동기를 감소시킬 수 있다.
높은 수준의 바소프레신은 여성에 대한 성적 동기 저하를 초래할 수 있다.[13] 여성에게서 바소프레신 방출과 공격성 사이의 연관성이 관찰되었는데, 이는 성적인 파트너에 대한 무시와 적개심으로 이어져 여성의 성적 흥분과 성적 동기를 손상시킬 수 있다.[14] 남성에서는 바소프레신이 각성기에 관여한다. 바소프레신 수치는 남성의 성적 흥분 상태에서 발기 반응 시 증가하며, 사정 후 다시 기준치까지 감소하는 것으로 나타났다.[15] 발기 반응 중 바소프레신의 증가는 성적 행동에 관여하려는 동기 증가와 직접적인 관련이 있을 수 있다.[13]
비기후종
성적 동기의 호르몬 영향은 비기후 여성들에게 훨씬 더 명확하게 이해된다. 암컷 쥐의 시상하부의 뇌전핵에서 에스트로겐 수용체를 억제하는 것이 암컷의 수용성과 수용성을 감소시키는 것으로 관찰되었다.[16] 암컷 쥐의 수용성과 수용성은 성적 동기를 나타내는 지표로서, 따라서 에스트로겐 수치와 성적 동기 사이의 직접적인 관계를 나타낸다. 게다가 에스트로겐과 프로게스테론 투여를 받는 암컷 쥐들은 수컷 쥐로부터 성적 관심을 얻기 위해 더 많은 노력을 기울일 가능성이 있었다.[17] 암컷 쥐가 수컷 쥐에게 접근하려는 의지는 암컷의 성적 동기 수준을 직접적으로 보여주는 척도로 여겨졌다.
이제 막 새끼를 낳은 암컷 쥐에게서 바소프레신의 증가가 관찰되었다. 바소프레신은 공격적이고 적대적인 행동과 관련이 있으며, 여성의 성적 동기를 감소시키는 것으로 가정된다. 암컷 쥐의 뇌에 투여된 바소프레신은 성적인 동기가 즉시 감소하는 것으로 관찰되었다.[13]
성적 지향
호르몬이 성적인 동기에 미치는 영향에 대한 연구는 거의 이루어지지 않았다. 한 연구는 레즈비언과 양성 여성의 성적 동기 부여와 순환 에스트로겐 농도의 시대적 변화 사이의 관계를 관찰했다.[18] 그들의 비옥한 주기의 에스트로겐 피크에 있었던 레즈비언 여성들은 여성들과의 성적 접촉에 대한 성적 동기부여가 증가했다고 보고한 반면, 양성 여성들은 에스트로겐 수치가 피크일 때 동성 동기의 성적 접촉이 약간 증가했을 뿐이라고 보고했다.[citation needed]
레즈비언과 양성애자 모두 최고 에스트로겐 수준에서 다른 성별 성접촉에 대한 성적 동기부여가 감소하는 것을 보였으며, 양성애자 집단은 레즈비언 집단보다 더 큰 변화를 보였다.[citation needed]
임상연구
남자들
- 테스토스테론은 남성의 성욕, 기능, 흥분 등에 매우 중요하다.[19][20] 테스토 스테론의 에스트로겐 에스트라디올로 Aromatization 부분적으로 테스토 스테론 남성들은 성적 욕구와 기능에 대한 효과를 초래하는 것으로 보인다.[21][22][23]5α-Reduction 테스토 스테론의 더 강력한 남성 호르몬 다이 하이드로 테스토 스테론(다이 하이드로 테스토 스테론)에 테스토 스테론 남성들은 성적 욕구와 기능에 대한 효과에 작은 기여할 수도 있다.[24] 동물 연구에 따르면, 신경스테로이드와 약한 에스트로겐 3α-안드로스타네디올과 3β-안드로스타네디올을 포함한 DHT의 대사물은 남성의 성기능에 관여할 수 있다.[25][26][27]
- 남성은 300ng/dL 이하의 테스토스테론 수준에서 성기능 장애를 경험하고, 약 200ng/dL의 테스토스테론 수준을 가진 남성은 이러한 문제를 자주 경험한다.[28] 테스토스테론 생성의 완전한 상실로 인해 외과적 또는 의학적 거세와 함께 테스토스테론 수치가 거세 범위(평균 95% 감소, 15ng/dL) 내에 도달하게 되면 남성에게 심각한 성기능장애가 발생한다.[29][30] 테스토스테론 생성의 현저한 억제력을 결합하여 테스토스테론 수치가 거세/여성의 범위 바로 위(평균 70~80% 감소, 100ng/dL 감소)가 되고, 높은 도스량 시프로테론 아세테이트 단요법으로 표시된 안드로겐 수용체 길항작용은 남성에게 심오한 성적 장애를 일으킨다.[29][31] 테스토스테론 수치를 회복하기 위해 테스토스테론의 여러 투여량(약 200~900ng/dL 범위)을 투여한 남성을 치료한 결과, 테스토스테론은 용량 의존적으로 성욕과 남성의 발기 기능을 회복한 것으로 나타났다.[32] 테스토스테론과 에스트라디올 수치를 보존하는 비칼루타미드나 엔잘루타미드 등 안드로겐 수용체 길항제인 고선량 단효법은 안드로겐 수용체의 강력한 봉쇄에도 불구하고 남성의 성욕과 발기 기능에 미치는 부정적 영향이 미미하다.[29][33][34][35]
- 에스트라디올 보충제는 수술이나 의학적 거세가 있는 남성들에게 더 큰 성욕을 유지시킨다.[23] 테스토스테론 수치가 거세 범위(95% 감소, 50ng/dL 미만으로) 내에 있도록 테스토스테론 생성을 현저하게 또는 완전하게 억제하는 고선량 에스트로겐 요법은 성욕과 기능 저하를 초래한다.[23][36][37] 그러나 성기능과 성행위는 외과적 거세보다는 고선량 에스트로겐 요법으로 현저하게 좋아 보인다.[21][22][23] 아로마타아제 억제제 아나스트로졸이 있든 없든 테스토스테론 수치를 회복하기 위해 의학적인 거세와 추가 테스토스테론을 투여한 남성을 치료한 결과 테스토스테론이 에스트라디올로 전환되는 것을 방지하는 것이 남성의 성욕 회복과 발기부전을 부분적으로 막았다는 것을 알 수 있었다.[32] 그러나 아로마타제 억제제 테스토락톤을 사용한 유사한 설계를 가진 다른 연구에서는 그렇지 않았다.[22] 아로마타아제 결핍증과 에스트로겐 불감증후군, 그리고 따라서 에스트로겐 결핍증을 가진 남성은 정상적인 성욕, 기능, 활동을 하는 것으로 보인다.[22][21] 그러나 아로마타아제 결핍증을 가진 일부 남성에게서 에스트라디올 보충제가 성욕과 활동을 증가시켰지만 아로마타아제 결핍증을 가진 다른 남성들에게는 그렇지 않았다.[22][21][38] 항에스트로겐 선택성 에스트로겐 수용체 조절기(SERM) 타목시펜을 이용한 치료가 남성 유방암으로 치료받은 남성의 성욕을 감소시키는 것으로 나타났다.[39] 그러나 타목시펜, 클로미펜, 랄록시펜, 토레미펜 등 SERM으로 치료된 남성에게서 성기능이 감소했다는 사실은 다른 연구에서 발견되거나 보고되지 않았다.[22][40]
- 테스토스테론의 DHT로의 전환을 막는 5α-감소효소 억제제는 성기능장애의 위험이 약간 높아지며, 성기능장애 발생률은 약 3~16%[41][42][24]이다. 5α-감소효소 억제제 두타스테라이드가 있든 없든 테스토스테론 에난산염을 다량 투여한 건강한 남성을 치료한 결과, 두타스테라이드가 성욕과 기능의 변화에 유의미한 영향을 미치지 않는 것으로 나타났다.[43][24] 5α-감소효소 억제제 두타스테리드를 사용하거나 사용하지 않고 고용량 바이칼루타미드 요법으로 남성을 치료한 결과, 두타스테라이드가 성기능에 유의미한 영향을 미치지 않는 것으로 나타났다.[44] 고선량 바이칼루타미드 요법과 두타스테리드를 결합한 결과 고선량 바이칼루타미드 단요법과 유사하게 의료적 거세보다 성기능장애가 덜 나타났다.[45]
- DHT 수치가 약 10배 증가하고 테스토스테론과 에스트라디올 수치가 완전히 억제된 매우 높은 DHT(아로마타할 수 없는 안드로겐)를 가진 남성을 치료한 결과, 성기능의 척도가 경미하지만 현저하게 변화된 것은 하나도 없는 것으로 나타났다.esire.[40][46][24] 아로마타할 수 있는 테스토스테론 언카노이트와 아로마타할 수 없는 맥콜레스테롤을 가진 저포고나달 남성들의 치료는 테스토스테론 언카노이트가 맥콜레스테롤보다 기분, 성욕, 발기, 사정 등에서 더 좋은 개선을 만들어 낸다는 것을 보여주었다.[21][40] 그러나, 맥콜레스테롤의 복용량은 차선책이 될 수 있었다.[40]
여성들.
- 에스트라디올은 여성에게서 성욕에 가장 중요한 호르몬인 것 같다.[47][28][48] 에스트라디올의 과민 수치는 여성의 성욕을 증가시킨다.[47] 동물 연구에 따르면 프로게스테론은 여성의 성기능에도 관여할 수 있다.[49][50][51] 매우 제한적인 임상 연구는 프로게스테론이 성욕을 증가시키지 않고 그것을 감소시킬 수 있다는 것을 시사한다.[52] 테스토스테론의 생리적 수준이 여성의 성욕에 중요하다는 개념에 대한 지지는 거의 없지만, 테스토스테론의 수프라피질학적 수준은 남성의 높은 수준과 유사하게 여성의 성욕을 증가시킬 수 있다.[47][28]
- 정상적인 생리적 범위 내의 총 테스토스테론 수치와 폐경 전 여성의 성욕 사이에는 거의 또는 전혀 상관관계가 없다.[28] 다낭성 난소증후군(PCOS)이 있는 여성은 테스토스테론 수치가 높음에도 성욕이 증가하지 않는다.[28] PCOS를 가지고 있는 여성들은 실제로 그들의 상태를 치료한 후에 성적 욕구가 개선되는 것을 경험하는데, 이는 심리적인 기능의 향상으로 인한 것일 가능성이 높다(예: 신체 이미지).[28]
- 완전히 비기능적인 안드로겐 수용체임에도 불구하고 영향을 받지 않는 여성에 비해 완전한 안드로겐 불감증후군(CAIS)을 가진 여성에게서 성욕은 줄어들지 않는다.[28] 대부분의 여성들이 복합 피임약을 복용하는 경우 성욕은 증가하거나 변하지 않는다.[28][53][54] 이 사실은 거의 모든 결합된 피임 약, 그리고ethinylestradiol 현재의 피임 약의 대표적인 양 2에 의해 4-fold고 결과적으로 40에서 80%까지 테스토 스테론 수치를 낮추는 성 호르몬 결합 글로불린(SHBG)정도가 높아지는 강력하게 간 친화성의 에스트로겐 ethinylestradiol을 함유하고 있었음에도 불구하고 있다.[55] 그러나 여성 내 성기능에 대한 복합출산제 효과에 대해서는 일부 상반된 보도가 나오고 있다.[56] 디포 메드록시프로게스테론 아세테이트나 이토노게스트렐 산아제한 임플란트와 같은 프로게스테겐 전용 산아제한은 성욕과 기능에 복합적인 효과를 보였다.[52][57] 플루타미드나 비칼루타미드 같은 안드로겐 수용체 길항제는 여성들에게 성욕 감소를 거의 유발하지 않는다.[58][59][60]
- 테스토스테론의 생리적 수준(< 50 ng/dL)을 초래하는 테스토스테론의 저용량은 여성의 성욕을 증가시키지 않는다.[47][28] 테스토스테론의 과다섭취학적 수준(>50ng/dL)을 초래하는 테스토스테론의 높은 투여량은 여성의 성욕을 현저하게 증가시키며, 테스토스테론의 수치는 80~150ng/dL의 "약간"으로 성욕을 증가시킨다.[47][28] 테스토스테론의 복용량이 더 많으면 여성의 성욕에 더 큰 영향을 미칠 수 있다.[47][28] 테스토스테론의 높은 투여량(50ng/dL 이하)은 여성의 장기요법으로 남성화(예: 여드름, 머리카락 성장, 목소리 변화)의 위험이 있다.[47][28] 테스토스테론은 많이 복용하지만 테스토스테론은 적게 복용하지 않으면 에스트로겐이 성욕에 미치는 영향을 강화한다.[47][28] 에스트로겐, 프로게스틴, 안드로겐이 결합된 티볼론은 폐경 후 여성의 에스트로겐-프로게스겐 표준 치료법보다 성욕을 더 크게 증가시킬 수 있다.[61][62][63][64]
트랜스젠더 개인
- 테스토스테론 요법은 트랜스젠더 남성에게 성욕과 흥분을 증가시킨다.[65][66] 에스트라디올과 항안드로겐 요법은 트랜스젠더 여성의 성욕과 흥분을 감소시킨다.[65] 그러나 외과적 거세를 겪은 트랜스젠더 여성에게서 에스트라디올을 이용한 치료는 외과적 거세에만 기대했던 것보다 훨씬 더 큰 성욕과 활동을 유지하는 것으로 보인다.[21][22][23]
참고 항목
참조
- ^ Wallen K (2001). "Sex and context: hormones and primate sexual motivation". Hormones and Behavior. 40 (2): 339–357. CiteSeerX 10.1.1.22.5968. doi:10.1006/hbeh.2001.1696. PMID 11534996. S2CID 2214664.
- ^ a b c Wallen K (2001). "Sex and context: hormones and primate sexual motivation". Hormones and Behavior. 40 (2): 339–57. CiteSeerX 10.1.1.22.5968. doi:10.1006/hbeh.2001.1696. PMID 11534996. S2CID 2214664.
- ^ Miller S. L.; Maner J. K. (2009). "Scent of a woman: Men's testosterone responses to olfactory ovulation cues". Psychological Science. 21 (2): 276–283. doi:10.1177/0956797609357733. PMID 20424057. S2CID 18170407.
- ^ Johnson D. F.; Phoenix C. H. (1976). "Hormonal control of female sexual attractiveness, proceptivity, and receptivity in rhesus monkeys". Journal of Comparative and Physiological Psychology. 90 (5): 473–483. doi:10.1037/h0077216. PMID 977822.
- ^ Veney S. L.; Rissman E. F. (2000). "Steroid implants in the medial preoptic area or ventromedial nucleus of the hypothalamus activate female sexual behaviour in the musk shrew". Journal of Neuroendocrinology. 12 (11): 1124–1132. doi:10.1046/j.1365-2826.2000.00567.x. PMID 11069128. S2CID 21548908.
- ^ a b Van Anders S. M.; Hamilton L. D.; Watson N. V. (2007). "Multiple partners are associated with higher testosterone in North American men and women" (PDF). Hormones and Behavior. 51 (3): 454–459. doi:10.1016/j.yhbeh.2007.01.002. hdl:2027.42/83914. PMID 17316638. S2CID 10492318.
- ^ Jones BC, Hahn AC, Fisher CI, Wang H, Kandrik M, DeBruine LM (February 2018). "General sexual desire, but not desire for uncommitted sexual relationships, tracks changes in women's hormonal status" (PDF). Psychoneuroendocrinology. 88: 153–157. doi:10.1016/j.psyneuen.2017.12.015. PMID 29287282. S2CID 10545604.
- ^ a b Ziegler T. E. (2007). "Female sexual motivation during non-fertile periods: a primate phenomenon". Hormones and Behavior. 51 (1): 1–2. doi:10.1016/j.yhbeh.2006.09.002. PMID 17069815. S2CID 37260925.
- ^ Gangestad S. W.; Thornhill R. (1998). "Menstrual cycle variation in women's preferences for the scent of symmetrical men". Proceedings of the Royal Society of London. 265 (1399): 927–933. doi:10.1098/rspb.1998.0380. PMC 1689051. PMID 9633114.
- ^ Gangestad S. W.; Thornhill R.; Garver-Apgar C. E. (2005). "Adaptations to ovulation implications for sexual and social behaviour". Current Directions in Psychological Science. 14 (6): 312–316. doi:10.1111/j.0963-7214.2005.00388.x. S2CID 53074076.
- ^ Giles (2008). "Sex hormones and sexual desire". Journal for the Theory of Social Behaviour. 38 (1): 45–66. doi:10.1111/j.1468-5914.2008.00356.x.
- ^ Jones A, et al. (2010). "Nonsteroidal selective androgen receptor modulators enhance female sexual motivation". The Journal of Pharmacology and Experimental Therapeutics. 334 (2): 439–448. doi:10.1124/jpet.110.168880. PMC 2913771. PMID 20444881.
- ^ a b c d 힐러, J. (2005) 성적 동기부여의 성별 차이. 남성 건강 및 성별 저널 2(3), 339-345.
- ^ Keverne E. B.; Curley J. P. (2004). "Vasopressin, oxytocin and social behaviour". Neurobiology. 14 (6): 777–783. doi:10.1016/j.conb.2004.10.006. PMID 15582383. S2CID 2106719.
- ^ Carter C. S. (1992). "Oxytocin and sexual behaviour". Neuroscience & Biobehavioral Reviews. 16 (2): 131–144. doi:10.1016/s0149-7634(05)80176-9. PMID 1630727. S2CID 36207185.
- ^ Spiteri T, et al. (2010). "Estrogen-induced sexual incentive motivation, proceptivity and receptivity depend on a functional estrogen receptor [alpha] in the ventromedial nucleus of the hypothalamus but not in the amygdala". Neuroendocrinology. 91 (2): 142–154. doi:10.1159/000255766. PMC 2918652. PMID 19887773.
- ^ Cummings J. A.; Becker J. B. (2012). "Quantitative assessment of female sexual motivation in the rat: Hormonal control of motivation". Journal of Neuroscience Methods. 204 (2): 227–233. doi:10.1016/j.jneumeth.2011.11.017. PMC 3273575. PMID 22120688.
- ^ Diamond L. M.; Wallen K. (2011). "Sexual minority women's sexual motivation around the time of ovulation". Archives of Sexual Behavior. 40 (2): 237–246. doi:10.1007/s10508-010-9631-2. PMID 20464467. S2CID 13989776.
- ^ Podlasek CA, Mulhall J, Davies K, Wingard CJ, Hannan JL, Bivalacqua TJ, Musicki B, Khera M, González-Cadavid NF, Burnett AL (August 2016). "Translational Perspective on the Role of Testosterone in Sexual Function and Dysfunction". J Sex Med. 13 (8): 1183–98. doi:10.1016/j.jsxm.2016.06.004. PMC 5333763. PMID 27436075.
- ^ Rastrelli G, Corona G, Maggi M (June 2018). "Testosterone and sexual function in men". Maturitas. 112: 46–52. doi:10.1016/j.maturitas.2018.04.004. PMID 29704917. S2CID 14012244.
- ^ a b c d e f Wibowo E, Schellhammer P, Wassersug RJ (January 2011). "Role of estrogen in normal male function: clinical implications for patients with prostate cancer on androgen deprivation therapy". J. Urol. 185 (1): 17–23. doi:10.1016/j.juro.2010.08.094. PMID 21074215.
- ^ a b c d e f g Kacker R, Traish AM, Morgentaler A (June 2012). "Estrogens in men: clinical implications for sexual function and the treatment of testosterone deficiency". J Sex Med. 9 (6): 1681–96. doi:10.1111/j.1743-6109.2012.02726.x. PMID 22512993.
- ^ a b c d e Wibowo E, Wassersug RJ (September 2013). "The effect of estrogen on the sexual interest of castrated males: Implications to prostate cancer patients on androgen-deprivation therapy". Crit. Rev. Oncol. Hematol. 87 (3): 224–38. doi:10.1016/j.critrevonc.2013.01.006. PMID 23484454.
- ^ a b c d Swerdloff RS, Dudley RE, Page ST, Wang C, Salameh WA (June 2017). "Dihydrotestosterone: Biochemistry, Physiology, and Clinical Implications of Elevated Blood Levels". Endocr. Rev. 38 (3): 220–254. doi:10.1210/er.2016-1067. PMC 6459338. PMID 28472278.
- ^ Morali G, Oropeza MV, Lemus AE, Perez-Palacios G (September 1994). "Mechanisms regulating male sexual behavior in the rat: role of 3 alpha- and 3 beta-androstanediols". Biol. Reprod. 51 (3): 562–71. doi:10.1095/biolreprod51.3.562. PMID 7803627.
- ^ Foradori CD, Weiser MJ, Handa RJ (May 2008). "Non-genomic actions of androgens". Front Neuroendocrinol. 29 (2): 169–81. doi:10.1016/j.yfrne.2007.10.005. PMC 2386261. PMID 18093638.
- ^ Kohtz AS, Frye CA (2012). "Dissociating behavioral, autonomic, and neuroendocrine effects of androgen steroids in animal models". Psychiatric Disorders. Methods in Molecular Biology. Vol. 829. pp. 397–431. doi:10.1007/978-1-61779-458-2_26. ISBN 978-1-61779-457-5. PMID 22231829.
- ^ a b c d e f g h i j k l m Reed BG, Bou Nemer L, Carr BR (2016). "Has testosterone passed the test in premenopausal women with low libido? A systematic review". Int J Women's Health. 8: 599–607. doi:10.2147/IJWH.S116212. PMC 5066846. PMID 27785108.
- ^ a b c Iversen P, Melezinek I, Schmidt A (January 2001). "Nonsteroidal antiandrogens: a therapeutic option for patients with advanced prostate cancer who wish to retain sexual interest and function". BJU Int. 87 (1): 47–56. doi:10.1046/j.1464-410x.2001.00988.x. PMID 11121992. S2CID 28215804.
- ^ Turner D, Briken P (January 2018). "Treatment of Paraphilic Disorders in Sexual Offenders or Men With a Risk of Sexual Offending With Luteinizing Hormone-Releasing Hormone Agonists: An Updated Systematic Review". J Sex Med. 15 (1): 77–93. doi:10.1016/j.jsxm.2017.11.013. PMID 29289377.
- ^ Neumann F, Kalmus J (1991). "Cyproterone acetate in the treatment of sexual disorders: pharmacological base and clinical experience". Exp. Clin. Endocrinol. 98 (2): 71–80. doi:10.1055/s-0029-1211103. PMID 1838080.
- ^ a b Finkelstein JS, Lee H, Burnett-Bowie SA, Pallais JC, Yu EW, Borges LF, Jones BF, Barry CV, Wulczyn KE, Thomas BJ, Leder BZ (September 2013). "Gonadal steroids and body composition, strength, and sexual function in men". N. Engl. J. Med. 369 (11): 1011–22. doi:10.1056/NEJMoa1206168. PMC 4142768. PMID 24024838.
- ^ Anderson J (March 2003). "The role of antiandrogen monotherapy in the treatment of prostate cancer". BJU Int. 91 (5): 455–61. doi:10.1046/j.1464-410X.2003.04026.x. PMID 12603397. S2CID 8639102.
- ^ Wellington K, Keam SJ (2006). "Bicalutamide 150mg: a review of its use in the treatment of locally advanced prostate cancer". Drugs. 66 (6): 837–50. doi:10.2165/00003495-200666060-00007. PMID 16706554. S2CID 46966712.
- ^ Tombal B, Borre M, Rathenborg P, Werbrouck P, Van Poppel H, Heidenreich A, Iversen P, Braeckman J, Heracek J, Baskin-Bey E, Ouatas T, Perabo F, Phung D, Hirmand M, Smith MR (May 2014). "Enzalutamide monotherapy in hormone-naive prostate cancer: primary analysis of an open-label, single-arm, phase 2 study". Lancet Oncol. 15 (6): 592–600. doi:10.1016/S1470-2045(14)70129-9. PMID 24739897.
- ^ Thibaut F, De La Barra F, Gordon H, Cosyns P, Bradford JM (2010). "The World Federation of Societies of Biological Psychiatry (WFSBP) guidelines for the biological treatment of paraphilias". World J. Biol. Psychiatry. 11 (4): 604–55. doi:10.3109/15622971003671628. PMID 20459370. S2CID 14949511.
- ^ Brogden RN, Clissold SP (August 1989). "Flutamide. A preliminary review of its pharmacodynamic and pharmacokinetic properties, and therapeutic efficacy in advanced prostatic cancer". Drugs. 38 (2): 185–203. doi:10.2165/00003495-198938020-00003. PMID 2670515.
A favourable feature of flutamide therapy has been its lesser effect on libido and sexual potency; fewer than 20% of patients treated with flutamide alone reported such changes. In contrast, nearly all patients treated with oestrogens or estramustine phosphate reported loss of sexual potency. [...] In comparative therapeutic trials, loss of potency has occurred in all patients treated with stilboestrol or estramustine phosphate compared with 0 to 20% of those given flutamide alone (Johansson et al. 1987; Lund & Rasmussen 1988).
- ^ Simpson ER, Jones ME (2006). "Of mice and men: the many guises of estrogens". Tissue-Specific Estrogen Action. Ernst Schering Found Symp Proc. Ernst Schering Foundation Symposium Proceedings. Vol. 2006/1. pp. 45–67. doi:10.1007/2789_2006_016. ISBN 978-3-540-49547-5. PMID 17824171.
- ^ Motofei IG, Rowland DL, Popa F, Kreienkamp D, Paunica S (July 2011). "Preliminary study with bicalutamide in heterosexual and homosexual patients with prostate cancer: a possible implication of androgens in male homosexual arousal". BJU Int. 108 (1): 110–5. doi:10.1111/j.1464-410X.2010.09764.x. PMID 20955264. S2CID 45482984.
- ^ a b c d Idan A, Griffiths KA, Harwood DT, Seibel MJ, Turner L, Conway AJ, Handelsman DJ (November 2010). "Long-term effects of dihydrotestosterone treatment on prostate growth in healthy, middle-aged men without prostate disease: a randomized, placebo-controlled trial". Ann. Intern. Med. 153 (10): 621–32. doi:10.7326/0003-4819-153-10-201011160-00004. PMID 21079217. S2CID 29435946.
- ^ Hirshburg JM, Kelsey PA, Therrien CA, Gavino AC, Reichenberg JS (2016). "Adverse Effects and Safety of 5-alpha Reductase Inhibitors (Finasteride, Dutasteride): A Systematic Review". J Clin Aesthet Dermatol. 9 (7): 56–62. PMC 5023004. PMID 27672412.
- ^ Gur S, Kadowitz PJ, Hellstrom WJ (January 2013). "Effects of 5-alpha reductase inhibitors on erectile function, sexual desire and ejaculation". Expert Opin Drug Saf. 12 (1): 81–90. doi:10.1517/14740338.2013.742885. PMID 23173718. S2CID 11624116.
- ^ Bhasin S, Travison TG, Storer TW, Lakshman K, Kaushik M, Mazer NA, Ngyuen AH, Davda MN, Jara H, Aakil A, Anderson S, Knapp PE, Hanka S, Mohammed N, Daou P, Miciek R, Ulloor J, Zhang A, Brooks B, Orwoll K, Hede-Brierley L, Eder R, Elmi A, Bhasin G, Collins L, Singh R, Basaria S (March 2012). "Effect of testosterone supplementation with and without a dual 5α-reductase inhibitor on fat-free mass in men with suppressed testosterone production: a randomized controlled trial". JAMA. 307 (9): 931–9. doi:10.1001/jama.2012.227. PMC 6035750. PMID 22396515.
- ^ Dijkstra S, Witjes WP, Roos EP, Vijverberg PL, Geboers AD, Bruins JL, Smits GA, Vergunst H, Mulders PF (2016). "The AVOCAT study: Bicalutamide monotherapy versus combined bicalutamide plus dutasteride therapy for patients with locally advanced or metastatic carcinoma of the prostate-a long-term follow-up comparison and quality of life analysis". SpringerPlus. 5: 653. doi:10.1186/s40064-016-2280-8. PMC 4870485. PMID 27330919.
- ^ Gaudet M, Vigneault É, Foster W, Meyer F, Martin AG (January 2016). "Randomized non-inferiority trial of Bicalutamide and Dutasteride versus LHRH agonists for prostate volume reduction prior to I-125 permanent implant brachytherapy for prostate cancer". Radiother Oncol. 118 (1): 141–7. doi:10.1016/j.radonc.2015.11.022. PMID 26702991.
Dutasteride and Bicalutamide is a regimen of non-inferior efficacy to LHRH agonist based regimens for prostate volume reduction prior to permanent implant prostate brachytherapy. D + B has less sexual toxicity compared to LHRH agonists prior to implant and for the first 6 months after implant. D + B is therefore an option to be considered for prostate volume reduction prior to PIPB.
- ^ Sartorius GA, Ly LP, Handelsman DJ (October 2014). "Male sexual function can be maintained without aromatization: randomized placebo-controlled trial of dihydrotestosterone (DHT) in healthy, older men for 24 months". J Sex Med. 11 (10): 2562–70. doi:10.1111/jsm.12550. PMID 24751323.
- ^ a b c d e f g h Cappelletti M, Wallen K (February 2016). "Increasing women's sexual desire: The comparative effectiveness of estrogens and androgens". Horm Behav. 78: 178–93. doi:10.1016/j.yhbeh.2015.11.003. PMC 4720522. PMID 26589379.
- ^ Stone L (November 2017). "Sexual medicine: Transdermal oestrogen is effective". Nat Rev Urol. 14 (11): 638. doi:10.1038/nrurol.2017.152. PMID 28895561. S2CID 7140458.
- ^ Schumacher M, Guennoun R, Ghoumari A, Massaad C, Robert F, El-Etr M, Akwa Y, Rajkowski K, Baulieu EE (June 2007). "Novel perspectives for progesterone in hormone replacement therapy, with special reference to the nervous system". Endocr. Rev. 28 (4): 387–439. doi:10.1210/er.2006-0050. PMID 17431228.
- ^ Brinton RD, Thompson RF, Foy MR, Baudry M, Wang J, Finch CE, Morgan TE, Pike CJ, Mack WJ, Stanczyk FZ, Nilsen J (May 2008). "Progesterone receptors: form and function in brain". Front Neuroendocrinol. 29 (2): 313–39. doi:10.1016/j.yfrne.2008.02.001. PMC 2398769. PMID 18374402.
- ^ Santoro N, Worsley R, Miller KK, Parish SJ, Davis SR (March 2016). "Role of Estrogens and Estrogen-Like Compounds in Female Sexual Function and Dysfunction". J Sex Med. 13 (3): 305–16. doi:10.1016/j.jsxm.2015.11.015. PMID 26944462.
- ^ a b Worsley R, Santoro N, Miller KK, Parish SJ, Davis SR (March 2016). "Hormones and Female Sexual Dysfunction: Beyond Estrogens and Androgens--Findings from the Fourth International Consultation on Sexual Medicine". J Sex Med. 13 (3): 283–90. doi:10.1016/j.jsxm.2015.12.014. PMID 26944460.
- ^ Pastor Z, Holla K, Chmel R (February 2013). "The influence of combined oral contraceptives on female sexual desire: a systematic review". Eur J Contracept Reprod Health Care. 18 (1): 27–43. doi:10.3109/13625187.2012.728643. PMID 23320933. S2CID 34748865.
- ^ Burrows LJ, Basha M, Goldstein AT (September 2012). "The effects of hormonal contraceptives on female sexuality: a review". J Sex Med. 9 (9): 2213–23. doi:10.1111/j.1743-6109.2012.02848.x. PMID 22788250.
- ^ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans; World Health Organization; International Agency for Research on Cancer (2007). Combined Estrogen-progestogen Contraceptives and Combined Estrogen-progestogen Menopausal Therapy. World Health Organization. pp. 157, 433–. ISBN 978-92-832-1291-1.
- ^ Casey PM, MacLaughlin KL, Faubion SS (March 2017). "Impact of Contraception on Female Sexual Function". J Womens Health (Larchmt). 26 (3): 207–213. doi:10.1089/jwh.2015.5703. PMID 27622561.
- ^ Shah MB, Hoffstetter S (August 2010). "Contraception and sexuality". Minerva Ginecol. 62 (4): 331–47. PMID 20827250.
- ^ Moretti C, Guccione L, Di Giacinto P, Simonelli I, Exacoustos C, Toscano V, Motta C, De Leo V, Petraglia F, Lenzi A (March 2018). "Combined Oral Contraception and Bicalutamide in Polycystic Ovary Syndrome and Severe Hirsutism: A Double-Blind Randomized Controlled Trial". J. Clin. Endocrinol. Metab. 103 (3): 824–838. doi:10.1210/jc.2017-01186. PMID 29211888.
- ^ Paradisi R, Fabbri R, Porcu E, Battaglia C, Seracchioli R, Venturoli S (October 2011). "Retrospective, observational study on the effects and tolerability of flutamide in a large population of patients with acne and seborrhea over a 15-year period". Gynecol. Endocrinol. 27 (10): 823–9. doi:10.3109/09513590.2010.526664. PMID 21117864. S2CID 20250916.
Among the slight and temporary adverse events [of flutamide], most frequently reported and not requesting treatment discontinuation were headache (7.8%), respiratory tract disorders (7.0%), nausea and/or vomiting (4.0%), diarrhea (4.0%), dry skin (9.5%), and reduction of libido (4.5%).
- ^ Venturoli S, Paradisi R, Bagnoli A, Colombo FM, Ravaioli B, Vianello F, Mancini F, Gualerzi B, Porcu E, Seracchioli R (2001). "Low-dose flutamide (125 mg/day) as maintenance therapy in the treatment of hirsutism". Horm. Res. 56 (1–2): 25–31. doi:10.1159/000048086. PMID 11815724. S2CID 46782286.
[...] changes in serum levels of the aminotransferases [11] or side effects (stomach pain, headache, dry skin, nausea, increased appetite, decrease of libido) are only occasionally seen [with flutamide] [10, 11].
- ^ Ross LA, Alder EM (February 1995). "Tibolone and climacteric symptoms". Maturitas. 21 (2): 127–36. doi:10.1016/0378-5122(94)00888-E. PMID 7752950.
- ^ Albertazzi P, Di Micco R, Zanardi E (November 1998). "Tibolone: a review". Maturitas. 30 (3): 295–305. doi:10.1016/S0378-5122(98)00059-0. PMID 9881330.
- ^ Davis SR (2002). "The effects of tibolone on mood and libido". Menopause. 9 (3): 162–70. doi:10.1097/00042192-200205000-00004. PMID 11973439. S2CID 11724490.
- ^ Garefalakis M, Hickey M (2008). "Role of androgens, progestins and tibolone in the treatment of menopausal symptoms: a review of the clinical evidence". Clin Interv Aging. 3 (1): 1–8. doi:10.2147/CIA.S1043. PMC 2544356. PMID 18488873.
- ^ a b Hembree WC, Cohen-Kettenis PT, Gooren L, Hannema SE, Meyer WJ, Murad MH, Rosenthal SM, Safer JD, Tangpricha V, T'Sjoen GG (November 2017). "Endocrine Treatment of Gender-Dysphoric/Gender-Incongruent Persons: An Endocrine Society Clinical Practice Guideline". J. Clin. Endocrinol. Metab. 102 (11): 3869–3903. doi:10.1210/jc.2017-01658. PMID 28945902.
- ^ Irwig MS (April 2017). "Testosterone therapy for transgender men". Lancet Diabetes Endocrinol. 5 (4): 301–311. doi:10.1016/S2213-8587(16)00036-X. PMID 27084565.