헥소바르비탈
Hexobarbital | |
 | |
| 임상 데이터 | |
|---|---|
| 상호 | 헥소바르비탈, 헥소바르비톤, 메틸헥사비탈, 메톡세닐, 에비팔 |
| ATC 코드 | |
| 법적 상태 | |
| 법적 상태 | |
| 약동학 데이터 | |
| 단백질 결합 | 25% |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 첸블 | |
| CompTox 대시보드 (EPA ) | |
| ECHA 정보 카드 | 100.000.241 |
| 화학 및 물리 데이터 | |
| 공식 | C12H16N2O3 |
| 몰 질량 | 236.271 g/120−1 |
| 3D 모델(JSmol) | |
| 키라리티 | 라세미 혼합물 |
| 밀도 | 1.1623 g/cm3 |
| 녹는점 | 146.5°C(295.7°F) |
| 비등점 | 378.73°C(713.71°F) |
| 물에 녹는 정도 | 0.435mg/mL(20°C) |
| |
| |
| (표준) | |
헥소바르비탈 또는 헥소바르비톤은 시토판, 에비판, 토비날 등 산염과 나트륨염 형태로 판매되며 최면 및 진정 효과가 있는 바르비투르산 유도체이다.1940년대와 1950년대에 수술용 마취유도제, 일반용 단시간 최면제 등으로 사용되었으며, 효과 발생이 비교적 빠르고 동작 [1]지속 시간이 짧다.라벤스브뤼크 강제수용소에서 [2]여성 죄수들을 살해하는데도 사용되었죠현대의 바르비투르산염(티오펜탈 등)은 마취 [3]깊이를 더 잘 제어할 수 있도록 하기 때문에 마취제로 헥소바르비탈을 대체했다.헥소바르비탈은 여전히 몇몇 과학 [4]연구에 사용되고 있다.
역사
바르비투르산염의 화학적 등급은 20세기 [5]초에 바르비탈이 도입된 이후로 알려진 가장 오래된 진정제 중 하나이다.동유럽에서는 [5]헥소바르비탈(및 다른 바르비투르산염)이 자살을 시도하는 임산부들에 의해 마약으로 정기적으로 사용되어 왔다.헥소바르비탈은 오랫동안 잠재적으로 기형적이고 체세포독성 효과가 있는 것으로 생각되었다.FDA는 이들을 임신 범주 D 또는 [6]C로 분류했다.그러나 일부 연구에 따르면 헥소바르비탈을 섭취하면 선천성 이상을 [5]일으킬 수 있다.
제2차 세계대전 중 헤르타 오버호이저는 나치 의사이자 유죄 판결을 받은 전범으로 헥소바르비탈의 영향을 조사했다.실험은 대부분 라벤스브뤼크 강제수용소의 여성 죄수들을 대상으로 이루어졌다.
연구에서의 응용
헥소바르비탈은 헥소바르비탈 수면 테스트(HST)에서 마취제로 사용됩니다.HST는 마이크로솜 산화의 강도가 높거나 낮은 설치류, 매우 빠른(FM) 또는 느린(SM)을 식별하는데, 예를 들어 수면 테스트는 PTSD에[7] 대한 민감성과 저항성을 예측하거나 독성 화합물이 수면 [8][9]시간에 미치는 영향을 결정하기 위해 사용된다.
합성
헥소바르비탈은 메틸(시클로헥센-1-일)시아노아세테이트와 구아니딘 및 메틸산나트륨을 반응시킴으로써 합성할 수 있다.이어서 [10]황산디메틸로 메틸화할 수 있는 헥소바르비탈나트륨 전구체를 형성한다.
헥소바르비탈 합성의 또 다른 경로는 메틸시클로헥세닐시아노아세트산에스테르와 N-메틸우레아를 [11]반응시키는 것이다.이 반응은 두 단계로 이루어지며, 첫 번째 단계에서는 20-50°C에서 Tert-Butylate에 Tert-Butylate를 첨가한다.제2단계에서는 에탄올과 물을 용매로 첨가한다.
반응성
시토크롬 P450 동질효소 중 하나는 유전자 CYP2B1에 의해 코드화되어 있으며, 여기서 헥소바르비탈은 기질이다.헥소바르비탈과 이소자임은 히드록실화 반응을 통해 효소-기질 복합체를 형성할 수 있으며, 이는 이종생물제의 대사에 관여한다.헥소바르비탈의 농도는 또한 간 마이크로솜 시토크롬 P450의 [12]산소분해효소 및 산화효소 활성에 역할을 한다.
또한 이소자임 CYP3A4의 억제제인 트리아세틸올레안도마이신은 헥소바르비탈 대사 및 생물학적 활성을 억제하여 헥소바르비탈과 시토크롬 [13]P450 사이의 밀접한 관계를 나타낸다.
독성
동작 메커니즘
헥소바르비탈의 생물학적 영향은 주로 중추신경계에 [14]침투하는 능력에 달려있다.헥소바르비탈은 모든 바르비투르산염처럼 GABA 수용체를 강화시킬A 수 있다.헥소바르비탈의 S(+) 에난티오머가 GABA 수용체를 R(-) [15]에난티오머보다 더 효과적으로 증강시키는A 것으로 수년간 밝혀졌다.GABA가 GABAA 수용체에 결합하면 염화물 이온 채널이 열려 염화물 이온이 뉴런으로 유입될 수 있다.이것은 뉴런의 막 전위에서의 과분극을 유발하며, 이것은 뉴런이 활동 전위를 시작할 가능성을 낮춥니다.따라서 이러한 유형의 수용체는 포유류 중추신경계의 [16]주요 억제성 신경전달물질 수용체이다.GABAA 수용체 증강제로서 헥소바르비탈은 염화물 이온 채널에 국재화된 바르비투르산 결합 부위에 결합함으로써 GABA 및 벤조디아제핀의 각각의 결합 부위에 대한 결합을 알로스테릭하게 [17]증가시킨다.또한 헥소바르비탈에 의해 염화물 이온 채널이 최장 개방 상태인 9밀리초까지 열려 시냅스 후 억제 효과가 [15]확대된다.GABA와 대조적으로 글루탐산염은 포유류의 뇌에서 주요 흥분성 신경전달물질이다.억제 효과 외에도 헥소바르비탈 블록은 모든 바르비투르산염 수용체, AMPA 수용체, 카이네이트 수용체, 신경 아세틸콜린 수용체와 마찬가지로 차단된다.또한 바르비투르산염은 P/[18]Qtype형 고전압활성칼슘채널에 개방채널블록을 발생시킴으로써 글루탐산염 방출을 억제한다.전체적으로 헥소바르비탈은 글루탐산 방출을 억제하고 GABA 효과를 증강함으로써 뇌에 CNS 억제 효과를 일으킨다.
대사
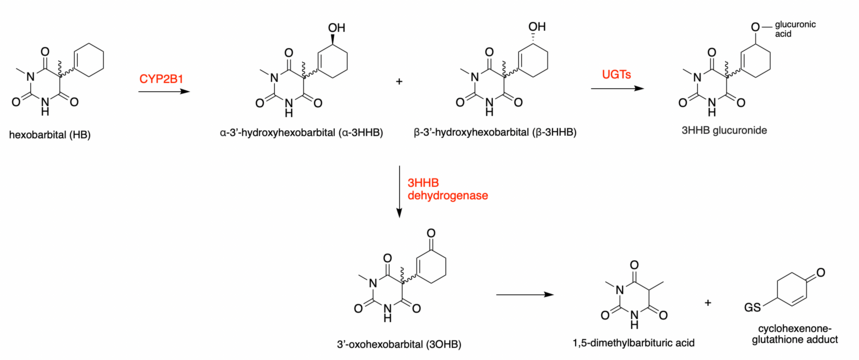
헥소바르비탈(HB)의 간 대사는 모두 다른 대사물을 [19]형성하는 다른 경로로 나눌 수 있다.HB의 S(+) 에난티오머는 β-3'-히드록시헥소바르비탈로, R(-) 에난티오머는 α-3'-히드록시헥소바르비탈로 우선 대사되므로 반응이 입체선택적이다.그러나 두 가지 에난티오머는 모두 α 이성질체와 β 이성질체를 형성한다.3'-히드록시헥소바르비탈(3HB)용 에난티오머는 총 4종류 대사할 수 있다.이 반응은 시토크롬 P450, CYP2B1에 [20]의해 촉매된다.형성된 모든 3HB 이성질체는 글루쿠론화 또는 탈수소를 통해 추가적인 대사를 겪을 수 있다.
3HB가 UDP-글루쿠로노실전달효소(UGT)를 통해 글루쿠로니화 반응을 하면 쉽게 배설되며, 3HB는 탈수소 작용으로 반응성 케톤, 3'-옥소헥소바르비탈(3OHB)을 형성할 수 있다.3HB가 3OHB로 생체 변환되는 것은 NAD(P)+ 결합 산화인 [21]3HB 탈수소효소(3HBD)를 통해 이루어진다.이 효소는 알도케토환원효소(AKR) 슈퍼패밀리의 일부이다.사람의 경우 3HBD는 [20]NAD에 대한+ 선호도가 높다.이러한 반응들은 또한 입체특이적이며, 3HBD는 알파 및 베타 [22]형태 모두에서 에난티오머에 대해 가장 높은 활성을 가지므로 R(-) 배치는 우선적으로 3OHB를 형성한다.
새로운 증거는 1,5-디메틸바르비투르산과 시클로헥세논 글루타티온 [20]부가물로의 3OHB의 추가 대사 과정을 증명했다.이 생체 변환 단계는 에폭시드-디올 [23][24]메커니즘을 통해 이루어집니다.반응성 에폭시드의 형성은 언급된 화합물의 형성을 이끈다.
인체 실험 결과 주요 대사물은 3HB, 3OHB,[23] 1,5-디메틸바르비투르산인 것으로 나타났다.
인간의 건강에 미치는 영향
배설물
사람 내 HB의 혈장 반감기는 222±[23]54분으로 추정된다.HB의 클리어런스는 두 가지 에난티오머와 피험자의 연령에 따라 다릅니다.R(-) 에난티오머의 간극은 S(+) 에난티오머의 간극보다 거의 10배 크다.노인의 청소는 젊은 피험자에 비해 평균적으로 [25]느리다.3대 [20][23]대사물은 주로 소변을 통해 배설된다.시클로헥세논 글루타치온 부가물은 [20]담즙으로 배설된다.
증상
헥소바르비탈에 걸린 사람의 중독은 무기력, 조정 불능, 사고력, 언어능력 저하, 잘못된 판단력, 졸음 또는 혼수, 얕은 호흡과 비틀거림을 초래할 수 있다.몇몇 심각한 경우 혼수상태와 사망은 [19]과다복용으로 인한 것일 수 있다.
동물에 미치는 영향
다음 표는 1900년대에 행해진 헥소바르비탈의 동물에 대한 영향에 대한 연구를 보여줍니다.이 연구들의 대부분은 헥소바르비탈이 단기적인 독성 효과를 가지고 있으며 쥐, 토끼, 개구리에게 최면 효과를 유발할 수 있다는 것을 보여주었다.
| 유기체 | 테스트 타입 | 경로 | 양 | 영향 | 언급 |
|---|---|---|---|---|---|
| 쥐. | LD50 | 복강 내의 | 330 mg/kg (330 mg/kg) | [27] | |
| 쥐. | LDLO | 피하의 | 400 mg/kg (400 mg/kg) | [28] | |
| 마우스 | LD50 | 오랄 | 468 mg/kg (468 mg/kg) | 수면시간 연장 | [29] |
| 마우스 | LD50 | 복강 내의 | 270 mg/kg (150 mg/kg) | L-asparagine에 의해 강화되는 수면시간과 이동불능시간 연장 | [30] |
| 마우스 | LDLO | 피하의 | 250 mg/kg (250 mg/kg) | [31] | |
| 마우스 | LD50 | 정맥주사 | 133 mg/kg (133 mg/kg) | 행동: 졸음(일반적으로 우울한 활동) | 국제약력학회(Archives de Pharmacoginousie et de Therapie.), 163(11), 1966 |
| 마우스 | LDLO | 흉막 내의 | 340 mg/kg (150 mg/kg) | 4,5-디히드로-6-메틸-2[2-(4-피리딜)-에틸]-3-피리다지논(U-320)으로 증강되는 최면 효과 | [32] |
| 마우스 | LD50 | 비경구 | 160 mg/kg (160 mg/kg) | 약리학과 독성학.FATOAO의 영어 번역, 20(569), 1957. | |
| 토끼 | LDLO | 오랄 | 1200 mg/kg (150 mg/kg) | 극단 배우, 최면 효과 최소치사량: 1200mg/kg 최소 최면 용량: 15 mg/kg | [33] |
| 토끼 | LDLO | 정맥주사 | 80 mg/kg (80 mg/kg) | 극단 배우, 최면 효과 최소치사량: 80mg/kg 최소 최면 용량: 15 mg/kg | [33] |
| 토끼 | LDLO | 직장의 | 175 mg/kg (175 mg/kg) | 극단 배우, 최면 효과 최소치사량: 175mg/kg 최소 최면 용량: 15 mg/kg | [33] |
| 개구리 | LDLO | 복강 내의 | 30 mg/kg (30 mg/kg) | [34] | |
| 개구리 | LD50 | 비경구 | 148 mg/kg (138 mg/kg) | 약리학과 독성학.FATOAO의 영어 번역, 20(569), 1957. |
대중문화에서
1937년 아가사 크리스티의 '테이블 위의 미스터리 카드'에서 헥소바르비탈은 베로날과 함께 과다 복용을 유도하기 위해 사용된다.에르큘 포와로는 N-메틸-시클로-헥세닐-메틸말로닐 요소 및 에비판을 [35]모두 지칭한다.
레퍼런스
- ^ Lexikon der Neurowissenschaft: 헥소바르비탈(독일어)
- ^ Helm S (2015). If this is a woman: Inside Ravensbruck: Hitler's concentration camp for women. London: Abacus. pp. 243–258. ISBN 9780349120034.
- ^ Pubchem. "Hexobarbital C12H16N2O3 - PubChem". pubchem.ncbi.nlm.nih.gov. Retrieved 2016-05-02.
- ^ Tseilikman VE, Kozochkin DA, Manukhina EB, Downey HF, Tseilikman OB, Misharina ME, et al. (April 2016). "Duration of hexobarbital-induced sleep and monoamine oxidase activities in rat brain: Focus on the behavioral activity and on the free-radical oxidation". General Physiology and Biophysics. 35 (2): 175–83. doi:10.4149/gpb_2015039. PMID 26689857.
- ^ a b c Timmermann G, Czeizel AE, Bánhidy F, Acs N (2008-02-01). "A study of the teratogenic and fetotoxic effects of large doses of barbital, hexobarbital and butobarbital used for suicide attempts by pregnant women". Toxicology and Industrial Health. 24 (1–2): 109–19. doi:10.1177/0748233708089004. PMID 18818187. S2CID 36948994.
- ^ "FDA Pregnancy Categories - CHEMM". chemm.nlm.nih.gov. Retrieved 2021-02-27.
- ^ Komelkova M, Manukhina E, Downey HF, Sarapultsev A, Cherkasova O, Kotomtsev V, et al. (August 2020). "Hexobarbital Sleep Test for Predicting the Susceptibility or Resistance to Experimental Posttraumatic Stress Disorder". International Journal of Molecular Sciences. 21 (16): 5900. doi:10.3390/ijms21165900. PMC 7460591. PMID 32824478.
- ^ Bornheim LM, Borys HK, Karler R (March 1981). "Effect of cannabidiol on cytochrome P-450 and hexobarbital sleep time". Biochemical Pharmacology. 30 (5): 503–7. doi:10.1016/0006-2952(81)90636-5. PMID 7225146.
- ^ Schnell RC, Prosser TD, Miya TS (May 1974). "Cadmium-induced potentiation of hexobarbital sleep time in rats". Experientia. 30 (5): 528–9. doi:10.1007/BF01926332. PMID 4833683. S2CID 6402325.
- ^ VCH Publishers (2002). Ullman's encyclopedia of industrial chemistry. Wiley-VCH. OCLC 50618230.
- ^ 미국 2015376136, 추마코바 L, 패트론 A, 사제 C, 카라네우스키 D, 키미치 R, 클레이튼 B, 제프리 B, 함마커 R, 추마코프 V, 자오 W, 논코비치 A, 웅 J, 2015년 12월 31일 발행
- ^ Heinemeyer G, Nigam S, Hildebrandt AG (November 1980). "Hexobarbital-binding, hydroxylation and hexobarbital-dependent hydrogen peroxide production in hepatic microsomes of guinea pig, rat and rabbit". Naunyn-Schmiedeberg's Archives of Pharmacology. 314 (2): 201–10. doi:10.1007/BF00504539. PMID 7453835. S2CID 37489777.
- ^ Timbrell JA (2009). Principles of biochemical toxicology. Informa Healthcare. p. 181. ISBN 978-0-8493-7302-2. OCLC 243818515.
- ^ Andrews PR, Mark LC (October 1982). "Structural specificity of barbiturates and related drugs". Anesthesiology. 57 (4): 314–20. doi:10.1097/00000542-198210000-00014. PMID 6751157.
- ^ a b Yamakura T, Bertaccini E, Trudell JR, Harris RA (2001-04-01). "Anesthetics and ion channels: molecular models and sites of action". Annual Review of Pharmacology and Toxicology. 41 (1): 23–51. doi:10.1146/annurev.pharmtox.41.1.23. PMID 11264449.
- ^ Sigel E, Steinmann ME (November 2012). "Structure, function, and modulation of GABA(A) receptors". The Journal of Biological Chemistry. 287 (48): 40224–31. doi:10.1074/jbc.R112.386664. PMC 3504738. PMID 23038269.
- ^ Olsen RW, Sapp DM, Bureau MH, Turner DM, Kokka N (1991). "Allosteric actions of central nervous system depressants including anesthetics on subtypes of the inhibitory gamma-aminobutyric acidA receptor-chloride channel complex". Annals of the New York Academy of Sciences. 625: 145–54. doi:10.1111/j.1749-6632.1991.tb33838.x. PMID 1711804. S2CID 12448489.
- ^ Löscher W, Rogawski MA (December 2012). "How theories evolved concerning the mechanism of action of barbiturates". Epilepsia. 53 Suppl 8 (s8): 12–25. doi:10.1111/epi.12025. PMID 23205959. S2CID 4675696.
- ^ a b "Hexobarbital". go.drugbank.com. Retrieved 2021-03-08.
- ^ a b c d e Takenoshita R, Toki S (December 2004). "[New aspects of hexobarbital metabolism: stereoselective metabolism, new metabolic pathway via GSH conjugation, and 3-hydroxyhexobarbital dehydrogenases]". Yakugaku Zasshi. 124 (12): 857–71. doi:10.1248/yakushi.124.857. PMID 15577260.
- ^ Endo S, Matsunaga T, Matsumoto A, Arai Y, Ohno S, El-Kabbani O, et al. (November 2013). "Rabbit 3-hydroxyhexobarbital dehydrogenase is a NADPH-preferring reductase with broad substrate specificity for ketosteroids, prostaglandin D₂, and other endogenous and xenobiotic carbonyl compounds". Biochemical Pharmacology. 86 (9): 1366–75. doi:10.1016/j.bcp.2013.08.024. PMID 23994167.
- ^ Furner RL, McCarthy JS, Stitzel RE, Anders MW (October 1969). "Stereoselective metabolism of the enantiomers of hexobarbital". The Journal of Pharmacology and Experimental Therapeutics. 169 (2): 153–8. PMID 5824599.
- ^ a b c d Vermeulen NP, Rietveld CT, Breimer DD (April 1983). "Disposition of hexobarbitone in healthy man: kinetics of parent drug and metabolites following oral administration". British Journal of Clinical Pharmacology. 15 (4): 459–64. doi:10.1111/j.1365-2125.1983.tb01530.x. PMC 1427803. PMID 6849782.
- ^ Takenoshita R, Nakamura T, Toki S (August 1993). "Hexobarbital metabolism: a new metabolic pathway to produce 1,5-dimethylbarbituric acid and cyclohexenone-glutathione adduct via 3'-oxohexobarbital". Xenobiotica; the Fate of Foreign Compounds in Biological Systems. 23 (8): 925–34. doi:10.3109/00498259309059419. PMID 8284947.
- ^ Smith DA, Chandler MH, Shedlofsky SI, Wedlund PJ, Blouin RA (December 1991). "Age-dependent stereoselective increase in the oral clearance of hexobarbitone isomers caused by rifampicin". British Journal of Clinical Pharmacology. 32 (6): 735–9. doi:10.1111/j.1365-2125.1991.tb03982.x. PMC 1368555. PMID 1768567.
- ^ PubChem. "Hexobarbital". pubchem.ncbi.nlm.nih.gov. Retrieved 2021-03-07.
- ^ Klinger W (March 1970). "[Toxicity, narcotic effect, blood level after awakening, elimination from the blood and biotransformation of hexobarbital in rats of different ages after induction with barbital and carbon tetrachloride poisoning]". Archives Internationales de Pharmacodynamie et de Therapie. 184 (1): 5–18. PMID 5448769.
- ^ "Naunyn-Schmiedeberg's Archives of Pharmacology Volumes and issues". SpringerLink. Retrieved 2021-03-09.
- ^ Reinhard JF, Kimura ET, Scudi JV (December 1952). "Pharmacologic characteristics of 1-(ortho-toluoxy)2, 3-bis-(2, 2, 2-trichloro-1-hydroxyethoxy)-propane". The Journal of Pharmacology and Experimental Therapeutics. 106 (4): 444–52. PMID 13023555.
- ^ Forney RB, Hughes FW, Richards AB, Gates PW (November 1963). "Toxicity and depressant action of ethanol and hexobarbital after pretreatment with asparagine". Toxicology and Applied Pharmacology. 5 (6): 790–3. doi:10.1016/0041-008X(63)90071-1. PMID 14082484.
- ^ Irrgang K (June 1965). "[On the pharmacology of 5-ethyl-5(3-hydroxyisoamyl)-barbituric acid--a breakdown product of 5-ethyl-5-isoamyl-barbituric acid]". Arzneimittel-Forschung. 15 (6): 688–91. PMID 5899249.
- ^ Buller RH, Rockhold WT, Buzard JA, Stern IJ (1961-10-01). "The Potentiating Effect of 4,5-Dihydro-6-Methyl-2[2-(4-Pyridyl)-Ethyl]-3-Pyridazinone (u-320) on Hexobarbital Hypnosis". Journal of Pharmacology and Experimental Therapeutics. 134 (1): 95–99. ISSN 0022-3565.
- ^ a b c Werner HW, Pratt TW, Tatum AL (1937-06-01). "A Comparative Study of Several Ultrashortacting Barbiturates, Nembutal, and Tribromethanol". Journal of Pharmacology and Experimental Therapeutics. 60 (2): 189–197. ISSN 0022-3565.
- ^ Tatum AL (October 1939). "The present status of the barbiturate problem". Physiological Reviews. 19 (4): 472–502. doi:10.1152/physrev.1939.19.4.472.
- ^ Christie A (1937). Cards on the Table. New York: William Morrow. p. 242. ISBN 978-0-06-207373-0.