리토나비르
Ritonavir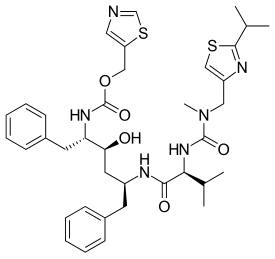 | |
 | |
| 임상 데이터 | |
|---|---|
| 발음 | /r-t-n-v-r/ rih-to-n-ver |
| 상호 | 노비루 |
| 기타 이름 | RTV |
| AHFS/Drugs.com | 모노그래프 |
| Medline Plus | a696029 |
| 라이선스 데이터 | |
| 임신 카테고리 |
|
| 루트 행정부. | 입으로 |
| ATC 코드 | |
| 법적 상태 | |
| 법적 상태 | |
| 약동학 데이터 | |
| 단백질 결합 | 98-99% |
| 물질 대사 | 간 |
| 반감기 제거 | 3-5시간 |
| 배설 | 주로 배설물 |
| 식별자 | |
| |
| CAS번호 | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| 케그 | |
| 체비 | |
| 첸블 | |
| NIAID 화학DB | |
| PDB배위자 | |
| CompTox 대시보드 (EPA ) | |
| ECHA 정보 카드 | 100.125.710 |
| 화학 및 물리 데이터 | |
| 공식 | C37H48N6O5S2 |
| 몰 질량 | 720.95g/표준−1 |
| 3D 모델(JSmol) | |
| |
| |
Norvir라는 상표명으로 판매되는 프로테아제 억제제인 Ritonavir는 HIV/[3][4][5]AIDS 치료에 다른 약물과 함께 사용되는 항레트로바이러스제이다.이 조합 치료법은 고활성 항레트로바이러스 치료법(HAART)[5]으로 알려져 있다.종종 저용량은 다른 단백질 분해효소 억제제와 [5]함께 사용된다.그것은 또한 [6]C형 간염을 치료하기 위해 다른 약물과 함께 사용될 수 있다.입으로 [5]먹는 거예요.리토나비르 정제는 혈장 농도가 [5]높을 수 있기 때문에 캡슐과 생물적으로 동등하지 않다.
일반적인 부작용으로는 메스꺼움, 구토, 식욕부진, 설사, 손발 [5]저림 등이 있다.심각한 부작용으로는 간 질환, 췌장염, 알레르기 반응, 관절염 [5]등이 있다.아미오다론과 심바스타틴을 포함한 [5]많은 다른 약물들과 심각한 상호작용이 일어날 수 있다.저용량에서는 임신 [7]중 사용이 허용되는 것으로 간주됩니다.리토나비르는 프로테아제 억제제 [5]등급이다.그러나 일반적으로 다른 단백질 분해효소 억제제를 [8]대사하는 효소를 억제하는 데 사용됩니다.이러한 억제는 이러한 후자의 약물의 저용량 사용을 [8]허용한다.
리토나비르는 1989년에 특허를 받았으며 [9][10]1996년에 의학적으로 사용되기 시작했다.그것은 세계보건기구의 필수 [11]의약품 목록에 있다.리토나비르 캡슐은 [12]2020년 미국에서 제네릭 의약품으로 승인되었습니다.
도 ★★★★★★★★★★★★★.
이 섹션은 적어도 리드선이 이 섹션을 요약할 수 있도록 보다 광범위한 오프닝 설명과 더불어 이 최고 등급 억제제 설계에 대한 매우 중요한 PK-PD 관찰 및 그 우연한 결과에 대한 적절한 설명이 필요하다.추가해서 도와주시면 됩니다. (2020년 2월) |
리토나비르는 HIV-1 감염 [3][4][5]환자의 치료를 위해 다른 항레트로바이러스제와 함께 투여된다.
2021년 12월, 미국 식품의약국(FDA)은 니르마트렐빌과 리토나비르의 조합을 코로나바이러스 질환 COVID-19 [13][14][15]치료에 대한 긴급 사용 허가를 승인했다.공동 포장된 의약품은 [14][15][16]팍스로비드라는 상표명으로 판매된다.팍슬로비드는 COVID-19의 사전 노출 또는 사후 노출 방지 또는 심각하거나 치명적인 COVID-19로 [14]인해 입원이 필요한 환자의 치료 개시에 대해 승인되지 않았다.2021년 12월 31일, 영국 의약품 및 의료 제품 규제청(MHRA)은 "중증 COVID-19에 걸릴 위험이 높은 경도에서 중간 정도의 COVID-19를 가진 사람들을 위해" 동일한 조합을 승인했다.[17][18]
★★★★★★
항HIV 치료에 효과적인 초기 테스트 높은 용량으로 투여했을 때 리토나비르의 부작용은 다음과 [3]같다.
리토나비르의 부작용 중 하나는 GLUT4 인슐린 조절 수송체의 억제를 통한 고혈당이며, 따라서 포도당이 지방과 근육 [medical citation needed]세포로 들어가는 것을 막는다.이것은 인슐린 저항성으로 이어질 수 있고 제2형 [medical citation needed]당뇨병을 앓고 있는 사람들에게 문제를 일으킬 수 있다.
리토나비르는 간 [19]활성을 보인다.리토나비르는 CYP1A2를[medical citation needed] 유도하여 주요 P450 아이소폼 3A4, 2D6을 [medical citation needed]억제한다.다양한 약물과 함께 리토나비르를 병행 치료하면 심각하고 때로는 치명적인 약물 [20]상호작용을 일으킬 수 있다.
시토크롬 P450 효소 CYP2D6 및 CYP3A4의 강력한 억제제(플라즈마 AUC 값의 최소 5배 증가 또는 클리어런스의 80% 이상 감소)이기 때문에 리토나비르는 오피오이돈 [21]진통제의 심각하고 생명을 위협하는 부작용을 심각하게 증강하고 연장할 수 있다.
리토나비르와 여러 가지 약물 등급의 조합은 위험한 [22]부작용을 일으킬 수 있다.
이 섹션은 HIV 단백질 분해효소 및 CYP3A4 결합 특성 및 구조적 세부사항을 정확하게 기술하여 확장해야 합니다. 단백질 분해효소 물질에 대한 한 문장은 역사에 불충분합니다.추가해서 도와주시면 됩니다. (2020년 2월) |

리토나비르는 원래 유사 C-대칭2 소분자 억제제 [24]중 하나인 HIV 단백질 [23]분해효소 억제제로 개발되었다.
리토나비르는 자체 항바이러스 활성에 거의 사용되지 않지만 다른 단백질 분해효소 억제제의 촉진제로 널리 사용된다.보다 구체적으로 리토나비르는 일반적으로 단백질분해효소 억제제인 시토크롬 P450-3A4(CYP3A4)[25]를 대사하는 특정 효소, 장, 간 및 다른 곳에서 억제하기 위해 사용된다.이 약물은 CYP3A4에 결합하고 억제하기 때문에 저용량을 사용하여 다른 단백질 분해효소 억제제를 강화할 수 있습니다.이 발견은 부작용을 획기적으로 감소시키고 단백질분해효소 억제제와 HAART의 효과를 향상시켰다.그러나 이종생물대사에서의 CYP3A4의 일반적인 역할 때문에 리토나비르와의 투여는 다른 수많은 약물의 효능에도 영향을 미쳐 약물 동시 [medical citation needed][26][better source needed]처방의 어려움을 가중시킨다.
및
그 약의 캡슐은 [5]알약과 같은 생물학적 가용성을 가지고 있지 않다.
리토나비르는 여러 [27]종에서 EC=050.02µM의 시험관내 효력과 경구 투여 후 혈장 내 농도가 높은 것으로 입증되었다.
★★★
리토나비르는 처음에는 중간 정도의 강력한 경구 생체 이용 가능한 작은 분자 A-80987에서 파생되었다.A-80987의 P3 및 P2' 복소환 그룹은 리토나비르로 알려진 유사체를 만들기 위해 [27]재설계되었다.
리토나비르의 합성에 대한 자세한 내용은 애보트 연구소의 과학자들에 의해 처음 발표되었다.
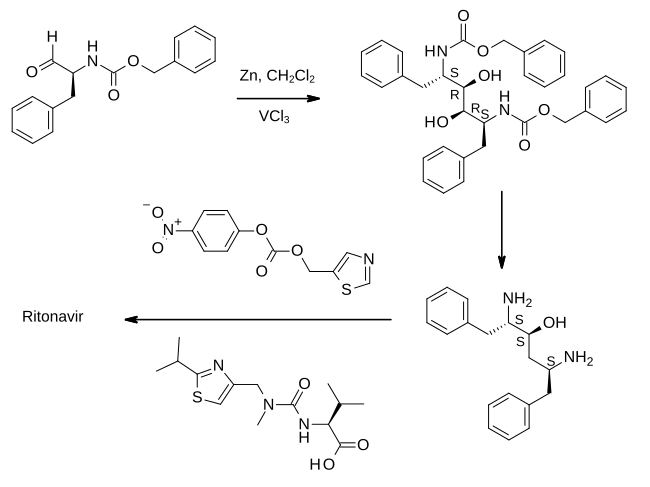
제1공정에서는 페닐알라닌 유래의 알데히드를 염화바나듐(II)의 존재 하에서 아연가루로 처리한다.그 결과, 피나콜 결합 반응이 일어나 재료를 이량화시켜 중간체를 제공하고, 중간체는 에폭시드로 변환된 다음 (2S,3S,5S)-2,5-디아미노-1,6-디페닐헥산-3-ol로 환원됩니다.중요한 것은, 이것은 아미노산 전구체의 절대 입체 화학을 유지한다는 것이다.그런 다음 디아민은 [28][29]리토나비르를 제공하기 위해 각각 아미드 결합으로 연결된 두 개의 티아졸 유도체로 순차적으로 처리됩니다.
★★★

Ritonavir는 AbbVie, Inc.[citation needed]에 의해 Norvir로 판매된다.미국 식품의약국(FDA)은 1996년 [31]3월 1일 리토나비르를 승인하여 미국에서 승인된 7번째 항레트로바이러스제이자 미국에서 승인된 단백질분해효소 억제제(4개월 [citation needed]전 사퀴나비르 이후)가 되었다.프로테아제 억제제 리토나비르와 사퀴나비르가 중요했던[citation needed] "고활성 항레트로바이러스 테아랍[ies]"의 도입으로 미국 HIV 관련 연간 사망률은 2년 [30]동안 50,000명 이상에서 약 18,000명으로 감소했다.
2014년 FDA는 C형 간염 바이러스(HCV) 유전자형 [6]4의 치료를 위해 옴비타비르/파리타프레비르/리토나비르의 조합을 승인했으며, 리토나비르의 존재는 인간 약물 대사 효소 CYP3A4와의 [medical citation needed]억제적 상호작용을 다시 활용했다.
2021년 COVID-19 [32][33][34][35]치료를 위해 리토나비르와 경구 활성 3C 유사 단백질분해효소 억제제인 니르마트렐비르의 조합이 개발되었다.리토나비르는 시토크롬 효소에 의한 니르마트렐빌의 신진대사를 늦추는 역할을 하여 주약물의 [36]순환 농도를 높입니다.그해 11월 화이자는 증상 [37][38]발생 후 3일 이내에 입원을 89% 감소시키는 등 2/3상 결과를 발표했다.
과 시장
리토나비르는 원래 냉장할 필요가 없는 캡슐로 제공되었다.이것은 리토나비르의 수정 형태를 포함하고 있었는데, 지금은 [39]I형식이라고 불린다.그러나 많은 약물과 마찬가지로 결정성 리토나비르는 다형성을 나타낼 수 있다. 즉, 동일한 분자가 하나 이상의 결정형 또는 다형성으로 결정화될 수 있으며, 각 분자는 동일한 반복 분자를 포함하지만 다른 결정 패킹/배열로 결정화될 수 있다.용해성과 생물학적 가용성은 배열에 따라 달라질 수 있으며, 이는 리토나비르의 [40]형태 I과 II에 대해 관찰되었다.
1996년 리토나비르가 도입되면서 현재는 형태 I이라고 불리는 결정 형태만 발견됐지만 1998년 보다 낮은 자유 에너지,[41] 보다 안정적인 다형 형태 II가 발견됐다.이 보다 안정적인 결정 형태는 용해성이 낮았고, 이로 인해 생물학적 가용성이 현저하게 낮아졌다.약물의 경구 생체 가용성이 저하됨에 따라 [40]시장에서 일시적으로 경구 캡슐 제제가 제거되었다.미량의 형태 II라도 보다 생물학적으로 이용 가능한 형태 I을 형태 II로 변환시킬 수 있다는 사실의 결과, 형태 II의 존재는 리토나비르의 경구 캡슐 제제의 기존 공급을 파괴할 우려가 있었으며, 실제로 양식 II는 생산 라인에서 발견되어 리토나비르 [39]생산을 사실상 중단하였다.Abbott(현 AbbVie)는 캡슐을 시장에서 철수시켰으며, 처방전 의사는 Norvir [citation needed]현탁액으로 전환할 것을 권장받았다.그 결과 애보트는 2억 5천만 달러 이상의 손실을 입은 것으로 추정되고 있으며, 이 사건은 종종 [42]다형이 사라진 대표적인 사례로 언급되고 있다.
이 회사의 연구 개발팀은 캡슐 제제를 냉장 [when?][citation needed]젤캡으로 대체함으로써 궁극적으로 문제를 해결했다.2000년 애보트(현 AbbVie)는 [43]냉장처리가 필요 없는 리토나비르 제제를 함유한 로피나비르/리토나비르(Kaletra) 정제 제조에 대한 FDA 승인을 받았다.용융액출에 의해 고형분산된 리토나비르는 형태 I에 머물러 있는 것으로 확인되어 [44]2010년에 상업적으로 재도입되었다.
와
2003년 Abbott(AbbVie, Inc)는 Norvir 코스의 가격을 하루 1.71달러에서 8.57달러로 인상하여 환자 단체와 일부 의회 의원들의 가격 담합 주장으로 이어졌습니다.소비자단체인 Essential Inventions는 NIH에 Norvir 특허를 무효화해 달라고 청원했지만 NIH는 2004년 8월 4일 Norvir의 [45]일반 생산을 허용할 법적 권리가 없다고 발표했다.
조사.
2020년에 로피나비르/리토나비르의 고정 용량 조합은 심각한 COVID-19에서 [46]작동하지 않는 것으로 밝혀졌다.실험에서는 증상이 [46]시작된 지 13일 정도 지나서 약물치료가 시작되었습니다.1930년 FDA 승인 약물에 대한 가상 스크리닝에 이어 분자역학 분석까지 예측된 리토나비르는 바이러스가 인간 [47]세포에 침투하는 데 중요한 인간 앤지오텐신 변환 효소-2(hACE2) 수용체에 대한 SARS-CoV-2 스파이크(S) 단백질의 결합을 차단한다.
레퍼런스
- ^ "Notice: Nirmatrelvir (COVID-19) added to Prescription Drug List (PDL)". Health Canada. January 17, 2022. Archived from the original on May 29, 2022. Retrieved June 25, 2022.
- ^ "Norvir Product information". Health Canada. April 25, 2012. Retrieved June 25, 2022.
- ^ a b c d "Norvir- ritonavir tablet, film coated Norvir- ritonavir solution Norvir- ritonavir powder". DailyMed. Archived from the original on November 18, 2021. Retrieved November 17, 2021.
- ^ a b c "Norvir EPAR". European Medicines Agency (EMA). Archived from the original on October 2, 2018. Retrieved August 20, 2020. 텍스트는 이 소스인 © 유럽 의약품청에서 복사한 것입니다.출처가 확인되면 복제가 허가됩니다.
- ^ a b c d e f g h i j k "Ritonavir". The American Society of Health-System Pharmacists. Archived from the original on October 17, 2015. Retrieved October 23, 2015.
- ^ a b "FDA approves Viekira Pak to treat hepatitis C" (Press release). U.S. Food and Drug Administration (FDA). December 19, 2014. Archived from the original on October 31, 2015.
- ^ "Ritonavir Pregnancy and Breastfeeding Warnings". drugs.com. Archived from the original on September 7, 2015. Retrieved October 23, 2015.
- ^ a b British National Formulary 69 (69 ed.). Pharmaceutical Pr. March 31, 2015. p. 426. ISBN 9780857111562.
- ^ Hacker M (2009). Pharmacology principles and practice. Amsterdam: Academic Press/Elsevier. p. 550. ISBN 9780080919225. Archived from the original on June 17, 2020. Retrieved September 10, 2017.
- ^ Fischer J, Ganellin CR (2006). Analogue-based Drug Discovery. John Wiley & Sons. p. 509. ISBN 9783527607495. Archived from the original on June 20, 2021. Retrieved August 27, 2020.
- ^ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ "First Generic Drug Approvals". U.S. Food and Drug Administration (FDA). Archived from the original on January 26, 2021. Retrieved February 13, 2021.
- ^ "Paxlovid- nirmatrelvir and ritonavir kit". DailyMed. Archived from the original on December 31, 2021. Retrieved December 30, 2021.
- ^ a b c "FDA Authorizes First Oral Antiviral for Treatment of COVID-19". U.S. Food and Drug Administration (FDA) (Press release). December 22, 2021. Archived from the original on December 27, 2021. Retrieved December 22, 2021.
- ^ a b "Pfizer Receives U.S. FDA Emergency Use Authorization for Novel COVID-19 Oral Antiviral Treatment" (Press release). Pfizer. December 22, 2021. Archived from the original on December 22, 2021. Retrieved December 22, 2021 – via Business Wire.
- ^ "Frequently Asked Questions on the Emergency Use Authorization for Paxlovid for Treatment of COVID-19" (PDF). U.S. Food and Drug Administration (FDA). December 22, 2021. Archived from the original on January 5, 2022. Retrieved January 3, 2022.
- ^ "Oral COVID-19 antiviral, Paxlovid, approved by UK regulator" (Press release). Medicines and Healthcare products Regulatory Agency. December 31, 2021. Archived from the original on January 11, 2022. Retrieved January 3, 2022.
- ^ Reed J (December 31, 2021). "Paxlovid: UK medicines regulator approves second Covid antiviral pill". BBC News Online. Archived from the original on January 1, 2022. Retrieved January 3, 2022.
- ^ Yeh RF, Gaver VE, Patterson KB, Rezk NL, Baxter-Meheux F, Blake MJ, et al. (May 2006). "Lopinavir/ritonavir induces the hepatic activity of cytochrome P450 enzymes CYP2C9, CYP2C19, and CYP1A2 but inhibits the hepatic and intestinal activity of CYP3A as measured by a phenotyping drug cocktail in healthy volunteers". Journal of Acquired Immune Deficiency Syndromes. 42 (1): 52–60. doi:10.1097/01.qai.0000219774.20174.64. PMID 16639344. S2CID 39632668.
- ^ "Ritonavir: Drug Information Provided by Lexi-Comp: Merck Manual Professional". Merck Manuals Professional Edition. April 30, 2008. Archived from the original on April 30, 2008.
- ^ Nieminen TH, Hagelberg NM, Saari TI, Neuvonen M, Neuvonen PJ, Laine K, et al. (October 2010). "Oxycodone concentrations are greatly increased by the concomitant use of ritonavir or lopinavir/ritonavir" (PDF). European Journal of Clinical Pharmacology. 66 (10): 977–985. doi:10.1007/s00228-010-0879-1. PMID 20697700. S2CID 25770818.
- ^ "Pfizer's Covid pills may be risky with other medications". NBC News. Archived from the original on February 3, 2022. Retrieved January 10, 2022.
- ^ "Espacenet – search results". worldwide.espacenet.com. Archived from the original on April 5, 2022. Retrieved April 5, 2022.
- ^ Kempf DJ, Norbeck DW, Codacovi L, Wang XC, Kohlbrenner WE, Wideburg NE, et al. (October 1990). "Structure-based, C2 symmetric inhibitors of HIV protease". Journal of Medicinal Chemistry. 33 (10): 2687–2689. doi:10.1021/jm00172a002. PMID 2213822.
- ^ Zeldin RK, Petruschke RA (January 2004). "Pharmacological and therapeutic properties of ritonavir-boosted protease inhibitor therapy in HIV-infected patients". The Journal of Antimicrobial Chemotherapy. 53 (1): 4–9. doi:10.1093/jac/dkh029. PMID 14657084.
- ^ "Drug Development and Drug Interactions: Table of Substrates, Inhibitors and Inducers". U.S. Food and Drug Administration (FDA). December 3, 2019. Archived from the original on March 12, 2020. Retrieved February 17, 2020.
- ^ a b Kempf DJ, Sham HL, Marsh KC, Flentge CA, Betebenner D, Green BE, et al. (February 1998). "Discovery of ritonavir, a potent inhibitor of HIV protease with high oral bioavailability and clinical efficacy". Journal of Medicinal Chemistry. 41 (4): 602–617. doi:10.1021/jm970636+. PMID 9484509.
- ^ WO 특허 1994014436, Kempf, Dale J., Norbeck, Daniel W., Sham, Hing Leung, Zhao, Chen, Thomas J., Reno, Daniel S., Haight, Anthony R. 및 Cooper, Arthur J., "레트로바이러스 단백질 분해효소"를 1994년에 발표했다.
- ^ Vardanyan, Ruben; Hruby, Victor (2016). "34: Antiviral Drugs". Synthesis of Best-Seller Drugs. pp. 698–701. doi:10.1016/B978-0-12-411492-0.00034-1. ISBN 9780124114920. S2CID 75449475.
- ^ a b c Centers for Disease Control Prevention (CDC) (June 2011). "HIV surveillance--United States, 1981-2008" (PDF). MMWR. Morbidity and Mortality Weekly Report. 60 (21): 689–93. PMID 21637182. Archived from the original (PDF) on September 24, 2015.
- ^ "Ritonavir FDA approval package" (PDF). March 1, 1996. Archived (PDF) from the original on March 1, 2021. Retrieved August 20, 2020.
- ^ Vandyck K, Deval J (August 2021). "Considerations for the discovery and development of 3-chymotrypsin-like cysteine protease inhibitors targeting SARS-CoV-2 infection". Current Opinion in Virology. 49: 36–40. doi:10.1016/j.coviro.2021.04.006. PMC 8075814. PMID 34029993.
- ^ Schooley RT, Carlin AF, Beadle JR, Valiaeva N, Zhang XQ, Clark AE, et al. (September 2021). "Rethinking Remdesivir: Synthesis, Antiviral Activity, and Pharmacokinetics of Oral Lipid Prodrugs". Antimicrobial Agents and Chemotherapy. 65 (10): e0115521. doi:10.1128/AAC.01155-21. ISSN 0066-4804. PMC 8448143. PMID 34310217. S2CID 236450769.
- ^ Ahmad B, Batool M, Ain QU, Kim MS, Choi S (August 2021). "Exploring the Binding Mechanism of PF-07321332 SARS-CoV-2 Protease Inhibitor through Molecular Dynamics and Binding Free Energy Simulations". International Journal of Molecular Sciences. 22 (17): 9124. doi:10.3390/ijms22179124. PMC 8430524. PMID 34502033.
- ^ "Pfizer begins dosing in Phase II/III trial of antiviral drug for Covid-19". Clinical Trials Arena. September 2, 2021. Archived from the original on November 5, 2021. Retrieved November 5, 2021.
- ^ Woodley M (October 19, 2021). "What is Australia's potential new COVID treatment?". The Royal Australian College of General Practitioners (RACGP). Archived from the original on November 5, 2021. Retrieved November 6, 2021.
- ^ "Pfizer's Novel COVID-19 Oral Antiviral Treatment Candidate Reduced Risk Of Hospitalization Or Death By 89% In Interim Analysis Of Phase 2/3 EPIC-HR Study". November 5, 2021. Archived from the original on November 16, 2021. Retrieved November 17, 2021.
- ^ Weintraub K (November 5, 2021). "Pfizer antiviral drug could nearly end deaths from COVID-19, company study suggests". USA Today. Archived from the original on November 5, 2021. Retrieved November 5, 2021.
- ^ a b Bauer J, Spanton S, Henry R, Quick J, Dziki W, Porter W, Morris J (June 2001). "Ritonavir: an extraordinary example of conformational polymorphism". Pharmaceutical Research. 18 (6): 859–866. doi:10.1023/A:1011052932607. PMID 11474792. S2CID 20923508.
- ^ a b Morissette SL, Soukasene S, Levinson D, Cima MJ, Almarsson O (March 2003). "Elucidation of crystal form diversity of the HIV protease inhibitor ritonavir by high-throughput crystallization". Proceedings of the National Academy of Sciences of the United States of America. 100 (5): 2180–2184. doi:10.1073/pnas.0437744100. PMC 151315. PMID 12604798.
- ^ Lüttge A (February 1, 2006). "Crystal dissolution kinetics and Gibbs free energy". Journal of Electron Spectroscopy and Related Phenomena. 150 (2): 248–259. doi:10.1016/j.elspec.2005.06.007.
- ^ Bučar, Dejan-Krešimir; Lancaster, Robert W.; Bernstein, Joel (June 8, 2015). "Disappearing Polymorphs Revisited". Angewandte Chemie International Edition. 54 (24): 6972–6993. doi:10.1002/anie.201410356.
- ^ "Kaletra FAQ". AbbVie's Kaletra product information. AbbVie. 2011. Archived from the original on July 7, 2014. Retrieved July 5, 2014.
- ^ Zhang C, Matzger AJ (February 2017). "A Newly Discovered Racemic Compound of Pioglitazone Hydrochloride Is More Stable than the Commercial Conglomerate". Crystal Growth & Design. 17 (2): 414–417. doi:10.1021/acs.cgd.6b01638. PMC 6752731. PMID 31537981.
- ^ Ceci Connolly (August 5, 2004). "NIH Declines to Enter AIDS Drug Price Battle". The Washington Post. Archived from the original on August 20, 2008. Retrieved January 16, 2006.
- ^ a b Cao B, Wang Y, Wen D, Liu W, Wang J, Fan G, et al. (May 2020). "A Trial of Lopinavir-Ritonavir in Adults Hospitalized with Severe Covid-19". The New England Journal of Medicine. 382 (19): 1787–1799. doi:10.1056/NEJMoa2001282. PMC 7121492. PMID 32187464.
- ^ Bagheri M, Niavarani A (October 2020). "Molecular dynamics analysis predicts ritonavir and naloxegol strongly block the SARS-CoV-2 spike protein-hACE2 binding". Journal of Biomolecular Structure & Dynamics. 40 (4): 1597–1606. doi:10.1080/07391102.2020.1830854. PMID 33030105. S2CID 222217607.
추가 정보
- Chemburkar SR, Bauer J, Deming K, Spiwek H, Patel K, Morris J, et al. (2000). "Dealing with the Impact of Ritonavir Polymorphs on the Late Stages of Bulk Drug Process Development". Organic Process Research & Development. 4 (5): 413–417. doi:10.1021/op000023y.
외부 링크
- "Ritonavir". Drug Information Portal. U.S. National Library of Medicine.