염증
Inflammation| 염증 | |
|---|---|
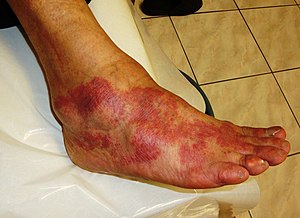 | |
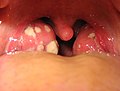
| 염증의 주요 징후는 통증, 열, 홍조, 붓기, 기능 상실을 포함한다.이러한 지표 중 일부는 알레르기 반응으로 인해 여기에서 볼 수 있습니다. | |
| 전문 | 면역학 류마티스학 |
| 증상 | 발열, 통증, 홍반, 붓기 |
| 합병증 | 천식, 폐렴, 자가면역질환 |
| 지속 | 급성 며칠 만성화 최대 수개월 또는 수 년 |
| 원인들 | 감염, 신체 부상, 자가면역장애 |
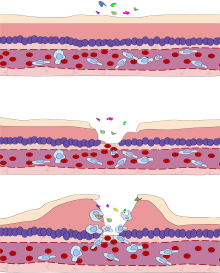
염증(라틴어: 염증)은 병원균, 손상된 세포 또는 자극제와 [1][2]같은 해로운 자극에 대한 신체 조직의 복잡한 생물학적 반응의 일부이며 면역 세포, 혈관 및 분자 매개체와 관련된 보호 반응입니다.염증의 기능은 세포 손상의 초기 원인을 제거하고, 원래의 모욕과 염증 과정에서 손상된 괴사 세포와 조직을 제거하고, 조직 복구를 시작하는 것입니다.
다섯 가지 주요 징후는 열, 통증, 붉어짐, 붓기, 그리고 기능 상실이다.염증은 일반적인 반응이며, 따라서 각 [3]병원체에 특정한 적응 면역과 비교하여 선천적 면역의 메커니즘으로 간주된다.염증이 너무 적으면 해로운 자극(예: 박테리아)에 의한 점진적인 조직 파괴로 이어질 수 있고 유기체의 생존을 위태롭게 할 수 있다.반대로, 만성 염증의 형태로 너무 많은 염증은 건초열, 치주질환, 아테롬성 동맥경화증, 골관절염과 같은 다양한 질병과 관련이 있다.
염증은 급성 또는 만성염으로 분류할 수 있다.급성 염증은 해로운 자극에 대한 신체의 초기 반응이며 혈액에서 손상된 조직으로 혈장과 백혈구(특히 과립구)의 움직임이 증가하여 달성된다.일련의 생화학적 사건이 국소 혈관계, 면역계 및 손상된 조직 내의 다양한 세포를 포함하는 염증 반응을 전파하고 성숙시킨다.만성 염증으로 알려진 장기 염증은 단핵세포와 같은 염증 부위에 존재하는 세포 유형의 점진적 변화를 가져오며 염증 과정에서 조직을 동시에 파괴하고 치유하는 것이 특징이다.
염증은 [4]또한 관련된 사이토카인과 도우미 T세포(Th1, Th2)의 종류에 따라 1형과 2형으로 분류되었다.
염증은 감염의 동의어가 아니다.감염은 미생물 침입의 작용과 신체의 염증 반응 사이의 상호작용을 기술합니다. 감염을 논할 때 두 성분이 함께 고려되며, 이 단어는 관찰된 염증 반응에 대한 미생물 침습적 원인을 암시하는 데 사용됩니다.반면에, 염증은 원인이 무엇이든 간에 순수하게 신체의 면역 혈관 반응을 묘사한다.하지만 이 두 단어가 얼마나 자주 연관되어 있는지 때문에, 접미사 -itis로 끝나는 단어들은 때때로 비공식적으로 감염을 가리키는 것으로 묘사된다.예를 들어 요도염이라는 단어는 엄격히 요도염만을 의미하지만 요도미생물 침입이 요도염의 가장 흔한 원인이기 때문에 의료기관에서는 요도염에 대해 요도염에 대해 논의한다.
그러나 염증-감염 구분은 아테롬성 동맥경화증, 외상, 허혈 및 자가면역질환(타입 III 과민증 포함)과 같이 미생물의 침입에 의해 염증이 유발되지 않는 병리 및 의료 진단에서 매우 중요하다.
원인들
이 섹션은 확인을 위해 추가 인용문이 필요합니다.(2015년 12월 (이 및 ) |
종류들
|
|
| 급성 | 만성 | |
|---|---|---|
| 원인물질 | 세균 병원체, 손상 조직 | 비분해성 병원체, 바이러스 감염, 지속성 이물질 또는 자가면역반응으로 인한 지속적인 급성염증 |
| 관련된 주요 세포 | 호중구(단구, 대식세포), 호산구(염증반응), 호산구(구충과 기생충에 대한 반응), 단핵세포(단구, 대식세포) | 단핵세포(단구, 대식세포, 림프구, 혈장세포), 섬유아세포 |
| 주요 중개자 | 혈관활성아민, 에이코사노이드 | IFN-γ 및 기타 사이토카인, 성장인자, 활성산소종, 가수분해효소 |
| 개시 | 즉각적인 | 지연된 |
| 지속 | 며칠 | 최대 몇 개월 또는 몇 년 |
| 결과 | 분해능, 농양 형성, 만성 염증 | 조직 파괴, 섬유화, 괴사 |
급성
급성 염증은 부상 즉시 발생하며 [8]며칠 밖에 지속되지 않습니다.사이토카인과 케모카인은 호중구와 대식세포의 [8]염증 부위로의 이동을 촉진한다.병원균, 알레르겐, 독소, 화상, 동상은 급성 [8]염증의 대표적인 원인 중 하나이다.톨라이크 수용체(TLR)는 미생물 [8]병원체를 인식한다.급성 염증은 조직을 [8]부상으로부터 보호하기 위한 방어 메커니즘이 될 수 있다.2주에서 6주 동안 지속되는 염증은 아급성 [8][9]염증으로 지정된다.
기수 기호
| 영어 | 라틴어 |
|---|---|
| 빨갛다 | 루보르 |
| 붓기 | 종양 |
| 열 | 열량 |
| 고통 | 돌로 |
| 기능 상실 | 풍토라사[b] |
급성 염증은 단기적인 과정으로 보통 몇 분 또는 몇 시간 안에 나타나고 해로운 자극이 [12]제거되면 멈추기 시작합니다.급성 염증의 다양한 면역, 내분비 및 신경학적 매개자의 국소적 조직적 동원 반응을 수반한다.정상적인 정상 응답에서는 활성화되어 병원체를 제거하고 복구 프로세스를 시작한 후 [13]중단됩니다.5가지 주요 [14]부호가 특징입니다.
염증의 징후를 나타내는 전통적인 이름은 라틴어에서 유래했다.
처음 네 개의 (고전적 부호)는 셀수스(c.기원전 30년–기원후 [16]38년)에 의해 설명되었고, 기능 상실은 아마도 나중에 [17]갤런에 의해 추가되었을 것이다.하지만, 이 다섯 번째 별자리의 추가는 토마스 시덴햄과[18] 버쵸에게도 [12][14]기인한다.
홍조와 열은 체내 코어 온도에서 염증 부위로의 혈류 증가 때문이다; 붓기는 체액의 축적에 의해 야기된다; 통증은 신경 말단을 자극하는 브라디키닌과 히스타민 같은 화학 물질의 방출 때문이다.기능 상실에는 여러 [14]가지 원인이 있습니다.
폐의 급성 염증은 (일반적으로 폐렴에 대한 반응과 같이) 통증 민감성 신경 종말을 [14]가진 두정 흉막에 염증이 수반되지 않는 한 통증을 유발하지 않습니다.
급성 프로세스

급성 염증의 과정은 주로 상주 대식세포, 수지상세포, 조직세포, 쿠퍼세포 및 비만세포와 같은 관련 조직에 이미 존재하는 상주 면역세포에 의해 시작된다.이러한 세포는 패턴 인식 수용체(PRR)로 알려진 표면 수용체를 가지고 있으며, 이는 병원체 관련 분자 패턴(PAMPs)과 손상 관련 분자 패턴(DAMPs)의 두 가지 하위 분류를 인식한다.PAMP는 다양한 병원균과 연관되어 있지만 숙주 분자와는 구별이 가능한 화합물이다.DAMP는 숙주와 관련된 부상 및 세포 손상과 관련된 화합물입니다.
감염, 화상 또는 다른 부상의 시작 시, 이러한 세포는 활성화되고(PRR 중 하나는 PAMP 또는 DAMP를 인식함) 염증의 임상적 징후를 담당하는 염증 매개자를 방출합니다.혈관 확장과 그에 따른 혈류 증가는 홍조(고무)와 열량(열량) 증가를 일으킨다.혈관의 투과성이 증가하면 혈장 단백질과 액체가 조직(부종)으로 유출되어 붓기(종양)로 나타납니다.브래디키닌과 같은 방출된 매개체 중 일부는 통증에 대한 민감도를 증가시킨다.매개체 분자는 또한 백혈구(주로 호중구 및 대식세포)가 혈관 밖으로 흘러나와 조직으로 이동할 수 있도록 혈관을 변화시킨다.호중구는 [12]국소 세포에 의해 만들어진 화학적인 구배를 따라 부상 부위에 도달한다.기능 상실(functio laesa)은 아마도 통증에 대한 신경학적 반사의 결과일 것이다.
세포 유래 매개체 외에도, 미리 형성된 혈장 단백질로 구성된 여러 무세포 생화학적 캐스케이드 시스템이 염증 반응을 시작하고 전파하기 위해 병렬로 작용한다.여기에는 박테리아에 의해 활성화된 보체 시스템과 괴사에 의해 활성화된 응고 및 섬유소 분해 시스템(예: 화상, 외상)[12]이 포함됩니다.
급성 염증은 부상에 대한 첫 번째 방어선으로 간주될 수 있다.급성 염증 반응은 지속적인 자극을 필요로 한다.염증 매개자는 수명이 짧고 조직 내에서 빠르게 분해된다.따라서 자극이 [12]제거되면 급성 염증이 멈추기 시작한다.
만성
만성 염증은 몇 달에서 몇 [9]년 동안 지속되는 염증이다.대식세포, 림프구, 혈장세포는 급성 [9]염증에서 우세한 호중구와 대조적으로 만성 염증에서 우세하다.당뇨병, 심혈관 질환, 알레르기, 만성폐쇄성폐질환(COPD) 등이 만성 [9]염증으로 인한 질환의 예다.비만, 흡연, 스트레스, 불충분한 식단은 만성 [9]염증을 촉진하는 요인 중 하나이다.2014년 한 연구에 따르면 미국인의 60%가 적어도 한 가지 만성 염증 질환을 앓고 있으며, 42%가 [9]한 가지 이상의 만성 염증을 앓고 있다고 합니다.
기수 기호
만성 염증 중에 나타나는 일반적인 징후와 증상은 다음과 같습니다.[9]
- 몸의 통증, 관절통, 근육통
- 만성피로와 불면증
- 우울증, 불안, 기분 장애
- 변비, 설사, 역류 등의 위장 합병증
- 체중 증가 또는 감소
- 빈번한 감염
혈관 성분
혈관확장 및 투과성 향상
정의된 바와 같이 급성 염증은 염증 자극에 대한 면역 혈관 반응이다.이것은 급성 염증이 먼저 발생하는 혈관 단계로 크게 나눌 수 있고, 이어서 면역 세포를 포함하는 세포 단계(더 구체적으로 급성 환경에서 골수성 과립구)로 나눌 수 있다는 것을 의미합니다.급성 염증의 혈관 구성요소는 섬유소와 면역글로불린과 같은 중요한 단백질을 포함한 혈장액이 염증 조직으로 이동하는 것을 포함한다.
PAMPs와 접촉하면 조직 대식세포와 유방세포는 히스타민 및 세로토닌과 같은 혈관 활성 아민과 프로스타글란딘 E2 및 류코트리엔 B4와 같은 에이코사노이드를 방출하여 국소 혈관 구조를 개조한다.대식세포와 내피세포는 일산화질소를 방출한다.이러한 매개자는 혈관을 혈관화하고 투과성을 유지하며, 이는 혈장이 혈관으로부터 조직 공간으로 순분포되는 결과를 초래합니다.조직 내 체액의 수집이 증가하면 체액이 붓는다.이 유출된 조직액에는 보체, 리소자임, 항체 등 혈장의 다양한 항균 매개체가 포함되어 있어 미생물에 즉각적인 손상을 입힐 수 있으며 세포 단계에 대비하여 미생물을 옵소닌화시킵니다.염증 자극이 열상인 경우 혈소판, 응고제, 플라스민 및 키닌이 상처 부위를 응고시켜 지혈을 우선 제공할 수 있다.이러한 응고 매개자는 또한 나중에 식세포 괴사 제거 및 상처 복구를 돕기 위해 섬유소 격자 형태로 염증 조직 현장의 구조적 스테이징 프레임워크를 제공한다.유출된 조직액의 일부는 림프관에 의해 국소 림프절로 흘러들어와 박테리아를 씻어내 적응 면역계의 인식과 공격 단계를 시작한다.
급성 염증은 다양한 염증 매개자의 작용에 의해 유발되는 혈관 확장, 투과성 및 혈류 증가를 포함한 현저한 혈관 변화로 특징지어진다.혈관확장은 동맥 수준에서 먼저 일어나 모세혈관 수준까지 진행되며 혈액의 양이 순증하여 염증의 발열과 발열을 일으킨다.혈관의 투과성이 증가하면 혈장이 조직으로 이동하게 되고, 이로 인해 혈액 내 세포의 농도가 증가하기 때문에 정지된다. 즉, 세포로 채워진 확장된 혈관이 특징이다.정지상태는 백혈구가 조직으로의 유입에 중요한 과정인 내피를 따라 확장(이동)할 수 있게 한다.정상적인 혈액 흐름은 혈관 주변을 따라 있는 전단력이 혈액의 세포를 혈관 중앙으로 이동시키기 때문에 이를 막습니다.
플라즈마 캐스케이드 시스템
- 보체계가 활성화되면 옵소닌화, 화학작용 및 응집을 촉진하는 일련의 화학반응이 생성되어 MAC가 생성됩니다.
- 키닌계는 혈관 확장과 다른 물리적 염증 효과를 지속할 수 있는 단백질을 생성한다.
- 응고 시스템 또는 응고 캐스케이드: 손상 부위에 보호 단백질 메시를 형성합니다.
- 응고 시스템과 반대되는 작용을 하는 섬유 분해 시스템은 응고를 상쇄하고 다른 여러 개의 염증 매개자를 생성합니다.
플라즈마 유래 매개체
* 중복되지 않는 목록
| 이름. | 제작자 | 묘사 |
|---|---|---|
| 브라디키닌 | 키닌계 | 혈관확장, 혈관투과성, 평활근수축, 통증유발 등을 할 수 있는 혈관활성단백질. |
| C3 | 보완 시스템 | C3a와 C3b를 생성하기 위해 분해됩니다.C3a는 비만세포에 의한 히스타민 방출을 촉진하여 혈관확장을 일으킨다.C3b는 박테리아 세포벽에 결합할 수 있고 옵소닌 역할을 할 수 있는데, 이것은 침입자를 식세포증의 표적으로 표시합니다. |
| C5a | 보완 시스템 | 비만세포에 의한 히스타민 방출을 촉진하여 혈관확장을 일으킨다.그것은 또한 화학작용을 통해 염증 부위로 세포를 유도하는 화학 유인제 역할을 할 수 있다. |
| 계수 XII(해그먼 계수) | 간 | 구조 변화를 통해 콜라겐, 혈소판 또는 노출된 기저막에 의해 활성화될 때까지 비활성적으로 순환하는 단백질.활성화되면 염증과 관련된 세 가지 혈장 시스템, 즉 키닌 시스템, 섬유 분해 시스템 및 응고 시스템을 차례로 활성화할 수 있습니다. |
| 막공격복합체 | 보완 시스템 | 보체단백질 C5b, C6, C7, C8 및 C9의 복수단위의 복합체.이 범위의 보체 단백질의 조합과 활성화는 막 공격 복합체를 형성하고, 이것은 세균 세포벽에 삽입될 수 있고, 뒤이은 세균 사망과 함께 세포 용해를 일으킨다. |
| 플라스민 | 섬유 분해계 | 섬유소 응괴를 분해하고 보체 단백질 C3를 분해하여 인자 XII를 활성화 할 수 있습니다. |
| 트롬빈 | Coagulation 시스템 | 용해성 있는 혈장 단백질 fibrinogen는 혈전을 형성할 통합하는 불용성 피브린을 생산하는데 Cleaves.Thrombin 또한 세포에게 PAR1 수용체를 통해 chemokines이나 일산화 질소의 생성과 같은 몇몇 다른 염증 반응을 유발한 에 바인딩 할 수 있다. |
셀룰러 컴포넌트
휴대 기기며 보통 혈액 속에 있고 그 염증이 생긴 조직으로 움직여야 한다 넘쳐 흐름을 통해 염증을 돕기 위해 거주하는 백혈구를 포함하고 있다.력을 높이, 섭취하는 박테리아, 바이러스,와 세포 잔해 같은 어떤 행위이다.다른 사람들은 피해 병원성 침략자들 효소 과립을 배출한다.백혈구는 또한고 유지하도록 염증 반응을 개발하는 염증성 매개자들을 배출한다.반면에 만성 염증 monocytes와 림프구를 모두 같은 단핵 세포에 의해 일반적으로 급성 염증 과립구에 의해 조정된다.
백혈구 유출
다양한 백혈구, 특히 호중구,의 제안 및 염증의 유지에 연루되어 있다.이 세포들은 혈액의 일반적인 위치에서 부상 부위로 이동할 수 있어야 하며, 따라서 백혈구를 모집하고 적절한 위치로 유도하는 메커니즘이 존재한다.백혈구가 혈관을 통해 혈액에서 조직으로 이동하는 과정은 확장이라고 알려져 있으며, 크게 여러 단계로 나눌 수 있습니다.
- 백혈구 확대 및 내피 접착:일반적으로 중앙에 위치한 혈관 내의 백혈구는 혈관 [20]벽 쪽으로 말초적으로 이동한다.조직 내 활성화된 대식세포는 IL-1 및 TNFα와 같은 사이토카인을 방출하고, 이는 염증 조직과 내피 벽을 따라 구배를 형성하는 프로테오글리칸에 결합하는 화학카인의 생산을 이끈다.염증성 사이토카인은 내피세포 표면에 P-셀렉틴의 즉각적인 발현을 유도하고, P-셀렉틴은 백혈구 표면에 있는 탄수화물 배위자에 약하게 결합하여 결합이 만들어지고 끊어짐에 따라 내피 표면을 따라 "롤"하게 한다.손상된 세포에서 방출되는 사이토카인은 P-셀렉틴과 유사한 기능을 하는 내피 세포에서 E-셀렉틴의 발현을 유도한다.사이토카인은 또한 내피세포에서 ICAM-1 및 VCAM-1과 같은 인테그린 배위자의 발현을 유도하여 접착을 매개하고 백혈구를 더욱 느리게 한다.이러한 약결합 백혈구는 단단한 유착을 위해 백혈구 표면에서 인테그린을 활성화하는 각각의 G 단백질 결합 수용체를 통한 신호 전달 후 손상된 조직에서 생성된 케모카인에 의해 활성화되지 않으면 자유롭게 분리된다.이러한 활성화는 내피세포 표면에서 ICAM-1 및 VCAM-1에 대한 결합 인테그린 수용체의 친화력을 증가시켜 백혈구를 내피와 단단히 결합시킨다.
- 이형 천자 과정을 통해 내피를 통과하는 이행, 이른바 이행:케모카인 구배는 부착된 백혈구가 인접한 내피 세포 사이를 이동하도록 자극한다.내피세포는 수축하고 백혈구는 ICAM-1과 [20]같은 접착 분자를 사용하여 기저막을 통과하여 주변 조직으로 들어갑니다.
- 조직 내 백혈구의 화학 축성을 통한 이동:조직 간질체에 도달하는 백혈구는 발현된 인테그린과 CD44를 통해 세포외 매트릭스 단백질에 결합하여 사이트를 떠나는 것을 방지한다.다양한 분자는 예를 들어 C3a 또는 C5와 같은 화학 유인제로서 작용하며 백혈구가 염증의 근원을 향해 화학적인 구배를 따라 이동하도록 한다.
식세포증
세포상 호중구는 염증된 조직의 미생물들과 접촉한다.식세포는 비특이적 미생물 관련 분자 패턴(PAMP)에 대한 친화력과 효능을 가진 세포 표면 내 세포 패턴 인식 수용체(PRR)를 발현한다.세포내 PRR에 결합하고 식세포증을 시작하는 대부분의 PAMP는 만난과 β-글루칸, 리포다당류(LPS), 펩티도글리칸, 표면 단백질과 같은 복합 탄수화물을 포함한 세포벽 성분이다.식세포의 세포내 PRR은 이러한 분자 패턴을 반영하며, C형 렉틴 수용체는 만난 및 β-글루칸에 결합하고 스캐빈저 수용체는 LPS에 결합한다.
세포내 PRR 결합 시 PR-PAMP 착체를 포함한 혈장막 및 미생물을 세포내포화시키는 방법으로 혈장막에 인접한 액틴-미오신 세포골격 전위가 이루어진다.포스파티딜이노시톨 및 Vps34-Vps15-Beclin1 신호전달경로는 세포내 리소좀에 내구화된 파고좀을 전달하고, 파고좀과 리소좀의 융합으로 파골리소좀이 생성된다.식세포 내의 활성 산소종, 초산화물 및 차아염소산 표백제는 식세포 내부의 미생물을 죽인다.
식세포효율은 옵소닌화를 통해 향상될 수 있다.혈장유래는 C3b를 보완하고 혈관단계에서 염증조직으로 배어나오는 항체는 미생물항원과 결합하여 코팅한다.식세포는 세포내 PRR과 더불어 항체와 C3b에 각각 결합하는 옵소닌 수용체 Fc 수용체 및 보체 수용체 1(CR1)을 발현한다.세포내 PRR과 옵소닌 수용체의 동시 자극은 식세포 과정의 효과를 증가시켜 감염제의 리소좀 제거를 강화한다.
세포에서 파생된 매개자
* 중복되지 않는 목록
| 이름. | 유형 | 원천 | 묘사 |
|---|---|---|---|
| 리소좀과립 | 효소 | 과립구 | 이 세포들은 많은 기능을 수행하는 다양한 효소를 포함하고 있다.과립은 함량에 따라 특이성 또는 아즈로필성으로 분류될 수 있으며, 많은 물질을 분해할 수 있으며, 그 중 일부는 이러한 효소가 염증 매개체 역할을 할 수 있는 혈장 유래 단백질일 수 있다. |
| GM-CSF | 당단백질 | 대식세포, 단구, T세포, B세포 및 조직거주세포 | GM-CSF의 증가는 염증성 관절염, 골관절염, 대장염 천식, 비만, COVID-19의 염증에 기여하는 것으로 나타났다. |
| 히스타민 | 모노아민 | 비만세포 및 호염기구 | 미리 형성된 과립에 저장된 히스타민은 많은 자극에 반응하여 방출된다.동맥 확장, 정맥 투과성 증가, 다양한 장기 특이적 효과의 원인이 됩니다. |
| IFN - if | 사이토카인 | T셀, NK셀 | 항바이러스성, 면역조절성, 항종양성.이 간섭자는 원래 대식세포 활성화 인자로 불리며 특히 만성 염증 유지에 중요하다. |
| IL-6 | 사이토카인과 미오카인 | 대식세포, 골아세포, 지방세포 및 평활근세포(사이토카인)골격근세포(myokine) | 병원체 관련 분자 패턴(PAMPs)에 반응하여 대식세포에 의해 분비되는 염증성 사이토카인, 지방세포에 의해 분비되는 염증성 사이토카인, 특히 비만에서 운동에 반응하여 골격근세포에 의해 분비되는 항염증성 미오카인. |
| IL-8 | 케모카인 | 주로 대식세포 | 단구 및 호산구에 약한 영향을 미치는 호중구의 활성화 및 화학적 유인. |
| 류코트리엔 B4 | 에이코사노이드 | 백혈구, 암세포 | 백혈구 접착과 활성화를 매개하여 내피와 결합하고 내피를 가로질러 이동할 수 있습니다.호중구에서는 또한 강력한 화학 유인제이며, 이러한 세포에 의한 활성 산소종의 형성과 리소좀 효소의 방출을 유도할 수 있다. |
| LTC4, LTD4 | 에이코사노이드 | 호산구, 비만세포, 대식세포 | 이 세 가지 시스테인이 함유된 류코트리엔은 폐 기도를 수축시키고 미세혈관 투과성을 증가시키며 점액 분비를 촉진하고 폐, 피부, 코, 눈 및 기타 조직에서 호산구 기반 염증을 촉진합니다. |
| 5-옥소이코사테트라엔산 | 에이코사노이드 | 백혈구, 암세포 | 호중구 화학작용, 리소좀 효소 방출 및 활성산소종 형성의 강력한 자극제, 단구 화학작용, 그리고 훨씬 더 큰 효력 호산구 화학작용, 리소좀 효소 방출 및 활성산소종 형성의 강력한 자극제. |
| 5-HETE | 에이코사노이드 | 백혈구 | 5-Oxo-eicosatetraenic acid의 대사 전구체로서 호중구 화학작용, 리소좀 효소 방출 및 활성산소종 형성, 단구 화학작용, 호산구 화학작용, 리소좀 효소 방출 및 활성산소종 형성의 덜 강력한 자극제이다. |
| 프로스타글란딘 | 에이코사노이드 | 돛대 세포 | 혈관 확장, 발열 및 통증을 일으킬 수 있는 지질 그룹입니다. |
| 산화질소 | 가용성 가스 | 대식세포, 내피세포, 일부 뉴런 | 강력한 혈관 확장제, 평활근 이완, 혈소판 응집 감소, 백혈구 보충, 고농도에서의 직접 항균 활성. |
| TNF-α 및 IL-1 | 사이토카인 | 주로 대식세포 | 둘 다 발열, 사이토카인 생성, 내피 유전자 조절, 화학 작용, 백혈구 부착, 섬유아세포 활성화와 같은 많은 유사한 염증 반응을 유도하기 위해 다양한 세포에 영향을 미칩니다.식욕부진 및 심박수 증가 등 염증의 전신적 영향에 대한 책임이 있습니다.TNF-α는 골아세포 분화를 억제합니다. |
| 트립타아제 | 효소 | 돛대 셀 | 이 세린단백질가수분해효소는 비만세포에 독점적으로 저장되며, 비만세포 [21][22][23]활성화 중에 히스타민과 함께 분비되는 것으로 여겨진다. |
형태학적 패턴
급성 및 만성 염증의 특정 패턴은 상피 표면에 염증이 발생하거나 화농균이 관여하는 등 신체에서 발생하는 특정 상황에서 나타난다.
- 육아종성 염증:육아종의 형성이 특징인 이들은 결핵, 나병, 육종, 매독 등 제한적이지만 다양한 질병의 결과물이다.
- 섬유소 염증:혈관 투과성의 큰 증가를 초래하는 염증은 혈관을 통해 섬유소가 통과할 수 있게 한다.암세포와 [12]같은 적절한 프로응고 자극이 존재할 경우 섬유소 삼출물이 퇴적된다.이것은 장액막 사이에서 섬유소 삼출액이 흉터로 전환되어 기능을 제한할 수 있는 장액강에서 흔히 볼 수 있다.그 퇴적물은 때때로 의사 막 시트를 형성한다.장의 염증(의사성 대장염) 중에는 의사성 관이 형성될 수 있다.
- 화농성 염증:호중구, 사세포, 액체로 이루어진 고름이 많이 생기는 염증.포도상구균 등의 화농균에 의한 감염이 이러한 염증의 특징입니다.주변 조직으로 둘러싸인 크고 국소적인 고름을 농양이라고 한다.
- 장액성 염증:일반적으로 장막의 중피세포에 의해 생성되는 비점성 장액액의 대량 유출로 특징지어지지만 혈장에서 파생될 수 있습니다.피부 물집은 이러한 염증 패턴의 예시이다.
- 궤양성 염증:상피 근처에서 발생하는 염증은 표면에서 조직을 괴사시켜 하층을 노출시킬 수 있습니다.상피에서의 후속 발굴은 궤양으로 알려져 있다.
장애
염증성 이상은 다양한 인간 질병의 근저에 있는 많은 질병 집단이다.면역체계는 알레르기 반응과 일부 근병증 모두에서 증명된 것처럼 염증성 질환과 관련이 있으며, 많은 면역체계 질환이 비정상적인 염증을 일으킨다.염증 과정에서 원인이 되는 비면역성 질환으로는 암, 아테롬성 동맥경화증, 허혈성 심장질환 [12]등이 있다.
염증과 관련된 장애의 예는 다음과 같습니다.
아테롬성 동맥경화증
아테롬성 동맥경화증은 이전에는 싱거운 지질 저장 질환으로 여겨졌지만 실제로는 지속적인 염증 반응을 수반한다.최근의 기초과학의 발전은 아테롬성 동맥경화의 모든 단계를 시작에서 진행에 이르기까지 그리고 궁극적으로 그것으로부터의 혈전 합병증을 중재하는 데 있어서 염증의 근본적인 역할을 확립했다.이러한 새로운 발견들은 위험인자와 무발생의 메커니즘 사이의 중요한 연결고리를 제공한다.임상 연구는 아테롬성 동맥경화증의 새로운 염증 생물학이 인간 환자에게 직접적으로 적용된다는 것을 보여주었다.염증 지표의 증가는 심근 손상과는 별개로 급성 관상동맥증후군 환자의 결과를 예측한다.또한 염증 마커 C-반응성 단백질의 수치로 나타나는 저급 만성 염증은 아테롬성 동맥경화 합병증의 위험을 전진적으로 정의하여 기존의 위험인자에 의해 제공되는 예후 정보를 추가한다.게다가, 관상동맥의 위험을 줄이는 어떤 치료법들은 또한 염증을 제한한다.스타틴과 함께 지질을 낮추는 경우, 항염증 효과는 저밀도 리포단백질 수치 감소와 상관관계가 없는 것으로 보인다.염증에 대한 이러한 새로운 통찰은 아테롬성 동맥경화의 병인학과 위험 계층화 및 아테롬성 동맥경화 [24]치료의 표적에 기여한다.
알레르기
공식적으로 타입 1 과민증으로 알려진 알레르기 반응은 염증, 혈관 확장, 신경 자극을 유발하는 부적절한 면역 반응의 결과입니다.대표적인 예가 꽃가루 알레르기인데, 이는 알레르기 항원에 대한 비만세포의 과민반응에 의해 발생한다.미리 감응된 비만 세포는 히스타민과 같은 혈관 활성 화학 물질을 방출하고 탈과민화함으로써 반응한다.이러한 화학물질은 혈관 확장, 소염 분자의 생성, 사이토카인 방출 및 백혈구의 [12]유입으로 특징지어지는 과도한 염증 반응을 전파합니다.심한 염증 반응은 과민증으로 알려진 전신 반응으로 성숙할 수 있다.
근병증
염증성 근병증은 면역체계가 근육의 구성 요소를 부적절하게 공격하여 근육 염증의 징후를 일으키면서 발생한다.그것들은 전신 경화증과 같은 다른 면역 질환과 함께 발생할 수 있으며 피부 근염, 다발성 근염,[12] 포접체 근염을 포함한다.
백혈구 결함
백혈구가 염증의 발생과 전파에 중추적인 역할을 하기 때문에 백혈구 기능의 결함은 종종 염증 방어 능력 저하를 초래하고 [12]그에 따른 감염에 대한 취약성을 초래한다.기능 장애가 있는 백혈구는 표면 수용체 돌연변이, 소화 박테리아(체디아크-)로 인해 혈관에 올바르게 결합하지 못할 수 있다.또는 살균제(만성 육아종 질환)를 생산한다.또한, 골수에 영향을 미치는 질병은 백혈구 이상을 유발하거나 백혈구를 적게 발생시킬 수 있다.
약리학
특정 약물이나 외인성 화합물은 염증에 영향을 미치는 것으로 알려져 있다.예를 들어 비타민 A 결핍은 염증 [25]반응을 증가시키고, 항염증제는 염증성 에이코사노이드를 생성하는 효소를 억제함으로써 특이하게 작용한다.또한 코카인 및 엑스터시와 같은 특정 불법 약물은 염증과 밀접하게 관련된 전사 인자(예: NF-δB)[26][27]를 활성화함으로써 일부 해로운 영향을 미칠 수 있다.
암
염증은 종양 주변의 미세 환경을 조정하여 증식, 생존 및 이동에 [28]기여합니다.암세포는 셀렉틴, 케모카인 및 그 수용체를 침입, 이동, [29]전이를 위해 사용한다.반면 면역체계의 많은 세포들은 암을 [30]억제하면서 암 면역학에 기여한다.세포 발달에 중요한 영향을 미치는 스테로이드 호르몬 수용체와 NF-δB와 같은 염증에 중요한 역할을 하는 전사 인자 사이의 분자 교차는 암세포에 [31]대한 염증 자극의 가장 중요한 영향의 일부를 중재할 수 있다.세포에서 스테로이드 호르몬의 효과에 영향을 미치는 염증의 매개자의 이러한 능력은 발암에 영향을 미칠 가능성이 매우 높다.한편, 많은 스테로이드 호르몬 수용체의 모듈러 특성으로 인해, 이 상호작용은 특정 세포 유형의 특정 단백질 도메인을 타겟팅함으로써 암 진행을 방해하는 방법을 제공할 수 있다.이러한 접근은 관심 종양과 무관한 부작용을 제한하고 유기체의 중요한 항상성 기능과 발달 과정을 보존하는 데 도움을 줄 수 있습니다.
2009년의 리뷰에 따르면, 최근 데이터는 암 관련 염증([32]CRI)이 암세포에 무작위 유전자 변화를 축적할 수 있음을 시사한다.
암에서의 역할
1863년, 루돌프 비르쵸는 암의 기원이 만성 [29][33]염증 부위라고 가설을 세웠다.현재 만성 염증은 인간 [33][34]암의 약 15~25%에 기여하는 것으로 추정된다.
암 매개체 및 DNA 손상
염증성 매개자는 혈관 및/또는 세포에 작용하여 염증 [35]반응을 촉진하는 전달자이다.종양의 원인이 되는 염증 매개체에는 프로스타글란딘, IL-1β, TNF-α, IL-6 및 IL-15 등의 염증성 사이토카인 및 IL-8 및 GRO-alpha [36][33]등의 케모카인이 포함된다.이러한 선동적인 중재자 등은 증식과 [29][36]생존을 촉진하는 환경을 조성합니다.
염증은 또한 다양한 세포 내 염증 [29][36][33]매개자에 의한 활성산소종(ROS)의 유도로 인해 DNA 손상을 일으킨다.또한 백혈구 및 염증 부위에 흡착된 다른 식세포는 ROS 및 반응성질소종(RNS)의 생성을 통해 증식세포의 DNA 손상을 유발한다.ROS 및 RNS는 일반적으로 이들 세포에 의해 생성되어 [29]감염과 싸운다.ROS만 20가지 이상의 DNA [37]손상을 일으킨다.산화적 DNA 손상은 돌연변이와 후생유전적 [39][33][40]변화를 일으킨다[38].RNS는 또한 돌연변이 유발 DNA [41]손상을 일으킨다.
정상세포는 장기간에 걸친 만성염증 중에 DNA 손상을 자주 받으면 발암을 일으켜 암세포가 될 수 있다.DNA 손상은 부정확한 복구로 인해 유전적 돌연변이를 일으킬 수 있습니다.또한, DNA 복구 과정의 실수는 후생유전학적 [33][36][40]변화를 일으킬 수 있다.체세포 증식 중에 복제되고 선택적 이점을 제공하는 돌연변이와 후생유전적 변화는 발암성일 수 있다.
인간 암 조직의 게놈 전체 분석에 따르면 하나의 전형적인 암세포가 코딩 영역에 약 100개의 돌연변이를 가지고 있을 수 있으며, 그 중 10-20개는 암 발병에 [33]기여하는 "운전자 돌연변이"이다.그러나 만성 염증은 종종 돌연변이보다 더 흔한 DNA 메틸화와 같은 후생유전학적 변화도 일으킨다.일반적으로 수백에서 수천 개의 유전자가 암세포에서 메틸화된다.크로마틴의 산화손상부위는 DNA메틸전달효소(DNMTs), 히스톤탈아세틸화효소(SIRT1) 및 히스톤메틸전달효소(EZH2)를 포함한 복합체를 모집할 수 있어 DNA메틸화를 [33][42][43]유도할 수 있다.프로모터 영역에 있는 CpG 섬의 DNA 메틸화는 하류 유전자의 침묵을 유발할 수 있다(CpG 부위와 암에서의 전사 조절 참조).특히, DNA 복구 유전자는 다양한 암에서 메틸화에 의해 자주 불활성화됩니다(암에서 DNA 복구 유전자의 과메틸화 참조).2018년[44] 보고서는 두 가지 다른 유형의 암에 진행 중인 돌연변이와 후생유전적 변화의 상대적 중요성을 평가했다.이 보고서는 (염증과 [45]관련된) 위암 발생에 있어 후생유전적 변화가 돌연변이보다 훨씬 더 중요하다는 것을 보여주었다.그러나 돌연변이와 후생유전적 변화는 식도 편평상피암(담배 화학물질 및 알코올 대사의 산물인 아세트알데히드와 관련됨)을 발생시키는 데 있어 거의 동일한 중요성을 지니고 있었다.
HIV 및 에이즈
HIV 감염은 심각한 면역 결핍의 발달뿐만 아니라 지속적인 염증과 면역 [46][47][48]활성화에 의해서도 특징지어지는 것이 오랫동안 알려져 왔다.상당한 증거들은 면역 기능 장애, 노화 관련 질병의 조기 출현, 그리고 면역 [46][49]결핍의 중요한 동인으로서의 만성 염증을 암시한다.현재 많은 사람들이 HIV 감염을 진화하는 바이러스로 인한 면역 결핍뿐만 아니라 만성 염증 [50]질환으로 간주하고 있다.HIV 감염자에게 효과적인 항레트로바이러스 치료(ART)와 바이러스 감염자의 효과적인 억제 후에도 만성 염증이 지속된다.동물 연구는 또한 면역 활성화와 진행성 세포 면역 결핍 사이의 관계를 뒷받침한다: 천연 비인간 영장류 숙주인 수티 망가베이의 SIVsm 감염은 높은 수준의 바이러스 복제를 유발하지만 [51][52]질병의 증거는 제한적이다.이러한 병원성의 부족은 염증, 면역 활성화 및 세포 증식을 동반한다.이와는 대조적으로, 붉은털 마카크의 실험적인 SIVsm 감염은 면역 활성화와 인간 HIV [53]감염과 많은 유사점을 가진 에이즈 유사 질병을 일으킨다.
CD4 T세포가 어떻게 고갈되고 만성 염증 및 면역 활성화가 어떻게 유도되는지를 설명하는 것은 HIV의 병인을 이해하는 데 핵심이 됩니다.이것은 국립 보건원 에이즈 연구 사무소의 HIV 연구소의 것입니다.Office of AIDS Research of National Institute of Health)입니다.최근 연구에 따르면 프로그램된 세포사멸의 매우 염증적인 형태인 카스파아제-1 매개 발열증([54][55][56]caspase-1-mediated pyroptosis)이 CD4 T세포의 고갈과 HIV에 의한 염증을 촉진하는 것으로 나타났다.이것들은 에이즈로 HIV 질병의 진행을 촉진하는 두 가지 특징적인 사건이다. 화농증은 죽어가는 CD4 T 세포와 다른 면역 세포(대식세포와 호중구 포함)가 감염된 림프 조직으로 더 많은 세포를 모집하는 염증 신호를 방출하는 병원성 악순환을 일으키는 것으로 보인다.이 염증 반응의 피드포워드 특성은 만성 염증과 조직 손상을 [57]일으킨다.CD4 T세포의 고갈과 만성 염증을 일으키는 주요 메커니즘으로 발열증을 식별하는 것은 새로운 치료 기회, 즉 발열 경로를 제어하는 카스파아제-1을 제공한다.이와 관련하여 인체임상시험 [58]2단계에서 이미 안전성이 입증되고 내성이 양호한 것으로 판명된 카스파아제 1억제제 VX-765를 [54]추가하여 HIV 감염 인간 림프조직에서 CD4 T세포의 발열 및 IL-1β, IL-18 등의 소염성 사이토카인의 분비를 차단할 수 있다.이러한 발견들은 바이러스가 아닌 숙주를 대상으로 하는 완전히 새로운 종류의 "항 에이즈" 치료법의 개발을 촉진할 수 있다.이러한 약물은 ART와 함께 사용될 것이 거의 확실합니다.바이러스의 복제를 억제하는 대신 바이러스의 "내성"을 촉진함으로써, VX-765 또는 관련 약물은 질병 부족, CD4 T 세포 수 감소 및 만성 염증을 초래한 종별 렌티바이러스에 감염된 여러 원숭이 숙주(예: 수티 망가베이)에서 발생하는 진화적 용액을 모방할 수 있다.
결의안
염증 반응은 [12]조직에 대한 불필요한 "방관자" 손상을 방지하기 위해 더 이상 필요하지 않을 때 능동적으로 종료되어야 한다.그렇게 하지 않으면 만성 염증이 생기고 세포가 파괴된다.염증의 분해는 다른 조직의 다른 메커니즘에 의해 일어난다.염증을 멈추게 하는 메커니즘은 다음과 같습니다.[12][59]
- 생체 내 염증 매개체의 짧은 반감기.
- 대식세포에서[60][61][62] TGF(Transforming Growth Factor) 베타 생성 및 출시
- 인터류킨 10(IL-10)[63]의 제조 및 방출
- 리옥신, 레졸빈, 마레신, 신경보호제[64][65] 등의 항염증 특화 전분해 매개제 생산
- 류코트리엔과 같은 소염성 분자의 하향 조절
- 인터류킨1 수용체 길항제 또는 수용성 종양 괴사인자 수용체(TNFR)와 같은 항염증 분자의 상향 조절
- 항염증[66] 세포의 아포토시스
- 수용체의 둔감화.
- 세포외매트릭스(ECM)[67][68]와의 상호작용으로 염증 영역의 세포 생존 증가
- 고농도의 리간드에 의한 수용체 활성의 하향 조절
- 매트릭스 금속단백질가수분해효소(MMP)에 의한 케모카인의 분해는 항염증인자의 [69]생성을 초래할 수 있다.
급성 염증은 보통 이해하기 힘든 메커니즘으로 해결된다.이제 새로운 증거는 염증 반응이 시작된 후 처음 몇 시간 안에 능동적이고 조정된 해결 프로그램이 시작된다는 것을 암시한다.조직에 들어간 후 과립구는 아라키돈산 유래 프로스타글란딘과 류코트라이엔의 리옥신으로의 전환을 촉진하고, 이는 종단 순서를 개시한다.호중구 모집은 따라서 중단되고 아포토시스에 의한 프로그램화된 죽음이 이루어진다.이러한 현상은 오메가-3 다불포화 지방산으로부터 레졸빈과 프로텍틴의 생합성과 일치하며, 이는 아포토시스를 개시함으로써 호중구 침투 기간을 심각하게 단축시킨다.그 결과 아포토시스 호중구는 대식세포에 의해 식세포증을 일으켜 호중구 클리어런스 및 성장인자β1과 같은 항염증성 및 회복성 사이토카인의 방출을 초래한다.항염증 프로그램은 대식세포가 림프관을 [70]통해 떠나면서 끝난다.
--
우울증에 대한 연관성
염증과 [71]우울증 사이의 연관성에 대한 증거가 있다.염증 과정은 부정적인 인식이나 스트레스, 폭력 또는 박탈과 같은 결과에 의해 유발될 수 있습니다.따라서,[72][73][dubious ] 부정적인 인식은 결국 우울증을 초래할 수 있는 염증을 유발할 수 있다.또 사이토카인의 증가로 염증이 우울증을 유발해 뇌를 '병'[74] 모드로 만든다는 증거도 늘고 있다.몸이 아픈 전형적인 증상인 무기력증은 우울증을 특징짓는 행동에서 큰 중복을 보인다.사이토카인의 수치는 양극성 장애를 가진 사람들의 우울증 증상 동안 급격히 증가하고 [75]완화되는 동안 감소하는 경향이 있다.또한 항우울제 외에 항염증제를 복용하면 증상이 현저하게 개선될 뿐만 아니라 [76]치료에 긍정적인 반응을 보이는 피험자의 비율도 증가한다는 것이 임상실험에서 입증되었다.심각한 우울증을 유발하는 염증은 바이러스, 박테리아, [77]심지어 기생충에 의해 야기되는 흔한 감염에 의해 야기될 수 있다.
섬망과의 연관성
COVID-19 [78]환자의 CRP를 조사한 최근 종적 연구 결과에 기초하여 염증과 섬망 사이의 연관성에 대한 증거가 있다.
전신 효과
전염성 유기체는 순환계나 림프계를 통해 신체의 다른 부분으로 확산될 수 있는 즉시 조직의 경계를 벗어날 수 있다.만약 생명체가 급성 염증의 작용에 의해 억제되지 않는다면, 그것은 근처의 림프관을 통해 림프계에 접근할 수 있다.림프관의 감염은 림프관염, 림프절 감염은 림프관염으로 알려져 있다.림프절이 모든 병원체를 파괴할 수 없을 때, 감염은 더 확산된다.병원체는 림프액 배수를 통해 순환계로의 혈류에 접근할 수 있다.
염증이 숙주를 압도하면 전신 염증 반응 증후군을 진단합니다.감염에 의한 경우에는 패혈증이라는 용어가 사용되며, 세균성 패혈증에는 균혈증, 바이러스성 패혈증에는 바이러스성 패혈증이라는 용어가 사용됩니다.혈관 확장과 장기 기능 장애는 패혈증 쇼크와 [79]사망을 초래할 수 있는 광범위한 감염과 관련된 심각한 문제이다.
급성단백질
염증은 또한 급성상 단백질의 높은 전신 수준에 의해 특징지어진다.급성 염증에서는 이 단백질들이 유익함을 증명하지만, 만성 염증에서는 아밀로이드증의 [12]원인이 될 수 있다.이러한 단백질에는 C-반응 단백질, 혈청 아밀로이드 A 및 혈청 아밀로이드 P가 포함되며,[12] 이는 다음을 포함한 다양한 전신 효과를 일으킨다.
백혈구수
염증은 종종 체내에 존재하는 백혈구의 수에 영향을 미친다.
- 백혈구 증가증은 감염에 의해 유발되는 염증 중에 종종 나타나며, 혈액 내 백혈구, 특히 미성숙한 세포의 양이 크게 증가한다.백혈구 수는 보통 마이크로리터당 15,000 - 20,000 세포로 증가하지만, 극단적인 경우 [12]마이크로리터당 10,000 세포에 근접할 수 있다.박테리아 감염은 보통 호중구를 증가시켜 호중구를 만드는 반면, 천식, 꽃가루 알레르기, 기생충 침입과 같은 질병은 호산구의 증가를 초래하여 호산구증을 [12]일으킨다.
- 백혈구 감소증은 바이러스 감염, 리케치아 감염, 원생동물, 결핵, [12]그리고 암을 포함한 특정 감염과 질병에 의해 유발될 수 있습니다.
인터류킨과 비만
인터류킨(IL)의 발견으로 전신 염증의 개념이 발달했다.관련된 과정이 조직 염증과 동일하지만 전신 염증은 특정 조직에 국한되지 않고 내피와 다른 장기 시스템과 관련된다.
만성 염증은 [80][81]비만에서 널리 관찰된다.비만인 사람들은 일반적으로 다음을 포함한 [82][83]많은 높은 염증 마커를 가지고 있습니다.
저급 만성 염증은 TNF-α, IL-6, [86]CRP와 같은 사이토카인의 전신 농도가 2~3배 증가하는 것이 특징이다.허리 둘레는 전신 염증 [87]반응과 상당한 상관관계가 있다.
백색 지방 조직의 손실은 염증 [80]표시의 수준을 감소시킨다.2017년 현재 인슐린 저항성, 2형 당뇨병 및 아테롬성 동맥경화증과의 전신 염증 관련성은 예비 연구 중에 있으나 그러한 [88]관계를 확인하기 위한 엄격한 임상시험이 수행되지는 않았다.
CRP(C-reactive protein, CRP)는 비만인 사람에게서 높은 수준으로 생성되며, 심혈관 [89]질환의 위험을 증가시킬 수 있다.
결과
특정 상황에서의 결과는 부상이 발생한 조직과 부상의 원인이 되는 유해 물질에 의해 결정됩니다.다음은 [12]염증이 발생할 수 있는 결과입니다.
- 결의안
염증이 생긴 조직을 정상 상태로 완전히 복구하는 것혈관확장, 화학생성, 백혈구 침윤 등의 염증조치가 중단되고 손상된 실질세포가 재생된다.이것은 보통 제한적이거나 단시간적인 염증이 발생했을 때 발생한다. - 섬유증
많은 양의 조직 파괴 또는 재생 불가능한 조직의 손상은 신체에 의해 완전히 재생될 수 없습니다.섬유상 흉터는 이러한 손상 부위에서 발생하며 주로 콜라겐으로 구성된 흉터를 형성합니다.흉터에는 실질 세포와 같은 특수 구조가 포함되어 있지 않기 때문에 기능 장애가 발생할 수 있습니다. - 농양 형성
고름, 죽은 백혈구를 포함한 불투명한 액체 및 파괴된 세포로부터의 일반적인 파편을 가진 박테리아를 포함한 캐비티를 형성한다. - 만성 염증
급성 염증에서 유해 물질이 지속되면 만성 염증이 뒤따른다.며칠, 몇 달, 심지어 몇 년 동안 지속되는 염증으로 특징지어지는 이 과정은 만성적인 상처의 형성을 초래할 수 있다.만성 염증은 손상된 조직에 대식세포가 지배적으로 존재하는 것이 특징이다.이 세포들은 인체의 강력한 방어제이지만, 활성 산소종을 포함한 독소는 침입제뿐만 아니라 유기체 자신의 조직에도 해롭다.그 결과 만성 염증은 거의 항상 조직 파괴를 동반한다.
예
염증은 보통 아래와 같이 접미사 "itis"를 추가하여 나타냅니다.그러나 천식이나 폐렴과 같은 일부 질환은 이 관례를 따르지 않습니다.더 많은 예시는 List of inviations(염증 유형 목록)에서 확인할 수 있습니다.
「 」를 참조해 주세요.
메모들
레퍼런스
- ^ Ferrero-Miliani L, Nielsen OH, Andersen PS, Girardin SE (February 2007). "Chronic inflammation: importance of NOD2 and NALP3 in interleukin-1beta generation". Clinical and Experimental Immunology. 147 (2): 227–35. doi:10.1111/j.1365-2249.2006.03261.x. PMC 1810472. PMID 17223962.
- ^ Chen, Linlin; Deng, Huidan; Cui, Hengmin; Fang, Jing; Zuo, Zhicai; Deng, Junliang; Li, Yinglun; Wang, Xun; Zhao, Ling (14 December 2017). "Inflammatory responses and inflammation-associated diseases in organs". Oncotarget. Impact Journals, LLC. 9 (6): 7204–7218. doi:10.18632/oncotarget.23208. ISSN 1949-2553. S2CID 3571245.
- ^ Abbas AB, Lichtman AH (2009). "Ch.2 Innate Immunity". In Saunders (Elsevier) (ed.). Basic Immunology. Functions and disorders of the immune system (3rd ed.). ISBN 978-1-4160-4688-2.
- ^ Berger A (August 2000). "Th1 and Th2 responses: what are they?". BMJ. 321 (7258): 424. doi:10.1136/bmj.321.7258.424. PMC 27457. PMID 10938051.
- ^ a b c d Hall J (2011). Guyton and Hall textbook of medical physiology (12th ed.). Philadelphia, Pa.: Saunders/Elsevier. p. 428. ISBN 978-1-4160-4574-8.
- ^ Granger DN, Senchenkova E (2010). "Leukocyte–Endothelial Cell Adhesion". Inflammation and the Microcirculation. Integrated Systems Physiology—From Cell to Function. Morgan & Claypool Life Sciences.
- ^ Piira OP, Miettinen JA, Hautala AJ, Huikuri HV, Tulppo MP (October 2013). "Physiological responses to emotional excitement in healthy subjects and patients with coronary artery disease". Autonomic Neuroscience. 177 (2): 280–5. doi:10.1016/j.autneu.2013.06.001. PMID 23916871. S2CID 19823098.
- ^ a b c d e f Hannoodee S, Nasuruddin DN (2020). "Acute Inflammatory Response". StatPearls. PMID 32310543.
- ^ a b c d e f g Pahwa R, Goyal A, Bansal P, Jialal I (28 September 2021). "Chronic Inflammation". StatPearls. National Institutes of Health - National Library of Medicine. PMID 29630225.
- ^ a b Stedman's Medical Dictionary (Twenty-fifth ed.). Williams & Wilkins. 1990.
- ^ Rather LJ (March 1971). "Disturbance of function (functio laesa): the legendary fifth cardinal sign of inflammation, added by Galen to the four cardinal signs of Celsus". Bulletin of the New York Academy of Medicine. 47 (3): 303–22. PMC 1749862. PMID 5276838.
- ^ a b c d e f g h i j k l m n o p q r Robbins SL, Cotran RS, Kumar V, Collins T (1998). Robbins Pathologic Basis of Disease. Philadelphia: W.B Saunders Company. ISBN 978-0-7216-7335-6.
- ^ Kumar R, Clermont G, Vodovotz Y, Chow CC (September 2004). "The dynamics of acute inflammation". Journal of Theoretical Biology. 230 (2): 145–55. arXiv:q-bio/0404034. Bibcode:2004PhDT.......405K. doi:10.1016/j.jtbi.2004.04.044. PMID 15321710. S2CID 16992741.
- ^ a b c d Chandrasoma P, Taylor CR (2005). "Part A. "General Pathology", Section II. "The Host Response to Injury", Chapter 3. "The Acute Inflammatory Response", sub-section "Cardinal Clinical Signs"". Concise Pathology (3rd ed.). McGraw-Hill. ISBN 978-0-8385-1499-3. OCLC 150148447. Retrieved 5 November 2008.
- ^ Werner R (2009). A massage Therapist Guide to Pathology (4th ed.). Wolters Kluwer. ISBN 978-0781769198.
- ^ Vogel WH, Berke A (2009). Brief History of Vision and Ocular Medicine. Kugler Publications. p. 97. ISBN 978-90-6299-220-1.
- ^ Porth C (2007). Essentials of pahtophysiology: concepts of altered health states. Hagerstown, MD: Lippincott Williams & Wilkins. p. 270. ISBN 978-0-7817-7087-3.
- ^ Dormandy T (2006). The worst of evils: man's fight against pain. New Haven, Conn: Yale University Press. pp. 22. ISBN 978-0-300-11322-8.
- ^ Robbins S, Cotran R, Kumar V, Abbas A, Aster J (2020). Pathologic basis of disease (10th ed.). Philadelphia, PA: Saunders Elsevier.
- ^ a b Herrington S (2014). Muir's Textbook of Pathology (15th ed.). CRC Press. p. 59. ISBN 978-1444184990.
- ^ Carstens E, Akiyama T, Cevikbas F, Kempkes C, Buhl T, Mess C, Buddenkotte J, Steinhoff M (2014). "Role of Interleukin-31 and Oncostatin M in Itch and Neuroimmune Communication". In Carstens M, Akiyama T (eds.). Itch: Mechanisms and Treatment. Frontiers in Neuroscience. Boca Raton (FL): CRC Press/Taylor & Francis. ISBN 9781466505438. PMID 24830021.
- ^ Caughey GH (June 2007). "Mast cell tryptases and chymases in inflammation and host defense". Immunological Reviews. 217 (1): 141–54. doi:10.1111/j.1600-065x.2007.00509.x. PMC 2275918. PMID 17498057.
- ^ Caughey GH (May 2016). "Mast cell proteases as pharmacological targets". European Journal of Pharmacology. Pharmacological modulation of Mast cells and Basophils. 778: 44–55. doi:10.1016/j.ejphar.2015.04.045. PMC 4636979. PMID 25958181.
- ^ Libby P (19–26 December 2002). "Inflammation in atherosclerosis". Nature. 420 (6917): 868–74. Bibcode:2002Natur.420..868L. doi:10.1038/nature01323. PMID 12490960. S2CID 407449.
- ^ Wiedermann U, Chen XJ, Enerbäck L, Hanson LA, Kahu H, Dahlgren UI (December 1996). "Vitamin A deficiency increases inflammatory responses". Scandinavian Journal of Immunology. 44 (6): 578–84. doi:10.1046/j.1365-3083.1996.d01-351.x. PMID 8972739. S2CID 3079540.
- ^ Hargrave BY, Tiangco DA, Lattanzio FA, Beebe SJ (2003). "Cocaine, not morphine, causes the generation of reactive oxygen species and activation of NF-kappaB in transiently cotransfected heart cells". Cardiovascular Toxicology. 3 (2): 141–51. doi:10.1385/CT:3:2:141. PMID 14501032. S2CID 35240781.
- ^ Montiel-Duarte C, Ansorena E, López-Zabalza MJ, Cenarruzabeitia E, Iraburu MJ (March 2004). "Role of reactive oxygen species, glutathione and NF-kappaB in apoptosis induced by 3,4-methylenedioxymethamphetamine ("Ecstasy") on hepatic stellate cells". Biochemical Pharmacology. 67 (6): 1025–33. doi:10.1016/j.bcp.2003.10.020. PMID 15006539.
- ^ Ungefroren H, Sebens S, Seidl D, Lehnert H, Hass R (September 2011). "Interaction of tumor cells with the microenvironment". Cell Communication and Signaling. 9: 18. doi:10.1186/1478-811X-9-18. PMC 3180438. PMID 21914164.
- ^ a b c d e Coussens LM, Werb Z (2002). "Inflammation and cancer". Nature. 420 (6917): 860–7. Bibcode:2002Natur.420..860C. doi:10.1038/nature01322. PMC 2803035. PMID 12490959.
- ^ Gunn L, Ding C, Liu M, Ma Y, Qi C, Cai Y, et al. (September 2012). "Opposing roles for complement component C5a in tumor progression and the tumor microenvironment". Journal of Immunology. 189 (6): 2985–94. doi:10.4049/jimmunol.1200846. PMC 3436956. PMID 22914051.
- ^ Copland JA, Sheffield-Moore M, Koldzic-Zivanovic N, Gentry S, Lamprou G, Tzortzatou-Stathopoulou F, et al. (June 2009). "Sex steroid receptors in skeletal differentiation and epithelial neoplasia: is tissue-specific intervention possible?". BioEssays. 31 (6): 629–41. doi:10.1002/bies.200800138. PMID 19382224. S2CID 205469320.
- ^ Colotta F, Allavena P, Sica A, Garlanda C, Mantovani A (July 2009). "Cancer-related inflammation, the seventh hallmark of cancer: links to genetic instability". Carcinogenesis (review). 30 (7): 1073–81. doi:10.1093/carcin/bgp127. PMID 19468060.
- ^ a b c d e f g h Chiba T, Marusawa H, Ushijima T (September 2012). "Inflammation-associated cancer development in digestive organs: mechanisms and roles for genetic and epigenetic modulation" (PDF). Gastroenterology. 143 (3): 550–563. doi:10.1053/j.gastro.2012.07.009. hdl:2433/160134. PMID 22796521. S2CID 206226588.
- ^ Mantovani A, Allavena P, Sica A, Balkwill F (July 2008). "Cancer-related inflammation" (PDF). Nature. 454 (7203): 436–44. Bibcode:2008Natur.454..436M. doi:10.1038/nature07205. hdl:2434/145688. PMID 18650914. S2CID 4429118.
- ^ Larsen GL, Henson PM (1983). "Mediators of inflammation". Annual Review of Immunology. 1: 335–59. doi:10.1146/annurev.iy.01.040183.002003. PMID 6399978.
- ^ a b c d Shacter E, Weitzman SA (February 2002). "Chronic inflammation and cancer". Oncology. 16 (2): 217–26, 229, discussion 230–2. PMID 11866137.
- ^ Yu Y, Cui Y, Niedernhofer LJ, Wang Y (December 2016). "Occurrence, Biological Consequences, and Human Health Relevance of Oxidative Stress-Induced DNA Damage". Chemical Research in Toxicology. 29 (12): 2008–2039. doi:10.1021/acs.chemrestox.6b00265. PMC 5614522. PMID 27989142.
- ^ Dizdaroglu M (December 2012). "Oxidatively induced DNA damage: mechanisms, repair and disease". Cancer Letters. 327 (1–2): 26–47. doi:10.1016/j.canlet.2012.01.016. PMID 22293091.
- ^ Nishida N, Kudo M (2013). "Oxidative stress and epigenetic instability in human hepatocarcinogenesis". Digestive Diseases. 31 (5–6): 447–53. doi:10.1159/000355243. PMID 24281019.
- ^ a b Ding N, Maiuri AR, O'Hagan HM (2017). "The emerging role of epigenetic modifiers in repair of DNA damage associated with chronic inflammatory diseases". Mutation Research. 780: 69–81. doi:10.1016/j.mrrev.2017.09.005. PMC 6690501. PMID 31395351.
- ^ Kawanishi S, Ohnishi S, Ma N, Hiraku Y, Oikawa S, Murata M (2016). "Nitrative and oxidative DNA damage in infection-related carcinogenesis in relation to cancer stem cells". Genes and Environment. 38: 26. doi:10.1186/s41021-016-0055-7. PMC 5203929. PMID 28050219.
- ^ O'Hagan HM, Wang W, Sen S, Destefano Shields C, Lee SS, Zhang YW, et al. (November 2011). "Oxidative damage targets complexes containing DNA methyltransferases, SIRT1, and polycomb members to promoter CpG Islands". Cancer Cell. 20 (5): 606–19. doi:10.1016/j.ccr.2011.09.012. PMC 3220885. PMID 22094255.
- ^ Maiuri AR, Peng M, Podicheti R, Sriramkumar S, Kamplain CM, Rusch DB, et al. (July 2017). "Mismatch Repair Proteins Initiate Epigenetic Alterations during Inflammation-Driven Tumorigenesis". Cancer Research. 77 (13): 3467–3478. doi:10.1158/0008-5472.CAN-17-0056. PMC 5516887. PMID 28522752.
- ^ Yamashita S, Kishino T, Takahashi T, Shimazu T, Charvat H, Kakugawa Y, et al. (February 2018). "Genetic and epigenetic alterations in normal tissues have differential impacts on cancer risk among tissues". Proceedings of the National Academy of Sciences of the United States of America. 115 (6): 1328–1333. doi:10.1073/pnas.1717340115. PMC 5819434. PMID 29358395.
- ^ Raza Y, Khan A, Farooqui A, Mubarak M, Facista A, Akhtar SS, et al. (October 2014). "Oxidative DNA damage as a potential early biomarker of Helicobacter pylori associated carcinogenesis". Pathology & Oncology Research. 20 (4): 839–46. doi:10.1007/s12253-014-9762-1. PMID 24664859. S2CID 18727504.
- ^ a b Deeks SG (1 January 2011). "HIV infection, inflammation, immunosenescence, and aging". Annual Review of Medicine. 62: 141–55. doi:10.1146/annurev-med-042909-093756. PMC 3759035. PMID 21090961.
- ^ Klatt NR, Chomont N, Douek DC, Deeks SG (July 2013). "Immune activation and HIV persistence: implications for curative approaches to HIV infection". Immunological Reviews. 254 (1): 326–42. doi:10.1111/imr.12065. PMC 3694608. PMID 23772629.
- ^ Salazar-Gonzalez JF, Martinez-Maza O, Nishanian P, Aziz N, Shen LP, Grosser S, et al. (August 1998). "Increased immune activation precedes the inflection point of CD4 T cells and the increased serum virus load in human immunodeficiency virus infection". The Journal of Infectious Diseases. 178 (2): 423–30. doi:10.1086/515629. PMID 9697722.
- ^ Ipp H, Zemlin A (February 2013). "The paradox of the immune response in HIV infection: when inflammation becomes harmful". Clinica Chimica Acta; International Journal of Clinical Chemistry. 416: 96–9. doi:10.1016/j.cca.2012.11.025. PMID 23228847.
- ^ Nasi M, Pinti M, Mussini C, Cossarizza A (October 2014). "Persistent inflammation in HIV infection: established concepts, new perspectives". Immunology Letters. 161 (2): 184–8. doi:10.1016/j.imlet.2014.01.008. PMID 24487059.
- ^ Milush JM, Mir KD, Sundaravaradan V, Gordon SN, Engram J, Cano CA, et al. (March 2011). "Lack of clinical AIDS in SIV-infected sooty mangabeys with significant CD4+ T cell loss is associated with double-negative T cells". The Journal of Clinical Investigation. 121 (3): 1102–10. doi:10.1172/JCI44876. PMC 3049370. PMID 21317533.
- ^ Rey-Cuillé MA, Berthier JL, Bomsel-Demontoy MC, Chaduc Y, Montagnier L, Hovanessian AG, Chakrabarti LA (May 1998). "Simian immunodeficiency virus replicates to high levels in sooty mangabeys without inducing disease". Journal of Virology. 72 (5): 3872–86. doi:10.1128/JVI.72.5.3872-3886.1998. PMC 109612. PMID 9557672.
- ^ Chahroudi A, Bosinger SE, Vanderford TH, Paiardini M, Silvestri G (March 2012). "Natural SIV hosts: showing AIDS the door". Science. 335 (6073): 1188–93. Bibcode:2012Sci...335.1188C. doi:10.1126/science.1217550. PMC 3822437. PMID 22403383.
- ^ a b Doitsh G, Galloway NL, Geng X, Yang Z, Monroe KM, Zepeda O, et al. (January 2014). "Cell death by pyroptosis drives CD4 T-cell depletion in HIV-1 infection". Nature. 505 (7484): 509–14. Bibcode:2014Natur.505..509D. doi:10.1038/nature12940. PMC 4047036. PMID 24356306.
- ^ Monroe KM, Yang Z, Johnson JR, Geng X, Doitsh G, Krogan NJ, Greene WC (January 2014). "IFI16 DNA sensor is required for death of lymphoid CD4 T cells abortively infected with HIV". Science. 343 (6169): 428–32. Bibcode:2014Sci...343..428M. doi:10.1126/science.1243640. PMC 3976200. PMID 24356113.
- ^ Galloway NL, Doitsh G, Monroe KM, Yang Z, Muñoz-Arias I, Levy DN, Greene WC (September 2015). "Cell-to-Cell Transmission of HIV-1 Is Required to Trigger Pyroptotic Death of Lymphoid-Tissue-Derived CD4 T Cells". Cell Reports. 12 (10): 1555–1563. doi:10.1016/j.celrep.2015.08.011. PMC 4565731. PMID 26321639.
- ^ Doitsh G, Greene WC (March 2016). "Dissecting How CD4 T Cells Are Lost During HIV Infection". Cell Host & Microbe. 19 (3): 280–91. doi:10.1016/j.chom.2016.02.012. PMC 4835240. PMID 26962940.
- ^ "Study of VX-765 in Subjects With Treatment-resistant Partial Epilepsy - Full Text View - ClinicalTrials.gov". clinicaltrials.gov. 19 December 2013. Retrieved 21 May 2016.
- ^ Eming SA, Krieg T, Davidson JM (March 2007). "Inflammation in wound repair: molecular and cellular mechanisms". The Journal of Investigative Dermatology. 127 (3): 514–25. doi:10.1038/sj.jid.5700701. PMID 17299434.
- ^ Ashcroft GS, Yang X, Glick AB, Weinstein M, Letterio JL, Mizel DE, et al. (September 1999). "Mice lacking Smad3 show accelerated wound healing and an impaired local inflammatory response". Nature Cell Biology. 1 (5): 260–6. doi:10.1038/12971. PMID 10559937. S2CID 37216623.
- ^ Ashcroft GS (December 1999). "Bidirectional regulation of macrophage function by TGF-beta". Microbes and Infection. 1 (15): 1275–82. doi:10.1016/S1286-4579(99)00257-9. PMID 10611755.
- ^ Werner F, Jain MK, Feinberg MW, Sibinga NE, Pellacani A, Wiesel P, et al. (November 2000). "Transforming growth factor-beta 1 inhibition of macrophage activation is mediated via Smad3". The Journal of Biological Chemistry. 275 (47): 36653–8. doi:10.1074/jbc.M004536200. PMID 10973958.
- ^ Sato Y, Ohshima T, Kondo T (November 1999). "Regulatory role of endogenous interleukin-10 in cutaneous inflammatory response of murine wound healing". Biochemical and Biophysical Research Communications. 265 (1): 194–9. doi:10.1006/bbrc.1999.1455. PMID 10548513.
- ^ Serhan CN (August 2008). "Controlling the resolution of acute inflammation: a new genus of dual anti-inflammatory and proresolving mediators". Journal of Periodontology. 79 (8 Suppl): 1520–6. doi:10.1902/jop.2008.080231. PMID 18673006.
- ^ Headland SE, Norling LV (May 2015). "The resolution of inflammation: Principles and challenges". Seminars in Immunology. 27 (3): 149–60. doi:10.1016/j.smim.2015.03.014. PMID 25911383.
- ^ Greenhalgh DG (September 1998). "The role of apoptosis in wound healing". The International Journal of Biochemistry & Cell Biology. 30 (9): 1019–30. doi:10.1016/S1357-2725(98)00058-2. PMID 9785465.
- ^ Jiang D, Liang J, Fan J, Yu S, Chen S, Luo Y, et al. (November 2005). "Regulation of lung injury and repair by Toll-like receptors and hyaluronan". Nature Medicine. 11 (11): 1173–9. doi:10.1038/nm1315. PMID 16244651. S2CID 11765495.
- ^ Teder P, Vandivier RW, Jiang D, Liang J, Cohn L, Puré E, et al. (April 2002). "Resolution of lung inflammation by CD44". Science. 296 (5565): 155–8. Bibcode:2002Sci...296..155T. doi:10.1126/science.1069659. PMID 11935029. S2CID 7905603.
- ^ McQuibban GA, Gong JH, Tam EM, McCulloch CA, Clark-Lewis I, Overall CM (August 2000). "Inflammation dampened by gelatinase A cleavage of monocyte chemoattractant protein-3". Science. 289 (5482): 1202–6. Bibcode:2000Sci...289.1202M. doi:10.1126/science.289.5482.1202. PMID 10947989.
- ^ Serhan CN, Savill J (December 2005). "Resolution of inflammation: the beginning programs the end". Nature Immunology. 6 (12): 1191–7. doi:10.1038/ni1276. PMID 16369558. S2CID 22379843.
- ^ Berk M, Williams LJ, Jacka FN, O'Neil A, Pasco JA, Moylan S, et al. (September 2013). "So depression is an inflammatory disease, but where does the inflammation come from?". BMC Medicine. 11: 200. doi:10.1186/1741-7015-11-200. PMC 3846682. PMID 24228900.
- ^ Cox WT, Abramson LY, Devine PG, Hollon SD (September 2012). "Stereotypes, Prejudice, and Depression: The Integrated Perspective". Perspectives on Psychological Science. 7 (5): 427–49. doi:10.1177/1745691612455204. PMID 26168502. S2CID 1512121.
- ^ Kiecolt-Glaser JK, Derry HM, Fagundes CP (November 2015). "Inflammation: depression fans the flames and feasts on the heat". The American Journal of Psychiatry. 172 (11): 1075–91. doi:10.1176/appi.ajp.2015.15020152. PMC 6511978. PMID 26357876.
- ^ Williams C (4 January 2015). "Is depression a kind of allergic reaction?". The Guardian.
- ^ Brietzke E, Stertz L, Fernandes BS, Kauer-Sant'anna M, Mascarenhas M, Escosteguy Vargas A, et al. (August 2009). "Comparison of cytokine levels in depressed, manic and euthymic patients with bipolar disorder". Journal of Affective Disorders. 116 (3): 214–7. doi:10.1016/j.jad.2008.12.001. PMID 19251324.
- ^ Müller N, Schwarz MJ, Dehning S, Douhe A, Cerovecki A, Goldstein-Müller B, et al. (July 2006). "The cyclooxygenase-2 inhibitor celecoxib has therapeutic effects in major depression: results of a double-blind, randomized, placebo controlled, add-on pilot study to reboxetine". Molecular Psychiatry. 11 (7): 680–4. doi:10.1038/sj.mp.4001805. PMID 16491133.
- ^ Canli T (2014). "Reconceptualizing major depressive disorder as an infectious disease". Biology of Mood & Anxiety Disorders. 4: 10. doi:10.1186/2045-5380-4-10. PMC 4215336. PMID 25364500.
- ^ Saini, Aman; Oh, Tae Hyun; Ghanem, Dory Anthony; Castro, Megan; Butler, Matthew; Sin Fai Lam, Chun Chiang; Posporelis, Sotiris; Lewis, Glyn; David, Anthony S.; Rogers, Jonathan P. (15 October 2021). "Inflammatory and blood gas markers of COVID-19 delirium compared to non-COVID-19 delirium: a cross-sectional study". Aging & Mental Health: 1–8. doi:10.1080/13607863.2021.1989375. ISSN 1360-7863. PMID 34651536. S2CID 238990849.
- ^ Ramanlal, Riddhi; Gupta, Vikas (2021), "Physiology, Vasodilation", StatPearls, Treasure Island (FL): StatPearls Publishing, PMID 32491494, retrieved 22 September 2021
- ^ a b Parimisetty A, Dorsemans AC, Awada R, Ravanan P, Diotel N, Lefebvre d'Hellencourt C (March 2016). "Secret talk between adipose tissue and central nervous system via secreted factors-an emerging frontier in the neurodegenerative research". Journal of Neuroinflammation (Review). 13 (1): 67. doi:10.1186/s12974-016-0530-x. PMC 4806498. PMID 27012931.
- ^ Kershaw EE, Flier JS (June 2004). "Adipose tissue as an endocrine organ". The Journal of Clinical Endocrinology and Metabolism. 89 (6): 2548–56. doi:10.1210/jc.2004-0395. PMID 15181022.
- ^ Bastard JP, Jardel C, Bruckert E, Blondy P, Capeau J, Laville M, et al. (September 2000). "Elevated levels of interleukin 6 are reduced in serum and subcutaneous adipose tissue of obese women after weight loss". The Journal of Clinical Endocrinology and Metabolism. 85 (9): 3338–42. doi:10.1210/jcem.85.9.6839. PMID 10999830.
- ^ Mohamed-Ali V, Flower L, Sethi J, Hotamisligil G, Gray R, Humphries SE, et al. (December 2001). "beta-Adrenergic regulation of IL-6 release from adipose tissue: in vivo and in vitro studies". The Journal of Clinical Endocrinology and Metabolism. 86 (12): 5864–9. doi:10.1210/jcem.86.12.8104. PMID 11739453.
- ^ a b c d e f g Loffreda S, Yang SQ, Lin HZ, Karp CL, Brengman ML, Wang DJ, et al. (January 1998). "Leptin regulates proinflammatory immune responses". FASEB Journal. 12 (1): 57–65. doi:10.1096/fasebj.12.1.57. PMID 9438411.
- ^ a b c d e f g Esposito K, Nappo F, Marfella R, Giugliano G, Giugliano F, Ciotola M, et al. (October 2002). "Inflammatory cytokine concentrations are acutely increased by hyperglycemia in humans: role of oxidative stress". Circulation. 106 (16): 2067–72. doi:10.1161/01.CIR.0000034509.14906.AE. PMID 12379575.
- ^ Petersen AM, Pedersen BK (April 2005). "The anti-inflammatory effect of exercise". Journal of Applied Physiology. 98 (4): 1154–62. doi:10.1152/japplphysiol.00164.2004. PMID 15772055. S2CID 4776835.
- ^ Rogowski O, Shapira I, Bassat OK, Chundadze T, Finn T, Berliner S, Steinvil A (July 2010). "Waist circumference as the predominant contributor to the micro-inflammatory response in the metabolic syndrome: a cross sectional study". Journal of Inflammation. 7: 35. doi:10.1186/1476-9255-7-35. PMC 2919526. PMID 20659330.
- ^ Goldfine AB, Shoelson SE (January 2017). "Therapeutic approaches targeting inflammation for diabetes and associated cardiovascular risk". The Journal of Clinical Investigation. 127 (1): 83–93. doi:10.1172/jci88884. PMC 5199685. PMID 28045401.
- ^ Choi J, Joseph L, Pilote L (March 2013). "Obesity and C-reactive protein in various populations: a systematic review and meta-analysis". Obesity Reviews. 14 (3): 232–44. doi:10.1111/obr.12003. PMID 23171381. S2CID 206227739.