모틸린
Motilin| 모틸린/그렐린 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 등방성 인지질 바이켈라 용액의 모틸린 구조.[1] | |||||||||
| 식별자 | |||||||||
| 기호 | 모틸린_그렐린 | ||||||||
| Pfam | PF04644 | ||||||||
| 인터프로 | IPR006738 | ||||||||
| SCOP2 | 1lbj / SCOPe / SUPFAM | ||||||||
| OPM 슈퍼 패밀리 | 145 | ||||||||
| OPM단백질 | 1lbj | ||||||||
| |||||||||
| 모틸린 | |||||||
|---|---|---|---|---|---|---|---|
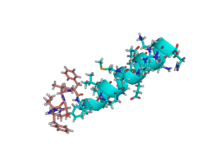 인광체 바이켈라 용액에 포함된 모틸린의 NMR [1]용액 구조 | |||||||
| 식별자 | |||||||
| 기호 | Mln. | ||||||
| 엔씨비유전자 | 4295 | ||||||
| HGNC | 7141 | ||||||
| 오밈 | 158270 | ||||||
| PDB | 1lbj | ||||||
| RefSeq | NM_001040109 | ||||||
| 유니프로트 | P12872 | ||||||
| 기타자료 | |||||||
| 로커스 | 6번 씨 p21.3-p21.2 | ||||||
| |||||||
모틸린은 모틸린 계열의 22-아미노산 폴리펩타이드 호르몬으로, 인간에서 MLN 유전자에 의해 암호화된다.[2]
모틸린은 소장의 암호, 특히 십이지장과 제주눔에서 많이 발견되는 내분비계 모세포[3][4](M세포, 또는 페이어의 패치에서 발견되는 마이크로폴드 세포와도 같지 않은 M세포라고도 한다)에 의해 분비된다.[5] 그것은 소화간 상태 동안 약 100분 간격으로 인간의 일반적인 순환에 방출되며 소화간 이동 수축을 조절하는 데 가장 중요한 요소로서 내분비 췌장의 내분비 분비를 자극하기도 한다.[6] 아미노산 염기서열로 볼 때 모틸린은 다른 호르몬과 무관하다. 위 활동을 자극하는 능력 때문에 '모틸린'이라는 이름이 붙었다. 인간과는 별개로, 모틸린 수용체는 돼지, 쥐, 소, 고양이의 위장작용과 토끼의 중추신경계에서 확인되었다.
디스커버리
모틸린은 J.C.에 의해 발견되었다. 브라운은 알칼리성 용액을 개의 듀오데나에 주입시켰고, 이것은 강한 위수축을 일으켰다. 브라운 외 연구진은 알칼리가 운동 활동을 활성화하기 위한 자극을 방출하거나 억제 호르몬 분비를 막을 수 있다고 예측했다. 그들은 카복시메틸 셀룰로오스의 분비물 정화로부터 폴리펩타이드 성분을 부산물로 분리했다. 그들은 이 폴리펩타이드의 이름을 "모틸린"[7]이라고 지었다.
구조
모틸린은 22개의 아미노산과 2698개의 달튼의 분자량을 가지고 있다. 인간의 내장과 혈장으로부터 추출물에는 두 가지 기본적인 형태의 모틸린이 있다. 첫 번째 분자 형태는 22개의 아미노산의 폴리펩타이드다. 반면, 두 번째 형태는 더 크고 첫 번째 형태와 동일한 22개의 아미노산을 포함하고 있지만 추가적인 카복실-터미네우스 종말을 포함한다.[8]
모틸린의 아미노산의 순서는 다음과 같다: Ph-Val-Pro-Ile-Phe-Thr-Tyr-Gly-Gly-Leu-Gln-Arg-Met-Gln-Lys-Asn-Lys-Gly-Gln.[9]
위장관 펩타이드 호르몬 모틸린의 구조와 역학관계는 등방성 q = 0.5 인산염 바이셀이 존재하는 곳에서 연구되었다. 산성 바이셀 용액에 포함된 펩타이드의 NMR 용액 구조는 203개의 NOE 유도 거리 제약 조건과 6개의 백본 비틀림 각도 제약 조건으로부터 결정되었다. Leu-10의 Cα→1H 벡터에 대한 동적 특성은 다중 필드 이완 데이터의 분석에 의해 이 위치에서 C로 라벨이 지정된 모틸린에 대해 결정되었다. 이 구조는 글루-9과 리스-20 사이의 순서가 정해진 알파헬리컬 순응을 보여준다. N-terminus는 또한 전통적인 베타-턴과 비슷한 턴으로 잘 구성되어 있다. C 역학은 큰 물체의 상관 시간 특성과 함께 모틸린이 천천히 용액에서 투덜거린다는 것을 분명히 보여준다.[1]
자극
일부 연구에서는 십이지장의 알칼리성 pH가 분비를 자극한다고 보지만, 모틸린 분비의 조절은 대체로 알려져 있지 않다. 그러나 낮은 pH에서는 위 운동 활동을 억제하는 반면 높은 pH에서는 자극 효과가 있다. 개에 대한 일부 연구에서는 단식이나 소화기 간 기간에 모틸린이 분비되며, 이 기간 동안 음식을 섭취하면 모틸린의 분비를 막을 수 있다는 연구 결과가 나왔다.[10] 인슐린 분비를 증가시키는 포도당 정맥주사도 플라즈마 모틸린의 주기적 상승을 억제하는 것으로 나타났다.[11] 개에 대한 다른 연구들도 모틸린이 더 많은 모틸린의 방출을 자극하기 위해 긍정적인 피드백 메커니즘에서 내생 리간드로 작용했다는 것을 시사했다.[12]
함수
모틸린의 주요 기능은 위장 운동성의 이동 근전기 복합부품을 증가시키고 펩신 생산을 촉진하는 것이다. 모틸린은 소장의 근막을 좋게 하고 내장을 맑게 해 다음 식사를 준비하기 때문에 '내장의 집사'라고도 불린다.[9] 식사 사이에 혈액 속으로 분비되는 높은 수준의 모틸린은 펀더스와 항문의 수축을 자극하고 위 비우기를 가속화한다. 그런 다음 담낭을 수축시켜 아랫도 식도 괄약근의 압착 압력을 높인다. 모틸린의 다른 기능으로는 췌장 폴리펩타이드와 소마토스타틴의 방출을 증가시키는 것이 있다.[13]
모틸린 작용제
에리트로마이신과 관련 항생제는 비펩타이드 모틸린 작용제로 작용하며 위장 운동성을 자극하는 능력에 쓰이기도 한다. 에리트로마이신의 경우, 모틸린 수용체에 직접 작용하는 위루멘의 저 pH 환경에서 경구 투여 후 형성된 헤미케탈 중간이다.[14] 적은 양의 에리트로마이신을 투여하면 페리스탈증을 유발하게 되는데, 이것은 모틸린 분비가 이러한 위장 운동성의 패턴을 유발한다는 결론에 대한 추가적인 지원을 제공하게 된다. 그러나 항생제 활동을 포함한 에리트로마이신의 성질의 일부는 환자의 평생 동안 만성적으로 사용하도록 설계된 약물에 적합하지 않다.
새로운 모틸린 작용제들은 에리트로마이신을 기반으로 하지만, 이 종류의 약이 중복되는 것일 수도 있다. 성장호르몬 분비물 수용체는 DNA의 52%를 모틸린 수용체와 공유하고 있으며, 이들 수용체의 작용제인 그렐린(grelin)은 모틸린 작용제와 유사한 효과를 가져올 수 있다.
카미시날은 개발 중인 모틸린 작용제다.
자일리톨 섭취는 또한 모틸린 분비를 증가시키며, 이것은 자일리톨의 설사 유발 능력과 관련이 있을 수 있다.[15]
관련 펩타이드
이 영역은 또한 위 내분비세포에 의해 합성된 성장호르몬 분비물인 그렐린에서도 발견된다. 그렐린은 뇌하수체 내 성장 호르몬 분비고그 수용체를 자극한다. 이러한 수용체는 성장 호르몬 방출 호르몬 수용체와 구별되므로 위장계에 의한 뇌하수체 성장 호르몬 분비를 조절하는 수단을 제공한다.[16] 에리트로마이신은 중추신경계 부작용이 없어 위 비울 때 메토클로프라미드보다 유리하다. 위 비우기 위해 사용하는 것은 FDA에 의해 승인되지 않았다. 당뇨병 환자의 경우, 그리고 어떤 시술이든 위장을 맑게 해야 하는 경우에는 FDA의 승인을 받지 않은 것을 충분히 이해하고 의사의 재량에 따라 사용할 수 있다.
인간 단백질
GHRL; 모틸린;
참조
- ^ a b c PDB: 1lbj; Andersson A, Mäler L (October 2002). "NMR solution structure and dynamics of motilin in isotropic phospholipid bicellar solution". Journal of Biomolecular NMR. 24 (2): 103–12. doi:10.1023/A:1020902915969. PMID 12495026. S2CID 34766985.
- ^ Daikh DI, Douglass JO, Adelman JP (October 1989). "Structure and expression of the human motilin gene". DNA. 8 (8): 615–21. doi:10.1089/dna.1989.8.615. PMID 2574660.
- ^ Daniel EE (1990-12-11). Neuropeptide Function in the Gastrointestinal Tract. CRC Press. ISBN 9780849361586.
- ^ Goswami C, Shimada Y, Yoshimura M, Mondal A, Oda S, Tanaka T, Sakai T, Sakata I (2015-06-26). "Motilin Stimulates Gastric Acid Secretion in Coordination with Ghrelin in Suncus murinus". PLOS ONE. 10 (6): e0131554. Bibcode:2015PLoSO..1031554G. doi:10.1371/journal.pone.0131554. PMC 4482737. PMID 26115342.
- ^ Poitras P, Peeters TL (February 2008). "Motilin". Current Opinion in Endocrinology, Diabetes and Obesity. 15 (1): 54–7. doi:10.1097/MED.0b013e3282f370af. PMID 18185063. S2CID 220582156.
- ^ Itoh Z (1997). "Motilin and clinical application". Peptides. 18 (4): 593–608. doi:10.1016/S0196-9781(96)00333-6. PMID 9210180. S2CID 38242445.
- ^ Brown JC, Cook MA, Dryburgh JR (May 1973). "Motilin, a gastric motor activity stimulating polypeptide: the complete amino acid sequence". Canadian Journal of Biochemistry. 51 (5): 533–7. doi:10.1139/o73-066. PMID 4706833.
- ^ DeGroot LJ (1989). McGuigan JE (ed.). Endocrinology. Philadelphia: Saunders. p. 2748. ISBN 978-0-7216-2888-2.
- ^ a b Williams RL (1981). Textbook of endocrinology (6th ed.). Philadelphia: Saunders. pp. 704–705. ISBN 978-0-7216-9398-9.
- ^ Itoh Z, Takeuchi S, Aizawa I, Mori K, Taminato T, Seino Y, Imura H, Yanaihara N (October 1978). "Changes in plasma motilin concentration and gastrointestinal contractile activity in conscious dogs". The American Journal of Digestive Diseases. 23 (10): 929–35. doi:10.1007/BF01072469. PMID 717352. S2CID 23526142.
- ^ Lemoyne M, Wassef R, Tassé D, Trudel L, Poitras P (September 1984). "Motilin and the vagus in dogs". Canadian Journal of Physiology and Pharmacology. 62 (9): 1092–6. doi:10.1139/y84-182. PMID 6388765.
- ^ Hall KE, Greenberg GR, El-Sharkawy TY, Diamant NE (July 1984). "Relationship between porcine motilin-induced migrating motor complex-like activity, vagal integrity, and endogenous motilin release in dogs". Gastroenterology. 87 (1): 76–85. doi:10.1016/0016-5085(84)90128-8. PMID 6724277.
- ^ Frohman LA, Felig P (2001). Ghosh PK, O'Dorisio TM (eds.). Endocrinology & metabolism. New York: McGraw-Hill, Medical Pub. Div. p. 1330. ISBN 978-0-07-022001-0.
- ^ Galligan JJ, Vanner S (October 2005). "Basic and clinical pharmacology of new motility promoting agents". Neurogastroenterology and Motility. 17 (5): 643–53. doi:10.1111/j.1365-2982.2005.00675.x. PMID 16185302. S2CID 7298061.
- ^ Wölnerhanssen BK, Meyer-Gerspach AC, Beglinger C, Islam MS (June 2019). "Metabolic effects of the natural sweeteners xylitol and erythritol: A comprehensive review". Critical Reviews in Food Science and Nutrition. 60 (12): 1986–1998. doi:10.1080/10408398.2019.1623757. PMID 31204494. S2CID 189944738.
- ^ Kojima M, Hosoda H, Matsuo H, Kangawa K (April 2001). "Ghrelin: discovery of the natural endogenous ligand for the growth hormone secretagogue receptor". Trends in Endocrinology and Metabolism. 12 (3): 118–22. doi:10.1016/S1043-2760(00)00362-3. PMID 11306336. S2CID 42054657.
외부 링크
- 미국 국립 의학 도서관의 모틸린(MeSH) 제목
- Nosek, Thomas M. "Section 6/6ch2/s6ch2_26". Essentials of Human Physiology. Archived from the original on 2016-03-24.


