시상하부
Hypothalamus| 시상하부 | |
|---|---|
 인간의 시상하부 위치 | |
 뇌하수체 및 나머지 뇌와 관련된 시상하부(파란색)의 위치 | |
| 세부 사항 | |
| 일부 | 뇌 |
| 식별자 | |
| 라틴어 | 시상하부 |
| 메쉬 | D007031 |
| NeuroLex ID | birnlex_734 |
| TA98 | A14.1.08.401 A14.1.08.901 |
| TA2 | 5714 |
| FMA | 62008 |
| 신경해부술의 해부학적 용어 | |
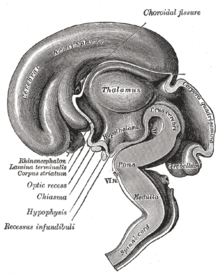
시상하부(고대 그리스어 '후포' '언더'와 '탈라모스' '챔버')는 다양한 기능을 가진 다수의 작은 핵을 포함하는 뇌의 부분이다.시상하부의 가장 중요한 기능 중 하나는 뇌하수체를 통해 신경계와 내분비계를 연결하는 것이다.시상하부는 시상 아래에 위치하고 변연계의 [1]일부이다.신경해부술의 용어로는 간뇌의 복측부를 형성한다.모든 척추동물의 뇌는 [2]시상하부를 포함하고 있다.인간의 경우, 그것은 아몬드 크기입니다.
시상하부는 자율신경계의 특정 대사 과정과 다른 활동들을 조절하는 역할을 한다.그것은 호르몬이나 시상하부 호르몬을 분비하는 것으로 불리는 특정 신경호르몬을 합성하고 분비하며, 이것들은 차례로 뇌하수체로부터의 호르몬 분비를 자극하거나 억제합니다.시상하부는 체온, 배고픔, 육아와 애착 행동의 중요한 측면, 갈증,[3] 피로, 수면, 그리고 일주기 [4]리듬을 조절합니다.
구조.
시상하부는 시상면에서 전방-후방 위치를 나타내는 3개 영역(상안검, 결절, 유두)과 내측-외측 위치를 나타내는 3개 영역(주방, 내측, 외측)으로 나뉜다.시상하부핵은 이러한 특정 영역과 [5]영역 내에 위치한다.그것은 모든 척추동물의 신경계에서 발견된다.포유동물에서 시상하부의 방실핵과 상안핵에 있는 마그노세포 신경분비세포는 신경하수체호르몬, 옥시토신 및 바소프레신을 생성한다.이 호르몬들은 뇌하수체 [6]후부의 혈액으로 방출된다.훨씬 더 작은 부세포 신경 분비 세포인 방실 핵의 뉴런은 피질 세포로 호르몬을 방출하는 호르몬과 다른 호르몬을 뇌하수체 전엽으로 확산시키는 저수체 간문 체계로 방출합니다.
핵
| 지역 | 지역 | 핵 | 기능.[10] |
| 전면(초광학) | 광학 전 | 광전핵 | |
| 중앙 | 내측 광전핵 | ||
| 상안핵 | |||
| 방추핵 |
| ||
| 시상하부전핵 | |||
| 상완골 | |||
| 측면 | |||
| 측핵 | '외측 시상하부 기능' 참조 - 뇌와 척수 전체에 투영되는 오렉신 뉴런의 주요 공급원 | ||
| 중간(두부) | 중앙 | 배꼽 시상하핵 | |
| 복측핵 | |||
| 호핵 |
| ||
| 측면 | 측핵 | '외측 시상하부 기능' 참조 - 뇌와 척수 전체에 투영되는 오렉신 뉴런의 주요 공급원 | |
| 외측결절핵 | |||
| 후부(모액) | 중앙 | 유두핵(유두체의 일부) | |
| 후핵 | |||
| 측면 | 측핵 | '외측 시상하부 기능' 참조 - 뇌와 척수 전체에 투영되는 오렉신 뉴런의 주요 공급원 | |
| 결절유두핵[12] |
- 「 」를 참조해 주세요.
시상하부의 한쪽에 있는 시상하부핵, 3차원 컴퓨터 재구성에[13] 표시됨
접속
시상하부는 중추신경계의 다른 부분, 특히 뇌간과 그 망상 형성과 매우 밀접하게 연관되어 있다.변연계의 일부로서 편도체와 격막을 포함한 다른 변연계 구조와 연결되며 자율신경계 영역과도 연결된다.
시상하부는 뇌간에서 많은 입력을 받는데, 이 중 가장 눈에 띄는 것은 독방의 핵, 강직, 그리고 복측수질입니다.
시상하부에 있는 대부분의 신경 섬유는 두 가지 방식으로 작동한다.
- 시상하부로 이어지는 부분에 대한 돌기는 내측 전뇌 다발, 유선피질로 및 배측 종방향 파시큘스를 통과합니다.
- 시상하부에 대한 외측부위의 돌기는 유선 시상관, 개구부 및 말단 선조체에 의해 운반된다.
- 교감운동계 영역(외측 뿔척수 세그먼트 T1-L2/L3)에 대한 돌기는 시상하부에 의해 운반되어 교감운동 경로를 활성화한다.
성적 이형성
시상하부핵은 성적 이형성을 가지고 있다. 즉, 남성과 [14]여성 사이에 구조와 기능 모두에서 분명한 차이가 있다.몇 가지 차이는 총신경해부술에서도 명백하다.가장 주목할 만한 것은 광전 [14]영역 내의 성적 이형성 핵으로, 그 차이는 특정 뉴런 세트의 연결성과 화학적 민감도의 미묘한 변화이다.이러한 변화의 중요성은 남성과 여성의 기능적 차이로 인식될 수 있다.예를 들어, 대부분의 종의 수컷들은 수컷보다 암컷의 냄새와 외모를 선호하는데, 이것은 수컷의 성적 행동을 자극하는 데 중요한 역할을 한다.성적 이형성 핵이 레슬레이션되면, 남성들에 의한 여성에 대한 이러한 선호는 감소한다.또한 성장호르몬 분비의 패턴은 성적 이형적이다;[15] 이것이 많은 종에서 성인 수컷이 암컷과 눈에 띄게 큰 이유이다.
난소 스테로이드제에 대한 반응성
다른 두드러진 기능성 이형성은 성인의 난소 스테로이드제에 대한 행동 반응이다.남성과 여성은 난소 스테로이드제에 다른 방식으로 반응하는데, 부분적으로는 시상하부에 있는 에스트로겐 감수성 뉴런의 발현이 성적 이형성이기 때문이다. 즉, 에스트로겐 수용체는 다른 일련의 [citation needed]뉴런에서 발현된다.
에스트로겐과 프로게스테론은 특정 뉴런의 유전자 발현에 영향을 미치거나 세포막 전위의 변화와 키나아제 활성화를 유도하여 다양한 비유전체 세포 기능을 이끌 수 있다.에스트로겐과 프로게스테론은 세포핵으로 전이되어 호르몬 반응 요소(HRE)로 알려진 DNA의 영역과 상호작용하거나 다른 전사 인자의 결합 부위에 결합되는 그들의 인지된 핵 호르몬 수용체에 결합합니다.에스트로겐 수용체(ER)는 유전자의 근위 프로모터 영역에 에스트로겐 반응 요소(ERE)가 없음에도 불구하고 이와 같은 방식으로 다른 전사 인자를 활성화하는 것으로 나타났다.일반적으로 ERs와 프로게스테론 수용체(PRs)는 유전자 활성제이며 호르몬 [citation needed]노출 후 mRNA와 후속 단백질 합성이 증가한다.
남성과 여성의 뇌는 에스트로겐 수용체의 분포가 다르며, 이러한 차이는 신생아 스테로이드 [citation needed]노출의 돌이킬 수 없는 결과이다.에스트로겐 수용체(및 프로게스테론 수용체)는 주로 시상하부의 앞부분과 중간부분 뉴런에서 발견되며, 특히 다음과 같다.
- 광전 영역(LHRH 뉴런이 위치하여 도파민 반응과 모성 [16]행동을 조절한다.)
- 소마토스타틴 뉴런이 위치한 방실주위의 핵으로 스트레스 [17]수준을 조절한다.
- 배고픔과 성적 각성을 조절하는 복측 시상하부
발전
신생아 생활에서 생식선 스테로이드제는 시상하부의 신경내분비 발달에 영향을 미친다.예를 들어, 그들은 암컷이 정상적인 생식 주기를 보이는 능력, 그리고 수컷과 암컷이 성인의 삶에서 적절한 생식 행동을 보이는 능력을 결정한다.
- 암컷 쥐가 산후 첫 며칠 동안 테스토스테론을 한 번 주입하면 시상하부는 돌이킬 수 없을 정도로 남성화된다.성체 쥐는 에스트로겐(암컷의 특징)에 반응하여 LH 급증을 일으킬 수 없지만 수컷의 성을 나타낼 수 있다.(성적으로 수용적인 [18]암컷을 제외함)
- 반면 태어난 직후 거세된 수컷 쥐는 여성화되고 성인은 에스트로겐에 반응해 여성의 [18]성행동을 보인다.
영장류에서 안드로겐의 발달적 영향은 덜 명확하고 그 결과는 덜 이해된다.뇌에서 테스토스테론은 발달에 영향을 미치는 주요 활성 호르몬인 방향족화된다.인간의 고환은 태아의 약 8주부터 출생 후 5~6개월까지 높은 수준의 테스토스테론을 분비한다(많은 종에서 테스토스테론의 유사한 주산기 급증이 관찰된다). 이 과정은 남성 표현형의 근저에 있는 것으로 보인다.모체 순환에서 나오는 에스트로겐은 상대적으로 효과가 없는데,[18] 부분적으로 임신 중 스테로이드 결합 단백질의 높은 순환 수치 때문이다.
성 스테로이드제는 시상하부 발달에 대한 중요한 영향만이 아니다; 특히, (쥐의) 초기 사춘기 전 스트레스는 급성 스트레스 [19]인자에 반응하는 성인 시상하부의 능력을 결정한다.생식선 스테로이드 수용체와 달리, 글루코콜티코이드 수용체는 뇌 전체에 매우 널리 퍼져 있습니다; 부심실 핵에서, 그들은 CRF 합성과 분비의 음성 피드백 제어를 매개하지만, 다른 곳에서는 그들의 역할이 잘 이해되지 않습니다.
기능.
호르몬 방출
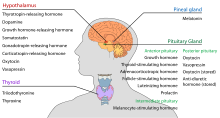
시상하부는 중추신경 내분비 기능을 가지고 있으며, 특히 뇌하수체 전엽을 조절하여 다양한 내분비샘과 장기를 조절합니다.분비 호르몬은 시상하부 핵에서 생성된 후 축삭을 따라 중앙 돌출부 또는 후뇌하수체로 운반되며,[20] 필요에 따라 저장되고 방출됩니다.
- 뇌하수체 전엽
시상하부-아데노하수체축에서는 시상하부의 연장인 중앙 돌출부에서 시상하부의 연장인 방출 호르몬이 뇌하수체 전방으로 방출되어 뇌하수체 분비 조절 기능을 발휘한다.하이씰 [21]호르몬이 저생체 호르몬들은 시상하부의 방실 주위에 위치한 파세포 신경 분비 세포에 의해 자극된다.제3심실의 모세혈관으로 방출된 후, 저생체 호르몬은 시상하부-뇌하수체 간문 순환으로 알려진 것을 통해 이동한다.일단 그들이 뇌하수체 전엽의 목적지에 도달하면, 이 호르몬들은 뇌하수체 세포의 표면에 위치한 특정 수용체와 결합합니다.어떤 세포가 이 결합을 통해 활성화되느냐에 따라 뇌하수체는 나머지 [22]혈류로 호르몬 분비를 시작하거나 호르몬 분비를 멈출 것이다.
| 분비 호르몬 | 줄임말 | 제작자 | 영향 |
|---|---|---|---|
| 티로트로핀 방출 호르몬 (프롤락틴 방출 호르몬) | TRH, TRF 또는 PRH | 방실핵의 방세포 신경분비세포 | 뇌하수체 전엽에서 방출되는 갑상선자극호르몬(TSH)을 자극한다(주로). 뇌하수체 전엽에서 프로락틴 분비를 촉진하다 |
| 코르티코트로핀 방출 호르몬 | CRH 또는 CRF | 방실핵의 방세포 신경분비세포 | 뇌하수체 전엽에서 방출되는 부신피질자극호르몬(ACTH)을 자극한다. |
| 도파민 (프롤락틴 억제 호르몬) | DA 또는 PIH | 호상핵의 도파민 뉴런 | 뇌하수체 전엽에서 프로락틴 방출을 억제하다 |
| 성장 호르몬 | GHRH | 호상핵의 신경내분비뉴런 | 뇌하수체 전엽에서 성장 호르몬(GH) 방출을 자극 |
| 고나도트로핀 방출 호르몬 | GnRH 또는 LHRH | 전안구 신경내분비세포 | 뇌하수체 전엽 자극 호르몬(FSH) 방출을 자극하다 뇌하수체 전엽에서 방출되는 황체화 호르몬(LH)을 자극합니다. |
| 소마토스타틴[23] (성장촉진호르몬) | SS, GHIH 또는 SRIF | 방실주위의 신경내분비세포 | 뇌하수체 전엽에서 성장 호르몬(GH) 방출 억제 뇌하수체 전엽에서 갑상선자극호르몬(TSH) 방출을 억제(중간) |
중앙 돌출부에서 분비되는 다른 호르몬으로는 바소프레신, 옥시토신, 신경텐신 [24][25][26][27]등이 있다.
- 후뇌하수체
시상하부-신경하수체 축에서는 뇌하수체 후부에서 신경하수체 호르몬이 분비되는데, 이는 시상하부의 연장선이다.
| 분비 호르몬 | 줄임말 | 제작자 | 영향 |
|---|---|---|---|
| 옥시토신 | OXY 또는 OXT | 근실핵과 상안핵 마그노세포 신경분비세포 | 자궁 수축 수유(하강 반사) |
| 바소프레신 (항이뇨호르몬) | ADH 또는 AVP | 방실핵의 자기세포 및 근세포 신경분비세포, 상안핵의 자기세포 | 원위세관 세포의 수분 투과성 증가 및 신장 내 집적관 수분 재흡수 및 농축뇨 배설 가능 |
시상하부-하수체-부신축(HPA) 호르몬이 특정 피부질환과 피부 항상성과 관련이 있는 것으로 알려져 있다.HPA호르몬의 과잉활동이 스트레스와 관련된 피부질환과 [28]피부종양과 관련이 있다는 증거가 있다.
자극
시상하부는 많은 호르몬 및 행동 리듬, 신경 내분비 출력의 복잡한 패턴, 복잡한 항상성 메커니즘, 그리고 중요한 행동을 조정합니다.따라서 시상하부는 많은 다른 신호에 반응해야 하며, 그 중 일부는 외부에서 생성되고 일부는 내부에서 생성됩니다.시상 또는 피질에서 발생하는 델타파 신호전달은 호르몬 분비에 영향을 미치며, TRH가 억제되는 동안 GHRH와 프로락틴이 자극된다.
시상하부는 다음과 같은 반응을 보입니다.
- 조명: 주간 길이와 광동작으로 주기와 계절의 리듬을 조절합니다.
- 페로몬을 포함한 후각 자극
- 성선 스테로이드와 코르티코스테로이드를 포함한 스테로이드제
- 특히 심장, 장신경계(위장관)[29] 및 [citation needed]생식기관에서 발생하는 신경전달 정보.
- 자동 입력
- 렙틴, 그렐린, 앤지오텐신, 인슐린, 뇌하수체 호르몬, 사이토카인, 포도당의 혈장 농도 및 삼투압 등을 포함한 혈액 매개 자극
- 스트레스
- 체온을 높여 미생물을 침입시키고, 체온조절기를 위쪽으로 되돌립니다.
후각 자극
후각 자극은 많은 종에서 성 생식 및 신경 내분비 기능에 중요하다.예를 들어, 임신한 쥐가 성교 후 중요한 기간 동안 '이상한' 수컷의 소변에 노출되면 임신은 실패한다(브루스 효과).따라서, 성교하는 동안 암컷 쥐는 며칠 동안 지속되는 파트너의 정확한 후각 기억을 형성합니다.페로몬 단서는 많은 종에서 발정기의 동기화를 돕습니다; 비록 인간에서 페로몬의 역할이 논쟁되기는 하지만, 여성의 경우, 동시 월경은 페로몬 단서에서 발생할 수도 있습니다.
혈액 매개 자극
펩타이드 호르몬은 시상하부에 중요한 영향을 미치며, 그러기 위해서는 혈액-뇌 장벽을 통과해야 한다.시상하부는 부분적으로 효과적인 혈액-뇌 장벽이 없는 전문화된 뇌 영역에 의해 제한된다; 이러한 부위의 모세혈관 내피는 심지어 큰 단백질과 다른 분자의 자유로운 통과를 허용하기 위해 펜스트레이션된다.이 부위들 중 일부는 신경분비 부위이다 - 신경하수체와 중앙 돌출부.하지만, 다른 것들은 뇌가 혈액의 성분을 채취하는 부위들이다.이들 부위 중 두 곳, SFO와 OVLT는 뉴런이 혈액과 CSF 둘 다와 밀접하게 접촉하는 소위 심실주위 장기이다.이러한 구조는 촘촘하게 혈관화되어 있으며, 음주, 바소프레신 방출, 나트륨 배설 및 나트륨 식욕을 조절하는 삼투압 및 나트륨 수용성 뉴런을 포함합니다.그들은 또한 안지오텐신, 심방나트륨뇨인자, 엔도테린, 릴렉신 수용체를 가진 뉴런을 포함하고 있으며, 각각은 유체 및 전해질 균형 조절에 중요하다.OVLT와 SFO의 뉴런은 상안핵과 방실핵에 투영되며 시상하부 영역에도 투영된다.또한 심실 주변 기관은 방실 [citation needed]신경세포에 대한 영향을 통해 발열과 ACTH 분비를 유도하기 위한 인터류킨의 작용 부위가 될 수 있다.
시상하부 활동에 영향을 미치는 모든 펩타이드가 어떻게 필요한 접근을 얻는지 명확하지 않다.프로락틴과 렙틴의 경우, 뇌척수액(CSF)으로 혈액에서 맥락막총에서 활발하게 흡수되는 증거가 있다.일부 뇌하수체 호르몬은 시상하부 분비에 부정적인 피드백 영향을 미친다. 예를 들어 성장 호르몬은 시상하부를 역류하지만 어떻게 뇌로 유입되는지는 명확하지 않다.프로락틴의 [citation needed]중심 작용에 대한 증거도 있다.
연구결과는 갑상선 호르몬(T4)이 시상하부 신경교세포에 의해 흡수되어 여기서 타입2의 디오디나아제(D2)에 의해 T3로 변환되는 것을 시사하고 있다.그 후 T3는 방실핵 내의 티로트로핀 방출호르몬(TRH) 생성 뉴런으로 운반된다.갑상선 호르몬 수용체는 이들 뉴런에서 발견되어 T3 자극에 정말로 민감하다는 것을 보여준다.또한 이들 뉴런은 갑상선 호르몬 운반체인 MCT8을 발현시켜 T3가 그들 안으로 운반된다는 이론을 뒷받침했다.T3는 이들 뉴런의 갑상선 호르몬 수용체에 결합해 티로트로핀 방출 호르몬 생산에 영향을 미쳐 갑상선 호르몬 [30]생성을 조절할 수 있다.
시상하부는 [31]몸을 위한 온도조절기의 한 종류로 기능한다.원하는 체온을 설정하고 열 생성과 유지를 촉진하여 혈액 온도를 더 높게 올리거나 땀을 흘리고 혈관을 확장하여 혈액을 더 낮은 온도로 냉각시킵니다.모든 열은 시상하부의 상승된 설정으로 인해 발생하며, 다른 원인으로 인한 체온 상승은 온열증으로 [31]분류된다.드물게 뇌졸중과 같이 시상하부에 직접 손상이 가해지는 것은 발열을 일으킬 것이다; 이것은 때때로 시상하부열이라고 불린다.하지만, 이러한 손상은 비정상적으로 낮은 [31]체온을 야기하는 것이 더 흔하다.
스테로이드
시상하부는 스테로이드와 글루코콜티코이드 (ACTH에 반응하여 분비되는 부신의 스테로이드 호르몬)에 강하게 반응하는 뉴런을 포함합니다.그것은 또한 식욕에 중요한 특화된 포도당 민감 뉴런을 포함합니다.시력전 영역은 열감응성 뉴런을 포함하고 있다; 이것들은 TRH 분비에 중요하다.
신경
젖먹이 또는 질경련 자극에 대한 반응의 옥시토신 분비는 이들 경로의 일부에 의해 매개되며, 경동맥체 및 대동맥궁의 화학수용체 및 저압심방용량 수용체로부터 발생하는 심혈관 자극에 대한 바소프레신 분비는 다른 경로에 의해 매개된다.쥐는 질 자극으로 프로락틴 분비가 일어나 불임 교미에 따른 의사임신이 된다.토끼의 성욕은 반사 배란을 일으킨다.양의 경우, 높은 수준의 에스트로겐이 존재하는 상태에서 자궁경부 자극은 처녀 암양에서 모성 행동을 유도할 수 있습니다.이러한 영향은 시상하부에 의해 모두 조정되며, 정보는 주로 뇌간에서 중계되는 척추 경로를 통해 전달됩니다.젖꼭지의 자극은 옥시토신과 프로락틴의 분비를 촉진하고 LH와 FSH의 분비를 억제한다.
심혈관 자극은 미주신경에 의해 전달된다.또한 미간은 각각 렙틴 또는 가스트린의 방출을 신호로 하여 영양 공급을 억제하거나 촉진하기 위해 예를 들어 위팽창 또는 비움에서 발생하는 신호를 포함한 다양한 내장 정보를 전달한다.다시 이 정보는 뇌간의 릴레이를 통해 시상하부에 도달한다.
또한 시상하부 기능은 신경화를 받는 작용에서 노르아드레날린, 도파민 및 세로토닌(5-히드록시 트립타민)의 세 가지 고전적 모노아민 신경전달물질 모두에 반응하고 그에 의해 조절된다.예를 들어 강압궤적에서 발생하는 노르아드레날린성 입력은 피질코트로핀 방출 호르몬(CRH) 수준에 중요한 조절 효과를 가진다.
식품 섭취 관리
| 증가하는 펩타이드 섭식 거동 | 감소하는 펩타이드 섭식 거동 |
|---|---|
| 그렐린 | 렙틴 |
| 신경펩타이드 Y | (α,β,γ)-멜라노사이트 자극 호르몬 |
| 아구티관련펩타이드 | 코카인 및 암페타민 조절 전사 펩타이드 |
| 오렉신(A,B) | 코르티코트로핀 방출 호르몬 |
| 멜라닌 농축 호르몬 | 콜레시스토키닌 |
| 갈라닌 | 인슐린 |
| 글루카곤유사펩타이드1 |
시상하부의 복막핵의 극외측부는 음식 섭취를 조절하는 역할을 한다.이 부위의 자극은 음식 섭취를 증가시킨다.이 부위의 양쪽 병변은 음식 섭취를 완전히 중단시킨다.핵의 안쪽 부분은 측면 부분에 조절 효과가 있다.복측핵의 내측부 양쪽 병변은 동물의 과식 및 비만을 일으킨다.같은 동물에서 복막핵의 외측부 병변이 일어나면 음식 섭취가 완전히 중단된다.
이 [33]규정과 관련된 여러 가지 가설이 있습니다.
- 지방 고정 가설:이 가설은 지방 조직이 지방의 양에 비례하는 체액 신호를 생성하고 시상하부에 작용하여 음식 섭취를 줄이고 에너지 생산량을 증가시킨다는 것입니다.호르몬 렙틴이 시상하부에 작용하여 음식 섭취를 줄이고 에너지 생산량을 증가시킨다는 것은 명백하다.
- 구펩타이드 가설: Grp, 글루카곤, CCK와 같은 위장 호르몬이 음식 섭취를 억제한다고 주장되었습니다.위장관에 들어간 음식은 이러한 호르몬의 분비를 유발하고, 이는 뇌에 포만감을 주기 위해 작용한다.뇌에는 CCK-A 수용체와 CCK-B 수용체가 모두 포함되어 있다.
- 글루코스타틱 가설:복막핵의 포만중추의 활동은 아마도 뉴런의 포도당 이용에 의해 지배될 것이다.이들의 포도당 이용률이 낮고 결과적으로 그들 사이의 동맥 혈당 차이가 낮을 때 뉴런 전체의 활동이 감소한다고 가정했다.이 상태에서는, 영양 공급 센터의 활동이 억제되어 개인이 배고픔을 느낀다.2-디옥시글루코스의 심실내 투여에 의해 음식 섭취가 급속히 증가하므로 세포 내 포도당 이용률이 감소한다.
- 온도 조절 가설:이 가설에 따르면 체온이 일정 기준치 이하로 떨어지면 식욕이 촉진되는 반면, 기준치 이상으로 높아지면 식욕이 억제된다.
공포 처리
시상하부의 안쪽 영역은 방어 [34]행동과 같은 동기 부여 행동을 제어하는 회로의 일부입니다.Fos-labeling의 분석은 "행동 제어 컬럼"의 일련의 핵이 선천적 및 조건부 방어 [35]행동의 발현을 조절하는 데 중요하다는 것을 보여주었다.
- 반감시적 방어 행동
맹수(고양이 등)에 대한 노출은 실험용 설치류에서 방어 행동을 유발하며,[36] 심지어 동물이 고양이에게 노출되지 않았을 때도 마찬가지입니다.시상하부에서 이 노출은 시상하부 전핵, 복측핵의 배측부 및 상악전핵(PMDvl)[37]의 복측부에 Fos표지세포의 증가를 일으킨다.상악 전핵은 포식자에 대한 방어 행동을 표현하는데 중요한 역할을 합니다. 왜냐하면 이 핵의 병변은 동파나 [37][38]비행과 같은 방어 행동을 폐지하기 때문입니다.이 핵의 병변은 충격 후 동결 [38]점수에 최소한의 영향을 미치기 때문에 PMD는 다른 상황에서 방어 행동을 조절하지 않습니다.PMD는 공포 [39][40]표현에서 중요한 구조인 배측근관 회백색과 중요한 연관성을 가지고 있다.또한, 동물들은 이전에 고양이와 관련된 환경에 대한 위험 평가 행동을 보인다.포스 라벨 세포 분석 결과 PMDvl은 시상하부에서 가장 활성화된 구조이며, 컨텍스트에 노출되기 전에 무시몰에 의한 불활성화는 방어 행동을 [37]폐지한다.따라서 시상하부, 주로 PMDvl은 포식자에 대한 선천적이고 조건적인 방어 행동을 표현하는데 중요한 역할을 합니다.
- 사회적 패배
마찬가지로 시상하부는 사회적 패배의 역할을 한다.공격적 동종과의 조우 시에도 중앙 영역의 핵이 동원된다.패배한 동물은 내측 광전핵, 복측핵의 복측부,[41] 복측부핵과 같은 성적 이형구조에서 Fos 수치가 증가한다.이러한 구조는 성적인 행동과 공격적인 행동과 같은 다른 사회적 행동에서 중요하다.또한 전유두핵도 동원되며,[41] 배측부는 동원되지 않는다.이 핵의 병변은 동결이나 "뒤로" [41]자세와 같은 수동적인 방어 행동을 없앱니다.
기타 이미지
「 」를 참조해 주세요.
- 코프틴
- 시상하부-하수체-부신축(HPA축)
- 시상하부-뇌하수체-성선축(HPG축)
- 시상하부-하수체-갑상선축(HPT축)
- 시상하부경로
- 신경내분비학
- 수면의 신경과학
레퍼런스
- ^ Dr. Boeree, C. George. "The Emotional Nervous System". The Limbic System. Retrieved 18 April 2016.
- ^ Lemaire, Laurence A.; Cao, Chen; Yoon, Peter H.; Long, Juanjuan; Levine, Michael (April 2021). "The hypothalamus predates the origin of vertebrates". Science Advances. 7 (18): eabf7452. Bibcode:2021SciA....7.7452L. doi:10.1126/sciadv.abf7452. ISSN 2375-2548. PMC 8081355. PMID 33910896.
- ^ "NCI Dictionary of Cancer Terms". National Cancer Institute.
- ^ Saper, Clifford B.; Scammell, Thomas E.; Lu, Jun (2005). "Hypothalamic regulation of sleep and circadian rhythms". Nature. 437 (7063): 1257–1263. Bibcode:2005Natur.437.1257S. doi:10.1038/nature04284. ISSN 1476-4687. PMID 16251950. S2CID 1793658.
- ^ Inderbir Singh (September 2011). Textbook of Anatomy: Volume 3: Head and Neck, Central Nervous System. JP Medical Ltd. pp. 1101–. ISBN 978-93-5025-383-0.
- ^ Melmed, S; Polonsky, KS; Larsen, PR; Kronenberg, HM (2011). Williams Textbook of Endocrinology (12th ed.). Saunders. p. 107. ISBN 978-1437703245.
- ^ "Enlarged view of the hypothalamus". psycheducation.org. Jim Phelps. Archived from the original on 15 December 2005. Retrieved 7 February 2020.
- ^ "Diagram of Nuclei". universe-review.ca. Retrieved 7 February 2020.
- ^ "Emotion and the limbic system". utdallas.edu. Lucien T. "Tres" Thompson, The University of Texas at Dallas. Retrieved 7 February 2020.
- ^ Hall, John E.; Guyton, Arthur C. (2011). Guyton and Hall Textbook of Medical Physiology (12th ed.). Saunders/Elsevier. ISBN 978-1416045748.
- ^ Yoshida K, Li X, Cano G, Lazarus M, Saper CB (September 2009). "Parallel preoptic pathways for thermoregulation". The Journal of Neuroscience. 29 (38): 11954–64. doi:10.1523/JNEUROSCI.2643-09.2009. PMC 2782675. PMID 19776281.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 6: Widely Projecting Systems: Monoamines, Acetylcholine, and Orexin". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 175–176. ISBN 9780071481274.
Within the brain, histamine is synthesized exclusively by neurons with their cell bodies in the tuberomammillary nucleus (TMN) that lies within the posterior hypothalamus. There are approximately 64000 histaminergic neurons per side in humans. These cells project throughout the brain and spinal cord. Areas that receive especially dense projections include the cerebral cortex, hippocampus, neostriatum, nucleus accumbens, amygdala, and hypothalamus. ... While the best characterized function of the histamine system in the brain is regulation of sleep and arousal, histamine is also involved in learning and memory ... It also appears that histamine is involved in the regulation of feeding and energy balance.
- ^ Brain Research Bulletin 35:323–327, 1994
- ^ a b Hofman MA, Swaab DF (June 1989). "The sexually dimorphic nucleus of the preoptic area in the human brain: a comparative morphometric study". Journal of Anatomy. 164: 55–72. PMC 1256598. PMID 2606795.
- ^ Quinnies KM, Bonthuis PJ, Harris EP, Shetty SR, Rissman EF (2015). "Neural growth hormone: Regional regulation by estradiol and / or sex chromosome complement in male and female mice". Biology of Sex Differences. 6: 8. doi:10.1186/s13293-015-0026-x. PMC 4434521. PMID 25987976.
- ^ Castañeyra-Ruiz L, González-Marrero I, Castañeyra-Ruiz A, González-Toledo JM, Castañeyra-Ruiz M, de Paz-Carmona H, Castañeyra-Perdomo A, Carmona-Calero EM (2013). "Luteinizing hormone-releasing hormone distribution in the anterior hypothalamus of the female rats". ISRN Anatomy. 2013: 1–6. doi:10.5402/2013/870721. PMC 4392965. PMID 25938107.
- ^ Isgor C, Cecchi M, Kabbaj M, Akil H, Watson SJ (2003). "Estrogen receptor beta in the paraventricular nucleus of hypothalamus regulates the neuroendocrine response to stress and is regulated by corticosterone". Neuroscience. 121 (4): 837–45. doi:10.1016/S0306-4522(03)00561-X. PMID 14580933. S2CID 31026141.
- ^ a b c McCarthy MM, Arnold AP, Ball GF, Blaustein JD, De Vries GJ (February 2012). "Sex differences in the brain: the not so inconvenient truth". The Journal of Neuroscience. 32 (7): 2241–7. doi:10.1523/JNEUROSCI.5372-11.2012. PMC 3295598. PMID 22396398.
- ^ Romeo RD, Bellani R, Karatsoreos IN, Chhua N, Vernov M, Conrad CD, McEwen BS (April 2006). "Stress history and pubertal development interact to shape hypothalamic-pituitary-adrenal axis plasticity". Endocrinology. 147 (4): 1664–74. doi:10.1210/en.2005-1432. PMID 16410296.
- ^ Bowen, R. "Overview of Hypothalamic and Pituitary Hormones". Retrieved 5 October 2014.
- ^ Melmed S, Jameson JL (2005). "Disorders of the anterior pituitary and hypothalamus". In Kasper DL, Braunwald E, Fauci AS, et al. (eds.). Harrison's Principles of Internal Medicine (16th ed.). New York, NY: McGraw-Hill. pp. 2076–97. ISBN 978-0-07-139140-5.
- ^ Bear MF, Connors BW, Paradiso MA (2016). "Hypothalamic Control of the Anterior Pituitary". Neuroscience: Exploring the Brain (4th ed.). Philadelphia: Wolters Kluwer. p. 528. ISBN 978-0-7817-7817-6.
- ^ Ben-Shlomo A, Melmed S (March 2010). "Pituitary somatostatin receptor signaling". Trends in Endocrinology and Metabolism. 21 (3): 123–33. doi:10.1016/j.tem.2009.12.003. PMC 2834886. PMID 20149677.
- ^ Horn AM, Robinson IC, Fink G (February 1985). "Oxytocin and vasopressin in rat hypophysial portal blood: experimental studies in normal and Brattleboro rats". The Journal of Endocrinology. 104 (2): 211–24. doi:10.1677/joe.0.1040211. PMID 3968510.
- ^ Date Y, Mondal MS, Matsukura S, Ueta Y, Yamashita H, Kaiya H, Kangawa K, Nakazato M (March 2000). "Distribution of orexin/hypocretin in the rat median eminence and pituitary". Brain Research. Molecular Brain Research. 76 (1): 1–6. doi:10.1016/s0169-328x(99)00317-4. PMID 10719209.
- ^ Watanobe H, Takebe K (April 1993). "In vivo release of neurotensin from the median eminence of ovariectomized estrogen-primed rats as estimated by push-pull perfusion: correlation with luteinizing hormone and prolactin surges". Neuroendocrinology. 57 (4): 760–4. doi:10.1159/000126434. PMID 8367038.
- ^ Spinazzi R, Andreis PG, Rossi GP, Nussdorfer GG (March 2006). "Orexins in the regulation of the hypothalamic-pituitary-adrenal axis". Pharmacological Reviews. 58 (1): 46–57. doi:10.1124/pr.58.1.4. PMID 16507882. S2CID 17941978.
- ^ Jung Eun Kim; Baik Kee Cho; Dae Ho Cho; Hyun Jeong Park (2013). "Expression of Hypothalamic-Pituitary-Adrenal Axis in Common Skin Diseases: Evidence of its Association with Stress-related Disease Activity". National Research Foundation of Korea. Retrieved 4 March 2014.
- ^ Mayer EA (July 2011). "Gut feelings: the emerging biology of gut-brain communication". Nature Reviews. Neuroscience. 12 (8): 453–66. doi:10.1038/nrn3071. PMC 3845678. PMID 21750565.
- ^ Fliers E, Unmehopa UA, Alkemade A (June 2006). "Functional neuroanatomy of thyroid hormone feedback in the human hypothalamus and pituitary gland". Molecular and Cellular Endocrinology. 251 (1–2): 1–8. doi:10.1016/j.mce.2006.03.042. PMID 16707210. S2CID 33268046.
- ^ a b c Fauci, Anthony; et al. (2008). Harrison's Principles of Internal Medicine (17 ed.). McGraw-Hill Professional. pp. 117–121. ISBN 978-0-07-146633-2.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 10: Neural and Neuroendocrine Control of the Internal Milieu – Table 10:3". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. p. 263. ISBN 9780071481274.
- ^ Theologides A (May 1976). "Anorexia-producing intermediary metabolites". The American Journal of Clinical Nutrition. 29 (5): 552–8. doi:10.1093/ajcn/29.5.552. PMID 178168.
- ^ Swanson LW (December 2000). "Cerebral hemisphere regulation of motivated behavior". Brain Research. 886 (1–2): 113–164. doi:10.1016/S0006-8993(00)02905-X. PMID 11119693. S2CID 10167219.
- ^ Canteras, N.S. (2002). "The medial hypothalamic defensive system:Hodological organization and functional implications". Pharmacology Biochemistry and Behavior. 71 (3): 481–491. doi:10.1016/S0091-3057(01)00685-2. PMID 11830182. S2CID 12303256.
- ^ Ribeiro-Barbosa ER, Canteras NS, Cezário AF, Blanchard RJ, Blanchard DC (2005). "An alternative experimental procedure for studying predator-related defensive responses". Neuroscience and Biobehavioral Reviews. 29 (8): 1255–63. doi:10.1016/j.neubiorev.2005.04.006. PMID 16120464. S2CID 8063630.
- ^ a b c Cezario AF, Ribeiro-Barbosa ER, Baldo MV, Canteras NS (September 2008). "Hypothalamic sites responding to predator threats--the role of the dorsal premammillary nucleus in unconditioned and conditioned antipredatory defensive behavior". The European Journal of Neuroscience. 28 (5): 1003–15. doi:10.1111/j.1460-9568.2008.06392.x. PMID 18691328. S2CID 10073236.
- ^ a b Blanchard, D.C. (2003). "Dorsal premammillary nucleus differentially modulates defensive behaviors induced by different threat stimuli in rats". Neuroscience Letters. 345 (3): 145–148. doi:10.1016/S0304-3940(03)00415-4. PMID 12842277. S2CID 16406187.
- ^ Canteras NS, Swanson LW (November 1992). "The dorsal premammillary nucleus: an unusual component of the mammillary body". Proceedings of the National Academy of Sciences of the United States of America. 89 (21): 10089–93. Bibcode:1992PNAS...8910089C. doi:10.1073/pnas.89.21.10089. PMC 50283. PMID 1279669.
- ^ Behbehani MM (August 1995). "Functional characteristics of the midbrain periaqueductal gray". Progress in Neurobiology. 46 (6): 575–605. doi:10.1016/0301-0082(95)00009-K. PMID 8545545. S2CID 24690642.
- ^ a b c Motta SC, Goto M, Gouveia FV, Baldo MV, Canteras NS, Swanson LW (March 2009). "Dissecting the brain's fear system reveals the hypothalamus is critical for responding in subordinate conspecific intruders". Proceedings of the National Academy of Sciences of the United States of America. 106 (12): 4870–5. Bibcode:2009PNAS..106.4870M. doi:10.1073/pnas.0900939106. PMC 2660765. PMID 19273843.
추가 정보
- de Vries GJ, Södersten P (May 2009). "Sex differences in the brain: the relation between structure and function". Hormones and Behavior. 55 (5): 589–96. doi:10.1016/j.yhbeh.2009.03.012. PMC 3932614. PMID 19446075.
외부 링크
- BrainMaps 프로젝트의 "Hypothalamus"를 포함하는 염색된 뇌 슬라이스 이미지
- 시상하부와 뇌하수체(endotexts.org)
- NIF 검색 - 신경과학 정보 프레임워크를 통한 시상하부
- 시상하부핵의 공간 채우기 및 단면도: 우측 시상하부, 전방, 관상, 후방.


![Hypothalamic nuclei on one side of the hypothalamus, shown in a 3-D computer reconstruction[13]](http://upload.wikimedia.org/wikipedia/commons/thumb/0/04/3D-Hypothalamus.JPG/120px-3D-Hypothalamus.JPG)