이중 결합
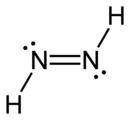
Double bond화학에서 이중 결합은 단일 결합의 2개가 아닌 4개의 결합 전자를 포함하는 두 원자 사이의 공유 결합이다.이중 결합은 두 개의 탄소 원자 사이에서 가장 흔하게 발생합니다. 예를 들어 알케인에서요.예를 들어 탄소 원자와 산소 원자 사이의 카르보닐기 등 두 가지 다른 요소 사이에 많은 이중 결합이 존재합니다.기타 일반적인 이중 결합은 아조 화합물(N=N), 이민(C=N) 및 술폭시드(S=O)에서 발견된다.골격식은 연결된 2개의 원자 사이에 2개의 평행선(=)으로 이중결합을 그린다.유형학적으로 이를 [1][2]위해 등호를 사용한다.이중 결합은 러시아 화학자 알렉산더 버틀로프에 [citation needed]의해 화학 표기법으로 처음 도입되었다.
탄소를 포함한 이중 결합은 단일 결합보다 더 강하고 짧습니다.채권 순서는 2개입니다.이중 결합은 또한 전자가 풍부하기 때문에 강력한 전자 수용체(할로겐의 반응과 마찬가지로)가 존재할 경우 잠재적으로 더 반응성이 높아집니다.
- 이중결합을 가진 화합물
아세톤 탄소-산소 이중 결합
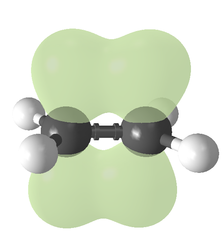
알케인의 이중 결합
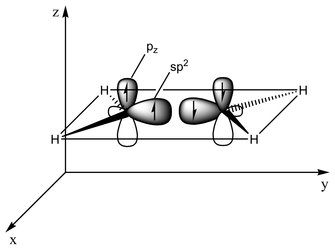
결합의 유형은 궤도 교잡의 관점에서 설명될 수 있다.에틸렌은 각 탄소 원자가 3개의2 sp 오비탈과 1개의 p 오비탈을 가지고 있다.3개의2 sp 궤도는 최대 120°의 각도의 평면에 있습니다.p-궤도는 이 평면에 수직이다.탄소 원자가 서로 접근하면, 두 개의 SP2 궤도가 겹쳐서 시그마 결합을 형성합니다.동시에 두 p-오비탈은 (같은 평면에서) 접근하고 함께 파이 결합을 형성합니다.최대 중첩을 위해 p-오비탈은 평행 상태를 유지해야 하므로 중심 결합을 중심으로 회전할 수 없습니다.이 성질은 cis-trans 이성질체를 일으킨다.이중 결합은 p-궤도 중첩이 극대화되기 때문에 단일 결합보다 짧다.
133 pm으로 에틸렌 C=C 결합 길이가 154 pm으로 에탄 내 C-C 길이보다 짧다.이중 결합도 636 kJ−1 mol 대 368 kJ−1 mol로 더 강하지만 파이 결합의 두 배 정도는 덜 효과적인 파이 오버랩으로 인해 시그마 결합보다 약합니다.
대체 표현에서 이중 결합은 구부러진 [3]결합과 같이 2개의 겹치는3 스패 오비탈에서 발생한다.
바리에이션
이중 결합과 단일 결합을 번갈아 가지는 분자에서, p-궤도 중첩은 사슬의 여러 원자에 걸쳐 존재할 수 있으며, 이는 켤레 시스템을 발생시킨다.결합은 디엔과 에논과 같은 시스템에서 찾을 수 있다.고리형 분자에서 결합은 방향족으로 이어질 수 있다.적란에서는 2개의 이중 결합이 인접해 있다.
이중 결합은 2주기 원소인 탄소, 질소 및 산소에 일반적이며, 더 높은 주기의 원소에는 덜 일반적입니다.금속도 금속 배위자 다중 결합에 관여할 수 있습니다.
14족 알켄 호몰로그
이중 결합 화합물, 알켄 호몰로그, RE2=ER는2 이제 모든 무거운 14족 원소에 대해 알려져 있습니다.알켄과 달리 이들 화합물은 평면이 아니라 트위스트 및/또는 트랜스 벤드 구조를 채택한다.이러한 효과는 무거운 원소일수록 더욱 뚜렷해집니다.디스타넨(MeSi3)2CHSn=SnCH(SiMe3)2는 단일 결합보다 약간 짧은 주석-주석 결합 길이, 각 주석 원자에 피라미드 배위성을 가진 트랜스 벤드 구조를 가지며 용액에서 쉽게 분리되어 (MeSi3)2C를 형성한다.(스타난디아일, 카르벤 유사체)결합은 두 개의 약한 기증자 수용체 결합으로 구성되어 있으며, 각 주석 원자의 단일 쌍은 다른 [4][5]주석의 빈 p 오비탈과 겹칩니다.반면 디실렌에서는 각 실리콘 원자는 평면 배위를 가지지만 치환기는 분자 전체가 평면상이 되지 않도록 꼬여 있다.디플럼벤에서 Pb=Pb 결합 길이는 많은 대응하는 단일[5] 결합 길이보다 길 수 있다. 일반적으로 플럼벤과 스타넨은 용액에서 대응하는 단일 결합의 극히 일부인 결합 엔탈피를 가진 단량체로 해리된다.일부 이중 결합 플리벤과 스타넨은 수소 [4]결합과 강도가 유사하다.Carter-Goddard-Malrieu-Trinquier 모델을 사용하여 [4]결합의 성질을 예측할 수 있습니다.
원자간 이중결합의 종류
| C | O | N | S | 시 | ge | 스니 | PB | |
|---|---|---|---|---|---|---|---|---|
| C | 알켄 | 카르보닐기 | imine | 티오케톤, 티알 | ||||
| O | 다이옥시겐 | 니트로소 화합물 | 술폭시드, 술폰, 술핀산, 술폰산 | |||||
| N | 아조 화합물 | |||||||
| S | 황을 제거하다 | |||||||
| 시 | 알킬리데닐란 | 실렌 | ||||||
| ge | 세균 | |||||||
| 스니 | 스타넨 | |||||||
| PB | 납 |
레퍼런스
- ^ March, Jerry, 1929-1997. (1985). Advanced organic chemistry : reactions, mechanisms, and structure (3rd ed.). New York: Wiley. ISBN 0-471-88841-9. OCLC 10998226.
{{cite book}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ McMurry, John. Organic chemistry (Ninth ed.). Boston, MA, USA. ISBN 978-1-305-08048-5. OCLC 907259297.
- ^ Carey, Francis A., 1937- (2007). Advanced organic chemistry. Sundberg, Richard J., 1938- (5th ed.). New York: Springer. ISBN 978-0-387-44897-8. OCLC 154040953.
{{cite book}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ a b c Power, Philip P. (1999). "π-Bonding and the Lone Pair Effect in Multiple Bonds between Heavier Main Group Elements". Chemical Reviews. 99 (12): 3463–3504. doi:10.1021/cr9408989. PMID 11849028.
- ^ a b Wang, Yuzhong; Robinson, Gregory H. (2009). "Unique homonuclear multiple bonding in main group compounds". Chemical Communications. Royal Society of Chemistry (35): 5201–5213. doi:10.1039/B908048A. PMID 19707626.
- Pyykkö, Pekka; Riedel, Sebastian; Patzschke, Michael (2005). "Triple-Bond Covalent Radii". Chemistry: A European Journal. 11 (12): 3511–20. doi:10.1002/chem.200401299. PMID 15832398.