메탄올
Methanol
| | |||
| | |||
 | |||
| 이름 | |||
|---|---|---|---|
| 발음 | /tmnnnl/ | ||
| 우선 IUPAC 이름 메탄올[1] | |||
| 기타 이름 카르비놀 콜럼비아의 정령 히드록시메탄 미오 메틸알코올 수산화메틸 메틸 알코올 메틸롤 메틸렌 하이드레이트, 1차 알코올 목초정령 목재 알코올 목재 나프타 나무정령 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 3 DMet | |||
| 1098229 | |||
| 체비 | |||
| 첸블 | |||
| 켐스파이더 | |||
| ECHA 정보 카드 | 100.000.599 | ||
| EC 번호 |
| ||
| 449 | |||
| 케그 | |||
| 메쉬 | 메탄올 | ||
PubChem CID | |||
| RTECS 번호 |
| ||
| 유니 | |||
| UN 번호 | 1230 | ||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| CHOH 3 또는 4 CHO | |||
| 몰 질량 | 32.04 g mol−1 | ||
| 외모 | 무색 액체 | ||
| 냄새 | 달콤하고 톡 쏘다 | ||
| 밀도 | 0.792 g/cm3[2] | ||
| 녹는점 | -97.6°C(-143.7°F, 175.6K) | ||
| 비등점 | 64.7 °C (148.5 °F, 337.8 K) | ||
| 혼선 | |||
| 로그 P | −0.69 | ||
| 증기압 | 13.02kPa (20°C에서) | ||
| 산도(pKa) | 15.5[3] | ||
| 켤레산 | 메틸록소늄[4] | ||
| 켤레 기저 | 메타놀레이트[5] | ||
자화율(δ) | - 21.40 · 10−6 cm3 / 세로 | ||
굴절률(nD) | 1.33141[6] | ||
| 점성 | 0.545 mPa/s (25 °[7]C에서) | ||
| 1.69 D | |||
| 열화학 | |||
| 725.7 kJ/mol, 173.4 kcal/mol, 5.77 kcal/g | |||
| 위험[12][13] 요소 | |||
| 산업안전보건(OHS/OSH): | |||
주요 위험 요소 | 메탄올과 그 증기는 인화성이 있다. 작은 동물에게 중간 정도의 독성 – 큰 동물과 사람에게 매우 독성이 있다(고농도로) – 삼킬 경우 치명적/치사적 또는 실명 및 간, 신장, 심장에 손상을 줄 수 있다 – 반복적인 과다 노출로 인한 독성 영향은 중추신경계, 특히 시신경에 축적되는 영향을 미칠 수 있다 – 증상 be 지연, 12시간에서 18시간 후에 심각해지고 노출 후 며칠[9] 동안 지속된다. | ||
| GHS 라벨링: | |||
   [8] [8] | |||
| 위험.[8] | |||
| H225, , , , , , , | |||
| P210, , , , , , , , , , , , , , , , , , , , , , , , , ,, | |||
| NFPA 704(파이어 다이아몬드) | |||
| 플래시 포인트 | 11 ~ 12 °C (52 ~54 °F, 284 ~285 K) | ||
| 470 °C (878 °F, 743 [15]K) 385 °C (725 °F, 658 [16]K) | |||
| 폭발 한계 | 6 ~ 36 %[10] | ||
| 치사량 또는 농도(LD, LC): | |||
LD50(중간선량) | 58 mg/kg (쥐, 경구) 730 mg/kg (경구) 1280mg/kg (랫드, 경구) 1400 mg/kg (경구)[11] | ||
LC50(중간 농도) | 64,000ppm (rat, 4시간)[11] | ||
LCLo(최저 공개) | 33,082ppm (고양이, 6시간) 37,594 ppm (표준, 2시간)[11] | ||
| NIOSH(미국 건강 노출 제한): | |||
PEL(허용) | TWA 200ppm (260mg/m3)[10] | ||
REL(권장) | TWA 200ppm (260mg/m3) ST 250ppm (325mg/m3) [피부][10] | ||
IDLH(즉시 위험) | 6000ppm[10] | ||
| 안전 데이터 시트(SDS) | [1] | ||
| 관련 화합물 | |||
관련 화합물 | 메타네티올 실라놀 에탄올 | ||
| 보충 데이터 페이지 | |||
| 메탄올(데이터 페이지) | |||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
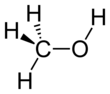
메틸 알코올로도 알려진 메탄올은 유기 화학 물질이며 가장 단순한 알코올로, 공식은3 CHOH(수산화기와 연결된 메틸기, 종종 MeOH로 약칭됩니다.에탄올(음용 알코올)[17]과 유사한 독특한 알코올 냄새를 가진 가볍고 휘발성, 무색, 인화성 액체입니다.극성 용매인 메탄올은 한때 주로 목재의 파괴 증류에 의해 생산되었기 때문에 목재 알코올이라는 이름을 얻었다.오늘날 메탄올은 주로 [18]일산화탄소의 수소화에 의해 산업적으로 생산된다.
메탄올은 극성 수산기와 연결된 메틸기로 구성되어 있다.연간 2천만 톤 이상 생산되며, 포름알데히드, 아세트산, 메틸 테르티부틸 에테르, 메틸벤조산, 아니솔, 페르옥시산 등 다른 일반 화학물질의 [18]선구자로 사용됩니다.
발생.
소량의 메탄올이 정상적이고 건강한 사람에게 존재한다.한 연구는 실험 [19]대상자들의 호흡에서 4.5ppm의 평균을 발견했습니다.사람의 평균 0.45g/d의 내인성 메탄올은 과일에서 발견되는 펙틴에서 대사될 수 있습니다. 사과 1kg은 최대 1.4g의 [20]메탄올을 생성합니다.
메탄올은 혐기성 박테리아와 식물성 플랑크톤에 [21][22]의해 생산된다.
성간 매질
메탄올은 또한 우주 공간의 별 형성 영역에서 풍부하게 발견되며 천문학에서 이러한 영역의 지표로 사용됩니다.그것은 스펙트럼 방출선을 [23]통해 감지된다.
2006년, 조드렐 뱅크 천문대의 MERLIN 전파 망원경을 사용하는 천문학자들은 [24][25]지름 463 테라메트르의 우주에서 메탄올의 큰 구름을 발견했다.2016년 천문학자들은 알마 전파망원경을 [26]이용해 젊은 별 TW 하이드라 주변의 행성 형성 원반에서 메탄올을 검출했다.
안전.
메탄올은 인화성이 매우 높다.그 증기는 공기보다 약간 더 무겁고, 이동하거나 발화할 수 있다.메탄올 화재는 건조 화학 물질, 이산화탄소, 물 스프레이 또는 알코올 내성 폼으로 [12]진화해야 합니다.
독성
순수 메탄올을 10 mL(0.34 US floz)만 섭취하면 시신경이 파괴되어 영구 실명할 수 있으며, 30 mL(1.0 US floz)는 [27]치명적일 수 있습니다.중간 치사량은 100 mL(3.4 US floz), 즉 순수 메탄올의 [28]1-2 mL/kg 체중이다.메탄올의 기준 선량은 [29][30]하루에 0.5mg/kg이다.독성 효과는 섭취 후 몇 시간 후에 시작되며, 해독제는 종종 영구적인 [27]손상을 예방할 수 있다.에탄올(음료 내 알코올)과 외관 및 냄새 모두 유사하기 때문에 이 둘을 구별하기가 어렵습니다. 변성 알코올, 불순 알코올 또는 매우 질 낮은 알코올 음료도 마찬가지입니다.
메탄올은 두 가지 메커니즘에 의해 독성이 있다.첫째, 메탄올은 에탄올 중독과 같은 방식으로 중추신경계 억제제 역할을 하는 중추신경계에 대한 영향으로 치명적일 수 있다.둘째, 독소화 과정에서 [31]간에서 알코올탈수소효소에 의해 개시되는 과정에서 포름알데히드를 통해 포름산(포름산 이온으로 존재하는 것)으로 대사된다.메탄올은 알코올탈수소효소(ADH)를 통해 포름알데히드로 전환되고, 포름알데히드는 알데히드탈수소효소(ALDH)를 통해 포름산(포름산)으로 전환된다.검출 가능한 포름알데히드가 [32]남지 않고 ALDH를 통해 형성되는 변환이 완전히 진행됩니다.포름산염은 미토콘드리아 시토크롬c 산화효소를 억제하여 세포 수준의 저산소증과 대사 [33]산증을 유발하기 때문에 독성이 있다.
메탄올 중독의 발생은 주로 음용 알코올의 오염으로 인해 발생했다.이것은 개발도상국에서 [34]더 흔하다.그럼에도 불구하고 2013년에는 미국에서 1700건 이상의 환자가 발생했다.영향을 받는 사람들은 종종 성인 [35]남성들이다.조기 [36]치료로 결과가 좋을 수 있습니다.메탄올에 대한 독성은 [37]1856년에 이미 기술되었다.
메탄올은 유독성 때문에 산업용으로 제조된 에탄올의 변성 첨가제로 자주 사용됩니다.메탄올을 첨가하면 미국과 다른 국가에서 공업용 에탄올(일반적으로 "변성 알코올" 또는 "메틸화 알코올"로 알려져 있음)의 주류 소비세가 면제됩니다.
COVID-19 대유행 과정에서 미국 식품의약국은 에탄올이 함유된 것으로 표시되었지만 메탄올 [38]오염에 양성 반응을 보이는 다수의 손 소독제 제품을 발견했다.FDA는 메탄올이 피부를 통해 흡수되거나 섭취될 경우 상대적으로 안전한 에탄올과 대조적으로 메탄올이 함유된 손세정제 제품에 대한 리콜을 명령하고 이들 제품이 미국 시장에 불법적으로 들어오는 [39]것을 막기 위해 수입 경보를 발령했다.
적용들
포름알데히드, 아세트산, 메틸테르트부틸에테르
메탄올은 주로 포름알데히드로 전환되는데, 포름알데히드는 많은 영역, 특히 폴리머에서 널리 사용됩니다.변환에는 산화가 수반됩니다.
아세트산은 메탄올에서 제조할 수 있다.
메탄올과 이소부텐을 조합하여 메틸테르트부틸에테르(MTBE)를 얻는다.MTBE는 휘발유의 주요 옥탄 부스터입니다.
메탄올과 탄화수소, 올레핀, 가솔린 연결
메탄올을 응축하여 탄화수소와 방향족 시스템을 생산하는 것은 기체와 액체와 관련된 여러 기술의 기초입니다.여기에는 메탄올-탄화수소(MtH), 메탄올-휘발유(MtG), 메탄올-올레핀(MtO) 및 메탄올-프로필렌(MtP)이 포함됩니다.이러한 변환은 이종 촉매로서 제올라이트에 의해 촉매된다.MtG 공정은 [41][42]한때 뉴질랜드 모투누이에서 상용화됐다.
가솔린 첨가물
유럽 연료 품질 지침에 따라 연료 생산자는 유럽에서 판매되는 휘발유와 동일한 양의 코졸벤트와 최대 3%의 메탄올을 혼합할 수 있습니다.중국은 연간 45억 리터 이상의 메탄올을 기존 차량용 저준위 혼합 연료로, 메탄올 [citation needed]연료용 고준위 혼합 연료로 사용하고 있다.그러나 최근 몇 년 동안 대부분의 현대식 가솔린 차량에서는 다양한 알코올 연료를 사용할 수 있어 마력이 비슷하거나 더 높지만, 차량의 소프트웨어 설정 변경과 50센트의 씰 또는 튜브 [43]부품이 필요할 수 있습니다.
기타 화학물질
메탄올은 대부분의 단순 메틸아민, 메틸 할로겐화물 및 메틸 [18]에테르의 전구체이다.메틸에스테르는 메탄올로부터 생산되며, 지방의 에스테르 교환과 에스테르 [44][45]교환을 통한 바이오디젤 생산을 포함한다.
틈새 및 잠재적 용도
에너지 캐리어
메탄올은 액체로서 수소와 천연가스보다 저장하기 쉽기 때문에 유망한 에너지 운반체입니다.그러나 그것의 에너지 밀도는 kg당 메탄보다 낮다.연소 에너지 밀도는 15.6 MJ/L이며, 에탄올은 24, 휘발유는 33 MJ/L이다.
메탄올의 또 다른 장점은 생분해성과 낮은 환경독성이다.호기성(산소-존재) 또는 혐기성(산소-부존재) 환경에서는 지속되지 않습니다.지하수에서 메탄올의 반감기는 1일에서 7일 정도인데 반해, 많은 일반적인 가솔린 성분은 수백 일 안에 반감기를 가집니다(10일에서 730일 사이의 벤젠 등).메탄올은 물과 혼합되어 생분해되기 때문에 지하수, 지표수, 공기 또는 [46]토양에 축적되지 않습니다.
연료
메탄올은 때때로 내연기관에 연료를 공급하는 데 사용됩니다.이산화탄소와 물을 생성하며 연소합니다.
메탄올 연료는 지상 운송용으로 제안되었다.메탄올 이코노미의 주요 장점은 엔진을 최소로 개조한 가솔린 내연 기관과 액체 연료를 공급하고 저장하는 인프라에 적합할 수 있다는 것입니다.그러나 에너지 밀도가 가솔린보다 낮기 때문에 더 자주 보충해야 합니다.그러나 마력으로는 초고옥탄가솔린과 맞먹으며, 대부분의 현대식 컴퓨터 제어 연료 분사 시스템은 이미 [47]그것을 사용할 수 있다.
메탄올은 선박의 대체 연료로 해운업계가 갈수록 엄격해지는 배기 가스 규제를 충족시키는 데 도움이 됩니다.황산화물(SOx), 질소산화물(NOx) 및 미립자 물질의 배출을 크게 줄여줍니다.메탄올은 소량의 파일럿 연료(듀얼 연료)[48][49]를 사용하여 약간의 개조 후 선박용 디젤 엔진에 고효율로 사용될 수 있습니다.
중국에서는 메탄올이 산업용 보일러에 연료를 공급하여 다양한 산업 용도 및 주택 난방을 위한 열과 증기를 발생시키는 데 광범위하게 사용됩니다.그 사용은 점점 더 엄격한 환경 [50]규제로 압박을 받고 있는 석탄을 대체하고 있다.
직접 메탄올 연료 전지는 저온 대기압 작동으로 매우 [51][52]소형화할 수 있습니다.이는 메탄올의 비교적 쉽고 안전한 보관과 취급과 결합되어 노트북 컴퓨터 및 휴대 [53]전화와 같은 연료 전지식 가전 제품의 가능성을 열 수 있습니다.
메탄올은 또한 캠핑과 보트 스토브에서 널리 사용되는 연료이다.메탄올은 압축되지 않은 버너에서 잘 연소되기 때문에 알코올 스토브는 종종 매우 단순하며 때로는 연료를 담는 컵보다 조금 더 많습니다.이러한 복잡성의 부족은 그들을 야생에서 오랜 시간을 보내는 등산객들이 좋아하는 것으로 만든다.마찬가지로, 알코올을 겔로 겔로 겔화하여 "Sterno" 브랜드와 같이 누출 또는 유출 위험을 줄일 수 있습니다.
메탄올은 물과 혼합되어 고성능 디젤 및 가솔린 엔진에 주입되어 물 메탄올 주입이라고 알려진 프로세스에서 출력을 높이고 흡기 온도를 낮춥니다.
기타 응용 프로그램
메탄올은 에탄올의 변성제로 사용되며, 이 제품은 "변성 알코올" 또는 "메틸화 알코올"로 알려져 있습니다.이것은 금주법 기간 동안 불법 주류의 소비를 막기 위해 흔히 사용되었고, 결국 여러 [54]명의 사망자를 낳았다.이런 종류의 관행은 현재 미국에서 불법으로 간주되어 살인 [55]행위로 간주되고 있다.
메탄올은 파이프라인 및 윈드실드 워셔액에서 용매 및 부동액으로 사용됩니다.메탄올은 1900년대 [56]초에 자동차용 냉각수 부동액으로 사용되었다.2018년 5월 현재 EU에서는 2012년 체코 메탄올 [59]중독으로 인한 인체 소비[57][58] 위험 때문에 앞유리 세척 및 해동 사용이 금지되어 있습니다.
일부 폐수처리장에서는 소량의 메탄올을 폐수에 첨가하여 탈질세균의 탄소식량원을 제공하고, 질산염을 질소가스로 변환하여 민감한 대수층의 질화를 감소시킨다.
폴리아크릴아미드겔 전기영동 중에 메탄올을 파괴제로 사용한다.
생산.
합성 가스로부터
일산화탄소와 수소는 촉매 위에서 반응하여 메탄올을 생성한다.오늘날 가장 널리 사용되는 촉매는 1966년 ICI에서 처음 사용된 것처럼 알루미나에서 지원되는 구리와 산화 아연의 혼합물입니다.5~10 MPa(50~100 atm) 및 250 °C(482 °F)에서 반응은
선택성이 높은(99.8%) 것이 특징입니다.메탄으로부터 합성 가스를 생산하면 일산화탄소 1몰당 수소 3몰을 생성하는 반면, 합성은 일산화탄소 1몰당 수소 가스를 2몰만 소비한다.과잉수소를 처리하는 한 가지 방법은 메탄올 합성반응기에 이산화탄소를 주입하는 것이며, 여기서도 반응하여 다음 식에 따라 메탄올을 형성한다.
- OH + O ( \ + H2 - > +)
메커니즘 측면에서, 이 과정은 CO를 CO로2 초기 전환한 후 [60]수소화됩니다.
HO 부산물은2 물-가스 이동 반응을 통해 재활용됩니다.
- + O (\+
이것은 전체적인 반응을 일으킨다.
이는 위에 나열된 것과 같습니다.합성가스로부터의 메탄올 생성과 밀접한 관련이 있는 공정에서는 수소와 CO의2 사료를 [61]직접 사용할 수 있다.이 과정의 주요 장점은 전기 분해에서 공급되는 포집된2 CO와 수소를 사용할 수 있어 화석 연료에 대한 의존성을 제거할 수 있다는 것이다.
생합성
메탄에서 메탄올로의 촉매 변환은 메탄 모노옥시게나아제를 포함한 효소에 의해 영향을 받는다.이러한 효소는 혼합 기능성 산소 분해효소입니다. 즉, 산소는 물과 [63]NAD의+ 생산과[62] 결합됩니다.
- 4+ + + OH + O + + {+ + }。
Fe-의존성 효소와 Cu-의존성 효소가 모두 [63]특징지어졌다.이러한 [64][65]반응을 모방하기 위해 격렬하지만 대부분 성과가 없는 노력이 수행되었다.메탄올은 원료 메탄보다 쉽게 산화되기 때문에 반응이 선택적이지 않은 경향이 있다.이 문제를 회피하기 위한 몇 가지 전략이 존재합니다.예를 들어 실로프 시스템과 제올라이트를 [66]함유한 Fe-와 Cu가 포함된다.이러한 시스템은 반드시 금속 효소에 의해 사용되는 메커니즘을 모방하는 것이 아니라 그것들로부터 영감을 얻습니다.활성 부위는 효소에 알려진 부위와는 상당히 다를 수 있습니다.예를 들어, sMMO 효소에는 2핵 활성 부위가 제안되고, Fe-zeolite에는 [67]단핵 철(α-산소)이 제안된다.
품질사양 및 분석
메탄올은 다양한 순도 등급으로 시판되고 있습니다.시판되는 메탄올은 일반적으로 ASTM 순도 등급 A 및 AA에 따라 분류된다.A등급과 AA등급 순도는 모두 99.85% 메탄올이다.등급 "AA" 메탄올에는 [68]미량의 에탄올도 포함되어 있습니다.
화학용 메탄올은 일반적으로 등급 AA에 해당한다.물과 더불어 대표적인 불순물로는 아세톤과 에탄올이 있습니다(증류로는 분리하기 매우 어렵습니다).UV-vis 분광법은 방향성 불순물을 검출하는 편리한 방법입니다.수분 함량은 Karl-Fischer 적정법에 의해 결정될 수 있다.
역사
방부처리 과정에서 고대 이집트인들은 목재의 열분해에서 얻은 메탄올을 포함한 물질의 혼합물을 사용했다.그러나 순수한 메탄올은 로버트 보일이 Buxus (박스우드)[69]의 증류를 통해 생산했을 때 1661년에 처음 분리되었다.그것은 나중에 "피록실 정신"으로 알려지게 되었다.1834년, 프랑스의 화학자 장 밥티스트 뒤마와 유진 펠리고가 그것의 원소 [70]성분을 결정했어요.
그들은 또한 "메틸렌"이라는 단어를 유기 화학에 도입하여 그리스 메티 = "유기 액체" + "목재, 목재, 목재, 재료"로 만들었다.메틸렌은 무게 기준으로 수소 함량이 약 14%이고 탄소 원자가 1개 포함된 라디칼을 가리켰다.이것은 CH가2 될 것이지만, 그 당시에는 탄소의 원자량이 수소의 6배밖에 되지 않는다고 생각되었기 때문에 그들은 [70]CH라는 공식을 얻었다.그리고 나서 그들은 나무 알코올(l'esprit de bois)을 "비수화물 드 메틸렌"이라고 불렀습니다(공식이 CHO = (CH)(4HO484)2라고2 생각했기 때문에 탄수화물)."메틸"이라는 용어는 약 1840년에 "메틸렌"에서 역형성을 통해 유래되었으며 "메틸알코올"을 설명하기 위해 사용되었습니다.이는 1892년 국제화학명칭회의에 의해 "메탄올"[71]로 단축되었다.유기 화학에서 탄소 그룹의 이름을 형성하는 접미사 -yl은 메틸이라는 단어에서 유래했습니다.
프랑스의 화학자 Paul Sabatier는 1905년에 메탄올을 합성하는데 사용될 수 있는 첫 번째 공정을 발표했다.이 과정은 이산화탄소와 수소를 반응시켜 메탄올을 [9]생산할 수 있다는 것을 시사했다.BASF(Badische-Anilin & Soda-Fabrik)에서 일하는 독일 화학자 알빈 미타슈와 마티아스 피어는 합성가스(일산화탄소, 이산화탄소, 수소의 혼합물)를 메탄올로 전환하는 방법을 개발해 특허를 획득했다.Bozzano와 Manenti에 따르면, BASF의 과정은 1923년 독일 Leuna에서 처음 사용되었다.작동 조건은 아연/산화크롬[disambiguation needed] [68]촉매가 있는 "고온"(300~400°C)과 압력(250~350atm)으로 구성되었습니다.
미국 특허 1,569,775 ( US 1569775)는 1924년 9월 4일에 적용되어 1926년 1월 12일에 BASF에 발행되었다. 이 공정은 50 ~ 220 atm, 최대 450 °C의 매우 강력한 조건의 크롬과 산화망간 촉매를 사용했다.현대의 메탄올 생산은 낮은 압력에서 작동할 수 있는 촉매(일반적으로 구리)를 사용하여 보다 효율적으로 이루어졌습니다.현대식 저압 메탄올(LPM) 공정은 1960년대 후반 ICI에 의해 오랫동안 기술 특허가 만료되어 개발되었습니다.
제2차 세계 대전 동안, 메탄올은 M-Stopf라는 이름으로 독일 군용 로켓 디자인에 연료로 사용되었고, C-Stoff로 알려진 히드라진과 약 50대 50의 혼합물에 사용되었습니다.
모터 연료로 메탄올을 사용하는 것은 1970년대 석유 위기 때 주목을 받았다.1990년대 중반까지 20,000대 이상의 메탄올 "플렉시블 연료 차량(FFV)"이 미국에 도입되었으며, 1980년대와 1990년대 초반 유럽에서 판매된 가솔린 연료에 저농도의 메탄올이 혼합되었습니다.자동차 회사들은 1990년대 후반까지 메탄올 FFV 생산을 중단하고 에탄올 연료 차량으로 관심을 돌렸다.메탄올 FFV 프로그램은 기술적인 성공을 거두었지만 가솔린 펌프 가격이 폭락하던 1990년대 중후반 메탄올 가격 상승으로 메탄올 [72]연료에 대한 관심이 줄어들었다.
1970년대 초, Mobil은 [73]메탄올로부터 가솔린 연료를 생산하는 공정을 개발했다.
1960년대와 1980년대 사이에 메탄올은 원료 화학 물질인 아세트산과 무수 아세트산의 전조로 떠올랐다.이러한 과정에는 몬산토 아세트산 합성, 카티바 과정 및 테네시 이스트만 무수물 과정이 포함됩니다.
「 」를 참조해 주세요.
레퍼런스
- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 692. doi:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Ballinger, P.; Long, F. A. (1960). "Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds". J. Am. Chem. Soc. 82 (4): 795–798. doi:10.1021/ja01489a008.
- ^ "Methyloxonium". pubchem.ncbi.nlm.nih.gov. Retrieved 21 December 2018.
- ^ "Methanolate". pubchem.ncbi.nlm.nih.gov. Retrieved 21 December 2018.
Methoxide is an organic anion that is the conjugate base of methanol. ... It is a conjugate base of a methanol.
- ^ "RefractiveIndex.INFO – Refractive index database". refractiveindex.info.
- ^ González, Begoña (2007). "Density, dynamic viscosity, and derived properties of binary mixtures of methanol or ethanol with water, ethyl acetate, and methyl acetate at T = (293.15, 298.15, and 303.15) K". The Journal of Chemical Thermodynamics. 39 (12): 1578–1588. doi:10.1016/j.jct.2007.05.004.
- ^ a b c d "Methanol" (PDF). Lab Chem. Valtech. Retrieved 10 March 2016.
- ^ a b PubChem의 독성
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. "#0397". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c "Methanol". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c "The Emergency Response Safety and Health Database: Systematic Agent: METHANOL". Centers for Disease Control and Prevention. Retrieved 3 August 2018.
- ^ "PubChem: Safety and Hazards - GHS Classification". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Methanol Safe Handling Manual" (PDF). Methanol Institute. 2017. p. 253. Retrieved 3 August 2018.
- ^ "Technical Information & Safe Handling Guide for Methanol". Methanex Corporation. Archived from the original on 11 March 2012.
- ^ "Methanol Safe Handling Manual" (PDF). Methanol Institute. 2017. p. 243. Retrieved 3 August 2018.
- ^ National Institute for Occupational Safety and Health (22 August 2008). "The Emergency Response Safety and Health Database: Methanol". Retrieved 17 March 2009.
- ^ a b c Fiedler, E.; Grossmann, G.; Burkhard Kersebohm, D.; Weiss, G. and Witte, C. (2005). "Methanol". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a16_465. ISBN 978-3527306732.
{{cite book}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ Turner C (2006). "A longitudinal study of methanol in the exhaled breath of 30 healthy volunteers using selected ion flow tube mass spectrometry, SIFT-MS". Physiological Measurement. 27 (7): 637–48. Bibcode:2006PhyM...27..637T. doi:10.1088/0967-3334/27/7/007. PMID 16705261. S2CID 22365066.
- ^ Lindinger W (1997). "Endogenous production of methanol after the consumption of fruit". Alcoholism, Clinical and Experimental Research. 21 (5): 939–43. doi:10.1111/j.1530-0277.1997.tb03862.x. PMID 9267548.
- ^ "Major Source of Methanol in the Ocean Identified". Woods Hole Oceanographic Institution. 10 March 2016. Retrieved 30 March 2016.
- ^ Mincer, Tracy J.; Aicher, Athena C. (2016). "Methanol Production by a Broad Phylogenetic Array of Marine Phytoplankton". PLOS ONE. 11 (3): e0150820. Bibcode:2016PLoSO..1150820M. doi:10.1371/journal.pone.0150820. PMC 4786210. PMID 26963515.
- ^ Brooks Hays (17 April 2015). "Why astronomers hate the lawn-mowing Roomba". Space Daily.
- ^ "Upgraded MERLIN spies cloud of alcohol spanning 288 billion miles" (Press release). Jodrell Bank Centre for Astrophysics. 19 April 2006. Archived from the original on 20 July 2011.
- ^ Amos, Jonathan (5 April 2006). "Merlin sees vast alcohol stream". BBC News.
- ^ "First Detection of Methyl Alcohol in a Planet-forming Disc". Retrieved 22 June 2016.
- ^ a b Vale A (2007). "Methanol". Medicine. 35 (12): 633–4. doi:10.1016/j.mpmed.2007.09.014.
- ^ "Methanol Poisoning Overview". Antizol. Archived from the original on 5 October 2011.
- ^ "Integrated Risk Information System". US EPA, ORD, NCEA, IRISD. 15 March 2013.
- ^ "Toxicological Review of Methanol (Noncancer) (CAS No. 67-56-1) In Support of Summary Information on the Integrated Risk Information System (IRIS)" (PDF). EPA. September 2013. EPA/635/R-11/001Fa. Retrieved 30 March 2021.
- ^ Schep LJ, Slaughter RJ, Vale JA, Beasley DM (2009). "A seaman with blindness and confusion". BMJ. 339: b3929. doi:10.1136/bmj.b3929. PMID 19793790. S2CID 6367081.
- ^ McMartin KE, Martin-Amat G, Noker PE, Tephly TR (1979). "Lack of a role for formaldehyde in methanol poisoning in the monkey". Biochem. Pharmacol. 28 (5): 645–9. doi:10.1016/0006-2952(79)90149-7. PMID 109089.
- ^ Liesivuori J, Savolainen H (September 1991). "Methanol and formic acid toxicity: biochemical mechanisms". Pharmacol. Toxicol. 69 (3): 157–63. doi:10.1111/j.1600-0773.1991.tb01290.x. PMID 1665561.
- ^ Beauchamp, GA; Valento, M (September 2016). "Toxic Alcohol Ingestion: Prompt Recognition And Management in the Emergency Department". Emergency Medicine Practice. 18 (9): 1–20. PMID 27538060.
- ^ Ferri, Fred F. (2016). Ferri's Clinical Advisor 2017: 5 Books in 1. Elsevier Health Sciences. p. 794. ISBN 9780323448383.
- ^ Kruse, JA (October 2012). "Methanol and ethylene glycol intoxication". Critical Care Clinics. 28 (4): 661–711. doi:10.1016/j.ccc.2012.07.002. PMID 22998995.
- ^ Clary, John J. (2013). The Toxicology of Methanol. John Wiley & Sons. p. 3.4.1. ISBN 9781118353103.
- ^ "Hand Sanitizers COVID-19". U.S. Food and Drug Administration. 9 July 2020. Archived from the original on 9 July 2020.
- ^ "FDA updates hand sanitizers consumers should not use". U.S. Food and Drug Administration. 31 July 2020. Archived from the original on 1 August 2020.
- ^ Sunley, G. J.; Watson, D. J. (2000). "High productivity methanol carbonylation catalysis using iridium – The Cativa process for the manufacture of acetic acid". Catalysis Today. 58 (4): 293–307. doi:10.1016/S0920-5861(00)00263-7.
- ^ Olsbye, U.; Svelle, S.; Bjorgen, M.; Beato, P.; Janssens, T. V. W.; Joensen, F.; Bordiga, S.; Lillerud, K. P. (2012). "Conversion of Methanol to Hydrocarbons: How Zeolite Cavity and Pore Size Controls Product Selectivity". Angew. Chem. Int. Ed. 51 (24): 5810–5831. doi:10.1002/anie.201103657. PMID 22511469.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ Tian, P.; Wei, Y.; Ye, M.; Liu, Z. (2015). "Methanol to Olefins (MTO): From Fundamentals to Commercialization". ACS Catal. 5 (3): 1922–1938. doi:10.1021/acscatal.5b00007.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ "Pump The Movie Methanol Clip". YouTube. Retrieved 7 June 2022.
- ^ "Biodiesel – METHANOL INSTITUTE". METHANOL INSTITUTE. Retrieved 24 March 2018.
- ^ "Biodiesel Production Principles and Processes – eXtension". Retrieved 24 March 2018.
- ^ 환경에서의 메탄올의 운명과 수송 평가(Evaluation of the Fate of the Environment) 2016년 5월 16일 1999년 1월 말콤 피니(Malcolm Pirnie, Inc) 포르투갈 웹 아카이브에 보관.
- ^ "Methanol Wins". National Review. December 2011. Retrieved 7 June 2022.
- ^ "Methanol as a Marine Fuel". Methanex Corporation. Retrieved 10 April 2021.
- ^ Andersson, Karin; Márquez Salazar, Carlos (2015). Methanol as a Marine Fuel Report (PDF) (Report). FC Business Intelligence. Retrieved 10 April 2021.
- ^ "Methanol as an Industrial Boiler Fuel". Methanex Corporation. Retrieved 10 April 2021.
- ^ Kamitani, A.; Morishita, S.; Kotaki, H.; Arscott, S. (2008). "Miniaturized microDMFC using silicon microsystems techniques: Performances at low fuel flow rates" (PDF). Journal of Micromechanics and Microengineering. 18 (12): 125019. Bibcode:2008JMiMi..18l5019K. doi:10.1088/0960-1317/18/12/125019. S2CID 110214840.
- ^ Kamitani, A.; Morishita, S.; Kotaki, H.; Arscott, S. (2011). "Microfabricated microfluidic fuel cells". Sensors and Actuators B: Chemical. 154 (2): 174. doi:10.1016/j.snb.2009.11.014.
- ^ Berger, Sandy (30 September 2006). "Methanol Laptop Fuel". Compu·Kiss. Retrieved 22 May 2007.
- ^ Blum, Deborah (19 February 2010). "The little-told story of how the U.S. government poisoned alcohol during Prohibition". Slate Magazine. Retrieved 10 June 2010.
- ^ "22 USC Ch. 75: CHEMICAL WEAPONS CONVENTION IMPLEMENTATION". uscode.house.gov.
- ^ Yant, W. P.; Schrenk, H. H.; Sayers, R. R. (1931). "Methanol Antifreeze and Methanol Poisoning". Industrial & Engineering Chemistry. 23 (5): 551. doi:10.1021/ie50257a020.
- ^ "EUR-Lex – 32018R0589 – EN – EUR-Lex". eur-lex.europa.eu. Retrieved 28 November 2018.
- ^ "Corrigendum to Commission Regulation (EU) 2018/589 of 18 April 2018 amending Annex XVII to Regulation (EC) No 1907/2006 of the European Parliament and of the Council concerning the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH) as regards methanol (OJ L 99, 19.4.2018)". 23 April 2018. Retrieved 7 July 2020.
- ^ "Annex XV Restriction Report: Proposal For a Restriction Substance Name: Methanol – table D.1-4-page 79". 16 January 2015.
- ^ Deutschmann, Olaf, Knözinger, Helmut, Kochloeflel, Karl and Turek, Thomas(2012) "이질 촉매 및 고체 촉매, 3.산업화학 백과사전의 산업용도.Wiley-VCH, Weinheim.doi: 10.1002/14356007.o05_o03
- ^ Bozzano, Giulia; Manenti, Flavio (2016). "Efficient methanol synthesis: Perspectives, technologies and optimization strategies". Progress in Energy and Combustion Science. 56: 76. doi:10.1016/j.pecs.2016.06.001. ISSN 0360-1285.
- ^ Mu-Hyun Baik, Martin Newcomb, Richard A. Friesner, Stephen J. Lippard (2003). "Mechanistic Studies on the Hydroxylation of Methane by Methane Monooxygenase". Chem. Rev. 103 (6): 2385–2420. doi:10.1021/cr950244f. PMID 12797835.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ a b Lawton, T. J.; Rosenzweig, A. C. (2016). "Biocatalysts for methane conversion: big progress on breaking a small substrate". Curr. Opin. Chem. Biol. 35: 142–149. doi:10.1016/j.cbpa.2016.10.001. PMC 5161620. PMID 27768948.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ Alayon, E. M. C.; Nachtegaal, M.; Ranocchiari, M.; Van Bokhoven, J. A. (2012). "Catalytic Conversion of Methane to Methanol Using Cu-Zeolites". CHIMIA International Journal for Chemistry. 66 (9): 668–674. doi:10.2533/chimia.2012.668. PMID 23211724.
- ^ Hammond, C.; Jenkins, R. L.; Dimitratos, N.; Lopez-Sanchez, J. A.; Ab Rahim, M. H.; Forde, M.M.; Thetford, A.; Murphy, D.M.; Hagen, H.; Stangland, E.E.; Moulijn, J.M.; Taylor, S. H.; Willock, D. J.; Hutchings, G.J. (2012). "Catalytic and Mechanistic Insights of the Low-Temperature Selective Oxidation of Methane over Cu-Promoted Fe-ZSM-5". Chemistry: A European Journal. 18 (49): 15735–45. doi:10.1002/chem.201202802. PMID 23150452.
- ^ Snyder, Benjamin E. R.; Bols, Max L.; Schoonheydt, Robert A.; Sels, Bert F.; Solomon, Edward I. (19 December 2017). "Iron and Copper Active Sites in Zeolites and Their Correlation to Metalloenzymes". Chemical Reviews. 118 (5): 2718–2768. doi:10.1021/acs.chemrev.7b00344. PMID 29256242.
- ^ Snyder, Benjamin E. R.; Vanelderen, Pieter; Bols, Max L.; Hallaert, Simon D.; Böttger, Lars H.; Ungur, Liviu; Pierloot, Kristine; Schoonheydt, Robert A.; Sels, Bert F. (2016). "The active site of low-temperature methane hydroxylation in iron-containing zeolites". Nature. 536 (7616): 317–321. Bibcode:2016Natur.536..317S. doi:10.1038/nature19059. PMID 27535535. S2CID 4467834.
- ^ a b Bozzano, Giulia; Manenti, Flavio (1 September 2016). "Efficient methanol synthesis: Perspectives, technologies and optimization strategies". Progress in Energy and Combustion Science. 56: 71–105. doi:10.1016/j.pecs.2016.06.001. ISSN 0360-1285.
- ^ 보일은 박스 관목의 나무에서 액체의 증류를 논한다: 로버트 보일, 회의적인 키미스트 (런던, 영국: J. 캐드웰, 1661), 192-195페이지.
- ^ a b J. Dumas와 E가 프랑스 과학 아카데미에 보낸 메탄올에 대한 보고서.펠리곶은 1834년 10월 27일 아카데미 회의에서 시작하여 1834년 11월 3일 회의에서 끝났다.참조: 아카데미 학회 10:600~601.이용 가능: Galica.보고서 전문은 J. Dumas 및 E에 표시됩니다.페리고(1835) "Mémoire sur l'espirit de bois et sur les divers composedes ethéré qui en provienent"(나무의 정신과 거기에서 유래한 다양한 에테랄 화합물에 관한 메모), Annales de chimie et de ficte, 58: 5-74; 9페이지부터 누스네르 le noménél le le (nél énénén é)nou liqueur spiritueuse du bois.(우리는 메틸렌 (1)이라는 이름을 과격... (1) 메티, 와인, 헐, 목재, 즉 와인 또는 나무의 정령에 붙인다.)
- ^ 1892년 4월 스위스 제네바에서 개최된 국제화학명칭회의에 대한 보고서는 다음을 참조하십시오.
- Armstrong, Henry E (1892). "The International Conference on Chemical Nomenclature". Nature. 46 (1177): 56–9. Bibcode:1892Natur..46...56A. doi:10.1038/046056c0.
- 암스트롱의 보고서 영어의 해상도로 암스트롱, 헨리(1892년):으로 발간된다."국제 회의 화학 품목 분류 표에".이어 해석적·응용 화학. 6(1177년):390–400.Bibcode:1892Natur..46...56A.doi:10.1038/046056c0. 우편 398:15.그 알코올과 페놀은 파생되는 탄화 수소, 그 접미사 올(전처예요 pentanol, pentenol 등)로 끝난 후 이름을 갖고 있다.
- ^ Halderman, James D.; Martin, Tony (2009). Hybrid and alternative fuel vehicles. Pearson/Prentice Hall. ISBN 978-0-13-504414-8.
- ^ Ronald Smith (1 December 2011). "Methanol to Gasoline: A Private Report by the Process Economics Program" (PDF). Retrieved 4 December 2019.
추가 정보
- Robert Boyle, The Sceptical Chimist (1661) – 목재 알코올 증류에 대한 설명을 포함합니다.
외부 링크
- 국제화학안전카드 0057
- 메틸알코올(메탄올) CDC/NIOSH, 안전 정보 링크
- CDC – 화학적 위험에 대한 NIOSH 포켓 가이드 – 메틸 알코올
- 메탄올 팩트 시트 – 국가 오염 물질 목록