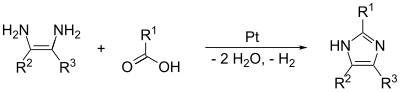이미다졸
Imidazole| | |||
| | |||
 | |||
| 이름 | |||
|---|---|---|---|
| 우선 IUPAC 이름 1H-이미다졸[1] | |||
| 시스템 IUPAC 이름 1,3-디아사이클로펜타-2,4-디엔 | |||
| 기타 이름 1,3-디아졸 글리옥살린(고대 문자) | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 체비 | |||
| 첸블 | |||
| 켐스파이더 | |||
| ECHA 정보 카드 | 100.005.473 | ||
| EC 번호 |
| ||
| 케그 | |||
PubChem CID | |||
| RTECS 번호 |
| ||
| 유니 | |||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| 채널342 | |||
| 몰 질량 | 68.077 g/g | ||
| 외모 | 흰색 또는 옅은 노란색 솔리드 | ||
| 밀도 | 1.23g/cm3, 솔리드 | ||
| 녹는점 | 89 ~ 91 °C (192 ~196 °F, 362 ~364 K) | ||
| 비등점 | 256 °C (493 °F, 529 K) | ||
| 633 g/L | |||
| 산도(pKa) | 6.95(공역산용) | ||
| UV-vis (µmax) | 206 nm | ||
| 구조. | |||
| 단사정계 | |||
| 평면 5원 링 | |||
| 3.61 D | |||
| 위험 요소 | |||
| 산업안전보건(OHS/OSH): | |||
주요 위험 요소 | 부식성 | ||
| GHS 라벨링: | |||
| H302, H314, H360D | |||
| P263, , , , , , | |||
| 플래시 포인트 | 146 °C (295 °F, 419 K) | ||
| 안전 데이터 시트(SDS) | 외부 MSDS | ||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
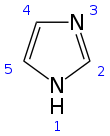
이미다졸은 CNH라는 공식의324 유기 화합물이다.물에 녹아서 약한 알칼리성 용액을 생성하는 흰색 또는 무색 고체입니다.화학에서 디아졸로 분류되는 방향족 헤테로환이며 메타 치환에서 비인접 질소 원자를 가진다.
많은 천연 제품, 특히 알칼로이드에는 이미다졸 고리가 포함되어 있습니다.이들 이미다졸은 1,3-CN32 고리를 공유하지만 다양한 치환기를 특징으로 한다.이 고리 시스템은 히스티딘과 관련된 호르몬 히스타민과 같은 중요한 생물학적 구성 요소에 존재합니다.많은 약물은 특정 항진균제, 니트로이미다졸 계열 항생제 및 진정제 미다졸람과 [4][5][6][7][8]같은 이미다졸 고리를 포함합니다.
피리미딘 고리와 융합하면,[9] 그것은 자연에서 가장 널리 발생하는 질소 함유 헤테로 고리인 퓨린을 형성합니다.
"이미다졸"이라는 이름은 1887년 독일의 화학자 Arthur Rudolf Hantzch (1857–[10]1935)에 의해 만들어졌습니다.
구조 및 속성
이미다졸은 수소가 하나 또는 다른 질소 원자에 결합될 수 있기 때문에 두 개의 동등한 호변이성 형태로 존재하는 평면 5원 고리이다.이미다졸은 3.67D의[11] 전기 쌍극자 모멘트에서 증명된 극성 화합물이며 물에 매우 잘 녹는다.이 화합물은 6µ 전자(양성자화된 질소 원자의 전자 쌍과 고리의 나머지 4개 원자의 전자 쌍)를 포함하는 평면 고리의 존재로 인해 방향족으로 분류된다.이미다졸의 일부 공명 구조는 다음과 같습니다.
양성애
이미다졸은 양성 물질로, 즉 산과 염기의 기능을 모두 할 수 있다.산으로서 이미다졸의 pK는a 14.5로 카르본산, 페놀, 이미드보다 산성이 낮지만 알코올보다는 산성이 약간 높다.산성 양성자는 질소와 결합되어 있다.탈양성자는 대칭인 이미다졸리드 음이온을 제공한다.염기로서 결합산(양자의 혼동을 피하기 위해 pK로BH+ 표기)의a pK는 약 7이므로 이미다졸은 피리딘보다 약 60배 더 염기성이 있다.기본 부위는 단일 쌍(수소에 결합되지 않음)을 가진 질소이다.양성자화는 대칭인 이미다졸륨 양이온을 생성한다.
준비
이미다졸은 다양한 이미다졸 유도체가 1840년대에 발견되었지만 1858년 독일의 화학자 하인리히 데부스에 의해 처음 보고되었다.글리옥살, 포름알데히드, 암모니아가 응축하여 이미다졸(원래 [12]이름 그대로 글리옥살린)을 형성하는 것으로 나타났다.이 합성은 상대적으로 낮은 수율을 생산하면서도 여전히 C-치환 이미다졸 생성에 사용된다.
하나의 마이크로파 개질에서 반응물은 빙초산 중의 벤질, 벤즈알데히드 및 암모니아로 2,4,5-트리페닐이미다졸([13]로핀)을 형성한다.
이미다졸은 데부스법 외에 많은 방법으로 합성할 수 있다.이러한 합성 중 다수는 반응물질의 관능기를 변화시킴으로써 치환된 이미다졸에도 적용될 수 있다.이러한 방법은 일반적으로 반응 성분 수에 따라 분류됩니다.
1개의 컴포넌트
(1,5) 또는 (3,4) 결합은 이미데이트와 α-아미노알데히드 또는 α-아미노아세탈의 반응에 의해 형성될 수 있다.아래의 예는 R2 = R = 수소일 때1 이미다졸에 적용된다.
2개의 컴포넌트
(1,2) 및 (2,3) 결합은 1,2-디아미노알칸을 고온에서 알코올, 알데히드 또는 카르본산으로 처리함으로써 형성될 수 있다.알루미나의 백금과 같은 탈수소 촉매가 필요하다.
(1,2) 및 (3,4) 결합은 또한 N-치환된 α-아미노케톤과 포름아미드에서 열로 형성될 수 있다.생성물은 1,4-디치환 이미다졸이지만, 여기서는 R = R2 = 수소이므로1 이미다졸 자체가 생성물이다.이 반응의 수율은 중간 정도이지만, 1,4 치환을 만드는 가장 효과적인 방법인 것 같습니다.
3개의 컴포넌트
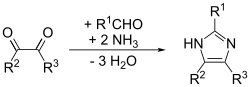
이 방법은 치환된 이미다졸에 대해 양호한 수율로 진행됩니다.데부스 방법의 적응으로 데부스-라지제프스키 이미다졸 합성이라고 불린다.원료는 치환 글리옥살, 알데히드, 아민, 암모니아 또는 암모늄염이다.[14]
다른 헤테로사이클로부터의 형성
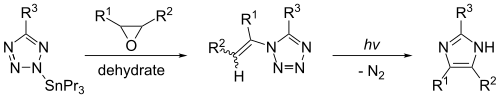
이미다졸은 1-비닐테트라졸의 광분해로 합성할 수 있다.이 반응은 1-비닐테트라졸이 2-트리부틸스탠닐테트라졸과 같은 유기화합물로부터 효율적으로 만들어진 경우에만 상당한 산출량을 제공할 것이다.이 반응은 R2 = R3 = R = 수소일1 때 이미다졸을 생성한다.
이미다졸은 기상 반응에서도 형성될 수 있다.포름아미드, 에틸렌디아민, 수소와 함께 알루미나에서 백금보다 높게 반응하며, 340~480°C 사이여야 한다.이것은 매우 순수한 이미다졸 제품을 형성합니다.
- 반 로이젠[15] 반응
Van Leusen 반응은 또한 Tos에서 시작하는 이미다졸을 형성하기 위해 사용될 수 있다.MIC와 알디민.Van Leusen 이미다졸 합성은 토실메틸 이소시아니드(ToSMIC)와 반응하여 알디민으로부터 이미다졸을 제조할 수 있게 한다.이후 반응은 알디민이 제 자리에서 생성되는 2단계 합성, 즉 반 로이젠 3성분 반응(vL-3CR)으로 확장되었다.
생물학적 의의와 응용
이미다졸은 많은 중요한 생물학적 화합물에 통합된다.가장 널리 퍼져 있는 것은 이미다졸 측쇄를 가진 아미노산 히스티딘이다.히스티딘은 헤모글로빈에서 볼 수 있는 것처럼 금속 보조 인자와 결합함으로써 많은 단백질과 효소에 존재한다.
이미다졸 기반 히스티딘 화합물은 세포 내 [16]완충에 매우 중요한 역할을 한다.히스티딘은 히스타민으로 탈탄산될 수 있다.히스타민은 알레르기 반응 중에 두드러기를 일으킬 수 있다.
이미다졸 치환기는 많은 의약품에서 발견된다.합성 이미다졸은 많은 살균제, 항진균제, 항원충제, 고혈압 약물에 존재한다.이미다졸은 중추신경계를 자극하는 찻잎과 커피콩에서 발견되는 테오필린 분자의 일부입니다.그것은 항암제인 메르캅토푸린에 있는데, 이것은 DNA 활동을 방해함으로써 백혈병과 싸운다.
클로트리마졸을 포함한 많은 치환 이미다졸은 염증, 신경변성 질환 및 신경계 [17][18]종양에 대한 흥미로운 약물 표적이 되는 질소산화물 합성효소의 선택적 억제제이다.이미다졸 약물의 다른 생물학적 활성은 세포2+ 내 Ca 및+ K 플럭스의 하향 조절 및 번역 개시 [19]간섭과 관련이 있다.
의약품 유도체
치환된 이미다졸 유도체는 많은 전신성 곰팡이 [20]감염 치료에 중요하다.이미다졸은 케토코나졸, 미코나졸 및 클로트리마졸을 포함하는 아졸 항진균제에 속한다.
비교를 위해 아졸의 또 다른 그룹은 플루코나졸, 이트라코나졸 및 보리코나졸을 포함하는 트리아졸이다.이미다졸과 트리아졸의 차이는 시토크롬 P450 효소의 억제 메커니즘을 포함한다.이미다졸 화합물의 N3은 철 시토크롬 P450의 헴 철 원자에 결합하는 반면 트리아졸의 N4는 헴 그룹에 결합한다.트리아졸은 이미다졸보다 시토크롬 P450에 대한 특이성이 더 높으므로 이미다졸보다 더 [21]강력한 것으로 나타났다.
일부 이미다졸 유도체는 곤충에 대한 영향을 나타내며, 예를 들어 질산술코나졸은 케라틴을 소화하는 호주산 융단풍뎅이 애벌레 Anthrenocerus australis에 대한 강한 먹이 억제 효과를 나타내며, 에코나졸은 일반 의류나방인 티네올라 [22]비셀리엘라에 대한 질산술도 마찬가지이다.
산업용 응용 프로그램
이미다졸 자체는 직접적인 용도가 거의 없다.대신 엔릴코나졸, 클라이마졸, 클로트리마졸,[23] 프로클로라졸 및 비포나졸을 포함한 다양한 농약들의 전구체이다.
배위 화학
이미다졸과 그 유도체는 금속 양이온에 대한 친화력이 높다.이미다졸의 용도 중 하나는 고정화 금속 친화성 크로마토그래피(IMAC)에서 His-tagged 단백질의 정제이다.이미다졸은 크로마토그래피 컬럼의 비즈 표면에 부착된 니켈 이온에 결합된 태그 부착 단백질을 용출하기 위해 사용된다.과다한 이미다졸이 컬럼을 통과하여 His-tag를 니켈 배위로부터 대체하여 His-taged 단백질을 해방시킵니다.
생물 연구에 사용
이미다졸은 pH 6.2~7.[24]8에 적합한 완충제이며, 순수 이미다졸은 기본적으로 단백질 관련 파벨렌트(280nm)[25][26]에서는 흡수성이 없지만, 이미다졸의 순도가 낮으면 280nm에서 현저한 흡수성을 제공할 수 있다.이미다졸은 Lowry 단백질 [27]분석을 방해할 수 있습니다.
이미다졸염
이미다졸 고리가 양이온인 이미다졸의 염류를 이미다졸륨염(예를 들어 염화이미다졸륨 또는 질산염)[28]이라고 한다.이 소금들은 이미다졸의 질소에서의 양성자화 또는 치환으로부터 형성된다.이 소금들은 이온성 액체와 안정적인 카르벤의 전구체로 사용되어 왔다.탈양성화 이미다졸이 음이온인 염류도 잘 알려져 있다. 이 염류들은 이미다졸레이트(예를 들어 이미다졸산나트륨, NaCHN332)로 알려져 있다.
관련 복소환
- 벤즈이미다졸, 용융 벤젠 고리를 가진 아날로그
- 디히드로이미다졸 또는 이미다졸린, 4,5-이중결합이 포화상태인 유사체
- 위치 1에 질소 원자가 1개뿐인 아날로그 Pyrole
- 산소 1위 질소 원자가 산소로 대체된 아날로그 물질인 옥사졸
- 위치 1에 황으로 대체된 질소 원자를 가진 유사 물질인 티아졸
- 피라졸, 두 개의 인접한 질소 원자를 가진 유사체
- 트리아졸, 질소 원자 3개를 가진 유사체
안전.
이미다졸은 LD가50 970mg/kg(Rat, 경구)[23]으로 나타나듯이 급성 독성이 낮다.
「 」를 참조해 주세요.
레퍼런스
- ^ "Front Matter". Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 140. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Walba, H.; Isensee, R. W. (1961). "Acidity constants of some arylimidazoles and their cations". J. Org. Chem. 26 (8): 2789–2791. doi:10.1021/jo01066a039.
- ^ "Imidazole". molekula.com. Molekula Group.
- ^ Karitzky, A. R.; Rees, C.W.R.; Scriven, E.F.V. (1984). Comprehensive Heterocyclic Chemistry. Vol. 5. pp. 469–498. ISBN 978-0-08-042072-1.
- ^ Grimmett, M. Ross (1997). Imidazole and Benzimidazole Synthesis. Academic Press. ISBN 978-0-08-053445-9.
- ^ Brown, E. G. (1998). Ring Nitrogen and Key Biomolecules. Kluwer Academic Press. ISBN 978-94-011-4906-8.
- ^ Pozharskii, A. F.; et al. (1997). Heterocycles in Life and Society. John Wiley & Sons. ISBN 978-0-471-96033-1.
- ^ Gilchrist, T. L. (1985). Heterocyclic Chemistry. Bath Press. ISBN 978-0-582-01421-3.
- ^ Rosemeyer, H. (2004). "The Chemodiversity of Purine as a Constituent of Natural Products". Chemistry & Biodiversity. 1 (3): 361–401. doi:10.1002/cbdv.200490033. PMID 17191854. S2CID 12416667.
- ^ Hantzsch, A. and Weber, J. H. (1887) "티아졸(티오펜 계열의 피리딘), Berichte der Deutschen chemischen Gesellschaft, p.31 참조:다음 항목도 참조하십시오.Hantzsch, A. (1888) "알레게마이네 베메르쿤겐 위버 아졸"(아졸에 대한 일반적인 관측), Annalen der Chemie, 249: 1~6. Hantzch는 복소환33 CH(NHIMAZole)를 "N"이라고 부르는 제안을 포함하여 아졸 화합물의 명명 구조를 개혁할 것을 제안했다.
- ^ Christen, Dines; Griffiths, John H.; Sheridan, John (1981). "The Microwave Spectrum of Imidazole; Complete Structure and the Electron Distribution from Nuclear Quadrupole Coupling Tensors and Dipole Moment Orientation". Zeitschrift für Naturforschung A. 36 (12): 1378–1385. Bibcode:1981ZNatA..36.1378C. doi:10.1515/zna-1981-1220. S2CID 3522351.
- ^ Debus, 하인리히(1858년)."Ueber Glyoxal auf Einwirkung 데 Ammoniaks 죽"[암모니아의 글리 옥살에 반응에].Annalen하는 Chemie Pharmacie und.107(2):199–208. doi:10.1002/jlac.18581070209.우편 205:"Diegereinigte 원물stellt 다쓰 oxalsaure Salzeiner 기반 dar, 죽ich mit Glyoxalinbezeichenen werde."(그 정제한 물질 나는"글리옥살린."로 정하여 주는 기지 괭이밥에서 채취한 소금을 만들어 낸다.)부터.
- ^ Crouch, R. David; Howard, Jessica L.; Zile, Jennifer L.; Barker, Kathryn H. (2006). "Microwave-Mediated Synthesis of Lophine: Developing a Mechanism To Explain a Product". J. Chem. Educ. 83 (11): 1658. Bibcode:2006JChEd..83.1658C. doi:10.1021/ed083p1658.
- ^ 미국 특허 6,177,575, A. J. Arduengo, '이미다졸 제조 프로세스' 2001-01-23 발표
- ^ Van Leusen, Albert M.; Wildeman, Jurjen; Oldenziel, Otto H. (1977). "Chemistry of sulfonylmethyl isocyanides. 12. Base-induced cycloaddition of sulfonylmethyl isocyanides to carbon, nitrogen double bonds. Synthesis of 1,5-disubstituted and 1,4,5-trisubstituted imidazoles from aldimines and imidoyl chlorides". Journal of Organic Chemistry. 42 (7): 1153–1159. Bibcode:1977JOrgC..42.1153A. doi:10.1021/jo00427a012.
- ^ Hochachka, P. W.; Somero, G. N. (2002). Biochemical Adaptation: Mechanisms and Process in Physiological Evolution. New York: Oxford University Press.
- ^ Castaño, T.; Encinas, A.; Pérez, C.; Castro, A.; Campillo, N. E.; Gil, C. (2008). "Design, synthesis, and evaluation of potential inhibitors of nitric oxide synthase" (PDF). Bioorg. Med. Chem. (Submitted manuscript). 16 (11): 6193–6206. doi:10.1016/j.bmc.2008.04.036. hdl:10261/87090. PMID 18477512.
- ^ Bogle, R. G.; Whitley, G. S.; Soo, S. C.; Johnstone, A. P.; Vallance, P. (1994). "Effect of anti-fungal imidazoles on mRNA levels and enzyme activity of inducible nitric oxide synthase". Br. J. Pharmacol. 111 (4): 1257–1261. doi:10.1111/j.1476-5381.1994.tb14881.x. PMC 1910171. PMID 7518297.
- ^ Khalid, M. H.; Tokunaga, Y.; Caputy, A. J.; Walters, E. (2005). "Inhibition of tumor growth and prolonged survival of rats with intracranial gliomas following administration of clotrimazole". J. Neurosurg. 103 (1): 79–86. doi:10.3171/jns.2005.103.1.0079. PMID 16121977.
- ^ Leon Shargel (2007). Comprehensive Pharmacy Review (6th ed.). p. 930. ISBN 9780781765619.
- ^ Davis, Jennifer L.; Papich, Mark G.; Heit, Mark C. (2009). "Chapter 39: Antifungal and Antiviral Drugs". In Riviere, Jim E.; Papich, Mark G. (eds.). Veterinary Pharmacology and Therapeutics (9th ed.). Wiley-Blackwell. pp. 1019–1020. ISBN 978-0-8138-2061-3.
- ^ Sunderland, M. R.; Cruickshank, R. H.; Leighs, S. J. (2014). "The efficacy of antifungal azole and antiprotozoal compounds in protection of wool from keratin-digesting insect larvae". Textile Res. J. 84 (9): 924–931. doi:10.1177/0040517513515312. S2CID 135799368.
- ^ a b Ebel, K., Koehler, H., Gamer, A. O., & Jäckh, R. (2002). "Imidazole and Derivatives". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a13_661.
{{cite encyclopedia}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Dawson, R. M. C. (1986). Data for biochemical research. Oxford: Clarendon Press. p. 325. ISBN 978-0-19-855299-4. OCLC 11865673.
- ^ "1H-Imidazole". Retrieved 13 May 2021.
- ^ "Optimizing Purification of Histidine-Tagged Proteins". Retrieved 13 May 2021.
- ^ Molina, F; Rueda, A; Bosque-Sendra, J.M; Megias, L (1996). "Determination of proteins in the presence of imidazole buffers". Journal of Pharmaceutical and Biomedical Analysis. Elsevier BV. 14 (3): 273–280. doi:10.1016/0731-7085(95)01615-5. ISSN 0731-7085. PMID 8851751.
- ^ Zolfigol, Mohammad A.; Khazaei, Ardeshir; Moosavi-Zare, Ahmad R.; Zare, Abdolkarim; Kruger, Hendrik G.; Asgari, Zhila; Khakyzadeh, Vahid; Kazem-Rostami, Masoud (2012-04-06). "Design of Ionic Liquid 3-Methyl-1-sulfonic Acid Imidazolium Nitrate as Reagent for the Nitration of Aromatic Compounds by in Situ Generation of NO2 in Acidic Media". The Journal of Organic Chemistry. 77 (7): 3640–3645. doi:10.1021/jo300137w. ISSN 0022-3263. PMID 22409592.