리팍시민
Rifaximin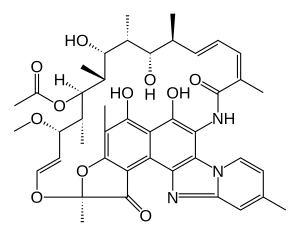 | |
 | |
| 임상자료 | |
|---|---|
| 상명 | 시팍산[1], 자신, 시팍산타, 노믹스 등 |
| AHFS/Drugs.com | 모노그래프 |
| 메드라인플러스 | a604027 |
| 임신 범주 |
|
| 경로: 행정 | 입으로 |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 | |
| 약동학 데이터 | |
| 생체이용가능성 | < 0.4% |
| 신진대사 | 간 |
| 제거 반감기 | 6시간 |
| 배설 | 배설(97%) |
| 식별자 | |
| |
| CAS 번호 | |
| 펍켐 CID | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 켐벨 | |
| CompTox 대시보드 (EPA) | |
| ECHA InfoCard | 100.111.624 |
| 화학 및 물리적 데이터 | |
| 공식 | C43H51N3O11 |
| 어금질량 | 785.891 g·197−1 |
| 3D 모델(JSmol) | |
| 녹는점 | 200 ~ 205 °C(392 ~ 401 °F) (결정) |
| |
| |
| | |
시팍산(미국)과 잭신(캐나다)이라는 브랜드명으로 판매되는 리팩시민은 여행자의 설사, 과민성 대장증후군, 간뇌병증 등을 치료하는 데 사용되는 항생제다.[3] 입으로 먹으면 흡수가 잘 안 된다.
그것은 리파마이신에 근거한다. 리팩시민은 2004년 5월 미국에서 의료용 허가를 받았다.[3][4]
의학적 용법
리팩시민은 성인의 과민성 장 증후군, 12세 이상 여행객의 설사, 성인의 과잉 간뇌병증(HE) 재발 위험 감소 등의 치료법으로 미국에서 제시되고 있다.[2][5]
과민성 장 증후군
리팍시민은 미국에서 과민성 장 증후군의 치료로 승인되었다.[6] 항염증, 항균성을 가지고 있으며, 내장에서 국소적으로 작용하는 비흡수성 항생제다. 이러한 성질은 비수축형 과민성 장 증후군(IBS)의 만성 기능 증상 완화에 효과적이다. 반복적인 과정에도 불구하고, 이 적응증에 대한 치료적 특성을 유지하는 것으로 보인다.[7][8] 리팩시민은 특히 소장의 박테리아 과성장이 사람의 IBS에 관여하는 것으로 의심되는 곳에 표시된다. 복통, 편평, 팽창, 대변의 일관성 등 전지구적 IBS 증상에 대해 증상 완화 또는 개선을 얻을 수 있다. 단점은 증상 재발을 위해 반복적인 코스가 필요할 수 있다는 점이다.[8][9] 리팩시민이 IBS를 가진 몇몇 사람들에게 치료할 수 있다는 증거가 있다.[10]
C. 확산성 감염
리팩시민은 또한 C. 확산성 감염을 재발한 환자들을 치료할 때 밴코마이신에 유용한 첨가물이 될 수 있다.[11][12] 그러나 이러한 연구의 증거의 질은 낮다고 판단되었다.[13] 과거 리파미신에 노출되면 저항 위험이 커질 수 있기 때문에 이런 경우 리팩시민은 피해야 한다.[citation needed]
간뇌병증
미국에서 리팩시민은 간뇌병증 치료에 대한 고아 약물 지위를 갖고 있다.[14] 비록 높은 수준의 증거가 여전히 부족하지만, 리팩시민은 다른 간뇌병증 치료제(유당류 등)가 더 잘 허용되고 더 빨리 효과가 나타날 수 있는 만큼 또는 더 효과적인 것으로 보인다.[15] 리팍시민은 입으로 가져간다. 부작용이 적고, 뇌병증이 재발하지 않으며, 환자 만족도가 높다. 사람들은 최소한의 부작용, 장기간의 완화, 그리고 전반적인 비용 때문에 다른 어떤 약보다 이 약을 먹는 것에 더 순응하고 만족한다.[16] 장내 암모니아 생성 세균의 수치를 줄여 간뇌병증 증상을 완화하고 사망률을 낮춘다.[9] 리팩시민의 단점은 비용 증가와 결합 유당요법이 없는 HE에 대한 강력한 임상시험의 부족이다.[citation needed]
기타 용도
다른 용도로는 전염성 설사, 작은 장내 박테리아 과성장, 염증성 장질환, 게실성 질환 등의 치료가 있다.[9] 리팍스민은 소장의 박테리아 과잉성장을 과민성 장 증후군과 관련이 있는지 여부와 상관없이 치료하는 데 효과적이다.[17] 리팍스민은 또한 작은 장내 박테리아 과성장(SIBO)과 함께 동반발생을 하는 환자들을 위해 건조한 눈처럼 보이는 안구인 로자세아(losacea), 안구형 로자세아(losacea)에도 효능을 보였다.[18]
특별 주의
C등급의 Child-Pugh 점수가 있는 간경변 환자에게는 주의 깊게 사용해야 한다.[9]
부작용
리팍시민은 부작용이 거의 없다.[8] 부작용은 일반적으로 경미하고 흔치 않다.[7] 이는 대체로 약물이 내장에서 거의 흡수되지 않기 때문이며, 이는 전신적인 부작용이 없다는 것을 의미한다.[8] Clostridium difficile 감염은 면역억제, 입원 등의 위험요인이 존재하지 않는 한 일반적으로 리팩시민 치료에서 발생하지 않는다. 리팍시민은 C. difficile에 대해 활동적이다.[7]
상호작용
리팩시민은 내장에서 유의하게 흡수되지 않기 때문에 정상적인 간 기능을 가진 사람의 다른 약물과 큰 상호작용을 하지 않는다.[7]
약리학
리팩시민은 이탈리아 회사 알파 파르마세우티치가 천연 항생제 리파마이신을 화학적으로 개조해 만든 반시스테틱 광역 스펙트럼 항균제다.[10][19][20] 경구 투여 후 흡수가 잘 되지 않아 생체이용률이 매우 낮다.[8] 이러한 내장의 내장의 국소 작용과 내성 유전자의 수평적 전달의 부족으로 인해 세균 저항의 발달은 드물다.[7] 이 같은 흡수가 잘 되지 않아 구강으로 복용하는 약의 대부분은 감염이 일어나는 위장관에 머무른다.[21] 그러나, 약물 다형성 및 화합물의 결정체와 비정형 형태 간의 차이 때문에, 특정 일반 약물 버전은 원래 상표명 버전보다 더 쉽게 흡수될 수 있다.[9]
작용기전
리팩시민은 박테리아 RNA 중합효소의 β-부분유닛에 결합하여 전사에 지장을 준다.[9] 이로 인해 일반적으로 첫 번째 인광체 결합의 형성을 따르는 번역 단계가 차단되며, 이는 전사 과정에서 발생한다.[22] 이는 결국 가스를 생성하는 박테리아를 포함한 박테리아 개체수의 감소로 이어져 점막염, 상피기능 장애, 내장 과민증을 감소시킬 수 있다. 리팩시민은 그램 양성 및 그램 음성 혐기성 및 에어로빅 박테리아에 대한 광범위한 스펙트럼 항균성을 가지고 있다. 담즙산 용해성의 결과, 그것의 항균 작용은 대부분 소장으로 제한되고 대장에는 덜 제한된다.[9] IBS 증상 완화를 위한 가능한 작용 메커니즘으로 박테리아 구성의 리셋이 제안되었다.[10] 또한 리팩시민은 임신의 X 수용체 변조를 통해 장 점막에 직접적인 항염증 효과를 가질 수 있다.[10]
그것의 치료적 특성에 대한 다른 메커니즘은 장의 상피 라이닝에 걸친 박테리아 번역의 억제, 상피 세포에 대한 박테리아의 부착의 억제, 그리고 염증 시토카인의 발현 감소를 포함한다.[23]
유용성
미국에서는 Salix Pharmetic이 리팩시민에 대한 미국특허를 보유하고 있으며, 시팩산이라는 이름으로 이 약품을 시판하고 있다.[24][25] 리팩시민은 2015년 5월 여행자의 설사와 간뇌병증(마케팅 승인)[25]에 대한 FDA 승인을 받은 데 이어 IBS에 대한 FDA 승인을 받았다.[26] 미국에는 일반적인 제형이 없고 FDA 승인 절차가 진행 중이었기 때문에 전혀 나타나지 않았다. 리팩시민이 간뇌병증에 대한 FDA의 완전한 승인을 받게 되면, Salix는 마케팅 독점성을 유지하고 2017년 3월 24일까지 일반 제형으로부터 보호받을 가능성이 있다.[25] 2018년에는 테바와의 특허 분쟁이 해결되어 미국에서 제네릭이 지연되었으며, 특허는 2029년에 만료될 예정이다.[27]
리팍시민은 33개국에서 GI 장애로 승인되었다.[28][29] 2013년 8월 13일, 캐나다 보건부는 약품 제품인 잭신(Zaxine)에 대해 Salix Pharmicals Inc.에 대한 준수 통지서를 발행했다.[30] 인도에서는 시보츠와 시파필이라는 브랜드로 이용 가능하다.[citation needed] 러시아와 우크라이나에서는 알파 바세르만 S.P.A.(이탈리아)가 생산한 알파 노르믹스(Alfa Normix)라는 이름으로 약품을 판매한다.[31]
FDA는 2018년 코스모스제약이 여행자 설사약으로 에이엠콜로(Aemcolo)라는 비슷한 약품을 승인했다.[32]
참조
- ^ "Rifaximin international". Drugs.com. 2 November 2020. Retrieved 11 November 2020.
- ^ a b "Xifaxan- rifaximin tablet". DailyMed. 1 October 2019. Retrieved 11 November 2020.
- ^ a b "Rifaximin Monograph for Professionals". The American Society of Health-System Pharmacists. Retrieved 8 January 2017.
- ^ "Drug Approval Package: Xifaxan (Nfaximin) NDA #021361". U.S. Food and Drug Administration (FDA). 27 August 2004. Retrieved 11 November 2020.
- ^ DuPont HL (July 2007). "Therapy for and prevention of traveler's diarrhea". Clinical Infectious Diseases. 45 (Suppl 1): S78-84. doi:10.1086/518155. PMID 17582576.
- ^ Kane JS, Ford AC (2016). "Rifaximin for the treatment of diarrhea-predominant irritable bowel syndrome". Expert Rev Gastroenterol Hepatol. 10 (4): 431–42. doi:10.1586/17474124.2016.1140571. PMID 26753693. S2CID 13607138.
- ^ a b c d e Ponziani FR, Pecere S, Lopetuso L, Scaldaferri F, Cammarota G, Gasbarrini A (July 2016). "Rifaximin for the treatment of irritable bowel syndrome - a drug safety evaluation". Expert Opinion on Drug Safety. 15 (7): 983–91. doi:10.1080/14740338.2016.1186639. PMID 27149541. S2CID 25426888.
- ^ a b c d e Song KH, Jung HK, Kim HJ, Koo HS, Kwon YH, Shin HD, et al. (April 2018). "Clinical Practice Guidelines for Irritable Bowel Syndrome in Korea, 2017 Revised Edition". Journal of Neurogastroenterology and Motility. 24 (2): 197–215. doi:10.5056/jnm17145. PMC 5885719. PMID 29605976.
- ^ a b c d e f g Iorio N, Malik Z, Schey R (2015). "Profile of rifaximin and its potential in the treatment of irritable bowel syndrome". Clin Exp Gastroenterol. 8: 159–67. doi:10.2147/CEG.S67231. PMC 4467648. PMID 26089696.
- ^ a b c d Pimentel M (January 2016). "Review article: potential mechanisms of action of rifaximin in the management of irritable bowel syndrome with diarrhoea". Aliment. Pharmacol. Ther. 43 Suppl 1: 37–49. doi:10.1111/apt.13437. PMID 26618924.
- ^ Johnson S, Schriever C, Galang M, Kelly CP, Gerding DN (March 2007). "Interruption of recurrent Clostridium difficile-associated diarrhea episodes by serial therapy with vancomycin and rifaximin". Clinical Infectious Diseases. 44 (6): 846–8. doi:10.1086/511870. PMID 17304459.
- ^ Garey KW, Ghantoji SS, Shah DN, Habib M, Arora V, Jiang ZD, DuPont HL (December 2011). "A randomized, double-blind, placebo-controlled pilot study to assess the ability of rifaximin to prevent recurrent diarrhoea in patients with Clostridium difficile infection". The Journal of Antimicrobial Chemotherapy. 66 (12): 2850–5. doi:10.1093/jac/dkr377. PMID 21948965.
- ^ Nelson RL, Suda KJ, Evans CT (March 2017). "Antibiotic treatment for Clostridium difficile-associated diarrhoea in adults". The Cochrane Database of Systematic Reviews. 2017 (3): CD004610. doi:10.1002/14651858.CD004610.pub5. PMC 6464548. PMID 28257555.
- ^ Wolf DC (2007-01-09). "Hepatic Encephalopathy". eMedicine. WebMD. Retrieved 2007-02-15.
- ^ Lawrence KR, Klee JA (August 2008). "Rifaximin for the treatment of hepatic encephalopathy". Pharmacotherapy. 28 (8): 1019–32. doi:10.1592/phco.28.8.1019. PMID 18657018. S2CID 25662917. Medscape에 등록하여 전체 텍스트를 무료로 제공하십시오.
- ^ Kimer N, Krag A, Gluud LL (March 2014). "Safety, efficacy, and patient acceptability of rifaximin for hepatic encephalopathy". Patient Preference and Adherence. 8: 331–8. doi:10.2147/PPA.S41565. PMC 3964161. PMID 24672227.
- ^ Triantafyllou K, Sioulas AD, Giamarellos-Bourboulis EJ (2015). "Rifaximin: The Revolutionary Antibiotic Approach for Irritable Bowel Syndrome". Mini Rev Med Chem. 16 (3): 186–92. doi:10.2174/1389557515666150722105340. PMID 26202193.
- ^ Weinstock, Leonard B.; Steinhoff, Martin (2013). "Rosacea and small intestinal bacterial overgrowth: Prevalence and response to rifaximin". Journal of the American Academy of Dermatology. 68 (5): 875–876. doi:10.1016/j.jaad.2012.11.038. PMID 23602178.
- ^ Laterza L, Ianiro G, Scoleri I, Landi R, Bruno G, Scaldaferri F, Gaetani E, Campanale M, Gasbarrini A (March 2015). "Rifaximin for the treatment of diarrhoea-predominant irritable bowel syndrome". Expert Opin Pharmacother. 16 (4): 607–15. doi:10.1517/14656566.2015.1007951. PMID 25641072. S2CID 24324310.
- ^ Brufani M, Cellai L, Marchi E, Segre A (Dec 1984). "The synthesis of 4-deoxypyrido[1',2'-1,2]imidazo[5,4-c]rifamycin SV derivatives". J Antibiot (Tokyo). 37 (12): 1611–22. doi:10.7164/antibiotics.37.1611. PMID 6526730.
- ^ Taylor DN (December 2005). "Poorly absorbed antibiotics for the treatment of traveler' diarrhea". Clinical Infectious Diseases. 41 Suppl 8 (Supplement_8): S564-70. doi:10.1086/432953. PMID 16267720.
- ^ "Rifaximin". DrugBank. 22 March 2017.
- ^ Lee KJ (October 2015). "Pharmacologic Agents for Chronic Diarrhea". Intest Res. 13 (4): 306–12. doi:10.5217/ir.2015.13.4.306. PMC 4641856. PMID 26576135.
- ^ "Xifaxan (Rifaximin) 550 mg - Reduce Overt Hepatic Encephalopathy Recurrences". Salix Pharmaceuticals.
- ^ a b c "Product Details for NDA 022554". Orange Book: Approved Drug Products with Therapeutic Equivalence Evaluations. U.S. Food and Drug Administration (FDA).
- ^ "FDA approves two therapies to treat IBS-D" (Press release). U.S. Food and Drug Administration (FDA).[데드링크]
- ^ Linnane, Ciara. "Bausch Health stock soars 8.6% premarket on news of patent settlement". MarketWatch. Retrieved 2019-05-14.
- ^ "Xifaxan (rifaximin) Tablets 550 mg for Hepatic Encephalopathy" (PDF). United States Food and Drug Administration Gastrointestinal Drugs Advisory Committee. 23 February 2010.
- ^ "Pharmaceutical News & Media - Salix Pharmaceuticals".
- ^ "Summary Basis of Decision (SBD): Zaxine". Government of Canada, Health Canada, Health Products and Food Branch, Therapeutic Products Directorate, Bureau of Gastroenterology Infection and Viral Diseases. 2013.
- ^ "Alfa Normix". Russian medical server.
- ^ "Cosmo to give Bausch Health a run for its money with FDA nod for Xifaxan rival". FiercePharma. Retrieved 2019-05-14.
외부 링크
- "Rifaximin". Drug Information Portal. U.S. National Library of Medicine.


