아르케타민
Arketamine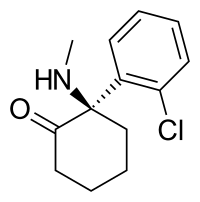 | |
 | |
| 임상 데이터 | |
|---|---|
| 기타 이름 | PCN-101, HR-071603 |
| ATC 코드 |
|
| 법적 상태 | |
| 법적 상태 | |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| CompTox 대시보드 (EPA ) | |
| 화학 및 물리적 데이터 | |
| 공식 | C13H16당분이나 지방 말고도NO |
| 중량 몰 | 237.73 g·mol−1 |
| 3D모델(JSmol) | |
| |
| |
케타민 Arketamine(개발 코드 이름 PCN-101, HR-071603), 또한(R)-ketamine 또는(R)-(−)-ketamine으로 알려져 있다(R)-(−)enantiomer.[1][2][3]마찬가지로 라세미 케타민과 esketamine 케타민의 S(+)enantiomer에, arketamine 생물학적으로 되지만,는 NMDA수용체 길항제와 마취제로 많이 사용하고 따라서 또는 enantiopure 약물로 임상적 사용으로 승인된 적이 없었다. 강력한이라고 하네요[1][3]Arketamine 현재 소설을 항우울제만큼 임상 개발에 있다.[4][5]
esketamine에 비해서, arketamine은 NMDA수용체의 PCP사이트 4에서 5회 낮은 친화성을 보유하고 있다.[2][6]따라 arketamine가 상당히 덜, 진통제 마취제 면에서 라세 미산의 케타민과 특히 esketamine,sedative-hypnotic 효과보다 독하다[6]반면 esketamine 자식은 무시할 수 있게 이 수용체, 그리고 라세 미산의 케타민의 시그마 수용기의 활동 arketamine에 있Racemic 케타민, 그것은 모두의 효능 제이다 역할을 하는 시그마 수용체, 잘 닮았다.[7]그것은 arketamine의 이런 행동을 라세미의 케타민의 환각 유발성 효과에, 그것은 발작 역치 인하 라세미 케타민과 목격한 책임을 질 수 있는 역할을 할 것이라고 제시하였다.[7]하지만 여러 연속된 연구들은 esketamine 더 환자가 전기 경련 치료를 받에서의 연구의 발작은 esketamine은 유력한 유도 제안했다 해리 events,[8][9]을 유도할 가능성이 있다고 한다.[10]Esketamine에 대해 8-fold 더 강력하게보다 arketamine는 않으며 그렇게 약 8배 더 도파민 재흡수 방해제로 강력하다는 것은 도파민 수송 차량을 금하고 있다.[11]아르케타민과 에스케타민은 무스카린성 아세틸콜린 [12]수용체와의 상호작용에 대해 유사한 효력을 가지고 있다.
새로운 항우울제
아르케타민은 임상 [13]전 연구에서 에스케타민보다 빠르게 작용하는 항우울제로서 더 효과적인 것으로 보인다.
설치류 연구에서 에스케타민은 NMDA 수용체 길항제 및 도파민 재흡수 [14]억제제로서의 효력이 낮기 때문에 과로코모션, 프리펄스 억제 결손 및 보상 효과를 발생시켰지만 아르케타민은 그렇지 않았다.이와 같이 아르케타민은 우수한 항우울제 [14]효능에 더해 정신자극 효과의 발생 성향이 낮아지고 남용 가능성이 낮아질 수 있다.
생쥐를 대상으로 실시된 연구에 따르면 케타민의 항우울제 활성은 NMDAR를 저해하는 케타민이 아니라 대사물인 (2R,6R)-히드록시노르케타민에 의해 다른 글루탐산 수용체인 AMPA 수용체가 지속적으로 활성화되면서 발생하는 것으로 [15][16]나타났다.아르케타민은 AMPA 수용체 작용제이다.[17]
역설적으로, 아르케타민은 에스케타민에 [13][18][14]비해 우울증 동물 모델에서 더 크고 오래 지속되는 빠른 항우울제 효과를 보인다.노르케타민과 히드록시노르케타민은 이 수용체와 빠른 항우울제 효과(특히 포유류 타르제 증가)의 잠재적 길항제이기 때문에 이는 α-니코틴7 수용체에서 아르케타민과 에스케타민 및 각각의 대사물의 다른 활성 가능성 때문일 수 있다.t of rapamycin functions)는 그것에 [19][20][21]대한 그들의 친화력과 밀접하게 상관된다.그러나 상황은 불분명하고 다른 메커니즘도 관련되어 있다.[14]
임상 개발
2019년 11월 현재, 아르케타민은 미국의 지각 신경과학(Persition Neuroscience)의 개발 코드명 PCN-101과 중국의 [4][5]장쑤 헝루이 의학(Jiangsu Hengrui Medicine)의 HR-071603으로 우울증 치료를 위해 개발 중이다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b C.R. Ganellin; David J. Triggle (21 November 1996). Dictionary of Pharmacological Agents. CRC Press. pp. 1188–. ISBN 978-0-412-46630-4.
- ^ a b David T. Yew (6 March 2015). Ketamine: Use and Abuse. Taylor & Francis. pp. 269–. ISBN 978-1-4665-8340-5.
- ^ a b Singh, Jaskaran B.; Fedgchin, Maggie; Daly, Ella; Xi, Liwen; Melman, Caroline; De Bruecker, Geert; Tadic, Andre; Sienaert, Pascal; Wiegand, Frank; Manji, Husseini; Drevets, Wayne C.; Van Nueten, Luc (2015). "Intravenous Esketamine in Adult Treatment-Resistant Depression: A Double-Blind, Double-Randomization, Placebo-Controlled Study". Biological Psychiatry. 80 (6): 424–31. doi:10.1016/j.biopsych.2015.10.018. ISSN 0006-3223. PMID 26707087.
- ^ a b Hashimoto, Kenji (2019). "Rapid‐acting antidepressant ketamine, its metabolites and other candidates: A historical overview and future perspective". Psychiatry and Clinical Neurosciences. 73 (10): 613–627. doi:10.1111/pcn.12902. ISSN 1323-1316. PMC 6851782. PMID 31215725.
- ^ a b "Arketamine - Jiangsu Hengrui Medicine - AdisInsight".
- ^ a b Paul G. Barash; Bruce F. Cullen; Robert K. Stoelting; Michael Cahalan; M. Christine Stock (28 March 2012). Clinical Anesthesia. Lippincott Williams & Wilkins. pp. 456–. ISBN 978-1-4511-4795-7.
- ^ a b Joris C. Verster; Kathleen Brady; Marc Galanter; Patricia Conrod (6 July 2012). Drug Abuse and Addiction in Medical Illness: Causes, Consequences and Treatment. Springer Science & Business Media. pp. 205–. ISBN 978-1-4614-3375-0.
- ^ Vollenweider, F.X.; Leenders, K.L.; Øye, I.; Hell, D.; Angst, J. (February 1997). "Differential psychopathology and patterns of cerebral glucose utilisation produced by (S)- and (R)-ketamine in healthy volunteers using positron emission tomography (PET)". European Neuropsychopharmacology. 7 (1): 25–38. doi:10.1016/S0924-977X(96)00042-9. PMID 9088882. S2CID 26861697.
- ^ Engelhardt, W (1997). "[Recovery and psychomimetic reactions following S-(+)-ketamine]". Anaesthesist. 46: S38-42. doi:10.1007/pl00002463. PMID 9163277. S2CID 24966884.
- ^ Zavorotnyy, Maxim; Kluge, Ina; Ahrens, Kathrin; Wohltmann, Thomas; Köhnlein, Benjamin; Dietsche, Patricia; Dannlowski, Udo; Kircher, Tilo; Konrad, Carsten (December 2017). "S -ketamine compared to etomidate during electroconvulsive therapy in major depression". European Archives of Psychiatry and Clinical Neuroscience. 267 (8): 803–813. doi:10.1007/s00406-017-0800-3. ISSN 0940-1334. PMID 28424861. S2CID 22725552.
- ^ Nishimura M, Sato K (1999). "Ketamine stereoselectively inhibits rat dopamine transporter". Neurosci. Lett. 274 (2): 131–4. doi:10.1016/s0304-3940(99)00688-6. PMID 10553955. S2CID 10307361.
- ^ J. Vuyk; Stefan Schraag (6 December 2012). Advances in Modelling and Clinical Application of Intravenous Anaesthesia. Springer Science & Business Media. pp. 270–. ISBN 978-1-4419-9192-8.
- ^ a b Zhang JC, Li SX, Hashimoto K (2014). "R (-)-ketamine shows greater potency and longer-lasting antidepressant effects than S (+)-ketamine". Pharmacol. Biochem. Behav. 116: 137–41. doi:10.1016/j.pbb.2013.11.033. PMID 24316345. S2CID 140205448.
- ^ a b c d Yang C, Shirayama Y, Zhang JC, Ren Q, Yao W, Ma M, Dong C, Hashimoto K (2015). "R-ketamine: a rapid-onset and sustained antidepressant without psychotomimetic side effects". Transl Psychiatry. 5 (9): e632. doi:10.1038/tp.2015.136. PMC 5068814. PMID 26327690.
- ^ Tyler, Marshall W.; Yourish, Harmony B.; Ionescu, Dawn F.; Haggarty, Stephen J. (2017-04-21). "Classics in Chemical Neuroscience: Ketamine". ACS Chemical Neuroscience. 8 (6): 1122–1134. doi:10.1021/acschemneuro.7b00074. ISSN 1948-7193. PMID 28418641.
- ^ Zanos, Panos; Moaddel, Ruin; Morris, Patrick J.; Georgiou, Polymnia; Fischell, Jonathan; Elmer, Greg I.; Alkondon, Manickavasagom; Yuan, Peixiong; Pribut, Heather J.; Singh, Nagendra S.; Dossou, Katina S. S.; Fang, Yuhong; Huang, Xi-Ping; Mayo, Cheryl L.; Wainer, Irving W.; Albuquerque, Edson X.; Thompson, Scott M.; Thomas, Craig J.; Zarate Jr, Carlos A.; Gould, Todd D. (2016). "NMDAR inhibition-independent antidepressant actions of ketamine metabolites". Nature. 533 (7604): 481–486. Bibcode:2016Natur.533..481Z. doi:10.1038/nature17998. ISSN 0028-0836. PMC 4922311. PMID 27144355.
- ^ Yang, Chun; Zhou, Wei; Li, Xiaomin; Yang, Jianjun; Szewczyk, Bernadeta; Pałucha-Poniewiera, Agnieszka; Poleszak, Ewa; Pilc, Andrzej; Nowak, Gabriel (2012). "A bright future of researching AMPA receptor agonists for depression treatment". Expert Opinion on Investigational Drugs. 21 (5): 583–585. doi:10.1517/13543784.2012.667399. PMID 22375566. S2CID 19842307.
- ^ Hashimoto, Kenji (2014). "The R-Stereoisomer of Ketamine as an Alternative for Ketamine for Treatment-resistant Major Depression". Clinical Psychopharmacology and Neuroscience. 12 (1): 72–73. doi:10.9758/cpn.2014.12.1.72. ISSN 1738-1088. PMC 4022771. PMID 24851126.
- ^ van Velzen, Monique; Dahan, Albert (2014). "Ketamine Metabolomics in the Treatment of Major Depression". Anesthesiology. 121 (1): 4–5. doi:10.1097/ALN.0000000000000286. ISSN 0003-3022. PMID 24936919.
- ^ Paul RK, Singh NS, Khadeer M, Moaddel R, Sanghvi M, Green CE, O'Loughlin K, Torjman MC, Bernier M, Wainer IW (2014). "(R,S)-Ketamine metabolites (R,S)-norketamine and (2S,6S)-hydroxynorketamine increase the mammalian target of rapamycin function". Anesthesiology. 121 (1): 149–59. doi:10.1097/ALN.0000000000000285. PMC 4061505. PMID 24936922.
- ^ Singh NS, Zarate CA, Moaddel R, Bernier M, Wainer IW (2014). "What is hydroxynorketamine and what can it bring to neurotherapeutics?". Expert Rev Neurother. 14 (11): 1239–42. doi:10.1586/14737175.2014.971760. PMC 5990010. PMID 25331415.


