비타민 D
Vitamin D| 비타민 D | |
|---|---|
| 드럭 클래스 | |
 콜레칼시페롤 (D3) | |
| 클래스 식별자 | |
| 동의어 | 칼시페롤류 |
| 사용하다 | 구루병, 골다공증, 비타민D 결핍 |
| ATC코드 | A11CC |
| 생물학적 표적 | 비타민 D 수용체 |
| 임상자료 | |
| Drugs.com | 메드팩트 천연제품 |
| 외부 링크 | |
| MeSH | D014807 |
| 법적지위 | |
| Wikidata | |
비타민 D는 엄밀히 말하면 비타민이 아니라 오히려 호르몬으로 여겨질 수 있습니다.[1]비타민 D는 칼슘, 마그네슘, 인산염의 장내 흡수를 증가시키고 다른 많은 생물학적 효과를 일으키는 지용성 세코스테로이드 그룹입니다.[2][3][1]인간의 경우, 이 그룹에서 가장 중요한 화합물은 비타민 D3 (콜레칼시페롤)과 비타민 D (에르고칼시페롤)입니다2.[3][1][4]
비타민 D의 주요한 자연적 공급원은 태양 노출(특히 UVB 방사선) 또는 UVB 램프로부터 UVB 광의 광화학 반응을 통해 피부 표피의 하층에서 콜레칼시페롤의 합성입니다.[2]콜레칼시페롤과 에르고칼시페롤은 식단과 보충제에서 섭취할 수 있습니다.[2][3]기름진 생선의 살과 같은 몇몇 음식만이 자연적으로 상당한 양의 비타민 D를 포함하고 있습니다.[3][5]미국과 다른 나라들에서, 많은 아침 시리얼들과 마찬가지로 소젖과 식물에서 추출한 우유 대용품들도 비타민 D로 강화됩니다.[2]자외선에 노출된 버섯은 유용한 양의 비타민 D를2 제공합니다.[3]일반적으로 식사 권장 사항은 사람의 비타민 D를 모두 입으로 섭취한다고 가정하는데, 이는 태양 노출이 인구에서 다양하고 피부암 위험을 고려할 때 안전한 태양 노출량에 대한 권장 사항이 불확실하기 때문입니다.[3]
식단이나 피부 합성에서 나오는 비타민 D는 생물학적으로 활동하지 않습니다.그것은 두 가지 단백질 효소 하이드록실화 단계에 의해 활성화되는데, 첫 번째 단계는 간에서, 두 번째 단계는 신장에서 활성화됩니다.[2][4]비타민 D는 햇빛을 충분히 받으면 대부분의 포유류에 의해 적절한 양으로 합성될 수 있기 때문에 필수적인 것은 아니며 따라서 엄밀히 말하면 비타민이 아닙니다.[1]대신 그것은 호르몬으로 간주될 수 있는데, 비타민 D 프로 호르몬의 활성화는 활성 형태인 칼시트리올을 낳고, 이것은 이후 여러 위치에서 핵 수용체를 통해 효과를 만들어냅니다.[1]
콜레칼시페롤은 간에서 칼시페디올(25-하이드록시콜레칼시페롤)로 전환되고, 에르고칼시페롤은 25-하이드록시콜레칼시페롤로 전환됩니다.[2]이 두 가지 비타민 D 대사 물질(25-하이드록시비타민 D 또는 25(OH)D라고 함)은 사람의 비타민 D 상태를 결정하기 위해 혈청에서 측정됩니다.[6][7]칼시페디올은 신장과 일부 면역계 세포에 의해 추가로 하이드록실화되어 비타민 D의 생물학적 활성 형태인 칼시트리올(1,25-디하이드록시콜레칼시페롤)을 형성합니다.[8][9]칼슘과 인산염의 농도를 조절하고 뼈의 건강한 성장과 재생을 촉진하는 주요 역할을 하는 칼슘은 혈액 속에서 호르몬으로 순환합니다.[2]Calcitriol은 또한 세포 성장, 신경근 및 면역 기능, 염증 감소를 포함한 다른 효과들도 가지고 있습니다.[3]
비타민 D는 칼슘 항상성과 신진대사에 중요한 역할을 합니다.[2]이 발견은 구루병(골연화증의 어린 시절 형태)을 앓고 있는 어린이들에게 부족한 식이 물질을 찾으려는 노력 때문이었습니다.[10]비타민 D 보충제는 골연화증과 구루병을 치료하거나 예방하기 위해 제공됩니다.[2]비타민 D가 보충된 사람들에게서 비타민 D 보충의 다른 건강 효과에 대한 증거는 일관성이 없습니다.[3]비타민 D 보충이 사망률에 미치는 영향은 명확하지 않은데, 한 메타 분석에서 노인의 사망률 감소가 작은 것으로 나타났습니다.[11]고위험군에서 구루병과 골연화증을 예방하는 것을 제외하면 근골격계 또는 일반 건강에 대한 비타민 D 보충제의 이점은 적을 수 있습니다.[12][13][14]
종류들
| 이름. | 화학 조성 | 구조. |
|---|---|---|
| 비타민1 D | 에르고칼시페롤의 분자 화합물과 루미스테롤의 혼합물, 1:1 | |
| 비타민2 D | 에르고칼시페롤(에르고스테롤로 만든) |  |
| 비타민3 D | 콜레칼시페롤 (피부의 7-dehyd로콜레스테롤로 제조). |  |
| 비타민4 D | 22-디하이드로에르고칼시페롤 |  |
| 비타민5 D | 시토칼 시페롤 (7-dehyd 로시토스테롤로 제조) |  |
비타민 D는 여러 형태로 존재합니다.[2]두 가지 주요 형태는 비타민 D2 또는 에르고칼시페롤, 비타민 D 또는3 콜레칼시페롤입니다.[2]첨자가 없는 비타민 D는 D 또는2 D3, 또는 둘 다를 의미하며, 칼시페롤(calciferol)로 통칭됩니다.[citation needed]
비타민 D는2 1931년에 화학적으로 특징지어졌습니다.1935년, 비타민3 D의 화학적 구조가 정의되었고 7-디하이드로콜레스테롤의 자외선 조사의 결과로 나타났습니다.비타민 D 형태에 대한 화학적 명명법은 1981년에 권장되었지만 대체 [15]이름은 여전히 일반적으로 사용되고 있습니다.[4]
화학적으로 비타민 D의 다양한 형태는 스테로이드 고리의 결합 중 하나가 깨지는 스테로이드입니다.[16]비타민 D와22 비타민 D의3 구조적인 차이는 22번 탄소와 23번 탄소 사이의 이중 결합을 포함하는 곁사슬과 24번 탄소에 있는 메틸기에 있습니다.[4]많은 비타민 D 유사체들이 합성되었습니다.[4]
생물학
활성 비타민 D 대사산물인 칼시트리올은 주로 표적 세포의 핵에 위치한 비타민 D 수용체(VDR)와 결합함으로써 생물학적 효과를 매개합니다.[2][16]칼시트리올의 VDR로의 결합은 VDR이 장의 칼슘 흡수에 관여하는 운반 단백질(TRPV6 및 칼빈딘과 같은)의 유전자 발현을 조절하는 전사 인자로 작용하게 합니다.[18]비타민D 수용체는 스테로이드/갑상선호르몬 수용체의 핵수용체 슈퍼패밀리에 속하며, VDR은 뇌, 심장, 피부, 생식선, 전립선, 유방 등 대부분의 장기에서 세포에 의해 발현됩니다.
장, 뼈, 신장 및 부갑상선 세포의 VDR 활성화는 혈액 내 칼슘 및 인 수준(부갑상선 호르몬 및 칼시토닌의 도움으로)을 유지하고 뼈 함량을 유지하도록 합니다.[2][19]
비타민D의 가장 중요한 역할 중 하나는 장내 칼슘 흡수를 촉진하여 골격 칼슘 균형을 유지하고, 골세포 수를 증가시켜 골 흡수를 촉진하며, 뼈 형성을 위한 칼슘과 인산염 수치를 유지하고, 혈청 칼슘 수치를 유지하기 위해 부갑상선호르몬의 적절한 기능을 할 수 있도록 하는 것입니다.[2]비타민 D의 부족이 신체의 미네랄 대사를 변화시키기 때문에 비타민 D 결핍은 뼈의 미네랄 밀도를 낮추고 골밀도 감소(골다공증) 또는 뼈 골절의 위험을 증가시킬 수 있습니다.[2][20]따라서, 비타민 D는 또한 뼈 흡수의 강력한 자극제로서의 역할을 통해 뼈를 재생시키는데 매우 중요합니다.[20]
VDR은 세포의 증식과 분화를 조절합니다.비타민 D는 면역계에도 영향을 미치며, VDR은 단핵구와 활성화된 T 및 B 세포를 포함한 여러 백혈구에서 발현됩니다.[21]시험관내에서 비타민 D는 부신수질세포에서 티로신 하이드록실라아제 유전자의 발현을 증가시키고, 신경영양인자, 산화질소 합성효소, 글루타티온의 합성에 영향을 줍니다.[22]
비타민 D 수용체의 발현은 나이가 들수록 줄어듭니다.[2]
결핍증
비타민 D가 부족한 식단은 햇빛 노출 부족과 함께 12ng/mL(30nmol/ℓ) 이하의 혈중 25(OH)D 수치로 정의되는 비타민 D 결핍을 유발하며, 비타민 D 결핍은 12~20ng/mL(30~50nmol/ℓ)의 혈중 25(OH)D 수치로 정의됩니다.[3][23]유럽의 선진국을 [24]포함하여 전세계적으로 약 10억 명의 성인이 비타민 D가 부족하거나 부족한 것으로 추정됩니다.[25]선진국에서 보기 드문 질병인 어린이의 심각한 비타민D 결핍은 뼈가 무르고 약해지는 원인이 되며 구루병이라고 불리는 질환입니다.[26]
비타민 D 결핍은 전세계적으로 노인들에게서 발견되며 어린이들과 성인들에게 흔합니다.[27][28][24]결핍은 뼈의 미네랄화 장애와 뼈 손상을 초래하며, 이는 어린이의 구루병과 성인의 골연화증을 포함한 [29]뼈 연화 질환으로 이어집니다.저혈당 석회화돌(25-하이드록시-비타민 D)은 태양을 피해서 생길 수 있습니다.[30]비타민 D가 부족하면 식이 칼슘 흡수량이 정상 분율(60~80%)에서 15% 미만으로 떨어질 수 있습니다.[19]
온화한 기후에 사는 검은 피부의 사람들은 비타민 D 수치가 낮은 것으로 나타났습니다.[31][32][33]피부가 어두운 사람들은 피부 속 멜라닌이 비타민 D 합성을 방해하기 때문에 비타민 D를 만드는 데 효율성이 떨어집니다.[34]비타민 D 결핍은 미국의 히스패닉과 아프리카계 미국인들에게 흔하며, 겨울에는 수치가 현저히 떨어집니다.[23]이것은 피부 속 멜라닌의 수치 때문인데, 멜라닌은 햇빛으로부터 자연적으로 보호해주는 역할을 하기 때문입니다.[23]
뼈 건강
구루병
소아 질환인 구루병은 성장이 저해되고 어린이가 걷기 시작하면 체중 이하로 휘어지고 절하는 부드럽고 허약하고 기형적인 긴 뼈가 특징입니다.구루병은 보통 생후 3개월에서 18개월 사이에 나타납니다.[35]북미와 다른 서구 국가에서 사례가 계속 보고되고 있으며 주로 모유를 먹은 유아와 피부가 검게 변한 유아에게서 볼 수 있습니다.[35]이 상태는 비타민 D의 부족뿐만 아니라 칼슘이나 인 결핍으로 인해 발생할 수 있는 [29]활다리가 특징입니다. 21세기에는 주로 아프리카, 아시아 또는 중동의[36] 저소득 국가와 유사 비타민 D 결핍 구루병과 같은 유전적 장애가 있는 사람들에게서 발견됩니다.[37]
산모의 비타민 D 결핍은 출생 전부터 명백한 골 질환을 유발하고 출생 후에는 골질의 손상을 유발할 수 있습니다.[38][39]영양 구루병은 나이지리아와 같이 일년 내내 햇빛이 강한 나라에 존재하며 비타민 D 결핍 없이 발생할 수 있습니다.[40][41]
비록 구루병과 골연화증이 영국에서 지금은 드물지만, 일부 이민자 사회에서 발병이 일어났는데, 골연화증을 가진 사람들 중에는 서양 옷을 입은, 겉보기에는 적당한 야외 노출을 가진 여성들도 포함되어 있습니다.[42]피부가 검고 햇빛에 노출되는 것이 줄어든 것은 육류, 생선, 계란의 높은 섭취를 특징으로 하는 서양의 잡식성 패턴에서 벗어나지 않는 한 구루병을 발생시키지 않았습니다.[43][44][45]구루병의 식이 위험 요소는 동물성 음식을 금하는 것을 포함합니다.[42][46]
모유는 비타민 D가 낮고 사회적 관습과 기후적 조건이 적절한 햇빛 노출을 막을 수 있기 때문에 비타민 D 결핍은 대부분의 국가에서 어린 유아들 사이에서 구루병의 주요 원인으로 남아 있습니다.나이가 많은 영유아와 어린이들 사이에서 구루병이 발생하는 나이지리아, 남아프리카공화국, 방글라데시 등 햇볕이 잘 드는 나라에서는 유제품에 대한 접근성이 제한된 시리얼 기반 식단의 특징인 식이 칼슘 섭취량이 낮기 때문으로 분석됐습니다.[45]
구루병은 이전에 미국 인구들 사이에서 주요한 공중 보건 문제였습니다.덴버에서는 1920년대 후반에 500명의 아이들 중 거의 3분의 2가 가벼운 구루병을 앓고 있었습니다.[47]상대적으로 적은 양의 비타민[46][48] D로 강화된 우유의 소비 증가와 함께 20세기 미국 식단에서 동물성 단백질의[49][50] 비율이 증가한 것은 구루병 사례의 극적인 감소와 동시에 일어났습니다.[19]또한, 미국과 캐나다에서는 비타민 D 강화 우유, 유아 비타민 보충제, 비타민 보충제가 지방 흡수 장애를 가진 어린이들의 구루병 사례의 대부분을 근절하는 데 도움을 주고 있습니다.[29]
골연화증 및 골다공증
골연화증은 성인에서 비타민 D 결핍으로 인해 발생하는 질병입니다.[2]이 질환의 특징은 뼈가 부드러워져 척추가 휘어지고 근위부 근육이 약해지고 뼈가 약하며 골절 위험이 증가하는 것입니다.[2]골연화증은 칼슘 흡수를 감소시키고 뼈에서 칼슘 손실을 증가시켜 뼈 골절의 위험을 증가시킵니다.골연화증은 보통 25-하이드록시비타민 D 수치가 약 10ng/mL 미만일 때 나타납니다.[51]골연화증의 효과가 만성 근골격계 통증에 기여하는 것으로 생각되지만, 만성 통증을[52] 가진 사람들의 비타민 D 수치가 낮다는 설득력 있는 증거는 없으며, 보충제가 만성 비특이적 근골격계 통증을 완화한다는 것입니다.[53]골연화증은 뼈의 연약함과 뼈 골절의 위험이 증가하고 뼈의 미네랄 밀도가 감소하는 골다공증으로 진행됩니다.골다공증은 칼슘 및/또는 비타민 D 부족의 장기적인 효과일 수 있으며, 후자는 칼슘 흡수를 감소시킴으로써 기여합니다.[3]
보충제 사용
비타민 D를 보충하는 것은 구루병을 예방하거나 치료하는 믿을만한 방법입니다.[2]반면 비타민 D 보충이 비골격계 건강에 미치는 영향은 불확실합니다.[54][55]검토 결과 노인 사망률의 잠정적 감소 외에 비골격계 질환 비율에 대한 보충 효과는 발견되지 않았습니다.[56]비타민 D 보충제는 심근경색, 뇌졸중 또는 뇌혈관 질환, 암, 뼈 골절 또는 무릎 골관절염의 결과를 바꾸지 않습니다.[13][57]
미국 의학연구소(IOM) 보고서는 "암, 심혈관 질환과 고혈압, 당뇨병과 대사증후군, 낙상 및 신체 기능 저하, 면역 기능 및 자가 면역 장애, 감염, 신경 심리학적 기능 및 전결장증과 관련된 결과는 어느 하나의 칼슘 섭취와도 확실하게 연결될 수 없습니다.m이나 비타민 D, 그리고 종종 충돌했습니다."[58]: 5 일부 연구원들은 IOM이 권고 사항에 너무 확정적이었고 뼈 건강과 관련된 비타민 D의 혈중 수치를 계산할 때 수학적인 실수를 했다고 주장합니다.[59]IOM 위원회의 구성원들은 "식사 권장사항에 대한 표준 절차"를 사용했으며 보고서가 데이터에 견고하게 기반하고 있다고 주장합니다.[59]
사망률, 모든 원인
비타민 D3 보충은 노인의 사망 위험을 감소시키는 것으로 잠정적으로 밝혀졌지만,[11][56] 그 효과는 뚜렷하지 않거나 보충제를 복용하는 것을 권장할 정도로 충분히 확실하다고 여겨지지 않았습니다.[13]다른 형태(비타민 D2, 알파칼시돌 및 칼시트리올)는 사망 위험에 유익한 영향을 미치지 않는 것으로 보입니다.[11]높은 혈중 농도는 사망 위험을 낮추는 것과 관련이 있는 것으로 보이지만, 보충이 이러한 이점으로 이어질 수 있는지는 확실하지 않습니다.[60]비타민 D의 과잉과 결핍은 비정상적인 기능과 조기 노화를 야기하는 것으로 보입니다.[61][62][63]혈청 칼시페디올 농도와 모든 원인에 의한 사망률 사이의 관계는 "U자형"입니다. 사망률은 중간 수준에 비해 높은 수준과 낮은 수준에서 높아집니다.[58]비타민 D로 인한 피해는 백인 인구보다 흑인 인구에서 더 낮은 비타민 D 수준에서 발생하는 것으로 보입니다.[58]: 435
뼈 건강
일반적으로 비타민 D 보충제가 골다공증 예방에 도움을 줄 수 있다는 일반적인 믿음을 뒷받침하는 좋은 증거는 없습니다.[13]따라서 비타민 D 결핍이 없는 사람들에게 이 질병의 예방을 위한 일반적인 용도는 필요하지 않을 것 같습니다.[12]골다공증이 있는 노인의 경우 칼슘과 함께 비타민D를 섭취하는 것이 고관절 골절 예방에 도움이 될 수도 있지만 위와 신장 질환의 위험도 다소 증가합니다.[64]65세 이상 노인의 경우 하루 800IU 이상 보충이 "고관절 골절과 비척추 골절 예방에 다소 유리하다"는 연구 결과가 나왔습니다.[65]독립적으로 사는 사람들에게는 효과가 작거나 아예 없습니다.[66][67]낮은 혈청 비타민 D 수치는 낙상과 관련이 있고, 낮은 골밀도가 있습니다.[68]그러나 비타민 D를 더 먹는 것은 위험을 바꾸지 않는 것으로 보입니다.[69]
비타민 D가 부족한 운동선수들은 스트레스 골절 및/또는 큰 골절의 위험이 증가하며, 특히 접촉 스포츠를 하는 운동선수들이 그렇습니다.보충과 함께 가장 큰 이점은 부족한 선수(25(OH)D 혈청 수치가 30ng/mL 미만) 또는 심각한 결핍(25(OH)D 혈청 수치가 25ng/mL 미만)에서 볼 수 있습니다.50ng/mL의 혈청 25(OH)D 농도가 상승하면서 위험이 점진적으로 감소하는 것으로 관찰되며, 이를 초과하는 수준에서는 추가적인 이점이 나타나지 않습니다.[70]
2020년 코크란의 체계적인 검토는 비타민 D에 칼슘이 더 있지만 독립적으로 영양 구루병을 앓고 있는 아이들의 치유를 향상시킬 수 없다는 제한적인 증거를 발견했지만 골절을 줄이는 데 결정적인 증거는 아니었습니다.[71]
미국 식품의약국(FDA)은 2016년 5월부터 제조업체들이 영양 성분 표시에 비타민 D의 양을 "공중 건강상 중요한 영양소"로 선언하도록 요구했습니다.제안된 기한 연장에 따라 일부 제조업체는 2021년 7월 1일까지 준수해야 했습니다.[72]
암
낮은 비타민 D 수치와 여러 종류의 암 발병 위험 사이의 잠재적인 연관성이 발견되었습니다.[73][74]관찰 연구의 메타 분석은 비타민 D 섭취와 25(OH)D 수준과 관련된 암 발생 위험을 감소시켰으며, 특히 대장암의 경우 연관성의 강도가 약하다고 분류되었습니다.[74][75]무작위 대조 실험에서 비타민 D 보충제가 암 발생 위험을 감소시킨다는 사실이 확인되지 않았지만, 여러 메타 분석에서 암 사망의 상대적 위험은 최대 16% 더 낮았습니다.[76][75]
심혈관질환
비타민 D 보충은 뇌졸중, 뇌혈관 질환, 심근 경색 또는 허혈성 심장 질환의 위험 감소와 관련이 없습니다.[13][77][78]보충제는 일반인의 혈압을 낮추지 않습니다.[79][80][81]
면역계
전염병
일반적으로 비타민 D는 선천적인 것을 활성화시키고 항균, 항바이러스 및 항염증 효과로 적응 면역 체계를 약화시키는 기능을 합니다.[82][83]비타민 D는 낮은 수치가 결핵의 위험인자로 보이며,[84] 역사적으로 치료제로 사용되었습니다.[85]
비타민 D를 저용량(400 ~ 1000 IU/일)으로 보충하면 급성 호흡기 감염의 전반적인 위험이 다소 감소할 수 있습니다.[86]혜택은 소아 청소년(1세부터 16세까지)에게서 확인되었으며, 더 높은 용량(1일 1천 IU 이상)으로 확인되지 않았습니다.[86]비타민 D 보충은 25nmol/L 이하의 기준치 25(OH)D 수준을 가진 사람들에게서 COPD의 중등도 또는 심각한 악화의 비율을 상당히 감소시키지만, 덜 심각한 결핍을 가진 사람들에게서는 그렇지 않습니다.[87]
천식
비타민 D 보충은 천식 발작을 예방하거나 증상을 완화하는 데 도움이 되지 않습니다.[88]
염증성 장질환
낮은 수준의 비타민 D는 인간 염증성 장 질환의 두 가지 주요 형태인 크론병과 궤양성 대장염과 관련이 있습니다.[89]염증성 장질환자와 비타민D 결핍자의 비타민D 치료 메타분석 결과, 보충이 비타민D 수치 교정에 효과적이며, 임상질환 활성도 및 생화학적 표지자 점수 향상과 관련이 있는 것으로 나타났습니다.[90]
기타조건
당뇨병
메타분석에서는 비타민 D 보충이 당뇨병 전치병을 앓고 있지 않은 사람들의 제2형 당뇨병 위험을 유의하게 감소시켰다고 보고했습니다.[91]또 다른 메타 분석은 비타민 D 보충이 제2형 당뇨병 환자의 혈당 조절[동정 모델 평가-인슐린 내성(HOMA-IR)], 헤모글로빈 A1C(HbA1C) 및 공복 혈당(FBG)을 유의하게 개선했다고 보고했습니다.[92]선행 연구에서 비타민 D의 높은 수준과 낮은 수준은 각각 제2형 당뇨병, 복합 제2형 당뇨병과 전치병, 전치병의 위험의 현저한 감소와 관련이 있었습니다.[93]2011년 Cochrane 체계적 리뷰는 인슐린과 함께 비타민 D가 인슐린 단독보다 12개월 후에 더 나은 공복 C-펩티드 수준을 유지한다는 것을 보여준 한 연구를 조사했습니다.그러나 이 검토에 포함될 수 있는 연구들이 품질과 디자인에서 상당한 결함을 나타냈다는 점을 강조할 필요가 있습니다.[94]
주의력결핍 과잉행동장애(ADHD)
관찰 연구를 메타 분석한 결과 ADHD 아동은 비타민D 수치가 낮은 것으로 나타났으며, 출생 당시의 낮은 비타민D 수치와 이후 ADHD 발병 사이에 연관성이 작았습니다.[95]비타민 D 보충의 몇 가지 소규모 무작위 대조군 실험은 충동성과 과잉행동과 같은 ADHD 증상이 개선되었음을 나타냈습니다.[96]
우울증.
우울 증상에 대한 비타민 D 보충의 임상 시험은 일반적으로 품질이 낮았고 전반적인 효과를 보이지 않았지만, 하위 그룹 분석에서 임상적으로 유의미한 우울 증상 또는 우울 장애가 있는 참가자에 대한 보충이 중간 효과를 나타냈습니다.[97]
인지와 치매
임상 연구를 체계적으로 검토한 결과 인지 장애와 비타민 D 수치가 낮은 것과 알츠하이머병 발병 위험이 높은 것 사이의 연관성이 발견되었습니다.하지만, 비타민 D 농도가 낮아지는 것은 영양 부족과 야외에서 보내는 시간이 줄어드는 것과도 관련이 있답니다.따라서, 인지 장애의 증가에 대한 대안적인 설명이 존재하며 따라서 비타민 D 수치와 인지 간의 직접적인 인과 관계를 확립할 수 없었습니다.[98]
조현병
실험을 통해 낮은 비타민 D 수치가 조현병 환자들, 특히 급성기 환자들에게 매우 널리 퍼져있다는 것이 증명되었습니다.[99]
임신
임신 중 비타민 D의 낮은 수준은 임신성 당뇨병, 전(前) 클렘프증, 그리고 작은 (임신 연령의) 유아와 관련이 있습니다.[100]임신 중에 비타민 D 보충제를 복용하면 산모의 혈중 비타민 D 농도가 높아지지만 산모나 아기를 위한 모든 혜택의 범위는 불분명합니다.[101][100][101][102]임신 중에 비타민 D를 적당량 섭취하는 임신부는 폐결핵[103] 전 위험과 긍정적인 면역 효과를 경험할 수 있습니다.[104]비타민 D 보충은 또한 임신성 당뇨병, 저체중아[103], 그리고 그들의 낮은 성장 속도의 위험을 감소시킬 가능성이 있습니다.[105]임산부는 권장량의 비타민 D를 섭취하지 않는 경우가 많습니다.[104]
체중감량
비타민 D 보충이 칼로리 제한과 별개로 비만에 효과적인 치료법일 수 있다는 가설이 있었지만, 한 체계적인 검토는 보충이 체중이나 지방량과 연관성이 없다는 것을 발견했습니다.[106]2016년 메타 분석에서는 체중 감소에 의해 순환 비타민 D 상태가 개선된 것으로 밝혀졌는데, 이는 지방량이 비타민 D의 혈중 농도와 역으로 연관되어 있을 수 있음을 보여줍니다.[107]
허용건강청구범위
정부의 규제 기관은 식품 및 식품 보조 식품 산업에 대해 특정 건강 주장을 포장에 명시된 문구와 같이 허용 가능하도록 규정합니다.
미국 식품의약국(FDA)
- "적절한 칼슘과 비타민 D는 신체 활동과 함께 균형 잡힌 식사의 일환으로 골다공증의 위험을 줄일 수 있습니다."[110]
- "적절한 칼슘과 규칙적인 운동은 어린이와 청소년들의 뼈를 튼튼하게 하는 데 도움을 주고 노인들의 골다공증 위험을 줄일 수 있습니다.비타민 D의 충분한 섭취도 필요합니다."[111]
기타 청구 안내 가능[112] 기관: 일본 FOSHU 및 호주-뉴질랜드.[113]
식사섭취량
| 영국 | ||
| 연령대 | 섭취량(μg/일) | 최대섭취량(μg/일)[114] |
|---|---|---|
| 모유 수유 유아 0~12개월 | 8.5 – 10 | 25 |
| 분유 수유 유아(<500mL/d) | 10 | 25 |
| 어린이 1~10세 | 10 | 50 |
| 10세 이상 어린이 및 성인 | 10 | 100 |
| 미국 | ||
| 연령대 | RDA(IU/일) | (μg/일)[58] |
| 유아 0~6개월 | 400* | 10 |
| 유아 6~12개월 | 400* | 10 |
| 1-70년 | 600 | 15 |
| 성인>70세 | 800 | 20 |
| 임신/유연 | 600 | 15 |
| 연령대 | 허용 가능한 상부 흡기 레벨(IU/일) | (μg/일) |
| 유아 0~6개월 | 1,000 | 25 |
| 유아 6~12개월 | 1,500 | 37.5 |
| 1-3년 | 2,500 | 62.5 |
| 4-8년 | 3,000 | 75 |
| 9년 이상 | 4,000 | 100 |
| 임신/유연 | 4,000 | 100[58] |
| 캐나다 | ||
| 연령대 | RDA(IU)[115] | 허용 가능한 상부 흡기(IU)[115] |
| 유아 0~6개월 | 400* | 1,000 |
| 유아 7~12개월 | 400* | 1,500 |
| 어린이 1~3세 | 600 | 2,500 |
| 어린이 4~8세 | 600 | 3,000 |
| 어린이와 성인은 9-70세 | 600 | 4,000 |
| 성인>70세 | 800 | 4,000 |
| 임신과 수유 | 600 | 4,000 |
| 오스트레일리아 뉴질랜드 | ||
| 연령대 | 적정섭취량(μg)[113] | 상부흡수량(μg)[113] |
| 유아 0~12개월 | 5* | 25 |
| 어린이 1~18세 | 5* | 80 |
| 성인 19~50세 | 5* | 80 |
| 성인 51~70세 | 10* | 80 |
| 성인>70세 | 15* | 80 |
| 유럽식품안전청 | ||
| 연령대 | 적정섭취량(μg)[116] | 허용상한치(μg)[117] |
| 유아 0~12개월 | 10 | 25 |
| 어린이 1~10세 | 15 | 50 |
| 어린이 11-17세 | 15 | 100 |
| 어른들 | 15 | 100 |
| 임신과 수유 | 15 | 100 |
| * 충분한 섭취량, 아직 RDA/RDI가 확립되지 않음 | ||
권장 수준
여러 기관에서 비타민 D의 하루 섭취량에[118] 대한 다양한 권장 사항을 제안했습니다.이것들은 정확한 정의, 나이, 임신 또는 수유에 따라 다르며 비타민 D의 피부 합성에 대한 범위 가정이 이루어집니다.[114][58][115][113][116]환산 : 1μg(마이크로그램) = 40IU(국제단위)
영국
영국 국민건강서비스(NHS)는 비타민D 결핍 위험이 있는 사람, 모유 수유를 받은 아기, 하루에 500ml 미만의 분유 수유를 받은 아기, 6개월에서 4세 사이의 어린이들은 충분한 섭취를 보장하기 위해 1년 내내 매일 비타민D 보충제를 복용해야 한다고 권고하고 있습니다.[114]여기에는 비타민 D의 피부 합성이 제한된 사람들이 포함되는데, 이들은 야외에 자주 있지 않고, 노쇠하거나, 집에 갇혀 있거나, 요양원에 살고 있거나, 보통 피부의 대부분을 덮는 옷을 입거나, 아프리카, 아프리카-카리브 또는 남아시아 배경과 같은 어두운 피부를 가진 사람들입니다.다른 사람들은 4월부터 9월까지의 햇빛 노출로부터 적절한 비타민 D를 만들 수 있을지도 모릅니다.NHS와 영국 공중보건국은 비타민D 합성을 위한 햇빛이 부족하기 때문에 임신과 모유 수유를 하는 사람들을 포함한 모든 사람들이 가을과 겨울에 비타민D가 10μg(400IU) 함유된 하루 보충제를 섭취하는 것을 고려할 것을 권고하고 있습니다.[119]
미국
2010년 의학연구소(IoM, National Academy of Medicine)가 발표한 비타민 D의 식이 기준 섭취량은 적절한 섭취량으로 표현되었던 이전의 권장 사항을 대체했습니다.권장 사항은 햇빛 노출이 불충분하여 비타민 D의 피부 합성이 없다고 가정하여 형성되었습니다.비타민 D의 기준 섭취량은 식품, 음료 및 보충제의 총 섭취량을 의미하며 칼슘 요구량이 충족되고 있다고 가정합니다.[58]: 5 허용 가능한 상위 섭취 수준([120]UL)은 "일반 인구의 거의 모든 사람들에게 건강에 악영향을 미칠 위험이 없을 가능성이 있는 영양소의 하루 평균 최고 섭취량"으로 정의됩니다.[58]: 403 UL은 안전하다고 여겨지지만 장기적인 영향에 대한 정보는 불완전하며 이러한 수준의 섭취는 장기적인 섭취에 권장되지 않습니다.[58]: 403 : 433
미국 식품 및 식이 보충제 표시 목적의 경우, 1인분의 양은 일일 가치(%DV)의 백분율로 표시됩니다.비타민D 표시 목적상 1일치의 100%를 400IU(10μg)로 했다가 2016년 5월 800IU(20μg)로 개정해 권장식량허용기준(RDA)에 합의했습니다.[121][122]개정된 표시 규정을 준수하도록 2020년 1월 1일까지 연간 식품 매출 미화 1,000만 달러 이상인 제조업자, 2021년 1월 1일까지 식품 판매량이 낮은 제조업자에게 요구되었습니다.[72][123]기준 일일 섭취량에는 기존 및 새로운 성인 일일 값 표가 제공됩니다.
캐나다
캐나다 보건부(Health Canada)는 공동으로 의뢰하고 기금을 지원하는 Institute of Medicine 2010 보고서에 근거하여 비타민 D에 대한 권장 식이 섭취량(DRIs)과 허용 가능한 상위 섭취 수준(ULs)을 발표했습니다.[58][115]
오스트레일리아 뉴질랜드
호주와 뉴질랜드는 2006년 식이 비타민 D 섭취 가이드라인을 포함한 영양소 기준치를 발표했습니다.[113]호주인의 약 3분의 1이 비타민 D 결핍을 가지고 있습니다.[124][125]
유럽 연합
2016년[116] 유럽 식품 안전청(EFSA)은 현재 증거를 검토했는데, 혈청 25(OH)D 농도와 근골격계 건강 결과 간의 관계가 매우 다양하다는 것을 발견했습니다.그들은 비타민 D에 대한 평균 요구량과 모집단 기준 섭취량 값을 도출할 수 없으며, 혈청 25(OH)D 농도가 50 nmol/L인 것이 적합한 목표 값임을 고려했습니다.임신 중이거나 수유 중인 여성을 포함한 1세 이상의 모든 사람들의 경우 15μg/day(600IU)의 적절한 섭취량을 설정합니다.[116]
EFSA는 2012년 안전한 섭취 수준을 검토하여 [117]성인의 허용 상한을 IOM과 유사한 결론인 100μg/일(4000 IU)로 설정했습니다.
스웨덴 국립 식품청은 어린이와 성인의 경우 최대 75세까지 비타민 D를3 하루 10μg (400IU) 섭취하고 75세 이상의 성인은 20μg (800IU) 섭취할 것을 권장합니다.[126]
유럽의 비정부기구들은 자체적으로 권고를 해왔습니다.독일영양학회에서는 20μg을 권장하고 있습니다.[127]유럽 폐경 앤 안드로파우즈 협회는 폐경기 여성이 70세까지 15μg (600IU)을 섭취하고 71세부터 20μg (800IU)을 섭취할 것을 권고하고 있습니다.비타민 D 상태가 매우 낮거나 동반 질환이 있는 일부 환자의 경우 이 용량을 100μg(4,000IU)으로 늘려야 합니다.[128]
원천
비타민 D는 몇몇 식품에만 자연적으로 존재하지만,[3] 제조된 식품에는 일반적으로 강화제로 첨가됩니다.어떤 나라에서는 주식이 인위적으로 비타민 D로 강화되어 있습니다.[129]
자연발생원
| 동물원 | |||
| 출처[130] | 아이유/g | 불규칙한 | |
|---|---|---|---|
| 익힌 계란 노른자 | 0.7 | 계란 한개에 44 IU | |
| 쇠고기 간, 조리, 조림 | 0.5 | ||
| 대구 간유와 같은 어류 간유 | 100 | 티스푼당 450IU (4.5g) | |
| 기름기 많은 어종 | |||
| 연어, 핑크, 익힌, 건열 | 5.2 | ||
| 고등어, 태평양, 잭, 혼합종, 조리, 건열 | 4.6 | ||
| 기름에 통조림으로 만든 참치 | 2.7 | ||
| 기름에 통조림으로 만든 정어리, 물기를 뺀 것 | 1.9 | ||
| 진균원 | |||
| 원천 | μg/g | 아이유/g | |
|---|---|---|---|
| Cladonia arbuscula (이끼), thali, dry[131] | 비타민3 D | 0.67–2.04 | 27–82 |
| 비타민2 D | 0.22–0.55 | 8.8–22 | |
| 아가리쿠스 비스포루스(일반 버섯):D2 + D3 | |||
| 포르토벨로 | 날것의 | 0.003 | 0.1 |
| 자외선에 노출됨 | 0.11 | 4.46 | |
| 크리미 | 날것의 | 0.001 | 0.03 |
| 자외선에 노출됨 | 0.32 | 12.8 | |
일반적으로, 비타민 D는3 동물성 식품, 특히 생선, 고기, 오팔, 달걀, 그리고 유제품에서 발견됩니다.[132]비타민 D는2 곰팡이에서 발견되며 에르고스테롤의 자외선 조사에 의해 생성됩니다.[133]버섯과 이끼인 Cladina arbuscula에 들어있는 비타민 D 함량은2 자외선에 노출됨에 따라 증가하고 [131][134]강화를 위한 공업용 자외선 램프에 의해 자극됩니다.[133]미국 농무부는 D와2 D3 함량을 하나의 값으로 결합했다고 보고합니다.
식량강화
비타민 D로 강화된 제조 식품에는 과일 주스와 과일 주스 음료, 식사 대용 에너지 바, 콩 단백질 기반 음료, 특정 치즈 및 치즈 제품, 밀가루 제품, 유아용 조제분유, 많은 아침 시리얼 및 우유가 포함됩니다.[135][136]
2016년 미국 식품의약국(FDA)은 우유 강화를 위한 식품첨가물 규정을 [137]개정하여 비타민D3 수치가 유제품 우유 100g(US quart당 400 IU)당 42 IU, 식물성 우유 100g(quart당 800 IU)당2 84 IU,식물성 요구르트나 콩 음료 제품에서는 100g당 89IU(쿼트당 800IU).[138][139][140]식물성 우유는 유제품 우유의 대안으로 의도된 다른 식물 공급원 중에서 콩, 아몬드, 쌀로 만들어진 음료로 정의됩니다.[141]
일부 연구들이 비타민 D가3 25(OH)D 혈액 수준을 더 빠르게 증가시키고 체내에서 더 오랫동안 활동적으로 유지된다는 것을 발견한 반면,[142][143] 다른 연구들은 비타민 D 공급원들이2 25(OH)D를 증가시키고 유지하는 데 D만큼3 생물학적으로 이용가능하고 효과적이라고 주장합니다.[133][144][145]
음식준비
일반적인 음식의 비타민 D 함량은 요리에 의해 다양하게 감소됩니다.삶은 음식, 튀긴 음식, 구운 음식은 원래 비타민 D의 69~89%를 유지했습니다.[146]
권장 혈청 수치

권장되는 25(OH)D 혈청 수치에 대한 권장 사항은 당국마다 다르며, 연령 등의 요인에 따라 다릅니다.[3]미국 실험실에서는 일반적으로 25(OH)D 수치를 ng/mL로 보고합니다.[149]다른 나라들은 종종 nmol/L을 사용합니다.[149]1ng/mL는 약 2.5nmol/L와 같습니다.[150]
2014년 리뷰에 따르면 모든 결과에 대해 25(OH)D에 대해 가장 유리한 혈청 수치는 30ng/mL(75nmol/L)에 가까운 것으로 나타났습니다.[151]최적의 비타민 D 수준은 여전히 논란의 여지가 있으며 운동선수들에게 30~40ng/mL (75~100nmol/L)의 범위가 권장된다는 또 다른 검토 결과가 나왔습니다.[152]논란의 일부는 수많은 연구들이 민족 간 25(OH)D의 혈청 수준의 차이를 발견했기 때문입니다. 연구들은 이러한 차이의 배후에 있는 유전적인 이유와 환경적인 이유를 지적합니다.[153]이러한 표준 수준을 달성하기 위한 보충제는 혈관 석회화를 유해하게 할 수 있습니다.[33]
2012년 메타분석에서는 분석된 연구들 간의 결과가 일관되지 않았지만 비타민 D의 혈중 수치가 8~24ng/mL (20~60nmol/L)의 범위에서 가장 낮을 경우 심혈관 질환의 위험이 증가하는 것으로 나타났습니다.[154]
2011년 IOM 위원회는 뼈와 전반적인 건강을 위해 20ng/mL (50nmol/L)의 혈청 25(OH)D 수준이 필요하다고 결론 내렸습니다.비타민 D에 대한 식이 기준 섭취량은 안전성의 한계를 가지고 선택되고 지정된 섭취 수준이 거의 모든 사람들이 원하는 혈청 25(OH)D 수준을 달성하도록 목표 혈청 값을 '오버슈트'합니다.혈청 25(OH)D 수치에 대한 기여는 햇빛 노출로 추정되지 않으며 피부가 검거나 햇빛에 거의 노출되지 않는 사람에게 권장 사항을 완전히 적용할 수 있습니다.이 연구소는 혈청 25(OH)D 농도가 30ng/mL(75nmol/L) 이상이면 "혜택 증가와 지속적으로 관련이 없다"는 것을 발견했습니다.혈청 25(OH)D 수치가 50ng/mL(125nmol/L)를 초과할 경우 우려할 수 있습니다.그러나 혈청 25(OH)D가 30~50ng/mL(75nmol/L-125nmol/L)인 일부 사람들은 비타민 D가 불충분할 것입니다.[58]
초과
비타민 D 독성은 희귀합니다.[24]햇빛보다는 고용량의 비타민D로 보충하는 것이 원인입니다.비타민 D 독성의 기준은 아직 정해지지 않았지만, 일부 연구에 따르면 9-71세[155](100μg/day)의 경우 참을 수 있는 상위 섭취 수준(UL)은 4,000 IU/day이며, 다른 연구에 따르면 건강한 성인의 경우 50 이상의 지속적인 섭취가 가능하다고 합니다.000 IU/day (1250 μg)는 수 개월 후에 명백한 독성을 생성할 수 있고 혈청 25-하이드록시비타민 D 수준을 150 ng/mL 이상으로 증가시킬 수 있습니다.[24][156]일차성 부갑상선기능항진증과 같은 특정한 질병을 가진 사람들은 비타민 D에 훨씬 더 민감하고 비타민 D 영양의 증가에 반응하여 고칼슘혈증이 발생합니다.[157]임신중 산모의 고칼슘혈증은 비타민 D의 영향에 대한 태아의 민감성을 증가시키고 지적 장애와 얼굴 기형의 증후군으로 이어질 수 있습니다.[157][158]
특발성 유아 고칼슘혈증은 CYP24A1 유전자의 돌연변이로 인해 발생하며, 이는 비타민D의 분해 감소로 이어집니다.이러한 변이를 가진 유아들은 비타민 D에 대한 민감도가 증가하고 추가적으로 섭취할 경우 고칼슘혈증의 위험이 있습니다.[159][160]그 장애는 성인이 되어서도 계속될 수 있습니다.[161]
2015년에 발표된 리뷰에 따르면 부작용은 200 nmol/L 이상의 25 (OH)D 혈청 농도에서만 보고되었습니다.[152]
비타민 D 용량과 25-하이드록시-비타민 D 수준이 모두 하루에 ≥40,000 IU (1,000 μg)의 섭취와 관련된 고칼슘혈증과 관련된 독성 사례가 발표되었습니다.
임신 중이거나 모유 수유를 받고 있는 분들은 비타민D 보충제를 복용하기 전에 의사와 상담해야 합니다.FDA는 액상 비타민 D 보충제 제조업체에 이러한 제품에 수반되는 적하제를 400개의 국제 단위로 명확하고 정확하게 표시해야 한다고 권고했습니다(1 IU는 25 ng 콜레칼시페롤/에르고칼시페롤의 생물학적 등가물입니다).또한 유아용 제품의 경우 FDA는 드로퍼에 400 IU 이하의 용량을 권장합니다.[162]영아(생후~12개월)의 경우 허용 상한치(해가 없이 견딜 수 있는 최대량)를 25μg/day(1,000IU)로 설정합니다.유아의 경우 하루에 1,000 마이크로그램의 독성이 한 달 안에 발생합니다.[156]2010년[update] 11월 30일부로 캐나다 및 미국 정부의 위탁을 받은 의학연구소(IOM)는 1-3세의 경우 하루 2,500 IU, 4-8세의 경우 하루 3,000 IU, 9-71세 이상의 경우 하루 4,000 IU(임산부 또는 수유부 포함)로 허용 상한치(UL)를 늘렸습니다.[155]
칼시트리올 자체는 음의 피드백 주기로 자동 조절되며 부갑상선호르몬, 섬유아세포성장인자 23, 사이토카인, 칼슘, 인산염 등의 영향도 받습니다.[163]
2017년에 발표된 한 연구는 1999년부터 2014년까지 공개된 NHANES 데이터를 기반으로 미국의 20세 이상 성인들의 높은 일일 비타민 D 섭취 수준을 평가했습니다.데이터에 의하면 다음과 같습니다.
- 인구의 18% 이상이 의도적인 보충 섭취를 암시하는 1000IU를 섭취함으로써 600-800IU의 NIH 일일 권장량(RDA)을 초과합니다.[3][164]
- 인구의 3% 이상이 NIH 일일 허용 상위 섭취 수준(UL)인 4000IU를 초과하여 독성 [3]영향의 위험이 증가합니다.[165][164]
- 추세 분석 결과, 1999년 이후 인구 1000 IU/일을 차지하는 비율과 4000 IU/일을 차지하는 비율이 모두 증가했습니다.[164]
초과효과
비타민 D 과다 복용은 고칼슘혈증을 일으키는데, 이는 비타민 D 독성의 강력한 징후입니다 – 이것은 소변과 갈증의 증가와 함께 주목할 수 있습니다.고칼슘혈증을 치료하지 않으면 신장, 간, 심장 등 연부조직과 장기에 칼슘이 과다하게 축적돼 통증과 장기 손상이 발생합니다.[24][29][166]
비타민 D 과다 복용의 주요 증상은 거식증, 메스꺼움, 구토를 포함한 고칼슘혈증입니다.이것들은 다뇨, 다뇨증, 허약, 불면증, 신경과민, 소양증 그리고 궁극적으로 신부전이 뒤따를 수 있습니다.또한 단백뇨, 요괴, 아조혈증, 전이성 석회화(특히 신장에서)가 발생할 수 있습니다.[156]비타민 D 독성의 다른 증상으로는 어린 아이들의 지적 장애, 비정상적인 뼈 성장과 형성, 설사, 과민성, 체중 감소, 심각한 우울증 등이 있습니다.[24][166]
비타민 D 독성은 비타민 D 보충을 중단하고 칼슘 섭취를 제한함으로써 치료됩니다.신장 손상은 돌이킬 수 없을 수도 있습니다.햇빛에 장시간 노출되면 비타민 D 독성이 나타나지 않습니다.피부에서 생성된 비타민 D 전구체의 농도는 평형에 도달하고, 더 이상 생성된 비타민 D는 분해됩니다.[157]
생합성
자연에서 비타민 D의 합성은 자외선의 존재와 간과 신장에서의 후속적인 활성화에 의존합니다.많은 동물들은 7-디하이드로콜레스테롤로부터 비타민 D를3 합성하고, 많은 곰팡이들은 에르고스테롤로부터 비타민 D를2 합성합니다.[133][167]
상호작용 경로
오른쪽 하단 모서리에 있는 아이콘을 클릭하여 엽니다.
아래의 유전자, 단백질 및 대사 물질을 클릭하여 각 기사로 연결합니다. [§ 1]
- ^ 대화형 경로 맵은 WikiPathways에서 편집할 수 있습니다."VitaminDSynthesis_WP1531".
광화학


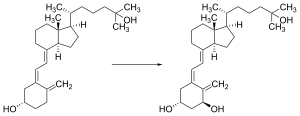
7-디하이드로콜레스테롤을 비타민D로3 전환시키는 전환은 두 단계로 이루어집니다.[168][169]첫째, 7-디하이드로콜레스테롤은 6-전자 수축 고리 개방 전기 순환 반응에서 자외선에 의해 광화되며; 생성물은 프리비타민 D3.둘째로, 프리비타민 D는3 자발적으로 비타민3 D(콜레칼시페롤)로 이성질화됩니다.실온에서, 유기 용매 중의 비타민33 D로의 프레비타민 D의 변환은 완성하는데 약 12일이 걸립니다.피부에서 비타민 D로의33 프리비타민 D의 전환은 유기 용매보다 약 10배 빠릅니다.[170]
에르고스테롤에서 비타민 D로의2 전환은 비슷한 과정을 따르며, 비타민 D2(에르고칼시페롤)로 이성질화되는 광분해에 의해 프리비타민 D를2 형성합니다.[171]메탄올에서 비타민 D로의22 프레비타민 D의 변환은 프레비타민 D와3 비슷한 속도를 갖습니다.흰단추 버섯은 그 과정이 더 빠릅니다.[133]: fig. 3
피부 합성

비타민 D는3 인간을 포함한 대부분의 척추동물의 피부에서 7-디하이드로콜레스테롤로부터 광화학적으로 생성됩니다.[172]비타민 D의3 전구체인 7-디하이드로콜레스테롤은 290~[173]315nm 파장의 UVB 빛과 반응하는 것을 특징으로 하는 비타민 D의 전구체인 7-디하이드로콜레스테롤.이러한 파장은 햇빛뿐만 아니라 태닝 베드의 UV 램프에 의해 방출되는 빛(주로 자외선을 생성하지만 일반적으로 전체 UV 방출의 4%에서 10%를 UVB로 생성)에도 존재하며, 일부 태닝 베드는 비타민 D 생성을 위해 별도의 UVB 전구만 사용할 수 있습니다.유리는 UVB 빛을 거의 완전히 차단하기 때문에 창문을 통한 빛 노출은 충분하지 않습니다.[174]
충분한 양의 비타민 D는 얼굴, 팔 및 다리(멜라닌이 가장 적은 사람의 경우)에 적당한 햇볕 노출로 생성될 수 있으며, 일주일에 두 번 평균 5-30분, 즉 햇볕에 타는 시간의 약 25%를 차지합니다.피부가 검고 햇빛이 약할수록 더 많은 시간 동안 노출이 필요합니다.자외선 노출로 인한 비타민 D 과다복용은 불가능합니다: 피부는 생성되는 만큼 빠르게 비타민 D가 저하되는 평형에 도달합니다.[24][175]
피부는 두 개의 주요 층으로 구성되어 있습니다: 진피라고 불리는 안쪽 층과 바깥쪽의 얇은 표피.비타민 D는 표피의 가장 안쪽에 있는 두 지층인 기저층과 스피노섬의 각질세포에서 생성되는데, 이것들은 또한 석회질을 생성하고 VDR을 발현할 수 있습니다.[176]
진화
비타민 D는 광화학적 과정을 통해서만 합성이 가능합니다.스테롤로부터 그것의 생산은 광합성의 기원 주변의 생명체의 진화에서 매우 일찍 시작되었을 것이고, 아마도 UVB를 흡수하여 비타민 D를 비활성 최종 산물로 만들면서 DNA 손상을 방지하는 데 도움을 줄 것입니다.비타민 D 수용체(VDR), 활성화 및 비활성화를 위한 다양한 CYP450 효소 및 비타민 D 결합 단백질(DBP)을 포함하는 익숙한 비타민 D 내분비 기계는 척추동물에서만 발견됩니다.비록 석회화된 연골이 없는 동물들에서의 기능은 불분명하지만, 원시 해양 척추동물들은 바다로부터 칼슘을 골격으로 흡수하고 비타민 D가 풍부한 플랑크톤을 먹는 것으로 생각됩니다.[177]바다에 있는 식물성 플랑크톤 (코콜리토포어와 에밀리아 헉슬리와 같은)은 5억년 이상 동안 비타민 D를 광합성 해왔습니다.
육상 척추동물은 석회화된 골격을 위해 식물 이외에 또 다른 비타민 D를 필요로 했습니다.그들은 피부에서 광합성을 하기 위해 햇빛을 섭취하거나 햇빛에 노출시켜야 했습니다.[167][170]육지 척추동물들은 3억 5천만년 이상 동안 비타민 D를 광합성 해왔습니다.[178]
새와 털을 가진 포유동물의 경우, 털이나 깃털은 자외선이 피부에 도달하는 것을 막습니다.대신, 비타민 D는 깃털이나 털에 축적된 피부의 기름진 분비물로부터 생성되며, 손질을 하는 동안 경구로 얻어집니다.[179]그러나 벌거벗은 두더지쥐와 같은 일부 동물들은 혈청 25-OH 비타민 D 수치가 검출되지 않기 때문에 선천적으로 콜레시페롤이 부족합니다.[180]개와 고양이는 7-디하이드로콜레스테롤 환원효소의 활성이 높아 비타민D 합성이 사실상 불가능하지만, 먹이 동물로부터 비타민D를 얻습니다.[181]
산업합성
비타민 D3(cholecalciferol)는 7-디하이드로콜레스테롤을 UVB와 UVC 빛에 노출시킨 후 정제함으로써 산업적으로 생산됩니다.[182][133]7-디하이드로콜레스테롤은 생선 장기, 특히 간에 있는 천연 물질이거나 [183]양의 양털 기름(라놀린)에 있는 물질입니다.비타민 D(ergocalciferol)는2 효모나 버섯의 에르고스테롤(ergosterol)을 출발물질로 하여 유사한 방법으로 제조됩니다.[182][133]
작용기전
대사활성화

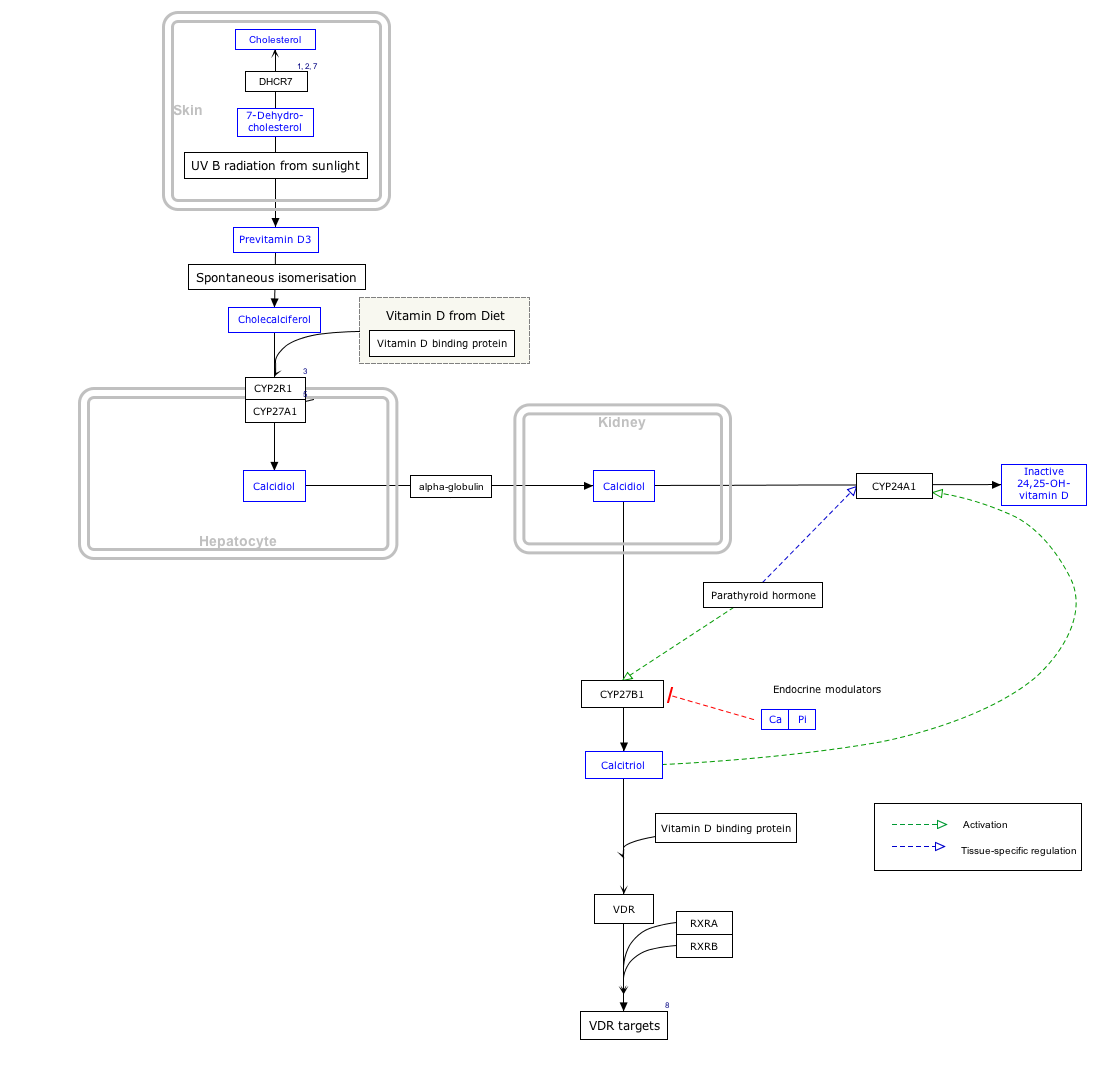
비타민 D는 혈액을 통해 간으로 운반되어 프로호르몬 석회화돌로 전환됩니다.순환하는 칼시페디올은 신장에서 비타민 D의 생물학적 활성 형태인 칼시트리올로 전환될 수 있습니다.[184]
피부에서 합성되든 섭취되든 간에, 비타민 D는 25번 위치(분자의 오른쪽 상단)에서 간에서 하이드록실화되어 25-하이드록시콜레칼시페롤(calcifiol 또는 25(OH)D)을 형성합니다.[4]이 반응은 CYP2R1 인간 유전자의 산물인 마이크로소말 효소 비타민 D 25-하이드록실라아제에 의해 촉매되고 간세포에 의해 발현됩니다.[185]일단 만들어지면, 그 제품은 혈장으로 방출되고, 그곳에서 비타민 D 결합 단백질이라는 이름의 α-글로불린 운반 단백질과 결합됩니다.[186]
칼시페디올은 신장의 근위세관으로 운반되고, 여기서 1-α 위치(분자의 우측 하단)에서 하이드록실화되어 칼시트리올(1,25-dihydroxycholecalciferol, 1,25(OH)2D)을 형성합니다.[2]칼시페디올의 칼시페디올로의 전환은 CYP27B1 인간 유전자의 산물인 효소 25-하이드록시비타민 D1-알파하이드록실라아제에3 의해 촉매됩니다.[2]CYP27B1의 활성은 부갑상선호르몬과 저칼슘 또는 인산염에 의해 증가됩니다.[2]신장에서 마지막 전환 단계를 거친 후, 캘시트리올은 순환으로 방출됩니다.비타민 D 결합 단백질과 결합함으로써, 칼시트리올은 장, 신장, 그리고 뼈를 포함한 몸 전체로 운반됩니다.[16]칼시트리올은 비타민 D 수용체의 가장 강력한 천연 리간드로, 비타민 D의 생리적 작용의 대부분을 중재합니다.[2][184]신장 외에도, 칼시트리올은 면역체계의 단세포 대식세포를 포함한 특정한 다른 세포들에 의해서도 합성됩니다.단세포 대식세포에 의해 합성될 때, 칼시트리올은 선천적인 면역 체계를 자극함으로써 미생물 침입자에 대한 신체 방어를 조절하는 사이토카인으로서 국소적으로 작용합니다.[184]
비활성화
칼시페돌과 칼시트리올의 활성은 비타민 D3 24-하이드록실라아제에 의한 24번 위치의 하이드록실화에 의해 감소될 수 있고, 세칼시페롤과 칼시테트롤을 각각 형성할 수 있습니다.[4]
기판간 차이
비타민 D2(에르고칼시페롤)와 비타민 D3(콜레칼시페롤)는 위에서 설명한 것과 유사한 작용 메커니즘을 공유합니다.[4]비타민 D에2 의해 생성된 대사 물질은 D 기반의3 대사 물질과 구별하기 위해 er- or ergo- 접두사로 명명됩니다(때로는 콜레- 접두사로 명명되기도 합니다).[15]
- 비타민 D로부터2 생성된 대사산물은 비타민 D 결합 단백질에 덜 잘 결합하는 경향이 있습니다.[4]
- 비타민 D는3 대안적으로 스테롤 27-하이드록실레이스(CYP27A1)에 의해 칼시페디올로 하이드록실화될 수 있지만, 비타민2 D는 그렇게 할 수 없습니다.[4]
- 에르고칼시페롤은 CYP27A1에 의해 위치 24에서 직접 하이드록실화될 수 있습니다.[4]이 하이드록실화는 또한 더 큰 비활성화를 초래합니다. 칼시트리올의 활성은 24-하이드록실화 후 원래의 60%로 감소하는 반면,[187] 에르칼시트리올은 에르칼시트리올로의 전환 시 활성이 10배 감소합니다.[188]
이러한 차이가 효과의 측정 가능한 감소로 이어지는지에 대해서는 논란이 되고 있습니다( § 식품 강화 참조).
세포내 메커니즘
칼시트리올은 표적 세포로 들어가 세포질에 있는 비타민 D 수용체와 결합합니다.이 활성화된 수용체는 핵으로 들어가 유전자의 특정한 DNA 서열인 비타민 D 반응 요소(VDRE)에 결합합니다.[2]이러한 유전자의 전사는 자극을 받고 비타민 D의 효과를 매개하는 더 많은 수준의 단백질을 생산합니다.[4]
칼시트리올에 대한 세포의 일부 반응은 고전적인 VDRE 전사 경로에 비해 너무 빠른 것으로 보이며, 비타민 D의 다양한 비유전적 작용의 발견으로 이어집니다.막 결합 PDIA3는 이 경로에서 대체 수용체 역할을 할 가능성이 있습니다.[189]고전적인 VDR은 여전히 역할을 할 수 있습니다.[190]
역사
비타민 D는 1922년 이전의 연구에 따라 발견되었습니다.[191]1914년[10] 미국 연구원 엘머 맥컬럼과 마거릿 데이비스는 대구 간유에서 물질을 발견했는데, 이 물질은 후에 "비타민 A"라고 불렸습니다.영국 의사 Edward Mellanby는 대구 간유를 먹은 개들은 구루병이 생기지 않았고 비타민 A, 혹은 밀접하게 연관된 요소가 질병을 예방할 수 있다고 결론지었습니다.1922년, 엘머 맥컬럼은 비타민 A가 파괴된 변형 대구 간유를 실험했습니다.[10]변형된 기름은 병든 개들을 치료했고, 그래서 맥컬럼은 구루병을 치료하는 대구 간유의 요소가 비타민 A와는 다르다는 결론을 내렸습니다.그는 그것이 이름 붙여진 네 번째 비타민이라고 생각했기 때문에 그것을 비타민 D라고 불렀습니다.[192][193]비타민 D가 자외선 노출을 통해 사람(피부)에 의해 합성될 수 있다는 사실은 처음에 깨닫지 못했고, 따라서 기술적으로 비타민이 아니라 오히려 호르몬으로 간주될 수 있습니다.
1925년에,[10] 7-디하이드로콜레스테롤에 빛을 조사하면, 지용성 물질의 형태가 생성된다는 것이 확인되었습니다(현재 D로3 알려져 있음).알프레드 파비안 헤스(Alfred Fabian Hess)는 "빛은 비타민 D와 같다"[194]고 말했습니다. 독일 괴팅겐(Göttingen) 대학의 아돌프 윈다우스(Adolf Windaus)는 스테롤의 구성과 비타민과의 연관성에 대한 연구로 1928년 노벨 화학상을 받았습니다.[195]1929년, 런던 햄스테드에 있는 NIMR의 한 연구팀은 아직 알려지지 않은 비타민 D의 구조와 스테로이드의 구조에 대해 연구하고 있었습니다.J.B.S. Haldane, J.D. Bernal 및 Dorothy Crowfoot와 함께 가능한 구조에 대해 논의하기 위해 미팅이 이루어졌으며, 이는 팀을 하나로 모으는데 기여했습니다.X-선 결정학은 스테롤 분자가 평평하다는 것을 보여주었습니다. Windaus가 이끄는 독일 팀이 제안한 것처럼 되지는 않았습니다.1932년 오토 로젠하임과 해롤드 킹은 스테롤과 담즙산의 구조를 제시하는 논문을 발표했는데, 이 논문은 즉각 받아들여졌습니다.[196]팀원 로버트 베네딕트 부르딜론, 오토 로젠하임, 해롤드 킹, 케네스 캘로우 간의 비공식적인 학술 협력은 매우 생산적이었고 비타민 D의 분리와 특성화로 이어졌습니다.[197]이때 의학연구회의 방침은 의학연구의 결과가 누구에게나 공개되어야 한다고 믿으며 특허 발굴을 하지 않았습니다.1930년대에 윈다우스는 비타민 D의 화학적 구조를 더욱 명확히 했습니다.[198]
1923년, 위스콘신 대학의 미국 생화학자 해리 스틴복은 자외선에 의한 조사가 음식과 다른 유기 물질의 비타민 D 함량을 증가시킨다는 것을 증명했습니다.[199]설치류 먹이를 조사한 후, Steenbock은 그 설치류들이 구루병으로 치료되었다는 것을 발견했습니다.300달러의 자비를 사용하여, Steenbock은 그의 발명품에 대한 특허를 냈습니다.그의 조사 기술은 식품, 특히 우유에 사용되었습니다.1945년 그의 특허가 만료되면서 구루병은 미국에서 거의 없어졌습니다.[200]
1969년, 비타민 D 수용체라고 불리는 비타민 D에 대한 특이적인 결합 단백질이 밝혀졌습니다.[201]얼마 지나지 않아 비타민D가 칼시페디올로 전환된 뒤 생물학적으로 활성화된 형태인 칼시트리올로 전환되는 것이 확인됐습니다.[8][9][202]프레비타민3 D를 통한 피부에서의 비타민 D의3 광합성과 그에 따른 대사는 1980년에 기술되었습니다.[203]
조사.
비타민 D에 대한 개입의 이점에 대해 상반된 증거가 있습니다.800~1,000 IU를 보충하는 것은 안전하지만, 혈중 농도가 50ng/mL(125nmol/L) 이상이 될 경우 부작용이 발생할 수 있습니다.[3][204]
미국 식이보충국(Office of Dietary Supplements)은 2004-18년에 걸쳐 비타민 D 이니셔티브(Vitamin D Initiative)를 설립하여 현재 연구를 추적하고 소비자에게 교육을 제공하고 있습니다.[205]2022년 현재 당뇨병, 포도당불내성, 고혈압, 다발성경화증 등의 예방 및 치료에 있어서 비타민 D의 역할은 선행 연구 중에 있습니다.[3]
몇몇 예비 연구들은 낮은 비타민 D 수치를 만년의 질병과 연관 짓습니다.[206]한 메타분석에서는 노인의 사망률이 감소하는 것으로 나타났습니다.[11]350,000명 이상의 사람들을 대상으로 한 또 다른 메타 분석은 선택되지 않은 지역 거주자들의 비타민 D 보충이 골격 (총 골절) 또는 비골격 결과 (심근경색, 허혈성 심장질환, 뇌졸중, 뇌혈관질환, 암)를 15% 이상 감소시키지 않는다는 결론을 내렸습니다.그리고 유사한 설계의 추가 연구 실험이 이러한 결론을 바꾸지는 못할 것입니다.[13]2022년 현재 비타민 D 보충이 암 발생 위험에 미치는 영향에 대한 근거는 충분하지 않습니다.[3][207][208]2019년 메타 분석에서는 칼슘과 비타민 D 보충제를 함께 복용했을 때 뇌졸중 위험이 조금 증가하는 것으로 나타났습니다.[209]
코로나19
2022년[update] 9월 현재 미국 국립보건원은 코로나19 예방 또는 치료를 위해 비타민 D 보충제를 사용하는 것에 대해 찬성 또는 반대할 증거가 부족하다고 밝혔습니다.[210]영국 국립보건의료원(NICE)은 코로나19 예방 또는 치료만을 위해 사람들에게 비타민D 보충제를 제공하는 것을 권장하지 않습니다.[211][212]두 기관은 뼈와 근육 건강과 같은 다른 이유로 비타민 D 보충에 대한 기존의 권고사항을 적용 가능한 한 계속 유지할 것을 권고하는 내용을 포함했습니다.두 기관은 팬데믹 기간 동안 태양에 노출되는 양이 적어 보충이 필요한 사람이 더 많을 수 있다고 지적했습니다.[210][211]
여러 연구에 대한 여러 체계적인 리뷰와 메타 분석은 비타민 D 결핍과 코로나19의 부정적인 결과의 연관성을 설명했습니다.[213][214][215][216][217][218]가장 큰 분석에서, 거의 200만 명의 성인을 포함한 76개 관찰 연구의 데이터에서 비타민 D 결핍 또는 결핍은 각각 1.5와 1.9의 승산비로 코로나19에 감염되고 심각한 코로나19에 걸릴 확률을 크게 높였습니다.하지만 이러한 소견은 편견과 이질성의 위험이 높았습니다.사망률은 2배 더 높았지만,[218] 이 분석은 덜 강력했습니다.이러한 연구 결과는 더 작고 이전의 분석을 확인하는데,[214][215][216][217] 그 중 하나는 코로나19에 걸린 사람들이 건강한 대상자보다 25(OH)D 수준이 낮은 경향이 있다는 보고에서 건강 결과와의 연관성에 대한 경향이 연구의 낮은 품질과 역인과 메커니즘의 가능성에 의해 제한된다고 말했습니다.[216]
경구 비타민 D 또는 칼시페디올 보충 효과에 대한 세 가지 연구의 메타분석 결과, 보충제가 없는 경우와 비교하여 낮은 중환자실(ICU) 입원율(odds ratio: 0.36)을 나타냈으나 사망률의 변화는 없었습니다.[219]Cochrane 리뷰는 또한 3개의 연구에서 코로나19 치료를 위한 비타민 D 보충의 효과에 대한 증거가 매우 불확실하다는 것을 발견했습니다.[220]그들은 포함된 세 가지 연구에서 상당한 임상적 및 방법론적 이질성이 있다는 것을 발견했는데, 주로 다양한 보충 전략, 비타민 D 제형(칼시페디올을 사용한 것), 치료 전 상태 및 보고된 결과 때문입니다.[220]또 다른 메타 분석은 비록 석회화돌 보충이 ICU 입원에 보호 효과를 가질 수 있지만, 코로나19 환자에서 고용량 비타민 D의 사용은 확실한 증거에 기초하지 않는다고 말했습니다.[216]
참고문헌
- ^ a b c d e Norman AW (August 2008). "From vitamin D to hormone D: fundamentals of the vitamin D endocrine system essential for good health". The American Journal of Clinical Nutrition. 88 (2): 491S–9S. doi:10.1093/ajcn/88.2.491S. PMID 18689389.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x "Vitamin D". Micronutrient Information Center, Linus Pauling Institute, Oregon State University, Corvallis. 11 February 2021. Archived from the original on 8 April 2015. Retrieved 14 March 2022.
- ^ a b c d e f g h i j k l m n o p q "Vitamin D". Office of Dietary Supplements, US National Institutes of Health. 12 August 2022. Archived from the original on 9 April 2021. Retrieved 22 February 2022.
- ^ a b c d e f g h i j k l Bikle DD (March 2014). "Vitamin D metabolism, mechanism of action, and clinical applications". Chemistry & Biology. 21 (3): 319–29. doi:10.1016/j.chembiol.2013.12.016. PMC 3968073. PMID 24529992.
- ^ Lehmann U, Gjessing HR, Hirche F, Mueller-Belecke A, Gudbrandsen OA, Ueland PM, et al. (October 2015). "Efficacy of fish intake on vitamin D status: a meta-analysis of randomized controlled trials". The American Journal of Clinical Nutrition. 102 (4): 837–47. doi:10.3945/ajcn.114.105395. PMID 26354531.
- ^ "Vitamin D Tests". Lab Tests Online (USA). American Association for Clinical Chemistry. Archived from the original on 7 November 2017. Retrieved 23 June 2013.
- ^ Hollis BW (January 1996). "Assessment of vitamin D nutritional and hormonal status: what to measure and how to do it". Calcified Tissue International. 58 (1): 4–5. doi:10.1007/BF02509538. PMID 8825231. S2CID 35887181.
- ^ a b Holick MF, Schnoes HK, DeLuca HF (April 1971). "Identification of 1,25-dihydroxycholecalciferol, a form of vitamin D3 metabolically active in the intestine". Proceedings of the National Academy of Sciences of the United States of America. 68 (4): 803–4. Bibcode:1971PNAS...68..803H. doi:10.1073/pnas.68.4.803. PMC 389047. PMID 4323790.
- ^ a b Norman AW, Myrtle JF, Midgett RJ, Nowicki HG, Williams V, Popják G (July 1971). "1,25-dihydroxycholecalciferol: identification of the proposed active form of vitamin D3 in the intestine". Science. 173 (3991): 51–4. Bibcode:1971Sci...173...51N. doi:10.1126/science.173.3991.51. PMID 4325863. S2CID 35236666.
- ^ a b c d Wolf G (June 2004). "The discovery of vitamin D: the contribution of Adolf Windaus". The Journal of Nutrition. 134 (6): 1299–302. doi:10.1093/jn/134.6.1299. PMID 15173387.
- ^ a b c d Bjelakovic G, Gluud LL, Nikolova D, Whitfield K, Wetterslev J, Simonetti RG, et al. (January 2014). "Vitamin D supplementation for prevention of mortality in adults". The Cochrane Database of Systematic Reviews (Systematic review). 1 (1): CD007470. doi:10.1002/14651858.CD007470.pub3. PMID 24414552.
- ^ a b Reid IR, Bolland MJ, Grey A (January 2014). "Effects of vitamin D supplements on bone mineral density: a systematic review and meta-analysis". Lancet. 383 (9912): 146–55. doi:10.1016/s0140-6736(13)61647-5. PMID 24119980. S2CID 37968189.
- ^ a b c d e f Bolland MJ, Grey A, Gamble GD, Reid IR (April 2014). "The effect of vitamin D supplementation on skeletal, vascular, or cancer outcomes: a trial sequential meta-analysis". The Lancet. Diabetes & Endocrinology (Meta-analysis). 2 (4): 307–20. doi:10.1016/S2213-8587(13)70212-2. PMID 24703049.
- ^ "The Lancet Diabetes & Endocrinology: Vitamin D supplementation in adults does not prevent fractures, falls or improve bone mineral density". EurekAlert!. Archived from the original on 24 March 2022. Retrieved 23 February 2022.
The authors conclude that there is therefore little reason to use vitamin D supplements to maintain or improve musculoskeletal health, except for the prevention of rare conditions such as rickets and osteomalacia in high risk groups, which can be caused by vitamin D deficiency after long lack of exposure to sunshine.
- ^ a b "IUPAC-IUB Joint Commission on Biochemical Nomenclature (JCBN): Nomenclature of vitamin D. Recommendations 1981". European Journal of Biochemistry. 124 (2): 223–7. May 1982. doi:10.1111/j.1432-1033.1982.tb06581.x. PMID 7094913.
- ^ a b c Fleet JC, Shapses SA (2020). "Vitamin D". In BP Marriott, DF Birt, VA Stallings, AA Yates (eds.). Present Knowledge in Nutrition, Eleventh Edition. London, United Kingdom: Academic Press (Elsevier). pp. 93–114. ISBN 978-0-323-66162-1.
- ^ Boron WF, Boulpaep EL (29 March 2016). Medical Physiology E-Book. Elsevier Health Sciences. ISBN 978-1-4557-3328-6. Archived from the original on 19 March 2023. Retrieved 9 April 2017.
- ^ Bouillon R, Van Cromphaut S, Carmeliet G (February 2003). "Intestinal calcium absorption: Molecular vitamin D mediated mechanisms". Journal of Cellular Biochemistry. 88 (2): 332–9. doi:10.1002/jcb.10360. PMID 12520535. S2CID 9853381.
- ^ a b c Holick MF (December 2004). "Sunlight and vitamin D for bone health and prevention of autoimmune diseases, cancers, and cardiovascular disease". The American Journal of Clinical Nutrition. 80 (6 Suppl): 1678S–88S. doi:10.1093/ajcn/80.6.1678S. PMID 15585788.
- ^ a b Bell TD, Demay MB, Burnett-Bowie SA (September 2010). "The biology and pathology of vitamin D control in bone". Journal of Cellular Biochemistry. 111 (1): 7–13. doi:10.1002/jcb.22661. PMC 4020510. PMID 20506379.
- ^ Watkins RR, Lemonovich TL, Salata RA (May 2015). "An update on the association of vitamin D deficiency with common infectious diseases". Canadian Journal of Physiology and Pharmacology. 93 (5): 363–8. doi:10.1139/cjpp-2014-0352. PMID 25741906.
- ^ Puchacz E, Stumpf WE, Stachowiak EK, Stachowiak MK (February 1996). "Vitamin D increases expression of the tyrosine hydroxylase gene in adrenal medullary cells". Brain Research. Molecular Brain Research. 36 (1): 193–6. doi:10.1016/0169-328X(95)00314-I. PMID 9011759.
- ^ a b c Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM, Hanley DA, Heaney RP, et al. (July 2011). "Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline". The Journal of Clinical Endocrinology and Metabolism. 96 (7): 1911–30. doi:10.1210/jc.2011-0385. PMID 21646368.
- ^ a b c d e f g Holick MF (July 2007). "Vitamin D deficiency". The New England Journal of Medicine. 357 (3): 266–81. doi:10.1056/NEJMra070553. PMID 17634462. S2CID 18566028.
- ^ Cashman KD, Dowling KG, Škrabáková Z, Gonzalez-Gross M, Valtueña J, De Henauw S, et al. (April 2016). "Vitamin D deficiency in Europe: pandemic?". The American Journal of Clinical Nutrition. 103 (4): 1033–44. doi:10.3945/ajcn.115.120873. PMC 5527850. PMID 26864360.
- ^ "Rickets". National Health Service. 8 March 2012. Archived from the original on 11 October 2017. Retrieved 9 July 2012.
- ^ Munns CF, Shaw N, Kiely M, Specker BL, Thacher TD, Ozono K, et al. (February 2016). "Global Consensus Recommendations on Prevention and Management of Nutritional Rickets". The Journal of Clinical Endocrinology and Metabolism. 101 (2): 394–415. doi:10.1210/jc.2015-2175. PMC 4880117. PMID 26745253.
- ^ Eriksen EF, Glerup H (2002). "Vitamin D deficiency and aging: implications for general health and osteoporosis". Biogerontology. 3 (1–2): 73–7. doi:10.1023/A:1015263514765. PMID 12014847. S2CID 22112344.
- ^ a b c d Brown JE, Isaacs J, Krinke B, Lechtenberg E, Murtaugh M (28 June 2013). Nutrition Through the Life Cycle. Cengage Learning. ISBN 978-1-285-82025-5. Archived from the original on 19 March 2023. Retrieved 9 April 2017.
- ^ Schoenmakers I, Goldberg GR, Prentice A (June 2008). "Abundant sunshine and vitamin D deficiency". The British Journal of Nutrition. 99 (6): 1171–3. doi:10.1017/S0007114508898662. PMC 2758994. PMID 18234141.
- ^ Lowe NM, Bhojani I (June 2017). "Special considerations for vitamin D in the south Asian population in the UK". Therapeutic Advances in Musculoskeletal Disease. 9 (6): 137–44. doi:10.1177/1759720X17704430. PMC 5466148. PMID 28620422.
- ^ O'Connor MY, Thoreson CK, Ramsey NL, Ricks M, Sumner AE (2013). "The uncertain significance of low vitamin D levels in African descent populations: a review of the bone and cardiometabolic literature". Progress in Cardiovascular Diseases. 56 (3): 261–9. doi:10.1016/j.pcad.2013.10.015. PMC 3894250. PMID 24267433.
- ^ a b Freedman BI, Register TC (June 2012). "Effect of race and genetics on vitamin D metabolism, bone and vascular health". Nature Reviews. Nephrology. 8 (8): 459–66. doi:10.1038/nrneph.2012.112. PMC 10032380. PMID 22688752. S2CID 29026212.
- ^ Khalid AT, Moore CG, Hall C, Olabopo F, Rozario NL, Holick MF, et al. (September 2017). "Utility of sun-reactive skin typing and melanin index for discerning vitamin D deficiency". Pediatric Research. 82 (3): 444–51. doi:10.1038/pr.2017.114. PMC 5570640. PMID 28467404.
- ^ a b Wagner CL, Greer FR (November 2008). "Prevention of rickets and vitamin D deficiency in infants, children, and adolescents". Pediatrics. 122 (5): 1142–52. doi:10.1542/peds.2008-1862. PMID 18977996. S2CID 342161.
- ^ Lerch C, Meissner T (October 2007). Lerch C (ed.). "Interventions for the prevention of nutritional rickets in term born children". The Cochrane Database of Systematic Reviews. 2010 (4): CD006164. doi:10.1002/14651858.CD006164.pub2. PMC 8990776. PMID 17943890.
- ^ Zargar AH, Mithal A, Wani AI, Laway BA, Masoodi SR, Bashir MI, et al. (June 2000). "Pseudovitamin D deficiency rickets—a report from the Indian subcontinent". Postgraduate Medical Journal. 76 (896): 369–72. doi:10.1136/pmj.76.896.369. PMC 1741602. PMID 10824056.
- ^ Elidrissy AT (September 2016). "The Return of Congenital Rickets, Are We Missing Occult Cases?". Calcified Tissue International (Review). 99 (3): 227–36. doi:10.1007/s00223-016-0146-2. PMID 27245342. S2CID 14727399.
- ^ Paterson CR, Ayoub D (October 2015). "Congenital rickets due to vitamin D deficiency in the mothers". Clinical Nutrition (Review). 34 (5): 793–8. doi:10.1016/j.clnu.2014.12.006. PMID 25552383.
- ^ Oramasionwu GE, Thacher TD, Pam SD, Pettifor JM, Abrams SA (August 2008). "Adaptation of calcium absorption during treatment of nutritional rickets in Nigerian children" (PDF). The British Journal of Nutrition. 100 (2): 387–92. doi:10.1017/S0007114507901233. PMID 18197991. S2CID 15406992.
- ^ Fischer PR, Rahman A, Cimma JP, Kyaw-Myint TO, Kabir AR, Talukder K, et al. (October 1999). "Nutritional rickets without vitamin D deficiency in Bangladesh". Journal of Tropical Pediatrics. 45 (5): 291–3. doi:10.1093/tropej/45.5.291. PMID 10584471.
- ^ a b Dunnigan MG, Henderson JB (November 1997). "An epidemiological model of privational rickets and osteomalacia". The Proceedings of the Nutrition Society. 56 (3): 939–56. doi:10.1079/PNS19970100. PMID 9483661.
- ^ Robertson I, Ford JA, McIntosh WB, Dunnigan MG (January 1981). "The role of cereals in the aetiology of nutritional rickets: the lesson of the Irish National Nutrition Survey 1943-8". The British Journal of Nutrition. 45 (1): 17–22. doi:10.1079/BJN19810073. PMID 6970590.
- ^ Clements MR (1989). "The problem of rickets in UK Asians". Journal of Human Nutrition and Dietetics. 2 (2): 105–16. doi:10.1111/j.1365-277X.1989.tb00015.x.
- ^ a b Pettifor JM (December 2004). "Nutritional rickets: deficiency of vitamin D, calcium, or both?". The American Journal of Clinical Nutrition. 80 (6 Suppl): 1725S–9S. doi:10.1093/ajcn/80.6.1725S. PMID 15585795.
- ^ a b Dunnigan MG, Henderson JB, Hole DJ, Barbara Mawer E, Berry JL (December 2005). "Meat consumption reduces the risk of nutritional rickets and osteomalacia". The British Journal of Nutrition. 94 (6): 983–91. doi:10.1079/BJN20051558. PMID 16351777.
- ^ Weick MT (November 1967). "A history of rickets in the United States". The American Journal of Clinical Nutrition. 20 (11): 1234–41. doi:10.1093/ajcn/20.11.1234. PMID 4862158.
- ^ Garrison RH, Somer E (1997). The Nutrition Desk Reference. McGraw-Hill. ISBN 978-0-87983-826-3. Archived from the original on 19 March 2023. Retrieved 9 April 2017.
- ^ Dupuis EM (1 February 2002). Nature's Perfect Food: How Milk Became America's Drink. NYU Press. ISBN 978-0-8147-1938-1. Archived from the original on 19 March 2023. Retrieved 9 April 2017.
- ^ Teegarden D, Lyle RM, Proulx WR, Johnston CC, Weaver CM (May 1999). "Previous milk consumption is associated with greater bone density in young women". The American Journal of Clinical Nutrition. 69 (5): 1014–7. doi:10.1093/ajcn/69.5.1014. PMID 10232644.
- ^ Holick MF (March 2006). "High prevalence of vitamin D inadequacy and implications for health". Mayo Clinic Proceedings. 81 (3): 353–73. doi:10.4065/81.3.353. PMID 16529140.
- ^ Straube S, Andrew Moore R, Derry S, McQuay HJ (January 2009). "Vitamin D and chronic pain". Pain. 141 (1–2): 10–3. doi:10.1016/j.pain.2008.11.010. PMID 19084336. S2CID 17244398.
- ^ Gaikwad M, Vanlint S, Mittinity M, Moseley GL, Stocks N (May 2017). "Does vitamin D supplementation alleviate chronic nonspecific musculoskeletal pain? A systematic review and meta-analysis". Clinical Rheumatology. 36 (5): 1201–08. doi:10.1007/s10067-016-3205-1. PMID 26861032. S2CID 30189971.
- ^ Chung M, Balk EM, Brendel M, Ip S, Lau J, Lee J, et al. (August 2009). "Vitamin D and calcium: a systematic review of health outcomes". Evidence Report/Technology Assessment (183): 1–420. PMC 4781105. PMID 20629479.
- ^ Theodoratou E, Tzoulaki I, Zgaga L, Ioannidis JP (April 2014). "Vitamin D and multiple health outcomes: umbrella review of systematic reviews and meta-analyses of observational studies and randomised trials". BMJ. 348: g2035. doi:10.1136/bmj.g2035. PMC 3972415. PMID 24690624.
- ^ a b Autier P, Boniol M, Pizot C, Mullie P (January 2014). "Vitamin D status and ill health: a systematic review". The Lancet. Diabetes & Endocrinology. 2 (1): 76–89. doi:10.1016/S2213-8587(13)70165-7. PMID 24622671.
- ^ Hussain S, Singh A, Akhtar M, Najmi AK (September 2017). "Vitamin D supplementation for the management of knee osteoarthritis: a systematic review of randomized controlled trials". Rheumatology International. 37 (9): 1489–98. doi:10.1007/s00296-017-3719-0. PMID 28421358. S2CID 23994681.
- ^ a b c d e f g h i j k Institute of Medicine (2011). "8, Implications and Special Concerns". In Ross AC, Taylor CL, Yaktine AL, Del Valle HB (eds.). Dietary Reference Intakes for Calcium and Vitamin D. The National Academies Collection: Reports funded by National Institutes of Health. National Academies Press. doi:10.17226/13050. ISBN 978-0-309-16394-1. PMID 21796828. S2CID 58721779. Archived from the original on 26 January 2021. Retrieved 17 September 2017.
- ^ a b Maxmen A (July 2011). "Nutrition advice: the vitamin D-lemma" (PDF). Nature. 475 (7354): 23–5. doi:10.1038/475023a. PMID 21734684. Archived (PDF) from the original on 3 August 2020. Retrieved 17 November 2011.
- ^ Schöttker B, Jorde R, Peasey A, Thorand B, Jansen EH, Groot L, et al. (Consortium on Health Ageing: Network of Cohorts in Europe the United States) (June 2014). "Vitamin D and mortality: meta-analysis of individual participant data from a large consortium of cohort studies from Europe and the United States". BMJ. 348 (jun17 16): g3656. doi:10.1136/bmj.g3656. PMC 4061380. PMID 24938302.
- ^ Tuohimaa P (March 2009). "Vitamin D and aging". The Journal of Steroid Biochemistry and Molecular Biology. 114 (1–2): 78–84. doi:10.1016/j.jsbmb.2008.12.020. PMID 19444937. S2CID 40625040.
- ^ Tuohimaa P, Keisala T, Minasyan A, Cachat J, Kalueff A (December 2009). "Vitamin D, nervous system and aging". Psychoneuroendocrinology. 34 (Suppl 1): S278–86. doi:10.1016/j.psyneuen.2009.07.003. PMID 19660871. S2CID 17462970.
- ^ Manya H, Akasaka-Manya K, Endo T (July 2010). "Klotho protein deficiency and aging". Geriatrics & Gerontology International. 10 (Suppl 1): S80-7. doi:10.1111/j.1447-0594.2010.00596.x. PMID 20590845. S2CID 36692930.
- ^ Avenell A, Mak JC, O'Connell D (April 2014). "Vitamin D and vitamin D analogues for preventing fractures in post-menopausal women and older men". The Cochrane Database of Systematic Reviews. 4 (4): CD000227. doi:10.1002/14651858.CD000227.pub4. PMC 7032685. PMID 24729336.
- ^ Bischoff-Ferrari HA, Willett WC, Orav EJ, Oray EJ, Lips P, Meunier PJ, et al. (July 2012). "A pooled analysis of vitamin D dose requirements for fracture prevention" (PDF). The New England Journal of Medicine. 367 (1): 40–9. doi:10.1056/NEJMoa1109617. hdl:1871/48765. PMID 22762317. S2CID 24338997. Archived (PDF) from the original on 15 December 2020. Retrieved 17 July 2019.
- ^ Chung M, Lee J, Terasawa T, Lau J, Trikalinos TA (December 2011). "Vitamin D with or without calcium supplementation for prevention of cancer and fractures: an updated meta-analysis for the U.S. Preventive Services Task Force". Annals of Internal Medicine. 155 (12): 827–38. doi:10.7326/0003-4819-155-12-201112200-00005. PMID 22184690. S2CID 22380502.
- ^ Zhao JG, Zeng XT, Wang J, Liu L (December 2017). "Association Between Calcium or Vitamin D Supplementation and Fracture Incidence in Community-Dwelling Older Adults: A Systematic Review and Meta-analysis". JAMA. 318 (24): 2466–2482. doi:10.1001/jama.2017.19344. PMC 5820727. PMID 29279934.
- ^ Cranney A, Horsley T, O'Donnell S, Weiler H, Puil L, Ooi D, et al. (August 2007). "Effectiveness and safety of vitamin D in relation to bone health". Evidence Report/Technology Assessment (158): 1–235. PMC 4781354. PMID 18088161.
- ^ Bolland MJ, Grey A, Gamble GD, Reid IR (July 2014). "Vitamin D supplementation and falls: a trial sequential meta-analysis". The Lancet. Diabetes & Endocrinology. 2 (7): 573–80. doi:10.1016/S2213-8587(14)70068-3. PMID 24768505.
- ^ Shuler FD, Wingate MK, Moore GH, Giangarra C (November 2012). "Sports health benefits of vitamin d". Sports Health. 4 (6): 496–501. doi:10.1177/1941738112461621. PMC 3497950. PMID 24179588.
- ^ Chibuzor MT, Graham-Kalio D, Osaji JO, Meremikwu MM, et al. (Cochrane Metabolic and Endocrine Disorders Group) (April 2020). "Vitamin D, calcium or a combination of vitamin D and calcium for the treatment of nutritional rickets in children". The Cochrane Database of Systematic Reviews. 2020 (4): CD012581. doi:10.1002/14651858.CD012581.pub2. PMC 7164979. PMID 32303107.
- ^ a b "Changes to the Nutrition Facts Label". U.S. Food and Drug Administration (FDA). 27 May 2016. Archived from the original on 6 May 2018. Retrieved 16 May 2020.
 이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다.
이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다. - ^ Zhao Y, Chen C, Pan W, Gao M, He W, Mao R, et al. (May 2016). "Comparative efficacy of vitamin D status in reducing the risk of bladder cancer: A systematic review and network meta-analysis". Nutrition. 32 (5): 515–523. doi:10.1016/j.nut.2015.10.023. PMID 26822497.
- ^ a b Hernández-Alonso P, Boughanem H, Canudas S, Becerra-Tomás N, Fernández de la Puente M, Babio N, et al. (July 2021). "Circulating vitamin D levels and colorectal cancer risk: A meta-analysis and systematic review of case-control and prospective cohort studies". Critical Reviews in Food Science and Nutrition. 63 (1): 1–17. doi:10.1080/10408398.2021.1939649. hdl:10609/136992. PMID 34224246. S2CID 235746547.
- ^ a b Sluyter JD, Manson JE, Scragg R (January 2021). "Vitamin D and Clinical Cancer Outcomes: A Review of Meta-Analyses". JBMR Plus. 5 (1): e10420. doi:10.1002/jbm4.10420. PMC 7839823. PMID 33553987.
- ^ Keum N, Lee DH, Greenwood DC, Manson JE, Giovannucci E (May 2019). "Vitamin D supplementation and total cancer incidence and mortality: a meta-analysis of randomized controlled trials". Annals of Oncology. 30 (5): 733–743. doi:10.1093/annonc/mdz059. PMC 6821324. PMID 30796437.
- ^ Barbarawi M, Kheiri B, Zayed Y, Barbarawi O, Dhillon H, Swaid B, et al. (August 2019). "Vitamin D Supplementation and Cardiovascular Disease Risks in More Than 83 000 Individuals in 21 Randomized Clinical Trials: A Meta-analysis". JAMA Cardiology. 4 (8): 765–76. doi:10.1001/jamacardio.2019.1870. PMC 6584896. PMID 31215980.
- ^ Nudy M, Krakowski G, Ghahramani M, Ruzieh M, Foy AJ (2020). "Vitamin D supplementation, cardiac events and stroke: A systematic review and meta-regression analysis". Int J Cardiol Heart Vasc. 28: 100537. doi:10.1016/j.ijcha.2020.100537. PMC 7240168. PMID 32462077.
- ^ Beveridge LA, Struthers AD, Khan F, Jorde R, Scragg R, Macdonald HM, et al. (May 2015). "Effect of Vitamin D Supplementation on Blood Pressure: A Systematic Review and Meta-analysis Incorporating Individual Patient Data". JAMA Internal Medicine. 175 (5): 745–54. doi:10.1001/jamainternmed.2015.0237. PMC 5966296. PMID 25775274.
- ^ Zhang D, Cheng C, Wang Y, Sun H, Yu S, Xue Y, et al. (2020). "Effect of Vitamin D on Blood Pressure and Hypertension in the General Population: An Update Meta-Analysis of Cohort Studies and Randomized Controlled Trials". Prev Chronic Dis. 17: E03. doi:10.5888/pcd17.190307. PMC 6977781. PMID 31922371.
- ^ Abboud M, Al Anouti F, Papandreou D (2021). "Vitamin D status and blood pressure in children and adolescents: a systematic review of observational studies". Systematic Reviews. 10 (1): 60. doi:10.1186/s13643-021-01584-x. PMC 7898425. PMID 33618764.
- ^ Hewison M (2011). "Vitamin D and innate and adaptive immunity". Vitamins and the Immune System. Vitamins & Hormones. Vol. 86. pp. 23–62. doi:10.1016/B978-0-12-386960-9.00002-2. ISBN 9780123869609. PMID 21419266.
- ^ Bishop E, Ismailova A, Dimeloe SK, Hewison M, White JH (August 2020). "Vitamin D and immune regulation: antibacterial, antiviral, anti-inflammatory". JBMR Plus. 5 (1): e10405. doi:10.1002/jbm4.10405. PMC 7461279. PMID 32904944.
- ^ Nnoaham KE, Clarke A (February 2008). "Low serum vitamin D levels and tuberculosis: a systematic review and meta-analysis". International Journal of Epidemiology. 37 (1): 113–9. CiteSeerX 10.1.1.513.3969. doi:10.1093/ije/dym247. PMID 18245055.
- ^ Luong K, Nguyen LT (June 2011). "Impact of vitamin D in the treatment of tuberculosis". The American Journal of the Medical Sciences. 341 (6): 493–8. doi:10.1097/MAJ.0b013e3182070f47. PMID 21289501. S2CID 18802134.
- ^ a b "SACN rapid review: Vitamin D and acute respiratory tract infections". Public Health England. Archived from the original on 14 January 2021. Retrieved 6 January 2021.
- ^ Jolliffe DA, Greenberg L, Hooper RL, Mathyssen C, Rafiq R, de Jongh RT, et al. (April 2019). "Vitamin D to prevent exacerbations of COPD: systematic review and meta-analysis of individual participant data from randomised controlled trials". Thorax. 74 (4): 337–345. doi:10.1136/thoraxjnl-2018-212092. PMID 30630893. S2CID 58548871.
- ^ Williamson A, Martineau AR, Sheikh A, Jolliffe D, Griffiths CJ (February 2023). "Vitamin D for the management of asthma". Cochrane Database Syst Rev. 2023 (2): CD011511. doi:10.1002/14651858.CD011511.pub3. PMC 9899558. PMID 36744416.
- ^ Del Pinto R, Pietropaoli D, Chandar AK, Ferri C, Cominelli F (November 2015). "Association Between Inflammatory Bowel Disease and Vitamin D Deficiency: A Systematic Review and Meta-analysis". Inflammatory Bowel Diseases. 21 (11): 2708–17. doi:10.1097/MIB.0000000000000546. PMC 4615394. PMID 26348447.
- ^ Guzman-Prado Y, Samson O, Segal JP, Limdi JK, Hayee B (May 2020). "Vitamin D Therapy in Adults With Inflammatory Bowel Disease: A Systematic Review and Meta-Analysis". Inflammatory Bowel Diseases. 26 (12): 1819–1830. doi:10.1093/ibd/izaa087. PMID 32385487.
- ^ Zhang Y, Tan H, Tang J, Li J, Chong W, Hai Y, et al. (July 2020). "Effects of Vitamin D Supplementation on Prevention of Type 2 Diabetes in Patients With Prediabetes: A Systematic Review and Meta-analysis". Diabetes Care. 43 (7): 1650–58. doi:10.2337/dc19-1708. PMID 33534730. S2CID 219897727.
- ^ Sahebi R, Rezayi M, Emadzadeh M, Salehi M, Tayefi M, Parizadeh SM, et al. (February 2019). "The effects of vitamin D supplementation on indices of glycemic control in Iranian diabetics: A systematic review and meta-analysis". Complementary Therapies in Clinical Practice. 34: 294–304. doi:10.1016/j.ctcp.2018.12.009. PMID 30712741. S2CID 57479957.
- ^ Mohammadi S, Hajhashemy Z, Saneei P (June 2021). "Serum vitamin D levels in relation to type-2 diabetes and prediabetes in adults: a systematic review and dose-response meta-analysis of epidemiologic studies". Critical Reviews in Food Science and Nutrition. 2 (29): 8178–8198. doi:10.1080/10408398.2021.1926220. PMID 34076544. S2CID 235295924.
- ^ Brophy S, Davies H, Mannan S, Brunt H, Williams R (September 2011). "Interventions for latent autoimmune diabetes (LADA) in adults". The Cochrane Database of Systematic Reviews. 2011 (9): CD006165. doi:10.1002/14651858.cd006165.pub3. PMC 6486159. PMID 21901702.
- ^ Khoshbakht Y, Bidaki R, Salehi-Abargouei A (January 2018). "Vitamin D Status and Attention Deficit Hyperactivity Disorder: A Systematic Review and Meta-Analysis of Observational Studies". Advances in Nutrition. 9 (1): 9–20. doi:10.1093/advances/nmx002. PMC 6333940. PMID 29438455.
- ^ Gan J, Galer P, Ma D, Chen C, Xiong T (November 2019). "The Effect of Vitamin D Supplementation on Attention-Deficit/Hyperactivity Disorder: A Systematic Review and Meta-Analysis of Randomized Controlled Trials". Journal of Child and Adolescent Psychopharmacology. 29 (9): 670–87. doi:10.1089/cap.2019.0059. PMID 31368773. S2CID 199054851.
- ^ Shaffer JA, Edmondson D, Wasson LT, Falzon L, Homma K, Ezeokoli N, et al. (April 2014). "Vitamin D supplementation for depressive symptoms: a systematic review and meta-analysis of randomized controlled trials". Psychosomatic Medicine. 76 (3): 190–6. doi:10.1097/psy.0000000000000044. PMC 4008710. PMID 24632894.
- ^ Balion C, Griffith LE, Strifler L, Henderson M, Patterson C, Heckman G, et al. (September 2012). "Vitamin D, cognition, and dementia: a systematic review and meta-analysis". Neurology. 79 (13): 1397–405. doi:10.1212/WNL.0b013e31826c197f. PMC 3448747. PMID 23008220.
- ^ Yüksel RN, Altunsoy N, Tikir B, Cingi Külük M, Unal K, Goka S, et al. (December 2014). "Correlation between total vitamin D levels and psychotic psychopathology in patients with schizophrenia: therapeutic implications for add-on vitamin D augmentation". Therapeutic Advances in Psychopharmacology. 4 (6): 268–75. doi:10.1177/2045125314553612. PMC 4257987. PMID 25489478.
- ^ a b Aghajafari F, Nagulesapillai T, Ronksley PE, Tough SC, O'Beirne M, Rabi DM (March 2013). "Association between maternal serum 25-hydroxyvitamin D level and pregnancy and neonatal outcomes: systematic review and meta-analysis of observational studies". BMJ. 346: f1169. doi:10.1136/bmj.f1169. PMID 23533188.
- ^ a b Palacios C, De-Regil LM, Lombardo LK, Peña-Rosas JP (November 2016). "Vitamin D supplementation during pregnancy: Updated meta-analysis on maternal outcomes". The Journal of Steroid Biochemistry and Molecular Biology. 164: 148–55. doi:10.1016/j.jsbmb.2016.02.008. PMC 5357731. PMID 26877200.
- ^ Roth DE, Leung M, Mesfin E, Qamar H, Watterworth J, Papp E (November 2017). "Vitamin D supplementation during pregnancy: state of the evidence from a systematic review of randomised trials". BMJ. 359: j5237. doi:10.1136/bmj.j5237. PMC 5706533. PMID 29187358.
- ^ a b Palacios C, Kostiuk LK, Peña-Rosas JP (July 2019). "Vitamin D supplementation for women during pregnancy". The Cochrane Database of Systematic Reviews. 7 (7): CD008873. doi:10.1002/14651858.CD008873.pub4. PMC 3747784. PMID 31348529.
- ^ a b Wagner CL, Taylor SN, Dawodu A, Johnson DD, Hollis BW (March 2012). "Vitamin D and its role during pregnancy in attaining optimal health of mother and fetus". Nutrients. 4 (3): 208–30. doi:10.3390/nu4030208. PMC 3347028. PMID 22666547.
- ^ Bi WG, Nuyt AM, Weiler H, Leduc L, Santamaria C, Wei SQ (July 2018). "Association Between Vitamin D Supplementation During Pregnancy and Offspring Growth, Morbidity, and Mortality: A Systematic Review and Meta-analysis". JAMA Pediatrics. 172 (7): 635–45. doi:10.1001/jamapediatrics.2018.0302. PMC 6137512. PMID 29813153.
- ^ Pathak K, Soares MJ, Calton EK, Zhao Y, Hallett J (June 2014). "Vitamin D supplementation and body weight status: a systematic review and meta-analysis of randomized controlled trials". Obesity Reviews. 15 (6): 528–37. doi:10.1111/obr.12162. PMID 24528624. S2CID 8660739.
- ^ Mallard SR, Howe AS, Houghton LA (October 2016). "Vitamin D status and weight loss: a systematic review and meta-analysis of randomized and nonrandomized controlled weight-loss trials". The American Journal of Clinical Nutrition. 104 (4): 1151–1159. doi:10.3945/ajcn.116.136879. PMID 27604772.
- ^ a b c European Food Safety Authority (EFSA) Panel on Dietetic Products, Nutrition and Allergies (NDA) (2010). "Scientific opinion on the substantiation of health claims related to vitamin D and normal function of the immune system and inflammatory response (ID 154, 159), maintenance of normal muscle function (ID 155) and maintenance of normal cardiovascular function (ID 159) pursuant to Article 13(1) of Regulation (EC) No 1924/2006". EFSA Journal. 8 (2): 1468–85. doi:10.2903/j.efsa.2010.1468.
- ^ European Food Safety Authority (EFSA) Panel on Dietetic Products, Nutrition and Allergies (NDA) (2011). "Scientific opinion on the substantiation of a health claim related to vitamin D and risk of falling pursuant to Article 14 of Regulation (EC) No 1924/2006" (PDF). EFSA Journal. 9 (9): 2382–2400. doi:10.2903/j.efsa.2011.2382. Archived (PDF) from the original on 20 August 2019. Retrieved 20 August 2019.
- ^ "Guidance for Industry: Food Labeling Guide". Food and Drug Administration (FDA). January 2013. Archived from the original on 22 December 2020. Retrieved 17 July 2019.
 이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다.
이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다. - ^ "Health Canada Scientific Summary on the U. S. Health Claim Regarding Calcium and Osteoporosis". Bureau of Nutritional Sciences Food Directorate, Health Products and Food Branch Health Canada. 1 May 2000. Archived from the original on 3 December 2016. Retrieved 29 January 2012.
- ^ "Regulatory Systems of Health Claims in Japan" (PDF). Japan Consumer Affairs Agency, Food Labelling Division. 1 June 2011. Archived from the original (PDF) on 6 March 2012. Retrieved 29 January 2012.
- ^ a b c d e Nutrient Reference Values for Australia and New Zealand Including Recommended Dietary Intakes. 2006. ISBN 1864962437. Archived from the original on 3 March 2023. Retrieved 19 March 2023.
{{cite book}}:work=무시됨(도움말)CS1 유지 관리: 위치 누락 게시자(링크) - ^ a b c d "Vitamins and minerals – Vitamin D". National Health Service. 3 August 2020. Archived from the original on 30 October 2017. Retrieved 15 November 2020.
- ^ a b c d "Vitamin D and Calcium: Updated Dietary Reference Intakes". Nutrition and Healthy Eating. Health Canada. 5 December 2008. Archived from the original on 14 June 2017. Retrieved 28 April 2018.
- ^ a b c d EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA) (29 June 2016). "Dietary reference values for vitamin D". EFSA Journal. 14 (10): e04547. doi:10.2903/j.efsa.2016.4547.
- ^ a b EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA) (2012). "Scientific Opinion on the Tolerable Upper Intake Level of vitamin D". EFSA Journal (Submitted manuscript). 10 (7): 2813. doi:10.2903/j.efsa.2012.2813.
- ^ "Office of Dietary Supplements – Vitamin D". National Institutes of Health Office of Dietary Supplements. Archived from the original on 23 July 2020. Retrieved 14 April 2022.
 이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다.
이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다. - ^ "PHE publishes new advice on vitamin D". Public Health England. 21 July 2016. Archived from the original on 3 January 2021. Retrieved 15 November 2020.
- ^ "Vitamin D". The Nutrition Source. 18 September 2012. Archived from the original on 13 April 2022. Retrieved 14 April 2022.
- ^ "Federal Register May 27, 2016 Food Labeling: Revision of the Nutrition and Supplement Facts Labels. FR page 33982" (PDF). Archived (PDF) from the original on 8 August 2016. Retrieved 20 August 2019.
 이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다.
이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다. - ^ "Daily Value Reference of the Dietary Supplement Label Database (DSLD)". Dietary Supplement Label Database (DSLD). Archived from the original on 7 April 2020. Retrieved 16 May 2020.
- ^ "Industry Resources on the Changes to the Nutrition Facts Label". U.S. Food and Drug Administration (FDA). 21 December 2018. Archived from the original on 25 December 2020. Retrieved 16 May 2020.
 이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다.
이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다. - ^ Salleh A (12 June 2012). "Vitamin D food fortification on the table". Australian Broadcasting Corporation. Archived from the original on 22 December 2020. Retrieved 12 June 2012.
- ^ "Australian Health Survey: Biomedical Results for Nutrients, 2011-12". Australian Bureau of Statistics. 21 December 2011. Archived from the original on 10 March 2023. Retrieved 19 March 2023.
- ^ "Vitamin D (translated)" (in Swedish). Swedish National Food Agency. Archived from the original on 26 October 2020. Retrieved 19 October 2018.
- ^ 비타민-D-베다프 바이 펠렌더 엔도제너 합성 도이체 게셀샤프트 für Ernährung, 2012년 1월
- ^ Pérez-López FR, Brincat M, Erel CT, Tremollieres F, Gambacciani M, Lambrinoudaki I, et al. (January 2012). "EMAS position statement: Vitamin D and postmenopausal health". Maturitas. 71 (1): 83–8. doi:10.1016/j.maturitas.2011.11.002. PMID 22100145.
- ^ Institute of Medicine (US) Standing Committee on the Scientific Evaluation of Dietary Reference Intakes (1997). DRI, Dietary reference intakes: for calcium, phosphorus, magnesium, vitamin D, and fluoride. Washington, D.C: National Academy Press. p. 250. doi:10.17226/5776. ISBN 978-0-309-06350-0. PMID 23115811. Archived from the original on 2 April 2015. Retrieved 11 April 2010.
- ^ "Search, National Nutrient Database for Standard Reference Release 27". US Department of Agriculture, Agricultural Research Service. 2014. Archived from the original on 19 April 2014. Retrieved 12 June 2015.
 이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다.
이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다. - ^ a b Wang T, Bengtsson G, Kärnefelt I, Björn LO (September 2001). "Provitamins and vitamins D2and D3in Cladina spp. over a latitudinal gradient: possible correlation with UV levels". Journal of Photochemistry and Photobiology B: Biology. 62 (1–2): 118–22. doi:10.1016/S1011-1344(01)00160-9. PMID 11693362. Archived from the original on 28 May 2020. Retrieved 31 October 2018.
- ^ Schmid A, Walther B (July 2013). "Natural vitamin D content in animal products". Advances in Nutrition. 4 (4): 453–62. doi:10.3945/an.113.003780. PMC 3941824. PMID 23858093.
- ^ a b c d e f g Keegan RJ, Lu Z, Bogusz JM, Williams JE, Holick MF (January 2013). "Photobiology of vitamin D in mushrooms and its bioavailability in humans". Dermato-Endocrinology. 5 (1): 165–76. doi:10.4161/derm.23321. PMC 3897585. PMID 24494050.
- ^ Haytowitz DB (2009). "Vitamin D in mushrooms" (PDF). Nutrient Data Laboratory, US Department of Agriculture. Archived (PDF) from the original on 1 February 2021. Retrieved 16 April 2018.
 이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다.
이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다. - ^ de Lourdes Samaniego-Vaesken M, Alonso-Aperte E, Varela-Moreiras G (2012). "Vitamin food fortification today". Food & Nutrition Research. 56: 5459. doi:10.3402/fnr.v56i0.5459. PMC 3319130. PMID 22481896.
- ^ Spiro A, Buttriss JL (December 2014). "Vitamin D: An overview of vitamin D status and intake in Europe". Nutrition Bulletin. 39 (4): 322–350. doi:10.1111/nbu.12108. PMC 4288313. PMID 25635171.
- ^ "Vitamin D for Milk and Milk Alternatives". Food and Drug Administration (FDA). 15 July 2016. Archived from the original on 22 December 2020. Retrieved 22 February 2017.
 이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다.
이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다. - ^ "Federal Register: Food Additives Permitted for Direct Addition to Food for Human Consumption; Vitamin D2". Food and Drug Administration, US Department of Health and Human Services. 18 July 2016. Archived from the original on 22 December 2020. Retrieved 22 February 2017.
 이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다.
이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다. - ^ "§172.379 Vitamin D2". Electronic Code of Federal Regulations. Archived from the original on 22 December 2020. Retrieved 16 July 2019.
 이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다.
이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다. - ^ "§172.380 Vitamin D3". Electronic Code of Federal Regulations. Archived from the original on 22 December 2020. Retrieved 16 July 2019.
 이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다.
이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다. - ^ "Alternative to dairy milk". osoblanco. 16 January 2020. Archived from the original on 22 December 2020. Retrieved 20 January 2020.
- ^ Tripkovic L (2013). "Vitamin D2 vs. vitamin D3: Are they one and the same?". Nutrition Bulletin. 38 (2): 243–248. doi:10.1111/nbu.12029.
- ^ Alshahrani F, Aljohani N (September 2013). "Vitamin D: deficiency, sufficiency and toxicity". Nutrients. 5 (9): 3605–16. doi:10.3390/nu5093605. PMC 3798924. PMID 24067388.
- ^ Biancuzzo RM, Clarke N, Reitz RE, Travison TG, Holick MF (March 2013). "Serum concentrations of 1,25-dihydroxyvitamin D2 and 1,25-dihydroxyvitamin D3 in response to vitamin D2 and vitamin D3 supplementation". The Journal of Clinical Endocrinology and Metabolism. 98 (3): 973–9. doi:10.1210/jc.2012-2114. PMC 3590486. PMID 23386645.
- ^ Borel P, Caillaud D, Cano NJ (2015). "Vitamin D bioavailability: state of the art" (PDF). Critical Reviews in Food Science and Nutrition. 55 (9): 1193–205. doi:10.1080/10408398.2012.688897. PMID 24915331. S2CID 9818323. Archived (PDF) from the original on 13 July 2021. Retrieved 27 April 2021.
- ^ Jakobsen J, Knuthsen P (April 2014). "Stability of vitamin D in foodstuffs during cooking". Food Chemistry. 148: 170–5. doi:10.1016/j.foodchem.2013.10.043. PMID 24262542.
- ^ Wahl DA, Cooper C, Ebeling PR, Eggersdorfer M, Hilger J, Hoffmann K, et al. (29 August 2012). "A global representation of vitamin D status in healthy populations" (PDF). Archives of Osteoporosis. 7 (1–2): 155–172. doi:10.1007/s11657-012-0093-0. hdl:11343/220606. PMID 23225293. S2CID 207300035. Archived from the original on 19 March 2023. Retrieved 20 August 2019.
- ^ Wahl DA, Cooper C, Ebeling PR, Eggersdorfer M, Hilger J, Hoffmann K, et al. (1 February 2013). "A global representation of vitamin D status in healthy populations: reply to comment by Saadi". Archives of Osteoporosis. 8 (1–2): 122. doi:10.1007/s11657-013-0122-7. PMID 23371520. S2CID 5929230.
- ^ a b "25(OH)D levels in ng/mL". health harvard edu/. 19 December 2016. Archived from the original on 2 January 2020. Retrieved 2 January 2020.
- ^ "nmol converter". endmemo. Archived from the original on 2 February 2020. Retrieved 5 January 2020.
- ^ Bischoff-Ferrari HA (2008). "Optimal Serum 25-Hydroxyvitamin D Levels for Multiple Health Outcomes". Sunlight, Vitamin D and Skin Cancer (Review). Advances in Experimental Medicine and Biology. Vol. 810. pp. 500–25. doi:10.1007/978-0-387-77574-6_5. ISBN 978-0-387-77573-9. PMID 25207384.
- ^ a b Dahlquist DT, Dieter BP, Koehle MS (2015). "Plausible ergogenic effects of vitamin D on athletic performance and recovery". Journal of the International Society of Sports Nutrition (Review). 12: 33. doi:10.1186/s12970-015-0093-8. PMC 4539891. PMID 26288575.
- ^ Engelman CD, Fingerlin TE, Langefeld CD, Hicks PJ, Rich SS, Wagenknecht LE, et al. (September 2008). "Genetic and environmental determinants of 25-hydroxyvitamin D and 1,25-dihydroxyvitamin D levels in Hispanic and African Americans". The Journal of Clinical Endocrinology and Metabolism. 93 (9): 3381–8. doi:10.1210/jc.2007-2702. PMC 2567851. PMID 18593774.
- ^ Wang L, Song Y, Manson JE, Pilz S, März W, Michaëlsson K, et al. (November 2012). "Circulating 25-hydroxy-vitamin D and risk of cardiovascular disease: a meta-analysis of prospective studies". Circulation: Cardiovascular Quality and Outcomes. 5 (6): 819–29. doi:10.1161/CIRCOUTCOMES.112.967604. PMC 3510675. PMID 23149428.
- ^ a b Ross AC, Manson JE, Abrams SA, Aloia JF, Brannon PM, Clinton SK, et al. (January 2011). "The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine: what clinicians need to know". The Journal of Clinical Endocrinology and Metabolism. 96 (1): 53–8. doi:10.1210/jc.2010-2704. PMC 3046611. PMID 21118827.
- ^ a b c Merck 진단 및 치료 매뉴얼 전문판의 비타민 데이터
- ^ a b c d Vieth R (May 1999). "Vitamin D supplementation, 25-hydroxyvitamin D concentrations, and safety" (PDF). The American Journal of Clinical Nutrition. 69 (5): 842–56. doi:10.1093/ajcn/69.5.842. PMID 10232622. Archived (PDF) from the original on 3 July 2012. Retrieved 30 January 2011.
- ^ Tolerable Upper Intake Limits for Vitamins And Minerals (PDF). European Food Safety Authority. December 2006. ISBN 978-92-9199-014-6. Archived (PDF) from the original on 6 May 2019. Retrieved 27 February 2011.
- ^ Schlingmann KP, Kaufmann M, Weber S, Irwin A, Goos C, John U, et al. (August 2011). "Mutations in CYP24A1 and idiopathic infantile hypercalcemia". The New England Journal of Medicine. 365 (5): 410–21. doi:10.1056/NEJMoa1103864. PMID 21675912.
- ^ De Paolis E, Scaglione GL, De Bonis M, Minucci A, Capoluongo E (October 2019). "CYP24A1 and SLC34A1 genetic defects associated with idiopathic infantile hypercalcemia: from genotype to phenotype". Clinical Chemistry and Laboratory Medicine. 57 (11): 1650–1667. doi:10.1515/cclm-2018-1208. PMID 31188746.
- ^ Tebben PJ, Singh RJ, Kumar R (October 2016). "Vitamin D-Mediated Hypercalcemia: Mechanisms, Diagnosis, and Treatment". Endocrine Reviews. 37 (5): 521–547. doi:10.1210/er.2016-1070. PMC 5045493. PMID 27588937.
- ^ "FDA Cautions on Accurate Vitamin D Supplementation for Infants" (Press release). Food and Drug Administration (FDA). 15 June 2010. Archived from the original on 12 January 2017.
 이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다.
이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다. - ^ Olmos-Ortiz A, Avila E, Durand-Carbajal M, Díaz L (January 2015). "Regulation of calcitriol biosynthesis and activity: focus on gestational vitamin D deficiency and adverse pregnancy outcomes". Nutrients. 7 (1): 443–80. doi:10.3390/nu7010443. PMC 4303849. PMID 25584965.
- ^ a b c Rooney MR, Harnack L, Michos ED, Ogilvie RP, Sempos CT, Lutsey PL (June 2017). "Trends in Use of High-Dose Vitamin D Supplements Exceeding 1000 or 4000 International Units Daily, 1999–2014". JAMA. 317 (23): 2448–2450. doi:10.1001/jama.2017.4392. PMC 5587346. PMID 28632857.
- ^ Institute of Medicine (US) Committee to Review Dietary Reference Intakes for Vitamin D and Calcium (2011). Ross AC, Taylor CL, Yaktine AL, Del Valle HB (eds.). Dietary Reference Intakes for Calcium and Vitamin D. The National Academies Collection: Reports funded by National Institutes of Health. Washington (DC): National Academies Press (US). PMID 21796828. Archived from the original on 29 January 2016. Retrieved 7 July 2012.
- ^ a b Insel P, Ross D, Bernstein M, McMahon K (18 March 2015). Discovering Nutrition. Jones & Bartlett Publishers. ISBN 978-1-284-06465-0. Archived from the original on 19 March 2023. Retrieved 9 April 2017.
- ^ a b Holick MF (1992). "Evolutionary biology and pathology of vitamin D". J Nutr Sci Vitaminol (Tokyo). Spec No: 79–83. doi:10.3177/jnsv.38.special_79. PMID 1297827.
- ^ Holick MF (April 1987). "Photosynthesis of vitamin D in the skin: effect of environmental and life-style variables". Federation Proceedings. 46 (5): 1876–82. PMID 3030826.
- ^ Deluca HF (January 2014). "History of the discovery of vitamin D and its active metabolites". BoneKEy Reports. 3: 479. doi:10.1038/bonekey.2013.213. PMC 3899558. PMID 24466410.
- ^ a b Holick MF (March 2004). "Vitamin D: importance in the prevention of cancers, type 1 diabetes, heart disease, and osteoporosis". The American Journal of Clinical Nutrition. 79 (3): 362–71. doi:10.1093/ajcn/79.3.362. PMID 14985208.
- ^ Eyley SC, Williams DH (1975). "Photolytic production of vitamin D. The preparative value of a photo-sensitiser". Journal of the Chemical Society, Chemical Communications (20): 858a. doi:10.1039/C3975000858A.
- ^ Crissey SD, Ange KD, Jacobsen KL, Slifka KA, Bowen PE, Stacewicz-Sapuntzakis M, et al. (January 2003). "Serum concentrations of lipids, vitamin d metabolites, retinol, retinyl esters, tocopherols and selected carotenoids in twelve captive wild felid species at four zoos". The Journal of Nutrition. 133 (1): 160–6. doi:10.1093/jn/133.1.160. PMID 12514284.
- ^ Holick MF (2018). "Chapter 4: Photobiology of Vitamin D". In Feldman D, Pike JW, Bouillon R, Giovannucci E, Goltzman D, Hewison M (eds.). Vitamin D: Volume 1: Biochemistry, Physiology and Diagnostics (4th ed.). London, UK: Academic Press. ISBN 978-0-12-809965-0.
- ^ Holick MF (2020). "Sunlight, UV Radiation, Vitamin D, and Skin Cancer: How Much Sunlight do We Need?". Sunlight, Vitamin D and Skin Cancer. Advances in Experimental Medicine and Biology. Vol. 1268. pp. 19–36. doi:10.1007/978-3-030-46227-7_2. ISBN 978-3-030-46226-0. PMID 32918212. S2CID 221636019.
108 references
- ^ Holick MF (February 2002). "Vitamin D: the underappreciated D-lightful hormone that is important for skeletal and cellular health". Current Opinion in Endocrinology, Diabetes and Obesity. 9 (1): 87–98. doi:10.1097/00060793-200202000-00011. S2CID 87725403.
- ^ Bikle DD (March 2010). "Vitamin D and the skin". Journal of Bone and Mineral Metabolism. 28 (2): 117–30. doi:10.1007/s00774-009-0153-8. PMID 20107849. S2CID 6072459.
- ^ Bouillon R, Suda T (January 2014). "Vitamin D: calcium and bone homeostasis during evolution". BoneKEy Reports. 3: 480. doi:10.1038/bonekey.2013.214. PMC 3899559. PMID 24466411.
- ^ Holick MF (1 April 2010). The Vitamin D Solution: A 3-Step Strategy to Cure Our Most Common Health Problems. Penguin Publishing Group. ISBN 978-1-101-22293-5. Archived from the original on 19 March 2023. Retrieved 19 March 2023.
- ^ Agarwal SC, Stout SD (28 June 2011). Bone Loss and Osteoporosis: An Anthropological Perspective. Springer Science & Business Media. ISBN 978-1-4419-8891-1. Archived (PDF) from the original on 29 January 2006.
The high 25(OH)D concentrations, and relatively high vitamin D requirements of apes and monkeys are understandable in light of their biology—their body surface area relative to mass is generally greater than for humans, and they are inveterate groomers, consuming by mouth the vitamin D generated from the oils secreted by skin into fur. Although much of the vitamin D produced within human skin is absorbed directly, birds and furbearing animals acquire most of their vitamin D orally, as they groom themselves (Bicknell and Prescott, 1946; Carpenter and Zhao, 1999). Vitamin D is generated from the oily secretions of skin into fur. The oral consumption of UV-exposed dermal excretion is the way many animals acquire the "nutrient," vitamin D. Although Fraser (1983) has argued that dermal absorption of vitamin D may be more natural, what we know from animals indicates that oral consumption is equally physiological. Since vitamin D can be extracted from UV-exposed human sweat and skin secretions (Bicknell and Prescott, 1946), it is also reasonable to think that early humans obtained some of their vitamin D by mouth as well, by licking the skin.
- ^ Yahav S, Buffenstein R (January 1993). "Cholecalciferol supplementation alters gut function and improves digestibility in an underground inhabitant, the naked mole rat (Heterocephalus glaber), when fed on a carrot diet". The British Journal of Nutrition. 69 (1): 233–41. doi:10.1079/BJN19930025. PMID 8384476.
- ^ Zafalon RV, Risolia LW, Pedrinelli V, Vendramini TH, Rodrigues RB, Amaral AR, et al. (January 2020). "Vitamin D metabolism in dogs and cats and its relation to diseases not associated with bone metabolism". Journal of Animal Physiology and Animal Nutrition. 104 (1): 322–42. doi:10.1111/jpn.13259. PMID 31803981.
- ^ a b Holick MF (November 2005). "The vitamin D epidemic and its health consequences" (PDF). The Journal of Nutrition. 135 (11): 2739S–48S. doi:10.1093/jn/135.11.2739S. PMID 16251641. Archived (PDF) from the original on 18 November 2017. Retrieved 24 November 2011.
[Vitamin D3] is produced commercially by extracting 7-dehydrocholesterol from wool fat, followed by UVB irradiation and purification [...] [Vitamin D2] is commercially made by irradiating and then purifying the ergosterol extracted from yeast
- ^ Takeuchi A, Okano T, Sayamoto M, Sawamura S, Kobayashi T, Motosugi M, et al. (February 1986). "Tissue distribution of 7-dehydrocholesterol, vitamin D3 and 25-hydroxyvitamin D3 in several species of fishes". Journal of Nutritional Science and Vitaminology. 32 (1): 13–22. doi:10.3177/jnsv.32.13. PMID 3012050. Archived from the original on 1 November 2018. Retrieved 20 August 2019.
- ^ a b c Adams JS, Hewison M (February 2010). "Update in vitamin D". The Journal of Clinical Endocrinology and Metabolism. 95 (2): 471–8. doi:10.1210/jc.2009-1773. PMC 2840860. PMID 20133466.
- ^ Cheng JB, Levine MA, Bell NH, Mangelsdorf DJ, Russell DW (May 2004). "Genetic evidence that the human CYP2R1 enzyme is a key vitamin D 25-hydroxylase". Proceedings of the National Academy of Sciences of the United States of America. 101 (20): 7711–5. Bibcode:2004PNAS..101.7711C. doi:10.1073/pnas.0402490101. PMC 419671. PMID 15128933.
- ^ Laing CJ, Cooke NE (2004). "Section I: Ch. 8: Vitamin D Binding Protein". In Feldman D, Glorieux FH, Pike JW (eds.). Vitamin D. Vol. 1 (2 ed.). Academic Press. pp. 117–134. ISBN 978-0122526879. Archived from the original on 19 March 2023. Retrieved 9 April 2017.
- ^ Holick MF, Kleiner-Bossaller A, Schnoes HK, Kasten PM, Boyle IT, DeLuca HF (October 1973). "1,24,25-Trihydroxyvitamin D3. A metabolite of vitamin D3 effective on intestine". The Journal of Biological Chemistry. 248 (19): 6691–6. doi:10.1016/S0021-9258(19)43408-X. PMID 4355503.
- ^ Horst RL, Reinhardt TA, Ramberg CF, Koszewski NJ, Napoli JL (July 1986). "24-Hydroxylation of 1,25-dihydroxyergocalciferol. An unambiguous deactivation process". The Journal of Biological Chemistry. 261 (20): 9250–6. doi:10.1016/S0021-9258(18)67647-1. PMID 3013880.
- ^ Doroudi M, Schwartz Z, Boyan BD (March 2015). "Membrane-mediated actions of 1,25-dihydroxy vitamin D3: a review of the roles of phospholipase A2 activating protein and Ca(2+)/calmodulin-dependent protein kinase II". The Journal of Steroid Biochemistry and Molecular Biology. 147: 81–84. doi:10.1016/j.jsbmb.2014.11.002. PMC 4323845. PMID 25448737.
- ^ Hii CS, Ferrante A (March 2016). "The Non-Genomic Actions of Vitamin D". Nutrients. 8 (3): 135. doi:10.3390/nu8030135. PMC 4808864. PMID 26950144.
- ^ Jones G (April 2022). "100 YEARS OF VITAMIN D: Historical aspects of vitamin D". Endocrine Connections. 11 (4). doi:10.1530/EC-21-0594. PMC 9066576. PMID 35245207.
- ^ Carere S (25 July 2007). "Age-old children's disease back in force". Toronto Star. Archived from the original on 17 May 2008. Retrieved 24 August 2010.
- ^ McClean FC, Budy AM (28 January 1964). "Vitamin A, Vitamin D, Cartilage, Bones, and Teeth". Vitamins and Hormones. Vol. 21. Academic Press. pp. 51–52. ISBN 978-0-12-709821-0. Archived from the original on 19 March 2023. Retrieved 19 March 2023.
- ^ "History of Vitamin D". University of California at Riverside. 2011. Archived from the original on 16 October 2017. Retrieved 9 May 2014.
- ^ "Adolf Windaus – Biography". Nobelprize.org. 25 March 2010. Archived from the original on 24 July 2018. Retrieved 25 March 2010.
- ^ Rosenheim O, King H (1932). "The Ring-system of sterols and bile acids. Part II". J. Chem. Technol. Biotechnol. 51 (47): 954–7. doi:10.1002/jctb.5000514702.
- ^ Askew FA, Bourdillon RB, Bruce HM, Callow RK, St. L. Philpot J, Webster TA (1932). "Crystalline Vitamin D". Proceedings of the Royal Society of London. Series B, Containing Papers of a Biological Character. 109 (764): 488–506. doi:10.1098/rspb.1932.0008. JSTOR 81571.
- ^ Hirsch AL (2011). "Industrial aspects of vitamin D". In Feldman DJ, Pike JW, Adams JS (eds.). Vitamin D. Academic Press. p. 73. ISBN 978-0-12-387035-3. Archived from the original on 19 March 2023. Retrieved 19 March 2023.
- ^ Ziedonis AA, Mowery DC, Nelson RR, Bhaven NS (2004). Ivory tower and industrial innovation: university-industry technology transfer before and after the Bayh-Dole Act in the United States. Stanford Business Books. pp. 39–40. ISBN 978-0-8047-4920-6. Archived from the original on 19 March 2023. Retrieved 19 March 2023.
- ^ Marshall J (September 2010). Elbridge a Stuart: Founder of Carnation Company. Kessinger Publishing. ISBN 978-1-164-49678-6. Archived from the original on 19 March 2023. Retrieved 9 April 2017.
- ^ Haussler MR, Norman AW (January 1969). "Chromosomal receptor for a vitamin D metabolite". Proceedings of the National Academy of Sciences of the United States of America. 62 (1): 155–62. Bibcode:1969PNAS...62..155H. doi:10.1073/pnas.62.1.155. PMC 285968. PMID 5253652.
- ^ Holick MF, DeLuca HF, Avioli LV (January 1972). "Isolation and identification of 25-hydroxycholecalciferol from human plasma". Archives of Internal Medicine. 129 (1): 56–61. doi:10.1001/archinte.1972.00320010060005. PMID 4332591.
- ^ Holick MF, MacLaughlin JA, Clark MB, Holick SA, Potts JT, Anderson RR, et al. (October 1980). "Photosynthesis of previtamin D3 in human skin and the physiologic consequences". Science. 210 (4466): 203–5. Bibcode:1980Sci...210..203H. doi:10.1126/science.6251551. JSTOR 1685024. PMID 6251551.
- ^ Rizzoli R (January 2021). "Vitamin D supplementation: upper limit for safety revisited?". Aging Clin Exp Res (Review). 33 (1): 19–24. doi:10.1007/s40520-020-01678-x. PMC 7897606. PMID 32857334.
- ^ "ODS Vitamin D Initiative". Office of Dietary Supplements, US National Institutes of Health. 2018. Archived from the original on 26 January 2021. Retrieved 22 February 2023.
- ^ Pyrżak B, Witkowska-Sędek E, Krajewska M, Demkow U, Kucharska AM (2015). "Metabolic and immunological consequences of vitamin D deficiency in obese children". Body Metabolism and Exercise. Advances in Experimental Medicine and Biology. Vol. 840. pp. 13–9. doi:10.1007/5584_2014_81. ISBN 978-3-319-10249-8. PMID 25315624. S2CID 13296456.
- ^ "Vitamin D and cancer prevention". National Cancer Institute, US National Institutes of Health. 21 October 2013. Archived from the original on 13 February 2015. Retrieved 15 December 2016.
- ^ Goulão, Beatriz; Stewart, Fiona; Ford, John A.; MacLennan, Graeme; Avenell, Alison (2018). "Cancer and vitamin D supplementation: a systematic review and meta-analysis". The American Journal of Clinical Nutrition. 107 (4): 652–63. doi:10.1093/ajcn/nqx047. PMID 29635490.
- ^ Khan SU, Khan MU, Riaz H, Valavoor S, Zhao D, Vaughan L, et al. (August 2019). "Effects of Nutritional Supplements and Dietary Interventions on Cardiovascular Outcomes: An Umbrella Review and Evidence Map". Annals of Internal Medicine. 171 (3): 190–98. doi:10.7326/m19-0341. PMC 7261374. PMID 31284304.
- ^ a b "Vitamin D". Coronavirus Disease 2019 (COVID-19) Treatment Guidelines. National Institutes of Health (NIH). 26 September 2022. Retrieved 4 July 2023.
 이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다.
이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다. - ^ a b COVID-19 rapid guideline: vitamin D (PDF) (Technical report). National Institute for Health and Care Excellence (NICE). December 2020. ISBN 978-1-4731-3942-8. NG187. Archived from the original on 3 December 2021. Retrieved 22 February 2021.
- ^ Evidence reviews for the use of vitamin D supplementation as prevention and treatment of COVID-19 (PDF) (Report). National Institute for Health and Care Excellence (NICE). December 2020. Archived from the original on 20 October 2021. Retrieved 22 February 2021.
- ^ Liu N, Sun J, Wang X, Zhang T, Zhao M, Li H (March 2021). "Low vitamin D status is associated with coronavirus disease 2019 outcomes: a systematic review and meta-analysis". International Journal of Infectious Diseases. 104: 58–64. doi:10.1016/j.ijid.2020.12.077. PMC 7833186. PMID 33401034.
- ^ a b Kazemi A, Mohammadi V, Aghababaee SK, Golzarand M, Clark CC, Babajafari S (October 2021). "Association of Vitamin D Status with SARS-CoV-2 Infection or COVID-19 Severity: A Systematic Review and Meta-analysis". Advances in Nutrition. 12 (5): 1636–58. doi:10.1093/advances/nmab012. PMC 7989595. PMID 33751020.
- ^ a b Petrelli F, Luciani A, Perego G, Dognini G, Colombelli PL, Ghidini A (July 2021). "Therapeutic and prognostic role of vitamin D for COVID-19 infection: A systematic review and meta-analysis of 43 observational studies". The Journal of Steroid Biochemistry and Molecular Biology. 211: 105883. doi:10.1016/j.jsbmb.2021.105883. PMC 7997262. PMID 33775818.
- ^ a b c d Bassatne A, Basbous M, Chakhtoura M, El Zein O, Rahme M, El-Hajj Fuleihan G (June 2021). "The link between COVID-19 and VItamin D (VIVID): A systematic review and meta-analysis". Metabolism (Systematic review). 119: 154753. doi:10.1016/j.metabol.2021.154753. PMC 7989070. PMID 33774074.
- ^ a b Damascena AD, Azevedo LM, Oliveira TA, Santana JD, Pereira M (August 2021). "Addendum to vitamin D deficiency aggravates COVID-19: systematic review and meta-analysis". Critical Reviews in Food Science and Nutrition. 63 (4): 557–62. doi:10.1080/10408398.2021.1951652. PMID 34384300. S2CID 236997712.
- ^ a b Dissanayake HA, de Silva NL, Sumanatilleke M, de Silva SD, Gamage KK, Dematapitiya C, et al. (April 2022). "Prognostic and Therapeutic Role of Vitamin D in COVID-19: Systematic Review and Meta-analysis". The Journal of Clinical Endocrinology and Metabolism. 107 (5): 1484–502. doi:10.1210/clinem/dgab892. PMC 8689831. PMID 34894254.
- ^ Shah K, Saxena D, Mavalankar D (January 2021). "Vitamin D supplementation, COVID-19 & Disease Severity: A meta-analysis". QJM: Monthly Journal of the Association of Physicians. 114 (3): 175–81. doi:10.1093/qjmed/hcab009. PMC 7928587. PMID 33486522.
- ^ a b Stroehlein JK, Wallqvist J, Iannizzi C, Mikolajewska A, Metzendorf MI, Benstoem C, et al. (May 2021). "Vitamin D supplementation for the treatment of COVID-19: a living systematic review". The Cochrane Database of Systematic Reviews. 2021 (5): CD015043. doi:10.1002/14651858.CD015043. PMC 8406457. PMID 34029377. S2CID 235202971.