도파민
Dopamine 도파민 골격식 | |
 | |
| 임상자료 | |
|---|---|
| 기타이름 |
|
| 생리학적 데이터 | |
| 소스조직 | 실질적인 니그라; 복측부 피질 부위; 많은 다른 것들 |
| 대상조직 | 시스템 전체 |
| 리셉터 | D1, D2, D3, D4, D5, TAAR1[3] |
| 아고니스트 | 다이렉트: 아포모르핀, 브로모크립틴 간접: 코카인, 암페타민 |
| 길항자 | 신경 렙틱스, 메토클로프라미드, 돔페리돈 |
| 전구체 | 페닐알라닌, 티로신, L-DOPA |
| 생합성 | DOPA 탈카복실화효소 |
| 신진대사 | 마오, COMT[3] |
| 식별자 | |
| |
| CAS 번호 |
|
| 펍켐 CID | |
| IUPHAR/BPS | |
| 드럭뱅크 | |
| 켐스파이더 | |
| 유니아이 | |
| 케그 | |
| CompTox 대시보드 (EPA) | |
| ECHA 인포카드 | 100.000.101 |
| 화학 및 물리 데이터 | |
| 공식 | C8H11NO2 |
| 어금니 질량 | 153.181g·mol |
| 3D 모델(JSMO) | |
| |
| |
도파민(DA, 3,4-디하이드록시페닐아민의 축약)은 세포에서 몇 가지 중요한 역할을 하는 신경 조절 분자입니다.그것은 카테콜아민과 페네틸아민 계열의 유기 화학 물질입니다.도파민은 뇌 속 카테콜아민 함량의 약 80%를 차지합니다.뇌와 신장에서 합성되는 그 전구체 화학물질인 L-DOPA의 분자에서 카르복실기를 제거하여 합성되는 아민입니다.도파민은 식물과 대부분의 동물에서도 합성됩니다.뇌에서 도파민은 신경전달물질의 역할을 하는데, 신경세포가 다른 신경세포에 신호를 보내기 위해 신경세포에서 방출하는 화학물질입니다.신경전달물질은 뇌의 특정한 영역에서 합성되지만, 많은 영역에 체계적으로 영향을 미칩니다.뇌는 몇 가지 독특한 도파민 경로를 포함하고 있는데, 그 중 하나는 보상 동기 부여 행동의 동기적 요소에 주요한 역할을 합니다.대부분의 보상에 대한 기대는 뇌의 도파민 수준을 증가시키고,[4] 많은 중독성 약물은 도파민 방출을 증가시키거나 방출 후 신경세포로의 재흡수를 막습니다.[5]다른 뇌 도파민 경로는 운동 조절과 다양한 호르몬 분비 조절에 관여합니다.이 경로들과 세포 그룹들은 신경조절인 도파민 시스템을 형성합니다.[5]
대중문화와 대중매체에서 도파민은 종종 즐거움의 주요 화학물질로 묘사되지만, 약리학의 현재 의견은 도파민이 대신 동기적 현저성을 부여한다는 것입니다;[6][7][8] 다시 말해서, 도파민은 결과의 인지된 동기적 현저성 (즉, 바람직함 또는 혐오감)을 나타내는 신호입니다.결국 유기체의 행동이 그 결과를 달성하는 쪽으로 또는 그 결과를 달성하는 쪽으로 나아가게 합니다.[8][9]배측 분절에서 CB1 수용체 활성화를 통해 큐-동기 행동의 누적 부호화를 형성하고 보상을 추구하는 동안 큐-발화된 도파민 과도현상을 조절하는 것은 엔도칸나비노이드, 2-아라키도닐글리세롤(2-AG: CHO; 20:4, ω-6)입니다.
중추신경계 외부에서 도파민은 주로 국소 파라크린 메신저 역할을 합니다.혈관에서, 그것은 노르에피네프린 방출을 억제하고 (정상 농도에서) 혈관 확장제의 역할을 합니다; 신장에서, 나트륨 배설과 소변 배출을 증가시키고; 췌장에서, 인슐린 생산을 감소시키고; 소화계에서, 위장관 운동을 감소시키고 장점막을 보호합니다; 그리고 면역계에서,림프구의 활동을 줄여줍니다.혈관을 제외하고, 이러한 각 말초 시스템에 있는 도파민은 국소적으로 합성되어 그것을 방출하는 세포 근처에서 효과를 발휘합니다.
신경계의 몇몇 중요한 질병들은 도파민 시스템의 역기능과 관련이 있고, 그것들을 치료하는데 사용되는 몇몇 주요한 약들은 도파민의 효과를 바꿈으로써 작용합니다.떨림과 운동장애를 일으키는 퇴행성 질환인 파킨슨병은 흑요석이라고 불리는 중뇌의 한 부분에서 도파민 분비 신경세포가 소실됨으로써 발생합니다.L-DOPA의 대사 전구물질인 L-DOPA를 제조할 수 있습니다; L-DOPA의 순수한 형태인 레보도파는 파킨슨병에 가장 널리 사용되는 치료제입니다.정신분열증은 도파민 활성의 변화된 수준을 수반한다는 증거가 있고, 이것을 치료하기 위해 사용되는 대부분의 항정신병 약물은 도파민 활성을 감소시키는 도파민 길항제입니다.[11]유사한 도파민 길항제 또한 가장 효과적인 항마취제입니다.안절부절못하는 다리 증후군과 주의력결핍 과잉행동장애(ADHD)는 도파민 활동의 감소와 관련이 있습니다.[12]도파민 자극제는 고용량일 수 있지만, 일부는 ADHD를 치료하기 위해 저용량으로 사용됩니다.도파민 자체는 정맥 주사를 위한 제조된 약으로 이용 가능합니다.심한 심부전이나 심장성 쇼크 치료에 유용합니다.[13]신생아의 경우 저혈압과 패혈성 쇼크에 사용될 수 있습니다.[14]
구조.
도파민 분자는 하나의 아민기가 에틸 사슬을 통해 결합된 카테콜 구조(두 개의 하이드록실기를 갖는 벤젠 고리)로 구성됩니다.[15]이와 같이 도파민은 신경전달물질인 노르에피네프린과 에피네프린을 포함하는 가장 간단한 카테콜아민입니다.[16]이 아민 부착물을 갖는 벤젠 고리의 존재는 치환된 페네틸아민으로, 다양한 정신 활성 약물을 포함합니다.[17]
대부분의 아민처럼 도파민은 유기 염기입니다.[18]염기로서, 이것은 일반적으로 산성 환경에서 양성자화됩니다([18]산-염기 반응에서.양성자화된 형태는 수용성이 높고 비교적 안정적이지만 산소나 다른 산화제에 노출되면 산화될 수 있습니다.[18]기본적인 환경에서는 도파민이 양성자화되지 않습니다.[18]이 유리 염기 형태에서는 수용성이 낮고 반응성이 높습니다.[18]도파민은 프로톤화된 형태의 안정성 및 수용성이 향상되어 화학적 또는 의약적 용도로 사용되는 염산(dopamine chloride), 즉, 도파민이 염산과 결합할 때 생성되는 염산(chloride salt)[18]으로 공급됩니다.건조한 형태에서, 염산 도파민은 흰색에서 노란색의 미세한 가루입니다.[19]
생화학
합성
도파민은 제한된 종류의 세포에서 합성되는데, 주로 부신의 물 속에 있는 뉴런과 세포들입니다.[23]주요 대사 경로와 경미한 대사 경로는 각각 다음과 같습니다.
- 일차: L-페닐알라닌 → L-티로신 → L-DOPA → 도파민
- 마이너: L-페닐알라닌 → L-티로신 → p-티라민 → 도파민
- 마이너: L-페닐알라닌 → m-티로신 → m-티라민 → 도파민
도파민의 직접 전구체인 L-DOPA는 필수 아미노산 페닐알라닌으로부터 간접적으로 또는 비필수 아미노산 티로신으로부터 직접 합성될 수 있습니다.[26]이 아미노산들은 거의 모든 단백질에서 발견되며 따라서 티로신이 가장 일반적인 음식에서 쉽게 구할 수 있습니다.도파민은 많은 종류의 음식에서도 발견되지만, 뇌를 둘러싸고 보호하는 혈액 뇌 장벽을 넘을 수 없습니다.[27]따라서 신경세포의 활동을 수행하기 위해서는 뇌 속에서 합성되어야 합니다.[27]
L-페닐알라닌은 페닐알라닌 하이드록실화효소에 의해 L-티로신으로 전환되며, 분자산소(O2)와 테트라하이드로바이옵테린이 보조인자로 작용합니다.티로신 하이드록실화효소는 L-DOPA로 전환되는데, Tetrahydrobiopterin, O 및2 철(Fe2+)을 보조인자로 합니다.[26]L-DOPA는 피리독살 포스페이트를 보조인자로 하여 방향족 L-아미노산 디카르복실화효소(DOPA 디카르복실화효소라고도 함)에 의해 도파민으로 전환됩니다.[26]
도파민 자체는 신경전달물질인 노르에피네프린과 에피네프린의 합성에서 전구물질로 사용됩니다.[26]도파민은 도파민 β-하이드록실라아제 효소에 의해 노르에피네프린으로 전환되며, O와2 L-아스코르브산이 보조 인자로 작용합니다.[26]노르에피네프린은 S-아데노실-L-메티오닌을 보조인자로 하는 페닐에탄올아민 N-메틸트랜스퍼라제에 의해 에피네프린으로 전환됩니다.[26]
어떤 보조 인자들은 또한 그들 자신의 합성을 필요로 합니다.[26]필요한 아미노산이나 보조 인자의 결핍은 도파민, 노르에피네프린, 에피네프린의 합성을 방해할 수 있습니다.[26]
퇴화
도파민은 순차적으로 작용하는 모노아민 산화효소(MAO), 카테콜-O-메틸 전이효소(COMT), 알데하이드 탈수소효소(ALDH) 등의 효소에 의해 비활성 대사산물로 분해됩니다.[28]모노아민 산화효소의 두 동형인 MAO-A와 MAO-B는 도파민을 효과적으로 대사시킵니다.[26]다양한 분해 경로가 존재하지만 주요 최종 생성물은 알려진 생물학적 활성이 없는 호모바닐산(HVA)입니다.[28]혈류로부터 호모바닐산은 신장에 의해 걸러진 후 소변으로 배출됩니다.[28]도파민을 HVA로 전환시키는 두 가지 주요 대사 경로는 다음과 같습니다.
- 도파민 → DOPAL → DOPAC → HVA – MAO, ALDH, COMT에 의해 각각 촉매됨
- 도파민 → 3-메톡시티라민 → HVA – COMT 및 MAO+ALDH에 의해 각각 촉매됨
조현병에 대한 임상 연구에서 혈장 중 호모바닐산의 측정은 뇌의 도파민 활동 수준을 추정하는 데 사용되었습니다.그러나 이 접근법의 어려움은 노르에피네프린의 대사에 의해 기여되는 높은 수준의 혈장 호모바닐산을 분리하는 것입니다.[29][30]
도파민은 일반적으로 산화환원효소에 의해 분해되지만, 산소와 직접 반응하여 퀴논과 다양한 활성산소를 생성함으로써 산화되기 쉽습니다.[31]산화 속도는 철철이나 다른 요소들의 존재에 의해 증가될 수 있습니다.도파민의 자동 산화에 의해 생성된 퀴논과 활성산소는 세포를 독살할 수 있으며, 이 메커니즘이 파킨슨병 등에서 발생하는 세포 손실에 기여할 수 있다는 증거가 있습니다.[32]
기능들
세포효과
인간 뇌의[3][33] 도파민의 주요 표적| 가족 | 리셉터 | 유전자 | 유형 | 매커니즘 |
|---|---|---|---|---|
| D1 같은 | 라1 | DRD1 | 지커플s. | cAMP의 세포내 수치 증가 아데닐산 고리화효소를 활성화시킴으로써. |
| 라5 | DRD5 | |||
| D2 같은 | 라2 | DRD2 | 지커플i. | cAMP의 세포내 수치 감소 아데닐산 고리화효소를 억제함으로써. |
| 라3 | DRD3 | |||
| 라4 | DRD4 | |||
| TAAR | TAAR1 | TAAR1 | 지커플s. 지커플q. | cAMP의 세포내 수치 증가 그리고 세포내 칼슘 농도. |
도파민은 세포 표면 수용체에 결합하고 활성화시킴으로써 그 효과를 발휘합니다.[23]인간에서 도파민은 도파민 수용체 및 인간 미량 아민 연관 수용체 1(hTAAR1)에서 높은 결합 친화도를 갖습니다.[3][33]포유류에서, D1부터 D5까지 5가지의 도파민 수용체의 아형이 확인되었습니다.[23]그들 모두는 대사작용을 하는 G 단백질 결합 수용체로서 기능하는데, 이것은 복잡한 두 번째 메신저 시스템을 통해 그들의 효과를 발휘한다는 것을 의미합니다.[34]이 수용체들은 D1 유사체와 D2 유사체로 알려진 두 개의 가족으로 나눌 수 있습니다.[23]신경계의 뉴런에 위치한 수용체의 경우, D1 유사 활성화(D1 및 D5)의 궁극적인 효과는 흥분(나트륨 채널의 개방을 통한) 또는 억제(칼륨 채널의 개방을 통한)일 수 있습니다. D2 유사 활성화(D2, D3 및 D4)의 궁극적인 효과는 일반적으로 표적 뉴런의 억제입니다.[34]따라서 도파민 자체를 흥분성 또는 억제성으로 설명하는 것은 올바르지 않습니다: 표적 뉴런에 대한 그것의 효과는 어떤 종류의 수용체가 그 뉴런의 막에 존재하는지와 두 번째 메신저 cAMP에 대한 그 뉴런의 내부 반응에 달려 있습니다.[34] D1 수용체는 인간의 방식에서 가장 많은 도파민 수용체입니다.vous system; D2 수용체가 그 다음입니다; D3, D4, 그리고 D5 수용체는 상당히 낮은 수준에 있습니다.[34]
저장, 해제 및 재이용
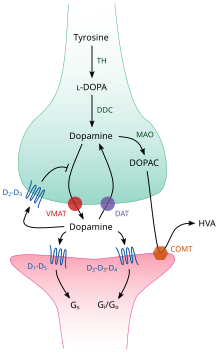
TH: 티로신 하이드록실화효소
DOPA: L-DOPA
DAT: 도파민 수송체
DDC: DOPA 탈카복실화효소
VMAT: 소포체 모노아민 수송체 2
MAO: 모노아민 산화효소
COMT: 카테콜-O-메틸전이효소
호모바닐산
뇌 안에서 도파민은 신경전달물질과 신경조절물질의 역할을 하며, 모든 모노아민 신경전달물질에 공통적인 일련의 메커니즘에 의해 조절됩니다.[23]합성 후, 도파민은 용질 운반체인 소포체(vesicular monoamine transporter, VMAT2)에 의해 세포질로부터 시냅스 소포로 운반되며,[35] 도파민은 시냅스 분열로 방출될 때까지 이 소포들에 저장됩니다.대부분의 경우 도파민의 방출은 활동전위에 의해 발생하는 세포외전증이라는 과정을 통해 발생하지만, 세포내 미량 아민 관련 수용체인 TAAR1의 활성에 의해 발생할 수도 있습니다.[33]TAAR1은 도파민, 미량 아민에 대한 고친화성 수용체입니다시냅스전 세포의 세포내 환경에 있는 막들을 따라 위치하는 특정한 치환된 암페타민; 수용체의 활성화는 다양한 메커니즘 세트를 통해 신경세포의 발화를 억제할 뿐만 아니라 도파민 재흡수 억제 및 유출을 유도함으로써 도파민 신호를 조절할 수 있습니다.[33][33][36]
일단 시냅스에 들어가면, 도파민은 도파민 수용체에 결합하고 활성화됩니다.[37]이것들은 덴드라이트(시냅틱 후 뉴런)에 위치하는 시냅틱 후 도파민 수용체 또는 축삭 말단(시냅틱 전 뉴런)의 막에 위치하는 시냅틱 전 자가 수용체(예: Dsh2 및 시냅틱 D 수용체3)일 수 있습니다.[23][37]시냅스 후 뉴런이 활동전위를 이끌어낸 후 도파민 분자는 빠르게 수용체로부터 결합하지 못하게 됩니다.그 다음 도파민 전달체 또는 혈장 막 모노아민 전달체에 의해 매개된 재흡수를 통해 시냅스 전 세포로 다시 흡수됩니다.[38]일단 세포질로 돌아오면, 도파민은 모노아민 산화효소에 의해 분해되거나 VMAT2에 의해 소포로 재포장되어 나중에 방출될 수 있습니다.[35]
뇌에서 세포 외 도파민의 수준은 위상 전달과 강장 전달이라는 두 가지 메커니즘에 의해 조절됩니다.[39]대부분의 신경 전달 물질이 신경계에서 방출되는 것처럼, 단계적인 도파민 방출은 도파민을 포함한 세포의 활동 전위에 의해 직접적으로 유도됩니다.[39]강장성 도파민 전달은 시냅스 전 활동 잠재력이 앞서지 않고 소량의 도파민이 방출될 때 발생합니다.[39]강장 전달은 다른 뉴런들의 활동과 신경전달물질의 재흡수를 포함한 다양한 요소들에 의해 조절됩니다.[39]
중추신경계

뇌 안에서 도파민은 수유, 성적 만족, 메스꺼움을 포함한 하위 기능뿐만 아니라 실행 기능, 운동 조절, 동기 부여, 각성, 강화, 보상에 중요한 역할을 합니다.도파민성 세포 그룹과 경로는 신경 조절인 도파민 시스템을 구성합니다.
도파민을 생성하는 신경세포(도파민을 생성하는 신경세포)는 사람의 뇌에서[40] 약 40만 개 정도로 그 수가 상대적으로 적으며, 그 세포체들은 집단적으로 소수의 비교적 작은 뇌 영역에 국한되어 있습니다.[41]하지만 그들의 축삭은 다른 많은 뇌 영역으로 투사되고, 그들의 목표물에 강력한 효과를 발휘합니다.[41]이 도파민성 세포 그룹은 1964년 아니카 달스트롬과 크젤 푹스(Kjell Fuxe)에 의해 처음으로 매핑되었으며, 그들은 "A"로 시작하는 라벨을 부여했습니다.[42]그들의 계획에서, A1부터 A7까지의 영역은 신경전달물질인 노르에피네프린을 함유하고 있는 반면, A8부터 A14까지의 영역은 도파민을 함유하고 있습니다.그들이 확인한 도파민성 영역은 실질적인 흑막(8군과 9군), 복측절개 영역(10군), 후측 시상하부(11군), 궁상핵(12군), 조나 인세르타(13군) 및 심실 주위핵(14군)입니다.[42]
흑운모는 기저 신경절의 구성 요소를 형성하는 작은 중뇌 영역입니다.여기에는 파 콤팩트라 불리는 입력 영역과 파 레티큘라타라는 출력 영역의 두 부분이 있습니다.도파민성 뉴런은 주로 파스 콤팩트카(세포군 A8)와 근처(군 A9)에서 발견됩니다.[41]인간의 경우, 도파민성 신경세포의 실질적인 흑점 콤팩트타에서 등의 선조체로의 투사는 운동 기능의 조절과 새로운 운동 기술의 학습에 중요한 역할을 합니다.[43]이 뉴런들은 특히 손상에 취약하고, 다수가 사망하면 파킨슨 증후군이 발생합니다.[44]
복측 신경절 영역(VTA)은 또 다른 중뇌 영역입니다.VTA 도파민성 뉴런의 가장 중요한 그룹은 중피질 경로를 통해 전두엽 피질로 투사하고 다른 작은 그룹은 중피질 경로를 통해 핵으로 투사합니다.이 두 경로를 합쳐서 중피질임픽 투영이라고 합니다.[41][43]VTA는 편도체, 회전자, 해마, 후각 전구에도 도파민 돌기를 보냅니다.[41][43]중피질 신경세포는 보상과 동기부여의 다른 측면에서 중심적인 역할을 합니다.[43]축적된 문헌은 도파민이 여러 뇌 영역에 미치는 영향을 통해 학습을 회피하는 데 중요한 역할을 한다는 것을 보여줍니다.[45][46][47]
시상하부 뒤쪽에는 척수로 돌출된 도파민 신경세포가 있지만 기능은 제대로 확립되어 있지 않습니다.[48]이 지역의 병리학이 신체의 일부, 특히 다리를 끊임없이 움직이게 하는 압도적인 강박관념으로 인해 잠을 자는 데 어려움을 겪는 불안정한 다리 증후군에서 역할을 한다는 증거가 있습니다.[48]
시상하부의 궁상핵과 심실주위핵은 중요한 돌기를 형성하는 도파민 뉴런을 가지고 있는데, 이것은 뇌하수체로 가는 투베로인 펀디블 경로이며, 여기서 프로락틴 호르몬 분비에 영향을 줍니다.[49]도파민은 뇌하수체 전방에서 프로락틴 분비의 주요 신경내분비 억제제입니다.[49]궁상핵의 뉴런들에 의해 생성된 도파민은 뇌하수체를 공급하는 정중각의 시상하부로 분비됩니다.[49]프로락틴을 생산하는 프로락틴 세포는 도파민이 없을 때 프로락틴을 지속적으로 분비하는데, 도파민은 이 분비를 억제합니다.[49]프로락틴 분비를 조절하는 과정에서, 도파민은 때때로 프로락틴 억제 인자, 프로락틴 억제 호르몬 또는 프로락토스타틴이라고 불립니다.[49]
궁상핵과 심실주위핵 사이에 무리를 지은 조나인각은 시상하부의 여러 부위에 투사돼 사춘기 이후 남녀 생식기 발달을 활성화하는 데 필요한 고나도트로핀 방출 호르몬 조절에 참여합니다.[49]
도파민 분비 뉴런의 추가적인 그룹은 눈의 망막에서 발견됩니다.[50]이 뉴런들은 축삭이 없다는 것을 의미하는 아마크린 세포입니다.[50]그들은 도파민을 세포외 매체로 방출하고, 특히 낮 시간에는 활동적이어서 밤에는 조용해집니다.[50]이 망막 도파민은 망막에서 원추세포의 활성을 강화하는 동시에 막대세포를 억제하는 역할을 합니다. 그 결과 밝은 빛 조건에서 빛이 어두울 때 민감도가 감소하는 대신 색과 대비에 대한 민감도가 증가합니다.[50]
기저신경절

척추동물 뇌에서 도파민의 가장 크고 중요한 공급원은 실질적인 흑막과 배측 부분입니다.[41]이들 구조는 서로 밀접하게 연관되어 있으며 많은 면에서 기능적으로 유사합니다.[41]둘 다 중뇌의 구성 요소입니다.[41]기저 신경절의 가장 큰 구성 요소는 선조체입니다.[51]흑체는 도파민성 돌기를 배쪽 선조체에 보내고, 배쪽 분절 부위는 배쪽 선조체에 유사한 유형의 도파민성 돌기를 보냅니다.[41]
기저 신경절의 기능을 이해하는 데는 진전이 더뎠습니다.[51]가장 일반적인 가설은 기저 신경절이 행동 선택에 중심적인 역할을 한다는 것을 제시합니다.[52]가장 간단한 형태의 행동선택이론은 사람이나 동물이 여러 행동이 가능한 상황에 있을 때 기저신경절의 활동이 그들 중 어떤 행동이 실행되는지를 결정한다고 제안합니다.다른 운동 시스템이 활성화되면 경쟁 행동이 발생할 수 있는 다른 운동 시스템을 계속 억제하면서 억제에 의한 반응을 방출하는 것입니다.[53]따라서 이 개념에서 기저 신경절은 행동을 시작하는 데 책임이 있지만 행동을 수행하는 방법의 세부 사항을 결정하는 데는 책임이 없습니다.즉, 그들은 본질적으로 의사결정 체계를 형성합니다.[53]
기저 신경절은 여러 부문으로 나눌 수 있으며, 각각은 특정 유형의 행동을 통제하는 데 관여합니다.[54]기저 신경절(ventral striatum 및 ventral tegmental area 포함)의 복측 영역은 전체 유기체 수준에서 동작을 선택하여 계층 구조의 가장 높은 수준에서 작동합니다.[53]등쪽 부분(등쪽 줄무늬와 실질 니그라를 포함)은 더 낮은 수준에서 작동하며, 주어진 행동 패턴을 구현하는 데 사용되는 특정 근육과 움직임을 선택합니다.[54]
도파민은 적어도 두 가지 중요한 방법으로 행동 선택 과정에 기여합니다.첫째, 작업을 시작하기 위한 "임계값"을 설정합니다.[52]도파민 활성 수준이 높을수록 주어진 행동을 유발하는 데 필요한 자극이 줄어듭니다.[52]결과적으로, 높은 수준의 도파민은 높은 수준의 운동 활동과 충동적인 행동으로 이어집니다; 낮은 수준의 도파민은 피로와 느린 반응으로 이어집니다.[52]실질적인 흑요석 회로의 도파민 수치가 크게 감소하는 파킨슨병은 뻣뻣하고 운동을 시작하기 어려운 특징이 있지만, 이 질환을 앓고 있는 사람들이 심각한 위협과 같은 강한 자극에 직면했을 때 건강한 사람만큼 반응이 왕성할 수 있습니다.[55]반대 방향으로, 코카인이나 암페타민과 같은 도파민 방출을 증가시키는 약물은 극도로 심동적인 동요와 정형화된 움직임을 포함하여 높은 수준의 활동을 일으킬 수 있습니다.[56]
도파민의 두 번째 중요한 효과는 "가르침" 신호입니다.[52]도파민 활성의 증가에 따라 어떤 작용이 뒤따를 때, 기저 신경절 회로는 미래에 비슷한 상황이 발생할 때 같은 반응을 더 쉽게 환기시키는 방식으로 변경됩니다.[52]이것은 도파민이 보상 신호의 역할을 하는 작동 조건의 한 형태입니다.[53]
보상

보상 체계를 논의하는 데 사용되는 언어에서 보상은 식욕 행동(접근 행동이라고도 함)[57]과 소모 행동을 유도하는 자극의 매력적이고 동기적인 속성입니다.보상적인 자극은 유기체가 그것에 접근하고 그것을 소비하도록 선택하도록 유도할 수 있는 자극입니다.[57]즐거움, 학습(예: 고전 및 작동 조건), 접근 행동은 보상의 세 가지 주요 기능입니다.[57]보상의 한 측면으로서, 즐거움은 보상의 정의를 제공하지만,[57] 모든 즐거운 자극은 보상이지만, 모든 보상 자극이 즐거운 것은 아닙니다(예를 들어, 돈과 같은 외재적 보상).[57][58]보상적 자극의 동기적 또는 바람직한 측면은 그들이 유도하는 접근 행동에 의해 반영되는 반면, 내재적 보상으로부터의 즐거움은 그것을 획득한 후에 그것을 소비하는 것으로부터 발생합니다.[57]본질적으로 보상적인 자극의 이 두 가지 요소를 구분하는 신경심리학적 모델은 인센티브 현저성 모델인데, 여기서 "원함" 또는 "욕망"(덜 일반적으로 "추구")[59]은 식욕 또는 접근 행동에 해당하고 "좋아함" 또는 즐거움은 소비 행동에 해당합니다.[57][6][60]인간의 약물중독에서 '원함'은 중독성 있는 약물을 사용하려는 욕구가 증가하면 '좋아요'와 해리되는 반면, 이를 섭취함으로써 얻는 즐거움은 약물에 대한 내성으로 인해 감소합니다.[6]
뇌 안에서 도파민은 부분적으로 전세계적인 보상 신호의 기능을 합니다.보상적 자극에 대한 초기 도파민 반응은 보상의 현저성, 가치 및 맥락에 대한 정보를 암호화합니다.[57]보상 관련 학습의 맥락에서 도파민은 보상 예측 오류 신호, 즉 보상의 가치가 예상치 못한 정도로 기능하기도 합니다.[57]Montague, Dayan, and Sejnowski에 의해 제안된 이 가설에 따르면,[61] 기대되는 보상은 특정 도파민성 세포에서 두 번째 단계의 도파민 반응을 일으키지 않지만, 예상치 못했거나 예상보다 큰 보상은 시냅스 도파민의 짧은 지속적인 증가를 야기합니다.반면에 기대되는 보상의 누락은 실제로 도파민 방출을 배경 수준 이하로 떨어지게 합니다.[57]시간차 학습으로 알려진 영향력 있는 컴퓨터 학습 방법이 예측 오차를 부호화하는 신호를 많이 사용하기 때문에 "예측 오차" 가설은 컴퓨터 신경 과학자들의 특별한 관심을 끌어왔습니다.[57]이러한 이론과 데이터의 융합은 신경과학자와 기계 학습에 관심이 있는 컴퓨터 과학자들 사이의 비옥한 상호작용을 이끌어냈습니다.[57]
동물의 뇌에서 나온 미세 전극 기록의 증거는 복측 신경절 영역(VTA)의 도파민 뉴런과 실질적인 니그라가 다양한 보상적인 사건에 의해 강하게 활성화된다는 것을 보여줍니다.[57]VTA에서 이러한 보상반응 도파민 뉴런과 실질적인 니그라는 보상 관련 인지에 중요하며 보상 시스템의 핵심 요소입니다.[6][62][63]도파민의 기능은 VTA와 실질적인 니그라의 축삭 투영에서 다양합니다.[6] 예를 들어, VTA-핵 축삭 투영은 보상하는 자극과 그와 관련된 단서에 인센티브 현저성("원함")을 할당하고, VTA-전전두피질 투영은 인센티브 현저성에 따라 다른 목표의 값을 업데이트합니다., VTA-편도체 및 VTA-히포캠푸스 투영은 보상 관련 기억의 통합을 매개하며, VTA-핵 축적 코어 및 실질적인 흑요석-도막 선조체 경로 모두 보상 자극의 획득을 촉진하는 운동 반응 학습에 관여합니다.[6][64]VTA 도파민 예측 내의 일부 활동은 보상 예측과도 관련이 있는 것으로 보입니다.[6][64]
내 기쁨이지.
도파민은 보상 받는 자극에 대한 식욕 또는 접근 행동 반응과 관련된 "원함"을 유발하는 중심적인 역할을 하지만, 세부적인 연구들은 도파민이 단순히 쾌락적인 "좋아요"[58] 또는 쾌락과 동일시 될 수 없다는 것을 보여주었습니다.도파민 신경 전달은 쾌락 중심이 도파민 시스템(즉, 핵 침적 껍질)과 도파민 시스템 외부(즉, 복강 및 부완골 핵)에서 확인되었기 때문에 쾌락과 관련된 인지의 모든 측면에서 관여하지 않습니다.[58][60][65]예를 들어, 뇌에 심어진 전극을 이용한 도파민 경로의 직접적인 전기 자극은 즐거움으로 경험되고, 많은 종류의 동물들은 기꺼이 그것을 얻기 위해 노력합니다.[66]항정신병 약물은 도파민 수치를 감소시키고 쾌락을 경험하는 능력의 감소인 무장애를 유발하는 경향이 있습니다.[67]성관계, 식사, 비디오 게임과 같은 많은 종류의 즐거운 경험은 도파민 분비를 증가시킵니다.[68]모든 중독성 약물은 핵의 도파민 신경 전달에 직접적 또는 간접적으로 영향을 미치며,[6][66] 이 약물들은 약물 "원만"을 증가시켜, 반복적으로 고용량으로 복용할 경우, 아마도 인센티브-특이성의 감작을 통해 강박적 약물 사용으로 이어집니다.[60]시냅스 도파민 농도를 높이는 약물로는 필로폰이나 코카인 같은 정신자극제가 있습니다.이러한 결과는 "원하는" 행동을 증가시키지만, 기쁨의 표현을 크게 변화시키거나 만족도를 변화시키지는 않습니다.[60][66]그러나 헤로인과 모르핀과 같은 아편계 약물은 "좋아요"와 "원하는" 행동의 표현이 증가합니다.[60]게다가, 복막 도파민 시스템이 비활성화된 동물들은 음식을 찾지 않고, 스스로 내버려두면 굶어 죽지만, 음식을 입에 넣으면 그것을 소비하고 즐거움을 나타내는 표현을 보여줍니다.[69]
음악에 대한 보상 반응에 대한 도파민 전구체(레보도파), 도파민 길항제(리스페리돈), 위약의 효과를 평가한 2019년 1월의 임상 연구에 따르면, 전극피 활동의 변화뿐만 아니라 주관적인 평가로 측정된 음악적 오한 동안 경험한 즐거움의 정도를 포함하여, 조작자가 음악에 대한 보상 반응에 미치는 영향을 확인했습니다.도파민 신경전달의 온은 인간의 피험자들에서 쾌락인지(specif적으로 음악의 쾌락적 영향)를 양방향으로 조절합니다.이 연구는 도파민 신경 전달의 증가가 인간의 음악에 대한 즐거운 헤도닉 반응을 위한 사인 콰 조건으로 작용한다는 것을 증명했습니다.[70][71]
1998년 네이처에 발표된 한 연구는 비디오 게임을 하는 것이 인간의 선조체에 있는 도파민을 방출한다는 증거를 발견했습니다.이 도파민은 학습, 행동 강화, 주의 집중 및 감각 운동 통합과 관련이 있습니다.[72]연구원들은 양전자 방출 단층 촬영 스캔과 11C 라벨이 부착된 라클롭라이드를 사용하여 목표 지향 운동 과제 동안 뇌의 도파민 수준을 추적했고 도파민 방출이 과제 수행과 긍정적인 상관관계가 있으며 복측 선조체에서 가장 크다는 것을 발견했습니다.이것은 도파민이 인간에게서 방출되는 행동 조건을 보여준 최초의 연구였습니다.행동 변화 중에 신경전달물질의 흐름을 감지하는 양전자 방출 단층촬영의 능력을 강조합니다.연구에 따르면 잠재적으로 문제가 될 수 있는 비디오 게임 사용은 낮은 자존감과 낮은 자기 효능감, 불안, 공격성, 우울증과 불안 장애의 임상 증상과 같은 성격적 특성과 관련이 있다고 합니다.[73]또한 개인이 비디오 게임을 하는 이유는 대처, 사회화, 개인적 만족 등 다양합니다.DSM-5는 인터넷게임장애를 도박장애와 밀접한 관련이 있는 정신장애로 정의하고 있습니다.이는 일부 연구자들에 의해 지지를 받기도 했지만 논란을 불러일으키기도 했습니다.
중추신경계 바깥쪽에서
도파민은 혈액-뇌 장벽을 넘지 않기 때문에, 그것의 합성과 주변 영역에서의 기능은 그것의 합성과 뇌에서의 기능에 크게 독립적입니다.[27]상당한 양의 도파민이 혈류를 따라 순환하지만, 그 기능은 완전히 명확하지 않습니다.[28]도파민은 에피네프린과 비슷한 수준의 혈장에서 발견되지만, 인간의 경우 혈장 내 도파민의 95% 이상이 유리 도파민에 작용하는 효소인 설포전달효소 1A3/1A4에 의해 생성되는 결합체인 설페이트(dopamine sulfate) 형태입니다.[28]이 황산 도파민의 대부분은 장간막에서 생성됩니다.[28]일반적으로 음식물로 섭취되거나 소화 과정에 의해 생성되는 도파민을 해독하는 메커니즘으로 도파민 황산염의 생성이 알려져 있는데, 일반적으로 식사 후 혈장 내 수치가 50배 이상 증가합니다.[28]황산 도파민은 알려진 생물학적 기능이 없고 소변으로 배출됩니다.[28]
혈류에서 비교적 적은 양의 비결합 도파민은 교감 신경계, 소화계, 또는 가능하면 다른 장기에 의해 생성될 수 있습니다.[28]그것은 말초 조직의 도파민 수용체에 작용하거나, 대사되거나, 부신수질에 의해 혈류로 방출되는 도파민 베타 하이드록실화효소에 의해 노르에피네프린으로 전환될 수 있습니다.[28]일부 도파민 수용체는 동맥 벽에 위치하며, 혈관 확장제 및 신경 접합 후 교감 신경 말단에서 노르에피네프린 방출 억제제 역할을 합니다(도파민은 시냅스 전 도파민 수용체 및 노르에피네프린 자체와 같은 시냅스 전 α-1 수용체에 작용하여 노르에피네프린 방출을 억제할 수 있습니다).[74]이러한 반응은 저산소 상태에서 경동맥에서 방출되는 도파민에 의해 활성화 될 수 있지만 동맥 도파민 수용체가 다른 생물학적으로 유용한 기능을 수행하는지는 알려지지 않았습니다.[74]
혈류를 조절하는 역할 외에도 도파민이 제한된 영역 내에서 순환하며 외분비 또는 파라크린 기능을 수행하는 여러 말초 시스템이 있습니다.[28]도파민이 중요한 역할을 하는 말초 체계에는 면역 체계, 신장, 췌장 등이 포함됩니다.
면역계
면역체계에서 도파민은 면역세포, 특히 림프구에 존재하는 수용체에 작용합니다.[75]도파민은 비장, 골수, 순환계의 면역세포에도 영향을 미칠 수 있습니다.[76]게다가, 도파민은 면역 세포에 의해 합성되고 방출될 수 있습니다.[75]림프구에 대한 도파민의 주된 효과는 활성화 수준을 낮추는 것입니다.이 시스템의 기능적 중요성은 명확하지 않지만, 신경계와 면역계 사이의 상호작용을 위한 가능한 경로를 제공하며, 일부 자가 면역 질환과 관련이 있을 수 있습니다.[76]
신장
신장 도파민 시스템은 모든 아형의 도파민 수용체가 존재하는 신장의 네프론 세포에 위치합니다.[77]도파민 또한 그곳에서 세뇨관 세포에 의해 합성되어 세뇨관 유체로 배출됩니다.그것의 작용은 신장으로의 혈액 공급을 증가시키고, 사구체 여과율을 증가시키고, 소변에서 나트륨의 배설을 증가시키는 것을 포함합니다.따라서 신장 도파민 기능의 결함은 나트륨 배설을 감소시키고 결과적으로 고혈압을 발생시킬 수 있습니다.도파민 생성이나 수용체의 결함이 산화 스트레스, 부종, 그리고 유전적 또는 본질적 고혈압을 포함한 많은 병태를 초래할 수 있다는 강력한 증거가 있습니다.산화 스트레스는 그 자체로 고혈압을 유발할 수 있습니다.[78]시스템의 결함은 유전적 요인이나 고혈압에 의해서도 발생할 수 있습니다.[79]
췌장
췌장에서 도파민의 역할은 다소 복잡합니다.췌장은 외분비와 내분비 두 부분으로 구성되어 있습니다.외분비 부분은 소화효소와 도파민을 포함한 다른 물질들을 합성하여 소장으로 분비합니다.[80]소장에 들어간 후 분비되는 이 도파민의 기능은 명확하게 확립되어 있지 않습니다. 손상으로부터 장점막을 보호하고 위장관 운동성(내용물이 소화기관을 통해 이동하는 속도)을 감소시키는 것을 포함할 수 있습니다.[80]
췌장섬은 췌장의 내분비 부분을 구성하고 인슐린을 포함한 호르몬을 혈류로 합성하고 분비합니다.[80]인슐린을 합성하는 섬의 베타 세포가 도파민 수용체를 포함하고 있고, 도파민이 분비되는 인슐린의 양을 줄이는 역할을 한다는 증거가 있습니다.[80]그들의 도파민 입력의 근원은 명확하게 확립되어 있지 않습니다. 혈류에서 순환하는 도파민에서 비롯될 수 있고 교감 신경계에서 비롯될 수도 있고 다른 종류의 췌장 세포에 의해 국소적으로 합성될 수도 있습니다.[80]
의료용

도파민은 제조 의약품으로 Intropin, Dopastat, Revimine 등의 상표명으로 판매되고 있습니다.그것은 세계보건기구의 필수 의약품 목록에 올라있습니다.[81]심한 저혈압, 느린 심장박동, 심정지 등의 치료에 각성제로 가장 많이 사용됩니다.이것은 신생아들에게서 이러한 것들을 치료하는데 특히 중요합니다.[82][14]정맥 주사로 투여합니다.혈장 중 도파민의 반감기는 성인의 경우 약 1분, 신생아의 경우 2분, 조기아의 경우 최대 5분으로 매우 짧기 때문에 보통 한 번의 주사가 아닌 지속적인 정맥 주사로 투여됩니다.[83]
용량에 따라 신장에 의한 나트륨 배설의 증가, 소변 배출의 증가, 심박수의 증가, 혈압의 증가 등이 있습니다.[83]낮은 용량에서는 교감 신경계를 통해 작용하여 심장 근육 수축력과 심박수를 증가시켜 심박출량과 혈압을 증가시킵니다.[84]고용량은 혈관 수축을 일으켜 혈압을 더욱 상승시킵니다.[84][85]오래된 문헌은 또한 다른 결과 없이 신장 기능을 향상시키는 것으로 생각되는 매우 낮은 용량에 대해서도 설명하고 있지만, 최근의 리뷰는 그러한 낮은 수준의 용량은 효과적이지 않으며 때로는 해로울 수도 있다는 결론을 내렸습니다.[86]일부 효과는 도파민 수용체의 자극에 의해 발생하지만 두드러진 심혈관 효과는 α1,β1,β2 아드레날린 수용체에서 작용하는 도파민에 의해 발생합니다.[87][88]
도파민의 부작용으로는 신장 기능과 불규칙한 심장 박동에 대한 부정적인 영향이 있습니다.[84]모집단의 50%에서 치명적일 것으로 예상되는 LD50 또는 치사량은 59mg/kg (마우스; 정맥내 투여), 95mg/kg (마우스; 복강내 투여), 163mg/kg (쥐; 복강내 투여), 79mg/kg (개; 정맥내 투여)로 확인되었습니다.[89]
질병, 장애, 약리학
도파민 시스템은 파킨슨병, 주의력 결핍 과잉 행동 장애, 투렛 증후군, 조현병, 조울증, 그리고 중독을 포함한 몇몇 중요한 의학적 상황에서 중심적인 역할을 합니다.도파민 자체 외에도, 뇌나 신체의 여러 부분에 있는 도파민 시스템에 작용하는 많은 다른 중요한 약물들이 있습니다.일부는 의학적 또는 오락적 목적으로 사용되지만 신경화학자들은 또한 다양한 연구 약물을 개발했습니다. 그 중 일부는 특정 유형의 도파민 수용체에 높은 친화력으로 결합하고 그 효과를 고뇌시키거나 길항시키고, 도파민 수송 억제제, V를 [90]포함한 도파민 생리학의 다른 측면에 영향을 미치는 많은 약물들입니다.MAT 억제제, 효소 억제제.
뇌노화
많은 연구들이 도파민 합성과 뇌의 도파민 수용체 밀도(즉, 수용체의 수)의 나이와 관련된 감소를 보고했습니다.[91]이 감소는 선조체와 외배부에서 일어나는 것으로 나타났습니다.[92]D1, D2, D3 수용체의 감소는 잘 기록되어 있습니다.[93][94][95]노화에 따른 도파민의 감소는 팔의 흔들림 감소, 경직 증가와 같이 나이가 들수록 빈도가 증가하는 많은 신경학적 증상의 원인으로 생각됩니다.[96]도파민 수준의 변화는 인지적 유연성에 나이와 관련된 변화를 일으킬 수도 있습니다.[96]
세로토닌과 글루타메이트와 같은 다른 신경 전달 물질들도 노화에 따라 생산량이 감소하는 것을 보여줍니다.[95][97]
다발성 경화증
여러 연구에서 도파민 불균형이 다발성 경화증의 피로에 영향을 준다고 보고했습니다.[98]다발성 경화증 환자에서 도파민은 말초혈액 단핵세포에 의한 IL-17 및 IFN- γ의 생성을 억제합니다.
파킨슨병
파킨슨병은 사용하지 않을 때 몸이 경직되고 움직임이 느려지며 팔다리가 떨리는 등의 움직임 장애가 특징인 나이와 관련된 질환입니다.[55]진행 단계에서는 치매로 진행되어 결국 사망에 이릅니다.[55]주요 증상은 흑요석에서 도파민을 분비하는 세포가 소실됨으로써 발생합니다.[100]이러한 도파민 세포는 특히 손상에 취약하며, 뇌염(책과 영화 "Awakening"에 묘사된 바와 같이), 반복적인 스포츠 관련 뇌진탕, MPTP와 같은 일부 형태의 화학 중독을 포함한 다양한 모욕은 상당한 세포 손실을 초래할 수 있습니다.파킨슨병과 유사한 파킨슨 증후군을 일으키는 것입니다.[101]그러나 파킨슨병의 대부분의 경우는 특발성으로, 세포사멸의 원인을 밝혀낼 수 없다는 것을 의미합니다.[101]
파킨슨병에 가장 널리 사용되는 치료법은 도파민의 대사 전구물질인 L-DOPA의 투여입니다.[27]L-DOPA는 DOPA 탈카복실화효소에 의해 뇌와 신체의 여러 부분에서 도파민으로 전환됩니다.[26]L-DOPA는 도파민과 달리 혈액 뇌 장벽을 넘을 수 있기 때문에 도파민 자체보다는 사용됩니다.[27]종종 카비도파나 벤세라자이드와 같은 말초 탈카복실화의 효소 억제제와 병용 투여하여, 주변부의 도파민으로 전환되는 양을 감소시켜 뇌로 유입되는 L-DOPA의 양을 증가시킵니다.[27]L-DOPA를 장기간에 걸쳐 정기적으로 투여할 경우, 종종 여러 가지 불쾌한 부작용들이 나타나기 시작하지만, 그렇더라도 파킨슨병의 대부분의 경우에 가장 좋은 장기 치료 방법으로 여겨집니다.[27]
L-DOPA 치료는 손실된 도파민 세포를 회복시킬 수 없지만, 남아있는 세포가 더 많은 도파민을 생성하게 하여 최소한 어느 정도 손실을 보상합니다.[27]진행 단계에서 세포 손실이 너무 심해서 L-DOPA 수치와 상관없이 남아있는 세포들이 충분한 도파민을 생성할 수 없기 때문에 치료는 실패하기 시작합니다.[27]브로모크립틴과 퍼골라이드와 같은 도파민 기능을 강화하는 다른 약물들도 파킨슨병 치료에 사용되기도 하지만 대부분의 경우 L-DOPA는 긍정적인 효과와 부정적인 부작용 사이에서 최상의 균형을 이루는 것으로 보입니다.[27]
도파민 조절 장애 증후군은 파킨슨병 치료에 사용되는 도파민성 약물의 과다 사용과 도박 및 성행위와 같은 자연적 보상에 약물에 의한 강박적 참여를 수반하는 경우가 있습니다.[102][103]후자의 행동은 행동 중독을 가진 사람들에게서 관찰되는 것과 비슷합니다.[102]
약물중독과 정신자극제

코카인, 치환 암페타민(필로폰 포함), 애더럴, 메틸페니데이트(리탈린 또는 콘세르타로 판매됨), 그리고 다른 정신 자극제들은 주로 또는 부분적으로 다양한 메커니즘에 의해 뇌의 도파민 수준을 증가시킴으로써 그 효과를 발휘합니다.[104]코카인과 메틸페니데이트는 도파민 수송 차단제 또는 재흡수 억제제입니다.[105] 이들은 경쟁적으로 도파민 재흡수를 억제하여 시냅스 분열에서 도파민 농도를 증가시킵니다.[106][107]: 54–58 코카인과 마찬가지로, 치환된 암페타민과 암페타민 또한 시냅스의 분열에서 도파민의 농도를 증가시키지만, 다른 메커니즘에 의해 증가시킵니다.[36][107]: 147–150
정신 자극제의 효과는 심박수, 체온, 땀의 증가, 경계심, 주의력, 지구력의 향상, 보람 있는 일들에 의해 생성되는 즐거움의 증가를 포함합니다; 그러나 고용량의 경우에는 동요, 불안, 심지어 현실과의 접촉 상실을 포함합니다.[104]이 그룹의 약물은 뇌의 도파민 매개 보상 체계에 대한 활성화 효과 때문에 높은 중독 가능성을 가질 수 있습니다.[104]그러나 일부는 주의력결핍 과잉행동장애(ADHD)와 기면증 치료에도 낮은 용량으로 유용할 수 있습니다.[108][109]중요한 차별화 요소는 행동의 시작과 지속 기간입니다.[104]코카인은 자유염기 형태로 주입되거나 흡입되면 몇 초 안에 효과를 볼 수 있습니다; 효과는 5분에서 90분까지 지속됩니다.[110]이 빠르고 짧은 행동은 효과를 쉽게 인지하게 하고 결과적으로 높은 중독 가능성을 줍니다.[104]대조적으로, 알약 형태로 섭취된 메틸페니데이트는 혈류의 최고치에 도달하는 데 2시간이 걸릴 수 있으며,[108] 제형에 따라 그 효과는 최대 12시간까지 지속될 수 있습니다.[111]이렇게 장기간 작용하는 제형은 남용 가능성을 줄이고, 보다 편리한 투약 방식을 사용함으로써 치료에 대한 순응도를 향상시킬 수 있는 이점이 있습니다.[112]

다양한 중독성 약물은 보상과 관련된 도파민 활동을 증가시킵니다.[104]니코틴, 코카인 그리고 필로폰과 같은 자극제들은 중독을 일으키는 주요한 요인으로 보이는 도파민의 수치를 증가시키도록 촉진합니다.오피오이드 헤로인과 같은 다른 중독성 약물의 경우, 보상 체계에서 증가된 도파민 수준은 중독에서 미미한 역할만 할 수 있습니다.[113]자극제에 중독된 사람들이 금단현상을 겪을 때, 그들은 알코올 금단현상이나 아편제에 대한 금단현상과 관련된 육체적 고통을 경험하지 않습니다; 대신, 그들은 심리적 의존에 [114]의해 야기되는 짜증, 불안, 그리고 다른 각성 증상들을 특징으로 하는 약물에 대한 강한 갈망을 경험합니다.
도파민 시스템은 중독의 여러 측면에서 중요한 역할을 합니다.초기 단계에서, 뇌의 도파민 수용체의 표현을 바꾸는 유전적 차이는 자극제가 매력적인지 아니면 혐오적인지를 예측할 수 있습니다.[115]자극제의 섭취는 몇 분에서 몇 시간 동안 지속되는 뇌 도파민 수준을 증가시킵니다.[104]마지막으로, 반복적인 고용량 자극제 섭취와 함께 오는 도파민의 만성적인 상승은 중독을 특징짓는 행동적 이상에 책임이 있는 뇌의 광범위한 구조적 변화를 유발합니다.[116]자극제 중독의 치료는 매우 어렵습니다. 소비가 중단되더라도 심리적인 위축과 함께 오는 갈망은 그렇지 않기 때문입니다.[114]갈망이 멸종된 것처럼 보일 때도, 친구, 장소, 상황과 같이 약물과 관련된 자극에 직면했을 때 다시 나타날 수 있습니다.[114]뇌의 연결망은 크게 상호 연결되어 있습니다.[117]
정신병과 항정신병약
1950년대 초 정신과 의사들은 전형적인 항정신병 약물로 알려진 약물 종류가 종종 조현병의 정신병적 증상을 줄이는 데 효과적이라는 것을 발견했습니다.[118]1950년대에 널리 사용된 최초의 항정신병 약물인 클로로프로마진(Thorazine)의 도입은 그 후 몇 년 동안 기관에서 많은 조현병 환자들이 방출되도록 이끌었습니다.[118]1970년대까지 연구자들은 이러한 전형적인 항정신병약이 D2 수용체에 길항제로서 작용한다는 것을 이해했습니다.[118][119]이 깨달음은 조현병의 소위 도파민 가설로 이어졌는데, 조현병은 주로 뇌 도파민 시스템의 과잉 활동에 의해 발생한다고 가정합니다.[120]도파민 가설은 필로폰과 같은 도파민 강화 자극제에 의해 정신병적 증상이 강화되는 경우가 많고, 이 약물들도 충분히 많은 용량을 복용할 경우 건강한 사람들에게 정신병을 일으킬 수 있다는 관찰에서 추가적인 지지를 이끌어 냈습니다.[120]이후 수십 년 동안 심각한 부작용이 적은 다른 비정형 항정신병 약물들이 개발되었습니다.[118]이러한 새로운 약들 중 많은 것들이 도파민 수용체에 직접적으로 작용하지 않고, 간접적으로 도파민 활성의 변화를 만들어냅니다.[121]이 약들은 다른 정신병 치료에도 사용되었습니다.[118]항정신병 약물은 대부분의 적극적인 행동 유형에 광범위한 억제 효과를 가지며, 특히 명백한 정신병의 망상과 동요된 행동 특성을 감소시킵니다.[119]
그러나 이후 관찰된 것들은 도파민 가설이 적어도 단순한 원래 형태로는 인기를 잃게 만들었습니다.[120]한 가지 예로, 조현병 환자들은 일반적으로 뇌 도파민 활동의 수치가 측정할 정도로 증가하지 않습니다.[120]그럼에도 불구하고, 많은 정신과 의사들과 신경과학자들은 정신분열증이 일종의 도파민 시스템의 기능 장애를 포함한다고 계속해서 믿고 있습니다.[118]그러나 시간이 지남에 따라 "도파민 가설"이 진화함에 따라, 그것이 가정하는 역기능의 종류는 점점 더 교묘해지고 복잡해지는 경향이 있습니다.[118]
정신약리학자 스티븐 M. Stahl은 2018년 리뷰에서 조현병을 포함한 많은 정신병 사례에서 도파민, 세로토닌, 글루타메이트에 기반을 둔 세 개의 상호 연결된 네트워크가 각각 자체적으로 또는 다양한 조합으로 복측 선조체에서 도파민 D2 수용체의 과발현에 기여했다고 제안했습니다.[122]
주의력결핍과잉행동장애
변화된 도파민 신경전달은 주의력결핍 과잉행동장애(ADHD)와 관련이 있으며, 이는 다시 주의력을 조절하는 문제(주의력 조절), 행동을 억제하는 문제(억제력 조절), 무언가를 잊거나 누락된 세부사항(작업 기억)로 이어집니다.여러 가지 문제 [123]중에도파민 수용체, 도파민 전달체, ADHD 사이에는 다른 신경전달물질 수용체와 전달체와의 연결 외에도 유전적 연결이 있습니다.[124]도파민과 ADHD 사이의 가장 중요한 관계는 ADHD를 치료하는 데 사용되는 약물과 관련이 있습니다.[125]ADHD에 가장 효과적인 치료제 중 일부는 뇌의 도파민과 노르에피네프린 수치를 모두 증가시키는 약물인 메틸페니데이트(리탈린, 콘체르타)와 암페타민(에베케오, 애더럴, 덱세드린)과 같은 정신 자극제입니다.[125]ADHD를 치료하는 데 있어 이러한 정신 자극제의 임상적 효과는 전전두엽 피질에서 도파민과 노르에피네프린 수용체, 특히 도파민 수용체1 D와 아드레노 수용체2 α의 간접적인 활성화를 통해 매개됩니다.[123][126][127]
통증
도파민은 척수, 경막하회색, 시상, 기저신경절, 그리고 회상피질을 포함한 중추신경계의 여러 단계에서 통증을 처리하는 역할을 합니다.[128]도파민의 수치 감소는 파킨슨병에서 자주 발생하는 고통스러운 증상과 관련이 있습니다.[128]도파민성 신경 전달의 이상은 입이 타는 증후군, 섬유근육통, 다리가 안절부절 못하는 증후군을 포함한 여러 고통스러운 임상 상황에서도 발생합니다.[128]
메스꺼움
메스꺼움과 구토는 주로 화학수용체 유발 영역으로 알려진 영역에서 뇌간수막의 잔존 후의 활동에 의해 결정됩니다.[129]이 지역은 많은 수의 D2형 도파민 수용체를 포함하고 있습니다.[129]따라서 D2 수용체를 활성화하는 약물은 메스꺼움을 유발할 가능성이 높습니다.[129]이 그룹은 아포모르핀과 같은 다른 도파민 작용제뿐만 아니라 파킨슨병을 위해 투여되는 일부 약물을 포함합니다.[130]메토클로프라미드와 같은 D2 수용체 길항제는 일부 경우에 항마취제로서 유용합니다.[129]
비교생물학과 진화
미생물
고균에서 도파민에 대한 보고는 없지만, 일부 박테리아 유형과 테트라히메나라고 불리는 원생동물에서 발견되었습니다.[131]아마도 더 중요한 것은 동물들이 도파민을 합성하는데 사용하는 모든 효소들의 상동을 포함하는 박테리아의 종류가 있다는 것입니다.[132]동물들이 박테리아로부터 도파민 합성 메커니즘을 유도했다고 제안되어 왔는데, 아마도 미토콘드리아를 탄생시킨 진핵세포에 박테리아가 공생적으로 포함된 결과로 진화의 시기에 비교적 늦게 발생했을 수도 있는 수평적 유전자 전달을 통해서입니다.[132]
애니멀스
도파민은 대부분의 다세포 동물에서 신경전달물질로 사용됩니다.[133]해면동물의 경우 도파민의 존재에 대한 보고는 단 한 건뿐이며 기능에 대한 표시는 없습니다.[134] 하지만 도파민은 시니다리안 해파리, 히드라 및 일부 산호를 포함한 방사상으로 대칭되는 많은 종의 신경계에서 보고되었습니다.[135]이것은 신경전달물질로서의 도파민의 출현을 캄브리아기 5억년 전 신경계의 가장 초기 모습으로 거슬러 올라갑니다.도파민은 척추동물, 극피동물, 절지동물, 연체동물 및 여러 종류의 벌레에서 신경전달물질로 기능합니다.[136][137]
조사된 모든 종류의 동물에서 도파민은 운동 행동을 변화시키는 것으로 보여졌습니다.[133]모델 생물인 선충류(선충류)에서는 이동을 줄이고 먹이를 탐색하는 움직임을 늘립니다. 편충류에서는 "나사와 같은" 움직임을 보이고 거머리에서는 헤엄치는 것을 억제하고 기어 다니는 것을 촉진합니다.다양한 척추동물에 걸쳐 도파민은 포유류에서의 효과와 비슷한 행동 전환과 반응 선택에 "활성화" 효과를 가집니다.[133][138]
도파민은 또한 모든 동물 집단에서 보상 학습에 지속적인 역할을 하는 것으로 나타났습니다.[133]모든 척추동물과 마찬가지로 회충, 편충, 연체동물 및 일반 초파리와 같은 무척추동물은 도파민 수준이 지속적으로 증가할 경우 행동을 반복하도록 훈련 받을 수 있습니다.[133]초파리에서 보상 학습을 위한 개별적인 요소들은 포유류와 대체로 유사한 곤충 보상 처리 시스템에 모듈 구조를 제안합니다.[139]예를 들어, 도파민은 원숭이의 장단기 학습을 조절합니다;[140] 초파리에서는, 도파민 뉴런의 다른 그룹이 장단기 기억에 대한 보상 신호를 매개합니다.[141]
오랫동안 절지동물은 예외였고 도파민이 나쁜 영향을 미치는 것으로 여겨져 왔습니다.보상은 노르에피네프린과 밀접한 관련이 있는 신경전달물질인 옥토파민에 의해 대신 매개되는 것으로 보였습니다.[142]그러나 최근의 연구들은 초파리에서 도파민이 보상 학습에 역할을 한다는 것을 보여주었습니다.옥토파민의 보상적인 효과는 연구에서 이전에 접근하지 않았던 도파민성 뉴런 세트를 활성화하기 때문이라는 것도 밝혀졌습니다.[142]
식물

다양한 식용 식물을 포함한 많은 식물들이 다양한 정도로 도파민을 합성합니다.[143]바나나에서 가장 높은 농도가 관찰되었습니다. 빨간색과 노란색 바나나의 과일 과육에는 도파민이 중량 기준으로 40에서 50 ppm까지 포함되어 있습니다.[143]감자, 아보카도, 브로콜리, 그리고 브뤼셀 새싹은 또한 도파민을 백만분의 1 또는 그 이상의 수준으로 함유하고 있을지도 모릅니다. 오렌지, 토마토, 시금치, 콩, 그리고 다른 식물들은 측정 가능한 농도가 백만분의 1 미만입니다.[143]식물의 도파민은 동물이 사용하는 것과 유사한 생화학적 메커니즘에 의해 아미노산 티로신으로부터 합성됩니다.[143]멜라닌과 다양한 알칼로이드를 부산물로 생성하면서 다양한 방법으로 대사될 수 있습니다.[143]식물성 카테콜아민의 기능은 명확하게 정립되지 않았지만 세균 감염과 같은 스트레스 요인에 대한 반응에 역할을 하고, 어떤 상황에서는 성장 촉진 인자로 작용하며, 당이 대사되는 방식을 변형시킨다는 증거가 있습니다.이러한 작용을 매개하는 수용체는 아직 밝혀지지 않았고, 그들이 활성화하는 세포내 메커니즘도 가지고 있지 않습니다.[143]
음식에 섭취된 도파민은 혈액 뇌 장벽을 넘을 수 없기 때문에 뇌에 작용할 수 없습니다.[27]하지만 도파민의 대사 전구물질인 L-DOPA를 함유한 식물도 다양합니다.[144]무쿠나속 식물의 잎과 콩깍지, 특히 L-DOPA의 원료로 사용되어 온 무쿠나 프루리엔스(자두콩)에서 가장 높은 농도가 발견됩니다.[145]L-DOPA를 상당량 함유하고 있는 또 다른 식물은 파바 콩("광대 콩"이라고도 함)을 생산하는 식물인 비키아 파바(Vicia faba는그러나 콩의 L-DOPA 수준은 꼬투리 껍질이나 식물의 다른 부분보다 훨씬 낮습니다.[146]카시아 나무와 바우히니아 나무의 씨앗에도 상당한 양의 L-DOPA가 포함되어 있습니다.[144]
일부 녹조류의 주요 구성 요소인 해양 녹조 울바리아 옵스쿠라 종에서 도파민은 건조 중량의 4.4%로 추정되는 매우 높은 농도로 존재합니다.이 도파민이 달팽이와 등각류의 소비를 줄이면서 항식동물 방어 기능을 한다는 증거가 있습니다.[147]
멜라닌의 전구물질로서
멜라닌은 다양한 종류의 생물에서 발견되는 어두운 색소의 물질입니다.[148]화학적으로 그것들은 도파민과 밀접한 관련이 있고, 도파민-멜라닌으로 알려진 멜라닌의 한 종류가 있는데, 티로시나아제 효소를 통해 도파민의 산화에 의해 합성될 수 있습니다.[148]인간의 피부를 어둡게 하는 멜라닌은 이런 종류가 아닙니다: L-DOPA를 전구체로 사용하지만 도파민은 사용하지 않는 경로로 합성됩니다.[148]하지만, 뇌의 실질적인 흑요석에 어두운 색을 주는 뉴로멜라닌이 적어도 부분적으로는 도파민 멜라닌이라는 실질적인 증거가 있습니다.[149]
도파민에서 파생된 멜라닌은 적어도 다른 생물학적 시스템에서도 나타날 것입니다.식물의 도파민 중 일부는 도파민 멜라닌의 전구체로 사용될 가능성이 높습니다.[150]곤충 유충의 몸에 있는 흑백 줄무늬뿐만 아니라 나비 날개에 나타나는 복잡한 패턴은 공간적으로 구조화된 도파민 멜라닌의 축적에 의한 것으로 생각됩니다.[151]
역사와 발전
도파민은 1910년 영국[152] 런던의 웰컴 연구소에서 조지 바거와 제임스 에웬스에 의해 처음 합성되었고 1957년 캐서린 몬태구에 의해 인간의 뇌에서 처음으로 확인되었습니다.이것은 Barger-Ewens 합성에서 전구체가 3,4-다이하이드록시페닐알라닌(levodopa 또는 L-DOPA)인 모노아민이기 때문에 도파민이라는 이름이 붙여졌습니다.신경전달물질로서의 도파민의 기능은 1958년 스웨덴 국립 심장 연구소의 화학약리학 연구소에서 아르비드 칼손과 닐스오케 힐라프에 의해 처음으로 인식되었습니다.[153]칼슨은 도파민이 노르에피네프린(노르아드레날린)과 에피네프린(아드레날린)의 전구체일 뿐만 아니라 신경전달물질이라는 것을 보여준 공로로 2000년 노벨 생리의학상을 수상했습니다.[154]
폴리도파민
홍합에 있는 접착성 폴리페놀 단백질에 의해 동기부여된 연구는 2007년에 다양한 물질들이 약간의 염기성 pH의 도파민 용액에 놓이게 되면 종종 폴리도파민이라고 불리는 중합된 도파민 층으로 코팅된다는 것을 발견하게 했습니다.[155][156]이 중합된 도파민은 자발적인 산화 반응에 의해 형성되며, 형식적으로는 멜라닌의 한 종류입니다.[157]또한, 도파민 자가중합은 펩타이드 기반 겔의 기계적 특성을 조절하는데 사용될 수 있습니다.[158]폴리도파민의 합성은 보통 물에서 트리스를 염기로 하는 염산 도파민의 반응을 포함합니다.폴리도파민의 구조는 알려져 있지 않습니다.[156]
폴리도파민 코팅은 나노입자에서부터 큰 표면에 이르기까지 크기가 다양한 물체에 형성될 수 있습니다.[157]폴리도파민 층은 매우 유용할 가능성이 있는 화학적 특성을 가지고 있으며, 많은 연구들이 그들의 가능한 적용을 검토했습니다.[157]가장 간단한 수준에서 빛에 의한 손상으로부터 보호하거나 약물 전달을 위한 캡슐을 형성하는 데 사용될 수 있습니다.[157]더 정교한 수준에서, 그들의 접착 특성은 그것들을 바이오 센서 또는 다른 생물학적으로 활성인 거대 분자의 기질로서 유용하게 만들 수 있습니다.[157]
참고 항목
참고문헌
- ^ Cruickshank L, Kennedy AR, Shankland N (2013). "CSD Entry TIRZAX: 5-(2-Ammonioethyl)-2-hydroxyphenolate, Dopamine". Cambridge Structural Database: Access Structures. Cambridge Crystallographic Data Centre. doi:10.5517/cc10m9nl.
- ^ Cruickshank L, Kennedy AR, Shankland N (2013). "Tautomeric and ionisation forms of dopamine and tyramine in the solid state". J. Mol. Struct. 1051: 132–36. Bibcode:2013JMoSt1051..132C. doi:10.1016/j.molstruc.2013.08.002.
- ^ a b c d "Dopamine: Biological activity". IUPHAR/BPS guide to pharmacology. International Union of Basic and Clinical Pharmacology. Retrieved 29 January 2016.
- ^ Berridge KC (April 2007). "The debate over dopamine's role in reward: the case for incentive salience". Psychopharmacology. 191 (3): 391–431. doi:10.1007/s00213-006-0578-x. PMID 17072591. S2CID 468204.
- ^ a b Wise RA, Robble MA (January 2020). "Dopamine and Addiction". Annual Review of Psychology. 71 (1): 79–106. doi:10.1146/annurev-psych-010418-103337. PMID 31905114. S2CID 210043316.
- ^ a b c d e f g h Malenka RC, Nestler EJ, Hyman SE (2009). Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 147–48, 366–67, 375–76. ISBN 978-0-07-148127-4.
- ^ Baliki MN, Mansour A, Baria AT, Huang L, Berger SE, Fields HL, Apkarian AV (October 2013). "Parceling human accumbens into putative core and shell dissociates encoding of values for reward and pain". The Journal of Neuroscience. 33 (41): 16383–93. doi:10.1523/JNEUROSCI.1731-13.2013. PMC 3792469. PMID 24107968.
- ^ a b Wenzel JM, Rauscher NA, Cheer JF, Oleson EB (January 2015). "A role for phasic dopamine release within the nucleus accumbens in encoding aversion: a review of the neurochemical literature". ACS Chemical Neuroscience. 6 (1): 16–26. doi:10.1021/cn500255p. PMC 5820768. PMID 25491156.
Thus, fear-evoking stimuli are capable of differentially altering phasic dopamine transmission across NAcc subregions. The authors propose that the observed enhancement in NAcc shell dopamine likely reflects general motivational salience, perhaps due to relief from a CS-induced fear state when the US (foot shock) is not delivered. This reasoning is supported by a report from Budygin and colleagues112 showing that, in anesthetized rats, the termination of tail pinch results in augmented dopamine release in the shell.
- ^ Puglisi-Allegra S, Ventura R (June 2012). "Prefrontal/accumbal catecholamine system processes high motivational salience". Front. Behav. Neurosci. 6: 31. doi:10.3389/fnbeh.2012.00031. PMC 3384081. PMID 22754514.
- ^ Oleson, Erik B. (26 January 2013). "Endocannabinoids shape accumbal encoding of cue-motivated behavior via CB1 receptor activation in the ventral tegmentum". Neuron. 73 (2): 360–373. doi:10.1016/j.neuron.2011.11.018. PMC 3269037. PMID 22284189.
- ^ Moncrieff J (2008). The myth of the chemical cure. A critique of psychiatric drug treatment. Basingstoke, UK: Palgrave MacMillan. ISBN 978-0-230-57432-8.
- ^ Volkow ND, Wang GJ, Kollins SH, Wigal TL, Newcorn JH, Telang F, Fowler JS, Zhu W, Logan J, Ma Y, Pradhan K, Wong C, Swanson JM (September 2009). "Evaluating dopamine reward pathway in ADHD: clinical implications". JAMA. 302 (10): 1084–91. doi:10.1001/jama.2009.1308. PMC 2958516. PMID 19738093.
- ^ "Dopamine infusion" (PDF). Retrieved 13 October 2023.
- ^ a b "Shock and Hypotension in the Newborn Medication: Alpha/Beta Adrenergic Agonists, Vasodilators, Inotropic agents, Volume Expanders, Antibiotics, Other". emedicine.medscape.com. Retrieved 13 October 2023.
{{cite web}}: CS1 유지 : url-status (링크) - ^ "Dopamine". PubChem. Retrieved 21 September 2015.
- ^ "Catecholamine". Britannica. Retrieved 21 September 2015.
- ^ "Phenylethylamine". ChemicalLand21.com. Retrieved 21 September 2015.
- ^ a b c d e f Carter JE, Johnson JH, Baaske DM (1982). "Dopamine Hydrochloride". Analytical Profiles of Drug Substances. 11: 257–72. doi:10.1016/S0099-5428(08)60266-X. ISBN 978-0122608117.
- ^ "Specification Sheet". www.sigmaaldrich.com. Retrieved 13 September 2019.
- ^ a b c Broadley KJ (March 2010). "The vascular effects of trace amines and amphetamines". Pharmacology & Therapeutics. 125 (3): 363–375. doi:10.1016/j.pharmthera.2009.11.005. PMID 19948186.
- ^ a b c Lindemann L, Hoener MC (May 2005). "A renaissance in trace amines inspired by a novel GPCR family". Trends in Pharmacological Sciences. 26 (5): 274–281. doi:10.1016/j.tips.2005.03.007. PMID 15860375.
- ^ a b c d Wang X, Li J, Dong G, Yue J (February 2014). "The endogenous substrates of brain CYP2D". European Journal of Pharmacology. 724: 211–218. doi:10.1016/j.ejphar.2013.12.025. PMID 24374199.
- ^ a b c d e f Seeman P (2009). "Chapter 1: Historical overview: Introduction to the dopamine receptors". In Neve K (ed.). The Dopamine Receptors. Springer. pp. 1–22. ISBN 978-1-60327-333-6.
- ^ EC 1.14.16.2 – Tyrosine 3-monooxygenase (Homo sapiens). July 2016. Retrieved 7 October 2016.
Substrate: L-phenylalanine + tetrahydrobiopterin + O2
Product: L-tyrosine + 3-hydroxyphenylalanine [(aka m-tyrosine)] + dihydropteridine + H2O
Organism: Homo sapiens{{cite encyclopedia}}:website=무시됨(도움말)
반응도 - ^ EC 4.1.1.28 – Aromatic-L-amino-acid decarboxylase (Homo sapiens). July 2016. Retrieved 7 October 2016.
Substrate: m-tyrosine
Product: m-tyramine + CO2
Organism: Homo sapiens{{cite encyclopedia}}:website=무시됨(도움말)
반응도 - ^ a b c d e f g h i j Musacchio JM (2013). "Chapter 1: Enzymes involved in the biosynthesis and degradation of catecholamines". In Iverson L (ed.). Biochemistry of Biogenic Amines. Springer. pp. 1–35. ISBN 978-1-4684-3171-1.
- ^ a b c d e f g h i j k The National Collaborating Centre for Chronic Conditions, ed. (2006). "Symptomatic pharmacological therapy in Parkinson's disease". Parkinson's Disease. London: Royal College of Physicians. pp. 59–100. ISBN 978-1-86016-283-1. Archived from the original on 24 September 2010. Retrieved 24 September 2015.
- ^ a b c d e f g h i j k Eisenhofer G, Kopin IJ, Goldstein DS (September 2004). "Catecholamine metabolism: a contemporary view with implications for physiology and medicine". Pharmacological Reviews. 56 (3): 331–49. doi:10.1124/pr.56.3.1. PMID 15317907. S2CID 12825309.
- ^ Amin F, Davidson M, Davis KL (1992). "Homovanillic acid measurement in clinical research: a review of methodology". Schizophrenia Bulletin. 18 (1): 123–48. doi:10.1093/schbul/18.1.123. PMID 1553492.
- ^ Amin F, Davidson M, Kahn RS, Schmeidler J, Stern R, Knott PJ, Apter S (1995). "Assessment of the central dopaminergic index of plasma HVA in schizophrenia". Schizophrenia Bulletin. 21 (1): 53–66. doi:10.1093/schbul/21.1.53. PMID 7770741.
- ^ Sulzer D, Zecca L (February 2000). "Intraneuronal dopamine-quinone synthesis: a review". Neurotoxicity Research. 1 (3): 181–95. doi:10.1007/BF03033289. PMID 12835101. S2CID 21892355.
- ^ Miyazaki I, Asanuma M (June 2008). "Dopaminergic neuron-specific oxidative stress caused by dopamine itself" (PDF). Acta Medica Okayama. 62 (3): 141–50. doi:10.18926/AMO/30942. PMID 18596830.
- ^ a b c d e Grandy DK, Miller GM, Li JX (February 2016). ""TAARgeting Addiction" – The Alamo Bears Witness to Another Revolution: An Overview of the Plenary Symposium of the 2015 Behavior, Biology and Chemistry Conference". Drug and Alcohol Dependence. 159: 9–16. doi:10.1016/j.drugalcdep.2015.11.014. PMC 4724540. PMID 26644139.
TAAR1 is a high-affinity receptor for METH/AMPH and DA
- ^ a b c d Romanelli RJ, Williams JT, Neve KA (2009). "Chapter 6: Dopamine receptor signalling: intracellular pathways to behavior". In Neve KA (ed.). The Dopamine Receptors. Springer. pp. 137–74. ISBN 978-1-60327-333-6.
- ^ a b Eiden LE, Schäfer MK, Weihe E, Schütz B (February 2004). "The vesicular amine transporter family (SLC18): amine/proton antiporters required for vesicular accumulation and regulated exocytotic secretion of monoamines and acetylcholine". Pflügers Archiv. 447 (5): 636–40. doi:10.1007/s00424-003-1100-5. PMID 12827358. S2CID 20764857.
- ^ a b Miller GM (January 2011). "The emerging role of trace amine-associated receptor 1 in the functional regulation of monoamine transporters and dopaminergic activity". Journal of Neurochemistry. 116 (2): 164–76. doi:10.1111/j.1471-4159.2010.07109.x. PMC 3005101. PMID 21073468.
- ^ a b Beaulieu JM, Gainetdinov RR (March 2011). "The physiology, signaling, and pharmacology of dopamine receptors". Pharmacological Reviews. 63 (1): 182–217. doi:10.1124/pr.110.002642. PMID 21303898. S2CID 2545878.
- ^ Torres GE, Gainetdinov RR, Caron MG (January 2003). "Plasma membrane monoamine transporters: structure, regulation and function". Nature Reviews. Neuroscience. 4 (1): 13–25. doi:10.1038/nrn1008. PMID 12511858. S2CID 21545649.
- ^ a b c d Rice ME, Patel JC, Cragg SJ (December 2011). "Dopamine release in the basal ganglia". Neuroscience. 198: 112–37. doi:10.1016/j.neuroscience.2011.08.066. PMC 3357127. PMID 21939738.
- ^ Schultz W (2007). "Multiple dopamine functions at different time courses". Annual Review of Neuroscience. 30: 259–88. doi:10.1146/annurev.neuro.28.061604.135722. PMID 17600522. S2CID 13503219.
- ^ a b c d e f g h i Björklund A, Dunnett SB (May 2007). "Dopamine neuron systems in the brain: an update". Trends in Neurosciences. 30 (5): 194–202. doi:10.1016/j.tins.2007.03.006. PMID 17408759. S2CID 14239716.
- ^ a b Dahlstroem A, Fuxe K (1964). "Evidence for the existence of monoamine-containing neurons in the central nervous system. I. Demonstration of monoamines in the cell bodies of brain stem neurons". Acta Physiologica Scandinavica. Supplementum. 232 (Suppl): 1–55. PMID 14229500.
- ^ a b c d Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 6: Widely Projecting Systems: Monoamines, Acetylcholine, and Orexin". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 147–48, 154–57. ISBN 978-0-07-148127-4.
- ^ Christine CW, Aminoff MJ (September 2004). "Clinical differentiation of parkinsonian syndromes: prognostic and therapeutic relevance". The American Journal of Medicine. 117 (6): 412–19. doi:10.1016/j.amjmed.2004.03.032. PMID 15380498.
- ^ Fadok JP, Dickerson TM, Palmiter RD (September 2009). "Dopamine is necessary for cue-dependent fear conditioning". The Journal of Neuroscience. 29 (36): 11089–97. doi:10.1523/JNEUROSCI.1616-09.2009. PMC 2759996. PMID 19741115.
- ^ Tang W, Kochubey O, Kintscher M, Schneggenburger R (April 2020). "A VTA to basal amygdala dopamine projection contributes to signal salient somatosensory events during fear learning". The Journal of Neuroscience. 40 (20): JN–RM–1796-19. doi:10.1523/JNEUROSCI.1796-19.2020. PMC 7219297. PMID 32277045.
- ^ Jo YS, Heymann G, Zweifel LS (November 2018). "Dopamine Neurons Reflect the Uncertainty in Fear Generalization". Neuron. 100 (4): 916–925.e3. doi:10.1016/j.neuron.2018.09.028. PMC 6226002. PMID 30318411.
- ^ a b Paulus W, Schomburg ED (June 2006). "Dopamine and the spinal cord in restless legs syndrome: does spinal cord physiology reveal a basis for augmentation?". Sleep Medicine Reviews. 10 (3): 185–96. doi:10.1016/j.smrv.2006.01.004. PMID 16762808.
- ^ a b c d e f Ben-Jonathan N, Hnasko R (December 2001). "Dopamine as a prolactin (PRL) inhibitor". Endocrine Reviews. 22 (6): 724–63. doi:10.1210/er.22.6.724. PMID 11739329.
- ^ a b c d Witkovsky P (January 2004). "Dopamine and retinal function". Documenta Ophthalmologica. Advances in Ophthalmology. 108 (1): 17–40. doi:10.1023/B:DOOP.0000019487.88486.0a. PMID 15104164. S2CID 10354133.
- ^ a b Fix JD (2008). "Basal Ganglia and the Striatal Motor System". Neuroanatomy (Board Review Series) (4th ed.). Baltimore: Wulters Kluwer & Lippincott Williams & Wilkins. pp. 274–81. ISBN 978-0-7817-7245-7.
- ^ a b c d e f Chakravarthy VS, Joseph D, Bapi RS (September 2010). "What do the basal ganglia do? A modeling perspective". Biological Cybernetics. 103 (3): 237–53. doi:10.1007/s00422-010-0401-y. PMID 20644953. S2CID 853119.
- ^ a b c d Floresco SB (January 2015). "The nucleus accumbens: an interface between cognition, emotion, and action". Annual Review of Psychology. 66: 25–52. doi:10.1146/annurev-psych-010213-115159. PMID 25251489. S2CID 28268183.
- ^ a b Balleine BW, Dezfouli A, Ito M, Doya K (2015). "Hierarchical control of goal-directed action in the cortical–basal ganglia network". Current Opinion in Behavioral Sciences. 5: 1–7. doi:10.1016/j.cobeha.2015.06.001. S2CID 53148662.
- ^ a b c Jankovic J (April 2008). "Parkinson's disease: clinical features and diagnosis". Journal of Neurology, Neurosurgery, and Psychiatry. 79 (4): 368–76. doi:10.1136/jnnp.2007.131045. PMID 18344392.
- ^ Pattij T, Vanderschuren LJ (April 2008). "The neuropharmacology of impulsive behaviour". Trends in Pharmacological Sciences. 29 (4): 192–99. doi:10.1016/j.tips.2008.01.002. PMID 18304658.
- ^ a b c d e f g h i j k l m Schultz W (July 2015). "Neuronal Reward and Decision Signals: From Theories to Data". Physiological Reviews. 95 (3): 853–951. doi:10.1152/physrev.00023.2014. PMC 4491543. PMID 26109341.
- ^ a b c Robinson TE, Berridge KC (1993). "The neural basis of drug craving: an incentive-sensitization theory of addiction". Brain Research. Brain Research Reviews. 18 (3): 247–91. doi:10.1016/0165-0173(93)90013-p. hdl:2027.42/30601. PMID 8401595. S2CID 13471436.
- ^ Wright JS, Panksepp J (2012). "An evolutionary framework to understand foraging, wanting, and desire: the neuropsychology of the SEEKING system". Neuropsychoanalysis. 14 (1): 5–39. doi:10.1080/15294145.2012.10773683. S2CID 145747459. Retrieved 24 September 2015.
- ^ a b c d e Berridge KC, Robinson TE, Aldridge JW (February 2009). "Dissecting components of reward: 'liking', 'wanting', and learning". Current Opinion in Pharmacology. 9 (1): 65–73. doi:10.1016/j.coph.2008.12.014. PMC 2756052. PMID 19162544.
- ^ Montague PR, Dayan P, Sejnowski TJ (March 1996). "A framework for mesencephalic dopamine systems based on predictive Hebbian learning". The Journal of Neuroscience. 16 (5): 1936–47. doi:10.1523/JNEUROSCI.16-05-01936.1996. PMC 6578666. PMID 8774460.
- ^ Bromberg-Martin ES, Matsumoto M, Hikosaka O (December 2010). "Dopamine in motivational control: rewarding, aversive, and alerting". Neuron. 68 (5): 815–34. doi:10.1016/j.neuron.2010.11.022. PMC 3032992. PMID 21144997.
- ^ Yager LM, Garcia AF, Wunsch AM, Ferguson SM (August 2015). "The ins and outs of the striatum: Role in drug addiction". Neuroscience. 301: 529–41. doi:10.1016/j.neuroscience.2015.06.033. PMC 4523218. PMID 26116518.
- ^ a b Saddoris MP, Cacciapaglia F, Wightman RM, Carelli RM (August 2015). "Differential Dopamine Release Dynamics in the Nucleus Accumbens Core and Shell Reveal Complementary Signals for Error Prediction and Incentive Motivation". The Journal of Neuroscience. 35 (33): 11572–82. doi:10.1523/JNEUROSCI.2344-15.2015. PMC 4540796. PMID 26290234.
- ^ Berridge KC, Kringelbach ML (May 2015). "Pleasure systems in the brain". Neuron. 86 (3): 646–64. doi:10.1016/j.neuron.2015.02.018. PMC 4425246. PMID 25950633.
- ^ a b c Wise RA (1996). "Addictive drugs and brain stimulation reward". Annual Review of Neuroscience. 19: 319–40. doi:10.1146/annurev.ne.19.030196.001535. PMID 8833446.
- ^ Wise RA (October 2008). "Dopamine and reward: the anhedonia hypothesis 30 years on". Neurotoxicity Research. 14 (2–3): 169–83. doi:10.1007/BF03033808. PMC 3155128. PMID 19073424.
- ^ Arias-Carrión O, Pöppel E (2007). "Dopamine, learning and reward-seeking behavior". Acta Neurobiol Exp. 67 (4): 481–88. PMID 18320725.
- ^ Ikemoto S (November 2007). "Dopamine reward circuitry: two projection systems from the ventral midbrain to the nucleus accumbens-olfactory tubercle complex". Brain Research Reviews. 56 (1): 27–78. doi:10.1016/j.brainresrev.2007.05.004. PMC 2134972. PMID 17574681.
- ^ a b Ferreri L, Mas-Herrero E, Zatorre RJ, Ripollés P, Gomez-Andres A, Alicart H, Olivé G, Marco-Pallarés J, Antonijoan RM, Valle M, Riba J, Rodriguez-Fornells A (2019). "Dopamine modulates the reward experiences elicited by music". Proceedings of the National Academy of Sciences of the United States of America. 116 (9): 3793–98. Bibcode:2019PNAS..116.3793F. doi:10.1073/pnas.1811878116. PMC 6397525. PMID 30670642.
Listening to pleasurable music is often accompanied by measurable bodily reactions such as goose bumps or shivers down the spine, commonly called "chills" or "frissons." ... Overall, our results straightforwardly revealed that pharmacological interventions bidirectionally modulated the reward responses elicited by music. In particular, we found that risperidone impaired participants' ability to experience musical pleasure, whereas levodopa enhanced it. ... Here, in contrast, studying responses to abstract rewards in human subjects, we show that manipulation of dopaminergic transmission affects both the pleasure (i.e., amount of time reporting chills and emotional arousal measured by EDA) and the motivational components of musical reward (money willing to spend). These findings suggest that dopaminergic signaling is a sine qua non condition not only for motivational responses, as has been shown with primary and secondary rewards, but also for hedonic reactions to music. This result supports recent findings showing that dopamine also mediates the perceived pleasantness attained by other types of abstract rewards (37) and challenges previous findings in animal models on primary rewards, such as food (42, 43).
- ^ a b Goupil L, Aucouturier JJ (February 2019). "Musical pleasure and musical emotions". Proceedings of the National Academy of Sciences of the United States of America. 116 (9): 3364–66. Bibcode:2019PNAS..116.3364G. doi:10.1073/pnas.1900369116. PMC 6397567. PMID 30770455.
In a pharmacological study published in PNAS, Ferreri et al. (1) present evidence that enhancing or inhibiting dopamine signaling using levodopa or risperidone modulates the pleasure experienced while listening to music. ... In a final salvo to establish not only the correlational but also the causal implication of dopamine in musical pleasure, the authors have turned to directly manipulating dopaminergic signaling in the striatum, first by applying excitatory and inhibitory transcranial magnetic stimulation over their participants' left dorsolateral prefrontal cortex, a region known to modulate striatal function (5), and finally, in the current study, by administrating pharmaceutical agents able to alter dopamine synaptic availability (1), both of which influenced perceived pleasure, physiological measures of arousal, and the monetary value assigned to music in the predicted direction. ... While the question of the musical expression of emotion has a long history of investigation, including in PNAS (6), and the 1990s psychophysiological strand of research had already established that musical pleasure could activate the autonomic nervous system (7), the authors' demonstration of the implication of the reward system in musical emotions was taken as inaugural proof that these were veridical emotions whose study has full legitimacy to inform the neurobiology of our everyday cognitive, social, and affective functions (8). Incidentally, this line of work, culminating in the article by Ferreri et al. (1), has plausibly done more to attract research funding for the field of music sciences than any other in this community.
The evidence of Ferreri et al. (1) provides the latest support for a compelling neurobiological model in which musical pleasure arises from the interaction of ancient reward/valuation systems (striatal–limbic–paralimbic) with more phylogenetically advanced perception/predictions systems (temporofrontal). - ^ Koepp MJ, Gunn RN, Lawrence AD, Cunningham VJ, Dagher A, Jones T, et al. (May 1998). "Evidence for striatal dopamine release during a video game". Nature. 393 (6682): 266–268. Bibcode:1998Natur.393..266K. doi:10.1038/30498. PMID 9607763. S2CID 205000565.
- ^ von der Heiden JM, Braun B, Müller KW, Egloff B (2019). "The Association Between Video Gaming and Psychological Functioning". Frontiers in Psychology. 10: 1731. doi:10.3389/fpsyg.2019.01731. PMC 6676913. PMID 31402891.
- ^ a b Missale C, Nash SR, Robinson SW, Jaber M, Caron MG (January 1998). "Dopamine receptors: from structure to function" (PDF). Physiological Reviews. 78 (1): 189–225. doi:10.1152/physrev.1998.78.1.189. PMID 9457173. S2CID 223462. Archived from the original (PDF) on 2 March 2019.
- ^ a b Buttarelli FR, Fanciulli A, Pellicano C, Pontieri FE (June 2011). "The dopaminergic system in peripheral blood lymphocytes: from physiology to pharmacology and potential applications to neuropsychiatric disorders". Current Neuropharmacology. 9 (2): 278–88. doi:10.2174/157015911795596612. PMC 3131719. PMID 22131937.
- ^ a b Sarkar C, Basu B, Chakroborty D, Dasgupta PS, Basu S (May 2010). "The immunoregulatory role of dopamine: an update". Brain, Behavior, and Immunity. 24 (4): 525–28. doi:10.1016/j.bbi.2009.10.015. PMC 2856781. PMID 19896530.
- ^ Hussain T, Lokhandwala MF (February 2003). "Renal dopamine receptors and hypertension". Experimental Biology and Medicine. 228 (2): 134–42. doi:10.1177/153537020322800202. PMID 12563019. S2CID 10896819.
- ^ Choi MR, Kouyoumdzian NM, Rukavina Mikusic NL, Kravetz MC, Rosón MI, Rodríguez Fermepin M, Fernández BE (May 2015). "Renal dopaminergic system: Pathophysiological implications and clinical perspectives". World Journal of Nephrology. 4 (2): 196–212. doi:10.5527/wjn.v4.i2.196. PMC 4419129. PMID 25949933.
- ^ Carey RM (September 2001). "Theodore Cooper Lecture: Renal dopamine system: paracrine regulator of sodium homeostasis and blood pressure". Hypertension. 38 (3): 297–302. doi:10.1161/hy0901.096422. PMID 11566894.
- ^ a b c d e Rubí B, Maechler P (December 2010). "Minireview: new roles for peripheral dopamine on metabolic control and tumor growth: let's seek the balance". Endocrinology. 151 (12): 5570–81. doi:10.1210/en.2010-0745. PMID 21047943.
- ^ "WHO Model List of Essential Medicines" (PDF). World Health Organization. October 2013. Archived (PDF) from the original on 10 February 2014. Retrieved 24 September 2015.
- ^ Noori S, Friedlich P, Seri I (2003). "Pharmacology Review Developmentally Regulated Cardiovascular, Renal, and Neuroendocrine Effects of Dopamine". NeoReviews. 4 (10): e283–e288. doi:10.1542/neo.4-10-e283. S2CID 71902752. Retrieved 24 September 2015.
- ^ a b Bhatt-Mehta V, Nahata MC (1989). "Dopamine and dobutamine in pediatric therapy". Pharmacotherapy. 9 (5): 303–14. doi:10.1002/j.1875-9114.1989.tb04142.x. PMID 2682552. S2CID 25614283.
- ^ a b c Bronwen JB, Knights KM (2009). Pharmacology for Health Professionals (2nd ed.). Elsevier Australia. p. 192. ISBN 978-0-7295-3929-6.
- ^ De Backer D, Biston P, Devriendt J, Madl C, Chochrad D, Aldecoa C, et al. (March 2010). "Comparison of dopamine and norepinephrine in the treatment of shock" (PDF). The New England Journal of Medicine. 362 (9): 779–89. doi:10.1056/NEJMoa0907118. PMID 20200382. S2CID 2208904. Archived from the original (PDF) on 28 February 2019.
- ^ Karthik S, Lisbon A (2006). "Low-dose dopamine in the intensive care unit". Seminars in Dialysis. 19 (6): 465–71. doi:10.1111/j.1525-139X.2006.00208.x. PMID 17150046. S2CID 22538344.
- ^ Moses S. "Dopamine". Family Practice Notebook. Retrieved 1 February 2016.
- ^ Katritsis DG, Gersh BJ, Camm AJ (2013). Clinical Cardiology: Current Practice Guidelines. OUP Oxford. ISBN 978-0-19-150851-6.
Dopamine binds to beta-1, beta-2, alpha-1 and dopaminergic receptors
- ^ Lewis RJ (2004). Sax's Dangerous Properties of Industrial Materials (11th ed.). Hoboken, NJ: Wiley & Sons. p. 1552. ISBN 978-0-471-47662-7.
- ^ Standaert DG, Walsh RR (2011). "Pharmacology of dopaminergic neurotransmission". In Tashjian AH, Armstrong EJ, Golan DE (eds.). Principles of Pharmacology: The Pathophysiologic Basis of Drug Therapy. Lippincott Williams & Wilkins. pp. 186–206. ISBN 978-1-4511-1805-6.
- ^ Mobbs CV, Hof PR (2009). Handbook of the neuroscience of aging. Amsterdam: Elsevier/Academic Press. ISBN 978-0-12-374898-0. OCLC 299710911.
- ^ Ota M, Yasuno F, Ito H, Seki C, Nozaki S, Asada T, Suhara T (July 2006). "Age-related decline of dopamine synthesis in the living human brain measured by positron emission tomography with L-[beta-11C]DOPA". Life Sciences. 79 (8): 730–36. doi:10.1016/j.lfs.2006.02.017. PMID 16580023.
- ^ Kaasinen V, Vilkman H, Hietala J, Någren K, Helenius H, Olsson H, Farde L, Rinne J (2000). "Age-related dopamine D2/D3 receptor loss in extrastriatal regions of the human brain". Neurobiology of Aging. 21 (5): 683–68. doi:10.1016/S0197-4580(00)00149-4. PMID 11016537. S2CID 40871554.
- ^ Wang Y, Chan GL, Holden JE, Dobko T, Mak E, Schulzer M, Huser JM, Snow BJ, Ruth TJ, Calne DB, Stoessl AJ (September 1998). "Age-dependent decline of dopamine D1 receptors in human brain: a PET study". Synapse. 30 (1): 56–61. doi:10.1002/(SICI)1098-2396(199809)30:1<56::AID-SYN7>3.0.CO;2-J. PMID 9704881. S2CID 31445572.
- ^ a b Wong DF, Wagner HN, Dannals RF, Links JM, Frost JJ, Ravert HT, Wilson AA, Rosenbaum AE, Gjedde A, Douglass KH (December 1984). "Effects of age on dopamine and serotonin receptors measured by positron tomography in the living human brain". Science. 226 (4681): 1393–96. Bibcode:1984Sci...226.1393W. doi:10.1126/science.6334363. PMID 6334363. S2CID 24278577.
- ^ a b Wang E, Snyder SD (1998). Handbook of the aging brain. San Diego, California: Academic Press. ISBN 978-0-12-734610-6. OCLC 636693117.
- ^ Chang L, Jiang CS, Ernst T (January 2009). "Effects of age and sex on brain glutamate and other metabolites". Magnetic Resonance Imaging. 27 (1): 142–45. doi:10.1016/j.mri.2008.06.002. PMC 3164853. PMID 18687554.
- ^ Dobryakova E, Genova HM, DeLuca J, Wylie GR (12 March 2015). "The dopamine imbalance hypothesis of fatigue in multiple sclerosis and other neurological disorders". Frontiers in Neurology. 6: 52. doi:10.3389/fneur.2015.00052. PMC 4357260. PMID 25814977.
- ^ Marino F, Cosentino M (April 2016). "Multiple sclerosis: Repurposing dopaminergic drugs for MS—the evidence mounts". Nature Reviews. Neurology. 12 (4): 191–92. doi:10.1038/nrneurol.2016.33. PMID 27020558. S2CID 26319461.
- ^ Dickson DV (2007). "Neuropathology of movement disorders". In Tolosa E, Jankovic JJ (eds.). Parkinson's disease and movement disorders. Hagerstown, MD: Lippincott Williams & Wilkins. pp. 271–83. ISBN 978-0-7817-7881-7.
- ^ a b Tuite PJ, Krawczewski K (April 2007). "Parkinsonism: a review-of-systems approach to diagnosis". Seminars in Neurology. 27 (2): 113–22. doi:10.1055/s-2007-971174. PMID 17390256. S2CID 260319916.
- ^ a b Olsen CM (December 2011). "Natural rewards, neuroplasticity, and non-drug addictions". Neuropharmacology. 61 (7): 1109–22. doi:10.1016/j.neuropharm.2011.03.010. PMC 3139704. PMID 21459101.
- ^ Ceravolo R, Frosini D, Rossi C, Bonuccelli U (November 2010). "Spectrum of addictions in Parkinson's disease: from dopamine dysregulation syndrome to impulse control disorders". Journal of Neurology. 257 (Suppl 2): S276–83. doi:10.1007/s00415-010-5715-0. PMID 21080189. S2CID 19277026.
- ^ a b c d e f g Ghodse H (2010). Ghodse's Drugs and Addictive Behaviour: A Guide to Treatment (4th ed.). Cambridge University Press. pp. 87–92. ISBN 978-1-139-48567-8.
- ^ Siciliano CA, Jones SR (August 2017). "Cocaine Potency at the Dopamine Transporter Tracks Discrete Motivational States During Cocaine Self-Administration". Neuropsychopharmacology. 42 (9): 1893–1904. doi:10.1038/npp.2017.24. PMC 5520781. PMID 28139678.
- ^ Heal DJ, Pierce DM (2006). "Methylphenidate and its isomers: their role in the treatment of attention-deficit hyperactivity disorder using a transdermal delivery system". CNS Drugs. 20 (9): 713–38. doi:10.2165/00023210-200620090-00002. PMID 16953648. S2CID 39535277.
- ^ a b Freye E (2009). Pharmacology and abuse of cocaine, amphetamines, ecstasy and related designer drugs a comprehensive review on their mode of action, treatment of abuse and intoxication. Dordrecht: Springer. ISBN 978-90-481-2448-0.
- ^ a b Kimko HC, Cross JT, Abernethy DR (December 1999). "Pharmacokinetics and clinical effectiveness of methylphenidate". Clinical Pharmacokinetics. 37 (6): 457–70. doi:10.2165/00003088-199937060-00002. PMID 10628897. S2CID 397390.
- ^ Mignot EJ (October 2012). "A practical guide to the therapy of narcolepsy and hypersomnia syndromes". Neurotherapeutics. 9 (4): 739–52. doi:10.1007/s13311-012-0150-9. PMC 3480574. PMID 23065655.
- ^ Zimmerman JL (October 2012). "Cocaine intoxication". Critical Care Clinics. 28 (4): 517–26. doi:10.1016/j.ccc.2012.07.003. PMID 22998988.
- ^ "Quillivant XR – methylphenidate hydrochloride suspension, extended release". dailymed.nlm.nih.gov. Retrieved 11 July 2020.
- ^ López FA, Leroux JR (September 2013). "Long-acting stimulants for treatment of attention-deficit/hyperactivity disorder: a focus on extended-release formulations and the prodrug lisdexamfetamine dimesylate to address continuing clinical challenges". Attention Deficit and Hyperactivity Disorders. 5 (3): 249–65. doi:10.1007/s12402-013-0106-x. PMC 3751218. PMID 23564273.
- ^ Nutt DJ, Lingford-Hughes A, Erritzoe D, Stokes PR (May 2015). "The dopamine theory of addiction: 40 years of highs and lows" (PDF). Nature Reviews. Neuroscience. 16 (5): 305–12. doi:10.1038/nrn3939. PMID 25873042. S2CID 205511111.
- ^ a b c Sinha R (August 2013). "The clinical neurobiology of drug craving". Current Opinion in Neurobiology. 23 (4): 649–54. doi:10.1016/j.conb.2013.05.001. PMC 3735834. PMID 23764204.
- ^ Volkow ND, Baler RD (January 2014). "Addiction science: Uncovering neurobiological complexity". Neuropharmacology. 76 (Pt B): 235–49. doi:10.1016/j.neuropharm.2013.05.007. PMC 3818510. PMID 23688927.
- ^ Nestler EJ (December 2012). "Transcriptional mechanisms of drug addiction". Clinical Psychopharmacology and Neuroscience. 10 (3): 136–43. doi:10.9758/cpn.2012.10.3.136. PMC 3569166. PMID 23430970.
- ^ Yeo BT, Krienen FM, Sepulcre J, Sabuncu MR, Lashkari D, Hollinshead M, Roffman JL, Smoller JW, Zöllei L, Polimeni JR, Fischl B, Liu H, Buckner RL (September 2011). "The organization of the human cerebral cortex estimated by intrinsic functional connectivity". Journal of Neurophysiology. 106 (3): 1125–65. doi:10.1152/jn.00338.2011. PMC 3174820. PMID 21653723.
- ^ a b c d e f g Healy D (2004). The Creation of Psychopharmacology. Harvard University Press. pp. 37–73. ISBN 978-0-674-01599-9.
- ^ a b Brunton L. Goodman and Gilman's The Pharmacological Basis of Therapeutics (12th ed.). McGraw Hill. pp. 417–55.
- ^ a b c d Howes OD, Kapur S (May 2009). "The dopamine hypothesis of schizophrenia: version III—the final common pathway". Schizophrenia Bulletin. 35 (3): 549–62. doi:10.1093/schbul/sbp006. PMC 2669582. PMID 19325164.
- ^ Horacek J, Bubenikova-Valesova V, Kopecek M, Palenicek T, Dockery C, Mohr P, Höschl C (2006). "Mechanism of action of atypical antipsychotic drugs and the neurobiology of schizophrenia". CNS Drugs. 20 (5): 389–409. doi:10.2165/00023210-200620050-00004. PMID 16696579. S2CID 18226404.
- ^ Stahl SM (2018). "Beyond the dopamine hypothesis of schizophrenia to three neural networks of psychosis: dopamine, serotonin, and glutamate" (PDF). CNS Spectr. 23 (3): 187–91. doi:10.1017/S1092852918001013. PMID 29954475. S2CID 49599226. Archived (PDF) from the original on 29 April 2020.
- ^ a b Malenka RC, Nestler EJ, Hyman SE (2009). "Chapters 10 and 13". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 266, 318–23. ISBN 978-0-07-148127-4.
- ^ Wu J, Xiao H, Sun H, Zou L, Zhu LQ (June 2012). "Role of dopamine receptors in ADHD: a systematic meta-analysis". Molecular Neurobiology. 45 (3): 605–20. doi:10.1007/s12035-012-8278-5. PMID 22610946. S2CID 895006.
- ^ a b Berridge CW, Devilbiss DM (June 2011). "Psychostimulants as cognitive enhancers: the prefrontal cortex, catecholamines, and attention-deficit/hyperactivity disorder". Biological Psychiatry. 69 (12): e101–11. doi:10.1016/j.biopsych.2010.06.023. PMC 3012746. PMID 20875636.
- ^ Spencer RC, Devilbiss DM, Berridge CW (June 2015). "The cognition-enhancing effects of psychostimulants involve direct action in the prefrontal cortex". Biological Psychiatry. 77 (11): 940–50. doi:10.1016/j.biopsych.2014.09.013. PMC 4377121. PMID 25499957.
- ^ Ilieva IP, Hook CJ, Farah MJ (June 2015). "Prescription Stimulants' Effects on Healthy Inhibitory Control, Working Memory, and Episodic Memory: A Meta-analysis". Journal of Cognitive Neuroscience. 27 (6): 1069–89. doi:10.1162/jocn_a_00776. PMID 25591060. S2CID 15788121.
- ^ a b c Wood PB (May 2008). "Role of central dopamine in pain and analgesia". Expert Review of Neurotherapeutics. 8 (5): 781–97. doi:10.1586/14737175.8.5.781. PMID 18457535. S2CID 24325199.
- ^ a b c d Flake ZA, Scalley RD, Bailey AG (March 2004). "Practical selection of antiemetics". American Family Physician. 69 (5): 1169–74. PMID 15023018.
- ^ Connolly BS, Lang AE (2014). "Pharmacological treatment of Parkinson disease: a review". JAMA. 311 (16): 1670–83. doi:10.1001/jama.2014.3654. PMID 24756517.
- ^ Roshchina VV (2010). "Evolutionary considerations of neurotransmitters in microbial, plant, and animal cells". In Lyte M, Primrose PE (eds.). Microbial Endocrinology. New York: Springer. pp. 17–52. ISBN 978-1-4419-5576-0.
- ^ a b Iyer LM, Aravind L, Coon SL, Klein DC, Koonin EV (July 2004). "Evolution of cell-cell signaling in animals: did late horizontal gene transfer from bacteria have a role?". Trends in Genetics. 20 (7): 292–99. doi:10.1016/j.tig.2004.05.007. PMID 15219393.
- ^ a b c d e Barron AB, Søvik E, Cornish JL (2010). "The roles of dopamine and related compounds in reward-seeking behavior across animal phyla". Frontiers in Behavioral Neuroscience. 4: 163. doi:10.3389/fnbeh.2010.00163. PMC 2967375. PMID 21048897.
- ^ Liu H, Mishima Y, Fujiwara T, Nagai H, Kitazawa A, Mine Y, et al. (2004). "Isolation of Araguspongine M, a new stereoisomer of an Araguspongine/Xestospongin alkaloid, and dopamine from the marine sponge Neopetrosia exigua collected in Palau". Marine Drugs. 2 (4): 154–63. doi:10.3390/md204154. PMC 3783253.
- ^ Kass-Simon G, Pierobon P (January 2007). "Cnidarian chemical neurotransmission, an updated overview". Comparative Biochemistry and Physiology. Part A, Molecular & Integrative Physiology. 146 (1): 9–25. doi:10.1016/j.cbpa.2006.09.008. PMID 17101286.
- ^ Cottrell GA (January 1967). "Occurrence of dopamine and noradrenaline in the nervous tissue of some invertebrate species". British Journal of Pharmacology and Chemotherapy. 29 (1): 63–69. doi:10.1111/j.1476-5381.1967.tb01939.x. PMC 1557178. PMID 19108240.
- ^ Kindt KS, Quast KB, Giles AC, De S, Hendrey D, Nicastro I, Rankin CH, Schafer WR (August 2007). "Dopamine mediates context-dependent modulation of sensory plasticity in C. elegans". Neuron. 55 (4): 662–76. doi:10.1016/j.neuron.2007.07.023. PMID 17698017. S2CID 2092645.
- ^ Kalivas PW, Stewart J (1 September 1991). "Dopamine transmission in the initiation and expression of drug- and stress-induced sensitization of motor activity". Brain Research. Brain Research Reviews. 16 (3): 223–44. doi:10.1016/0165-0173(91)90007-U. PMID 1665095. S2CID 10775295.
- ^ Perry CJ, Barron AB (2013). "Neural mechanisms of reward in insects" (PDF). Annual Review of Entomology. 58 (1): 543–62. doi:10.1146/annurev-ento-120811-153631. PMID 23020615. S2CID 19678766. Archived from the original (PDF) on 5 June 2020.
- ^ Takikawa Y, Kawagoe R, Hikosaka O (October 2004). "A possible role of midbrain dopamine neurons in short- and long-term adaptation of saccades to position-reward mapping" (PDF). Journal of Neurophysiology. 92 (4): 2520–29. doi:10.1152/jn.00238.2004. PMID 15163669. S2CID 12534057. Archived from the original (PDF) on 2 March 2019.
- ^ Yamagata N, Ichinose T, Aso Y, Plaçais PY, Friedrich AB, Sima RJ, et al. (January 2015). "Distinct dopamine neurons mediate reward signals for short- and long-term memories". Proceedings of the National Academy of Sciences of the United States of America. 112 (2): 578–83. Bibcode:2015PNAS..112..578Y. doi:10.1073/pnas.1421930112. PMC 4299218. PMID 25548178.
- ^ a b Waddell S (June 2013). "Reinforcement signalling in Drosophila; dopamine does it all after all". Current Opinion in Neurobiology. 23 (3): 324–29. doi:10.1016/j.conb.2013.01.005. PMC 3887340. PMID 23391527.
- ^ a b c d e f Kulma A, Szopa J (2007). "Catecholamines are active compounds in plants". Plant Science. 172 (3): 433–40. doi:10.1016/j.plantsci.2006.10.013.
- ^ a b Ingle PK (2003). "L-DOPA bearing plants" (PDF). Natural Product Radiance. 2: 126–33. Archived (PDF) from the original on 2 March 2014. Retrieved 24 September 2015.
- ^ Wichers HJ, Visser JF, Huizing HJ, Pras N (1993). "Occurrence of L-DOPA and dopamine in plants and cell cultures of Mucuna pruriens and effects of 2, 4-d and NaCl on these compounds". Plant Cell, Tissue and Organ Culture. 33 (3): 259–64. doi:10.1007/BF02319010. S2CID 44814336.
- ^ Longo R, Castellani A, Sberze P, Tibolla M (1974). "Distribution of l-dopa and related amino acids in Vicia". Phytochemistry. 13 (1): 167–71. Bibcode:1974PChem..13..167L. doi:10.1016/S0031-9422(00)91287-1.
- ^ Van Alstyne KL, Nelson AV, Vyvyan JR, Cancilla DA (June 2006). "Dopamine functions as an antiherbivore defense in the temperate green alga Ulvaria obscura". Oecologia. 148 (2): 304–11. Bibcode:2006Oecol.148..304V. doi:10.1007/s00442-006-0378-3. PMID 16489461. S2CID 5029574.
- ^ a b c Simon JD, Peles D, Wakamatsu K, Ito S (October 2009). "Current challenges in understanding melanogenesis: bridging chemistry, biological control, morphology, and function". Pigment Cell & Melanoma Research. 22 (5): 563–79. doi:10.1111/j.1755-148X.2009.00610.x. PMID 19627559.
- ^ Fedorow H, Tribl F, Halliday G, Gerlach M, Riederer P, Double KL (February 2005). "Neuromelanin in human dopamine neurons: comparison with peripheral melanins and relevance to Parkinson's disease". Progress in Neurobiology. 75 (2): 109–24. doi:10.1016/j.pneurobio.2005.02.001. PMID 15784302. S2CID 503902.
- ^ Andrews RS, Pridham JB (1967). "Melanins from DOPA-containing plants". Phytochemistry. 6 (1): 13–18. Bibcode:1967PChem...6...13A. doi:10.1016/0031-9422(67)85002-7.
- ^ Beldade P, Brakefield PM (June 2002). "The genetics and evo-devo of butterfly wing patterns". Nature Reviews. Genetics. 3 (6): 442–52. doi:10.1038/nrg818. PMID 12042771. S2CID 17417235.
- ^ Fahn S (2008). "The history of dopamine and levodopa in the treatment of Parkinson's disease". Movement Disorders. 23 (Suppl 3): S497–508. doi:10.1002/mds.22028. PMID 18781671. S2CID 45572523.
- ^ Benes FM (January 2001). "Carlsson and the discovery of dopamine". Trends in Pharmacological Sciences. 22 (1): 46–47. doi:10.1016/S0165-6147(00)01607-2. PMID 11165672.
- ^ Barondes SH (2003). Better Than Prozac. New York: Oxford University Press. pp. 21–22, 39–40. ISBN 978-0-19-515130-5.
- ^ Lee H, Dellatore SM, Miller WM, Messersmith PB (October 2007). "Mussel-inspired surface chemistry for multifunctional coatings". Science. 318 (5849): 426–30. Bibcode:2007Sci...318..426L. doi:10.1126/science.1147241. PMC 2601629. PMID 17947576.
- ^ a b Dreyer DR, Miller DJ, Freeman BD, Paul DR, Bielawski CW (2013). "Perspectives on poly(dopamine)". Chemical Science. 4 (10): 3796. doi:10.1039/C3SC51501J.
- ^ a b c d e Lynge ME, van der Westen R, Postma A, Städler B (December 2011). "Polydopamine—a nature-inspired polymer coating for biomedical science" (PDF). Nanoscale. 3 (12): 4916–28. Bibcode:2011Nanos...3.4916L. doi:10.1039/c1nr10969c. PMID 22024699. Archived from the original on 7 March 2014.
- ^ Fichman G, Schneider JP (March 2021). "Dopamine Self-Polymerization as a Simple and Powerful Tool to Modulate the Viscoelastic Mechanical Properties of Peptide-Based Gels". Molecules. 26 (5): 1363. doi:10.3390/molecules26051363. PMC 7961423. PMID 33806346.