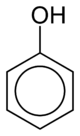
페놀
Phenol| | |||
| | |||
 | |||
| 이름 | |||
|---|---|---|---|
| 우선 IUPAC 이름 페놀[1] | |||
| 시스템 IUPAC 이름 벤제놀 | |||
| 기타 이름 카르본산 페닐산 히드록시벤젠 페닌산 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 체비 | |||
| 첸블 | |||
| 켐스파이더 | |||
| 드러그뱅크 | |||
| ECHA 정보 카드 | 100.003.303 | ||
| 케그 | |||
PubChem CID | |||
| RTECS 번호 |
| ||
| 유니 | |||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| C6H6O | |||
| 몰 질량 | 94.140 g/140 | ||
| 외모 | 투명한 결정성 고체 | ||
| 냄새 | 스위트 앤 타리 | ||
| 밀도 | 1.07 g/cm3 | ||
| 녹는점 | 40.5°C(104.9°F, 313.6K) | ||
| 비등점 | 181.7°C(359.1°F, 454.8K) | ||
| 8.3g/100mL(20°C) | |||
| 로그 P | 1.48[2] | ||
| 증기압 | 0.4mmHg(20°C)[3] | ||
| 산도(pKa) |
| ||
| 켤레 기저 | 페녹사이드 | ||
| UV-vis (µmax) | 270.75 nm[5] | ||
| 1.224 D | |||
| 약리학 | |||
| C05BB05 (WHO) D08AE03 (WHO), N01BX03 (WHO), R02AA19 (WHO) | |||
| 위험 요소 | |||
| GHS 라벨링: | |||
   [6] [6] | |||
| H301, , , , , , | |||
| P261, , , , , | |||
| NFPA 704(파이어 다이아몬드) | |||
| 플래시 포인트 | 79 °C (174 °F, 352 K) | ||
| 폭발 한계 | 1.8~8.[3]6% | ||
| 치사량 또는 농도(LD, LC): | |||
LD50(중간선량) |
| ||
LDLo(최저 공개) |
| ||
LC50(중간 농도) |
| ||
| NIOSH(미국 건강 노출 제한): | |||
PEL(허용) | TWA 5ppm(19mg/m3) [피부][3] | ||
REL(권장) |
| ||
IDLH(즉시 위험) | 250ppm[3] | ||
| 안전 데이터 시트(SDS) | [2] | ||
| 관련 화합물 | |||
관련 화합물 | 티오페놀 페녹시드나트륨 | ||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
페놀은 분자식이65 CHOH인 방향족 유기 화합물이다.그것은 휘발성이 있는 하얀 결정성 고체이다.이 분자는 히드록시기(-OH)에 결합된 페닐기65(-CH)로 구성됩니다.약한 산성으로 화학적 화상을 일으킬 수 있기 때문에 취급에 주의가 필요합니다.
페놀은 콜타르에서 처음 추출되었지만, 오늘날에는 석유에서 유래한 원료로 대량(연간 약 70억 kg) 생산되고 있다.그것은 많은 물질과 유용한 [8]화합물의 선구자로서 중요한 산업 상품이다.주로 플라스틱 및 관련 재료를 합성하는 데 사용됩니다.페놀과 그 화학 유도체는 폴리카보네이트, 에폭시, 베이클라이트, 나일론, 세제, 페녹시 제초제와 같은 제초제, 그리고 수많은 제약 약물의 생산에 필수적입니다.
특성.
페놀은 물에 잘 녹는 유기화합물로 약 84.2g이 1000mL(0.895M)에 용해된다.페놀과 페놀에서 물의 균질 혼합은 2.6 이상일 수 있다.페놀의 나트륨 소금인 페녹시드 나트륨은 수용성이 훨씬 더 높습니다.
산도
페놀은 약한 산이다.pH 범위 ca. 8 - 12의 수용액에서 페놀레이트 음이온65− CHO(페녹시드라고도 함)[9]와 평형 상태에 있다.
- CHOH65 cho65− CHO + H+
페놀은 지방족 알코올보다 더 산성이다.pKa의 차이는 페녹시드 음이온의 공진 안정화에 기인한다.이와 같이 산소에 대한 음전하는 파이계를 [10]통해 오르토 및 파라 탄소 원자에 대해 디국재화된다.또 다른 설명은 시그마 프레임워크를 포함하며, 지배적인 효과가 보다2 전기음성 sp 혼성 탄소로부터의 유도라고 가정한다. sp2 시스템에 의해 제공되는3 전자 밀도의 상대적으로 더 강력한 유도 인출은 sp 시스템에 비해 옥시 음이온의 큰 안정화를 가능하게 한다.두 번째 설명을 뒷받침하는 것으로, 물 속의 아세톤 에놀의 pK는a 10.9로, 페놀(pKa 10.0)[11]보다 산도가 약간 낮다.따라서 아세톤 에놀라트에 비해 페녹사이드에 사용할 수 있는 공명 구조의 수가 많은 것은 페녹사이드의 안정화에 거의 기여하지 않는 것으로 보인다.그러나 용매화 효과가 제외되면 상황이 달라진다.공진 안정화를 허용하거나 제외하는 구성에서 페놀과 시클로헥산올의 비닐로그의 기상 산성도에 대한 최근의 실리코 비교는 다음과 같은 추론을 이끈다.페놀의 산도 증가의 1⁄3은 유도효과에 기인하며, 나머지 차이는 [12]공명이 차지한다.
수소 결합
피리딘, 디에틸에테르 및 황화디에틸 등의 광범위한 루이스 염기를 가진 사염화탄소 및 알칸 용제 페놀 수소 결합.부가물 형성의 엔탈피와 부가물 형성에 따른 –OH IR 주파수 이동이 [13]연구되었다.페놀은 E = 2.27, CA = 1.07인A ECW 모델의 C/E 비율에 적합한 경산으로 분류된다.다른 루이스산 대비 일련의 염기에 대한 페놀의 상대 수용체 강도는 C-B [14][15]플롯으로 설명할 수 있다.
페녹시드 음이온
페녹시드 음이온은 카르보니온 또는 3차 아민에 [16]필적하는 친핵성을 가진 강한 친핵성입니다.이것은 산소 또는 탄소 부위에서 대기성 친핵체로 반응할 수 있다(HSAB 이론 참조).일반적으로 페녹시드 음이온의 산소 공격이 동역학적으로 선호되며, 탄소 공격이 열역학적으로 선호된다(열역학 대 운동 반응 제어 참조).혼합산소/탄소 공격 및 이에 의해 반응 속도가 확산 [17]제어에 도달하면 일반적으로 선택성 상실이 관찰된다.
호변이성
페놀은 불안정한 케토호토머 시클로헥사디에논과 함께 케토에놀 호변이성(tautomerism)을 보이지만 케토 형태로는 페놀의 극히 일부만이 존재한다.엔올라이제이션의 평형 상수는 약 10으로−13,[18] 10조 분자의 1개당 1개만 케토 형태이다.C=C 결합을 C=O 결합으로 교환함으로써 얻을 수 있는 소량의 안정성은 방향족 상실로 인한 큰 불안정성으로 상쇄될 수 있습니다.따라서 페놀은 본질적으로 완전히 에놀 [19]형태로 존재한다. 4, 4' 치환된 시클로헥사디엔은 산성 조건에서 디에논-페놀 전위 과정을 거쳐 안정적인 3,4' 치환된 페놀을 [20]형성할 수 있다.
페녹시드는 방향족에 의해 안정화된 에놀레이트이다.정상적인 상황에서 페녹시드는 산소 위치에서 더 반응하지만 산소 위치는 "하드" 친핵성인 반면 알파-탄소 위치는 "부드러운"[21] 경향이 있다.
반응
페놀은 친전자성 방향족 치환에 대해 반응성이 매우 높다.친핵성 강화는 O에서 고리로 파이 전자 밀도를 공급하기 때문이다.할로겐화, 아실화, 술폰화 및 관련 프로세스를 통해 많은 그룹을 링에 부착할 수 있습니다.페놀 고리는 매우 강하게 활성화되어 브롬화 및 염소화 리드가 쉽게 [22]다치환된다.페놀은 상온에서 묽은 질산과 반응하여 2-니트로페놀과 4-니트로페놀의 혼합물을 생성하는 한편, 농축 질산과 함께 추가 니트로기를 도입하여 예를 들어 2,4,6-트리니트로페놀을 얻는다.
페놀 수용액은 약산성이며 파란색 리트머스가 약간 빨간색으로 변한다.페놀은 페놀산나트륨이나 페놀라트를 형성하는 수산화나트륨에 의해 중화되지만 탄산보다 약한 페놀은 중탄산나트륨이나 탄산나트륨에 의해 중화되지 않아 이산화탄소가 방출된다.
- CHOH65 + NaOH → CHUNa65 + HO2
희박한 수산화나트륨 용액 하에서 페놀과 염화벤조일의 혼합물을 흔들면 벤조산페닐이 형성된다.다음은 쇼텐-바우만 반응의 예입니다.
- CHCOCl65 + HOCH65 → CHCOCH65265 + HCl
페놀은 아연 가루와 함께 증류되거나 증기가 400°[23]C에서 아연의 과립 위를 통과할 때 벤젠으로 환원됩니다.
- CHOH65 + Zn → CH66 + ZnO
페놀을 삼불화붕소(BF3)의 존재 하에서 디아조메탄으로 처리하면 애니솔을 주산물로, 질소가스를 부산물로 얻는다.
- CHOH65 + CHN22 → CHOCH653 + N2
페놀이 염화철(III) 용액과 반응하면 강렬한 보라색 용액이 형성된다.
생산.
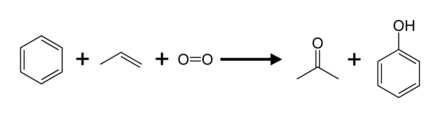
페놀의 상업적 중요성 때문에 그 생산을 위한 많은 방법들이 개발되었지만, 쿠멘 공정이 지배적인 기술이다.
쿠멘법
생산의 95%(2003년)를 차지하는 것은 Hock 공정이라고도 불리는 Cumene 공정입니다.이것은 Hock [8]재배열을 통해 쿠멘(이소프로필벤젠)의 부분 산화를 수반한다: 다른 대부분의 공정과 비교하여 쿠멘 공정은 비교적 가벼운 조건과 비교적 저렴한 원료를 사용한다.공정의 경제성을 높이려면 페놀과 아세톤 부산물이 [24][25]모두 수요가 있어야 합니다.2010년에 아세톤에 대한 전 세계 수요는 약 670만 톤이었으며, 이 중 83%는 쿠멘 공정으로 생산된 아세톤에 만족했다.
쿠멘 공정과 유사한 경로는 시클로헥실벤젠에서 시작한다.이는 쿠멘 하이드로페옥시드의 생성과 유사하게 하이드로페옥시드로 산화된다.Hock 전위를 통해 시클로헥실벤젠 하이드로페옥시드를 분해하여 페놀과 시클로헥사논을 얻는다.시클로헥사논은 일부 나일론의 [26]중요한 전구체이다.
벤젠과 톨루엔의 산화
벤젠을 페놀로 직접 산화시키는 것은 이론적으로 가능하며 매우 흥미롭지만 상용화되지는 않았습니다.
- CH66 + O → CHOH65
아산화질소는 잠재적으로 "녹색" 산화제로 O보다2 더 강력한 산화제이다.그러나 아산화질소를 생성하는 경로는 여전히 [27][24][26]경쟁력이 없습니다.
교류전류를 이용한 전기합성은 [28]벤젠으로부터 페놀을 얻는다.
Dow Chemical에서 개발한 톨루엔의 산화는 녹은 벤조산나트륨과 공기의 구리 촉매 반응을 수반합니다.
- CHH653 + 2 O2 → CHOH65 + CO22 + HO
이 반응은 벤조일살리실산염의 [8]형성을 통해 진행되도록 제안되었다.
오래된 방법
초기 방법은 석탄 유도체로부터 페놀을 추출하거나 벤젠 유도체의 가수 분해에 의존했다.
벤젠술폰산 가수분해
1900년대 초 바이엘과 몬산토가 개발한 초기 상업 경로는 강력한 염기와 벤젠술폰산의 반응으로 시작한다.변환은 다음과 같은 이상적인 [29]방정식으로 표현됩니다.
- CHSOH653 + 2 NaOH → CHOH65 + NaSO23 + HO2
클로로벤젠 가수분해
클로로벤젠은 염기(Dow 공정) 또는 증기(Raschig-)를 사용하여 페놀로 가수분해될 수 있다.후커 프로세스):[25][26][30]
- CHCl65 + NaOH → CHOH65 + NaCl
- CHCl65 + HO2 → CHOH65 + HCl
이러한 방법들은 클로로벤젠의 비용과 염화물을 제품별로 처분해야 하는 필요성 때문에 어려움을 겪는다.
석탄 열분해
페놀은 석탄 [30]열분해의 회수 가능한 부산물이기도 하다.Lummus 공정에서는 톨루엔에서 안식향산으로의 산화를 별도로 실시한다.
기타 방법
페닐디아조늄염은 페놀로 가수분해된다.그 방법은 선행기술이 [31]비싸서 상업적인 관심이 없다.
사용하다
페놀의 주요 용도는 생산량의 3분의 2를 소비하며, 플라스틱의 전구체로 전환하는 것이다.아세톤과의 축합은 폴리카보네이트 및 에폭시드 수지의 핵심 전구체인 비스페놀-A를 생성한다.페놀, 알킬페놀 또는 디페놀을 포름알데히드로 응축하면 페놀 수지가 생성되는데, 그 중 유명한 것이 베이클라이트이다.페놀의 부분 수소화는 나일론의 전구체인 시클로헥사논을 생성한다.비이온성 세제는 페놀의 알킬화에 의해 제조되어 알킬페놀, 예를 들어 노닐페놀을 얻을 수 있으며, 이들 알킬페놀은 에톡실화된다.[8]
페놀은 또한 아스피린뿐만 아니라 많은 제초제와 제약 약품들을 포함한 많은 약품들의 다재다능한 선구자이다.
페놀은 조직 또는 세포 배양 샘플로부터 핵산을 얻기 위해 분자 생물학에서 사용되는 액체-액체-페놀-클로로포름 추출 기술의 성분이다.용액의 pH에 따라 DNA 또는 RNA 중 하나를 추출할 수 있다.
의료의
페놀은 방부제로 널리 사용된다.이 용도는 Joseph Lister에 의해 개척되었습니다(이력 섹션 참조).
1900년대 초반부터 1970년대까지 그것은 탄수화물 비누의 생산에 사용되었다.농축 페놀 액체는 일반적으로 화학적 매트릭스 절제술로 알려진 내향 발가락과 손가락 손톱의 영구적인 치료에 사용됩니다.이 절차는 1945년 오토 볼에 의해 처음 기술되었다.그 이후로 그것은 족부암 전문의들에 의해 행해지는 화학적 기질학에서 선택되는 화학물질이 되었다.
농축액체페놀은 전신마취 또는 다른 국소마취의 대안으로 근막절개 및 고막절개 튜브 배치와 같은 이비인후과 시술에 국소마취제로 국소마취로 사용될 수 있다.또한 지혈 및 방부 기능을 갖추고 있어 이러한 용도에 이상적입니다.
페놀 스프레이는 보통 1.4% 페놀을 유효성분으로 하며 [33]인후염 치료에 의학적으로 사용된다.그것은 클로로라제틱 스프레이, TCP, [34]카르멕스와 같은 일부 경구 진통제의 활성 성분이다.
틈새 용도
페놀은 매우 저렴해서 많은 소규모 사용을 유도한다.에폭시, 폴리우레탄 및 기타 내화학성 코팅 제거를 [35]위해 항공 산업에서 사용되는 산업용 페인트 스트리퍼의 구성요소입니다.
페놀 유도체는 자외선 차단제,[36][37] 헤어 착색제, 피부 미백제 등의 화장품 제조에 사용되어 왔다.하지만, 안전상의 우려 때문에, 페놀은 유럽연합과[38][39] [40][41]캐나다에서 화장품에 사용하는 것이 금지되어 있다.
역사
페놀은 1834년 콜타르에서 [42]추출한 (불순한 형태로) 프리들립 페르디난드 룬지에 의해 발견되었습니다.페놀 "카르볼새레"(석탄-기름산, 카볼산)라고 불리는 런지.콜타르는 석유화학 산업이 발달할 때까지 주요 공급원으로 남아있었다.1841년 프랑스 화학자 오귀스트 로랑은 순수한 형태로 [43]페놀을 얻었다.
1836년, 오귀스트 로랑은 [44]벤젠을 뜻하는 "phene"이라는 이름을 만들었습니다; 이것은 "페놀"과 "페닐"이라는 단어의 어근입니다.1843년, 프랑스의 화학자 찰스 게르하르트는 "페놀"[45]이라는 이름을 만들었다.
페놀의 방부 특성은 조지프 리스터 경(1827–1912)에 의해 방부 수술의 선구적인 기술에 사용되었습니다.리스터는 상처 자체를 깨끗이 씻어야 한다고 결심했다.그리고 나서 그는 상처를 페놀로 덮인 헝겊 조각이나[46] 보풀, 또는 그가 말하는 카볼산으로 덮었다.페놀에 대한 지속적인 노출로 인한 피부 자극은 결국 수술에 무균(독성) 기술의 도입으로 이어졌다.
조지프 리스터는 로버트 리스턴 밑에서 런던 유니버시티 칼리지의 학생이었고, 후에 글래스고 왕립 의무실에서 외과의사 계급으로 올라갔다.리스터는 다양한 생물학적 배지를 살균하는 동시대의 루이스 파스퇴르의 작업과 실험을 연구한 후 탄수화물로 덮인 천으로 실험을 했다.리스터는 파스퇴르의 실험에서 요구되는 열로는 할 수 없는 살아있는 상처를 소독하는 방법을 찾도록 영감을 받았습니다.파스퇴르의 연구를 조사하면서, 리스터는 환자들이 세균에 의해 죽임을 당하고 있다는 그의 이론을 종합하기 시작했다.그는 세균을 죽이거나 예방할 수 있다면 감염이 발생하지 않을 것이라는 이론을 세웠다.리스터는 화학물질이 [47]감염을 일으키는 미생물을 파괴하는 데 사용될 수 있다고 추론했다.
한편, 영국 칼라일에서, 관계자들은 하수구 웅덩이 냄새를 줄이기 위해 카볼산을 사용하는 하수 처리 방법을 실험하고 있었다.이러한 개발 소식을 듣고 이전에 방부 목적으로 다른 화학 약품을 실험했지만 별다른 성과가 없었던 리스터는 상처 방부제로 탄수화물을 시험해 보기로 결심했다.그는 1865년 8월 12일, 환자를 처음 접견했습니다: 11세 소년이 그의 아랫다리 피부를 관통한 정강이뼈 골절상을 입었습니다.보통은 절단만이 유일한 해결책입니다.하지만 리스터는 탄수화물을 먹기로 결심했다.리스터는 뼈를 세팅하고 부목을 이용해 다리를 지탱한 뒤 깨끗한 면 타월을 원탄산에 담가 상처 부위에 바른 뒤 은박지 층을 덮어 나흘 동안 방치했다.그가 상처를 확인했을 때, 리스터는 탄산에 의한 가벼운 화상으로 인한 상처 가장자리 근처가 붉어졌을 뿐, 감염의 징후를 발견하지 못해 기분 좋게 놀랐다.희석된 탄수화물로 된 새로운 붕대를 다시 감은 후, 소년은 약 [48]6주간의 치료 후에 집으로 걸어갈 수 있었다.
1867년 3월 16일, Lancet에 리스터의 연구 결과가 발표되었을 때, 그는 그의 새로운 방부법을 사용하여 총 11명의 환자를 치료했다.그 중 한 명만 사망했고, 그건 리스터의 상처 치료 기술과 무관한 합병증으로 인한 것입니다.처음으로 복합골절 환자가 팔다리를 다치지 않고 퇴원할 가능성이 높았습니다
- - Richard Hollingham, 혈액과 내장: 수술의 역사, 페이지 62[48]
병원에 방부 수술이 도입되기 전에는 35건의 수술에서 16명이 사망했다.거의 두 명 중 한 명의 환자가 죽었다.1865년 여름 방부수술이 도입된 후 40건 중 6건만 사망했습니다.사망률은 거의 50%에서 약 15%로 떨어졌다.그것은 놀라운 성과였다.
- - Richard Hollingham, 혈액과 내장: 수술의 역사, 페이지 63[49]
페놀은 19세기 런던에서 인플루엔자와 다른 질병으로부터 보호하기 위해 판매된 비효율적인 장치인 카볼 스모크 볼의 주요 성분이었고 유명한 법률 소송의 주제였다.
제2차 세계 대전
아래에서 논의되는 페놀의 독성 효과는 인간과 동물 모두에게 갑작스런 붕괴와 의식 상실을 야기합니다; 중추 [50]신경계에 의해 통제되는 운동 활동 때문에 경련 상태가 이러한 증상들에 선행합니다.페놀 주사는 제2차 세계대전 [51]당시 나치 독일에 의해 개인 처형 수단으로 사용되었다.그것은 1939년 나치에 의해 Aktion T4 안락사 [52]프로그램의 일부로 사용되었습니다.독일인들은 희생자들에게 페놀을 주사함으로써 소규모 집단을 박멸하는 것이 더 경제적이라는 것을 알게 되었다.페놀 주사는 수천 명의 사람들에게 투여되었다.막시밀리안 콜베도 아우슈비츠에서 2주간의 탈수와 굶주림에서 살아남은 후 페놀 주사를 맞고 사망했다.약 [53]1그램이면 사망에 충분합니다.
오카렌즈
페놀은 사람의 [50]소변에서 최대 40mg/L의 양으로 배설되는 정상적인 대사산물이다.
수컷 코끼리의 측두샘 분비는 머스트 [54][55]기간 동안 페놀과 4-메틸페놀의 존재를 보였다.
그것은 또한 카스토름에서 발견되는 화합물 중 하나이다.이 화합물은 비버가 [56]먹는 식물에서 섭취된다.
위스키의 발생
페놀은 독특한 Islay 스카치 [57]위스키의 향과 맛에서 측정 가능한 성분으로 일반적으로 30ppm까지이지만 위스키 [58]제조에 사용되는 맥아 보리에는 160ppm 이상 함유될 수 있습니다.이 양은 증류액과 다르고 아마도 더 많을 [57]것이다.
생분해
Cryptanaerobacter phenolicus는 페놀로부터 [59]4-히드록시벤조산염으로 벤조산염을 생산하는 박테리아 종이다.로도코커스 페놀리쿠스는 페놀을 유일한 [60]탄소원으로 분해할 수 있는 박테리아 종이다.
독성
페놀과 그 증기는 눈, 피부, [61]호흡기를 부식시킨다.피부와 점막에 대한 부식 작용은 단백질 변성 [50]작용에 의한 것입니다.페놀과 피부가 반복적으로 또는 장기간 접촉하면 피부염이나 2도 및 3도 화상을 [62]입을 수 있습니다.페놀 증기의 흡입은 폐 [61]부종을 일으킬 수 있다.이 물질은 중추신경계와 심장에 해로운 영향을 미쳐 부정맥, 발작, [63]혼수상태에 이를 수 있다.신장도 영향을 받을 수 있습니다.장기간 또는 반복적인 노출은 간과 [64]신장에 해로운 영향을 미칠 수 있습니다.페놀이 사람에게 [65]암을 유발한다는 증거는 없다.페놀의 소수성 효과 외에도 페놀의 독성에 대한 또 다른 메커니즘은 페녹실 [66]라디칼의 형성일 수 있다.
페놀은 비교적 빨리 피부를 통해 흡수되기 때문에 국소 가성 [50]화상 외에 전신 중독이 발생할 수 있다.다량의 페놀에 의한 흡수성 중독은 피부 면적이 작더라도 발생할 수 있어 중추신경계의 마비와 체온 저하로 빠르게 이어진다.경구 독성에 대한50 LD는 개, 토끼 또는 생쥐의 경우 500mg/kg 미만이며, 사람의 최소 치사량은 140mg/[50]kg이었다.미국 보건복지부 독성물질 및 질병등록국(ATSDR)은 페놀 섭취에 대한 치명적 선량은 1에서 32g [67]사이라고 밝히고 있다.
피부 노출로 인한 화학적 화상은 폴리에틸렌 글리콜,[68] 이소프로필 [69]알코올 또는 많은 양의 [70]물로 씻음으로써 오염을 제거할 수 있습니다.오염된 의류를 제거하고 큰 물거품이 생기면 즉시 병원 치료를 받아야 합니다.이것은 페놀이 클로로포름(분자생물학에서 DNA와 RNA 정화를 위해 일반적으로 사용되는 혼합물)과 혼합된 경우 특히 중요합니다.페놀은 또한 생식 독소로 유산의 위험을 증가시키고 [71]저체중으로 자궁의 발육이 지연됨을 나타낸다.
페놀류
또한 페놀이라는 단어는 6원소 방향족 고리를 포함하는 화합물을 지칭하는 데 사용되며, 하이드록실기(-OH)에 직접 결합됩니다.따라서 페놀은 이 기사에서 설명한 페놀이 가장 단순한 성분인 유기 화합물의 한 종류이다.
「 」를 참조해 주세요.
레퍼런스
- ^ "Front Matter". Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 690. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
Only one name is retained, phenol, for C6H5-OH, both as a preferred name and for general nomenclature.
- ^ "Phenol_msds".
- ^ a b c d e NIOSH Pocket Guide to Chemical Hazards. "#0493". National Institute for Occupational Safety and Health (NIOSH).
- ^ Kütt, Agnes; Movchun, Valeria; Rodima, Toomas; Dansauer, Timo; Rusanov, Eduard B.; Leito, Ivo; Kaljurand, Ivari; Koppel, Juta; Pihl, Viljar; Koppel, Ivar; Ovsjannikov, Gea; Toom, Lauri; Mishima, Masaaki; Medebielle, Maurice; Lork, Enno; Röschenthaler, Gerd-Volker; Koppel, Ilmar A.; Kolomeitsev, Alexander A. (2008). "Pentakis(trifluoromethyl)phenyl, a Sterically Crowded and Electron-withdrawing Group: Synthesis and Acidity of Pentakis(trifluoromethyl)benzene, -toluene, -phenol, and -aniline". The Journal of Organic Chemistry. 73 (7): 2607–20. doi:10.1021/jo702513w. PMID 18324831.
- ^ "Phenol".
- ^ a b c 시그마-알드리치 회사, 페놀2022-02-15에 취득.
- ^ a b c "Phenol". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c d Weber, Manfred; Weber, Markus; Kleine-Boymann, Michael (2004). "Phenol". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_299.pub2.
- ^ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ 유기화학 제2판존 맥머리 ISBN 0-534-07968-7
- ^ "Archived copy" (PDF). Archived from the original (PDF) on 2013-01-30. Retrieved 2007-03-14.
{{cite web}}: CS1 maint: 제목으로 아카이브된 복사(링크) - ^ Pedro J. Silva (2009). "Inductive and Resonance Effects on the Acidities of Phenol, Enols, and Carbonyl α-Hydrogens". J. Org. Chem. 74 (2): 914–916. doi:10.1021/jo8018736. hdl:10284/3294. PMID 19053615.(지원정보에 기재된 아세트알데히드 에놀과 페놀의 상대산도에 대한 용해효과)
- ^ 드라고, 화학자를 위한 물리적 방법(1992년 손더스 칼리지 출판), ISBN 0-03-075176-4
- ^ C. 로렌스와 J-F. 갈.Lewis Basicity and Affinity Scales, Data and Measurement, (Wiley 2010) pp 50-51 ISBN 978-0-470-74957-9
- ^ Cramer, R. E.; Bopp, T. T. (1977). "Graphical display of the enthalpies of adduct formation for Lewis acids and bases". Journal of Chemical Education. 54: 612–613. doi:10.1021/ed054p612. 이 문서에 표시된 플롯은 오래된 매개변수를 사용했습니다.개량된 E&C 파라미터는 ECW 모델에 기재되어 있습니다.
- ^ [1] Mayr의 반응성 파라미터 데이터베이스.2019년 7월 10일 취득.
- ^ Mayer, Robert J.; Breugst, Martin; Hampel, Nathalie; Ofial, Armin R.; Mayr, Herbert (2019-06-26). "Ambident Reactivity of Phenolate Anions Revisited: A Quantitative Approach to Phenolate Reactivities". Journal of Organic Chemistry. 84 (14): 8837–8858. doi:10.1021/acs.joc.9b01485. PMID 31241938. S2CID 195696760.
- ^ Capponi, Marco; Gut, Ivo G.; Hellrung, Bruno; Persy, Gaby; Wirz, Jakob (1999). "Ketonization equilibria of phenol in aqueous solution". Can. J. Chem. 77 (5–6): 605–613. doi:10.1139/cjc-77-5-6-605.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (1st ed.). Oxford University Press. p. 531. ISBN 978-0-19-850346-0.
- ^ Arnold, Richard T.; Buckley, Jay S. (1 May 1949). "The Dienone-Phenol Rearrangement. II. Rearrangement of 1-Keto-4-methyl-4-phenyl-1,4-dihydronaphthalene". J. Am. Chem. Soc. 71 (5): 1781. doi:10.1021/ja01173a071.
- ^ David Y. Curtin & Allan R. Stein (1966). "2,6,6-Trimethyl-2,4-Cyclohexadione". Organic Syntheses. 46: 115. doi:10.15227/orgsyn.046.0115. Archived from the original on 2011-06-05. Retrieved 2010-03-31.
- ^ François Muller, Liliane Caillard (2011). "Chlorophenols". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a07_001.pub2.
{{cite encyclopedia}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ Roscoe, Henry (1891). A treatise on chemistry, Volume 3, Part 3. London: Macmillan & Co. p. 23.
- ^ a b "Phenol -- The essential chemical industry online". 2017-01-11. Retrieved 2018-01-02.
- ^ a b "Direct Routes to Phenol". Archived from the original on 2007-04-09. Retrieved 2007-04-09.
- ^ a b c Plotkin, Jeffrey S. (2016-03-21). "What's New in Phenol Production?". American Chemical Society. Archived from the original on 2019-10-27. Retrieved 2018-01-02.
- ^ Parmon, V. N.; Panov, G. I.; Uriarte, A.; Noskov, A. S. (2005). "Nitrous oxide in oxidation chemistry and catalysis application and production". Catalysis Today. 100 (2005): 115–131. doi:10.1016/j.cattod.2004.12.012.
- ^ Lee, Byungik; Naito, Hiroto; Nagao, Masahiro; Hibino, Takashi (9 July 2012). "Alternating-Current Electrolysis for the Production of Phenol from Benzene". Angewandte Chemie International Edition. 51 (28): 6961–6965. doi:10.1002/anie.201202159. PMID 22684819.
- ^ Wittcoff, H.A., 루벤, B.G. 산업용 유기 화학 물질 투시도제1부: 원료 및 제조.와일리 인터사이언스, 뉴욕 1980년
- ^ a b 프랭크, H.-G. 스타델호퍼, J.W. 산업용 방향족 화학.스프링거-벌러그, 뉴욕, 1988. 페이지 148-155.
- ^ a b Kazem-Rostami, Masoud (2017). "Amine to phenol conversion". Synlett. 28 (13): 1641–1645. doi:10.1055/s-0036-1588180.
- ^ Kaeding, Warren W. (1 September 1964). "Oxidation of Aromatic Acids. IV. Decarboxylation of Salicylic Acids". The Journal of Organic Chemistry. 29 (9): 2556–2559. doi:10.1021/jo01032a016.
- ^ "Phenol spray". drugs.com.
- ^ "How Does Our Lip Balm Work". Carmex. Archived from the original on 18 February 2015. Retrieved 18 February 2015.
- ^ "CH207 Aircraft paintstripper, phenolic, acid" (PDF). Callington. 14 October 2009. Archived from the original (PDF) on 23 September 2015. Retrieved 25 August 2015.
- ^ A. Svobodová; J. Psotová & D. Walterová (2003). "Natural Phenolics in the Prevention of UV-Induced Skin Damage. A Review". Biomed. Papers. 147 (2): 137–145. doi:10.5507/bp.2003.019.
- ^ DeSelms, R. H., UV-Active Phenol 에스테르 화합물, Enigen Science Publishing: 워싱턴 DC, 2008.2011년 10월 3일 Wayback Machine에서 아카이브 완료
- ^ "Prohibited substances in cosmetic product (Annex II, #1175, Phenol) - European Commission". ec.europa.eu. Retrieved 2018-07-06.
- ^ "CosIng - Cosmetics - GROWTH - European Commission". ec.europa.eu. Retrieved 2018-07-06.
- ^ Canada, Health (2004-06-18). "Cosmetic Ingredient Hotlist - Canada.ca". www.canada.ca. Retrieved 2018-07-06.
- ^ Canada, Health (2004-06-18). "Cosmetic Ingredient Hotlist: Prohibited and Restricted Ingredients - Canada.ca". www.canada.ca. Retrieved 2018-07-06.
- ^ F. F. 룽지(1834) "석탄 증류 제품에 대하여" Annalen der Physik und Chemie, 31: 65-78.31권 69쪽에서 룽게는 페놀을 "카르볼소레"(석탄-기름산, 카볼산)라고 명명한다.Runge는 F. F. Runge(1834) "Eber einige Productkte der Steinkhlendillation", Annalen der Physik und Chemie, 31:308-328에서 페놀의 특징을 나타내고 있습니다.
- ^ 오귀스트 로랑 (1841) "Mémoire sur le phényle et ses dérivés"(벤젠 및 그 파생물에 대한 기억), Annales de Chimie et de Ficture, 시리즈 3, 3: 195-228).198페이지에서 로랑은 페놀을 "hydrate de pényle"과 "l'acide pénique"라고 명명합니다.
- ^ 오귀스트 로랑(1836) "Sur la clorophénise et les clorophénisique et clorophénésique", Annales de Chemie et de Feechique, vol. 63, 페이지 27-45 참조: Je donne le nom de phen au radical pondamental des des phécécécécécécécéces (α)(나는 앞의 산의 기본 래디칼에 'phene'(ααδδδ, 조명)이라는 이름을 붙인다. 왜냐하면 벤젠은 조명 가스에서 발견되기 때문이다.)
- ^ 게르하르트, 샤를 (1843) "살리틴의 회고", 아날레스 드 치미에 외 체격, 시리즈 3, 7:215-229.게르하르트는 221페이지에 "페놀"이라는 이름을 붙인다.
- ^ Lister, Joseph (1867). "Antiseptic Principle Of The Practice Of Surgery".
- ^ Hollingham, Richard (2008). Blood and Guts: A History of Surgery. BBC Books - Random House. p. 61. ISBN 9781407024530.
- ^ a b Hollingham, Richard (2008). Blood and Guts: A History of Surgery. BBC Books - Random House. p. 62. ISBN 9781407024530.
- ^ Hollingham, Richard (2008). Blood and Guts: A History of Surgery. BBC Books - Randomhouse. p. 63. ISBN 9781407024530.
- ^ a b c d e "Phenol". Ullmann's Encyclopedia of Industrial Chemistry. Vol. 25. Wiley-VCH. 2003. pp. 589–604.
- ^ 피터 타이슨의 실험.노바
- ^ 나치 의사들은 2017-10-22를 웨이백 머신에 보관, 14장 주사기로 살해:페놀 주사.저자: 로버트 제이 리프턴 박사
- ^ "Killing through phenol injection". Auschwitz: Final Station Extermination. Linz, Austria: Johannes Kepler University. Archived from the original on 2006-11-12.
- ^ Rasmussen, L.E.L; Perrin, Thomas E (1999). "Physiological Correlates of Musth". Physiology & Behavior. 67 (4): 539–49. doi:10.1016/S0031-9384(99)00114-6. PMID 10549891. S2CID 21368454.
- ^ 코끼리에 걸렸어디파 아난스, 동물원의 인쇄 저널, 15(5), 259-262쪽 (기사)
- ^ 비버:라이프와 임팩트Dietland Muller-Schwarze, 2003, 43페이지 (구글북스에서의 책)
- ^ a b "Peat, Phenol and PPM, by Dr P. Brossard" (PDF). Retrieved 2008-05-27.
- ^ "Bruichladdich". Bruichladdich. BDCL. Archived from the original on 21 April 2016. Retrieved 8 August 2015.
- ^ Juteau, P.; Côté, V; Duckett, MF; Beaudet, R; Lépine, F; Villemur, R; Bisaillon, JG (2005). "Cryptanaerobacter phenolicus gen. nov., sp. nov., an anaerobe that transforms phenol into benzoate via 4-hydroxybenzoate". International Journal of Systematic and Evolutionary Microbiology. 55 (Pt 1): 245–50. doi:10.1099/ijs.0.02914-0. PMID 15653882.
- ^ Rehfuss, Marc; Urban, James (2005). "Rhodococcus phenolicus sp. nov., a novel bioprocessor isolated actinomycete with the ability to degrade chlorobenzene, dichlorobenzene and phenol as sole carbon sources". Systematic and Applied Microbiology. 28 (8): 695–701. doi:10.1016/j.syapm.2005.05.011. PMID 16261859.
- ^ a b Budavari, S, ed. (1996). "The Merck Index: An Encyclopedia of Chemical, Drugs, and Biologicals". Whitehouse Station, NJ: Merck.
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ Lin TM, Lee SS, Lai CS, Lin SD (June 2006). "Phenol burn". Burns: Journal of the International Society for Burn Injuries. 32 (4): 517–21. doi:10.1016/j.burns.2005.12.016. PMID 16621299.
- ^ Warner, MA; Harper, JV (1985). "Cardiac dysrhythmias associated with chemical peeling with phenol". Anesthesiology. 62 (3): 366–7. doi:10.1097/00000542-198503000-00030. PMID 2579602.
- ^ 세계보건기구/국제노동기구:국제 화학 안전 카드, http://www.inchem.org/documents/icsc/icsc/eics0070.htm
- ^ U.S. Department of Health and Human Services. "How can phenol affect my health?" (PDF). Toxicological Profile for Phenol: 24.
- ^ Hanscha, Corwin; McKarns, Susan C; Smith, Carr J; Doolittle, David J (June 15, 2000). "Comparative QSAR evidence for a free-radical mechanism of phenol-induced toxicity". Chemico-Biological Interactions. 127 (1): 61–72. doi:10.1016/S0009-2797(00)00171-X. PMID 10903419.
- ^ "Medical Management Guidelines for Phenol (C6H6O)". Agency for Toxic Substances and Disease Registry. U.S. Department of Health and Human Services. October 21, 2014. Retrieved 8 August 2015.
- ^ Brown, VKH; Box, VL; Simpson, BJ (1975). "Decontamination procedures for skin exposed to phenolic substances". Archives of Environmental Health. 30 (1): 1–6. doi:10.1080/00039896.1975.10666623. PMID 1109265.
- ^ Hunter, DM; Timerding, BL; Leonard, RB; McCalmont, TH; Schwartz, E (1992). "Effects of isopropyl alcohol, ethanol, and polyethylene glycol/industrial methylated spirits in the treatment of acute phenol burns". Annals of Emergency Medicine. 21 (11): 1303–7. doi:10.1016/S0196-0644(05)81891-8. PMID 1416322.
- ^ Pullin, TG; Pinkerton, MN; Johnston, RV; Kilian, DJ (1978). "Decontamination of the skin of swine following phenol exposure: a comparison of the relative efficacy of water versus polyethylene glycol/industrial methylated spirits". Toxicol Appl Pharmacol. 43 (1): 199–206. doi:10.1016/S0041-008X(78)80044-1. PMID 625760.
- ^ PubChem. "Phenol". pubchem.ncbi.nlm.nih.gov. Retrieved 2019-03-19.