스테로이드
Steroid
스테로이드는 생물학적으로 활성화된 유기화합물로, 4개의 고리가 특정 분자 형태로 배열되어 있다.스테로이드제는 두 가지 주요한 생물학적 기능을 가지고 있다: 막의 유동성을 변화시키는 세포막의 중요한 구성 요소로서 그리고 신호 분자로서.수백 개의 스테로이드제가 식물, 동물, 곰팡이에서 발견됩니다.모든 스테로이드제는 스테롤 라노스테롤 또는 시클로아르테놀에서 추출된 세포에서 제조된다.라노스테롤과 시클로아르테놀은 트리테르펜 스쿠알렌의 [2]환화로 유도된다.
스테로이드 코어 구조는 일반적으로 17개의 탄소 원자로 구성되어 있으며, 4개의 "융착" 고리에 결합되어 있습니다: 3개의 6개의 멤버 시클로헥산 고리(첫 번째 그림의 A, B 및 C 고리)와 1개의 5개의 멤버 시클로펜탄 고리(D 고리).스테로이드제는 이 4고리 코어에 부착된 기능군과 고리의 산화 상태에 따라 달라집니다.스테롤은 위치 3에 히드록시기가 있고 콜레스탄에서 [1]: 1785f [3]파생된 골격을 가진 스테로이드 형태이다.스테로이드제는 또한 고리 구조의 변화에 의해, 예를 들어 고리 중 하나를 잘라내는 것과 같이, 보다 근본적으로 변형될 수 있다.링 B를 자르면 세코스테로이드가 생성되는데, 그 중 하나가 비타민3 D입니다.
예를 들어 지질 콜레스테롤, 성호르몬 에스트라디올과 테스토스테론,[4]: 10–19 항염증제 덱사메타손 등이 있다.[5]
명명법

스테로이드 또는 사이클로펜타노페로페난트렌으로도 알려진 고난은 가장 단순한 스테로이드이며 모든 스테로이드와 스테롤의 [6][7]핵인 탄소 결합에 있는 17개의 탄소 원자로 구성되어 있으며 3차원 형태로 4개의 융합 고리를 형성한다.세 개의 시클로헥산 고리(첫 번째 그림의 A, B 및 C)는 페넌트렌의 과수 유도체의 골격을 형성합니다.D링은 사이클로펜탄 구조로 되어 있습니다.2개의 메틸기와 8개의 탄소 곁사슬(콜레스테롤에 표시된 것처럼 C-17)이 존재할 때 스테로이드에는 콜레스테롤 골격이 있다고 한다.스테로이드의 두 가지 일반적인 5α 및 5β 입체 이성질체 형태는 탄소-5의 수소(H) 원자가 부착되어 스테로이드 A-링 구조의 변화를 초래하는 대체로 평면 고리 시스템의 측면에 차이가 있기 때문에 존재한다.C-21 측쇄에서의 이성질화는 이소스테로이드라고 [8]하는 병렬 계열의 화합물을 생성한다.
스테로이드 구조의 예는 다음과 같습니다.
합성 코르티코스테로이드제인 덱사메타손
프로게스테론, 여성의 생리 주기, 임신, 태아 발생에 관여하는 스테로이드 호르몬
프로게스테론과 유사한 효과를 가진 합성 의약품인 Medrogestone
링 균열(박리), 팽창 및 수축(박리 및 더 크거나 더 작은 링으로 재접속)과 탄소-탄소 결합 프레임워크의 모든 변화는 다음과 같이 달라질 수 있다.
- 링 내의 채권 순서에서
- 링에 부착된 메틸기 수(및 존재하는 경우 C17의 눈에 띄는 측쇄에 있음),
- 링과 사이드 체인에 부착된 기능군 및
- 링과 [4]: 2–9 체인에 접속된 그룹 설정에서 사용됩니다.
예를 들어 콜레스테롤 및 라노스테롤 등의 스테롤은 C-3 위치에 하이드록실기가 부착되어 있으며, 테스토스테론과 프로게스테론은 C-3에 카르보닐(옥소 치환기)을 가지고 있으며, 이들 중 라노스테롤만이 C-4에 2개의 메틸기를 가지고 있으며, 콜레스테롤(C-5~C-6의 이중결합을 가진)과 테스토스테론이 다르다.C-5 이중 결합).
 일반적인 스테로이드 코어인 5α-콜레스탄 |
종 분포 및 기능
이 섹션은 약리학 전문가의 주의가 필요하다.구체적인 문제는 이 섹션과 다음 섹션(및 전체)을 검토하여 나열된 콘텐츠의 중복을 제거하고 나열된 콘텐츠의 소싱을 확인하는 것입니다. 약리학은 이 될 수 . (2017년 3월) |
진핵생물에서 스테로이드제는 곰팡이, 동물, 식물에서 발견됩니다.
곰팡이 스테로이드
곰팡이 스테로이드는 곰팡이 세포막의 무결성을 유지하는 데 관여하는 에르고스테롤을 포함한다.암포테리신 B와 아졸 항진균제와 같은 다양한 항진균제들은 병원성 곰팡이를 [9]죽이기 위해 이 정보를 이용한다.균류는 에르고스테롤을 [10]표적으로 하는 약물에 대한 내성을 발달시키기 위해 에르고스테롤 함유량을 변경할 수 있다(예를 들어 ERG3 또는 ERG6 효소의 기능 돌연변이 손실, 에르고스테롤 함유량 감소를 유도하는 돌연변이).에르고스테롤은 동물(사람 포함)의 세포막에서 발견되는 콜레스테롤이나 [10]식물의 세포막에서 발견되는 피토스테롤과 유사하다.모든 버섯에는 건조 [10]중량 100그램 당 수십에서 수백 밀리그램의 에르고스테롤이 다량 함유되어 있습니다.산소는 [10]곰팡이에서 에르고스테롤의 합성에 필요하다.에르고스테롤은 버섯에서 발견되는 비타민 D의 함량을 담당한다; 에르고스테롤은 자외선에 [10]노출됨으로써 화학적으로 프로비타민 D2로 변환된다.프로비타민 D2는 자연적으로 비타민 D2를 [10]형성한다.그러나, 모든 균류가 세포막에서 에르고스테롤을 사용하는 것은 아니다. 예를 들어 병원성 진균종인 폐렴구스티스 지로베치는 그렇지 않다. 이는 중요한 임상적 의미를 갖는다(많은 항진균제의 [10]작용 메커니즘을 고려할 때).예를 들어 사카로미세스 세레비시아균을 사용하는 다른 주요 스테로이드에는 에르고스타55,7,22,24(28)tet테트라33βolol, 지모스테롤 [10]및 라노스테롤이 포함된다.S. cerevisiae는 [10]세포막에서 에르고스테롤 대신 5,6µ디히드로에르고스테롤을 사용한다.
동물 스테로이드
동물 스테로이드제는 척추동물과 곤충 기원의 화합물을 포함하며, 후자는 엑디스테론과 같은 엑디스테로이드를 포함한다.척추동물의 예로는 스테로이드 호르몬과 콜레스테롤이 있다; 후자는 세포막의 유동성을 결정하는 데 도움을 주는 세포막의 구조적 구성 요소이며 플라크의 주요 구성 요소이다.스테로이드 호르몬에는 다음이 포함된다.
- 성호르몬은 성별 차이에 영향을 미치고 번식을 돕는다.이것들은 안드로겐, 에스트로겐, 그리고 프로게스토겐을 포함한다.
- 대부분의 합성 스테로이드 약물을 포함한 코르티코스테로이드, 천연물 등급의 글루코코르티코이드(대사와 면역 기능의 많은 측면을 조절하는) 및 미네랄코르티코이드(혈액량을 유지하고 전해질의 신장 배설을 제어하는 데 도움이 됨)
- 근육과 뼈의 합성을 증가시키기 위해 안드로겐 수용체와 상호작용하는 천연 및 합성 동화 스테로이드.일반적으로 "스테로이드"라는 용어는 종종 동화성 스테로이드와 관련이 있습니다.
식물 스테로이드
식물 스테로이드에는 Solanaceae와[11] Melanthiaceae(특히 [12]Veratrum속), 심장 배당체,[13] 피토스테롤 및 브라시노스테로이드(여러 식물 호르몬 포함)에서 발견되는 스테로이드 알칼로이드가 포함된다.
원핵생물
이 섹션은 비우핵성 유형 스테롤 프레임워크에 대한 정보가 누락되어 있습니다. PMID 27446030, 그림 4/5, 그룹 1 옥도스퀄렌 사이클라아제 참조.(2021년 11월) |
원핵생물에서 생합성 경로는 진핵생물으로부터의 기원이 추측되는[15] 4환식 스테로이드 프레임워크(예를 들어 마이코박테리아)[14]와 더 일반적인 [16]5환식 트리테르피노이드 호파노이드 프레임워크에 대해 존재한다.
종류들
기능별
스테로이드 호르몬의 주요 등급은 주요 구성원과 관련 기능의 예를 포함한다.[citation needed]
스테로이드제의 추가 등급은 다음과 같다.
- 및 알로프로닌올론 등의 신경스테로이드
- 타우로콜산 등의 담즙산
- 브롬화 판쿠로늄 등의 아미노스테로이드 신경근 차단제(주로 합성)
- 아세트산 시프로테론 등의 스테로이드 항안드로겐(주로 합성)
- 알파트라디올과 같은 스테로이드 생성 억제제(주로 외인성)
- 콜레스테롤, 에르고스테롤, 각종 피토스테롤 등의 막스테롤
- 스테로이드 사포닌, 카르데놀라이드/카르디악 배당체 등의 독소
또한 다음과 같은 종류의 세코스테로이드(열린 고리 스테로이드)도 있습니다.
구조별
온전한 링 시스템
스테로이드제는 화학성분에 [17]따라 분류할 수 있다.MeSH가 이 분류를 수행하는 방법의 한 예는 Wikipedia MeSH 카탈로그에서 확인할 수 있습니다.이 분류의 예는 다음과 같습니다.

| 학급 | 예 | 탄소 원자수 |
|---|---|---|
| 콜레스탄 | 콜레스테롤 | 27 |
| 코란스 | 콜산 | 24 |
| 프레그네 | 프로게스테론 | 21 |
| 안드로스타네스 | 테스토스테론 | 19 |
| 에스트라네스 | 에스트라디올 | 18 |
생물학에서, 호르몬을 언급할 때 존재하는 탄소 원자의 수에 의해 위의 스테로이드 등급의 이름을 짓는 것이 일반적이다: 에스트란18(대부분 에스트로겐), 안드로겐19(대부분 안드로겐), 그리고 임신21(대부분 코르티코스테로이드)[18]을 위한 C-스테로이드.17-케토스테로이드라는 분류도 의학에서 중요하다.
고난(스테로이드 핵)은 알킬 곁사슬이 [19]없는 모체 17-탄소 4환 탄화수소 분자이다.
절단, 수축 및 팽창 링
세코스테로이드(라틴어 seco, "절단")는 부모 스테로이드 고리(일반적으로 4개 중 하나)의 절단(절단)에서 생합성 또는 개념적으로 발생하는 스테로이드 화합물의 하위 분류이다.주요 세코스테로이드 서브클래스는 이 절단이 발생한 스테로이드 탄소 원자에 의해 정의된다.예를 들어 시제품인 세코스테로이드 콜레칼시페롤(그림시3)은 9,10-세코스테로이드 서브클래스이며 스테로이드 B-링의 탄소원자 C-9 및 C-10의 분할에서 유래한다. 5,6-세코스테로이드와 13,14-스테로이드도 [20]유사하다.
노르스테로이드(nor-, L. norma; 화학에서 "정상"[21]으로 탄소 제거를 나타냄)와 호모스테로이드(homo-, 그리스 호모, "동일"로 탄소 첨가를 나타냄)는 생합성 단계에서 형성되는 스테로이드의 구조적 하위 분류이다.전자는 효소 고리 팽창 수축 반응을 수반하며, 후자는 부모 스테로이드 [22]프레임워크보다 더 많은(또는 더 적은) 고리 원자를 가진 비순환 전구체의 고리 폐쇄를 통해 달성된다.
이러한 링의 변경의 조합은 본질적으로 알려져 있습니다.예를 들어, 콘릴리를 방목하는 에우는 원래의 C-13 원자의 생합성 이동을 통해 각각 C-링과 D-링이 수축 및 팽창하는 스테로이드 서브 패밀리 중 2종인 사이클로파민(표시)과 베라트라민을 섭취한다.이러한 C-nor-D-호모스테로이드를 섭취하면 어린 양의 선천성 기형을 초래한다: 시클로파민으로부터 사이클로피아, [23]베라트라민으로부터 다리 기형을.또한 C-nor-D-호모스테로이드(나키테피오신)는 예를 들어 Terpios Hoshinota와 같은 오키나와 시아노박터균에 의해 배설되어 흑산호병에 [24]의한 산호사망으로 이어진다.나키테르피오신형 스테로이드는 다수의 [citation needed]암에서 과잉 활성인 경로인 평활화 및 고슴도치 단백질을 포함하는 신호 경로에 대해 활성이다.
생물학적 의의
스테로이드와 그들의 대사물은 종종 신호 전달 분자로 기능하고 스테로이드와 인지질은 세포막의 [25]구성요소이다.콜레스테롤과 같은 스테로이드제는 막의 [26]유동성을 감소시킨다.지질과 마찬가지로 스테로이드제는 고농축 에너지 저장고입니다.하지만, 그것들은 전형적인 에너지원이 아닙니다; 포유류의 경우, 그것들은 일반적으로 대사되고 배설됩니다.
스테로이드제는 종양 안팎의 [27]스테로이드 생산이 암세포의 공격성을 촉진하는 전립선암과 같은 악성종양을 포함한 많은 질환에서 중요한 역할을 한다.
및
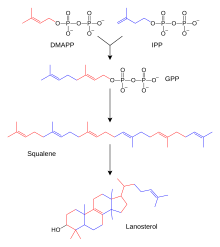
동물, 곰팡이, 그리고 식물에서 발견되는 수백 개의 스테로이드들은 라노스테롤이나 시클로아르테놀로 만들어진다.라노스테롤과 시클로아르테놀은 모두 트리테르페노이드 스쿠알렌의 [2]고리화에서 유래한다.라노스테롤과 사이클로아르테놀은 다른 모든 스테로이드제의 시작 화합물 역할을 하기 때문에 때때로 프로토스테롤이라고 불립니다.
스테로이드 생합성은 단순한 전구체로부터 스테로이드를 생성하는 동화 경로이다.동물에서는 (다른 많은 유기체와 비교하여) 독특한 생합성 경로를 따르며, 이 경로는 항생제 및 기타 항감염제의 공통 표적이 된다.인간의 스테로이드 대사 또한 스타틴과 같은 콜레스테롤을 낮추는 약물의 대상이다.인간과 다른 동물에서 스테로이드 생합성은 아세틸-CoA를 디메틸알릴 이인산염(DMAPP)과 이소펜테닐 이인산염(IPP)[28][better source needed]의 구성 요소로 사용하는 메발론산 경로를 따른다.
후속 공정에서 DMAPP와 IPP는 결합하여 파르네실 이인산(FPP)을 형성하고, 이 둘은 더욱 결합하여 선형 트리테르페노이드 스쿠알렌을 형성한다.스쿠알렌 생합성은 스쿠알렌/피토엔 합성효소 계열에 속하는 스쿠알렌 합성효소에 의해 촉매된다.스쿠알렌의 후속 에폭시화 및 사이클화는 라노스테롤을 생성하며, 이는 다른 스테로이드(스테로이드 형성)[29]로의 추가 수정의 시작점이다.다른 진핵생물에서는 에폭시화 스쿠알렌(옥시도스쿠알렌)의 환화생물이 시클로아르테놀이다.
메발론산 경로(HMG-CoA 환원효소 경로라고도 함)는 아세틸-CoA로 시작하여 디메틸알릴 이인산(DMAPP)과 이소펜테닐 이인산(IPP)으로 끝납니다.
DMAPP와 IPP는 테르펜과 이소프레노이드[30](카로티노이드를 포함하고 식물 천연물의 [31]가장 큰 클래스를 형성하는 지질)를 형성하기 위해 조립되고 변형된 이소프레네 단위를 기증합니다.여기서 이소프렌 유닛을 결합하여 스쿠알렌을 만들고, 한 쌍의 링으로 접어서 [32]라노스테롤을 만든다.라노스테롤은 콜레스테롤과 에르고스테롤과 [32][33]같은 다른 스테로이드로 바뀔 수 있다.
두 가지 종류의 약물이 메발론산 경로를 표적으로 합니다: 높아진 콜레스테롤 [34]수치를 줄이기 위해 사용되는 스타틴(로스바스타틴)과 많은 뼈 퇴행성 질병을 치료하기 [35]위해 사용되는 비스포네이트(조레드로네이트)입니다.
스테로이드 생성
스테로이드 생성은 콜레스테롤로부터 스테로이드가 생성되어 다른 [37]스테로이드로 바뀌는 생물학적 과정이다.스테로이드 형성의 경로는 종마다 다르다.스테로이드 호르몬의 주요 종류는 위에서 언급한 바와 같이 프로게스토겐,[38][citation needed] 코르티코스테로이드, 안드로겐, 에스트로겐이다.이러한 등급의 인간 스테로이드 형성은 여러 위치에서 발생합니다.
- 프로게스토겐은 다른 모든 인간 스테로이드들의 전구체이고 스테로이드를 생성하는 모든 인간 조직은 먼저 콜레스테롤을 프레그네놀론으로 전환시켜야 합니다.이 전환은 스테로이드 합성의 속도 제한 단계로, 각 조직의 [39][38][better source needed]미토콘드리아 내부에서 발생합니다.
- 코르티솔, 코르티코스테론, 알도스테론, 테스토스테론은 부신피질에서 [38][citation needed]생산된다.
- 에스트라디올, 에스트론, 프로게스테론은 주로 난소에서 만들어지며, 임신 중 태반에서 [38][citation needed]에스트리올, 그리고 테스토스테론은 주로 고환에서 만들어집니다.
- 에스트라디올은 테스토스테론에서 직접(남성)[38][citation needed] 또는 1차 경로 DHEA - 안드로스테디온 - 에스트론을 통해, 2차 경로(여성)를 통해 전환된다.
- 간질세포는 안드로겐이 부족한 전립선암세포에 [40][non-primary source needed][better source needed]의해 생성되는 신호에 반응하여 스테로이드를 생성하는 것으로 나타났다.
- 중추신경계(CNS)의 일부 뉴런과 글리아는 프레그네놀론, 프로게스테론, DHEA 및 DHEAS, de novo 또는 말초 [38][citation needed]소스의 국소 합성에 필요한 효소를 발현한다.
| 섹스. | 성호르몬 | 생식 기능 단계 | 피 생산율 | 생식선 분비율 | 대사 클리어런스 레이트 | 기준 범위(세럼 레벨) | |
|---|---|---|---|---|---|---|---|
| SI 유닛 | 비유닛SI | ||||||
| 남자들 | 안드로스테디온 | – | 2.8 mg/일 | 1.6 mg/일 | 2,200 L/일 | 2.8~7.3 nmol/L | 80 ~ 210 ng/dL |
| 테스토스테론 | – | 6.5 mg/일 | 6.2mg/일 | 950 L/일 | 6.9~34.7 nmol/L | 200~1000ng/dL | |
| 에스트로네 | – | 150μg/일 | 110μg/일 | 2050 L/일 | 37 ~ 250 pmol / L | 10 ~ 70 pg / mL | |
| 에스트라디올 | – | 60μg/일 | 50μg/일 | 1,600 L/일 | 37~210 pmol/L 미만 | 10 ~ 57 pg / mL | |
| 황산에스트론 | – | 80μg/일 | 중요하지 않다 | 167 L/일 | 600 ~ 2,500 pmol / L | 200~900 pg/mL | |
| 여성들. | 안드로스테디온 | – | 3.2mg/일 | 2.8 mg/일 | 2,000 L/day | 3.1~12.2 nmol/L | 89~350 ng/dL |
| 테스토스테론 | – | 190μg/일 | 60μg/일 | 500 L/일 | 0.7~2.8 nmol/L | 20 ~ 81 ng/dL | |
| 에스트로네 | 엽상 | 110μg/일 | 80μg/일 | 2,200 L/일 | 110~400 pmol/L | 30~110 pg/mL | |
| 황체상 | 260μg/일 | 150μg/일 | 2,200 L/일 | 310 ~ 660 pmol / L | 80~180 pg/mL | ||
| 갱년기 후 | 40μg/일 | 중요하지 않다 | 1610 L/일 | 22 ~ 230 pmol / L | 6 ~ 60 pg / mL | ||
| 에스트라디올 | 엽상 | 90μg/일 | 80μg/일 | 1,200 L/일 | 37~360 pmol/L 미만 | 10 ~ 98 pg / mL | |
| 황체상 | 250μg/일 | 240μg/일 | 1,200 L/일 | 699 ~ 1250 pmol / L | 190 ~ 341 pg/mL | ||
| 갱년기 후 | 6μg/일 | 중요하지 않다 | L 910 L/µ | pmol 37~140 pmol/L 미 | ~ pg / 10 ~38 pg / mL | ||
| 100μg/g | 않다 | L 146 L/µ | 700~3600 pmol/L | ~ pg / 250 ~1300 pg / mL | |||
| ''' | 180μg/g | 않다 | L 146 L/µ | 1100~7300pmol/L | ~ pg / 400 ~2600 pg / mL | ||
| mg 2 mg/mg | mg/일 1.7 mg/g | L 2100 L/day | 0.3~3nmol/L | .1 0.1~0.9ng/mL | |||
| ''' | mg 25 mg/g | mg 24 mg/g | L 2100 L/day | 19~45nmol/L | 6~14ng/mL | ||
및 주의: "순환 중 스테로이드 농도는 그것이 분비선에서 분비되는 속도, 전구체 또는 호르몬이 스테로이드로 대사되는 속도, 그리고 그것이 조직에 의해 추출되어 대사되는 속도에 의해 결정됩니다.스테로이드 분비율은 단위시간당 분비샘에서 분비되는 화합물의 총량을 말한다.분비율은 시간이 지남에 따라 분비샘에서 정맥 유출물을 추출하고 동맥 및 말초 정맥 호르몬 농도를 빼서 평가했습니다.스테로이드 대사 클리어런스율은 단위시간당 호르몬이 완전히 제거된 혈액의 양으로 정의된다.스테로이드 호르몬의 생산률은 분비선에서 나오는 분비물과 프로호르몬을 관심 스테로이드로 전환하는 것을 포함한 모든 가능한 원천에서 화합물의 혈액으로 들어가는 것을 말한다.정상 상태에서 모든 공급원에서 혈액으로 유입되는 호르몬의 양은 제거 속도(산출 속도=대사 제거 속도×농도)에 혈중 농도를 곱한 값과 같다.프로호르몬 대사가 스테로이드 순환 풀에 거의 기여하지 않으면 생산률은 분비율에 근접할 것입니다.출처:"템플릿"을 참조해 주세요. | |||||||
대체 경로
식물 및 박테리아에서 비메발론산 경로(MEP 경로)는 피루브산 및 글리세린알데히드 3-인산을 [30][41]기질로 사용하여 IPP 및 DMAPP를 생성한다.
질병 중에는 건강한 사람에게 중요하지 않은 경로가 이용될 수 있다.예를 들어, 선천성 부신 과형성의 한 형태에서 21-히드록실라아제 효소 경로의 결핍은 17α-히드록시프로게스테론(17-OHP)을 초과하게 한다. 즉, 17-OHP의 병리학적 초과는 Lyase 멤버 중 1720a를 통해 디히드로테스트스테론(DHT, 전위성과 수소)으로 전환될 수 있다.5α-환원효소 및 3α-히드록시스테로이드 탈수소효소.[42]
이화 및 배설
스테로이드제는 주로 CYP3A4와 같은 시토크롬 P450 산화효소 효소에 의해 산화된다.이러한 반응은 스테로이드 고리에 산소를 도입하여 콜레스테롤이 다른 효소에 의해 담즙산으로 [43]분해되도록 합니다.이 산들은 담즙의 [44]간에서 분비됨으로써 제거될 수 있다.스테로이드 [45]혈중 농도가 높을 때 산화효소 유전자의 발현이 스테로이드 센서 PXR에 의해 상향 조절될 수 있다.콜레스테롤과 담즙산의 측쇄가 없는 스테로이드 호르몬은 일반적으로 다양한 고리 위치에서 수산화되거나 17 위치에서 산화되어 황산 또는 글루쿠론산과 결합되어 소변으로 배설된다.[46]
분리, 구조 결정 및 분석 방법
화학 물질의 스테로이드를 격리, 상황에 따라, 격리 화학 구조 해명, derivitzation나 퇴화 화학, 생물학적 시험 및 다른 연구 필요(일반적으로그램었지만 종종 more[47]또는"분석적인 양"(이 초점은 관심의 본질에 대한 격리 milligrams에 필요하다.에물질 식별 및 정량화(예를 들어 생물학적 조직 또는 유체)분리되는 양은 분석 방법에 따라 다르지만 일반적으로 1마이크로그램 [48][page needed]미만입니다.두 가지 제품 척도를 달성하기 위한 분리 방법은 구별되지만 추출, 침전, 흡착, 크로마토그래피 및 결정화를 포함한다.두 경우 모두 분리된 물질은 화학적 균질성으로 정제된다. LC-MS와 같은 결합된 분리 및 분석 방법은 순수한 표본에서 단일 종을 검출하기 위해 물질과 분리 매트릭스 간의 고유한 상호 작용 모드에 기초한 분리를 달성하는 "직교" 방식으로 선택된다.구조 결정이란 NMR 및 소분자 결정학을 [4]: 10–19 포함한 화학 및 물리적 방법의 진화하는 어레이를 사용하여 분리된 순수 스테로이드 화학 구조를 결정하는 방법을 말한다.분석방법은 상기 두 영역을 모두 겹쳐 혼합물에 스테로이드가 존재하는지 여부를 판단하고 그 [48]양을 결정하는 분석방법을 강조한다.
화학 합성
피토스테롤 측쇄의 미생물 이화 작용은 C-19 스테로이드, C-22 스테로이드 및 17-케토스테로이드(부신피질 호르몬 및 피임약의 전구체)[49][50][51]를 생성한다.이 화학 분류 내에서 사용 가능한 다양한 약물을 생산할 때 기능군의 추가와 수정이 핵심이다.이러한 개조는 기존의 유기합성 및/또는 생체변환 [52][53]기술을 사용하여 이루어진다.
전구체
반합성
스테로이드제의 반합성은 종종 콜레스테롤,[51] 피토스테롤 [50]또는 사포게닌과 [54]같은 전구물질에서 시작된다.멕시코 바르바스코 무역에 관여하고 있는 Syntex의 노력은 합성 스테로이드 제약 [47]산업 초기에 사포게닌 디오스제닌을 생산하기 위해 Dioscorea mexicana를 사용했다.
종합합성
일부 스테로이드 호르몬은 석유 화학 물질(예: 13-알킬 스테로이드)[51]의 총합성을 통해서만 경제적으로 얻을 수 있다.예를 들어 제약 노르스트렐은 페놀에서 유래한 석유화학물질인 메톡시-1-테트라론에서 시작한다.
연구상
스테로이드 연구로 다음과 같은 노벨상이 수여되었습니다.
- 1927(화학) 하인리히 오토 빌랜드 - 담즙산과 스테롤의 구성 및 비타민과의 관계[55]
- 1928 (화학) 아돌프 오토 라인홀트 윈다우스 - 스테롤의 구성 및 비타민과의 관계[56]
- 1939년 (화학) 아돌프 부테난트와 레오폴드 루지치카 - 스테로이드 성호르몬의 분리 및 구조 연구, 고테르펜에[57] 대한 관련 연구
- 1950(생리학 또는 의학) 에드워드 캘빈 켄달, 타데우스 라이히스타인 및 필립 헨치 - 부신 호르몬의[58] 구조와 생물학적 영향
- 1965년(화학) 로버트 번스 우드워드 - 콜레스테롤, 코티손 및 라노스테롤[59] 합성용
- 1969 (화학) 데릭 바튼과 오드 하셀 - 스테로이드[60] 핵을 강조하면서 화학에서의 배합 개념 개발
- 1975(화학) 블라디미르 프렐로그 - 부분적으로 스쿠알렌을[61] 통해 메발론산에서 콜레스테롤 생합성의 입체 화학적 과정을 결정하는 방법을 개발하기 위해
「 」를 참조해 주세요.
레퍼런스
- ^ a b c d 모스 GP를, 워킹이 IUPAC-IUB 합동 위원회의 생물학적 품목 분류 표(1989년)에."스테로이드의 Nomenclature, 권장 사항 1989년"(PDF).순수 Appl.화학은 61(10):1783–1822. doi:10.1351/pac198961101783.S2CID 97612891.과 같은 저자들 atCarlson 또한 사용 가능한 P, 불 JR, 엥겔 K, 튀긴 J-키르허 HW, Loaning한데 KL, 모스 GP를, Popják G, Uskokovic MR(12월 1989년)."IUPAC-IUB 합동 위원회 생물학적 품목 분류 표(JCBN)에.스테로이드제에 대한 명명 법권고 사항은 1989".유럽 저널 생화학. 186(3):429–58. doi:10.1111/j.1432-1033.1989.tb15228.x. PMID 2606099.;.또한 온라인에서 이용 at"그 품목 분류 표 Steroids".런던, GBR:여왕 메리 런던 대학교. p. 3S–1.4. 5월 10일 2014년 Retrieved.
- ^ a b "Lanosterol biosynthesis". Recommendations on Biochemical & Organic Nomenclature, Symbols & Terminology. International Union Of Biochemistry And Molecular Biology. Archived from the original on 2011-03-08. Retrieved 2006-11-28.
- ^ 인쇄판도 이쪽에서 구할 수 있습니다.
- ^ a b c Lednicer D (2011). Steroid Chemistry at a Glance. Hoboken: Wiley. ISBN 978-0-470-66084-3.
- ^ Rhen T, Cidlowski JA (Oct 2005). "Antiinflammatory action of glucocorticoids--new mechanisms for old drugs" (PDF). The New England Journal of Medicine. 353 (16): 1711–23. doi:10.1056/NEJMra050541. PMID 16236742.
- ^ Victor A. Rogozkin (14 June 1991). Metabolism of Anabolic-Androgenic Steroids. CRC Press. pp. 1–. ISBN 978-0-8493-6415-0.
The steroid structural base is a steran nucleus, a polycyclic C17 steran skeleton consisting of three condensed cyclohexane rings in nonlinear or phenanthrene junction (A, B, and C), and a cyclopentane ring (D).1,2
- ^ Klaus Urich (16 September 1994). Comparative Animal Biochemistry. Springer Science & Business Media. pp. 624–. ISBN 978-3-540-57420-0.
- ^ GREEP 2013.
- ^ Bhetariya PJ, Sharma N, Singh P, Tripathi P, Upadhyay SK, Gautam P (2017-03-21). "Human Fungal Pathogens and Drug Resistance Against Azole Drugs". In Arora C, Sajid A, Kalia V (eds.). Drug Resistance in Bacteria, Fungi, Malaria, and Cancer. Springer. ISBN 978-3-319-48683-3.
- ^ a b c d e f g h i Kavanagh K, ed. (8 September 2017). Fungi: Biology and Applications. John Wiley & Sons, Inc. ISBN 9781119374312.
- ^ Wink M (Sep 2003). "Evolution of secondary metabolites from an ecological and molecular phylogenetic perspective". Phytochemistry. 64 (1): 3–19. doi:10.1016/S0031-9422(03)00300-5. PMID 12946402.
- ^ Wink M, Van Wyk BE (2008). Mind-altering and poisonous plants of the world. Portland (Oregon USA) and Salusbury (London England): Timber press inc. pp. 252, 253 and 254. ISBN 978-0-88192-952-2.
- ^ Wink M, van Wyk BE (2008). Mind-altering and poisonous plants of the world. Portland (Oregon USA) and Salusbury (London England): Timber press inc. pp. 324, 325 and 326. ISBN 978-0-88192-952-2.
- ^ Bode HB, Zeggel B, Silakowski B, Wenzel SC, Reichenbach H, Müller R (Jan 2003). "Steroid biosynthesis in prokaryotes: identification of myxobacterial steroids and cloning of the first bacterial 2,3(S)-oxidosqualene cyclase from the myxobacterium Stigmatella aurantiaca". Molecular Microbiology. 47 (2): 471–81. doi:10.1046/j.1365-2958.2003.03309.x. PMID 12519197.
- ^ Desmond E, Gribaldo S (2009). "Phylogenomics of sterol synthesis: insights into the origin, evolution, and diversity of a key eukaryotic feature". Genome Biology and Evolution. 1: 364–81. doi:10.1093/gbe/evp036. PMC 2817430. PMID 20333205.
- ^ Siedenburg G, Jendrossek D (Jun 2011). "Squalene-hopene cyclases". Applied and Environmental Microbiology. 77 (12): 3905–15. Bibcode:2011ApEnM..77.3905S. doi:10.1128/AEM.00300-11. PMC 3131620. PMID 21531832.
- ^ Zorea A (2014). Steroids (Health and Medical Issues Today). Westport, CT: Greenwood Press. pp. 10–12. ISBN 978-1440802997.
- ^ "C19-steroid hormone biosynthetic pathway - Ontology Browser - Rat Genome Database". rgd.mcw.edu.
- ^ Edgren RA, Stanczyk FZ (Dec 1999). "Nomenclature of the gonane progestins". Contraception. 60 (6): 313. doi:10.1016/S0010-7824(99)00101-8. PMID 10715364.
- ^ Hanson JR (Jun 2010). "Steroids: partial synthesis in medicinal chemistry". Natural Product Reports. 27 (6): 887–99. doi:10.1039/c001262a. PMID 20424788.
- ^ "IUPAC Recommendations: Skeletal Modification in Revised Section F: Natural Products and Related Compounds (IUPAC Recommendations 1999)". International Union of Pure and Applied Chemistry (IUPAC). 1999.
- ^ Wolfing J (2007). "Recent developments in the isolation and synthesis of D-homosteroids and related compounds". Arkivoc. 2007 (5): 210–230. doi:10.3998/ark.5550190.0008.517.
- ^ Gao G, Chen C (2012). "Nakiterpiosin". In Corey EJ, Li JJ (eds.). Total synthesis of natural products: at the frontiers of organic chemistry. Berlin: Springer. doi:10.1007/978-3-642-34065-9. ISBN 978-3-642-34064-2. S2CID 92690863.
- ^ Uemura E, Kita M, Arimoto H, Kitamura M (2009). "Recent aspects of chemical ecology: Natural toxins, coral communities, and symbiotic relationships". Pure Appl. Chem. 81 (6): 1093–1111. doi:10.1351/PAC-CON-08-08-12.
- ^ Silverthorn DU, Johnson BR, Ober WC, Ober CE, Silverthorn AC (2016). Human physiology : an integrated approach (Seventh ed.). [San Francisco]. ISBN 9780321981226. OCLC 890107246.
- ^ Sadava D, Hillis DM, Heller HC, Berenbaum MR (2011). Life: The Science of Biology (9 ed.). San Francisco: Freeman. pp. 105–114. ISBN 978-1-4292-4646-0.
- ^ Lubik AA, Nouri M, Truong S, Ghaffari M, Adomat HH, Corey E, Cox ME, Li N, Guns ES, Yenki P, Pham S, Buttyan R (2016). "Paracrine Sonic Hedgehog Signaling Contributes Significantly to Acquired Steroidogenesis in the Prostate Tumor Microenvironment". Int. J. Cancer. 140 (2): 358–369. doi:10.1002/ijc.30450. PMID 27672740. S2CID 2354209.
- ^ Grochowski LL, Xu H, White RH (May 2006). "Methanocaldococcus jannaschii uses a modified mevalonate pathway for biosynthesis of isopentenyl diphosphate". Journal of Bacteriology. 188 (9): 3192–8. doi:10.1128/JB.188.9.3192-3198.2006. PMC 1447442. PMID 16621811.
- ^ Chatuphonprasert W, Jarukamjorn K, Ellinger I (2018-09-12). "Physiology and Pathophysiology of Steroid Biosynthesis, Transport and Metabolism in the Human Placenta". Frontiers in Pharmacology. 9: 1027. doi:10.3389/fphar.2018.01027. ISSN 1663-9812. PMC 6144938. PMID 30258364.
- ^ a b Kuzuyama T, Seto H (Apr 2003). "Diversity of the biosynthesis of the isoprene units". Natural Product Reports. 20 (2): 171–83. doi:10.1039/b109860h. PMID 12735695.
- ^ Dubey VS, Bhalla R, Luthra R (Sep 2003). "An overview of the non-mevalonate pathway for terpenoid biosynthesis in plants" (PDF). Journal of Biosciences. 28 (5): 637–46. doi:10.1007/BF02703339. PMID 14517367. S2CID 27523830. Archived from the original (PDF) on 2007-04-15.
- ^ a b Schroepfer GJ (1981). "Sterol biosynthesis". Annual Review of Biochemistry. 50: 585–621. doi:10.1146/annurev.bi.50.070181.003101. PMID 7023367.
- ^ Lees ND, Skaggs B, Kirsch DR, Bard M (Mar 1995). "Cloning of the late genes in the ergosterol biosynthetic pathway of Saccharomyces cerevisiae--a review". Lipids. 30 (3): 221–6. doi:10.1007/BF02537824. PMID 7791529. S2CID 4019443.
- ^ Kones R (December 2010). "Rosuvastatin, inflammation, C-reactive protein, JUPITER, and primary prevention of cardiovascular disease--a perspective". Drug Design, Development and Therapy. 4: 383–413. doi:10.2147/DDDT.S10812. PMC 3023269. PMID 21267417.
- ^ Roelofs AJ, Thompson K, Gordon S, Rogers MJ (October 2006). "Molecular mechanisms of action of bisphosphonates: current status". Clinical Cancer Research. 12 (20 Pt 2): 6222s–6230s. doi:10.1158/1078-0432.CCR-06-0843. PMID 17062705.
- ^ Häggström M, Richfield D (2014). "Diagram of the pathways of human steroidogenesis". WikiJournal of Medicine. 1 (1). doi:10.15347/wjm/2014.005. ISSN 2002-4436.
- ^ Hanukoglu I (Dec 1992). "Steroidogenic enzymes: structure, function, and role in regulation of steroid hormone biosynthesis". The Journal of Steroid Biochemistry and Molecular Biology. 43 (8): 779–804. doi:10.1016/0960-0760(92)90307-5. PMID 22217824. S2CID 112729.
- ^ a b c d e f Miller WL, Auchus RJ (February 2011). "The molecular biology, biochemistry, and physiology of human steroidogenesis and its disorders". Endocrine Reviews. 32 (1): 81–151. doi:10.1210/er.2010-0013. PMC 3365799. PMID 21051590.
- ^ Rossier MF (Aug 2006). "T channels and steroid biosynthesis: in search of a link with mitochondria". Cell Calcium. 40 (2): 155–64. doi:10.1016/j.ceca.2006.04.020. PMID 16759697.
- ^ Lubik AA, Nouri M, Truong S, Ghaffari M, Adomat HH, Corey E, Cox ME, Li N, Guns ES, Yenki P, Pham S, Buttyan R (2016). "Paracrine Sonic Hedgehog Signaling Contributes Significantly to Acquired Steroidogenesis in the Prostate Tumor Microenvironment". International Journal of Cancer. 140 (2): 358–369. doi:10.1002/ijc.30450. PMID 27672740. S2CID 2354209.
- ^ Lichtenthaler HK (Jun 1999). "The 1-deoxy-d-xylulose-5-phosphate pathway of isoprenoid biosynthesis in plants". Annual Review of Plant Physiology and Plant Molecular Biology. 50: 47–65. doi:10.1146/annurev.arplant.50.1.47. PMID 15012203.
- ^ Witchel SF, Azziz R (2010). "Nonclassic congenital adrenal hyperplasia". International Journal of Pediatric Endocrinology. 2010: 1–11. doi:10.1155/2010/625105. PMC 2910408. PMID 20671993.
- ^ Pikuleva IA (Dec 2006). "Cytochrome P450s and cholesterol homeostasis". Pharmacology & Therapeutics. 112 (3): 761–73. doi:10.1016/j.pharmthera.2006.05.014. PMID 16872679.
- ^ Zollner G, Marschall HU, Wagner M, Trauner M (2006). "Role of nuclear receptors in the adaptive response to bile acids and cholestasis: pathogenetic and therapeutic considerations". Molecular Pharmaceutics. 3 (3): 231–51. doi:10.1021/mp060010s. PMID 16749856.
- ^ Kliewer SA, Goodwin B, Willson TM (Oct 2002). "The nuclear pregnane X receptor: a key regulator of xenobiotic metabolism". Endocrine Reviews. 23 (5): 687–702. doi:10.1210/er.2001-0038. PMID 12372848.
- ^ Steimer T. "Steroid Hormone Metabolism". WHO Collaborating Centre in Education and Research in Human Reproduction. Geneva Foundation for Medical Education and Research.
- ^ a b "Russell Marker Creation of the Mexican Steroid Hormone Industry". International Historic Chemical Landmark. American Chemical Society.
- ^ a b Makin HL, Honor JW, Shackleton CH, Griffiths WJ (2010). "General methods for the extraction, purification, and measurement of steroids by chromatography and mass spectrometry". In Makin HL, Gower DB (eds.). Steroid analysis. Dordrecht; New York: Springer. pp. 163–282. ISBN 978-1-4020-9774-4.
- ^ Conner AH, Nagaoka M, Rowe JW, Perlman D (August 1976). "Microbial conversion of tall oil sterols to C19 steroids". Applied and Environmental Microbiology. 32 (2): 310–1. Bibcode:1976ApEnM..32..310C. doi:10.1128/AEM.32.2.310-311.1976. PMC 170056. PMID 987752.
- ^ a b Hesselink PG, van Vliet S, de Vries H, Witholt B (1989). "Optimization of steroid side chain cleavage by Mycobacterium sp. in the presence of cyclodextrins". Enzyme and Microbial Technology. 11 (7): 398–404. doi:10.1016/0141-0229(89)90133-6.
- ^ a b c Sandow J, Jürgen E, Haring M, Neef G, Prezewowsky K, Stache U (2000). "Hormones". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a13_089. ISBN 978-3527306732.
{{cite book}}:누락 또는 비어 있음title=(도움말) - ^ Fried J, Thoma RW, Gerke JR, Herz JE, Donin MN, Perlman D (1952). "Microbiological Transformations of Steroids.1 I. Introduction of Oxygen at Carbon-11 of Progesterone". Journal of the American Chemical Society. 73 (23): 5933–5936. doi:10.1021/ja01143a033.
- ^ Capek M, Oldrich H, Alois C (1966). Microbial Transformations of Steroids. Prague: Academia Publishing House of Czechoslovak Academy of Sciences. doi:10.1007/978-94-011-7603-3. ISBN 9789401176057. S2CID 13411462.
- ^ Marker RE, Rohrmann E (1939). "Sterols. LXXXI. Conversion of Sarsasa-Pogenin to Pregnanedial--3(α),20(α)". Journal of the American Chemical Society. 61 (12): 3592–3593. doi:10.1021/ja01267a513.
- ^ "The Nobel Prize in Chemistry 1927". The Nobel Foundation.
- ^ "The Nobel Prize in Chemistry 1928". The Nobel Foundation.
- ^ "The Nobel Prize in Chemistry 1939". The Nobel Foundation.
- ^ "The Nobel Prize in Physiology or Medicine 1950". The Nobel Foundation.
- ^ "The Nobel Prize in Chemistry 1965". The Nobel Foundation.
- ^ "The Nobel Prize in Chemistry 1969". The Nobel Foundation.
- ^ "The Nobel Prize in Chemistry 1975". The Nobel Foundation.
참고 문헌
- Russel CA (2005). "Organic Chemistry: Natural products, Steroids". In Russell CA, Roberts GK (eds.). Chemical History: Reviews of the Recent Literature. Cambridge: RSC Publ. ISBN 978-0-85404-464-1.
- "Russell Marker Creation of the Mexican Steroid Hormone Industry - Landmark -". American Chemical Society. 1999.
- Lednicer D (2011). Steroid Chemistry at a Glance. Hoboken: Wiley. doi:10.1002/9780470973639. ISBN 978-0-470-66085-0. 스테로이드 연구의 간결한 역사.
- Yoder RA, Johnston JN (Dec 2005). "A case study in biomimetic total synthesis: polyolefin carbocyclizations to terpenes and steroids". Chemical Reviews. 105 (12): 4730–56. doi:10.1021/cr040623l. PMC 2575671. PMID 16351060. 스테로이드 합성의 역사, 특히 생체 모방에 대한 리뷰.
- Han TS, Walker BR, Arlt W, Ross RJ (Feb 2014). "Treatment and health outcomes in adults with congenital adrenal hyperplasia". Nature Reviews. Endocrinology. 10 (2): 115–24. doi:10.1038/nrendo.2013.239. PMID 24342885. S2CID 6090764. 부신 스테로이드 생성 경로.
- Greep RO, ed. (22 October 2013). "Cortoic acids". Recent Progress in Hormone Research: Proceedings of the 1979 Laurentian Hormone Conference. Elsevier Science. pp. 345–391. ISBN 978-1-4832-1956-1.
- Bowen RA (October 20, 2001). "Steroidogenesis". Pathophysiology of the Endocrine System. Colorado State University. Archived from the original on February 28, 2009.