엽록소
Chlorophyll엽록소(Clorophyl)는 시아노박테리아의 메소솜과 조류와 식물의 엽록체에서 발견되는 여러 가지 관련 녹색 색소 중 하나이다.[2]그것의 이름은 그리스어 wordsχως, Khloros("팔레그린")과 φύλλ,,, Phylon("[3]잎")에서 유래되었다.엽록소는 식물이 빛으로부터 에너지를 흡수하도록 한다.
엽록소는 적색 부분뿐만 아니라 전자기 스펙트럼의 청색 부분에서도 빛을 가장 강하게 흡수한다.[4]반대로 스펙트럼의 녹색 부분과 거의 녹색 부분의 흡수력이 떨어진다.따라서 엽록소 함유 조직은 세포벽과 같은 구조물에 의해 확산적으로 반사되는 녹색 빛이 덜 흡수되기 때문에 녹색으로 보인다.[1]녹색 식물의 포토스템에는 엽록소 a와 b의 두 가지 종류의 엽록소가 존재한다.[5]
역사
엽록소는 1817년에 처음 격리되었고 조지프 비엔에이메 카벤투와 피에르 조셉 펠레티에가 이름을 지었다.[6]엽록소에 마그네슘이 들어 있는 것은 1906년에 발견되었으며,[7] 그 원소가 살아있는 조직에서 처음으로 검출된 것이다.[8]
1905년부터 1915년까지 독일의 화학자 리차드 윌슈타터에 의해 초기 작업이 끝난 후, 엽록소 a의 일반적인 구조는 1940년에 한스 피셔에 의해 해명되었다.엽록소 a의 입체화학이 대부분 알려진 1960년까지 로버트 번즈 우드워드는 이 분자의 총합성을 발표했다.[8][9]1967년 마지막으로 남아있는 입체화학 용해화가 이안 플레밍에 의해 완성되었고,[10] 1990년 우드워드와 공동저자들이 최신 합성을 발표했다.[11]엽록소 f는 2010년에 스트로마톨라이트를 형성하는 시아노박테리아와 기타 산소 미생물에 존재한다고 발표되었다;[12][13] COUNMg의557064 분자 공식과 (2-포밀)-염소엽록 a의 구조를 NMR, 광학 및 질량 스펙트럼에 기초하여 추론하였다.[14]
광합성
엽록소는 식물이 빛으로부터 에너지를 흡수할 수 있도록 하는 광합성에 필수적이다.[15]
엽록소의 분자는 엽록체의 태일라코이드 막에 내장된 포토시스템 안과 주변에 배치된다.[16]이들 복합체에서 엽록소는 세 가지 기능을 한다.대부분의 엽록소의 기능은 빛을 흡수하는 것이다.그렇게 한 후, 이 같은 센터는 두 번째 기능인 공명 에너지 전달에 의한 빛 에너지의 광계 반응 중심에 있는 특정 엽록소 쌍에 대한 전달을 실행한다.이 쌍은 엽록소의 최종 기능인 전하 분리에 영향을 미쳐 생합성을 유도한다.현재 승인된 두 개의 광시스템 유닛은 각각 P680과 P700이라는 고유한 반응 센터를 가진 광시스템 II와 광시스템 I이다.이 센터들은 적색 피크 흡수 최대치의 파장(나노미터 단위)에서 이름을 따왔다.각 광섬유의 엽록소 유형의 정체성, 기능 및 스펙트럼 특성은 서로 구별되고 결정되며 이를 둘러싼 단백질 구조가 결정된다.
엽록소 반응센터의 기능은 빛 에너지를 흡수하여 광섬유의 다른 부분으로 전달하는 것이다.광자의 흡수된 에너지는 전하 분리라고 불리는 과정에서 전자에 전달된다.엽록소에서 전자를 제거하는 것은 산화 반응이다.엽록소는 고에너지 전자를 전자 운송 체인이라고 불리는 일련의 분자 매개체에 기부한다.그리고 나서 엽록소의 충전된 반응 중심(P680+)은 물에서 벗겨낸 전자를 받아들임으로써 다시 그 지상 상태로 감소한다.P680을+ 감소시키는 전자는 궁극적으로 여러 중간자를 통해 물을 O와2 H로+ 산화시키는 데서 온다.이 반응은 식물과 같은 광합성 유기체가 O2 가스를 생산하는 방법이며, 지구 대기의 사실상 모든 O의2 근원이다.광시스템 I는 일반적으로 포토시스템 II와 직렬로 작용한다. 따라서 광시스템 I의 P700은+ 태일라코이드 막의 많은 중간체를 통해 궁극적으로 포토시스템 II에서 오는 전자에 의해 전자를 받아들이면서 감소된다.그러나 태즈메니아 늑막의 전자전달 반응은 복잡하며 P700을+ 줄이는 데 사용되는 전자의 근원은 다양할 수 있다.
반응센터 엽록소 색소에 의해 생성되는 전자 흐름은 태일라코이드 막을+ 가로질러 H 이온을 펌프질하여 주로 ATP(Stored Chemic Energy)의 생산에 사용되는 원발력을 설정하거나 NADP를+ NADPH로 감소시키는 데 사용된다.NADPH는 CO를2 당으로 감소시키고 다른 생합성 반응에 사용되는 보편적인 물질이다.
반응센터 엽록소-단백질 콤플렉스는 다른 엽록소 색소의 도움 없이 빛을 직접 흡수하고 전하 분리 이벤트를 수행할 수 있지만, 주어진 빛의 강도 아래에서 일어날 확률은 작다.따라서 광체계에 있는 다른 엽록소와 안테나 색소 단백질은 모두 광 에너지를 협력적으로 흡수하여 반응 중심부로 보낸다.엽록소 a 외에도, 이러한 색소-단백 안테나 복합체에서 발생하는 부속 색소라고 불리는 다른 색소들이 있다.
화학구조
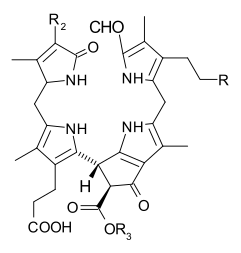
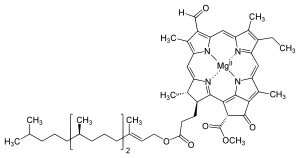
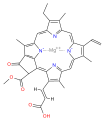
몇몇 엽록소가 알려져 있다.모두 네 개의 피롤 같은 고리 너머에 케톤이 함유된 다섯 번째 링이 존재함으로써 모체 클로로린의 유도체로 정의된다.대부분의 엽록소는 클로린으로 분류되는데, 이것은 (헤모글로빈에서 발견되는) 포르피린과의 감소된 친척이다.그들은 전구체 우로포피리노겐3를 포함하여 포르피린과 공통의 생합성 경로를 공유한다.N4 중심부에 묶인 철분을 함유하고 있는 헤메스와 달리 대부분의 엽록소는 마그네슘을 결합한다.Mg2+ 센터에 부착된 축방향 리간드는 명확성을 위해 생략하는 경우가 많다.클로린 링에 첨가되는 것은 다양한 사이드 체인으로, 보통 긴 파이틸 체인을 포함한다.CHO2039). 지상 식물에서 가장 널리 분포하는 형태는 엽록소 a이다.엽록소 a와 엽록소 b의 유일한 차이점은 전자가 메틸 집단을 가지고 있다는 것이다.이 차이는 흡수 스펙트럼에 상당한 차이를 일으켜 식물이 가시광선을 더 많이 흡수할 수 있게 한다.
| 엽록소 a | 엽록소 b | 엽록소1 c | 엽록소2 c | 엽록소 d | 엽록소 f[14] | |
|---|---|---|---|---|---|---|
| 분자식 | 천엠그557254 | 천엠그557064 | 천엠그353054 | 천엠그352854 | 천엠그547064 | 천엠그557064 |
| C2군 | −CH3 | −CH3 | −CH3 | −CH3 | −CH3 | −CHO |
| C3군 | −CH=CH2 | −CH=CH2 | −CH=CH2 | −CH=CH2 | −CHO | −CH=CH2 |
| C7그룹 | −CH3 | −CHO | −CH3 | −CH3 | −CH3 | −CH3 |
| C8군 | −CH2CH3 | −CH2CH3 | −CH2CH3 | −CH=CH2 | −CH2CH3 | −CH2CH3 |
| C17그룹 | -CHCHCOU-Phyl22 | -CHCHCOU-Phyl22 | −CH=CHCOOH | −CH=CHCOOH | -CHCHCOU-Phyl22 | -CHCHCOU-Phyl22 |
| C17-C18 채권 | 싱글 (염소) | 싱글 (염소) | 더블 (포피린) | 더블 (포피린) | 싱글 (염소) | 싱글 (염소) |
| 발생 | 유니버설 | 대부분 식물 | 각종조류 | 각종조류 | 시아노박테리아 | 시아노박테리아 |
- 엽록소의 구조
엽록소 함량 측정
엽록소는 단백질에서 유기 용제로 추출될 수 있다.[19][20][21]이렇게 하면 잎 내 엽록소의 농도를 추정할 수 있다.[22]엽록소 a와 엽록소 b를 분리하는 방법도 존재한다.
디에틸에테르에서 엽록소 a는 대략 흡착 최대치가 430nm, 662nm인 반면, 엽록소 b는 대략 최대치가 453nm, 642nm이다.[23]엽록소 a의 흡수 피크는 465 nm, 665 nm이다.엽록소는 673nm(최대)와 726nm의 형광물질을 배출한다.엽록소의 최고 어금니 흡수 계수는 105 M−1 cm를−1 초과하는데, 이는 소분자 유기 화합물의 최고치 중 하나이다.[24]아세톤-물 90%에서 엽록소 a의 피크 흡수 파장은 430nm, 664nm, 엽록소 b의 피크는 460nm, 647nm, 엽록소 c의1 피크는 442nm, 630nm, 엽록소 c의2 피크는 444nm, 630nm, 엽록소 d의 피크는 401nm, 455nm, 696nm이다.[25]
비율 형광 방출은 엽록소 함량을 측정하는 데 사용될 수 있다.낮은 파장에서 흥분되는 엽록소 형광물질에 의해 705±10nm와 735±10nm의 엽록소 형광물질 배출 비율은 화학시험과 비교할 때 엽록소 함량의 선형 관계를 제공할 수 있다.F735/F700 비율은 41 mg m−2 ~ 675 mg m의−2 범위에서 화학 시험과 비교하여2 r 0.96의 상관 관계 값을 제공했다.기텔슨은 또한 엽록소 함량을 mg 단위로−2 직접 판독하는 공식을 개발했다.이 공식은 41mgm에서−2 675mgm까지의−2 엽록소 함량을 0.95의 상관관계 r2 값으로 측정하는 신뢰할 수 있는 방법을 제공했다.[26]
생합성
일부 식물에서 엽록소는 글루탐산염으로부터 파생되어 헤메와 시로헴과 공유되는 갈라진 생합성 경로를 따라 합성된다.[27][28][29]엽록소 싱타아제는[30] 엽록소 a의 생합성을 완성하는 효소다.[31][32]
- 엽록소 a + pytyl diphosphate 엽록소 a + diphosphate.
이 수렴은 엽록소 a에서 20-카본 디테르펜 알코올 피톨과 함께 카르복실산 그룹의 에스테르를 형성한다.엽록소 b는 엽록소 b에 작용하는 동일한 효소에 의해 만들어진다.
안지오스펨 식물의 경우, 생합성 경로의 후기 단계는 빛에 의존한다.그런 식물은 어둠 속에서 자라면 창백하다.비혈관 식물과 녹조는 빛에 독립적인 효소를 추가로 가지고 있으며 어둠 속에서도 녹색으로 자란다.[33]
엽록소는 단백질과 결합한다.생합성 매개체 중 하나인 프로토클로로필라이드는 대부분 자유형에서 발생하며, 가벼운 조건에서 광센서제 역할을 하여 활성산소를 형성하여 식물에 독성이 있을 수 있다.그러므로 식물은 이 엽록소의 전구체의 양을 조절한다.혈관 조영에서 이 규정은 생합성 경로 내 중간 화합물 중 하나인 아미노레불린산(ALA) 단계에서 달성된다.ALA에 의해 공급되는 식물들은 높은 수준의 유독성 원색소생물을 축적한다; 손상된 규제 시스템을 가진 돌연변이들도 그러하다.[34]
노쇠와 엽록소 주기
식물 노화의 과정은 엽록소의 분해와 관련된다: 예를 들어 엽록소 효소 엽록소효소(EC 3.1.14)는 엽록소가 엽록소 a 또는 b로부터 생물합성되는 반응을 역전시키기 위해 피틸 사이드체인을 가수분해한다.엽록소 a는 엽록소 b로 변환될 수 있고, 후자는 엽록소 b로 다시 에스테르화할 수 있기 때문에, 이러한 과정들은 엽록소 a와 b를 순환하는 것을 허용한다.게다가 엽록소 b는 (7-hydroxyclorophyll1 a를 통해) 엽록소 a로 직접 환원될 수 있어 순환을 완료할 수 있다.[35][36]노화 후기 단계에서 엽록소는 일반 구조와 함께 비형광 엽록소 카타볼라이트(NCCs)로 알려진 무색소 테트라피롤 그룹으로 전환된다.
이러한 화합물은 익는 과일에서도 확인되었으며 낙엽성 식물에 독특한 가을 색을 준다.[36][37]
분배
엽록소 지도에는 매월 바닷물 세제곱미터 당 엽록소의 밀리그램이 표시된다.엽록소의 양이 매우 적어서 식물성 플랑크톤이 매우 적은 곳은 파란색이다.엽록소 농도가 높았던 곳, 즉 식물성 플랑크톤이 많이 자라고 있던 곳은 노란색이다.관측은 NASA 아쿠아 위성의 MODIS(Medium Resolution Imaging Spectroadiometer)에서 나왔다.땅은 짙은 회색이고, 모디스가 해빙이나 극지 어둠, 구름 때문에 데이터를 수집하지 못한 곳은 옅은 회색이다.초소형 해양식물이 번성하고 있는 엽록소 농도가 가장 높은 곳은 차가운 극지 또는 적도 주변이나 대륙 해안을 따라 해류가 차가운 물을 표면으로 가져오는 곳이다.식물성 플랑크톤을 자극하는 것은 찬물 자체가 아니다.대신 시원한 온도는 바닷속 깊은 곳에서 물이 흘러나와 시간이 지나면서 쌓인 영양분을 실어 나른다는 신호인 경우가 많다.극지에서는 식물이 자랄 수 없는 어두운 겨울철에 지표수에 영양분이 축적된다.봄과 여름에 햇빛이 돌아오면 식물은 고농도로 번성한다.[38]
요리용도
합성 엽록소는 식품첨가물 착색제로 등록되어 있으며, E번호는 E140이다.요리사들은 엽록소를 사용하여 파스타나 정령과 같은 다양한 음식과 음료를 녹색으로 칠한다.압신테는 그 생산에 사용되는 많은 종류의 약초를 통해 소개된 엽록소로부터 자연적으로 초록색을 얻는다.[39]엽록소는 물에 녹지 않으며, 우선 소량의 식물성 기름과 혼합하여 원하는 용액을 얻는다.[citation needed]
생물학적 이용
2002년 한 연구에서는 "강한 빛에 노출된 침전물은 어둠 속에 보관된 침전물과 달리 주요 안테나 단백질이 분해되어 격리된 단백질의 조명에 관한 연구와 일치한다"고 밝혀내었다.이는 식물의 단기적 행동에서 "활성 산소종이 생체내 역할을 한다"는 가설을 뒷받침하는 것으로 저자들에게 나타났다.[40]
참고 항목
| 위키미디어 커먼즈에는 엽록소와 관련된 미디어가 있다. |
참조
- ^ a b Virtanen, Olli; Constantinidou, Emanuella; Tyystjärvi, Esa (2020). "Chlorophyll does not reflect green light – how to correct a misconception". Journal of Biological Education: 1–8. doi:10.1080/00219266.2020.1858930.
- ^ May P. "Chlorophyll". University of Bristol.
- ^ "chlorophyll". Online Etymology Dictionary.
- ^ Muneer S, Kim EJ, Park JS, Lee JH (March 2014). "Influence of green, red and blue light emitting diodes on multiprotein complex proteins and photosynthetic activity under different light intensities in lettuce leaves (Lactuca sativa L.)". International Journal of Molecular Sciences. 15 (3): 4657–70. doi:10.3390/ijms15034657. PMC 3975419. PMID 24642884.
- ^ Speer BR (1997). "Photosynthetic Pigments". UCMP Glossary (online). University of California Museum of Paleontology. Retrieved 2010-07-17.
- ^ 참조:
- Delépine M (September 1951). "Joseph Pelletier and Joseph Caventou". Journal of Chemical Education. 28 (9): 454. Bibcode:1951JChEd..28..454D. doi:10.1021/ed028p454.
- 펠레티에와 카벤투 (1817) "Notice sur la matiere 꼭지점 des feuille"(잎의 녹색 물질에 대한 공지), 저널 드 파르미티 (Journal de Pharmicie) 3 : 486-491.490페이지에, 저자들은 엽록소의 새로운 이름을 제안한다.From p. 490: "Nous n'avons aucun droit pour nommer une substance connue depuis long-temps, et à l'histoire de laquelle nous n'avons ajouté que quelques faits ; cependant nous proposerons, sans y mettre aucune importance, le nom de chlorophyle, de chloros, couleur, et φυλλον, feuille : ce nom indiquerait le rôle qu'elle joue dans la nature." (We ha 오랫동안 알려진 물질에 이름을 붙일 권리는 없으며, 우리가 단지 몇 가지 사실만을 덧붙인 그 물질에 대해 우리는 어떠한 중요성도 주지 않고 클로로스, 색, φυλλον, 잎에서 엽록소라는 이름을 제안할 것이다. 이 이름은 자연에서 하는 역할을 나타낼 것이다.)
- ^ Willstätter R (1906). "Zur Kenntniss der Zusammensetzung des Chlorophylls" [Contribution to the knowledge of the composition of chlorophyll]. Annalen der Chemie (in German). 350 (1–2): 48–82. doi:10.1002/jlac.19063500103.
From p. 49: "Das Hauptproduct der alkalischen Hydrolyse bilden tiefgrüne Alkalisalze. In ihnen liegen complexe Magnesiumverbindungen vor, die das Metall in einer gegen Alkali auch bei hoher Temperatur merkwürdig widerstandsfähigen Bindung enthalten." (Deep green alkali salts form the main product of alkali hydrolysis. In them, complex magnesium compounds are present, which contain the metal in a bond that is extraordinarily resistant to alkali even at high temperature.)
- ^ a b Motilva M (2008). "Chlorophylls – from functionality in food to health relevance". 5th Pigments in Food congress- for quality and health (Print). University of Helsinki. ISBN 978-952-10-4846-3.
- ^ Woodward RB, Ayer WA, Beaton JM, Bickelhaupt F, Bonnett R, Buchschacher P, et al. (July 1960). "The total synthesis of chlorophyll" (PDF). Journal of the American Chemical Society. 82 (14): 3800–3802. doi:10.1021/ja01499a093.
- ^ Fleming I (14 October 1967). "Absolute Configuration and the Structure of Chlorophyll". Nature. 216 (5111): 151–152. Bibcode:1967Natur.216..151F. doi:10.1038/216151a0. S2CID 4262313.
- ^ Woodward RB, Ayer WA, Beaton JM, Bickelhaupt F, Bonnett R, Buchschacher P, et al. (1990). "The total synthesis of chlorophyll a". Tetrahedron. 46 (22): 7599–7659. doi:10.1016/0040-4020(90)80003-Z.
- ^ Jabr F (August 2010). "A New Form of Chlorophyll?". Scientific American.
- ^ 적외선 엽록소는 태양 전지를 증가시킬 수 있다.뉴 사이언티스트.2010년 8월 19일.2012-04-15년에 검색됨.
- ^ a b Chen M, Schliep M, Willows RD, Cai ZL, Neilan BA, Scheer H (September 2010). "A red-shifted chlorophyll". Science. 329 (5997): 1318–9. Bibcode:2010Sci...329.1318C. doi:10.1126/science.1191127. PMID 20724585. S2CID 206527174.
- ^ Carter JS (1996). "Photosynthesis". University of Cincinnati. Archived from the original on 2013-06-29.
- ^ Nature (July 5, 2013). "Unit 1.3. Photosynthetic Cells". Essentials of Cell Biology. nature.com.
- ^ Scheer H (2006). "An Overview of Chlorophylls and Bacteriochlorophylls: Biochemistry, Biophysics, Functions and Applications". Chlorophylls and Bacteriochlorophylls. Advances in Photosynthesis and Respiration. Vol. 25. pp. 1–26. doi:10.1007/1-4020-4516-6_1. ISBN 978-1-4020-4515-8.
- ^ Taniguchi, Masahiko; Lindsey, Jonathan S. (2017). "Synthetic Chlorins, Possible Surrogates for Chlorophylls, Prepared by Derivatization of Porphyrins". Chemical Reviews. 117 (2): 344–535. doi:10.1021/acs.chemrev.5b00696. OSTI 1534468. PMID 27498781.
- ^ Marker AF (1972). "The use of acetone and methanol in the estimation of chlorophyll in the presence of phaeophytin in plant". Freshwater Biology. 2 (4): 361–385. doi:10.1111/j.1365-2427.1972.tb00377.x.
- ^ Jeffrey SW, Shibata (February 1969). "Some Spectral Characteristics of Chlorophyll c from Tridacna crocea Zooxanthellae". Biological Bulletin. 136 (1): 54–62. doi:10.2307/1539668. JSTOR 1539668.
- ^ Gilpin L (21 March 2001). "Methods for analysis of benthic photosynthetic pigment". School of Life Sciences, Napier University. Archived from the original on April 14, 2008. Retrieved 2010-07-17.
- ^ Cate TM, Perkins TD (October 2003). "Chlorophyll content monitoring in sugar maple (Acer saccharum)". Tree Physiology. 23 (15): 1077–9. doi:10.1093/treephys/23.15.1077. PMID 12975132.
- ^ Gross J (1991). Pigments in vegetables: chlorophylls and carotenoids. Van Nostrand Reinhold. ISBN 978-0442006570.
- ^ Porra RJ, Thompson WA, Kriedemann PE (1989). "Determination of accurate extinction coefficients and simultaneous equations for assaying chlorophylls a and b extracted with four different solvents: verification of the concentration of chlorophyll standards by atomic absorption spectroscopy". Biochimica et Biophysica Acta (BBA) - Bioenergetics. 975 (3): 384–394. doi:10.1016/S0005-2728(89)80347-0.
- ^ Larkum AW, Douglas S, Raven JA, eds. (2003). Photosynthesis in algae. London: Kluwer. ISBN 978-0-7923-6333-0.
- ^ Gitelson AA, Buschmann C, Lichtenthaler HK (1999). "The Chlorophyll Fluorescence Ratio F735/F700 as an Accurate Measure of Chlorophyll Content in Plants". Remote Sens. Environ. 69 (3): 296–302. Bibcode:1999RSEnv..69..296G. doi:10.1016/S0034-4257(99)00023-1.
- ^ Battersby AR (December 2000). "Tetrapyrroles: the pigments of life". Natural Product Reports. 17 (6): 507–26. doi:10.1039/B002635M. PMID 11152419.
- ^ Akhtar M (2007). "The Modification of Acetate and Propionate Side Chains During the Biosynthesis of Haem and Chlorophylls: Mechanistic and Stereochemical Studies". Ciba Foundation Symposium 180 - the Biosynthesis of the Tetrapyrrole Pigments. Novartis Foundation Symposia. Vol. 180. pp. 131–155. doi:10.1002/9780470514535.ch8. ISBN 9780470514535. PMID 7842850.
- ^ Willows RD (June 2003). "Biosynthesis of chlorophylls from protoporphyrin IX". Natural Product Reports. 20 (3): 327–41. doi:10.1039/B110549N. PMID 12828371.
- ^ Schmid HC, Rassadina V, Oster U, Schoch S, Rüdiger W (November 2002). "Pre-loading of chlorophyll synthase with tetraprenyl diphosphate is an obligatory step in chlorophyll biosynthesis" (PDF). Biological Chemistry. 383 (11): 1769–78. doi:10.1515/BC.2002.198. PMID 12530542. S2CID 3099209.
- ^ Eckhardt U, Grimm B, Hörtensteiner S (September 2004). "Recent advances in chlorophyll biosynthesis and breakdown in higher plants". Plant Molecular Biology. 56 (1): 1–14. doi:10.1007/s11103-004-2331-3. PMID 15604725. S2CID 21174896.
- ^ Bollivar DW (November 2006). "Recent advances in chlorophyll biosynthesis". Photosynthesis Research. 90 (2): 173–94. doi:10.1007/s11120-006-9076-6. PMID 17370354. S2CID 23808539.
- ^ Muraki N, Nomata J, Ebata K, Mizoguchi T, Shiba T, Tamiaki H, Kurisu G, Fujita Y (May 2010). "X-ray crystal structure of the light-independent protochlorophyllide reductase". Nature. 465 (7294): 110–4. Bibcode:2010Natur.465..110M. doi:10.1038/nature08950. PMID 20400946. S2CID 4427639.
- ^ Meskauskiene R, Nater M, Goslings D, Kessler F, op den Camp R, Apel K (October 2001). "FLU: a negative regulator of chlorophyll biosynthesis in Arabidopsis thaliana". Proceedings of the National Academy of Sciences of the United States of America. 98 (22): 12826–31. Bibcode:2001PNAS...9812826M. doi:10.1073/pnas.221252798. JSTOR 3056990. PMC 60138. PMID 11606728.
- ^ "Chlorophyll Cycle". IUBMB. 2011. Retrieved 2020-06-04.
- ^ a b Hörtensteiner S (2006). "Chlorophyll degradation during senescence". Annual Review of Plant Biology. 57: 55–77. doi:10.1146/annurev.arplant.57.032905.105212. PMID 16669755.
- ^ Müller T, Ulrich M, Ongania KH, Kräutler B (2007). "Colorless tetrapyrrolic chlorophyll catabolites found in ripening fruit are effective antioxidants". Angewandte Chemie. 46 (45): 8699–702. doi:10.1002/anie.200703587. PMC 2912502. PMID 17943948.
- ^ 엽록소: 글로벌 맵.Earthobservatory.nasa.gov.2014-02-02에 검색됨
- ^ Adams J (2004). Hideous absinthe : a history of the devil in a bottle. United Kingdom: I.B.Tauris, 2004. p. 22. ISBN 978-1860649202.
- ^ Zolla L, Rinalducci S (December 2002). "Involvement of active oxygen species in degradation of light-harvesting proteins under light stresses". Biochemistry. 41 (48): 14391–402. doi:10.1021/bi0265776. PMID 12450406.






 a + diphosphate.
a + diphosphate.