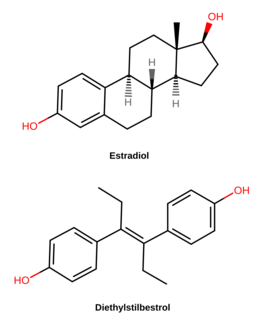
디에틸스틸베스트롤
Diethylstilbestrol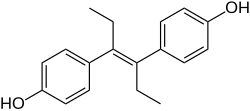 | |
 | |
| 임상 데이터 | |
|---|---|
| 기타 이름 | DES, 스틸보이스트롤, 스틸베스트롤, (E)-11,12-디에틸-4,13-스틸베네디올 |
| AHFS/Drugs.com | Micromedex 상세 소비자 정보 |
| 임신 카테고리 |
|
| 루트 행정부. | 구강, 질, 국소, 정맥, 근육내 주사(에스테르로서) |
| 약물 클래스 | 비스테로이드성 에스트로겐 |
| ATC 코드 | |
| 약동학 데이터 | |
| 바이오 어베이러빌리티 | 흡수가[1] 잘 된 |
| 단백질 결합 | 95%[2] 이상 |
| 대사 | 히드록실화, 산화, 글루쿠론화[1][2][3] |
| 대사물 | • (Z,Z)-디에네스트롤[1] • 파르옥시프로피온[1] • 글루쿠로니드[2][3] |
| 반감기 제거 | 24시간[1][4] |
| 배설물 | 소변, 대변[2][3] |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 첸블 | |
| CompTox 대시보드 (EPA ) | |
| ECHA 정보 카드 | 100.000.253 |
| 화학 및 물리 데이터 | |
| 공식 | C18H20O2 |
| 몰 질량 | 268.356 g/g−1/g |
| 3D 모델(JSmol) | |
| |
| |
| (표준) | |
디에틸스틸베스트롤(DES)은 비스테로이드성 에스트로겐 약물로, 현재는 거의 [5][6][7]사용되지 않는다.과거에는 재발 유산이력 여성의 임신 지원, 여성의 갱년기 증상 및 에스트로겐 결핍에 대한 호르몬 치료, 남성의 전립선암 치료, 여성의 유방암 치료 등 다양한 [5]징후로 널리 사용되었다.2007년까지 그것은 전립선암과 [8]유방암 치료에만 사용되었다.2011년, 후버와 동료들은 불임, 유산, 자궁외 임신, 전임증, 조기 출산, 사산, 영아 사망, 45세 이전의 폐경, 유방암, 자궁경부암, [9]질암 등 DES와 관련된 부정적인 건강 결과를 보고했다.DES는 구강으로 가장 일반적으로 복용되지만 질, 국소 및 주입과 같은 다른 경로에서도 사용할 수 있었다.
DES는 에스트라디올과 [7]같은 에스트로겐의 생물학적 표적인 에스트로겐 수용체의 작용제 또는 작용제이다.그것은 스틸베스트롤 그룹의 합성 및 비스테로이드성 에스트로겐이며,[7] 천연 에스트로겐 에스트라디올과는 여러 면에서 다릅니다.에스트라디올에 비해 DES는 경구 섭취 시 생체 가용성이 크게 향상되고 신진대사에 대한 저항력이 강하며 간,[7] 자궁 등 신체 특정 부위에서 상대적으로 높은 효과를 보인다.이러한 차이로 인해 DES는 혈전, 심혈관 문제 및 기타 부작용의 위험이 [7]높아집니다.
DES는 1938년에 발견되어 [10][11]1939년에 의료용으로 도입되었습니다.약 1940년부터 1971년까지 임신 합병증과 손실의 [10]위험을 줄일 수 있다는 잘못된 믿음으로 임신부들에게 이 약이 투여되었다.1971년,[10][5] DES는 자궁에서 이 약물에 노출된 소녀들과 여성들에게 희귀한 질 종양인 클리어 세포 암을 일으키는 것으로 나타났다.미국 식품의약국은 이후 임산부 [10][5]치료제로서 DES의 승인을 철회했다.후속 연구는 DES가 [10][12]피폭자의 수명 동안 다양한 유의한 의료 합병증을 일으킬 수 있다는 것을 보여준다.
미국 국립암연구소는[13] DES를 복용한 산모에게서 태어난 여성들에게 정기적으로 특별한 건강검진을 받도록 권고하고 있다.임신 중 DES에 노출된 사람은 일반적으로 "DES 딸"과 "DES 아들"[10][14]이라고 불립니다.DES의 독성 효과가 발견된 이후, DES는 대부분 중단되었고 현재는 대부분 [10][15]더 이상 판매되지 않습니다.
의료 용도
이 섹션은 확인을 위해 추가 인용문이 필요합니다.(2017년 9월 (이 및 ) |
DES는 과거에 다음과 같은 [5][additional citation(s) needed]표시로 사용되었습니다.
- 임신 중 재발성 유산
- 화끈거림, 질 위축 등 갱년기 증상 치료를 위한 갱년기 호르몬 요법
- 저에스트로겐증에 대한 호르몬 치료(예: 생식선 이상, 조기 난소 기능 상실, 난소 절제 후)
- 유방 발병을[16] 예방하거나 되돌리기 위한 산후 수유 억제
- 임질염(항생제 페니실린 투입 후 중단)
- 전립선암과 유방암
- 키가 큰 사춘기 소녀들의 키 큰 키 방지
- 소녀와 여성의 여드름 치료
- 응급 산후 피임약으로
- 남성 및 성범죄자의 과성 및 경구 거세의 화학적 거세의 수단으로서
- 고나도트로핀 방출 호르몬 작용제(GnRH 작용제) 치료[17][18][19][20][21][22][23] 시작 시 테스토스테론 플레어 예방
- 트랜스젠더[24][25] 여성을 위한 여성화 호르몬 치료
DES는 갱년기 호르몬 [26][5]치료에서 하루에 0.2~0.5mg의 용량으로 사용되었다.
남성들에게 전립선암을 치료하기 위해 DES를 사용하는 것에 대한 관심은 [27][28][29][30][31][32][33]오늘날에도 계속되고 있다.그러나 폴리에스트라디올 인산염과 같은 생체 동질 비경구 에스트로겐의 사용은 심혈관 [34][31][33]독성 위험이 훨씬 낮기 때문에 DES와 같은 경구 합성 에스트로겐을 선호한다.전립선암과 더불어 여성의 유방암 치료에 DES를 사용하는 것에 대한 관심이 오늘날에도 계속되고 있다.[35][36]그러나 전립선암의 경우와 유사하게 유방암에 [35][37]DES 대신 에스트라디올과 같은 생체동질 에스트로겐을 사용해야 한다는 주장이 제기되어[who?] 왔다.
경구 DES는 전립선암으로 [38]안드로겐 결핍 치료를 받고 있는 남성의 핫플래시 치료에 효과적이다.
부작용
1일 1mg 이상에서 DES는 메스꺼움, 구토, 복부 불쾌감, 두통 및 팽창(확률 15~50%)[39]을 포함한 높은 부작용 비율과 관련이 있다.
가슴의 변화와 여성화
DES [5][40][41][42][43][44][45][46]치료로 유방 유륜의 색소침착은 종종 매우 어둡고 거의 검은색이다.DES와 같은 합성 에스트로겐에서 발생하는 색소는 [5][40]에스트라디올과 같은 천연 에스트로겐보다 훨씬 크다.그 차이의 메커니즘은 [5]불분명하다.히드록시프로게스테론 카프로에이트와 같은 프로게스토겐은 고용량 에스트로겐 치료에 [47]의해 유발되는 유두과 색소 침착을 감소시키는 것으로 보고되었다.
전립선암 치료를 받은 남성에서 DES는 41~77%[48]의 높은 비율의 여성유방증(유방발달)을 생성하는 것으로 밝혀졌다.
혈전 및 심혈관 문제
전립선암에 걸린 남성을 위한 고용량 에스트로겐 치료의 한 형태로서 DES에 대한 연구에서, 그것은 상당한 심혈관 질환률과 [28][5]사망률과 관련이 있다.위험은 용량에 [28]따라 달라진다.1일 5mg DES의 복용량은 비암 관련(대부분 심혈관)[28] 사망의 36% 증가와 관련이 있다.또한 정맥 혈전 [49]색전증의 발생률은 최대 15%이다.DES의 3mg/일 투여량은 9.6~17%의 혈전 색전증 발병률과 33.[28]3%의 심혈관 합병증 발병률과 관련이 있다.1일 1mg의 낮은 용량 DES는 14.8%의 심혈관 사건으로 인한 사망률과 관련이 있다(구강 절제술의 경우 [28]8.3%에 비해 상대적으로 높다).
기타 장기적인 영향
DES는 다양한 장기 부작용과 연계되어 있다. 예를 들어, DES의 위험 증가는
임신 중 치료를 받은 여성 및/[50]또는 그 자손에게.
1993년 포괄적인 동물 연구는 다음과 같은 DES로부터 과도한 부작용을 발견했다.
- 유전독성(퀴논 대사물에 의한)
- 기형성
- 음경 및 고환저형성
- (쥐와 붉은털원숭이에서) 크립토르키디즘(cryptorchidism,
- 간암 및 신장암(햄스터), 난소유두암(송곳니) 및
- 악성 자궁 중피종(다람쥐 원숭이)[51]ADHD를 F2 세대와 연관짓는 증거도 발견돼 [52]발암물질 외에 최소한 신경학적 및 세대 간 영향이 있다는 것을 입증했다.
설치류 연구에 따르면 암컷 생식기 암과 F2 세대에 이르는 기형이 밝혀졌으며, DES [53]산모의 손자녀에게서 성간 생리 주기 불규칙과 같은 부작용의 증거가 있다.또한 증거는 F2아들의 저감소증 [54]등 세대 간 영향을 지적합니다.그러나 현시점에서 인간의 DES 세대 간 영향의 정도는 완전히 파악되지 않았다.
과다 복용
DES는 과거 임상 연구에서 1,500 -[35][55][56] 5,000mg/일의 매우 높은 용량으로 평가되었다.
약리학
약역학
에스트로겐 활성
DES는 에스트로겐입니다. 구체적으로는 두 에스트로겐 수용체 모두의 매우 [57][58]강력한 완전 작용제입니다.ERα와 ERβ에서 각각 [59]에스트라디올 친화력의 약 468%와 295%를 가진다.그러나 ERα와 ERβ에 대해 각각 0.18nM과 0.06nM의 DES 값이 보고되었으며50, 이는 두 수용체에 대한 결합 친화력에도 불구하고 ERα보다 [60]ERβ 활성화에 대한 여러 배 선호도를 시사한다.핵 ER 외에 DES는 비교적 낮은 친화력(약 1,000nM)[61]을 가지지만 G 단백질 결합 에스트로겐 수용체(GPER)의 작용제이다.DES는 에스트라디올과 [62][63]같은 천연 에스트로겐에 기인하는 동일한 생물학적 영향을 모두 생성한다.이것은 자궁, 질, 유선, 뇌하수체,[62][63][64][65] 그리고 다른 조직에서의 영향을 포함한다.
1 mg/day DES의 용량은 전신 에스트로겐의 [1][4]효력 측면에서 50 µg/day 에티닐에스트라디올의 용량과 거의 동등하다.에티닐에스트라디올과 유사하게, DES는 간 단백질 [7]합성에 현저하고 불균형적으로 강한 효과를 보인다.전신 에스트로겐 효력은 미량화된 에스트라디올과 유사한 효력을 가진 에스트로피네이트(피페라진 에스트로겐 황산염)의 약 3.8배인 반면, DES의 간 에스트로피네이트 효력은 에스트로피네이트의 28배(또는 동등한 전신 에스트로겐 효과가 [1]있는 용량에 대해서는 약 7.5배)였다.
DES는 남성의 [66]전립선암 치료에 최소한 세 가지 작용 메커니즘을 가지고 있다.성선 안드로겐 생성 및 항나토픽 효과로 인해 순환 안드로겐 수치를 억제하고, 간 성호르몬 결합 글로불린(SHBG) 생성을 자극하여 SHBG의 순환 수준을 증가시키고, 순환 중인 테스토스테론 및 디히드로테스트스테론(DHT)의 활성 비율을 감소시키며, d를 가질 수 있다.고환과 [66]전립선에 세포독성 효과가 있다.DES는 또한 [66]고용량에서 DNA 합성을 감소시키는 것으로 밝혀졌다.
DES는 약 [67][68]24시간 동안 핵을 보유하는 오래 작용하는 에스트로겐이다.
| 에스트로겐 | HF | VE | UCa | FSH | LH | HDL-C | SHBG | CBG | AGT | Liver |
|---|---|---|---|---|---|---|---|---|---|---|
| 에스트라디올 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 |
| 에스트로네 | ? | ? | ? | 0.3 | 0.3 | ? | ? | ? | ? | ? |
| 에스트리올 | 0.3 | 0.3 | 0.1 | 0.3 | 0.3 | 0.2 | ? | ? | ? | 0.67 |
| 황산에스트론 | ? | 0.9 | 0.9 | 0.8–0.9 | 0.9 | 0.5 | 0.9 | 0.5–0.7 | 1.4–1.5 | 0.56–1.7 |
| 켤레 에스트로겐 | 1.2 | 1.5 | 2.0 | 1.1–1.3 | 1.0 | 1.5 | 3.0–3.2 | 1.3–1.5 | 5.0 | 1.3–4.5 |
| 황산 에퀼린 | ? | ? | 1.0 | ? | ? | 6.0 | 7.5 | 6.0 | 7.5 | ? |
| 에티닐에스트라디올 | 120 | 150 | 400 | 60–150 | 100 | 400 | 500–600 | 500–600 | 350 | 2.9–5.0 |
| 디에틸스틸베스트롤 | ? | ? | ? | 2.9–3.4 | ? | ? | 26–28 | 25–37 | 20 | 5.7–7.5 |
| 컴파운드 | 특정 용도를 위한 용량([a]통상 mg) | ||||||
|---|---|---|---|---|---|---|---|
| ETD[b] | EPD[b] | MSD[b] | MSD[c] | OID[c] | TSD[c] | ||
| 에스트라디올(비미크론) | 30 | ≥120–300 | 120 | 6 | - | - | |
| 에스트라디올(미립자화) | 6–12 | 60–80 | 14–42 | 1–2 | 5를 넘다 | >8 | |
| 에스트라디올 발라레이트 | 6–12 | 60–80 | 14–42 | 1–2 | - | >8 | |
| 에스트라디올 안식향산염 | - | 60–140 | - | - | - | - | |
| 에스트리올 | ≥20 | 120~150[d] | 28–126 | 1–6 | 5를 넘다 | - | |
| 숙신산 에스트리올 | - | 140~150[d] | 28–126 | 2–6 | - | - | |
| 황산에스트론 | 12 | 60 | 42 | 2 | - | - | |
| 켤레 에스트로겐 | 5–12 | 60–80 | 8.4–25 | 0.625–1.25 | 3.75 이상 | 7.5 | |
| 에티닐에스트라디올 | 200μg | 1–2 | 280μg | 20~40μg | 100μg | 100μg | |
| 메스트라놀 | 300μg | 1.5–3.0 | 300~600μg | 25~30μg | 80μg 이상 | - | |
| 퀴네스트롤 | 300μg | 2–4 | 500μg | 25~50μg | - | - | |
| 메틸에스트라디올 | - | 2 | - | - | - | - | |
| 디에틸스틸베스트롤 | 2.5 | 20–30 | 11 | 0.5–2.0 | 5를 넘다 | 3 | |
| 디프로피온산 DES | - | 15–30 | - | - | - | - | |
| 디엔스트롤 | 5 | 30–40 | 42 | 0.5–4.0 | - | - | |
| 디엔스트롤 디아세테이트 | 3–5 | 30–60 | - | - | - | - | |
| 헥스테롤 | - | 70–110 | - | - | - | - | |
| 클로로트리아니센 | - | 100을 넘다 | - | - | 48 이상 | - | |
| 메탈렌스트릴 | - | 400 | - | - | - | - | |
| 에스트로겐 | 형태 | 메이저 브랜드명 | EPD (14일) | 지속 | |
|---|---|---|---|---|---|
| 디에틸스틸베스트롤(DES) | 오일 용액 | 메테스트롤 | 20밀리그램 | 1mg 2 2~3일, 3mg 3 3일 | |
| 디에틸스틸베스트롤디프로피온산염 | 오일 용액 | 시렌 B | 12.5~15mg | 2.5mg 5 5일 | |
| 수성 현탁액 | ? | 5밀리그램 | ? mg = 21 ~28일 | ||
| 디메트롤(DES디메틸에테르) | 오일 용액 | Depot-Cyren, Depot-Oestromon, Retalon 지각 | 20 ~ 40 mg | ? | |
| 포스페스트롤(DES이인산)a | 수용액 | 혼반 | ? | 1일 미만 | |
| 디엔스트롤 디아세테이트 | 수성 현탁액 | 팜아시롤-크리스탈 서스펜션 | 50밀리그램 | ? | |
| 헥스테롤디프로피온산염 | 오일 용액 | 호르모에스트롤, 레탈론올레오섬 | 25 mg | ? | |
| 헥스테롤 이인산a | 수용액 | 사이토스테신, 파메스트린, 레탈론 아쿠오섬 | ? | 매우 짧다 | |
| 주의: 달리 언급하지 않는 한 모두 근육 내 주입으로 이루어집니다.각주 : = 정맥주사에 의한.출처:"템플릿"을 참조해 주세요. | |||||
항나토픽 효과
DES는 에스트로겐 활성으로 인해 항당향성 [79][66][90][91]효과가 있습니다.즉 시상하부-뇌하수체-성선축(HPG축)에 음성피드백(negative feedback)을 발휘하여 성선내 [79][66][90][91]성호르몬, 황체호르몬(LH) 및 모낭자극호르몬(FSH)의 분비를 억제하고 성호르몬 생성 및 생식체 생성 또는 성숙을 억제한다.여성의 배란 억제 연구 결과, 하루 5mg의 경구 DES가 92% 효과적이었으며, 배란은 단 한 [92][86]번의 주기로만 발생했다.DES는 1일 3mg 이상의 용량에서 1~2주 이내에 남성에서 테스토스테론 수치를 거세 범위(50ng/dL 미만)[79][91][93]로 지속적으로 억제한다.반대로, 1일 1mg의 DES 복용량은 남성에서 테스토스테론 수치를 거세 범위로 완전히 억제할 수 없으며, 이는 종종 거세 수준 바로 위(>50 ng/dL)[28][66][90]에서 안정된다.그러나, 1일 1mg DES는 개인 간 변동성이 [79][94]크지만 테스토스테론 수치를 약 50% 억제하는 것으로 보고되었다.1일 1mg 미만의 DES 복용량은 테스토스테론 [79]수치에는 영향을 미치지 않는다고 알려져 있다.그러나 시프로테론 아세테이트에 0.1mg/day의 "극저" 용량 DES를 추가하면 시너지 효과가 나타나고 [95][96][97]남성에서 테스토스테론 수치가 거세산염 범위로 억제되는 것으로 밝혀졌다.DES는 3mg/일 용량 300mg/일과 유사한 테스토스테론 억제를 가지며, 이는 테스토스테론 수치 억제가 최대 3mg/일임을 [98]시사한다.
기타 액티비티
ER 외에도, 체외 연구는 DES가 다른 다양한 스테로이드 호르몬 [60]수용체에서도 상대적으로 약하지만 활성을 가지고 있다는 것을 발견했다.반면 연구 데이터 암호화 표준의 지분 0.18nM과 0.06nM의 ERα과 ERβ에 EC50 값을 각각 약물에 1μM의를 넘어섰다 집중력 중요한 당질 코르티코이드 활동을 보였다는 0.1nM 덱사메사 손뿐만 아니라 남성 호르몬, 프로게스테론의 중요한 대립, 그리고 mineralocorticoid 수용체(75%85%, 50%inh.i양성 대조군 자극의 바이온(bion)을 모두 1μM)[60] 농도로 검출한다.또한 10μM [60]농도에서 PPAR and와 LXRα의 활성화가 약 25% 억제되었다.연구진은 그들이 아는 한 DES의 그러한 작용을 최초로 보고했으며, 이러한 작용이 예를 들어 전립선암(특히 DES의 높은 투여량이 사용되는 [60]경우)에서 DES의 임상 효과에 관여할 수 있다는 가설을 세웠다.그러나, 그들은 또한 활동의 중요성으로 인해 약리학적으로 관련된 [60]용량에서 동물 모델에 대한 추가 연구가 필요하다고 지적했다.
DES는 에스트로겐 관련 수용체(ERR)의 세 가지 동종인 ERRα,[99][100] ERRβ 및 ERRγ의 길항제인 것으로 확인되었다.반최대 억제는 약 1μM의 [100]농도에서 일어난다.
약동학
DES는 경구 [1]투여에 잘 흡수됩니다.1일 1mg DES 경구 투여 시 마지막 용량 이후 20시간 동안의 혈장 DES 수치는 0.9~1.9ng/mL(3.4~7.1nmol/L)[1]이었다.DES의 설하 투여는 여성의 [101]경구 DES와 거의 동일한 에스트로겐 효력을 가진 것으로 보인다.자궁내 DES는 자궁저형성증 [102]치료를 위해 연구되었다.경구 DES는 [103]주사에 의한 DES의 임상 에스트로겐 효력의 약 17~50%를 갖는 것으로 생각된다.
DES의 전달 반감기는 80분입니다.[1]SHBG 또는 코르티코스테로이드 결합 글로불린에는 친화력이 없으므로 혈액 [104]내 이러한 단백질에 결합하지 않는다.DES의 혈장 단백질 결합은 95%[2] 이상이다.
DES의 방향족 고리의 히드록실화와 에틸 측쇄의 후속 결합은 DES 대사의 80~90%를 차지하며, 산화는 나머지 10~20%를 차지하며 결합 반응에 [2][3]의해 지배된다.DES의 결합은 글루쿠론화로 구성되며, 산화는 (Z,Z)-디엔스트롤로의 [1][2][3]탈수소화를 포함한다.이 약물은 또한 [105]대사물로서 파르옥시프로피온을 생성하는 것으로 알려져 있다.DES는 세포 및 유전적 손상을 일으키는 일시적인 퀴논과 유사한 반응성 중간체를 생성하며,[1] 이는 DES의 알려진 발암 효과를 설명하는데 도움을 줄 수 있다.그러나 다른 연구에 따르면 DES의 독성 효과는 단순히 ER의 [106]과활성화 때문일 수 있다.에스트라디올과는 대조적으로 DES의 수산기는 에스트론 유사 [107]당량으로 산화되지 않는다.
DES의 제거 반감기는 [1]24시간입니다.DES의 대사물은 소변과 [2][3]대변으로 배출된다.
화학
DES는 스틸베스트롤(4,4'-dihydroxystilbene) 그룹의 [111]화합물에 속합니다.스테로이드 에스트로겐 에스트라디올의 [108]비스테로이드 오픈링 유사체입니다.DES는 또한 약한 에스트로겐성인 [111][112][110][109]아네톨로부터 준비될 수 있다.아네트홀은 탈메틸화되어 아놀과 아놀을 형성한 후 자발적으로 디아놀과 헥스테롤로 이합화되었고, 이후 DES는 헥스테롤의 [111][112][110][109]구조적 변형을 통해 합성되었다.X선 결정학에서 알 수 있듯이 DES의 분자 치수는 에스트라디올의 분자 치수와 거의 동일하며, 특히 말단 하이드록실기 [109]사이의 거리에 관해서는 더욱 그러하다.
역사
합성
DES는 1938년 초 당시 옥스퍼드 대학의 다이슨 페린스 연구소에서 로버트 로빈슨 경의 대학원생이었던 레온 골버그에 의해 처음 합성되었습니다.Golberg의 연구는 Courtauld Institute of Bihchemistry의 Wilfrid Lawson의 연구에 기초했다(현재 University College London의 일부인 Middlesex Hospital Medical School의 Edward Charles Dodds 경이 이끌었다.1938년 [113][114][115]2월 5일자 네이처지에 그것의 합성 보고서가 게재되었다.
DES 연구는 공적 자금을 사용하여 발견된 약물의 특허를 금지하는 정책을 가진 영국 의학 연구 위원회(MRC)의 자금 지원을 받았다.DES는 특허를 받지 않았기 때문에 전 세계 200개 이상의 제약 및 화학 회사에서 생산되었습니다.
임상 사용
DES는 [11]1939년에 의료용으로 처음 판매되었습니다.그것은 1941년 9월 19일 미국 식품의약국(FDA)에 의해 4가지 지표에 대해 최대 5mg의 알약으로 승인되었습니다: 임질염, 위축성 질염, 갱년기 증상, 유방 기관지 [115]예방을 위한 산후 수유 억제.항생제 페니실린을 사용할 수 있게 되었을 때 임질염 표시가 떨어졌다.처음부터 그 약은 매우 [116][117]논란이 많았다.
1941년, 시카고 대학의 찰스 허긴스와 클라렌스 호지스는 에스트라디올 벤조산염과 DES가 전이성 전립선암 [118][119]치료에 효과적인 첫 번째 약이라는 것을 발견했습니다.DES는 최초의 암 [120]치료제였다.
GnRH 작용제인 루프로렐린이 에스트로겐 효과가 없는 DES와 유사한 효능을 가진 것으로 밝혀지고 [93]1985년에 승인되기 전까지 40년 이상 동안 고치 절제술 또는 DES 또는 둘 다 증상 진행 전립선암의 표준 초기 치료제였다.
1940년대부터 1980년대 후반까지 DES는 난소 이상, 조기 난소 기능 상실, 난소 절제술 등 에스트로겐 결핍 상태에 대한 에스트로겐 대체 치료제로 FDA 승인을 받았다.
1940년대에 DES는 유산 경력이 있는 여성의 임신 부작용 예방을 위해 오프라벨로 사용되었다.1947년 7월 1일 FDA는 이 표시에 DES 사용을 승인했다.이러한 첫 번째 승인은 Bristol-Myers Squibb에 주어졌으며, 임신 중 25mg(나중에 100mg)의 DES 정제를 사용할 수 있게 되었다.같은 [121]해 말 다른 제약회사에도 승인이 내려졌다.권장되는 식이요법은 임신 7주와 8주(지난 생리 첫날부터)에 하루 5mg으로 시작해 14주까지 격주로 5mg씩 증가했고,[122] 이후 15주에는 하루 25mg에서 35주에는 하루 125mg으로 매주 5mg씩 증가했다.DES는 원래 임산부와 발육 중인 아기 모두에게 효과적이고 안전한 것으로 여겨졌다.그것은 공격적으로 판매되었고 일상적으로 처방되었다.매출은 1953년에 최고조에 달했다.
1950년대 초 시카고 대학의 이중맹검 임상시험은 [123]DES를 받거나 받지 않도록 할당된 여성의 임신 결과를 평가했다.연구는 임신 중 DES 복용의 이점을 보여주지 않았다. DES를 투여받은 여성에게서 임신 부작용은 감소하지 않았다.1960년대 후반까지 주요 산부인과 교과서 7권 중 6권은 DES가 유산을 [121][124]막는 데 효과가 없다고 말했다.
임신 부작용 예방을 위한 DES 사용을 뒷받침하는 증거가 없음에도 불구하고, DES는 1960년대까지 임산부에게 계속 제공되었다.1971년 New England Journal of Medicine에 발표된 보고서는 자궁에서 이 약물에 노출된 소녀들과 젊은 여성들에게 DES와 질 투명 세포 선암 사이의 가능한 연관성을 보여주었다.같은 해 말, FDA는 임산부에게 DES를 사용하지 말 것을 권고하는 FDA Drug Bulletin을 모든 미국 의사들에게 보냈다.FDA는 또한 DES 사용을 위한 표시로 유산 방지를 제거하고 DES [125]사용을 위한 금기로 임신을 추가했다.1975년 2월 5일, FDA는 25mg과 100mg의 DES를 1975년 [126]2월 18일부터 철수시켰다.1940년부터 1971년까지 임신 중 또는 자궁 내에서 DES에 노출된 사람의 수는 알려지지 않았지만 미국에서는 200만 명에 이를 수 있다.DES는 특히 프랑스, 네덜란드, 영국 등 다른 나라에서도 사용되었습니다.
1950년대부터 1970년대 초반까지, DES는 사춘기 이전의 소녀들에게 사춘기를 시작하고, 따라서 뼈의 성장판을 닫음으로써 성장을 멈추도록 처방되었다.암과의 분명한 연관성에도 불구하고 의사들은 계속해서 이 호르몬을 "키 초과"[127]에 대해 추천했다.
1960년에 DES는 폐경 [128]후 여성의 진행 유방암 치료에 안드로겐보다 더 효과적인 것으로 밝혀졌다.DES는 1977년 FDA가 DES와 유사하지만 부작용이 [129]적은 선택적 에스트로겐 수용체 조절제인 타목시펜을 승인하기 전까지 폐경 후 여성의 유방암에 대한 호르몬 치료제로 선택되었다.
1970년대와 1980년대의 의학 문헌의 여러 출처는 DES가 트랜스젠더 [130][131][132]여성에 대한 호르몬 치료의 구성요소로 사용되었음을 나타낸다.
1973년, 사후 피임약으로서의 라벨 외 DES 사용을 강간과 같은 응급 상황으로 제한하기 위해 FDA Drug Bulletin이 FDA가 승인했다고 밝힌 모든 미국 의사와 약사에게 FDA Drug Bulletin이 전송되었다.제한된 조건하에서 [133]DES의 사후 피임 사용.
1975년 FDA는 실제로 DES를 산후 피임약으로 판매하도록 어떤 제조업체에도 승인하지 않았지만,[134] 1975년 발표된 FDA 최종 규칙에 명시된 환자 라벨과 특수 포장을 제조사가 제공한다면 강간이나 근친상간과 같은 응급 상황에 대한 표시를 승인할 것이라고 말했다.사후피임약으로서의 DES의 오프라벨 사용을 막기 위해, FDA는 1975년 DES 25mg 정제들을 시장에서 제거하고, 첫 번째 블록 대문자로 "이 약품은 사후피임약으로 사용해서는 안 된다"는 문구를 바꾸도록 여전히 승인된 낮은 용량(5mg 이하)의 DES 라벨을 명령했다.용기 [126][135]및 상자 라벨의 눈에 잘 띄는 위치에 정보 패키지를 처방하는 의사의 라인.1980년대에 특정 일반 복합 경구 피임약의 유즈페 식이요법의 오프 라벨 사용은 사후 [136]피임약으로서 DES의 오프 라벨 사용을 대체했다.
1978년 FDA는 DES 및 기타 [137]에스트로겐에 대한 승인된 표시에서 유방 발병을 방지하기 위해 산후 수유 억제를 제거했다.1990년대에 DES에 대해 유일하게 승인된 징후는 폐경 후 여성의 전립선암 진행 치료와 유방암 진행 치료였다.미국의 마지막 DES 제조업체인 일라이 릴리는 1997년에 [citation needed]DES의 제조와 판매를 중단했다.
트라이얼
디에틸스틸베스트롤은 쥐를 대상으로 한 연구에서 수없이 사용되어 왔다.DES가 질암을 일으킨다는 것이 밝혀지자 수컷 쥐와 암컷 [138]쥐를 대상으로 한 실험이 시작되었다.이 수컷 쥐들 중 많은 수가 DES를 주입받았고 다른 수컷 쥐들은 올리브유를 주입받았고, [138]그들은 대조군으로 간주되었다.각 그룹은 같은 날 같은 양을 받았고, 연구원들은 빛 현미경, 전자 현미경, 그리고 공초점 레이저 현미경을 시행했다.전자현미경과 공초점 레이저 현미경 검사 모두 대조군 [138]쥐에 비해 36년 뒤 디에틸스틸베스트롤을 주입한 쥐에서 정자가 고환에서 생기는 체세포인 세르톨리 세포가 형성되는 것이 일반적이었다.실험 완료 후,[138] DES를 주입한 노년기의 쥐는 세르톨리 세포 성숙이 지연되고 부고환체가 발달하지 않으며 체중이 급격히 감소하는 것을 알 수 있었다.
사용된 암컷 쥐들은 근친교배되었고, 그들 대부분은 그들의 먹이에 결합된 DES를 받았다.이 쥐들은 디에틸스틸베스트롤을 투여받지 않은 그룹, 식단에 DES를 혼합한 그룹, 임신 [139]13일 이후에 DES를 투여한 그룹 등 세 그룹으로 나뉘었다.불행히도 DES를 맞은 쥐들은 새끼를 [139]낳기 전에 죽었다.임신 중 13일 동안 음식에서 DES를 받은 그룹은 조기 낙태와 분만 [139]실패를 초래했다.이러한 결과는 DES가 가능한 한 자주 투여되었을 때 임신에 해로운 영향을 미친다는 것을 보여주었다.임신 기간 후반에 디에틸스틸베스트롤을 투여한 것도 [139]쥐들 사이에서 낙태의 발생을 가시화했다.전반적으로 암컷 쥐의 DES와의 상호작용은 쥐의 낙태 경험, 부적절한 태아 성장, [139]불임의 증가로 결론지어졌다.
DES 치료를 받았거나 DES에 노출된 사람들에 대한 리뷰는 장기적인 효과가 얼마나 [140]나타날지 알아내기 위해 이루어졌다.사람들은 임신 기간 동안 오랫동안 DES로 치료를 받아왔고 호르몬 치료에 독성과 부작용이 있는 것으로 알려져 왔다."DES에 대한 노출은 DES 산모의 유방암 위험 증가(상대 위험, <2.0) 및 DES 딸의 평생 투명 세포 자궁경부암 위험 1/1000 ~ 1/10,[140]000과 관련이 있습니다."DES의 부작용은 사용 [140]후 암에 대한 위험을 증가시킬 수 있기 때문에 장기적인 것으로 입증되고 있다.많은 여성들이 임신 중에 DES를 사용했고 그것이 자손과 [140]산모에게 장기적으로 어떤 영향을 미칠지 보는 긴 줄이 있기 때문에 DES의 역효과가 이전 치료 후에 어디까지 미칠지 지켜보는 연구가 계속될 것이다.
규정
1938년, 동물에 대한 DES의 안전성을 시험할 수 있는 능력이 FDA에 의해 처음으로 확보되었다.예비 테스트의 결과는 DES가 동물의 생식 시스템에 해를 끼친다는 것을 보여주었다.이러한 결과를 사람에게 적용하는 것을 결정할 수 없었기 때문에 FDA는 규제 방식으로 [141]행동할 수 없었다.
DES 승인을 위한 신약 신청은 1940년 과학적 불확실성에 기초한 FDA의 결정으로 철회되었다.하지만, 이 결정은 상당한 정치적 압력을 초래했고, 그래서 FDA는 타협에 이르렀다.이 타협은 DES가 처방전에 의해서만 이용 가능하고 병에 미치는 영향에 대한 경고가 있어야 한다는 것을 의미했지만, 이 경고는 1945년에 철회되었다.1947년, DES는 유산 방지 방법으로서 당뇨병에 걸린 임산부에 대한 처방을 FDA로부터 최종 승인받았다.이것은 모든 임산부들에게 DES의 [141]처방이 널리 퍼지게 했다.
1971년 FDA는 임산부에게 [142]DES 처방을 하지 말 것을 권고했다.그 결과 DES는 1972년부터 미국 시장에서, 1978년부터 유럽 시장에서 철수하기 시작했지만 FDA는 여전히 [143]DES의 인체 사용 승인을 철회하지 않았다.
DES는 국제 암 연구 기구에 의해 그룹 1의 발암 물질로 분류되었다.DES는 발암물질로 분류된 후 2000년 [142]FDA 승인을 철회했다.DES는 현재 [144]FDA에 의해 허용된 수의사 및 연구 시험에만 사용되고 있습니다.
의료 윤리
디에틸스틸베스트롤의 승인 및 사용에 관한 의료윤리는 사용 당시 DES를 만들고 있던 FDA 및 제약회사의 조치 때문에 폐지되었습니다.미국 의약품 제조자 협회의 부회장인 Carson Frailey는 DES를 만드는 제약 회사에 고용되어 FDA(식품의약국)의 승인을 얻도록 지원했습니다.예방책으로부터의 후퇴의 저자 낸시 랭스턴:디에틸스틸베스트롤(DES), 내분비교란자 및 환경건강 규제(Environmental Health)는 "프레이리가 전국에서 온 54명의 의사에게 FDA에 편지를 보내도록 설득하여 총 5,000명 이상의 환자를 대상으로 한 임상 경험을 설명했습니다.오직 이 네가지fifty-four 의사들의 데이터 암호화 표준 승인되지 않아야 한다 그리고 그 결과, FDA는 의료진의 많은 사람들의 우려에 대한 FDA의 마약 책임자 시어도어 Klumpp은 FDA에 적힌 박범신 어떻게 DES비윤리적으로 승인되었다며, 자신의 승인 뒤에 있는 동기에 대해 보여 줬을 거에 대해 설명합니다 DES."[145]을 승인하면 추천하다고 느꼈다.그약물을 사용하려는 사람들보다는 제약회사들의 이익입니다.DES에 대한 이러한 승인은 DES가 사용자에게 [146]어떤 영향을 미칠지에 대한 고려가 거의 없었기 때문에 의료 윤리, 자율성, 비악성, 유익성 및 정의의 가치를 위반합니다.FDA 지도자들이 더 이상의 연구 없이 DES를 승인하고 DES 사용에 대한 의사들의 의견을 무시하도록 설득한 결정은 비윤리적이다.일단 DES가 공공 소비에 대해 승인되면, "[DES에 대한 경고]는 환자가 볼 수 없는 별도의 회람에서만 사용할 수 있게 되었다.의사들은 제약회사에 편지를 써서 요청해야만 이 경고장을 받을 수 있었다.기업과 FDA 규제당국 간의 서한에 따르면 두 그룹 모두 여성이 DES가 얼마나 많은 잠재적 위험을 일으킬 수 있는지 알게 되면 DES의 복용을 거부하거나 [145]약을 복용한 후 암이나 간 손상을 입었을 경우 회사와 처방받은 의사들을 고소할 수 있다고 우려했습니다."의사들과 FDA 규제 당국은 DES가 실패하여 제약회사들에게 수백만 달러의 손해를 입힐 것을 두려워했기 때문에 여성들은 DES의 가능한 효과에 대해 듣지 못했다.금전적인 이익만을 위해 미칠 수 있는 영향과 피해에 관계없이 잠재적으로 위험한 약을 환자에게 배포하는 행위는 비윤리적이다.
소송
1970년대에 DES의 장기적 효과 발견을 둘러싼 부정적인 평판은 미국에서 제조사를 상대로 한 소송의 물결을 일으켰다.이는 1980년 캘리포니아 대법원의 획기적인 판결인 신델 대 애보트 연구소의 결정으로 절정에 달했다.법원은 이 판결에서 특정 원고의 어머니가 약을 소비했을 당시 모든 DES 제조사에 대해 시장 점유율 비율에 비례하여 시장 점유율 책임 추정을 내렸다.
DES를 제조하는 제약회사와 시카고대학은 1950년대 임상시험에 대해 소송을 제기했다.세 명의 여성이 그들의 딸들이 자신과 [147]아들의 생식 이상뿐만 아니라 비정상적인 자궁경부 세포 형성이 발생했다고 주장했다.원고들은 법원에 집단 소송으로 자신들의 사건을 증명해 줄 것을 요청했지만 법원에서 거절당했다.그러나 법원은 자신들의 소송이 가치가 있다는 의견을 내놓았다.법원은 Eli Lilly가 DES의 위험을 알았거나 알게 되었을 때 DES의 [147]위험에 대해 알릴 의무가 있다고 판결했다.일리노이주 불법행위법에 따르면 원고가 경고 및 엄중한 책임에 대한 배임 이론에 따라 회복하려면 원고가 자신에게 상해를 입혔다고 주장해야 한다.결국 경고의무 위반과 엄중한 책임이라는 원고의 주장에 따라 [147]본인은 신체적 상해가 아닌 타인에 대한 상해 위험을 이유로 기각됐다.집단소송으로 인정되지 않았고 경고 및 엄중한 책임에 대한 배임 주장은 기각됐지만 법원은 배터리 의혹을 [147]기각하지 않았다.그 후 쟁점은 시카고 대학이 이 여성들에 대해 구타죄를 저질렀는지 여부를 확인하는 것이었으나 재판 [147]전에 사건은 해결되었다.대학 연구는 1950년 실험 기간 중뿐만 아니라DES-associated이나 자궁 경부 질 암이 어떤 여성의 딸들이 처리 DES에 자궁 속에서 노출된 자식에 대한 무료 검진을 제공하기 위하여 이 사건의 합의서의 일부분, 밍크 대 시카고 대학이 원고 측 변호사 협상을 했다.[147]
1991년 2월 현재 DES 제조업체에 대한 [147]법적 소송은 1,000건 이상 진행 중입니다.동일한 공식에 따라 DES를 제조한 회사는 300개 이상이며, 회복의 가장 큰 장벽은 각각의 [147]경우에 어떤 제조사가 그 약을 공급했는지를 결정하는 것입니다.성공한 사례의 대부분은 공동 또는 여러 당사자가 책임을 지고 있는 것에 의존해 왔다.
보스턴 연방법원에 53명의 DES 딸들에 의해 소송이 제기되었는데, 이 딸들은 DES가 임신 중 어머니에게 처방된 결과라고 말했다.그들의 소송은 도베르 청문회에서 살아남았다.2013년 유방암/DES 연계 소송을 시작한 Fecho 자매는 재판 둘째 날 미공개 합의 금액에 합의했다.나머지 소송자들은 여러 가지 [148]합의금을 받았다.
옹호 단체인 DES Action USA는 [149]소송에 참여한 DES 노출자들을 위한 정보와 지원을 제공하는 것을 도왔다.
사회와 문화
획기적인 암호학자, 컴퓨터 과학과 프로그램 가능 컴퓨터의 창시자인 앨런 튜링은 또한 생물학적 형태 형성의 실제 이론적 모델을 제안했고, 그가 애매한 권리에서 죽기 직전에 동성애 행동에 대한 징벌적이고 신뢰받지 못하는 "치료"로서 화학적 거세를 유도하도록 이 약물에 강요받았다.찬스[150]
제임스 헤리오트는 1974년 저서 All Things Bright and Beautiful에서 작은 개의 고환 서톨리 세포 종양을 치료한 사례를 설명한다.헤리오트는 재발하는 종양에 많은 양의 신약 스틸보에스트롤을 처방하기로 결정했는데, 수컷 개가 "다른 수컷 개들에게 매력적"이 되어 몇 주 동안 마을 주변을 테리어들을 따라다녔다는 흥미로운 부작용과 함께 말이다.헤리오트는 이 이야기에서 "신약이 여성화 효과가 있다고들 하지만, 확실히 그 정도는 아니다."라고 말했다.
수의학에서의 사용
개실금
DES는 괄약근 조절 불량으로 인한 암컷 개 요실금 치료에 매우 성공적이었다.그것은 여전히 복합 약국에서 구할 수 있으며, 낮은 용량(1mg)에서는 [151]사람에게서 문제가 되는 발암 특성을 가지고 있지 않다.일반적으로 하루에 한 번 7일에서 10일 정도 투여하고 필요에 따라 매주 한 번 투여합니다.
가축육성촉진
DES의 가장 큰 사용은 축산업으로, 쇠고기와 가금류의 사료 전환을 개선하는 데 사용되었습니다.1960년대에 DES는 쇠고기 및 가금류 산업에서 성장 호르몬으로 사용되었다.이후 1971년까지 암을 유발하는 것으로 밝혀졌지만 [152][153]1979년이 되어서야 서서히 제거되었다.DES는 인간에게 유해한 것으로 밝혀졌지만, 그 수의학적 사용이 즉시 중단되지는 않았다.DES는 2011년 현재도 [154]중국 등 세계 일부 지역에서 육지 축산이나 어류의 생육촉진제로 사용되고 있습니다.
레퍼런스
- ^ a b c d e f g h i j k l m Chabner B, Longo DL (1996). Cancer Chemotherapy and Biotherapy: Principles and Practice. Lippincott-Raven Publishers. p. 186. ISBN 978-0-397-51418-2.
Piperazine estrone sulfate and micronized estradiol were equipotent with respect to increases in SHBG, whereas [...] DES was 28.4-fold more potent [...]. With respect to decreased FSH, [...] DES was 3.8-fold, and ethinyl estradiol was 80 to 200-fold more potent than was piperazine estrone sulfate. The dose equivalents for ethinyl estradiol (50 µg) and DES (1 mg) reflect these relative potencies.220 [...] DES, a potent synthetic estrogen (Fig. 6-12), is absorbed well after an oral dosage. Patients given 1 mg of DES daily had plasma concentrations at 20 hours ranging from 0.9 to 1.9 ng per mL. The initial half-life of DES is 80 minutes, with a secondary half-life of 24 hours.223 The principal pathways of metabolism are conversion to the glucuronide and oxidation. The oxidative pathways include aromatic hydroxylation of the ethyl side chains and dehydrogenation to (Z,Z)-dienestrol, producing transient quinone-like intermediates that react with cellular macromolecules and cause genetic damage in eukaryotic cells.223 Metabolic activation of DES may explain its well-established carcinogenic properties.224
- ^ a b c d e f g h Oelschläger H, Rothley D, Dunzendorfer U (1988). "New Results on the Pharmacokinetics of Fosfestrol". Urologia Internationalis. 43 (1): 15–23. doi:10.1159/000281427. ISSN 1423-0399.
- ^ a b c d e f Droz JP, Kattan J, Bonnay M, Chraibi Y, Bekradda M, Culine S (February 1993). "High-dose continuous-infusion fosfestrol in hormone-resistant prostate cancer". Cancer. 71 (3 Suppl): 1123–30. doi:10.1002/1097-0142(19930201)71:3+<1123::AID-CNCR2820711434>3.0.CO;2-T. PMID 8428334. S2CID 23078614.
- ^ a b Abramson FP, Miller HC (December 1982). "Bioavailability, distribution and pharmacokinetics of diethystilbestrol produced from stilphostrol". J Urol. 128 (6): 1336–9. doi:10.1016/s0022-5347(17)53502-8. PMID 7154205.
- ^ a b c d e f g h i j Noller KL, Fish CR (July 1974). "Diethylstilbestrol usage: Its interesting past, important present, and questionable future". Med. Clin. North Am. 58 (4): 793–810. doi:10.1016/S0025-7125(16)32122-8. PMID 4276416.
- ^ Elks J (14 November 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. pp. 396–. ISBN 978-1-4757-2085-3.
- ^ a b c d e f Kuhl H (August 2005). "Pharmacology of estrogens and progestogens: influence of different routes of administration" (PDF). Climacteric. 8 (Suppl 1): 3–63. doi:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ Watkins ES (16 April 2007). The Estrogen Elixir: A History of Hormone Replacement Therapy in America. JHU Press. pp. 26–. ISBN 978-0-8018-8602-7.
- ^ "Effects of Diethylstilbestrol (DES), a Trans-placental Carcinogen". dceg.cancer.gov. 20 November 2012. Retrieved 3 September 2020.
- ^ a b c d e f g Veurink M, Koster M, Berg LT (June 2005). "The history of DES, lessons to be learned". Pharm World Sci. 27 (3): 139–43. doi:10.1007/s11096-005-3663-z. PMID 16096877. S2CID 12630813.
- ^ a b Feldberg GD, Ladd-Taylor M, Li A (2003). Women, Health and Nation: Canada and the United States Since 1945. McGill-Queen's Press - MQUP. pp. 103–. ISBN 978-0-7735-2501-6.
- ^ "DES Update: For Consumers". United States Department of Health and Human Services: Centers for Disease Control and Prevention. Retrieved 2011-06-30.
- ^ "Diethylstilbestrol (DES) and Cancer". National Cancer Institute. Retrieved 2011-06-30.
- ^ Arnold A (January 5, 2017). "The Devastating Effects of a 1940s 'Wonder Pill' Haunt Women Generations Later". Broadly.
- ^ Coelingh Bennink HJ (April 2004). "Are all estrogens the same?". Maturitas. 47 (4): 269–275. doi:10.1016/j.maturitas.2003.11.009. PMID 15063479.
- ^ Vorherr H (2 December 2012). The Breast: Morphology, Physiology, and Lactation. Elsevier Science. pp. 201–203. ISBN 978-0-323-15726-1.
- ^ Thompson IM (2001). "Flare Associated with LHRH-Agonist Therapy". Rev Urol. 3 (Suppl 3): S10–4. PMC 1476081. PMID 16986003.
- ^ Scaletscky R, Smith JA (April 1993). "Disease flare with gonadotrophin-releasing hormone (GnRH) analogues. How serious is it?". Drug Saf. 8 (4): 265–70. doi:10.2165/00002018-199308040-00001. PMID 8481213. S2CID 36964191.
- ^ Kreis W, Ahmann FR, Jordan VC, de Haan H, Scott M (October 1988). "Oestrogen pre-treatment abolishes luteinising hormone-releasing hormone testosterone stimulation". Br J Urol. 62 (4): 352–4. doi:10.1111/j.1464-410X.1988.tb04364.x. PMID 2973364.
- ^ Stein BS, Smith JA (April 1985). "DES lead-in to use of luteinizing hormone releasing hormone analogs in treatment of metastatic carcinoma of prostate". Urology. 25 (4): 350–3. doi:10.1016/0090-4295(85)90484-4. PMID 3920802.
- ^ Fernandez del Moral P, Litjens TT, Weil EH, Debruyne FM (August 1988). "Can combined DES and LHRH depot therapy (ICI 118630) prevent endocrinologic and clinical flare-up in metastatic prostate cancer?". Urology. 32 (2): 137–40. doi:10.1016/0090-4295(88)90316-0. PMID 2969641.
- ^ Bruchovsky N, Goldenberg SL, Akakura K, Rennie PS (September 1993). "Luteinizing hormone-releasing hormone agonists in prostate cancer. Elimination of flare reaction by pretreatment with cyproterone acetate and low-dose diethylstilbestrol". Cancer. 72 (5): 1685–91. doi:10.1002/1097-0142(19930901)72:5<1685::AID-CNCR2820720532>3.0.CO;2-3. PMID 7688656. S2CID 21824595.
- ^ Kotake T, Usami M, Akaza H, Koiso K, Homma Y, Kawabe K, Aso Y, Orikasa S, Shimazaki J, Isaka S, Yoshida O, Hirao Y, Okajima E, Naito S, Kumazawa J, Kanetake H, Saito Y, Ohi Y, Ohashi Y (November 1999). "Goserelin acetate with or without antiandrogen or estrogen in the treatment of patients with advanced prostate cancer: a multicenter, randomized, controlled trial in Japan. Zoladex Study Group". Jpn. J. Clin. Oncol. 29 (11): 562–70. doi:10.1093/jjco/29.11.562. PMID 10678560.
- ^ Hamburger C (1969). "Endocrine treatment of male and female transsexualism". In Money J, Green R (eds.). Transsexualism and Sex Reassignment. Johns Hopkins Press. pp. 291–307. ISBN 9780801810381. OCLC 6866559.
- ^ Ober WB (1976). "Stilbestrol: a pathologist's view". Pathol Annu. 11: 227–54. PMID 794803.
- ^ Buchsbaum HJ (6 December 2012). The Menopause. Springer Science & Business Media. pp. 60–. ISBN 978-1-4612-5525-3.
- ^ Reis LO, Zani EL, García-Perdomo HA (June 2018). "Estrogen therapy in patients with prostate cancer: a contemporary systematic review". Int Urol Nephrol. 50 (6): 993–1003. doi:10.1007/s11255-018-1854-5. PMID 29600433. S2CID 4403709.
- ^ a b c d e f g Turo R, Smolski M, Esler R, Kujawa ML, Bromage SJ, Oakley N, Adeyoju A, Brown SC, Brough R, Sinclair A, Collins GN (February 2014). "Diethylstilboestrol for the treatment of prostate cancer: past, present and future". Scand J Urol. 48 (1): 4–14. doi:10.3109/21681805.2013.861508. PMID 24256023. S2CID 34563641.
- ^ Bosset PO, Albiges L, Seisen T, de la Motte Rouge T, Phé V, Bitker MO, Rouprêt M (December 2012). "Current role of diethylstilbestrol in the management of advanced prostate cancer". BJU Int. 110 (11 Pt C): E826–9. doi:10.1111/j.1464-410X.2012.11206.x. PMID 22578092. S2CID 21407416.
- ^ Scherr DS, Pitts WR (November 2003). "The nonsteroidal effects of diethylstilbestrol: the rationale for androgen deprivation therapy without estrogen deprivation in the treatment of prostate cancer". J. Urol. 170 (5): 1703–8. doi:10.1097/01.ju.0000077558.48257.3d. PMID 14532759.
- ^ a b Oh WK (September 2002). "The evolving role of estrogen therapy in prostate cancer". Clin Prostate Cancer. 1 (2): 81–9. doi:10.3816/cgc.2002.n.009. PMID 15046698.
- ^ Malkowicz SB (August 2001). "The role of diethylstilbestrol in the treatment of prostate cancer". Urology. 58 (2 Suppl 1): 108–13. doi:10.1016/s0090-4295(01)01252-3. PMID 11502463.
- ^ a b Cox RL, Crawford ED (December 1995). "Estrogens in the treatment of prostate cancer". J. Urol. 154 (6): 1991–8. doi:10.1016/s0022-5347(01)66670-9. PMID 7500443.
- ^ Lycette JL, Bland LB, Garzotto M, Beer TM (December 2006). "Parenteral estrogens for prostate cancer: can a new route of administration overcome old toxicities?". Clin Genitourin Cancer. 5 (3): 198–205. doi:10.3816/CGC.2006.n.037. PMID 17239273.
- ^ a b c Coelingh Bennink HJ, Verhoeven C, Dutman AE, Thijssen J (January 2017). "The use of high-dose estrogens for the treatment of breast cancer". Maturitas. 95: 11–23. doi:10.1016/j.maturitas.2016.10.010. PMID 27889048.
- ^ Marselos M, Tomatis L (1992). "Diethylstilboestrol: I, Pharmacology, Toxicology and carcinogenicity in humans". Eur. J. Cancer. 28A (6–7): 1182–9. doi:10.1016/0959-8049(92)90482-h. PMID 1627392.
- ^ [비프라이머리 소스 필요] Ellis MJ, Dehdahti F, Kommareddy A, Jamalabadi-Majidi S, Crowder R, Jeffe DB, et al. (2014). "A randomized phase 2 trial of low dose (6 mg daily) versus high dose (30 mg daily) estradiol for patients with estrogen receptor positive aromatase inhibitor resistant advanced breast cancer". Cancer Research. 69 (2 Supplement): 16. doi:10.1158/0008-5472.SABCS-16. ISSN 0008-5472.
- ^ Moorthy HK, Laxman Prabhu GG, Venugopal P (2019). "The resurgence of estrogens in the treatment of castration-resistant prostate cancer". Indian J Urol. 35 (3): 189–196. doi:10.4103/iju.IJU_56_19. PMC 6639989. PMID 31367069.
- ^ Swyer GI (April 1959). "The oestrogens". Br Med J. 1 (5128): 1029–31. doi:10.1136/bmj.1.5128.1029. PMC 1993181. PMID 13638626.
[Diethylstilbestrol] suffers from the serious drawback that in doses above 1 mg. a day it is likely to produce nausea, vomiting, abdominal discomfort, headache, and bloating in a proportion of patients varyingly estimated from 15 to 50%.
- ^ a b Dell Castillo EB, Argonz J (April 1954). "Oestrogen treatment in cases of rudimentary ovary syndrome". Acta Endocrinologica. 15 (4): 299–312. doi:10.1530/acta.0.0150299. PMID 13157878.
- ^ Labhart A (6 December 2012). Clinical Endocrinology: Theory and Practice. Springer Science & Business Media. pp. 720–. ISBN 978-3-642-96158-8.
- ^ Davis ME, Boynton MW (1941). "Indications, clinical use and toxicity of 4-4' dihydroxy diethyl stilbene". The Journal of Clinical Endocrinology & Metabolism. 1 (4): 339–345. doi:10.1210/jcem-1-4-339. ISSN 0021-972X.
- ^ Davis ME, Boynton MW, Ferguson JH, Rothman S (1945). "Studies on Pigmentation of Endocrine Origin". The Journal of Clinical Endocrinology & Metabolism. 5 (3): 138–146. doi:10.1210/jcem-5-3-138. ISSN 0021-972X.
- ^ Lewis RM (December 1939). "The Clinical Use of Stilbestrol, A Synthetic Estrogen: Preliminary Report". The Yale Journal of Biology and Medicine. 12 (2): 235–8. PMC 2602231. PMID 21433876.
- ^ Lisser H, Curtis LE (October 1947). "The syndrome of congenitally aplastic ovaries with sexual infantilism, high urinary gonadotropins, short stature and other congenital abnormalities; tabular presentation of 25 previously unpublished cases". The Journal of Clinical Endocrinology and Metabolism. 7 (10): 665–87. doi:10.1210/jcem-7-10-665. PMID 20270944.
- ^ Hamblen EC (1943). "Endocrine therapy in gynecology and obstetrics". American Journal of Obstetrics and Gynecology. 45 (1): 147–160. doi:10.1016/S0002-9378(43)90672-6. ISSN 0002-9378.
- ^ Crowley LG, Macdonald I (April 1965). "Delalutin and estrogens for the treatment of advanced mammary carcinoma in the postmenopausal woman". Cancer. 18 (4): 436–46. doi:10.1002/1097-0142(196504)18:4<436::aid-cncr2820180407>3.0.co;2-d. PMID 14278040.
- ^ Di Lorenzo G, Autorino R, Perdonà S, De Placido S (December 2005). "Management of gynaecomastia in patients with prostate cancer: a systematic review". Lancet Oncol. 6 (12): 972–9. doi:10.1016/S1470-2045(05)70464-2. PMID 16321765.
- ^ Phillips I, Shah SI, Duong T, Abel P, Langley RE (2014). "Androgen Deprivation Therapy and the Re-emergence of Parenteral Estrogen in Prostate Cancer". Oncol Hematol Rev. 10 (1): 42–47. doi:10.17925/ohr.2014.10.1.42. PMC 4052190. PMID 24932461.
- ^ Bamigboye AA, Morris J (2003). "Oestrogen supplementation, mainly diethylstilbestrol, for preventing miscarriages and other adverse pregnancy outcomes". Cochrane Database Syst Rev. 2010 (3): CD004353. doi:10.1002/14651858.CD004353. PMC 9039959. PMID 12918007.
- ^ Marselos M, Tomatis L (1993). "Diethylstilboestrol: II, pharmacology, toxicology and carcinogenicity in experimental animals". European Journal of Cancer. 29A (1): 149–155. doi:10.1016/0959-8049(93)90597-9. PMID 1445734.
- ^ Kioumourtzoglou MA, Coull BA, O'Reilly ÉJ, Ascherio A, Weisskopf MG (July 2018). "Association of Exposure to Diethylstilbestrol During Pregnancy With Multigenerational Neurodevelopmental Deficits". JAMA Pediatrics. 172 (7): 670–677. doi:10.1001/jamapediatrics.2018.0727. PMC 6137513. PMID 29799929.
- ^ Titus-Ernstoff L, Troisi R, Hatch EE, Wise LA, Palmer J, Hyer M, et al. (August 2006). "Menstrual and reproductive characteristics of women whose mothers were exposed in utero to diethylstilbestrol (DES)". International Journal of Epidemiology. 35 (4): 862–868. doi:10.1093/ije/dyl106. PMID 16723367.
- ^ Kalfa N, Paris F, Soyer-Gobillard MO, Daures JP, Sultan C (June 2011). "Prevalence of hypospadias in grandsons of women exposed to diethylstilbestrol during pregnancy: a multigenerational national cohort study". Fertility and Sterility. 95 (8): 2574–2577. doi:10.1016/j.fertnstert.2011.02.047. PMID 21458804.
- ^ Carter AC, Sedransk N, Kelley RM, Ansfield FJ, Ravdin RG, Talley RW, Potter NR (May 1977). "Diethylstilbestrol: recommended dosages for different categories of breast cancer patients. Report of the Cooperative Breast Cancer Group". JAMA. 237 (19): 2079–8. doi:10.1001/jama.1977.03270460065023. PMID 576887.
- ^ Karnaky KJ (December 1952). "Micronized stilbestrol for dysfunctional uterine bleeding and endometriosis". South. Med. J. 45 (12): 1166–72. doi:10.1097/00007611-195212000-00009. PMID 13005120.
- ^ Jordan VC (2013). Estrogen Action, Selective Estrogen Receptor Modulators, and Women's Health: Progress and Promise. World Scientific. pp. 143–. ISBN 978-1-84816-958-6.
- ^ Seiler JP, Autrup JL, Autrup H (6 December 2012). Diversification in Toxicology — Man and Environment: Proceedings of the 1997 EUROTOX Congress Meeting Held in Århus, Denmark, June 25–28, 1997. Springer Science & Business Media. pp. 23–. ISBN 978-3-642-46856-8.
- ^ Kuiper GG, Carlsson B, Grandien K, Enmark E, Häggblad J, Nilsson S, Gustafsson JA (March 1997). "Comparison of the ligand binding specificity and transcript tissue distribution of estrogen receptors alpha and beta". Endocrinology. 138 (3): 863–870. doi:10.1210/endo.138.3.4979. PMID 9048584.
- ^ a b c d e f Coss CC, Jones A, Parke DN, Narayanan R, Barrett CM, Kearbey JD, Veverka KA, Miller DD, Morton RA, Steiner MS, Dalton JT (March 2012). "Preclinical characterization of a novel diphenyl benzamide selective ERα agonist for hormone therapy in prostate cancer". Endocrinology. 153 (3): 1070–81. doi:10.1210/en.2011-1608. PMID 22294742.
- ^ Prossnitz ER, Arterburn JB (July 2015). "International Union of Basic and Clinical Pharmacology. XCVII. G Protein-Coupled Estrogen Receptor and Its Pharmacologic Modulators". Pharmacological Reviews. 67 (3): 505–540. doi:10.1124/pr.114.009712. PMC 4485017. PMID 26023144.
- ^ a b Lackner JE, Tulsky AS (1941). "Effect of stilbestrol on the myometrial and endometrial activity of the human castrate uterus". The Journal of Clinical Endocrinology & Metabolism. 1 (5): 415–418. doi:10.1210/jcem-1-5-415. ISSN 0021-972X.
[Diethylstilbestrol], differing distinctly in chemical structure from the previously known estrogens, has been shown to produce all the biologic effects attributed to them, such as suppression of the antuitary (2), inhibition of body growth (2), proliferation of the ductile system of the breast (3), suppression of engorgement incident to lactation (4), hyperemia, edema, and distention of the uterus (5), proliferation of the endometrium (6), vaginal cornification (7), and swelling of the sexual skin (8). It likewise presumably has the supposed carcinogenic propensities of the true estrogens (9).
- ^ a b Jacobsen E, Christensen SS (1939). "Comparison of the effects of stilboestrol and oestrone on the mammary tissue of castrated female rats". Acta Pathologica et Microbiologica Scandinavica. 16 (4): 359–364. doi:10.1111/j.1600-0463.1939.tb06045.x. ISSN 0365-5555.
After it was shown by Dodds, Goldberg, Lawson, and Robinson that stilboestrol (4.4' dioxy-α-β-diethylstilbene had the same effects as the natural oestrones on the vaginal mucosa of castrated female rats, a great number of works have appeared, which show that this substance, despite its very great chemical difference from the natural female sexual hormones has practically the same effect as these in all respects. The most important of these investigations have been made by Dodds, Lawson and Noble, by Noble, by Bishop, Boycott and Zuckermann, by Erik Guldberg, by Engelhardt, by Winterton and MacGregor, by Erik Jacobsen and most recently by Kreitmair and Sickman, by Buschbeck and Hausknecht, by Cobet, Ratschow and Stechner. The previous experiments have been made on hens, mice, rats, guineapigs, rabbits, monkeys, and human subjects.
- ^ Lewis AA, Turner CW (1941). "Effect of Stilbestrol on the Mammary Gland of the Mouse, Rat, Rabbit, and Goat". Journal of Dairy Science. 24 (10): 845–860. doi:10.3168/jds.S0022-0302(41)95467-X. ISSN 0022-0302.
- ^ Lewis AA, Turner CW (1942). "Effect of Diethylstilbestrol on Mammary Gland Development in Dairy Animals1". Endocrinology. 31 (5): 520–528. doi:10.1210/endo-31-5-520. ISSN 0013-7227.
- ^ a b c d e f Denis LJ, Griffiths E, Kaisary AV, Murphy GP (1 March 1999). Textbook of Prostate Cancer: Pathology, Diagnosis and Treatment: Pathology, Diagnosis and Treatment. CRC Press. pp. 294, 297–. ISBN 978-1-85317-422-3.
- ^ Runnebaum B, Rabe T (17 April 2013). Gynäkologische Endokrinologie und Fortpflanzungsmedizin: Band 1: Gynäkologische Endokrinologie. Springer-Verlag. pp. 88–. ISBN 978-3-662-07635-4.
- ^ Hammond CB, Maxson WS (January 1982). "Current status of estrogen therapy for the menopause". Fertility and Sterility. 37 (1): 5–25. doi:10.1016/S0015-0282(16)45970-4. PMID 6277697.
- ^ Lauritzen C (September 1990). "Clinical use of oestrogens and progestogens". Maturitas. 12 (3): 199–214. doi:10.1016/0378-5122(90)90004-P. PMID 2215269.
- ^ Lauritzen C (June 1977). "[Estrogen thearpy in practice. 3. Estrogen preparations and combination preparations]" [Estrogen therapy in practice. 3. Estrogen preparations and combination preparations]. Fortschritte Der Medizin (in German). 95 (21): 1388–92. PMID 559617.
- ^ Wolf AS, Schneider HP (12 March 2013). Östrogene in Diagnostik und Therapie. Springer-Verlag. pp. 78–. ISBN 978-3-642-75101-1.
- ^ Göretzlehner G, Lauritzen C, Römer T, Rossmanith W (1 January 2012). Praktische Hormontherapie in der Gynäkologie. Walter de Gruyter. pp. 44–. ISBN 978-3-11-024568-4.
- ^ Knörr K, Beller FK, Lauritzen C (17 April 2013). Lehrbuch der Gynäkologie. Springer-Verlag. pp. 212–213. ISBN 978-3-662-00942-0.
- ^ Horský J, Presl J (1981). "Hormonal Treatment of Disorders of the Menstrual Cycle". In Horsky J, Presl J (eds.). Ovarian Function and its Disorders: Diagnosis and Therapy. Springer Science & Business Media. pp. 309–332. doi:10.1007/978-94-009-8195-9_11. ISBN 978-94-009-8195-9.
- ^ Pschyrembel W (1968). Praktische Gynäkologie: für Studierende und Ärzte. Walter de Gruyter. pp. 598–599. ISBN 978-3-11-150424-7.
- ^ Lauritzen CH (January 1976). "The female climacteric syndrome: significance, problems, treatment". Acta Obstetricia Et Gynecologica Scandinavica. Supplement. 51: 47–61. doi:10.3109/00016347509156433. PMID 779393.
- ^ Lauritzen C (1975). "The Female Climacteric Syndrome: Significance, Problems, Treatment". Acta Obstetricia et Gynecologica Scandinavica. 54 (s51): 48–61. doi:10.3109/00016347509156433. ISSN 0001-6349.
- ^ Kopera H (1991). "Hormone der Gonaden". Hormonelle Therapie für die Frau. Kliniktaschenbücher. pp. 59–124. doi:10.1007/978-3-642-95670-6_6. ISBN 978-3-540-54554-5. ISSN 0172-777X.
- ^ a b c d e f Scott WW, Menon M, Walsh PC (April 1980). "Hormonal Therapy of Prostatic Cancer". Cancer. 45 Suppl 7: 1929–1936. doi:10.1002/cncr.1980.45.s7.1929. PMID 29603164.
- ^ Leinung MC, Feustel PJ, Joseph J (2018). "Hormonal Treatment of Transgender Women with Oral Estradiol". Transgender Health. 3 (1): 74–81. doi:10.1089/trgh.2017.0035. PMC 5944393. PMID 29756046.
- ^ Ryden AB (1950). "Natural and synthetic oestrogenic substances; their relative effectiveness when administered orally". Acta Endocrinologica. 4 (2): 121–39. doi:10.1530/acta.0.0040121. PMID 15432047.
- ^ Ryden AB (1951). "The effectiveness of natural and synthetic oestrogenic substances in women". Acta Endocrinologica. 8 (2): 175–91. doi:10.1530/acta.0.0080175. PMID 14902290.
- ^ Kottmeier HL (1947). "Ueber blutungen in der menopause: Speziell der klinischen bedeutung eines endometriums mit zeichen hormonaler beeinflussung: Part I". Acta Obstetricia et Gynecologica Scandinavica. 27 (s6): 1–121. doi:10.3109/00016344709154486. ISSN 0001-6349.
There is no doubt that the conversion of the endometrium with injections of both synthetic and native estrogenic hormone preparations succeeds, but the opinion whether native, orally administered preparations can produce a proliferation mucosa changes with different authors. PEDERSEN-BJERGAARD (1939) was able to show that 90% of the folliculin taken up in the blood of the vena portae is inactivated in the liver. Neither KAUFMANN (1933, 1935), RAUSCHER (1939, 1942) nor HERRNBERGER (1941) succeeded in bringing a castration endometrium into proliferation using large doses of orally administered preparations of estrone or estradiol. Other results are reported by NEUSTAEDTER (1939), LAUTERWEIN (1940) and FERIN (1941); they succeeded in converting an atrophic castration endometrium into an unambiguous proliferation mucosa with 120–300 oestradiol or with 380 oestrone.
- ^ Rietbrock N, Staib AH, Loew D (11 March 2013). Klinische Pharmakologie: Arzneitherapie. Springer-Verlag. pp. 426–. ISBN 978-3-642-57636-2.
- ^ Martinez-Manautou J, Rudel HW (1966). "Antiovulatory Activity of Several Synthetic and Natural Estrogens". In Robert Benjamin Greenblatt (ed.). Ovulation: Stimulation, Suppression, and Detection. Lippincott. pp. 243–253.
- ^ a b Herr, F.; Revesz, C.; Manson, A. J.; Jewell, J. B. (1970). "Biological Properties of Estrogen Sulfates". Chemical and Biological Aspects of Steroid Conjugation. pp. 368–408. doi:10.1007/978-3-642-49793-3_8. ISBN 978-3-642-49506-9.
- ^ Duncan CJ, Kistner RW, Mansell H (October 1956). "Suppression of ovulation by trip-anisyl chloroethylene (TACE)". Obstetrics and Gynecology. 8 (4): 399–407. PMID 13370006.
- ^ a b c Shearer RJ, Hendry WF, Sommerville IF, Fergusson JD (December 1973). "Plasma testosterone: an accurate monitor of hormone treatment in prostatic cancer". Br J Urol. 45 (6): 668–77. doi:10.1111/j.1464-410x.1973.tb12238.x. PMID 4359746.
- ^ a b c Kent JR, Bischoff AJ, Arduino LJ, Mellinger GT, Byar DP, Hill M, Kozbur X (May 1973). "Estrogen dosage and suppression of testosterone levels in patients with prostatic carcinoma". J. Urol. 109 (5): 858–60. doi:10.1016/s0022-5347(17)60564-0. PMID 4699685.
- ^ a b c Salam MA (2003). Principles & Practice of Urology: A Comprehensive Text. Universal-Publishers. pp. 684–. ISBN 978-1-58112-412-5.
- ^ a b c Lam JS, Leppert JT, Vemulapalli SN, Shvarts O, Belldegrun AS (January 2006). "Secondary hormonal therapy for advanced prostate cancer". J. Urol. 175 (1): 27–34. doi:10.1016/S0022-5347(05)00034-0. PMID 16406864.
- ^ Martinez-Manautou J, Rudel HW (1966). "Antiovulatory Activity of Several Synthetic and Natural Estrogens". In Robert Benjamin Greenblatt (ed.). Ovulation: Stimulation, Suppression, and Detection. Lippincott. pp. 243–253. ISBN 9780397590100.
- ^ a b The Leuprolide Study Group (November 1984). "Leuprolide versus diethylstilbestrol for metastatic prostate cancer". N Engl J Med. 311 (20): 1281–6. doi:10.1056/NEJM198411153112004. PMID 6436700.
- ^ Seftel AD, Spirnak JP, Resnick MI (1989). "Hormonal therapy for advanced prostatic carcinoma". J Surg Oncol. 42 (Suppl 1): 14–20. doi:10.1002/jso.2930420505. PMID 2669792. S2CID 44250508.
- ^ Schröder FH, Radlmaier A (2009). "Steroidal Antiandrogens". Hormone Therapy in Breast and Prostate Cancer. pp. 325–346. doi:10.1007/978-1-59259-152-7_15. ISBN 978-1-60761-471-5.
- ^ Goldenberg SL, Bruchovsky N, Rennie PS, Coppin CM (December 1988). "The combination of cyproterone acetate and low dose diethylstilbestrol in the treatment of advanced prostatic carcinoma". J. Urol. 140 (6): 1460–5. doi:10.1016/S0022-5347(17)42073-8. PMID 2973529.
- ^ Goldenberg SL, Bruchovsky N, Gleave ME, Sullivan LD (June 1996). "Low-dose cyproterone acetate plus mini-dose diethylstilbestrol--a protocol for reversible medical castration". Urology. 47 (6): 882–4. doi:10.1016/S0090-4295(96)00048-9. PMID 8677581.
- ^ Robinson MR, Thomas BS (November 1971). "Effect of hormonal therapy on plasma testosterone levels in prostatic carcinoma". Br Med J. 4 (5784): 391–4. doi:10.1136/bmj.4.5784.391. PMC 1799485. PMID 5124437.
- ^ Greschik H, Flaig R, Renaud JP, Moras D (August 2004). "Structural basis for the deactivation of the estrogen-related receptor gamma by diethylstilbestrol or 4-hydroxytamoxifen and determinants of selectivity". The Journal of Biological Chemistry. 279 (32): 33639–46. doi:10.1074/jbc.M402195200. PMID 15161930.
- ^ a b Ariazi EA, Jordan VC (2006). "Estrogen-related receptors as emerging targets in cancer and metabolic disorders". Curr Top Med Chem. 6 (3): 203–15. doi:10.2174/1568026610606030203. PMID 16515477.
- ^ Rabinowitz JL, Myerson RM (1967). Topics in Medicinal Chemistry. Wiley-Interscience. p. 16. ISBN 978-0-471-70468-3.
- ^ Friedberg V (October 1951). "Die Behandlung der genitalen Hypoplasie mit intrauterinen Cyren-B-Kristallsuspensionen" [Intrauterine Cyren-B Crystal Suspensions in Therapy of Genital Hypoplasia]. Geburtshilfe Frauenheilkd (in German). 11 (10): 923–30. ISSN 0016-5751. PMID 14926876.
- ^ Bishop PM (2008). "The Difficulty of Evaluating the Potency of Steroid Hormones by Different Routes of Administration in Humans". Ciba Foundation Symposium - Steroid Hormone Administration (Book II of Colloquia on Endocrinology, Vol. 3). Novartis Foundation Symposia. pp. 349–355. doi:10.1002/9780470715154.ch10. ISBN 9780470715154. ISSN 1935-4657.
- ^ Pugeat MM, Dunn JF, Nisula BC (July 1981). "Transport of steroid hormones: interaction of 70 drugs with testosterone-binding globulin and corticosteroid-binding globulin in human plasma". The Journal of Clinical Endocrinology and Metabolism. 53 (1): 69–75. doi:10.1210/jcem-53-1-69. PMID 7195405.
- ^ Chambers PL, Günzel P (12 March 2013). Mechanism of Toxic Action on Some Target Organs: Drugs and Other Substances. Springer Science & Business Media. pp. 276–. ISBN 978-3-642-67265-1.
- ^ Couse JF, Korach KS (December 2004). "Estrogen receptor-alpha mediates the detrimental effects of neonatal diethylstilbestrol (DES) exposure in the murine reproductive tract". Toxicology. 205 (1–2): 55–63. doi:10.1016/j.tox.2004.06.046. PMID 15458790.
- ^ Jensen EV, Jacobson HI, Walf AA, Frye CA (February 2010). "Estrogen action: a historic perspective on the implications of considering alternative approaches". Physiol. Behav. 99 (2): 151–62. doi:10.1016/j.physbeh.2009.08.013. PMC 2834267. PMID 19737574.
- ^ a b c Wermuth CG, Aldous D, Raboisson P, Rognan D (1 July 2015). The Practice of Medicinal Chemistry. Elsevier Science. pp. 244–245. ISBN 978-0-12-417213-5.
- ^ a b c d Sneader W (31 October 2005). Drug Discovery: A History. John Wiley & Sons. pp. 196–197. ISBN 978-0-470-01552-0.
- ^ a b c Ravina (11 January 2011). T he Evolution of Drug Discovery: From Traditional Medicines to Modern Drugs. John Wiley & Sons. pp. 177–. ISBN 978-3-527-32669-3.
- ^ a b c Vitamins and Hormones. Academic Press. 1945. pp. 233–. ISBN 978-0-08-086600-0.
- ^ a b Maximov PY, McDaniel RE, Jordan VC (23 July 2013). Tamoxifen: Pioneering Medicine in Breast Cancer. Springer Science & Business Media. pp. 3–. ISBN 978-3-0348-0664-0.
- ^ Dodds EC, Goldberg L, Lawson W, Robinson R (1938). "Estrogenic activity of certain synthetic compounds". Nature. 141 (3562): 247–8. doi:10.1038/141247b0. S2CID 4078256.
- ^ Dodds EC (1957). Biochemical contributions to endocrinology; experiments in hormonal research. Stanford: Stanford University Press. OCLC 1483899.
- ^ a b Meyers R (1983). D.E.S., the bitter pill. New York: Seaview/Putnam. ISBN 0-399-31008-8.
- ^ Langston N (2010). Toxic bodies: Hormone disruptors and the legacy of DES. New Haven, CT: Yale University Press. ISBN 978-0-300-13607-4.
- ^ Seaman B (2003). The greatest experiment ever performed on women: Exploding the estrogen myth. New York: Hyperion. ISBN 978-0-7868-6853-7.
- ^ Huggins C, Hodges CV (1972). "Studies on prostatic cancer. I. The effect of castration, of estrogen and androgen injection on serum phosphatases in metastatic carcinoma of the prostate". CA. 22 (4): 232–40. doi:10.3322/canjclin.22.4.232. PMID 4625049. S2CID 19786742.
- ^ "Prostate cancer yields to a drug". The New York Times: 29. 15 December 1943.
- ^ Lupulescu A (24 October 1990). Hormones and Vitamins in Cancer Treatment. CRC Press. pp. 36–. ISBN 978-0-8493-5973-6.
- ^ a b Dutton DB (1988). Worse than the disease: pitfalls of medical progress. Cambridge: Cambridge University Press. ISBN 0-521-34023-3.
- ^ Physicians' desk reference to pharmaceutical specialties and biologicals (15th ed.). Oradell NJ: Medical Economics. 1961. p. 625. ISBN 0-00-093447-X.
- ^ Dieckmann WJ, Davis ME, Rynkiewicz LM, Pottinger RE (November 1953). "Does the administration of diethylstilbestrol during pregnancy have therapeutic value?". American Journal of Obstetrics and Gynecology. 66 (5): 1062–81. doi:10.1016/S0002-9378(16)38617-3. PMID 13104505.
- ^ Apfel RJ, Fisher SM (1984). To do no harm: DES and the dilemmas of modern medicine. New Haven: Yale University Press. ISBN 0-300-03192-0.
- ^ United States Food and Drug Administration (1971). "Certain estrogens for oral or parenteral use. Drugs for human use; drug efficacy study implementation". Fed Regist. 36 (217): 21537–8.; 36 FR 21537
- ^ a b FDA (1975). "Certain estrogens for oral use. Notice of withdrawal of approval of new drug applications". Fed Regist. 40 (25): 5384.; 25 FR 5384
- ^ Zuger A (2009-07-27). "At What Height, Happiness? A Medical Tale". The New York Times.
- ^ Council on Drugs (1960). "Androgens and estrogens in the treatment of disseminated mammary carcinoma: retrospective study of nine hundred forty-four patients". JAMA. 172 (12): 1271–83. doi:10.1001/jama.1960.03020120049010.
- ^ Ingle JN, Ahmann DL, Green SJ, Edmonson JH, Bisel HF, Kvols LK, Nichols WC, Creagan ET, Hahn RG, Rubin J, Frytak S (January 1981). "Randomized clinical trial of diethylstilbestrol versus tamoxifen in postmenopausal women with advanced breast cancer". The New England Journal of Medicine. 304 (1): 16–21. doi:10.1056/NEJM198101013040104. PMID 7001242.
- ^ Goodwin WE, Cummings RH (March 1984). "Squamous metaplasia of the verumontanum with obstruction due to hypertrophy: long-term effects of estrogen on the prostate in an aging male-to-female transsexual". The Journal of Urology. 131 (3): 553–4. doi:10.1016/s0022-5347(17)50493-0. PMID 6199525.
- ^ Lehrman KL (February 1976). "Pulmonary embolism in a transsexual man taking diethylstilbestrol". JAMA. 235 (5): 532–3. doi:10.1001/jama.1976.03260310046024. PMID 946104.
- ^ Seyler LE, Canalis E, Spare S, Reichlin S (July 1978). "Abnormal gonadotropin secretory responses to LRH in transsexual women after diethylstilbestrol priming". The Journal of Clinical Endocrinology and Metabolism. 47 (1): 176–83. doi:10.1210/jcem-47-1-176. PMID 122396.
- ^ Kuchera LK (October 1971). "Postcoital contraception with diethylstilbestrol". JAMA. 218 (4): 562–3. doi:10.1001/jama.218.4.562. PMID 5171004.
- ^ FDA (1975). "Diethylstilbestrol as posticoital oral contraceptive; patient labeling". Fed Regist. 40 (25): 5451–5.; 40 FR 5451
- ^ FDA (1975). "Estrogens for oral or parenteral use. Drugs for human use; drug efficacy study; amended notice". Fed Regist. 40 (39): 8242.; 39 FR 8242
- ^ Hatcher RA, Stewart GK, Stewart F, Guest F, Josephs N, Dale J (1982). Contraceptive Technology 1982–1983. New York: Irvington Publishers. pp. 152–7. ISBN 0-8290-0705-9.
- ^ FDA (1978). "Estrogens for postpartum breast engorgement". Fed Regist. 43 (206): 49564–7.; 43 FR 49564
- ^ a b c d Toyama Y, Ohkawa M, Oku R, Maekawa M, Yuasa S (May 2001). "Neonatally administered diethylstilbestrol retards the development of the blood-testis barrier in the rat". Journal of Andrology. 22 (3): 413–423. PMID 11330641.
- ^ a b c d e Kawaguchi H, Miyoshi N, Miyamoto Y, Souda M, Umekita Y, Yasuda N, Yoshida H (October 2009). "Effects of exposure period and dose of diethylstilbestrol on pregnancy in rats". The Journal of Veterinary Medical Science. 71 (10): 1309–1315. doi:10.1292/jvms.001309. PMID 19887736.
- ^ a b c d Giusti RM, Iwamoto K, Hatch EE (May 1995). "Diethylstilbestrol revisited: a review of the long-term health effects". Annals of Internal Medicine. 122 (10): 778–788. doi:10.7326/0003-4819-122-10-199505150-00008. PMID 7717601. S2CID 25131834.
- ^ a b Langston N (2008). "The Retreat from Precaution: Regulating Diethylstilbestrol (Des), Endocrine Disruptors, and Environmental Health". Environmental History. 13 (1): 41–65. doi:10.1093/envhis/13.1.41. ISSN 1084-5453. JSTOR 25473193.
- ^ a b Zamora-León P (September 2021). "Are the Effects of DES Over? A Tragic Lesson from the Past". International Journal of Environmental Research and Public Health. 18 (19): 10309. doi:10.3390/ijerph181910309. PMC 8507770. PMID 34639609.
- ^ Eve L, Fervers B, Le Romancer M, Etienne-Selloum N (November 2020). "Exposure to Endocrine Disrupting Chemicals and Risk of Breast Cancer". International Journal of Molecular Sciences. 21 (23): 9139. doi:10.3390/ijms21239139. PMC 7731339. PMID 33266302.
- ^ Carey JL, Nader N, Chai PR, Carreiro S, Griswold MK, Boyle KL (January 2017). "Drugs and Medical Devices: Adverse Events and the Impact on Women's Health". Clinical Therapeutics. 39 (1): 10–22. doi:10.1016/j.clinthera.2016.12.009. PMC 5779632. PMID 28069260.
- ^ a b Langston N (January 2008). "The retreat from precaution: Regulating diethylstilbestrol (DES), endocrine disruptors, and environmental health". Environmental History. 13 (1): 41–65. doi:10.1093/envhis/13.1.41.
- ^ Beauchamp TL (2018). "The principles of biomedical ethics as universal principles.". Islamic Perspectives on the Principles of Biomedical Ethics: Muslim Religious Scholars and Biomedical Scientists in Face-to-Face Dialogue with Western Bioethicists. Intercultural Dialogue in Bioethics. Vol. 1. pp. 91–119. doi:10.1142/9781786340481_0004. ISBN 978-1-78634-047-4.
- ^ a b c d e f g h Mastroianni AC, Faden R, Federman D (March 1994). "Women and health research: a report from the Institute of Medicine". Kennedy Institute of Ethics Journal. 4 (1): 55–62. doi:10.1353/ken.0.0121. PMID 10132589. S2CID 31494934.
- ^ Lavoie D (9 January 2013). "DES Pregnancy Drug Lawsuit: Settlement Reached Between Melnick Sisters And Eli Lilly And Co". Huffington Post. Archived from the original on 10 January 2013. Retrieved 19 March 2014.
- ^ "Collection: DES Action USA records Smith College Finding Aids". Retrieved 2020-06-09.
- ^ West-Taylor Z (24 September 2016). "The Alan Turing Law – a Formal Pardon for Unpardonable Homophobia". Affinity magazine. Retrieved 3 December 2016.
- ^ "Urinary Incontinence". Merck Veterinary Manual. Merck Veterinary Manual. Retrieved 30 November 2012.
- ^ Harris RM, Waring RH (June 2012). "Diethylstilboestrol--a long-term legacy". Maturitas. 72 (2): 108–12. doi:10.1016/j.maturitas.2012.03.002. PMID 22464649.
- ^ Gandhi R, Snedeker S (2000-06-01). "Consumer Concerns About Hormones in Food" (PDF). Fact Sheet #37, June 2000. Program on Breast Cancer and Environmental Risk Factors, Cornell University. Archived from the original on 2011-07-19. Retrieved 2011-07-20.
- ^ Liu, WJ, et al. (2018). "Removal and Biodegradation of 17β-Estradiol and Diethylstilbestrol by the Freshwater Microalgae Raphidocelis subcapitata". International Journal of Environmental Research and Public Health. 15 (3): 452. doi:10.3390/ijerph15030452. PMC 5876997. PMID 29510598. S2CID 4711788.
추가 정보
외부 링크
- 디에틸스틸베스트롤(DES) 및 암 국립 암 연구소
- 미국 질병통제예방센터의 DES 업데이트
- DES 노출 개인에 대한 포괄적인 정보를 제공하는 DES Action USA 전국 소비자 조직
- 미국 국립보건원(National Institute of Health)c.의 DES 책자(1980년)
- DES 추적 연구 국립 암 연구소의 DES 피폭자에 대한 장기 연구(DES-AD 프로젝트 포함)
- 시카고 대학 DES 질 및/또는 자궁경부 CCA(클리어 세포 선암) 환자 등록부
- DES Dietylstilbestrol 일반적인 DES 인식을 위한 리소스 및 소셜 미디어 링크 제공