시알산
Sialic acid시알산은 9개의 탄소 [1]골격을 가진 알파케토산 당류이다."시알산"이라는 용어는 1952년 스웨덴의 생화학자인 군나르 블릭스에 의해 처음 도입되었다.이 그룹의 가장 일반적인 구성원은 동물과 일부 원핵생물에서 발견되는 N-아세틸뉴라민산(Neu5Ac 또는 NANA)이다.
시알산은 동물 조직에 널리 분포되어 있으며, 관련 형태는 일부 미세 조류,[2] 박테리아 및 [3][4][5][6]고세균과 같은 다른 유기체에서 덜 발견된다.시알산은 일반적으로 당단백질, 당지질 또는 간글리오시드의 일부로, 세포나 가용성 [7]단백질의 표면에 있는 당 사슬의 끝을 장식합니다.하지만, 시알산은 드로소필라 배아와 다른 [8]곤충에서도 관찰되었습니다.일반적으로 식물은 시알산을 [9]포함하거나 표시하지 않는 것으로 보인다.
인간의 뇌는 가장 높은 시알산 함량을 가지고 있는데, 이 산들은 신경 전달과 시냅토 [7]형성에 있어 간글리오시드 구조에 중요한 역할을 합니다.50종류 이상의 시알산이 알려져 있으며, 이들 모두는 뉴라미닌산 분자로부터 히드록실기 [1]중 하나로 아미노기를 치환함으로써 얻을 수 있다.일반적으로 아미노기는 아세틸기 또는 글리코릴기 중 하나를 가지고 있지만, 다른 변형이 설명되었다.이러한 변형은 연결과 함께 조직 특이적이고 발달적으로 조절된 발현으로 나타나므로, 그들 중 일부는 특정 [8]세포에서 특정 유형의 당결합체에서만 발견된다.히드록실 치환기는 상당히 다를 수 있으며 아세틸, 락틸, 메틸, 황산염 및 인산기가 발견되었다.[10]
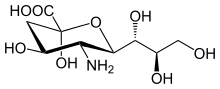
구조.
시알산 계열은 9탄당 뉴라민산의 많은 유도체를 포함하고 있지만, 이러한 산들은 자연에서 거의 자유로워 보이지 않습니다.일반적으로 그들은 말단을 차지하는 뮤신, 당단백질 및 당지질의 올리고당 사슬의 구성 요소로서 발견될 수 있으며, 매우 노출되고 [7]중요한 기능을 발달시키는 외부 및 내부 막 영역 모두에서 복합 탄수화물의 위치를 감소시키지 않는다.
탄소 원자의 번호는 카르본산염 탄소에서 시작하여 사슬을 따라 계속된다.카르본산염을 축방향 위치에 배치하는 배치는 알파 아노머입니다.
알파 아노머는 시알산이 글리칸에 결합할 때 발견되는 형태이다.그러나 용액에서는 주로 (90% 이상) 베타 아노머 형태이다.시알산 뮤타로타아제 활성을 가진 박테리아 효소 NanM이 발견되었으며,[11] 시알산 용액을 약 90% 베타/10% 알파의 휴지 평형 위치에 빠르게 평형시킬 수 있다.
다른 동물과 달리 인간은 유전적으로 시알산 변이형 N-글리콜뉴라민산(Neu5Gc)을 생산할 수 없다.그러나 인체 조직에서 검출된 소량의 Neu5Gc는 외인성([12]영양성) 공급원에서 통합될 수 있다.
생합성
시알산은 글루코사민6인산과 아세틸-CoA에 의해 트랜스페이스를 통해 합성되어 N-아세틸글루코사민-6-P가 된다.이는 에피머라이즈를 통해 N-아세틸만노사민-6-P가 되며, 이는 포스포에놀피루브산과 반응하여 N-아세틸뉴라민-9-P(시알산)를 생성한다.세포의 올리고당 생합성 과정에서 활성화하기 위해 시알산을 시티딘3인산(CMP-sialic acid)으로 변화시켜 시알산을 시티딘1인산(CMP-sialic acid).이 화합물은 동물 [13][14]세포의 핵에서 합성된다.
박테리아 시스템에서 시알산은 알돌라아제에 의해 생합성될 수도 있다.이 효소는 예를 들어 만노스 유도체를 기질로 사용하여 피루브산으로부터 생성된 시알산 구조에 3개의 탄소를 삽입합니다.이들 효소는 시알산 [15]유도체의 화학효소 합성에 사용될 수 있다.
기능.
당단백질을 포함한 시알산은 사람과 다른 유기체에서 셀렉틴과 결합한다.전이성 암세포는 종종 높은 밀도의 시알산이 풍부한 당단백질을 발현한다.표면에서 시알산이 과도하게 발현되면 세포막에 음전하가 생긴다.이것은 세포들 사이에 [16]거부감을 만들고 이러한 말기 암세포들이 혈류로 들어가는 것을 돕는다.최근 실험은 암 분비 세포 외 [17]기질에 시알산의 존재를 증명했다.
표면막에서 발견되는 당결합체(당지질, 당단백질, 프로테오글리칸)에 있는 시알산이 풍부한 올리고당은 세포 표면에[citation needed] 수분을 유지하는 데 도움을 준다.시알산이 풍부한 영역은 세포 표면에 음전하를 만드는 데 기여합니다.물은 수소 원자 둘 다 부분적으로 양전하를 띠는 극성 분자이기 때문에 세포 표면과 막에 끌린다.이것은 또한 세포액 흡수에 기여한다.
시알산은 만노스 결합 [citation needed]렉틴으로부터 숙주 세포나 박테리아 표면에 만노스 항원을 "숨길" 수 있다.이렇게 하면 보체가 활성화되지 않습니다.
폴리시알산 형태의 시알산은 신경세포 접착 분자(NCAM)에서 발생하는 특이한 번역 후 변형입니다.시냅스에서는 폴리시알산의 강한 음전하가 세포의 NCAM 가교화를 방지한다.
거세된 생쥐에 대한 에스트로겐 투여는 질 내 시알산 함량의 용량 의존적인 감소로 이어진다.반대로 쥐의 질에 있는 시알산 함량은 에스트로겐의 효능을 나타내는 척도이다.기준물질은 피하도포용 에스트라디올,[18] 경구투여용 에티닐에스트라디올이다.
면역
시알산은 척추동물과 일부 무척추동물의 모든 세포 표면에서 발견되며 척추동물과 상호작용하는 특정 박테리아에서도 발견됩니다.
아데노바이러스(Adenoviridae), 로타바이러스(Reoviridae), 인플루엔자 바이러스(Orthomyxoviridae)의 Ad26[19] 혈청형과 같은 많은 바이러스들은 표적 숙주 세포에 결합하기 위해 숙주 시릴화 구조를 사용할 수 있다.시알산은 보존성이 높고 사실상 모든 세포에 다량 존재하기 때문에 이러한 바이러스에 대한 좋은 표적이 됩니다.놀랄 것도 없이, 시알산은 또한 몇몇 인간 바이러스 감염에서 중요한 역할을 한다.인플루엔자 바이러스는 인간 적혈구 표면과 상부 호흡기의 세포막에서 발견되는 시알산에 결합하는 헤마글루티닌 활성(HA) 당단백질을 표면에 가지고 있다.이것은 바이러스가 혈액 세포와 섞였을 때 혈응집되어 바이러스가 상부 호흡기의 세포로 들어가는 기본이다.널리 사용되는 항인플루엔자 약물(오셀타미비르 및 자나미비르)은 바이러스 효소인 뉴라미니다제를 [20]억제함으로써 감염된 세포에서 새로 생성된 바이러스의 방출을 방해하는 시알산 유사체이다.
일부 박테리아는 결합과 인식을 위해 숙주 시릴화 구조를 사용하기도 한다.예를 들어, 유리 시알산이 폐렴구균과 같은 특정 박테리아에 대한 신호 역할을 할 수 있다는 증거가 있다.유리 시알산은 아마도 박테리아가 서식지에 적합한 척추동물 환경에 도달했음을 인식하도록 도울 수 있다.5위치의 N-글리콜기 또는 측쇄의 O-아세틸기와 같은 Sias의 변형은 세균성 시알리다아제 작용을 감소시킬 수 있다.[20]
대사
시알산의 합성과 분해는 세포의 다른 구획에 분포되어 있다.합성은 N-아세틸만노사민 6인산과 포스포에놀피루브산이 생성되는 사이토솔에서 시작된다.이후 Neu5Ac9인산은 CMP-Neu5Ac합성효소를 통해 CMP잔기에 의해 핵에서 활성화된다.시알산과 다른 화합물 사이의 결합은 α 결합인 경향이 있지만, 이 특이적 결합은 β 결합인 유일한 결합이다.다음으로 CMP-Neu5Ac를 소포체 또는 골지장치로 운반하여 올리고당 사슬에 전달하여 새로운 당결합체가 된다.이 결합은 O-아세틸화 또는 O-메틸화에 의해 변형될 수 있다.당결합체가 성숙하면 세포 표면으로 운반된다.
시알리다아제는 시알산 이화작용의 가장 중요한 효소 중 하나이다.세포 표면 또는 혈청 시알로글리코복합체로부터 시알산 잔류물을 제거할 수 있습니다.일반적으로 고등동물에서는 분해되기 쉬운 당결합체가 내구증(endocytosis)에 의해 포착된다.후기 엔도솜과 리소좀의 융합 후 리소좀 시알리다아제(Lysosomal sialidase)가 시알산 잔기를 제거한다.이러한 시알리다아제들의 활성은 O-아세틸기 제거를 기반으로 한다.유리 시알산 분자는 리소좀의 막을 통해 세포로 운반된다.거기서, 그것들은 재활용되고 다시 활성화되어 골지 기구에 또 다른 신생 당결합 분자를 형성할 수 있다.시알산은 또한 세포질 효소인 아실뉴라민산분해효소에 의해 아실만노사민 및 피루브산으로 분해될 수 있다.
일부 심각한 질병은 시알산 대사와 관련된 일부 효소의 유무에 따라 달라질 수 있다.NANS 유전자의 돌연변이를 수반하는 시알리도시스 및 시알산 결핍증(아래 참조)은 이러한 유형의 [21]장애의 예가 될 수 있다.
두뇌 발달
시알산을 보충한 쥐 강아지들은 [22]성인이 되었을 때 학습과 기억력이 향상되었다.식이성 시알산 보충과 인지 기능 사이의 관계는 시알산을 [23]대량 섭취한 아기 돼지들에게서 나타났다.
질병.
시알산은 사람에게서 관찰되는 몇 가지 다른 질병과 관련이 있다.
NANS 유전자 돌연변이를 수반하는 시알산 결핍증
인간의 시알산 합성 유전자인 N-아세틸-뉴라민산합성효소(NANS)의 바이알릴 열성 돌연변이는 지적 장애와 짧은 키를 특징으로 하는 심각한 질병을 초래할 수 있으며, 이는 뇌 [24]발달에서 시알산의 중요성을 강조한다.경구 투여된 시알산의 단기 보충을 통한 치료 실험은 생화학적 파라미터에 유의미한 유익한 효과를 보여주지 못했다.
살라병
살라병은 매우 드문 질병으로 유리 시알산 축적[26] 장애의 가장 가벼운 형태로 간주되지만, 어린 시절 형태는 공격적인 변종으로 간주되고 정신지체를 [27]앓고 있는 사람들은 그 병을 앓고 있다.6번 [28]염색체의 돌연변이에 의한 자기 염색체 열성 질환입니다.그것은 주로 신경계에 영향을 미치고 그것은 리소좀[29] 막에 위치한 특정 시알산 운반체의 결핍에서 오는 리소좀 저장의 불규칙성에 의해 야기된다. 현재,[26] 이 질환에 대한 치료법은 없으며 증상 조절에 초점을 맞추어 치료법이 뒷받침되고 있다.
아테롬성 동맥경화증
아테롬성 동맥경화를 일으키는 LDL 콜레스테롤의 서브프랙션은 시알산 [30]수치를 감소시켰다.여기에는 작은 고밀도 LDL 입자와 전기음성 LDL이 [30]포함됩니다. 작은 고밀도 LDL 입자의 시알산 수치가 감소하면 동맥벽의 [30]프로테오글리칸에 대한 이들 입자의 친화력이 높아집니다.
인플루엔자
모든 인플루엔자 A 바이러스 변종은 세포와 연결하기 위해 시알산이 필요하다.시알산에는 인플루엔자 A 바이러스의 종류와 친화력이 다른 다양한 형태가 있습니다.이 다양성은 어떤 종이 [31]감염될 수 있는지를 결정하는 중요한 사실이다.특정 인플루엔자 A 바이러스가 시알산 수용체에 의해 인식되면 세포는 바이러스를 엔도사이토스로 만드는 경향이 있어 세포가 감염된다.
원핵생물 중 시알산 및 기타 비플루오존산(NulOs)
시알산은 많은 다른 생물학적 과정에 관여하는 척추동물 조직에 매우 풍부하다.원래 동물들의 Deuterostome 계통 내에서 발견된 시알산은 실제로 노울로손산이라고 불리는 보다 오래된 9개의 탄소 골격 단당류 계열의 서브셋으로 간주될 수 있으며, 이것은 또한 Eubacteria와 [32]Archia에서도 최근에 발견되었다.많은 병원성 박테리아는 세포 표면에 시알산을 포함하고 있는데,[33] 이는 숙주의 선천적인 면역 반응을 피하는 데 도움을 준다.최근 게놈 수준 연구는 비플루오존산(NulOs)을 생성하기 위한 생합성 경로가 이전에 [34]실현된 것보다 훨씬 더 넓게 생명의 계통수에 분포되어 있음을 나타내는 대규모 염기서열 미생물 게놈 세트를 조사했다.이 발견은 최근 렉틴 염색 연구와 원핵 비플루오손산에 대한 분자 수준 조사에 의해 더욱 뒷받침되고 있으며, 또한 많은 비병원적이고 순수하게 환경적인 변종들이 박테리아 시알산(NulOs)[35][36]을 생산한다는 것을 보여준다.일부(아나목스) 박테리아는 매우 산성인 알파-케토산기와 더불어 염기성 그룹(유리기 아민)[37]을 표시(중화)하는 NulO를 생성한다.C5에서 [38]음전하 카르복실기를 중화시키는 유리 아민을 생성함으로써 세포 표면 전하를 조작하는 화학적 리모듈링에 의해 유사한 세포 표면 시알산이 생성되었다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b Varki, Ajit; Roland Schauer (2008). "Sialic Acids". in Essentials of Glycobiology. Cold Spring Harbor Press. pp. Ch. 14. ISBN 9780879697709.
- ^ Wagstaff, Ben (2018). "Identification of a Kdn biosynthesis pathway in the haptophyte Prymnesium parvum suggests widespread sialic acid biosynthesis among microalgae". Journal of Biological Chemistry. 293 (42): 16277–16290. doi:10.1074/jbc.RA118.004921. PMC 6200933. PMID 30171074.
- ^ Ajit, Varki (2017). "Sialic Acids and Other Nonulosonic Acids". Sialic acids and other nonulosonic acids." Essentials of Glycobiology. Cold Spring Harbor Laboratory Press.
- ^ Kleikamp, Hugo (2020). "Tackling the chemical diversity of microbial nonulosonic acids – a universal large-scale survey approach". Chemical Science. 11 (11): 3074–3080. doi:10.1039/c9sc06406k. PMC 8157484. PMID 34122812.
- ^ Lewis, Amanda (2009). "Innovations in host and microbial sialic acid biosynthesis revealed by phylogenomic prediction of nonulosonic acid structure". Proceedings of the National Academy of Sciences. 106 (32): 13552–13557. Bibcode:2009PNAS..10613552L. doi:10.1073/pnas.0902431106. PMC 2726416. PMID 19666579.
- ^ Schauer, Roland (2018). "Exploration of the Sialic Acid World". Adv Carbohydr Chem Biochem. Advances in Carbohydrate Chemistry and Biochemistry. 75 (75): 1–213. doi:10.1016/bs.accb.2018.09.001. ISBN 9780128152027. PMC 7112061. PMID 30509400.
- ^ a b c Wang, B.; Brand-Miller, J. (2003). "The role and potential of sialic acid in human nutrition". European Journal of Clinical Nutrition. 57 (11): 1351–1369. doi:10.1038/sj.ejcn.1601704. PMID 14576748.
- ^ a b Mandal, C. (1990). "Sialic acid binding lectins". Experientia. 46 (5): 433–441. doi:10.1007/BF01954221. PMID 2189746. S2CID 27075067.
- ^ Varki, Ajit; Roland Schauer (2008). "Sialic Acids". in Essentials of Glycobiology. Cold Spring Harbor Press. pp. Ch. 14. ISBN 9780879697709.
- ^ Schauer R. (2000). "Achievements and challenges of sialic acid research". Glycoconj. J. 17 (7–9): 485–499. doi:10.1023/A:1011062223612. PMC 7087979. PMID 11421344.
- ^ Severi E, Müller A, Potts JR, Leech A, Williamson D, Wilson KS, Thomas GH (2008). "Sialic acid mutarotation is catalyzed by the Escherichia coli beta-propeller protein YjhT". J Biol Chem. 283 (8): 4841–91. doi:10.1074/jbc.M707822200. PMID 18063573.
- ^ Tangvoranuntakul, Pam (October 14, 2003). "Human uptake and incorporation of an immunogenic nonhuman dietary sialic acid". PNAS. 100 (21): 12045–12050. Bibcode:2003PNAS..10012045T. doi:10.1073/pnas.2131556100. PMC 218710. PMID 14523234.
- ^ Fulcher CA, "MetaCyc 키메라 경로: 시알산 및 CMP-시알산 생합성 초경로", "MetaCyc, 2009년 3월"
- ^ Warren, Leonard; Felsenfeld, Herbert (1962). "The Biosynthesis of Sialic Acids" (PDF). The Journal of Biological Chemistry. 237 (5): 1421. doi:10.1016/S0021-9258(19)83718-3.
- ^ Hai Yu; Harshal Chokhawala; Shengshu Huang & Xi Chen (2006). "One-pot three-enzyme chemoenzymatic approach to the synthesis of sialosides containing natural and non-natural functionalities". Nature Protocols. 1 (5): 2485–2492. doi:10.1038/nprot.2006.401. PMC 2586341. PMID 17406495.
- ^ Fuster, Mark M.; Esko, Jeffrey D. (2005). "The sweet and sour of cancer: Glycans as novel therapeutic targets". Nature Reviews Cancer. 5 (7): 526–42. doi:10.1038/nrc1649. PMID 16069816. S2CID 10330140.
- ^ Dasgupta, Debayan; Pally, Dharma; Saini, Deepak; Bhat, Ramray; Ghosh, Ambarish (2020). "Nanomotors Sense Local Physicochemical Heterogeneities in Tumor Microenvironments". Angewandte Chemie. 59 (52): 23690–23696. doi:10.1002/anie.202008681. PMC 7756332. PMID 32918839.
- ^ Jürgen Sandow; Ekkehard Scheiffele; Michael Haring; Günter Neef; Klaus Prezewowsky; Ulrich Stache (2007), "Hormones", Ullmann's Encyclopedia of Industrial Chemistry (7th ed.), Wiley, pp. 1–81, doi:10.1002/14356007.a13_089, ISBN 978-3527306732
- ^ Baker, Alexander T.; Mundy, Rosie M.; Davies, James A.; Rizkallah, Pierre J.; Parker, Alan L. (September 2019). "Human adenovirus type 26 uses sialic acid–bearing glycans as a primary cell entry receptor". Science Advances. 5 (9): eaax3567. Bibcode:2019SciA....5.3567B. doi:10.1126/sciadv.aax3567. PMC 6726447. PMID 31517055.
- ^ a b Varki A.; Gagneux P. (2012). "Multifarious roles of sialic acids in immunity". Ann N Y Acad Sci. 1253 (1): 16–36. Bibcode:2012NYASA1253...16V. doi:10.1111/j.1749-6632.2012.06517.x. PMC 3357316. PMID 22524423.
- ^ Traving, C.; Schauer, R. (1998). "Structure, function and metabolism of sialic acids". Cellular and Molecular Life Sciences. 54 (12): 1330–1349. doi:10.1007/s000180050258. PMC 7082800. PMID 9893709.
- ^ Oliveros E, Vázquez E, Barranco A, Ramírez M, Gruart A, Delgado-García JM, Buck R, Rueda R, Martín MJ (2018). "Sialic Acid and Sialylated Oligosaccharide Supplementation during Lactation Improves Learning and Memory in Rats". Nutrients. 10 (10): E1519. doi:10.3390/nu10101519. PMC 6212975. PMID 30332832.
- ^ Wang B. (2012). "Molecular Mechanism Underlying Sialic Acid as an Essential Nutrient for Brain Development and Cognition". Adv. Nutr. 3 (3): 465S–472S. doi:10.3945/an.112.001875. PMC 3649484. PMID 22585926.
- ^ van Karnebeek, Clara D. M.; Bonafé, Luisa; Wen, Xiao-Yan; Tarailo-Graovac, Maja; Balzano, Sara; Royer-Bertrand, Beryl; Ashikov, Angel; Garavelli, Livia; Mammi, Isabella; Turolla, Licia; Breen, Catherine (July 2016). "NANS-mediated synthesis of sialic acid is required for brain and skeletal development". Nature Genetics. 48 (7): 777–784. doi:10.1038/ng.3578. ISSN 1546-1718. PMID 27213289. S2CID 24953080.
- ^ Tran C, Turolla L, Ballhausen D, Buros SC, Teav T, Gallart-Ayala H, Ivanisevic J, Faouzi M, Lefeber DJ, Ivanovski I, Giangiobbe S, Caraffi SG, Garavelli L, Superti-Furga A (2021). "The fate of orally administered sialic acid: First insights from patients with N-acetylneuraminic acid synthase deficiency and control subjects". Mol Genet Metab Rep. 28: 100777. doi:10.1016/j.ymgmr.2021.100777. PMC 8251509. PMID 34258226.
- ^ a b c "Salla disease Genetic and Rare Diseases Information Center (GARD) – an NCATS Program".
- ^ "Free sialic acid storage disease". Orphanet. Retrieved 21 February 2019.
- ^ Ponsot, G. (2007). "Enfermedades por depósito de ácido siálico libre: enfermedad de Salla (incluida su forma infantil grave) y sialuria". EMC - Pediatría (in Spanish). 42: 1–3. doi:10.1016/S1245-1789(07)70257-3.
- ^ "Enfermedades por depósito de ácido siálico libre: Enfermedad de Salla (incluida su forma infantil grave) y sialuria" (in Spanish).
- ^ a b c Ivanova EA, Myasoedova VA, Melnichenko AA, Grechko AV, Orekhov AN (2017). "Small Dense Low-Density Lipoprotein as Biomarker for Atherosclerotic Diseases". Oxidative Medicine and Cellular Longevity. 2017 (10): 1273042. doi:10.1155/2017/1273042. PMC 5441126. PMID 28572872.
- ^ Racaniello, Vincent (5 May 2009). "Influenza virus attachment to cells: role of different sialic acids". Virology Blog. Retrieved 10 April 2019.
- ^ Ajit, Varki (2015). "Sialic Acids and Other Nonulosonic Acids". Sialic acids and other nonulosonic acids, Essentials of Glycobiology (3rd ed.). Chapter 15.: Cold Spring Harbor (NY): Cold Spring Harbor Laboratory Press. pp. 2015–2017.
{{cite book}}: CS1 유지보수: 위치(링크) - ^ Severi E.; Hood D.W.; Thomas G.H. (2007). "Sialic acid utilization by bacterial pathogens". Microbiology. 153 (9): 2817–2822. doi:10.1099/mic.0.2007/009480-0. PMID 17768226.
- ^ Amanda, Lewis (2009). "Innovations in host and microbial sialic acid biosynthesis revealed by phylogenomic prediction of nonulosonic acid structure". Proceedings of the National Academy of Sciences. 106 (32): 13552–13557. Bibcode:2009PNAS..10613552L. doi:10.1073/pnas.0902431106. PMC 2726416. PMID 19666579.
- ^ Kleikamp, Hugo (2020). "Tackling the chemical diversity of microbial nonulosonic acids–a universal large-scale survey approach". Chemical Science. 11 (11): 3074–3080. doi:10.1039/C9SC06406K. PMC 8157484. PMID 34122812.
- ^ Boleij, Marissa (March 31, 2020). "Decorating the Anammox House: Sialic Acids and Sulfated Glycosaminoglycans in the Extracellular Polymeric Substances of Anammox Granular Sludge". Environ. Sci. Technol. 54 (8): 5218–5226. Bibcode:2020EnST...54.5218B. doi:10.1021/acs.est.9b07207. PMC 7181257. PMID 32227885.
- ^ Pabst, Martin; Grouzdev, Denis S.; Lawson, Christopher E.; Kleikamp, Hugo B. C.; de Ram, Carol; Louwen, Rogier; Lin, Yue Mei; Lücker, Sebastian; van Loosdrecht, Mark C. M.; Laureni, Michele (2021-08-02). "A general approach to explore prokaryotic protein glycosylation reveals the unique surface layer modulation of an anammox bacterium". The ISME Journal. 16 (2): 346–357. doi:10.1038/s41396-021-01073-y. ISSN 1751-7370. PMC 8776859. PMID 34341504.
- ^ Wang, Jie; Cheng, Bo; Li, Jie; Zhang, Zhaoyue; Hong, Weiyao; Chen, Xing; Chen, Peng R. (2015). "Chemical Remodeling of Cell-Surface Sialic Acids through a Palladium-Triggered Bioorthogonal Elimination Reaction". Angewandte Chemie International Edition. 54 (18): 5364–5368. doi:10.1002/anie.201409145. ISSN 1521-3773. PMID 25765364.






