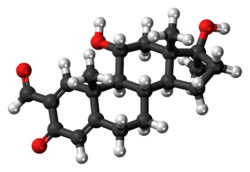
포메볼론
Formebolone | |
 | |
| 임상 데이터 | |
|---|---|
| 상호 | 에시클렌, 휴버놀, 메타노르 |
| 기타 이름 | 포르말디에놀론(2-포르밀-11α-히드록시-17α-메틸-γ-테스토스테론1) |
| 루트 행정부. | 오랄 |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| 켐스파이더 | |
| 유니 | |
| 첸블 | |
| CompTox 대시보드 (EPA ) | |
| ECHA 정보 카드 | 100.017.749 |
| 화학 및 물리 데이터 | |
| 공식 | C21H28O4 |
| 몰 질량 | 344.451g/120−1 |
| 3D 모델(JSmol) | |
| |
| |
| | |
포르메볼론(INN, BAN)(상표명 에시클렌, 휴버놀, 메타노르)은 2-포르밀-11α-히드록시-17α-메틸-γ-테스토스테론뿐만1 아니라 (혼합하여) 구강 활성 아나볼론(Anabolic-androgenic Steuseor, AAS)으로 항산화제로서 설명된다.AAS로서 효력 면에서는 테스토스테론보다 떨어지지만 안드로겐 활성은 [4]거의 없는 것으로 알려져 있다.포메볼론은 [4][5]인산덱사메타손과 같은 강력한 글루코콜티코이드의 이화 작용(질소 균형 조절)을 중화시킨다.가까운 유사체인 록시볼론(및 그 장시간 작용하는 에스테르 변종 데실록시볼론)은 포르메볼론과 유사한 항루코콜티코이드 활성을 보이지만 반대로 AAS로서의 [6]활성은 없다.
록시볼론은 글루코콜티코이드 수용체에 결합하지 않는 것으로 밝혀졌으며, 록시볼론과 포르메볼론의 항루코콜티코이드 활성은 대신 효소 [7]과정의 변조에 의해 매개될 수 있다고 제안되었다.실제로 11α- 및 11β-히드록시프로게스테론(포르메볼론 및 록시볼론은 각각 11α- 및 11β-히드록시실화됨)은 잠재적 내인성 글루코코르티코이드 및 코르티솔 전구체로부터의 생합성을 담당하는 11β-히드록시스테로이드탈수소효소(11β-HSD)의 잠재적 억제제인 것으로 알려져 있다.디옥시코르티코스테론)을 각각 [8][9]분리한다.단, 포름볼론은 11β-HSD 타입 2(IC > 10μM)의50 매우 약한 억제제인 것으로 밝혀졌다. 단, 11β-HSD의 이소엔자임은 글루코코르티코이드의 [10]생산보다는 불활성화에 책임이 있다.
레퍼런스
- ^ Index Nominum 2000: International Drug Directory. Taylor & Francis. January 2000. pp. 471–. ISBN 978-3-88763-075-1.
- ^ J. Elks (14 November 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. pp. 577–. ISBN 978-1-4757-2085-3.
- ^ I.K. Morton; Judith M. Hall (31 October 1999). Concise Dictionary of Pharmacological Agents: Properties and Synonyms. Springer Science & Business Media. pp. 125–. ISBN 978-0-7514-0499-9.
- ^ a b Gelli D, Vignati E (1976). "Metabolic studies with formebolone (2-formyl-17 (alpha)-methyl-androsta-1,4-diene-11 (alpha), 17 (beta)-diol-3-one) in humans". J. Int. Med. Res. 4 (2): 96–105. doi:10.1177/030006057600400203. PMID 799985. S2CID 86157607.
- ^ Cerutti S, Forlani A, Galimberti E (1976). "Anticatabolic action of formebolone in the castrated rat treated with dexamethasone". Arzneimittelforschung. 26 (9): 1673–7. PMID 1036699.
- ^ Felippone F, Resnati G, Scolastico C, Tronconi G (1984). "Synthesis of 2-carboxy-11 beta, 17 beta-dihydroxy-17-methyl-1, 4-androstadien-3-one and related compounds". Steroids. 43 (3): 271–82. doi:10.1016/0039-128x(84)90045-x. PMID 6523544. S2CID 54289377.
- ^ Dahlberg E, Snochowski M, Gustafsson JA (1981). "Regulation of the androgen and glucocorticoid receptors in rat and mouse skeletal muscle cytosol". Endocrinology. 108 (4): 1431–40. doi:10.1210/endo-108-4-1431. PMID 6970661.
- ^ Souness GW, Latif SA, Laurenzo JL, Morris DJ (1995). "11 alpha- and 11 beta-hydroxyprogesterone, potent inhibitors of 11 beta-hydroxysteroid dehydrogenase (isoforms 1 and 2), confer marked mineralocorticoid activity on corticosterone in the ADX rat". Endocrinology. 136 (4): 1809–12. doi:10.1210/endo.136.4.7895695. PMID 7895695.
- ^ Souness GW, Morris DJ (1996). "11 alpha- and 11 beta-hydroxyprogesterone, potent inhibitors of 11 beta-hydroxysteroid dehydrogenase, possess hypertensinogenic activity in the rat". Hypertension. 27 (3 Pt 1): 421–5. doi:10.1161/01.hyp.27.3.421. PMID 8698448.
- ^ Fürstenberger C, Vuorinen A, Da Cunha T, Kratschmar DV, Saugy M, Schuster D, Odermatt A (2012). "The anabolic androgenic steroid fluoxymesterone inhibits 11β-hydroxysteroid dehydrogenase 2-dependent glucocorticoid inactivation". Toxicol. Sci. 126 (2): 353–61. doi:10.1093/toxsci/kfs022. PMID 22273746.