입체 이성질체
Stereoisomerism입체화학에서, 입체 이성질체 또는 공간 이성질체는 분자식이 같고 결합된 원자(구성)의 배열이 같지만 우주에서의 [1][2]원자의 3차원 방향이 다른 이성질체이다.이는 동일한 분자식을 공유하지만 결합 연결이나 순서가 다른 구조 이성질체와 대조됩니다.정의상, 서로의 입체 이성질체인 분자는 동일한 구조 [3]이성질체를 나타낸다.
에난티오머
광학 이성질체로도 알려진 에난티오머는 반사에 의해 서로 연관된 두 개의 입체 이성질체입니다. 즉, 서로 중첩할 수 없는 거울상입니다.인간의 손은 이와 거시적으로 유사하다.한쪽의 모든 입체 중심은 다른 쪽과 반대되는 구성을 가지고 있습니다.서로 에난티오머인 두 화합물은 편광의 회전 방향과 다른 화합물의 광학 이성질체와 어떻게 상호작용하는지를 제외하고는 동일한 물리적 특성을 가지고 있습니다.그 결과 화합물의 서로 다른 에난티오머가 실질적으로 다른 생물학적 영향을 미칠 수 있다.순수 에난티오머도 광학 활성 현상을 나타내며 키랄제를 사용해야만 분리할 수 있다.자연에서 아미노산과 같은 대부분의 키랄 생물학적 화합물 중 오직 하나의 에난티오머만이 존재한다.광학활성화합물은 D-(+)형식과 L-(-)형식의 2가지 형태를 나타낸다.
디아스테레오머
디아스테레오머는 반사 [4]연산을 통해 관련되지 않은 입체 이성질체이다.서로 거울에 비친 모습이 아니에요.여기에는 메소 화합물, cis-trans 이성질체, E-Z 이성질체 및 비항대성 이성질체 등이 포함된다.디아스테레오머는 동일한 물리적 특성을 갖는 경우가 거의 없습니다.아래 예에서 타르타르산의 메소 형태는 레보산과 덱스트로타르타르산을 모두 가진 디아스테레오머 쌍을 형성하며, 이는 에난티오머 쌍을 형성한다.
 |  | |
| (천연) 주석산 | D-타르타르산 | 메소아미노카르산 |
| (1:1) | ||
위의 이성질체의 D- 및 L- 라벨은 더 일반적으로 볼 수 있는 d- 및 l- 라벨과 동일하지 않으며, 후자의 명명 규칙에만 익숙한 이들과 반대로 보일 수 있는 이유를 설명한다.
피셔 투영법은 L-분자와 D-분자의 키랄리티(화학)를 구별하는 데 사용할 수 있습니다.예를 들어, 정의상, 피셔 투영법에서 D-당류의 두 번째 탄소는 왼쪽에 수소가, 오른쪽에 수산기가 그려져 있다.L-설탕은 오른쪽에 수소가 있고 왼쪽에 히드록실기가 있을 것이다.
다른 하나는 광원을 볼 때 편광면의 회전은 어떤 입체 이성질체가 우세한지에 따라 오른쪽(+로 표현되는 d-회전, 시계방향으로 표현되는 d-회전) 또는 왼쪽(-시계방향으로 표현되는 l-회전) 중 하나일 수 있다.예를 들어, 수크로스와 장뇌는 d-로터리이고 콜레스테롤은 l-로터리입니다.
Cis-trans 및 E-Z 이성질체
이중결합에 대한 입체이성체는 이중결합에 대한 회전이 제한되어 치환기가 서로 [5]고정되기 때문에 발생한다.이중결합의 적어도 한쪽 끝에 있는 2개의 치환기가 동일하면 입체이성체는 존재하지 않으며 이중결합은 스테레오 중심이 아니며, 예를 들어 한쪽 끝에 있는 2개의 치환기가 모두 [6]H인 프로펜, CHH3=CH이다2.
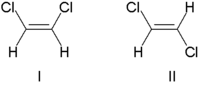
전통적으로 이중 결합 입체 화학은 이중 결합의 양쪽에 있는 치환기의 상대적 위치를 기준으로 cis(라틴어, 이쪽) 또는 trans(라틴어, 반대쪽)로 설명되었다.cis-trans 이성질체의 간단한 예는 디클로로에텐(CHCl222) 이성질체와 같이 1,2-디치환된 에텐이다.[7]
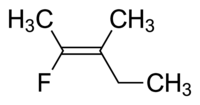
분자I는 시스-1,2-디클로로에텐이고 분자II는 트랜스-1,2-디클로로에텐이다.때때로 모호하기 때문에 IUPAC는 이중 결합의 양 끝에 있는 치환기가 원자 번호에 따라 우선 순위를 할당하는 보다 엄격한 시스템을 채택했다.고우선순위 치환기가 결합의 같은 쪽에 있으면 Z(Ger. zusamen, 함께)가 할당됩니다.반대편에 있으면 E(Ger. Entgegen, 반대)[8]입니다.염소는 수소보다 원자 번호가 크기 때문에 가장 우선순위가 높은 [9]그룹이다.위의 그림 분자를 명명하기 위해 이 표기법을 사용하여 분자 I은 (Z)-1,2-디클로로에테인이고 분자 II는 (E)-1,2-디클로로에테인입니다.그러나 Z와 cis 또는 E와 trans가 항상 호환 가능한 것은 아닙니다.다음 플루오로메틸펜텐을 고려합니다.
이 분자의 적절한 이름은 골격 사슬을 형성하는 알킬기(메틸기 및 에틸기)가 서로 이중 결합을 사이에 두고 존재하기 때문에 트랜스-2-플루오로-3-메틸펜트-2-ene이거나, 이중 결합의 양측에서 가장 높은 우선순위가 동일한 그룹이므로 (Z)-2플루오로-3-메틸펜트-2-ene이다.플루오로기는 이중 결합의 왼쪽에 있는 가장 높은 우선 순위 그룹이고 에틸은 분자의 오른쪽에 있는 가장 높은 우선 순위 그룹입니다.
cis 및 trans라는 용어는 링 위의 두 치환기의 상대적 위치를 설명하기 위해 사용되기도 합니다. 같은 쪽에 있으면 cis, 그렇지 않으면 [10][11][12]trans입니다.
컨포머
입체 이성질체는 구조식은 같지만 하나 이상의 [13][14][15]결합에 대한 회전으로 인해 모양이 다른 분자의 현상을 설명하는 이성질체의 한 형태이다.다른 배치는 다른 에너지를 가질 수 있고, 보통 상호 변환이 가능하며, 매우 드물게 분리할 수 있습니다.예를 들어, 탄소 원자 중 4개가 의자의 "시트"를 형성하고 탄소 원자 1개가 의자의 "뒷면"이고 탄소 원자 1개가 "발 받침대"인 의자 구조를 포함하여 다양한 사이클로헥산 구조(시클로헥산은 나일론–6의 합성에 필수적인 중간체)가 존재한다.보트 컨포메이션은 두 개의 동등한 의자 형태 사이의 컨포메이션 여행 일정에서 에너지 최대값을 나타낸다. 단, 낮은 에너지 경로가 있기 때문에 이 과정의 전환 상태를 나타내지 않는다.치환된 사이클로헥산의 구조 반전은 상온에서 매우 빠른 과정으로, 반감기는 0.00001초입니다.[16][17]
서로 다른 배치 사이의 큰 에너지 장벽 때문에 여러 배치에서 분리될 수 있는 분자가 있다. 2,2', 6, 6'-테트라 치환된 비페닐은 후자의 범주에 들어갈 수 있다.
아노머
아노머리즘은 "cis" 또는 "Z"와 "trans" 또는 "E" (기하학적 이성질)가 키랄리티의 동일성을 나타내는 탄소 원자에 치환 이름을 붙일 필요가 있는 단일 결합 고리 구조의 동일성이다.Ng.[18][19][20][21]Anomers 있는 아사쿠사"알파"또는"축 방향"과"베타"또는"적도"은 반지의 탄소 원자 사이의 예를 들어 단일 채권을 가진 순환 고리 구조를 대체하는 것, 수산기, 메틸에 수산화기, 메톡 시기 또는 전형적인 단일 결합 대체품이 아니라 lim 다른 pyranose이나 푸라노 우스 고리당 그룹이다.이들에게 ited.[22]축 기하학적 이성질은 기준 평면에 수직(90도)이며 적도는 축 결합으로부터 120도 떨어져 있거나 기준 [23]평면에서 30도 벗어난다.
아트로피소머
아트로피소머는 컨포머를 [24][25]분리할 수 있을 정도로 입체변형장벽이 높은 단일결합에 대한 회전이 저해된 입체이성체이다.
기타 정의
- 입체 이성질체는 스테레오 센터(예를 들어 R- 대 S- 또는 E- 대 Z-)에서 반대 구성을 가진 기준 분자의 입체 이성질체이다.즉, 구성 이성질체는 예를 들어 화합물 내 일부 또는 모든 스테레오 센터의 구성을 반전시킴으로써 스테레오 센터와의 공유 결합을 끊는 것만으로 상호 변환될 수 있습니다.
- 에피머는 스테레오 센터 중 하나에서만 반대 구성을 가진 디아스테레오 이성질체입니다.
르 벨 반트 호프의 법칙
Le Bel-Van't Hoff 법칙은 n개의 비대칭 탄소 원자를 가진 구조의 경우, 최대n 2개의 다른 입체 이성질체가 가능하다고 말한다.예를 들어 D-포도당은 알도헥소스로 CHO라는 식이다6126.D-포도당은 6개의 탄소 원자 중 4개가 입체 이성질체이며, 이는 D-포도당이 2=16개의 가능한 입체 이성질체 [26][27]중 하나임을4 의미한다.
「 」를 참조해 주세요.
레퍼런스
- ^ IUPAC, 화학 용어집, 제2판('골드북') (1997).온라인 수정판: (2006–) "스테레오 이성질체" doi: 10.1351/goldbook.S05983
- ^ 콜롬비아 백과사전.Encyclopedia.com, N.l., 2005, Link의 "스테레오 이성질체"
- ^ Clark, Jim (November 2012). "Optical isomerism". chemguide.co.uk. Retrieved 2022-08-09.
- ^ "Diastereomer - an overview ScienceDirect Topics".
- ^ "Geometric Isomers Definition And Examples Chemistry Dictionary". Retrieved 2022-06-20.
- ^ Clark, Jim (February 2020). "geometric (cis / trans) isomerism". Chemguide.uk. Retrieved 2022-08-09.
- ^ Helmenstine, Anne Marie. "Geometric Isomer Definition (Cis-Trans Isomers)". ThoughtCo.
- ^ Roberts, John D.; Caserio, Marjorie C. (1977). Basic Principles of Organic Chemistry (second ed.). W. A. Benjamin, Inc. p. 19.7. ISBN 0805383298.
- ^ Roberts, John D.; Caserio, Marjorie C. (1977). Basic Principles of Organic Chemistry (second ed.). W. A. Benjamin, Inc. p. 19.6. ISBN 0805383298.
- ^ "Cis-trans isomerism NAL Agricultural Thesaurus".
- ^ Clark, Jim (November 2012). "E-Z notation for geometric isomerism". chemguide.co.uk. Retrieved 2022-08-09.
- ^ "E and Z Notation for Alkenes (+ Cis/Trans)". 3 November 2016.
- ^ Hunt, Ian. "What are Conformational Isomers?". chem.ucalgary.ca. Retrieved 2022-08-09.
- ^ "Conformational Isomer - an overview ScienceDirect Topics".
- ^ "Isomerism - Conformational isomers Britannica".
- ^ "Cyclohexane - an overview ScienceDirect Topics".
- ^ Reusch, William (2013-05-05). "Stereoisomers". chemistry.msu.edu. Retrieved 2022-08-09.
- ^ Hunt, Ian. "What do the α- and β- forms look like?". chem.ucalgary.ca. Retrieved 2022-08-09.
- ^ "Anomer - an overview ScienceDirect Topics".
- ^ "Anomeric Effect - an overview ScienceDirect Topics".
- ^ Ashenhurst, James (2022-08-03). "The Big Damn Post Of Carbohydrate-Related Chemistry Definitions". masterorganicchemistry.com. Retrieved 2022-08-09.
- ^ Reusch, William. "Stereoisomers". chemistry.msu.edu. Retrieved 2022-08-09.
- ^ 모리슨과 보이드 유기화학 제6판 1170-1171 ISBN 0-13-643669-2
- ^ "Atropisomer - an overview ScienceDirect Topics".
- ^ Metrano, Anthony J. (2018-06-09). "Atropisomers" (PDF). knowleslab.princeton.edu. Retrieved 2022-08-09.
- ^ Blackmond, D. G. (2019). "The Origin of Biological Homochirality". Cold Spring Harbor Perspectives in Biology. 11 (3): a032540. doi:10.1101/cshperspect.a032540. PMC 6396334. PMID 30824575.
- ^ Brooks, Benjamin T. (1918). "The German Chemical Myth". The North American Review. 208 (756): 729–735. JSTOR 25151064.