광합성
Photosynthesis광합성은 빛 에너지를 화학 에너지로 변환하기 위해 식물과 다른 유기체에 의해 사용되는 과정으로, 세포 호흡을 통해 나중에 유기체의 활동에 연료를 공급하기 위해 방출될 수 있습니다.이러한 화학 에너지의 일부는 이산화탄소와 물에서 합성되는 설탕과 녹말과 같은 탄수화물 분자에 저장된다. 그래서 광합성이라는 이름은 그리스 포스(phoes), 빛(light), 합성(plositing)[1][2][3]에서 유래한다.대부분의 식물, 조류, 그리고 시아노박테리아는 광합성을 한다; 그러한 유기체는 광자영양체라고 불린다.광합성은 주로 지구 대기의 산소 함량을 생산하고 유지하는 데 책임이 있으며 [4]지구상의 생명체에 필요한 에너지의 대부분을 공급한다.
비록 광합성은 다른 종에 의해 다르게 수행되지만, 그 과정은 항상 녹색 엽록소 색소/색소세포를 포함하는 반응 중심이라고 불리는 단백질에 의해 빛의 에너지가 흡수될 때 시작됩니다.식물에서, 이러한 단백질은 엽록체라고 불리는 세포소기관 안에 있는데, 엽록체는 잎 세포에 가장 많이 있는 반면, 박테리아에는 그것들이 혈장막에 내장되어 있습니다.이러한 광의존적 반응에서 일부 에너지는 물과 같은 적절한 물질로부터 전자를 떼어내 산소 가스를 생성하는데 사용됩니다.물의 분열로 방출된 수소는 단기 에너지 저장소로 작용하는 두 개의 추가 화합물의 생성에 사용되며, 다른 반응을 유도하기 위해 전달을 가능하게 한다: 이러한 화합물은 환원된 니코틴아미드 아데닌 디뉴클레오티드 인산염과 세포의 "에너지 통화"인 아데노신 삼인산염이다.
식물, 조류, 시아노박테리아에서, 당은 캘빈 회로라고 불리는 광의존적 반응의 후속 시퀀스에 의해 합성된다.캘빈회로에서 대기 중의 이산화탄소는 리불로스2인산(RuBP)[5]과 같은 기존 유기탄소화합물에 포함된다.광의존성 반응에 의해 생성된 ATP와 NADPH를 사용하여, 생성된 화합물은 환원되고 포도당과 같은 추가적인 탄수화물을 형성하기 위해 제거된다.다른 박테리아에서는 같은 종말을 달성하기 위해 역 크렙스 회로와 같은 다른 메커니즘이 사용된다.
최초의 광합성 유기체는 아마도 생명의 진화 역사 초기에 진화했을 것이며 [6]전자원으로서 물 대신 수소나 황화수소와 같은 환원제를 사용했을 것이다.시아노박테리아는 나중에 나타났다; 그들이 만들어낸 과잉 산소는 지구의 [7]산소화에 직접적으로 기여했고, 이것은 복잡한 생명체의 진화를 가능하게 했다.오늘날, 전 세계적으로 광합성에 의한 에너지 포획의 평균 속도는 약 130테라와트이며,[8][9][10] 이는 [11]인류 문명의 현재 전력 소비량의 약 8배이다.광합성 유기체는 또한 매년 [12][13]약 1000억-1150억 톤의 탄소를 바이오매스로 전환한다.식물은 공기, 토양, 물 외에 빛으로부터 에너지를 공급받으며 1779년 얀 잉겐하우스에 의해 처음 발견되었다.
광합성은 공기 중의 이산화탄소를 흡수하고 식물과 토양, 수확한 생산물에 탄소를 결합시키기 때문에 기후 과정에 필수적이다.곡물만 해도 매년 3,825 Tg(테라그램) 또는 3.825 Pg(페타그램)의 이산화탄소를 결합하는 것으로 추정되며, 이는 38억 2,500만 미터톤이다.[14]
★★★
대부분의 광합성 유기체는 광자영양체인데, 이것은 그들이 빛으로부터 에너지를 사용하여 이산화탄소와 물에서 직접 음식을 합성할 수 있다는 것을 의미한다.하지만, 모든 유기체가 광합성을 수행하기 위해 탄소 원자의 원천으로 이산화탄소를 사용하는 것은 아니다; 광열영양체는 이산화탄소가 아닌 유기 화합물을 [4]탄소의 원천으로 사용한다.식물, 조류, 시아노박테리아에서 광합성은 산소를 방출한다.이 산소 광합성은 지금까지 살아있는 유기체에 의해 사용되는 광합성의 가장 흔한 형태이다.비록 식물, 조류, 그리고 시아노박테리아에서 산소 광합성 사이에 약간의 차이가 있지만, 전체적인 과정은 이 유기체들에서 꽤 유사하다.또한 이산화탄소를 소비하지만 산소를 방출하지 않는 박테리아에 의해 주로 사용되는 많은 종류의 비산소 광합성이 있다.
이산화탄소는 탄소 고정이라고 불리는 과정에서 당으로 전환된다; 광합성은 이산화탄소를 탄수화물로 바꾸기 위해 햇빛으로부터 에너지를 포착한다.탄소 고정은 흡열성 산화환원 반응이다.일반적으로, 광합성은 세포 호흡의 반대이다: 광합성은 이산화탄소를 탄수화물로 환원하는 과정인 반면, 세포 호흡은 탄수화물이나 다른 영양소가 이산화탄소로 산화되는 것이다.세포 호흡에 사용되는 영양소에는 탄수화물, 아미노산 및 지방산이 포함됩니다.이 영양소들은 이산화탄소와 물을 생산하기 위해 산화되고 유기체의 신진대사를 촉진하기 위해 화학 에너지를 방출한다.광합성과 세포 호흡은 서로 다른 화학 반응의 순서와 서로 다른 세포 구획에서 이루어지기 때문에 구별되는 과정이다.
Cornelis van Niel이 처음 제안한 광합성의 일반 방정식은 다음과 같다.[15]
- + 공여체 + → [ + Electronor +
광합성에 되므로 이 은 다음과 같다.
- + + → [ + +
이 방정식은 물이 광의존성 반응의 반응물인 동시에 광의존성 반응의 산물임을 강조하지만, 각 측면에서 n개의 물 분자를 상쇄하면 순방정식을 얻을 수 있다.
- + 물 + 에너지 → [ +
다른 과정은 전자 공급 역할의 물을 다른 화합물(비소산염 등)로 대체한다. 예를 들어, 일부 미생물은 햇빛을 사용하여 비산염을 산화시켜 [16]비산염을 산화시킨다.이 반응에 대한 방정식은 다음과 같습니다.
- + ( + 에너지 → ( + (이후 [17]반응에서 다른 화합물을 만드는 데 사용)
광합성은 두 단계로 이루어진다.제1단계에서는 광의존성 반응 또는 광반응이 빛의 에너지를 포착하여 수소담체 NADPH와 에너지저장분자 ATP를 만드는 데 사용한다.두 번째 단계 동안, 빛에 의존하지 않는 반응은 이산화탄소를 포착하고 줄이기 위해 이러한 생성물을 사용합니다.
산소 광합성을 이용하는 대부분의 유기체는 빛의존성 반응을 위해 가시광선을 사용하지만, 적어도 3개는 단파 적외선 또는 보다 구체적으로 원적외선 [18]방사선을 사용한다.
어떤 유기체들은 훨씬 더 급진적인 광합성을 사용한다.몇몇 고세균들은 동물들의 시력에 사용되는 것과 유사한 색소를 사용하는 더 간단한 방법을 사용한다.박테리어호돕신은 햇빛에 반응하여 양성자 펌프 역할을 하며 그 구성을 변화시킨다.이것은 보다 직접적으로 양성자 구배를 생성하며, 그 구배는 화학 에너지로 변환된다.이 과정은 이산화탄소 고정과 산소를 방출하지 않으며, [19][20]더 일반적인 광합성과는 별도로 진화한 것으로 보인다.
과
광합성 박테리아에서는 광합성을 위해 빛을 모으는 단백질이 세포막에 박혀 있다.가장 간단한 형태로는, 이것은 [21]세포 자체를 둘러싼 막을 포함한다.하지만,[22] 그 막은 틸라코이드라고 불리는 원통형 시트로 단단히 접혀지거나 세포질 [23]내막이라고 불리는 둥근 소포로 뭉쳐질 수 있다.이러한 구조는 세포 내부의 대부분을 채우고, 막에 매우 큰 표면적을 주어 박테리아가 [22]흡수할 수 있는 빛의 양을 증가시킨다.
식물과 조류에서, 광합성은 엽록체라고 불리는 유기체에서 일어난다.전형적인 식물 세포는 약 10개에서 100개의 엽록체를 포함합니다.엽록체는 막으로 둘러싸여 있다.이 막은 인지질 내막, 인지질 외막, 막간 공간으로 구성되어 있습니다.막에 둘러싸여 있는 것은 스트로마라고 불리는 수성 유체입니다.스트로마 안에는 광합성의 장소인 틸라코이드(그라나)가 쌓여 있다.틸라코이드는 평평한 원반 모양으로 보입니다.틸라코이드 자체는 틸라코이드 막으로 둘러싸여 있으며, 그 안에 루멘 또는 틸라코이드 공간이 있습니다.틸라코이드막에는 광합성계의 일체형 및 말초막 단백질 복합체가 내장되어 있다.
식물은 주로 엽록소 색소를 사용하여 빛을 흡수한다.빛 스펙트럼의 녹색 부분은 흡수되지 않고 반사되며, 이것이 대부분의 식물이 녹색을 띠는 이유이다.엽록소 외에도, 식물들은 또한 카로틴과 [24]크산토필과 같은 색소를 사용한다.조류는 또한 엽록소를 사용하지만, 녹조의 피코시아닌, 카로틴, 잔토필, 홍조의 피코에리스린, 그리고 갈조류와 규조류의 푸코산틴과 같은 다양한 색소들이 존재하여 다양한 색을 만들어낸다.
이 색소들은 안테나 단백질이라고 불리는 복합체의 식물과 조류에 내장되어 있다.이러한 단백질에는 색소가 함께 작용하도록 배치되어 있다.이러한 단백질의 조합은 광수확 [25]복합체라고도 불린다.
비록 식물의 녹색 부분에 있는 모든 세포들이 엽록체를 가지고 있지만, 대부분은 잎이라고 불리는 특별히 적응된 구조에서 발견됩니다.많은 Euphorbia와 선인장 종과 같이 강한 햇빛과 건조한 조건에 적응한 특정 종들은 줄기에 주요 광합성 기관을 가지고 있습니다.엽록소라고 불리는 잎 내부 조직의 세포는 잎의 평방 밀리미터 당 450,000에서 800,000개의 엽록체를 포함할 수 있습니다.잎의 표면은 물의 과도한 증발로부터 잎을 보호하고 자외선이나 푸른 빛의 흡수를 감소시켜 발열을 최소화하는 내수성 왁스 큐티클로 코팅되어 있습니다.투명한 표피층은 빛이 대부분의 광합성이 일어나는 팔리세이드 중엽 세포로 통과할 수 있게 해줍니다.
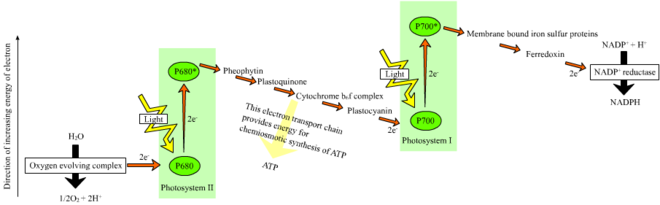
광의존성 반응에서 색소 엽록소 1분자는 광자 1개를 흡수하고 1개의 전자를 잃는다.이 전자는 페오피틴이라고 불리는 엽록소의 변형된 형태에 의해 흡수되며, 페오피틴은 전자를 퀴논 분자로 전달하고, NADPH를 NADPH로 궁극적으로 환원시키는 전자 전달 사슬을 따라 전자의 흐름을 시작합니다.또한, 이것은 엽록체 막을 가로질러 양성자 기울기(에너지 기울기)를 생성하며, 이는 ATP 합성에 ATP 합성 효소에 의해 사용된다.엽록소 분자는 궁극적으로 물 분자가 산소를 방출하는 광분해라고 불리는 과정에서 분열될 때 잃어버린 전자를 되찾는다.
녹색 식물에서 비순환 전자 흐름 조건에서의 광의존성 반응에 대한 전체 방정식은 다음과 같다.[26]
모든 빛의 파장이 광합성을 지원할 수 있는 것은 아니다.광합성 작용 스펙트럼은 존재하는 보조 색소의 유형에 따라 달라집니다.예를 들어 녹색 식물에서 작용 스펙트럼은 클로로필과 카로티노이드의 흡수 스펙트럼과 유사하며, 보라색-파란색과 빨간색 빛에서 흡수 피크를 이룬다.홍조류에서 활동 스펙트럼은 청록색 빛이며, 이것은 이 조류가 지상의 녹색 식물에 의해 사용되는 더 긴 파장(빨간색 빛)을 걸러내는 깊은 물에서 자라기 위해 스펙트럼의 푸른 끝을 사용할 수 있게 해줍니다.광스펙트럼의 비흡수 부분은 광합성 유기체(녹색 식물, 홍조류, 보라색 박테리아 등)에 색을 부여하고 각 유기체의 광합성에 가장 효과적이지 않다.
z
식물에서 광의존성 반응은 엽록체의 틸라코이드 막에서 일어나며, 엽록체와 NADPH의 합성을 촉진합니다.광의존성 반응은 순환반응과 비순환반응의 두 가지 형태가 있다.
비순환 반응에서 광자는 엽록소 및 기타 부속 색소에 의해 광계 II의 집광 안테나 착체에 포착된다(오른쪽 그림 참조).안테나 복합체에 의한 광자의 흡수는 광유도 전하 분리라고 불리는 과정에 의해 전자를 방출시킨다.안테나 시스템은 광계 II 반응 센터의 엽록소 분자의 핵심에 있습니다.이 느슨해진 전자는 1차 전자수용체 분자, 페오피틴에 의해 흡수된다.전자가 전자전달사슬(그림에 표시된 이른바 Z-구성체)을 통해 혼합되면, 양성자 양이온(H+)을 막 너머로 틸라코이드 공간으로 펌핑함으로써 화학삼투압 전위가 생성됩니다.ATP 합성효소는 광인산화 중에 ATP를 만들기 위해 화학 삼투압 전위를 사용하는 반면, NADPH는 Z-scheme의 말단 산화 환원 반응의 산물이다.전자는 광계 I의 엽록소 분자로 들어간다.거기서 광계가 흡수하는 빛에 의해 더욱 들뜨게 된다.그리고 나서 전자는 전자 수용체 사슬을 따라 전달되고, 이 사슬에 에너지의 일부를 전달합니다.전자 수용체에 전달되는 에너지는 수소 이온을 틸라코이드 막을 가로질러 내강으로 이동시키는 데 사용됩니다.전자는 결국 H에서+ NADPH로(광의존 반응에서 기능을 갖는) 보조효소 NADP를 환원하는 데 사용됩니다. 이 시점에서 전자의 경로는 끝납니다.
순환 반응은 비순환 반응과 유사하지만 ATP만 생성하며 환원 NADP(NADPH)는 생성되지 않는다는 점에서 다르다.순환 반응은 광계 I에서만 발생합니다.광계로부터 전자가 이동하면, 전자는 전자 수용체 분자를 통과해 광계 I로 돌아간다. 즉, 전자가 방출된 곳에서 순환 반응이라고 불린다.
광계를 통한 선형 전자 전달은 광계의 반응 중심을 산화시킵니다.다른 전자를 올리려면 먼저 반응 중심을 다시 줄여야 합니다.광계 I의 반응 중심(P700)에서 손실된 들뜬 전자는 광계 II를 통한 전자 전달에서 나오는 플라스토시아닌으로부터의 전달로 대체됩니다.광계 II는 Z-구성체의 첫 번째 단계로서, 산화 엽록소를 반응 중심으로 감소시키기 위해 전자의 외부 소스를 필요로 한다.녹색 식물과 시아노박테리아에서 광합성을 위한 전자의 원천은 물이다.광계 II의 4개의 연속 전하 분리 반응의 에너지에 의해 2개의 물 분자가 산화되어 1개의 2원자 산소 분자와 4개의 수소 이온이 생성된다.생성된 전자는 P680의+ 에너지에 의해 산화되는 산화 환원 활성 티로신 잔기로 전달됩니다.이것은 P680이 다른 광자를 흡수하고 또 다른 광분해 전자를 방출하는 능력을 재설정한다.물의 산화는 광계 II에서 4개의 망간 이온과 1개의 칼슘 이온을 포함하는 산화 환원 활성 구조에 의해 촉매되며, 이 산소 진화 복합체는 2개의 물 분자와 결합하고 물 산화 반응을 유도하는 데 사용되는 4개의 산화 당량(Kok의 S-상태 다이어그램)을 포함합니다.수소 이온은 틸라코이드 내강에서 방출되며, 따라서 ATP 합성을 이끄는 막 투과 화학 삼투압 전위에 기여합니다.산소는 빛에 의존하는 반응의 낭비물이지만, 지구상의 대부분의 유기체는 광합성 [27][28]유기체를 포함한 세포 호흡을 위해 산소와 그 에너지를 사용합니다.
광의존성(또는 "암흑") 반응에서 RuBis 효소는CO는 대기 중 CO를 흡수하고2 캘빈 회로라고 불리는 과정에서 새롭게 형성된 NADPH를 사용하며 3개의 탄소당을 방출하고 나중에 수크로스와 전분을 형성하기 위해 결합됩니다.녹색 식물에서[26]: 128 빛에 의존하지 않는 반응에 대한 전체 방정식은 다음과 같다.
탄소 고정은 3탄당 중간체를 생성하며, 이는 최종 탄수화물 생성물로 전환된다.광합성에 의해 생성된 단순 탄소당은 건축 재료 셀룰로오스, 지질 및 아미노산 생합성의 전구체 또는 세포 호흡의 연료로 사용되는 다른 유기 화합물을 형성하기 위해 사용됩니다.후자는 식물뿐만 아니라 식물에서 나오는 탄소와 에너지가 먹이사슬을 통과할 때 동물에서도 발생한다.
이산화탄소의 고정 또는 감소는 이산화탄소가 5개의 탄소당인 리불로스 1,5-이인산과 결합하여 3개의 탄소 화합물인 글리세린산 3-인산의 두 분자를 생성하는 과정이다.광의존성 단계에서 생성된 ATP 및 NADPH의 존재 하에서 글리세린산 3-인산은 글리세린알데히드 3-인산으로 환원된다.이 제품은 3-포스포글리세르알데히드(PGAL)라고도 하며, 더 일반적으로는 삼인산염이라고도 합니다.생성된 글리세린알데히드 3-인산 중 대부분(6분자 중 5분자)은 리불로스 1,5-이인산염을 재생하는 데 사용되므로 공정을 계속할 수 있다.이렇게 "재순환"되지 않은 삼탄당 인산염은 종종 응축되어 헥소스 인산염이 되고, 이는 궁극적으로 수크로스, 녹말 및 셀룰로오스를 생산합니다.탄소 대사 중에 생성된 당은 아미노산과 지질 생성과 같은 다른 대사 반응에 사용될 수 있는 탄소 골격을 생성한다.

덥고 건조한 환경에서 식물은 수분 손실을 막기 위해 기공을 닫는다.이러한 조건에서는 광합성의 가벼운 반응으로 생성되는 CO가2 감소하고 산소가스가 증가하여 리불로스-1,5-이인산카르복실화효소/산소화효소의 산소화효소 활성에 의한 광흡기 증가와 탄소고정 감소가 발생한다.일부 식물은 이러한 [29]조건에서 잎의 CO 농도를2 증가시키는 메커니즘을 진화시켰다.
C4 탄소 고정 과정을 사용하는 식물은 3탄소 분자 포스포에놀피루브산(PEP)에 첨가하여 4탄소 유기산 옥살로아세트산을 생성함으로써 메조필의 세포에 이산화탄소를 화학적으로 고정시킨다.이 과정에 의해 합성된 옥살로아세트산 또는 사과산염은 RuBis 효소가 있는 특수 다발 피복 세포로 옮겨진다.CO 및 기타 캘빈 회로 효소가 위치하며, 4탄소산의 탈탄산화로 방출되는 CO는2 RuBis에 의해 고정된다.3-탄소 3-포스포글리세릭산에 대한 CO 활성.RuBis의 물리적 분리산소발생광반응에 의한 CO는 광호흡을 감소시키고 CO고정을 증가시켜2 [30]잎의 광합성 능력을 증가시킨다.C4 식물은 높은 빛과 온도 조건에서 C 식물보다3 더 많은 설탕을 생산할 수 있다.많은 중요한 작물들은 옥수수, 수수, 사탕수수, 기장을 포함한 C 식물들이다4.탄소 고정에서 PEP-카르복실화효소를 사용하지 않는 식물을 C 식물이라고3 하는데, 이는 RuBisCO에 의해 촉매되는 1차 카르복실화 반응이 캘빈-벤슨 회로에서 직접 3탄소 3-인산 글리세릭산을 생성하기 때문이다.식물의 90% [31]이상이 C 탄소 고정법을 사용하는3 데 비해, C 탄소 고정법을 사용하는4 비율은 3%이지만, 60개 이상의 식물 계통에서 C가4 진화한 것은 수렴 진화의 두드러진 예입니다.[29]광호흡성2 글리신의 선택적 분해에 의한 탄소 농도를 수반하는 C 광합성은 C의4 진화적 전구체이자 [32]그 자체로 유용한 CCM이다.
선인장과 대부분의 다육식물들과 같은 건생식물들은 또한 CAM이라고 불리는 과정에서 이산화탄소를 포획하기 위해 PEP 카르복실화효소를 사용한다.PEP에 대한 CO 고정과2 캘빈 회로를 공간적으로 분리하는 C 대사와는 대조적으로4 CAM은 이 두 과정을 일시적으로 분리한다.CAM 식물은 C 식물과 다른3 잎 구조를 가지고 있으며, 기공이 열려 있는 밤에 CO를2 고정합니다.CAM 식물은 포스포에놀피루브산을 옥살아세트산으로 카르복실화시키고, 옥살아세트산은 말산으로 환원하여 말산의 형태로 CO를2 저장한다.낮에 말산의 탈탄산화는 잎 내부에 CO를 방출하여2 RuBis에 의한 3-포스포글리세린산 탄소 고정화를 가능하게 한다.CO. CAM은 16,000종의 [33]식물에 의해 사용됩니다.
Amaranthus Hybridus와 Colobanthus kitensis와 같은 옥살산칼슘 축적 식물은 옥살산칼슘 결정이 동적 탄소 풀로서 기능하는 광합성의 변이를 나타내며, 기공이 부분적으로 또는 완전히 닫혔을 때 광합성 세포에 이산화탄소(CO)를2 공급한다.이 과정은 Alarm 광합성이라고 불렸다.스트레스 조건(예를 들어 수분 결핍)에서 옥살산칼슘 결정에서 방출되는 옥살산은 옥살산산화효소 효소에 의해 CO로2 전환되며 생성된2 CO는 캘빈 회로 반응을 지원할 수 있다.옥살산산화효소 반응의 부산물인 반응성 과산화수소(HO)는22 카탈라아제에 의해 중화될 수 있다.경보 광합성은 잘 알려진 C4 및 CAM 경로에 추가되는 광합성 변이를 나타낸다.그러나, 이러한 경로와는 대조적으로, 경보 광합성은 [34][35]대기가 아닌 장기 내부(또는 토양)에서 탄소를 모으는 생화학 펌프로 작동한다.
시아노박테리아는 카복시좀을 가지고 있어 루비스 주변의 CO 농도를2 증가시킨다.광합성 속도를 증가시키기 위한 CO.카복시좀 내에 위치한 효소인 탄산 무수효소는 용해된 탄화수소 이온(HCO−
3)에서 CO를 방출합니다2.CO가2 확산되기 전에 RuBisCO에 의해 빠르게 흡수됩니다. RuBisCO는 카복시좀 내에 농축되어 있습니다.HCO−
3 이온은 다른 탄산무수분해효소에 의해 세포 외부의 CO로부터2 생성되며 막단백질에 의해 세포 내로 능동적으로 펌프된다.그들은 충전될 때 막을 통과할 수 없고, 세포질 내에서 탄산 무수효소의 도움 없이 매우 천천히 CO로2 돌아옵니다.이것은 HCO−
3 이온이 카복시좀으로 [36]확산되는 세포 내에 축적되도록 합니다.녹조 및 뿔새의 피레노이드 또한 RuB 주위에 CO를 농축하는2 역할을 합니다.CO.[37]
와
광합성의 전체 과정은 [13]4단계로 이루어집니다.
| ★★★★★★★★★★★★★★★★」 | ★★★ | 스케일 임임일 time time time |
|---|---|---|
| 1 | 안테나 클로로필(틸라코이드막)의 에너지 전달 | 펨토초에서 피코초 |
| 2 | 광화학반응에서의 전자전달(틸라코이드막) | 피코초 ~ 나노초 |
| 3 | ATP(ATP) | 마이크로초에서 밀리초 |
| 4 | 및 | 밀리초에서 초 |
식물은 보통 3~6%[38][39]의 광합성 효율로 빛을 화학 에너지로 변환한다.변환되지 않은 흡수된 빛은 주로 열로 소산되며, 소량(1-2%)[40]은 더 긴(더 붉은) 파장에서 클로로필 형광으로 재방출된다.이 사실은 엽록소 [40]형광계를 이용하여 광합성의 빛 반응을 측정할 수 있게 해준다.
실제 식물의 광합성 효율은 변환되는 빛의 빈도, 광강도, 온도 및 대기 중 이산화탄소의 비율에 따라 다르며, 0.1%에서 8%[41]까지 다양할 수 있습니다.이에 비해 태양 전지판은 대량 생산 패널의 경우 약 6-20%의 효율로 빛을 전기에너지로 변환하고 실험실 장치의 경우 40% 이상의 효율로 변환한다.과학자들은 [39]생산량이 증가한 식물을 개발하기 위해 광합성을 연구하고 있다.
명암 반응의 효율은 측정할 수 있지만 둘 사이의 관계는 [42]복잡할 수 있습니다.예를 들어 빛 반응에 의해 생성된 ATP 및 NADPH 에너지 분자는 C 식물에서 탄소 고정 [42]또는3 광호흡에 사용될 수 있습니다.전자는 다른 전자 [43][44][45]싱크에도 흐를 수 있습니다.이러한 이유로, 저자들이 비광기적 조건과 광기적 [46][47][48]조건 하에서 수행된 작업을 구별하는 것은 드문 일이 아니다.
광계 II의 클로로필 형광은 광반응을 측정할 수 있고, 적외선 가스 분석기는 암반응을 [49]측정할 수 있다.또한 통합된 엽록소 형광계 및 가스 교환 시스템을 사용하거나 두 개의 개별 시스템을 [50]함께 사용하여 두 가지를 동시에 조사할 수도 있습니다.적외선 가스 분석기 및 일부 수분 센서는 CO의2 광합성 동화를 측정할 수 있을 정도로 민감하며, 신뢰성 있는[51] 방법을2 이용한 δHO는2 일반적으로 μmols/(m2/s), pps/million 또는 부피/mars로 [51]측정되며2, HO는 일반적으로 mmol/(m2/s) 또는 mbars로 측정된다.CO동화, δHO2, 잎온도, 기압, 잎면적 및 광합성활성방사선(PAR)을 측정함으로써2 A 또는 탄소동화, E 또는 증산, gs 또는 기공전도, Ci 또는 세포내 CO를 추정할 수 있다2.[51]그러나 가장 일반적으로 사용되는 매개 변수인 FV/FM과 Y(II) 또는 F/FM'[48]을 몇 초 만에 측정할 수 있기 때문에 적절한 경우 엽록소 형광을 식물 스트레스 측정에 사용하는 것이 더 일반적이다.
주변 환경 위아래의 CO 수준 제어를2 제공하는 가스 교환 시스템은 다양한 CO2 수준에서 A/Ci 곡선의 일반적인 측정을 가능하게 하여 발전소의 광합성 [51]반응을 특징짓는다.
통합된 엽록소 형광계 – 가스 교환 시스템을 통해 광합성 반응과 메커니즘을 [49][50]보다 정확하게 측정할 수 있습니다.표준 가스 교환 광합성 시스템은 Ci, 즉 산하2 CO 수준을 측정할 수 있지만, 통합 엽록소 형광 측정치를 추가하면 [50][52]Ci를 대체할 C를 보다C 정확하게 측정할 수 있습니다.엽록체 내 카르복실화 부위의 CO 추정2 또는C C는 통합 시스템을 [49][50][53]사용하여 메소필 전도도 또는 g를m 측정함으로써 가능해진다.
광합성 측정 시스템은 잎에 흡수되는 빛의 양을 직접 측정하도록 설계되지 않았습니다.그러나 클로로필 형광, P700 및 P515 흡광도 및 가스 교환 측정의 분석에서는 광계, 양자 효율성 및 CO2 동화 속도에 대한 자세한 정보가 나타난다.일부 기구에서는 광합성 효율의 파장 의존성을 [54]분석할 수 있다.
양자 보행이라고 알려진 현상은 빛의 에너지 전달 효율을 크게 증가시킨다.조류, 박테리아, 또는 식물의 광합성 세포에는, 발색단이라고 불리는 빛에 민감한 분자들이 광합성체라고 불리는 안테나 모양의 구조로 배열되어 있다.광자가 발색단에 의해 흡수될 때, 그것은 엑시톤이라고 불리는 준입자로 변환되며, 이것은 발색단에서 발색단으로 뛰면서 세포의 대사에 접근할 수 있는 화학적인 형태로 에너지를 가두는 분자의 집합인 광복합체의 반응 중심을 향한다.여기자의 파동 특성에 의해, 보다 넓은 영역을 커버해, 동시에 몇개의 가능한 패스를 시험할 수 있기 때문에, 가장 효율적인 루트를 즉석에서 「선택」할 수 있습니다.최소한의 시간내에 목적지에 도착할 확률이 가장 높아집니다.
양자 보행은 보통 양자 현상보다 훨씬 높은 온도에서 일어나기 때문에 매우 짧은 거리에서만 가능하다.파괴적 간섭 형태의 장애물은 입자가 고전적인 "홉"을 통해 잠긴 위치에서 해방된 후 입자를 다시 회복하기 전에 순간적으로 입자의 파동 특성을 잃게 합니다.따라서 전자의 포토센터 방향 이동은 일련의 전통적인 홉과 [55][56][57]양자보행으로 커버된다.
★★
- - - 4500 - – – -syslog : – – - - - 3500 - – – - 3000 - – – :-2500 : – – - - 2000 - – – -syslog : – – - - 1000 - – – -500 - – – 0 : |
| |||||||||||||||||||||||||||||||||||||||||||||
녹색과 보라색 유황, 녹색과 보라색 비황 박테리아와 같은 초기 광합성 시스템은 산소가 없는 것으로 생각되며 전자 공여체로 물 이외의 다양한 분자를 사용했다.녹색과 보라색 유황 박테리아는 전자 공여체로 수소와 유황을 사용한 것으로 생각된다.녹색 비황세균은 다양한 아미노산과 다른 유기산을 전자 공여체로 사용했다.보라색 비황세균은 다양한 비특이성 유기 분자를 사용했다.이 분자들의 사용은 그 [58]당시 지구의 초기 대기가 매우 감소했다는 지질학적 증거와 일치한다.
필라멘트 형태의 광합성 유기체로 생각되는 화석은 34억 [59][60]년 전의 것으로 추정되고 있다.더 최근의 연구들은 또한 광합성이 약 34억 [61][62]년 전에 시작되었을 수도 있다는 것을 암시한다.
지구 대기 중 산소의 주요 공급원은 산소 광합성에서 비롯되며, 그 외관은 때때로 산소 재앙이라고 불립니다.지질학적 증거에 따르면 시아노박테리아와 같은 산소 광합성은 약 20억 년 전 고생대 동안 중요해졌다.식물과 대부분의 광합성 원핵생물의 현대 광합성은 물을 전자공여체로 사용하는 산소로 광합성 반응 중심에서 분자 산소로 산화됩니다.
의

몇몇 동물 집단은 광합성 조류와 공생 관계를 형성해 왔다.이것들은 산호, 스폰지, 말미잘에서 가장 흔하다.이는 이들 동물의 체적이 [63]부피에 비해 특히 단순하고 표면적이 넓기 때문으로 추정된다.게다가, 몇몇 해양 연체동물인 엘리시아 비리디스와 엘리시아 클로로티카도 그들이 식단에서 조류로부터 포획한 엽록체와 공생 관계를 유지하고, 그리고 나서 그들의 몸에 저장합니다.이것은 연체동물이 한 [64][65]번에 몇 달 동안 광합성에 의해서만 살아남을 수 있게 해준다.식물 세포 핵에서 나온 유전자 중 일부는 [66]엽록체가 살아남기 위해 필요한 단백질을 공급받을 수 있도록 민달팽이로 옮겨졌다.
더 가까운 형태의 공생은 엽록체의 기원을 설명할 수 있다.엽록체는 원형 염색체, 원핵형 리보솜, 그리고 광합성 반응 [67][68]센터의 유사한 단백질을 포함한 광합성 박테리아와 많은 유사점을 가지고 있습니다.내공생리학 이론은 광합성 박테리아가 최초의 식물 세포를 형성하기 위해 초기 진핵 세포에 의해 획득되었다는 것을 암시합니다.그러므로 엽록체는 식물 세포 내부의 생명에 적응한 광합성 박테리아일 수 있다.미토콘드리아와 마찬가지로 엽록체는 식물 숙주 세포의 핵 DNA와 분리된 자체 DNA를 가지고 있으며 이 엽록체 DNA의 유전자는 시아노박테리아에서 [69]발견되는 것과 유사합니다.엽록체의 DNA는 광합성 반응 센터에서 발견되는 것과 같은 산화환원 단백질을 암호화합니다.CoRR 가설은 유전자 발현의 산화환원 조절을 위해 유전자와 유전자 생성물의 공동 위치가 필요하며,[70] 생체 에너지 기관에서의 DNA 지속성을 설명한다.
공생 및 도벽성 생물 제외:
- 글루코피테와 홍조류-고구형성체(단세포와 다세포)
- 크립토피: 크립토피(단세포)
- 합토식물—합티스타(단세포) 분류
- 미조조아문의 다이노플라겔레이트와 크로메리드 - 알베올라타(단세포)
- 황색동물: 균사체 헤테로콘타(단세포 및 다세포)
- 세르코조아문(Cercozoa)의 클로라키니오피테스와 파울리넬라 3종-클레이드 리자리아(단세포)
- 유글레나과—클레이드 엑스카바타(단세포)
엑셀라타에서 발견된 유글레니드를 제외하고, 이것들은 모두 디폴로레틱스의 것이다.고형성균과 광합성을 하는 파울리넬라는 두 개의 세포막으로 둘러싸인 플라스티드를 시아노박테륨을 삼킴으로써 두 개의 개별적인 사건으로 1차 내심증을 통해 얻었다.다른 모든 그룹의 플라스티드는 적색 또는 녹색 조류의 기원을 가지며, "빨간색 계통"과 "녹색 계통"으로 불립니다.디노플라겔레이트 및 유글레니드는 3개의 막으로 둘러싸여 있으며, 나머지 라인은 4개로 둘러싸여 있다.원형질 내막과 외막 사이에 위치한 원조핵의 잔존물인 핵형상은 크립토피(빨간색 조류)와 클로로키니오피(녹색 조류)[71]에 존재한다.광합성 능력을 상실한 몇몇 다이노플라겔라트들은 나중에 다른 조류와의 새로운 내생생물학적 사건들을 통해 다시 광합성 능력을 되찾았다.광합성을 할 수 있는 동안, 이러한 진핵 생물군들 중 많은 수가 혼합영양이고 다양한 정도로 이종영양화를 실행한다.
물을 광합성에 있어서 전자의 원천으로 사용하는 생화학적 능력은 산소 광합성을 수행하는 유일한 원핵생물인 현존하는 시아노박테리아(옛 남조류라고 불림)의 공통 조상에서 한 번 진화했다.지질학적 기록에 따르면 이 변혁 사건은 적어도 2억4천50만-2억3천만년 전(Ma) 지구 역사 초기에 일어났으며 훨씬 더 [72][73]이른 것으로 추측된다.광합성의 추정 발달 동안 지구의 대기는 산소를 거의 포함하지 않았기 때문에, 최초의 광합성 시아노박테리아는 [74]산소를 생성하지 않았다고 여겨진다.시생대 퇴적암에 대한 지질학적 연구로부터의 이용 가능한 증거는 생명체가 3500 Ma에 존재했음을 나타내지만, 산소 광합성이 언제 진화했는지에 대한 의문은 여전히 풀리지 않고 있다.2000년경에 시아노박테리아 진화에 대한 명확한 고생물학 창이 열리면서 이미 다양한 시아노박테리아 생물군이 발견되었다.시아노박테리아는 원생대 Eon(2500–543Ma) 내내 산소의 주요 생산국으로 남아 있었는데, 부분적으로 바다의 산화환원 구조가 질소 [citation needed]고정성이 있는 광자영동물을 선호했기 때문이다.녹조는 원생대 말기 대륙붕에서 산소의 주요 1차 생산자로서 시아노박테리아에 합류했지만, 중생대(251-66Ma) 방사선의 다이노플라겔레이트, 콕콜리소포리드, 규조만이 해수붕에서 산소의 1차 생산 형태를 띠게 되었다.시아노박테리아는 해양회로의 산소 1차 생산국, 생물학적 질소 고정제, 변형된 형태의 [75]해양조류의 플라스티드로써 해양생태계에 여전히 중요하다.
★★★
19번입니다.
얀 반 헬몬트는 17세기 중반 식물이 사용하는 토양의 질량과 식물이 자랄 때의 질량을 주의 깊게 측정하면서 이 과정을 연구하기 시작했다.토양의 질량이 거의 변하지 않았다는 것을 알게 된 후, 그는 자라는 식물의 질량이 그가 화분에 첨가한 유일한 물질인 물에서 나온 것이 틀림없다는 가설을 세웠다.그의 가설은 부분적으로 정확했다 – 얻은 질량의 대부분은 물뿐만 아니라 이산화탄소에서 나온다.하지만, 이것은 식물의 바이오매스의 대부분이 토양 자체가 아니라 광합성의 투입물로부터 나온다는 생각을 보여주는 신호 지점이었다.
화학자이자 목사인 조셉 프리스틀리는 뒤집힌 항아리 아래에서 공기를 분리하여 그 안에서 초를 태우면2 초가 밀랍이 다 떨어지기 훨씬 전에 매우 빨리 타버린다는 것을 발견했습니다.그는 더 나아가 쥐도 비슷하게 공기를 "상처"할 수 있다는 것을 발견했다.그리고 나서 그는 촛불과 생쥐에 의해 "상처받은" 공기가 [76]식물에 의해 회복될 수 있다는 것을 보여주었다.
1779년, 얀 잉겐하우즈는 프리스틀리의 실험을 반복했다.그는 몇 [76][77]시간 만에 쥐를 소생시킬 수 있는 것은 햇빛이 식물에 미치는 영향이라는 것을 발견했다.
1796년 스위스의 목사이자 식물학자이자 박물학자였던 장 세네비에르는 녹색 식물이 이산화탄소를 소비하고 빛의 영향 하에서 산소를 방출한다는 것을 증명했다.곧이어 니콜라-테오도르 드 소쇠르는 식물이 성장함에 따라 질량이 증가하는 것은 CO의 흡수뿐만2 아니라 물의 통합 때문일 수 있다는 것을 보여주었다.따라서, 광합성이 음식(예: 포도당)을 생산하기 위해 사용되는 기본 반응의 [78]윤곽이 드러났다.
★★★★
코넬리스 반 니엘은 광합성의 화학을 설명하는 중요한 발견을 했다.보라색 유황 박테리아와 녹색 박테리아를 연구함으로써, 그는 광합성이 수소가 이산화탄소를 감소시키는 광의존적인 산화환원 반응이라는 것을 최초로 증명했습니다.
로버트 에머슨은 서로 다른 빛의 파장을 사용하여 식물 생산성을 시험함으로써 두 가지 빛 반응을 발견했다.빨간색만 있어도 빛 반응은 억제되었습니다.파란색과 빨간색이 결합되었을 때, 생산량은 훨씬 더 실질적이었다.따라서, 두 개의 광계가 있었는데, 하나는 최대 600 nm의 파장을 흡수하고 다른 하나는 최대 700 nm의 파장을 흡수했다.전자는 PSII로 알려져 있고, 후자는 PSI이다. PSI는 엽록소 "a"만을 포함하고 있으며, PSI는 다른 색소들 중에서 대부분의 이용 가능한 엽록소 "b"와 함께 주로 엽록소 "a"를 포함하고 있다.이것들은 각각 홍조와 남조의 홍색과 청색 색소인 피코빌린과 갈조류와 규조류의 푸코산톨을 포함한다.이 과정은 PSI와 PSI에서 양자 흡수가 같을 때 가장 생산적이며, 안테나 복합체로부터의 입력 에너지가 PSI와 PSI 시스템 간에 분배되어 [13]광화학에 전력을 공급합니다.
로버트 힐은 반응의 복합체가 시토크롬6 b에서 시토크롬 b로 구성되어 있고, 또 다른 복합체는 시토크롬 f에서 탄수화물 생성 메커니즘의 단계까지라고 생각했습니다.이것들은 시토크롬 f를 줄이기 위해 에너지를 필요로 하는 플라스토키논에 의해 연결되어 있다.녹색 식물의 광합성 과정에서 개발된 산소가 물에서 나온다는 것을 증명하기 위한 추가 실험은 1937년과 1939년에 힐에 의해 수행되었다.그는 분리된 엽록체가 빛에 노출된 후 옥살산철, 펠리시안화물 또는 벤조퀴논과 같은 부자연스러운 환원제 존재 하에서 산소를 방출한다는 것을 보여주었다.힐 반응:[79]
- 22 HO + 2 A + (라이트, 엽록체) → 2 AH2 + O2
A는 전자수용체입니다.따라서 빛에서는 전자수용체가 감소하여 산소가 생성된다.Samuel Ruben과 Martin Kamen은 광합성을 통해 방출되는 산소가 물에서 나온다는 것을 알아내기 위해 방사성 동위원소를 사용했다.

Melvin Calvin과 Andrew Benson은 James Bassham과 함께 식물에서 탄소 동화의 경로를 설명했다.탄소 환원 주기는 캘빈 회로로 알려져 있지만, 많은 과학자들은 그것을 캘빈-벤슨-칼빈 또는 심지어 캘빈-벤슨-바셈 회로라고 부른다.
노벨상 수상자인 과학자 루돌프 A. 마커스는 나중에 전자전달계의 기능과 중요성을 발견할 수 있었다.
오토 하인리히 바르부르크와 딘 버크는 [80]호흡에 의해 활성화된 CO를 분열시키는2 I-양자 광합성 반응을 발견했다.
1950년 오토 칸들러는 생체 내 광인산화 존재에 대한 첫 번째 실험 증거를 온전한 클로렐라 세포를 사용하고 그의 발견을 광의존성 ATP [81]형성으로 해석했다.1954년 다니엘 1세 Arnon 등은 [82][83]P의 도움을32 받아 격리된 엽록체에서 체외에서 광인산화 현상을 발견했다.
루이스 N.M. Duysens와 Jan Amesz는 엽록소 "a"가 하나의 빛을 흡수하여 시토크롬 f를 산화시키는 반면, 엽록소 "a"는 다른 빛을 흡수하지만 두 개의 빛 반응이 직렬임을 나타내면서 이 같은 산화 시토크롬을 감소시킨다는 것을 발견했습니다.
★★★★★★★★★★★★★★★★★★★★
1893년, 찰스 리드 반스는 광합성과 광합성이라는 두 가지 용어를 제안했는데, 이는 엽록소의 존재 하에서 탄산으로부터 복잡한 탄소 화합물을 합성하는 생물학적 과정을 의미한다.시간이 흐르면서 광합성이라는 용어가 널리 쓰이게 되었다.나중에 비산소 광합성 박테리아와 광인산화 현상이 발견됨에 따라 [84]이 용어의 정의가 필요하게 되었다.
: C3 : C4 광합성 연구
1940년대 후반 버클리 캘리포니아 대학의 화학자 멜빈 캘빈, 앤드류 벤슨, 제임스 배섬과 탄소-14 동위원소 및 종이 크로마토그래피 [85]기술을 사용하는 수십 명의 학생과 연구자들에 의해 광합성 탄소 대사의 세부 사항이 정리되었다.녹조 클로렐라에 의한 CO 고정 경로는2 1초 만에 포스포글리세릭산(PGA)이라고 불리는 3개의 탄소 분자를 생성했다.이 독창적이고 획기적인 연구로 1961년 멜빈 캘빈에게 노벨 화학상이 수여되었다.이와 함께 식물 생리학자는 새로운 적외선 가스 분석 방법과 순 광합성 속도가 10~13μmol2 CO−2·m−1·s인 잎실을 사용하여 잎 가스 교환을 연구했으며, 모든 지상 식물은 [86][87]햇빛의 50% 미만으로 광합성 능력이 동일하다는 결론을 내렸다.
이후 1958-1963년 코넬 대학에서 재배된 밭 옥수수는 40μmol2 CO·m−2·s의−1 훨씬 더 높은 잎 광합성 속도를 가지고 있으며 거의 완전한 [88][89]햇빛에서도 포화되지 않는 것으로 보고되었다.옥수수의 이러한 높은 비율은 밀과 콩과 같은 다른 종에서 관찰된 것보다 거의 두 배였으며, 이는 고등 식물들 사이에 광합성의 큰 차이가 있음을 보여준다.애리조나 대학에서는 15종 이상의 단떡잎과 쌍떡잎에 대한 상세한 가스 교환 연구를 통해 잎의 해부학적 차이가 [90][91]종 간의 광합성 능력을 구별하는 데 중요한 요소라는 사실이 처음으로 밝혀졌습니다.옥수수, 수수, 사탕수수, 버뮤다 잔디 및 다이콧 아마란서스를 포함한 열대 풀에서 잎 광합성 속도는 약 38~40μmol2 CO·m−2·s였으며−1, 잎은 두 종류의 녹색 세포, 즉 촘촘히 채워진 담즙성 혈관 다발 피복 세포를 둘러싼 중엽 세포의 외층을 가지고 있다.이런 형태의 해부학은 19세기에 식물학자 고틀립 하버란트가 사탕수수의 [92]잎 해부학을 연구하면서 크란츠 해부학이라고 불렀다.광합성 속도가 가장 높고 크란츠 해부학적 구조를 가진 식물 종들은 겉으로 보이는 광호흡, 매우2 낮은 CO 보상점, 높은 최적 온도, 높은 기공 저항, 그리고 가스 확산에 대한 낮은 메소필 저항과 완전한 태양 [93]빛에서 포화되지 않은 속도를 보였다.애리조나에서의 연구는 [91]1986년에 인용 고전으로 지정되었다.이 종들은 빛에서 CO 고정의 첫 번째 안정적인 화합물이2 말산염과 아스파르트산염으로 [94][95][96]4개의 탄소를 가지고 있기 때문에 나중에 C4 식물이라고 불렸다.크란츠 해부학이 결여된 다른 종들은 면화, 해바라기 등 C3형이라고 불리는데, 이는 최초의 안정 탄소 화합물이 3탄소 PGA이기 때문이다.공기 측정 시 CO 1000ppm에서2 C3와 C4 공장 모두 약 60μmol2 CO·m−2·s의−1 잎 광합성 속도가 비슷하여 C3 [90][91]공장의 광호흡 억제를 나타냈다.
★★★★★

광합성에 영향을[clarification needed] 미치는 세 가지 주요 요인과 몇 가지 부수적인 요인들이 있다.세 가지 주요 항목은 다음과 같습니다.[citation needed]
총 광합성은 다양한 환경 요인에 의해 제한된다.이것들은 이용 가능한 빛의 양, 식물이 빛을 포착해야 하는 잎 영역의 양, (다른 식물에 의한 그늘은 광합성의 주요 한계), 광합성을 지원하기 위해 엽록체에 이산화탄소가 공급될 수 있는 비율, 물의 가용성, 그리고 운반에 적합한 온도의 가용성을 포함합니다.광합성[97]
및 온도 (광도), δ(광도), δ(광도)
광합성의 과정은 생물권에 자유 에너지의 주요 투입물을 제공하며, 방사선이 [98]식물에게 중요한 네 가지 주요 방법 중 하나이다.
식물 군집 내의 방사선 기후는 시간과 공간 모두에서 매우 가변적이다.
20세기 초에, 프레드릭 블랙만과 가브리엘 마태이는 빛의 세기와 온도가 탄소 동화 속도에 미치는 영향을 조사했다.
- 일정한 온도에서 탄소 동화 속도는 조사 강도에 따라 달라지며, 조사 강도가 증가함에 따라 증가하지만 더 높은 조사 강도에서는 고원에 도달한다.
- 낮은 방사 강도에서 온도 상승은 탄소 동화 속도에 거의 영향을 미치지 않는다.일정한 고방사 강도에서는 온도가 상승함에 따라 탄소 동화 속도가 증가합니다.
이 두 가지 실험은 몇 가지 중요한 점을 보여 줍니다.첫째, 일반적으로 광화학반응은 온도의 영향을 받지 않는 것으로 알려져 있다.그러나, 이러한 실험은 온도가 탄소 동화 속도에 영향을 미친다는 것을 분명히 보여주므로, 탄소 동화의 전체 과정에는 두 가지 반응이 있어야 한다.이것들은 빛 의존적인 '광화학적인' 온도 의존적인 단계와 빛 의존적인 온도 의존적인 단계이다.둘째, 블랙맨의 실험은 제한 요인의 개념을 보여준다.또 다른 제한 요인은 빛의 파장이다.수 미터 아래에 있는 시아노박테리아는 기존의 광합성 색소에서 광유도 전하 분리를 일으키는 데 필요한 파장을 제대로 받지 못한다.이 문제와 싸우기 위해, 다른 색소를 가진 일련의 단백질들이 반응 중심을 둘러싸고 있다.이 단위는 [clarification needed]피코빌리솜이라고 불립니다.
이산화탄소 농도 및 광호흡
이산화탄소 농도가 증가함에 따라 다른 요인에 의해 제한될 때까지 광의존성 반응에 의해 설탕이 만들어지는 속도가 증가합니다.광의존 반응에서 이산화탄소를 포착하는 효소인 RuBisCO는 이산화탄소와 산소에 모두 결합 친화력을 가지고 있다.이산화탄소 농도가 높을 때 RuBis는CO는 이산화탄소를 고정시킬 것이다.단, 이산화탄소 농도가 낮으면 RuBis는CO는 이산화탄소 대신 산소를 결합시킬 것이다.광호흡이라고 불리는 이 과정은 에너지를 사용하지만 당을 생성하지는 않습니다.
RuBisCO 산소 분해효소 활성은 여러 가지 이유로 발전소에 불리합니다.
- 산소분해효소 활성의 한 산물은 3-포스포글리세린산(3탄소) 대신 포스포글리콜산(2탄소)이다.포스포글리콜산은 캘빈-벤슨 회로에 의해 대사될 수 없으며 회로로 손실된 탄소를 나타낸다.따라서 높은 산소가수분해효소 활성은 리불로스 5-이인산을 재활용하고 캘빈-벤슨 회로를 지속하기 위해 필요한 당을 배출한다.
- 포스포글리콜산은 고농도로 식물에 독성이 있는 글리콜산염으로 빠르게 대사되어 광합성을 억제한다.
- 글리콜산 회수 과정은 글리콜산 경로를 사용하는 에너지적으로 비용이 많이 드는 과정이며, 탄소의 75%만이 3-포스포글리세린산염으로 캘빈-벤슨 회로로 돌아간다.이 반응은 또한 암모니아(NH3)를 생성하며, 암모니아(NH)는 공장 밖으로 확산되어 질소의 손실을 초래할 수 있다.
- 매우 간단한 요약은 다음과 같습니다.
- 글리콜산 2개 + ATP → 3-글루글리세린산 3개 + 이산화탄소 + ADP + NH3
RuBis 제품의 인양 경로CO 산소 분해효소 활성은 빛에 의존하는 산소 소비와 이산화탄소의 방출로 특징지어지기 때문에 광호흡으로 더 일반적으로 알려져 있습니다.
「 」를 참조해 주세요.
레퍼런스
- ^ "photosynthesis". Online Etymology Dictionary. Archived from the original on 2013-03-07. Retrieved 2013-05-23.
- ^ 리델, 헨리 조지; 스콧, 로버트; 페르세우스 프로젝트의 그리스 영어 사전
- ^ 츠요시Liddell, Henry George; Scott, Robert; 페르세우스 프로젝트의 그리스 영어 사전
- ^ a b Bryant DA, Frigaard NU (Nov 2006). "Prokaryotic photosynthesis and phototrophy illuminated". Trends in Microbiology. 14 (11): 488–496. doi:10.1016/j.tim.2006.09.001. PMID 16997562.
- ^ Reece J, Urry L, Cain M, Wasserman S, Minorsky P, Jackson R (2011). Biology (International ed.). Upper Saddle River, NJ: Pearson Education. pp. 235, 244. ISBN 978-0-321-73975-9.
This initial incorporation of carbon into organic compounds is known as carbon fixation.
- ^ Olson JM (May 2006). "Photosynthesis in the Archean era". Photosynthesis Research. 88 (2): 109–117. doi:10.1007/s11120-006-9040-5. PMID 16453059. S2CID 20364747.
- ^ Buick R (Aug 2008). "When did oxygenic photosynthesis evolve?". Philosophical Transactions of the Royal Society of London, Series B. 363 (1504): 2731–2743. doi:10.1098/rstb.2008.0041. PMC 2606769. PMID 18468984.
- ^ Nealson KH, Conrad PG (Dec 1999). "Life: past, present and future". Philosophical Transactions of the Royal Society of London, Series B. 354 (1392): 1923–1939. doi:10.1098/rstb.1999.0532. PMC 1692713. PMID 10670014.
- ^ Whitmarsh J, Govindjee (1999). "The photosynthetic process". In Singhal GS, Renger G, Sopory SK, Irrgang KD, Govindjee (eds.). Concepts in photobiology: photosynthesis and photomorphogenesis. Boston: Kluwer Academic Publishers. pp. 11–51. ISBN 978-0-7923-5519-9.
100×1015 grams of carbon/year fixed by photosynthetic organisms, which is equivalent to 4×1018 kJ/yr = 4×1021 J/yr of free energy stored as reduced carbon.
- ^ Steger U, Achterberg W, Blok K, Bode H, Frenz W, Gather C, Hanekamp G, Imboden D, Jahnke M, Kost M, Kurz R, Nutzinger HG, Ziesemer T (2005). Sustainable development and innovation in the energy sector. Berlin: Springer. p. 32. ISBN 978-3-540-23103-5. Archived from the original on 2016-09-02. Retrieved 2016-02-21.
The average global rate of photosynthesis is 130 TW.
- ^ "World Consumption of Primary Energy by Energy Type and Selected Country Groups, 1980–2004". Energy Information Administration. July 31, 2006. Archived from the original (XLS) on November 9, 2006. Retrieved 2007-01-20.
- ^ Field CB, Behrenfeld MJ, Randerson JT, Falkowski P (Jul 1998). "Primary production of the biosphere: integrating terrestrial and oceanic components". Science. 281 (5374): 237–240. Bibcode:1998Sci...281..237F. doi:10.1126/science.281.5374.237. PMID 9657713. Archived from the original on 2018-09-25. Retrieved 2018-04-20.
- ^ a b c "Photosynthesis". McGraw-Hill Encyclopedia of Science & Technology. Vol. 13. New York: McGraw-Hill. 2007. ISBN 978-0-07-144143-8.
- ^ Frankelius, Per (July–August 2020). "A proposal to rethink agriculture in the climate calculations". Agronomy Journal. 112 (4): 3216–3221. doi:10.1002/agj2.20286. S2CID 219423329.
- ^ Whitmarsh J, Govindjee (1999). "Chapter 2: The Basic Photosynthetic Process". In Singhal GS, Renger G, Sopory SK, Irrgang KD, Govindjee (eds.). Concepts in Photobiology: Photosynthesis and Photomorphogenesis. Boston: Kluwer Academic Publishers. p. 13. ISBN 978-0-7923-5519-9.
- ^ 혐기성 광합성, 화학 & 엔지니어링 뉴스, 86, 33, 2008년 8월 18일자 36면
- ^ Kulp TR, Hoeft SE, Asao M, Madigan MT, Hollibaugh JT, Fisher JC, Stolz JF, Culbertson CW, Miller LG, Oremland RS (Aug 2008). "Arsenic(III) fuels anoxygenic photosynthesis in hot spring biofilms from Mono Lake, California". Science. 321 (5891): 967–970. Bibcode:2008Sci...321..967K. doi:10.1126/science.1160799. PMID 18703741. S2CID 39479754.
- ^ "Scientists discover unique microbe in California's largest lake". Archived from the original on 2009-07-12. Retrieved 2009-07-20.
- ^ 플랜트: 다양성과 진화 2016-09-01 Wayback Machine에서 아카이브, 14페이지, Martin Ingrouille, Bill Eddie
- ^ Oakley T (19 December 2008). "Evolutionary Novelties: Opsins: An amazing evolutionary convergence". Archived from the original on 17 April 2019. Retrieved 17 April 2019.
- ^ Tavano CL, Donohue TJ (December 2006). "Development of the bacterial photosynthetic apparatus". Current Opinion in Microbiology. 9 (6): 625–631. doi:10.1016/j.mib.2006.10.005. PMC 2765710. PMID 17055774.
- ^ a b Mullineaux CW (1999). "The thylakoid membranes of cyanobacteria: structure, dynamics and function". Australian Journal of Plant Physiology. 26 (7): 671–677. doi:10.1071/PP99027.
- ^ Sener MK, Olsen JD, Hunter CN, Schulten K (October 2007). "Atomic-level structural and functional model of a bacterial photosynthetic membrane vesicle". Proceedings of the National Academy of Sciences of the United States of America. 104 (40): 15723–15728. Bibcode:2007PNAS..10415723S. doi:10.1073/pnas.0706861104. PMC 2000399. PMID 17895378.
- ^ Campbell NA, Williamson B, Heyden RJ (2006). Biology Exploring Life. Upper Saddle River, New Jersey: Prentice Hall. ISBN 978-0-13-250882-7. Archived from the original on 2014-11-02. Retrieved 2009-02-03.
- ^ Ziehe D, Dünschede B, Schünemann D (December 2018). "Molecular mechanism of SRP-dependent light-harvesting protein transport to the thylakoid membrane in plants". Photosynthesis Research. 138 (3): 303–313. doi:10.1007/s11120-018-0544-6. PMC 6244792. PMID 29956039.
- ^ a b Raven PH, Evert RF, Eichhorn SE (2005). Biology of Plants (7th ed.). New York: W. H. Freeman and Company. pp. 124–127. ISBN 978-0-7167-1007-3.
- ^ "Yachandra/Yano Group". Lawrence Berkeley National Laboratory. Archived from the original on 2019-07-22. Retrieved 2019-07-22.
- ^ Pushkar Y, Yano J, Sauer K, Boussac A, Yachandra VK (February 2008). "Structural changes in the Mn4Ca cluster and the mechanism of photosynthetic water splitting". Proceedings of the National Academy of Sciences of the United States of America. 105 (6): 1879–1884. Bibcode:2008PNAS..105.1879P. doi:10.1073/pnas.0707092105. PMC 2542863. PMID 18250316.
- ^ a b Williams BP, Johnston IG, Covshoff S, Hibberd JM (September 2013). "Phenotypic landscape inference reveals multiple evolutionary paths to C4 photosynthesis". eLife. 2: e00961. doi:10.7554/eLife.00961. PMC 3786385. PMID 24082995.
- ^ Taiz L, Geiger E (2006). Plant Physiology (4th ed.). Sinauer Associates. ISBN 978-0-87893-856-8.
- ^ Monson RK, Sage RF (1999). "The Taxonomic Distribution of C
4 Photosynthesis". C4 plant biology. Boston: Academic Press. pp. 551–580. ISBN 978-0-12-614440-6. - ^ Lundgren, Marjorie R. (December 2020). "C 2 photosynthesis: a promising route towards crop improvement?". New Phytologist. 228 (6): 1734–1740. doi:10.1111/nph.16494. PMID 32080851.
- ^ Dodd AN, Borland AM, Haslam RP, Griffiths H, Maxwell K (April 2002). "Crassulacean acid metabolism: plastic, fantastic". Journal of Experimental Botany. 53 (369): 569–580. doi:10.1093/jexbot/53.369.569. PMID 11886877.
- ^ Tooulakou G, Giannopoulos A, Nikolopoulos D, Bresta P, Dotsika E, Orkoula MG, et al. (August 2016). "Alarm Photosynthesis: Calcium Oxalate Crystals as an Internal CO2 Source in Plants". Plant Physiology. 171 (4): 2577–2585. doi:10.1104/pp.16.00111. PMC 4972262. PMID 27261065.
- ^ Gómez-Espinoza O, González-Ramírez D, Bresta P, Karabourniotis G, Bravo LA (October 2020). "Decomposition of Calcium Oxalate Crystals in Colobanthus quitensis under CO2 Limiting Conditions". Plants. 9 (10): 1307. doi:10.3390/plants9101307. PMC 7600318. PMID 33023238.
- ^ Badger MR, Price GD (February 2003). "CO2 concentrating mechanisms in cyanobacteria: molecular components, their diversity and evolution". Journal of Experimental Botany. 54 (383): 609–622. doi:10.1093/jxb/erg076. PMID 12554704.
- ^ Badger MR, Andrews JT, Whitney SM, Ludwig M, Yellowlees DC, Leggat W, Price GD (1998). "The diversity and coevolution of Rubisco, plastids, pyrenoids, and chloroplast-based CO2-concentrating mechanisms in algae". Canadian Journal of Botany. 76 (6): 1052–1071. doi:10.1139/b98-074.
- ^ Miyamoto K. "Chapter 1 – Biological energy production". Renewable biological systems for alternative sustainable energy production (FAO Agricultural Services Bulletin – 128). Food and Agriculture Organization of the United Nations. Archived from the original on 7 September 2013. Retrieved 4 January 2009.
- ^ a b Ehrenberg R (2017-12-15). "The photosynthesis fix". Knowable Magazine. Annual Reviews. doi:10.1146/knowable-121917-115502. Retrieved 2018-04-03.
- ^ a b Maxwell K, Johnson GN (April 2000). "Chlorophyll fluorescence – a practical guide". Journal of Experimental Botany. 51 (345): 659–668. doi:10.1093/jexbot/51.345.659. PMID 10938857.
- ^ Govindjee R. "What is Photosynthesis?". Biology at Illinois. Archived from the original on 27 May 2014. Retrieved 17 April 2014.
- ^ a b Rosenqvist E, van Kooten O (2006). "Chapter 2: Chlorophyll Fluorescence: A General Description and Nomenclature". In DeEll JA, Toivonen PM (eds.). Practical Applications of Chlorophyll Fluorescence in Plant Biology. Dordrecht, the Netherlands: Kluwer Academic Publishers. pp. 39–78.
- ^ Baker NR, Oxborough K (2004). "Chapter 3: Chlorophyll fluorescence as a probe of photosynthetic productivity". In Papaqeorgiou G, Govindjee (eds.). Chlorophylla Fluorescence a Signature of Photosynthesis. Dordrecht, The Netherlands: Springer. pp. 66–79.
- ^ Flexas J, Escalnona JM, Medrano H (January 1999). "Water stress induces different levels of photosynthesis and electron transport rate regulation in grapevines". Plant, Cell and Environment. 22 (1): 39–48. doi:10.1046/j.1365-3040.1999.00371.x.
- ^ Fryer MJ, Andrews JR, Oxborough K, Blowers DA, Baker NR (1998). "Relationship between CO2 assimilation, photosynthetic electron transport, and active O2 metabolism in leaves of maize in the field during periods of low temperature". Plant Physiology. 116 (2): 571–580. doi:10.1104/pp.116.2.571. PMC 35114. PMID 9490760.
- ^ Earl H, Said Ennahli S (2004). "Estimating photosynthetic electron transport via chlorophyll fluorometry without Photosystem II light saturation". Photosynthesis Research. 82 (2): 177–186. doi:10.1007/s11120-004-1454-3. PMID 16151873. S2CID 291238.
- ^ Genty B, Briantais J, Baker NR (1989). "The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence". Biochimica et Biophysica Acta (BBA) - General Subjects. 990 (1): 87–92. doi:10.1016/s0304-4165(89)80016-9.
- ^ a b Baker NR (2008). "Chlorophyll fluorescence: A probe of photosynthesis in vivo". Annual Review of Plant Biology. 59: 89–113. doi:10.1146/annurev.arplant.59.032607.092759. PMID 18444897. S2CID 31451852.
- ^ a b c Bernacchi CJ, Portis AR, Nakano H, von Caemmerer S, Long SP (2002). "Temperature response of mesophyll conductance. Implications for the determination of Rubisco enzyme kinetics and for limitations to photosynthesis in vivo". Plant Physiology. 130 (4): 1992–1998. doi:10.1104/pp.008250. PMC 166710. PMID 12481082.
- ^ a b c d Ribas-Carbo M, Flexas J, Robinson SA, Tcherkez GG (2010). "In vivo measurement of plant respiration". University of Wollongong Research Online.
- ^ a b c d Long SP, Bernacchi CJ (2003). "Gas exchange measurements, what can they tell us about the underlying limitations to photosynthesis? Procedures and sources of error". Journal of Experimental Botany. 54 (392): 2393–2401. doi:10.1093/jxb/erg262. PMID 14512377.
- ^ Bernacchi CJ, Portis A (2002). "R., Nakano H., von Caemmerer S., and Long S.P. (2002) Temperature response of nesophyll conductance. Implications for the determination of Rubisco enzyme kinetics and for limitations to photosynthesis in vivo". Plant Physiology. 130 (4): 1992–1998. doi:10.1104/pp.008250. PMC 166710. PMID 12481082.
- ^ Yin X, Struik PC (2009). "Theoretical reconsiderations when estimating the mesophyll conductanceto CO2 diffusion in leaves of C3 plants by analysis of combined gas exchange and chlorophyll fluorescence measurements". Plant, Cell and Environment. 32 (11): 1513–1524 [1524]. doi:10.1111/j.1365-3040.2009.02016.x. PMID 19558403.
- ^ Schreiber U, Klughammer C, Kolbowski J (2012). "Assessment of wavelength-dependent parameters of photosynthetic electron transport with a new type of multi-color PAM chlorophyll fluorometer". Photosynthesis Research. 113 (1–3): 127–144. doi:10.1007/s11120-012-9758-1. PMC 3430841. PMID 22729479.
- ^ Palmer J (21 June 2013). "Plants 'seen doing quantum physics'". BBC News. Archived from the original on 3 October 2018. Retrieved 21 June 2018.
- ^ Lloyd S (10 March 2014). "Quantum Biology: Better living through quantum mechanics". The Nature of Reality. Nova: PBS Online; WGBH Boston. Archived from the original on 3 July 2017. Retrieved 8 September 2017.
- ^ Hildner R, Brinks D, Nieder JB, Cogdell RJ, van Hulst NF (June 2013). "Quantum coherent energy transfer over varying pathways in single light-harvesting complexes". Science. 340 (6139): 1448–1451. Bibcode:2013Sci...340.1448H. doi:10.1126/science.1235820. PMID 23788794. S2CID 25760719.
- ^ Gale J (2009). Astrobiology of Earth: The emergence, evolution and future of life on a planet in turmoil. Oxford University Press. pp. 112–113. ISBN 978-0-19-154835-2.
- ^ Davis K (2 October 2004). "Photosynthesis got a really early start". New Scientist. Archived from the original on 1 May 2015. Retrieved 8 September 2017.
- ^ Hooper R (19 August 2006). "Revealing the dawn of photosynthesis". New Scientist. Archived from the original on 24 May 2015. Retrieved 8 September 2017.
- ^ Cardona T (March 2018). "Early Archean origin of heterodimeric Photosystem I". Heliyon. 4 (3): e00548. doi:10.1016/j.heliyon.2018.e00548. PMC 5857716. PMID 29560463. Archived from the original on 1 April 2019. Retrieved 23 March 2018.
- ^ Howard V (7 March 2018). "Photosynthesis Originated A Billion Years Earlier Than We Thought, Study Shows". Astrobiology Magazine. Archived from the original on October 1, 2020. Retrieved 23 March 2018.
- ^ Venn AA, Loram JE, Douglas AE (2008). "Photosynthetic symbioses in animals". Journal of Experimental Botany. 59 (5): 1069–1080. doi:10.1093/jxb/erm328. PMID 18267943.
- ^ Rumpho ME, Summer EJ, Manhart JR (May 2000). "Solar-powered sea slugs. Mollusc/algal chloroplast symbiosis". Plant Physiology. 123 (1): 29–38. doi:10.1104/pp.123.1.29. PMC 1539252. PMID 10806222.
- ^ Muscatine L, Greene RW (1973). Chloroplasts and algae as symbionts in molluscs. International Review of Cytology. Vol. 36. pp. 137–169. doi:10.1016/S0074-7696(08)60217-X. ISBN 978-0-12-364336-0. PMID 4587388.
- ^ Rumpho ME, Worful JM, Lee J, Kannan K, Tyler MS, Bhattacharya D, Moustafa A, Manhart JR (November 2008). "Horizontal gene transfer of the algal nuclear gene psbO to the photosynthetic sea slug Elysia chlorotica". Proceedings of the National Academy of Sciences of the United States of America. 105 (46): 17867–17871. Bibcode:2008PNAS..10517867R. doi:10.1073/pnas.0804968105. PMC 2584685. PMID 19004808.
- ^ Douglas SE (December 1998). "Plastid evolution: origins, diversity, trends". Current Opinion in Genetics & Development. 8 (6): 655–661. doi:10.1016/S0959-437X(98)80033-6. PMID 9914199.
- ^ Reyes-Prieto A, Weber AP, Bhattacharya D (2007). "The origin and establishment of the plastid in algae and plants". Annual Review of Genetics. 41: 147–168. doi:10.1146/annurev.genet.41.110306.130134. PMID 17600460. S2CID 8966320.[permanent dead link]
- ^ Raven JA, Allen JF (2003). "Genomics and chloroplast evolution: what did cyanobacteria do for plants?". Genome Biology. 4 (3): 209. doi:10.1186/gb-2003-4-3-209. PMC 153454. PMID 12620099.
- ^ Allen JF (December 2017). "The CoRR hypothesis for genes in organelles". Journal of Theoretical Biology. 434: 50–57. Bibcode:2017JThBi.434...50A. doi:10.1016/j.jtbi.2017.04.008. PMID 28408315.
- ^ Keeling, P. J. (2010). "The endosymbiotic origin, diversification and fate of plastids - NCBI - NIH". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 365 (1541): 729–748. doi:10.1098/rstb.2009.0103. PMC 2817223. PMID 20124341.
- ^ Tomitani A, Knoll AH, Cavanaugh CM, Ohno T (April 2006). "The evolutionary diversification of cyanobacteria: molecular-phylogenetic and paleontological perspectives". Proceedings of the National Academy of Sciences of the United States of America. 103 (14): 5442–5447. Bibcode:2006PNAS..103.5442T. doi:10.1073/pnas.0600999103. PMC 1459374. PMID 16569695.
- ^ "Cyanobacteria: Fossil Record". Ucmp.berkeley.edu. Archived from the original on 2010-08-24. Retrieved 2010-08-26.
- ^ Smith A (2010). Plant biology. New York: Garland Science. p. 5. ISBN 978-0-8153-4025-6.
- ^ Herrero A, Flores E (2008). The Cyanobacteria: Molecular Biology, Genomics and Evolution (1st ed.). Caister Academic Press. ISBN 978-1-904455-15-8.
- ^ a b Martin D, Thompson A, Stewart I, Gilbert E, Hope K, Kawai G, Griffiths A (September 2012). "A paradigm of fragile Earth in Priestley's bell jar". Extreme Physiology & Medicine. 1 (1): 4. doi:10.1186/2046-7648-1-4. PMC 3707099. PMID 23849304.
- ^ Gest H (2000). "Bicentenary homage to Dr Jan Ingen-Housz, MD (1730-1799), pioneer of photosynthesis research". Photosynthesis Research. 63 (2): 183–190. doi:10.1023/A:1006460024843. PMID 16228428. S2CID 22970505.
- ^ Rabinowitch EI (1945). Photosynthesis and Related Processes. Vol. 1 – via Biodiversity Heritage Library.
- ^ Walker DA (2002). "'And whose bright presence' – an appreciation of Robert Hill and his reaction" (PDF). Photosynthesis Research. 73 (1–3): 51–54. doi:10.1023/A:1020479620680. PMID 16245102. S2CID 21567780. Archived from the original (PDF) on 2008-03-09. Retrieved 2015-08-27.
- ^ Otto Warburg – Biography Archived 2010-12-15 at the Wayback Machine. Nobelprize.org (1970-08-01). Retrieved on 2011-11-03.
- ^ Kandler O (1950). "Über die Beziehungen zwischen Phosphathaushalt und Photosynthese. I. Phosphatspiegelschwankungen bei Chlorella pyrenoidosa als Folge des Licht-Dunkel-Wechsels" [On the relationship between the phosphate metabolism and photosynthesis I. Variations in phosphate levels in Chlorella pyrenoidosa as a consequence of light-dark changes] (PDF). Zeitschrift für Naturforschung. 5b (8): 423–437. doi:10.1515/znb-1950-0806. S2CID 97588826. Archived (PDF) from the original on 2018-06-24. Retrieved 2018-06-26.
- ^ Arnon DI, Whatley FR, Allen MB (1954). "Photosynthesis by isolated chloroplasts. II. Photophosphorylation, the conversion of light into phosphate bond energy". Journal of the American Chemical Society. 76 (24): 6324–6329. doi:10.1021/ja01653a025.
- ^ Arnon DI (1956). "Phosphorus metabolism and photosynthesis". Annual Review of Plant Physiology. 7: 325–354. doi:10.1146/annurev.pp.07.060156.001545.
- ^ Gest H (2002). "History of the word photosynthesis and evolution of its definition". Photosynthesis Research. 73 (1–3): 7–10. doi:10.1023/A:1020419417954. PMID 16245098. S2CID 11265932.
- ^ Calvin M (July 1989). "Forty years of photosynthesis and related activities". Photosynthesis Research. 21 (1): 3–16. doi:10.1007/BF00047170. PMID 24424488. S2CID 40443000.
- ^ Verduin J (1953). "A table of photosynthesis rates under optimal, near natural conditions". Am. J. Bot. 40 (9): 675–679. doi:10.1002/j.1537-2197.1953.tb06540.x. JSTOR 2439681.
- ^ Verduin J, Whitwer EE, Cowell BC (July 1959). "Maximal photosynthetic rates in nature". Science. 130 (3370): 268–269. Bibcode:1959Sci...130..268V. doi:10.1126/science.130.3370.268. PMID 13668557. S2CID 34122342.
- ^ Hesketh JD, Musgrave R (1962). "Photosynthesis under field conditions. IV. Light studies with individual corn leaves". Crop Sci. 2 (4): 311–315. doi:10.2135/cropsci1962.0011183x000200040011x. S2CID 83706567.
- ^ Hesketh JD, Moss DN (1963). "Variation in the response of photosynthesis to light". Crop Sci. 3 (2): 107–110. doi:10.2135/cropsci1963.0011183X000300020002x.
- ^ a b El-Sharkawy, MA, Hesketh JD (1965). "Photosynthesis among species in relation to characteristics of leaf anatomy and CO2 diffusion resistances". Crop Sci. 5 (6): 517–521. doi:10.2135/cropsci1965.0011183x000500060010x.
- ^ a b c El-Sharkawy MA, Hesketh JD (1986). "Citation Classic-Photosynthesis among species in relation to characteristics of leaf anatomy and CO2 diffusion resistances" (PDF). Curr. Cont./Agr.Biol.Environ. 27: 14.[permanent dead link]
- ^ Haberlandt G (1904). Physiologische Pflanzanatomie. Leipzig: Engelmann.
- ^ El-Sharkawy MA (1965). Factors Limiting Photosynthetic Rates of Different Plant Species (Ph.D. thesis). The University of Arizona, Tucson, USA.
- ^ Karpilov YS (1960). "The distribution of radioactvity in carbon-14 among the products of photosynthesis in maize". Proc. Kazan Agric. Inst. 14: 15–24.
- ^ Kortschak HP, Hart CE, Burr GO (1965). "Carbon dioxide fixation in sugarcane leaves". Plant Physiol. 40 (2): 209–213. doi:10.1104/pp.40.2.209. PMC 550268. PMID 16656075.
- ^ Hatch MD, Slack CR (1966). "Photosynthesis by sugar-cane leaves. A new carboxylation reaction and the pathway of sugar formation". Biochem. J. 101 (1): 103–111. doi:10.1042/bj1010103. PMC 1270070. PMID 5971771.
- ^ Chapin FS, Matson PA, Mooney HA (2002). Principles of Terrestrial Ecosystem Ecology. New York: Springer. pp. 97–104. ISBN 978-0-387-95443-1.
- ^ Jones HG (2014). Plants and Microclimate: a Quantitative Approach to Environmental Plant Physiology (Third ed.). Cambridge: Cambridge University Press. ISBN 978-0-521-27959-8.
Further reading
| Library resources about Photosynthesis |
Books
- Bidlack JE, Stern KR, Jansky S (2003). Introductory Plant Biology. New York: McGraw-Hill. ISBN 978-0-07-290941-8.
- Blankenship RE (2014). Molecular Mechanisms of Photosynthesis (2nd ed.). John Wiley & Sons. ISBN 978-1-4051-8975-0.
- Govindjee, Beatty JT, Gest H, Allen JF (2006). Discoveries in Photosynthesis. Advances in Photosynthesis and Respiration. Vol. 20. Berlin: Springer. ISBN 978-1-4020-3323-0.
- Reece JB, et al. (2013). Campbell Biology. Benjamin Cummings. ISBN 978-0-321-77565-8.
Papers
- Gupta RS, Mukhtar T, Singh B (Jun 1999). "Evolutionary relationships among photosynthetic prokaryotes (Heliobacterium chlorum, Chloroflexus aurantiacus, cyanobacteria, Chlorobium tepidum and proteobacteria): implications regarding the origin of photosynthesis". Molecular Microbiology. 32 (5): 893–906. doi:10.1046/j.1365-2958.1999.01417.x. PMID 10361294. S2CID 33477550.
- Rutherford AW, Faller P (Jan 2003). "Photosystem II: evolutionary perspectives". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 358 (1429): 245–253. doi:10.1098/rstb.2002.1186. PMC 1693113. PMID 12594932.
External links
- A collection of photosynthesis pages for all levels from a renowned expert (Govindjee)
- In depth, advanced treatment of photosynthesis, also from Govindjee
- Science Aid: Photosynthesis Article appropriate for high school science
- Metabolism, Cellular Respiration and Photosynthesis – The Virtual Library of Biochemistry and Cell Biology
- Overall examination of Photosynthesis at an intermediate level
- Overall Energetics of Photosynthesis
- The source of oxygen produced by photosynthesis Interactive animation, a textbook tutorial
- Marshall J (2011-03-29). "First practical artificial leaf makes debut". Discovery News. Archived from the original on 2012-03-22. Retrieved 2011-03-29.
- Photosynthesis – Light Dependent & Light Independent Stages Archived 2011-09-10 at the Wayback Machine
- Khan Academy, video introduction