토레미펜
Toremifene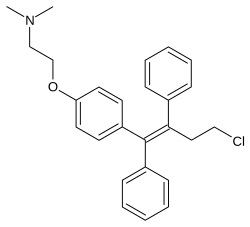 | |
 | |
| 임상 데이터 | |
|---|---|
| 발음 | /tct-r-m- |
| 상호 | Fareston, 기타 |
| 기타 이름 | (Z)-토레미펜; 4-클로로타목시펜; 4-CT; 아카포덴; CCRIS-8745; FC-1157; FC-1157a; GTx-006; NK-622; NSC-613680 |
| AHFS/Drugs.com | 모노그래프 |
| Medline Plus | a608003 |
| 라이선스 데이터 | |
| 루트 행정부. | 입으로 |
| 약물 클래스 | 선택적 에스트로겐 수용체 조절기 |
| ATC 코드 | |
| 약동학 데이터 | |
| 바이오 어베이러빌리티 | 양호/~100%[1][2] |
| 단백질 결합 | 99.7%[1] |
| 대사 | 간(CYP3A4)[5][2] |
| 대사물 | N-데스메틸토레미펜, 4-히드록시토레미펜, 오스페미펜[3][4] |
| 반감기 제거 | 토레미펜 : 3~7일[1] 대사물: 4~21일[2][4][1] |
| 배설물 | 대변 : 70% (대사물)[2] |
| 식별자 | |
| |
| CAS 번호 |
|
| PubChem CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 첸블 | |
| PDB배위자 | |
| CompTox 대시보드 (EPA ) | |
| ECHA 정보 카드 | 100.125.139 |
| 화학 및 물리 데이터 | |
| 공식 | C26H28클론NO |
| 몰 질량 | 405.97 g/g−1/g/g(표준) |
| 3D 모델(JSmol) | |
| |
| |
| (표준) | |
토레미펜은 파리스톤이라는 브랜드명으로 팔리고 있으며 폐경 [4][6][3]후 여성의 유방암 진행 치료에 사용되는 의약품이다.입으로 [4]먹는 거예요.
토레미펜의 부작용으로는 발열, 땀, 메스꺼움, 구토, 어지럼증, 질 분비물, 질 [5][7]출혈 등이 있다.그것은 또한 혈전, 불규칙한 심장박동, 백내장, 시각 장애, 높아진 간 효소, 자궁내막과형성증, 자궁내막암을 [5]일으킬 수 있다.고혈중 칼슘 수치는 뼈 [5]전이가 있는 여성들에게서 발생할 수 있다.
이 약은 선택적 에스트로겐 수용체 변조제(SERM)이므로 에스트라디올과 [5][7]같은 에스트로겐의 생물학적 표적인 에스트로겐 수용체(ER)의 혼합 작용제-항작용제이다.뼈, 간, 자궁에 에스트로겐 작용과 [6][8][9][5]유방에는 항에스트로겐 작용이 있습니다.트리페닐에틸렌 유도체이며 타목시펜과 [10]밀접한 관련이 있습니다.
토레미펜은 1997년에 [11][12]의료용으로 도입되었다.1978년 [13]타목시펜 이후 처음으로 도입된 항에스트로겐제다.미국에서는 [14]제네릭 의약품으로 구입할 수 있습니다.
의료 용도
토레미펜은 에스트로겐 수용체 양성 또는 불명 상태의 [4][6]종양을 가진 폐경 후 여성의 전이성 유방암 치료에 대해 승인되었다.이것은 [4]미국에서 유일하게 승인된 사용법입니다.이 [6][15]표시에 대해 타목시펜과 동등한 효과를 나타낸다.토레미펜은 유방 통증 치료에 효과가 있는 것으로 밝혀졌으며 이 적응증에 [16]대해 타목시펜보다 더 효과적인 약일 수 있다.그것은 또한 [15]타목시펜에 비해 콜레스테롤과 트리글리세리드 수치를 포함한 골밀도와 지질 프로필에 탁월한 영향을 미친다.토레미펜은 [17]남성들에게서 여성 흉부 증상을 현저하게 개선하는 것으로 보고되었다.
이용 가능한 폼
토레미펜은 60mg [18][19]경구정제의 형태로 제공됩니다.
부작용
토레미펜의 부작용은 타목시펜의 [5]부작용과 비슷하다.가장 흔한 부작용은 [5]핫플래시이다.다른 부작용으로는 땀, 메스꺼움, 구토, 어지럼증, 질 분비물, 질 [5][7]출혈 등이 있다.뼈 전이가 있는 여성에게는 고칼슘혈증이 발생할 [5]수 있다.토레미펜은 혈전 색전 증상의 위험이 [5]적다.백내장, 시력 변화, 간 효소 상승이 보고되었다.[5][7]이 약은 QT 간격을 연장시켜 치명적인 부정맥의 [5]위험이 있다.저칼륨혈증, 저자석혈증, 기존 QT 연장 환자 및 기타 QT 연장 [5]약물을 복용하는 환자에서 사용을 피함으로써 부정맥 장애의 위험을 줄일 수 있습니다.토레미펜은 자궁에 에스트로겐 작용을 하기 때문에 자궁내막과다형성과 [5]자궁내막암의 위험을 높일 수 있습니다.
토레미펜은 [15]타목시펜보다 안전한 것으로 보인다.정맥혈전색전증(VTE), 뇌졸중 및 [15]백내장의 위험이 낮다.VTE의 낮은 위험은 타목시펜이 항트롬빈 III의 수치를 60mg [15]또는 200mg/일 토레미펜보다 훨씬 더 크게 감소시킨다는 사실과 관련이 있을 수 있다.
상호 작용
토레미펜은 시토크롬 P450 효소인 CYP3A4의 기질이기 때문에 이 효소를 유도 또는 억제하는 약물은 [5]체내 토레미펜의 농도를 각각 낮추거나 증가시킬 수 있다.
약리학
약역학
토레미펜은 선택적 에스트로겐 수용체 변조제(SERM)[5][7][20]입니다. 즉, 에스트로겐 수용체(ER)의 선택적 혼합 작용제-항작용제이며, 일부 조직에서는 에스트로겐 작용, 다른 [5][7]조직에서는 항에스트로겐 작용이 있습니다.뼈에는 에스트로겐, 자궁과 간에는 부분 에스트로겐, 유방에는 [6][8][9][5]항에스트로겐 효과가 있습니다.
| 약 | 유방. | 뼈. | 간 | 자궁 | 질 | 뇌 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 지질 | 응고 | SHBG | IGF-1 | 핫 플래시 | 고나도트로핀류 | |||||||||
| 에스트라디올 | + | + | + | + | + | + | + | + | + | + | ||||
| "이상 SERM" | – | + | + | ± | ± | ± | – | + | + | ± | ||||
| 바제독시펜 | – | + | + | + | + | ? | – | ± | – | ? | ||||
| 클로미펜 | – | + | + | ? | + | + | – | ? | – | ± | ||||
| 라소폭시펜 | – | + | + | + | ? | ? | ± | ± | – | ? | ||||
| 오스페미펜 | – | + | + | + | + | + | ± | ± | – | ± | ||||
| 랄록시펜 | – | + | + | + | + | + | ± | – | – | ± | ||||
| 타목시펜 | – | + | + | + | + | + | + | – | – | ± | ||||
| 토레미펜 | – | + | + | + | + | + | + | – | – | ± | ||||
| 효과: + = 에스트로겐/작용제.± = 혼합 또는 중성.– = 항에스트로겐/길항제.참고: SERM은 일반적으로 폐경 전 여성(항에스트로겐)뿐만 아니라 저나달 및 유고나달 남성(유고나달)에서 고나도트로핀 수치를 증가시키지만 폐경 후 여성(에스트로겐)에서는 고나도트로핀 수치를 감소시킨다.출처:"템플릿"을 참조해 주세요. | ||||||||||||||
ER에 대한 토레미펜의 친화력은 타목시펜의 [6][21][22]친화력과 유사하다.랫드 ER을 사용한 연구에서 토레미펜은 약 1.4%, 타목시펜은 [23][24][25][26][27][22]ER에 대한 에스트라디올 친화력의 약 1.6%를 가졌다.인간 ER에서 토레미펜의 친화력(Ki)은 ERα의 경우 20.3 ± 0.1nM, ERβ의 [20]경우 15.4 ± 3.1nM으로 보고되었다.다른 랫드 ER 연구에서 토레미펜은 ER에 대한 에스트라디올 친화력의 3~9%를 가졌으며, 대사물인 N-데스메틸토레미펜과 4-히드록시토레미펜은 [28][29][30]각각 ER에 대한 에스트라디올 친화력의 3~5%, 64~158%를 나타냈다.다른 대사물인 4-히드록시-N-데스메틸토레미펜의 친화력은 [29]평가되지 않았으며, 4-히드록시토레미펜은 시험관내에서의 토레미펜보다 약 100배 높은 항에스트로겐 효력을 보였으나,[28] 다른 [29]연구에서는 그렇지 않았다. 4-히드록시-N-데스메틸토레미펜 역시 [28]시험관내에서의 항에스트로겐 효력이 강하게 나타났다.토레미펜의 대사물, 특히 4-히드록시토레미펜은 의약품의 [1][29][28]임상 활동에 중요한 기여를 할 수 있다.반면에, 일부 당국은 토레미펜이 프로드러그가 [31]아니라고 생각한다.
토레미펜은 타목시펜과 매우 유사하며 대부분의 [6][8][9][5]성질을 공유합니다.토레미펜은 동물에서 간암원이 아니며 유전독성의 가능성이 [6][3]낮기 때문에 타목시펜보다 안전할 수 있다는 징후가 있다.그러나 임상연구에서는 효과, 내구성 및 안전성 측면에서 토레미펜과 타목시펜 사이에 유의한 차이가 발견되지 않았으며, 따라서 토레미펜의 임상사용은 다소 [6][3]제한적이었다.토레미펜은 타목시펜 효력의 약 3분의 1을 가지고 있는 것으로 생각된다. 즉, 60mg의 토레미펜은 유방암 [32]치료에서 대략 20mg의 타목시펜과 같다.
토레미펜은 폐경 [33]후 여성에게는 항나토픽 효과가, [34]남성에게는 프로고나토픽 효과가 있으며, 성호르몬 결합 글로불린 [33]수치를 증가시키고, 폐경 후 여성 및 [35]남성에게는 인슐린 유사 성장인자 1 수치를 약 20% 감소시키는 것으로 밝혀졌다.
4-히드록시토레미펜은 SERM으로서의 활성과 더불어 에스트로겐 관련 수용체 δ(ERR)[36]의 길항제이다.
약동학
흡수.
토레미펜의 생물학적 가용성은 정확하게 결정되지는 않았지만 양호한 것으로 알려져 있으며 약 100%[1][2]로 추정되고 있다.정상상태에서 60mg/일 용량으로 토레미펜의 농도는 800~879ng/[1]mL이다.정상상태에서 N-desmethyltoremifen과 토레미펜의 수치는 60mg/day에서 3,058ng/mL, 200mg/day에서 5,942ng/mL, 400mg/[1]day에서 11,913ng/mL이었다.정상상태에서 4-히드록시토레미펜과 토레미펜의 수치는 200mg/day에서 438ng/mL, 400mg/[1]day에서 889ng/mL이었다.토레미펜의 농도는 10~680mg의 [37][38]선량 범위에서 선형적으로 증가한다.
분배
토레미펜은 혈장 단백질에 99.7% 결합되어 있으며, 92%는 알부민에 특이적으로 결합되어 있으며, 약 6%는1 β글로불린 분율에 결합되어 있으며, 2%는 알부민과 α글로불린 [37][1]사이의1 분수에 결합되어 있다.토레미펜의 겉보기 분포량은 457~[37]958L이다.
대사
토레미펜은 주로 CYP3A4에 의해 간에서 대사되며, 그 후 2차 히드록실화를 [2]거친다.토레미펜의 대사물로는 N-데스메틸토레미펜, 4-히드록시토레미펜,[1][29][2][39] 4-히드록시-N-데스메틸토레미펜 등이 있다.오스페미펜(데아미노히드록시토레미펜)[1][4] 또한 토레미펜의 주요 대사물이다.
소거
건강한 [1]사람의 경우 토레미펜의 반감기는 3~7일이다.간 기능이 손상된 사람의 반감기는 [1]11일입니다.토레미펜 대사물의 제거 반감기는 N-desmethyltoremifene이 5~21일, 4-히드록시토레미펜이 5일, 아스페미펜이 [1][2][4]4일이다.토레미펜과 그 대사물의 긴 제거 반감기는 장간 순환과 높은 혈장 단백질 [1][5]결합에 기인하는 것으로 생각된다.토레미펜은 대사물로서 [2]대변에서 70%가 제거된다.
화학
4-클로로타목시펜으로도 알려진 토레미펜은 트리페닐에틸렌의 유도체이며 타목시펜의 [10]가까운 유사체이다.또한 아피목시펜(4-히드록시타목시펜) 및 오스페미펜(데아미노히드록시토레미펜)[40][41]과도 밀접한 관련이 있다.
역사
토레미펜은 [11][12]1997년 미국에서 도입되었다.1978년 [13]타목시펜 이후 국내에 도입된 첫 항에스트로겐제다.
사회와 문화
일반명
토레미펜은 약과 그것의 그리고 그것의 총칭이고, 반면 토레미펜 구연산염은 그것의 그리고 토레미펜은 [42][43][44][45]그것의 것입니다.
브랜드명
토레미펜은 거의 전적으로 [43][45]파리스톤이라는 브랜드명으로 판매된다.
유용성
토레미펜은 전 세계적으로 널리 판매되고 있으며 미국, 영국, 아일랜드, 다른 많은 유럽 국가, 남아프리카공화국, 호주, 뉴질랜드 및 세계 [43][45]다른 곳에서 구입할 수 있습니다.
조사.
토레미펜은 또한 전립선암 예방에 대한 평가를 받았으며 잠정 상표명은 아카포덴이었다.[46]
2007년 제약회사 GTx, Inc.는 두 가지 다른 임상시험을 수행했습니다. 첫째, 진행성 전립선암에 대한 ADT(특히 척추/척추골절 및 핫플래시, 지질프로파일 및 산모양)의 심각한 부작용 치료를 위한 중추적 Phase 임상시험입니다.높은 등급의 전립선 상피 내 종양(PIN)을 가진 고위험 남성의 전립선암 예방을 위한 3단계 임상시험.이러한 테스트의 결과는 2008년[47] 1분기에 발표될 예정입니다.
2009년 [48]2월에 첫 번째 신청(전립선암 ADT 부작용 완화)에 대한 NDA가 제출되었고, 2009년 10월에 FDA는 다른 단계 III [49]시험과 같은 더 많은 임상 데이터가 필요하다고 밝혔다.
궁극적으로, 개발은 중단되었고 토레미펜은 ADT나 전립선암의 [50]치료 또는 예방과 관련된 합병증에 대해 시판되지 않았다.
토레미펜은 비칼루타미드유기성 여성유발증 [15]예방에 도움이 될 수 있다.
단계 III 시험 결과
1,260명의 남성 샘플을 사용하여 이중맹검, 플라시보 대조군, 랜덤화, 3년간의 토레미펜 임상시험을 수행했다.대상자의 평균 연령은 64세였으며, 톰슨과 리치는 낮은 등급의 PIN도 [51]사전 자극으로 간주될 수 있지만, 높은 등급의 전립선 상피내 신생물증(HGPIN)으로 진단되었다.
이 연구를 설계하고 관리한 후원자인 GTx는 위약의 34.7%, 토레미펜 그룹의 32.3%가 암 발병 사실을 발견했다.어느 [52]그룹의 글리슨 점수에서도 차이가 발견되지 않았다.
쥐의 전립선(TRAMP) 생쥐의 트랜스제닉 선암을 사용한 이전의 쥐 연구는 토레미펜이 동물의 60%에서 촉각성 종양을 예방하는 것을 보여주었다.이 연구는 초기 예방약으로 레미펜을 사용했는데, 이는 3단계 인간 [53]연구와 구별된다.
레퍼런스
- ^ a b c d e f g h i j k l m n o p Taras TL, Wurz GT, Linares GR, DeGregorio MW (November 2000). "Clinical pharmacokinetics of toremifene". Clin Pharmacokinet. 39 (5): 327–34. doi:10.2165/00003088-200039050-00002. PMID 11108432. S2CID 26647296.
- ^ a b c d e f g h i Vincent T. DeVita Jr.; Theodore S. Lawrence; Steven A. Rosenberg (7 January 2015). DeVita, Hellman, and Rosenberg's Cancer: Principles & Practice of Oncology. Wolters Kluwer Health. pp. 1126–. ISBN 978-1-4698-9455-3.
- ^ a b c d Bruce A. Chabner; Dan L. Longo (7 December 2011). Cancer Chemotherapy and Biotherapy: Principles and Practice. Lippincott Williams & Wilkins. pp. 659–. ISBN 978-1-4511-4820-6.
- ^ a b c d e f g h https://www.accessdata.fda.gov/drugsatfda_docs/label/2011/020497s006lbl.pdf[베어 URL PDF]
- ^ a b c d e f g h i j k l m n o p q r s t u Laura Rosenthal; Jacqueline Burchum (17 February 2017). Lehne's Pharmacotherapeutics for Advanced Practice Providers - E-Book. Elsevier Health Sciences. pp. 931–. ISBN 978-0-323-44779-9.
- ^ a b c d e f g h i William R. Miller; James N. Ingle (8 March 2002). Endocrine Therapy in Breast Cancer. CRC Press. pp. 55–57. ISBN 978-0-203-90983-6.
- ^ a b c d e f David Schiff; Isabel Arrillaga; Patrick Y. Wen (16 September 2017). Cancer Neurology in Clinical Practice: Neurological Complications of Cancer and its Treatment. Humana Press. pp. 296–. ISBN 978-3-319-57901-6.
- ^ a b c Monica Morrow; Virgil Craig Jordan (2003). Managing Breast Cancer Risk. PMPH-USA. pp. 192–. ISBN 978-1-55009-260-8.
- ^ a b c Selective Estrogen Receptor Modulators—Advances in Research and Application: 2013 Edition: ScholarlyBrief. ScholarlyEditions. 1 May 2013. pp. 51–. ISBN 978-1-4901-0447-8.
- ^ a b Antonio Cano; Joacquim Calaf i Alsina; Jose Luis Duenas-Diez (22 September 2006). Selective Estrogen Receptor Modulators: A New Brand of Multitarget Drugs. Springer Science & Business Media. pp. 52–. ISBN 978-3-540-34742-2.
- ^ a b Orlando E. Silva; Stefano Zurrida (2005). Breast Cancer: A Practical Guide. Elsevier Health Sciences. pp. 355–. ISBN 0-7020-2744-8.
- ^ a b Wayne R. Bidlack; Stanley T. Omaye; Mark S. Meskin; Debra K.W. Topham (16 March 2000). Phytochemicals as Bioactive Agents. CRC Press. pp. 26–. ISBN 978-1-56676-788-0.
- ^ a b Philip J. DiSaia; William T. Creasman; Robert S Mannel; D. Scott McMeekin, David G Mutch (4 February 2017). Clinical Gynecologic Oncology E-Book. Elsevier Health Sciences. pp. 124–. ISBN 978-0-323-44316-6.
- ^ "Generic Fareston Availability - Drugs.com". Drugs.com. Retrieved 2019-04-19.
- ^ a b c d e f Sieber PR (December 2007). "Treatment of bicalutamide-induced breast events". Expert Rev Anticancer Ther. 7 (12): 1773–9. doi:10.1586/14737140.7.12.1773. PMID 18062751. S2CID 40410461.
- ^ Kirby I. Bland; Edward M. Copeland; V. Suzanne Klimberg; William J Gradishar (29 June 2017). The Breast E-Book: Comprehensive Management of Benign and Malignant Diseases. Elsevier Health Sciences. pp. 86–. ISBN 978-0-323-51187-2.
- ^ Tabbal, Mahmoud; Fuleihan, Ghada El-Hajj (2010). "Future Therapies". Osteoporosis in Men. pp. 713–732. doi:10.1016/B978-0-12-374602-3.00057-2. ISBN 9780123746023.
- ^ Mari J. Wirfs, PhD, MN, APRN, ANP-BC, FNP-BC, CNE (9 May 2019). The APRN and PA's Complete Guide to Prescribing Drug Therapy 2020. Springer Publishing Company. pp. 60–. ISBN 978-0-8261-7934-0.
{{cite book}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Casciato; Mary C. Territo (2012). Manual of Clinical Oncology. Lippincott Williams & Wilkins. pp. 122–. ISBN 978-1-4511-1560-4.
- ^ a b Taneja SS, Smith MR, Dalton JT, Raghow S, Barnette G, Steiner M, Veverka KA (March 2006). "Toremifene--a promising therapy for the prevention of prostate cancer and complications of androgen deprivation therapy". Expert Opin Investig Drugs. 15 (3): 293–305. doi:10.1517/13543784.15.3.293. PMID 16503765. S2CID 29510508.
- ^ Paul Workman (6 December 2012). New Approaches in Cancer Pharmacology: Drug Design and Development. Springer Science & Business Media. pp. 104–. ISBN 978-3-642-77874-2.
- ^ a b Kallio S, Kangas L, Blanco G, Johansson R, Karjalainen A, Perilä M, Pippo I, Sundquist H, Södervall M, Toivola R (1986). "A new triphenylethylene compound, Fc-1157a. I. Hormonal effects". Cancer Chemother Pharmacol. 17 (2): 103–8. doi:10.1007/BF00306736. PMID 2941176. S2CID 13238715.
- ^ Wittliff, J. L., Kerr II, D. A., & Andres, S. A. (2005). "Estrogens IV: Estrogen-Like Pharmaceuticals". In Wexler, P. (ed.). Encyclopedia of Toxicology, 2nd Edition. Vol. Dib–L. pp. 254–258. ISBN 9780080548005.
{{cite book}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ Blair RM, Fang H, Branham WS, Hass BS, Dial SL, Moland CL, Tong W, Shi L, Perkins R, Sheehan DM (March 2000). "The estrogen receptor relative binding affinities of 188 natural and xenochemicals: structural diversity of ligands". Toxicol Sci. 54 (1): 138–53. doi:10.1093/toxsci/54.1.138. PMID 10746941.
- ^ Fang H, Tong W, Shi LM, Blair R, Perkins R, Branham W, Hass BS, Xie Q, Dial SL, Moland CL, Sheehan DM (March 2001). "Structure-activity relationships for a large diverse set of natural, synthetic, and environmental estrogens". Chem Res Toxicol. 14 (3): 280–94. doi:10.1021/tx000208y. PMID 11258977.
- ^ Chander SK, Sahota SS, Evans TR, Luqmani YA (December 1993). "The biological evaluation of novel antioestrogens for the treatment of breast cancer". Crit Rev Oncol Hematol. 15 (3): 243–69. doi:10.1016/1040-8428(93)90044-5. PMID 8142059.
- ^ Robert J. Kavlock; George P. Daston (6 December 2012). Drug Toxicity in Embryonic Development II: Advances in Understanding Mechanisms of Birth Defects: Mechanistics Understanding of Human Development Toxicants. Springer Science & Business Media. pp. 437–. ISBN 978-3-642-60447-8.
- ^ a b c d Kangas L (1990). "Biochemical and pharmacological effects of toremifene metabolites". Cancer Chemother Pharmacol. 27 (1): 8–12. doi:10.1007/BF00689269. PMID 2147128. S2CID 11502291.
- ^ a b c d e Robinson SP, Parker CJ, Jordan VC (August 1990). "Preclinical studies with toremifene as an antitumor agent". Breast Cancer Res Treat. 16 Suppl: S9–17. doi:10.1007/BF01807139. PMID 2149286. S2CID 19989845.
- ^ C. Kent Osborne (6 December 2012). Endocrine Therapies in Breast and Prostate Cancer. Springer Science & Business Media. pp. 104–. ISBN 978-1-4613-1731-9.
- ^ Vogel CL, Johnston MA, Capers C, Braccia D (February 2014). "Toremifene for breast cancer: a review of 20 years of data". Clin Breast Cancer. 14 (1): 1–9. doi:10.1016/j.clbc.2013.10.014. PMID 24439786.
- ^ MacGregor JI, Jordan VC (June 1998). "Basic guide to the mechanisms of antiestrogen action". Pharmacol. Rev. 50 (2): 151–96. PMID 9647865.
- ^ a b Ellmén J, Hakulinen P, Partanen A, Hayes DF (November 2003). "Estrogenic effects of toremifene and tamoxifen in postmenopausal breast cancer patients" (PDF). Breast Cancer Res. Treat. 82 (2): 103–11. doi:10.1023/B:BREA.0000003957.54851.11. hdl:2027.42/44217. PMID 14692654. S2CID 207694212.
- ^ Tsourdi E, Kourtis A, Farmakiotis D, Katsikis I, Salmas M, Panidis D (April 2009). "The effect of selective estrogen receptor modulator administration on the hypothalamic-pituitary-testicular axis in men with idiopathic oligozoospermia". Fertil. Steril. 91 (4 Suppl): 1427–30. doi:10.1016/j.fertnstert.2008.06.002. PMID 18692782.
- ^ Roelfsema F, Yang RJ, Takahashi PY, Erickson D, Bowers CY, Veldhuis JD (February 2018). "Effects of Toremifene, a Selective Estrogen Receptor Modulator, on Spontaneous and Stimulated GH Secretion, IGF-I, and IGF-Binding Proteins in Healthy Elderly Subjects". Journal of the Endocrine Society. 2 (2): 154–165. doi:10.1210/js.2017-00457. PMC 5789038. PMID 29383334.
- ^ Ariazi EA, Jordan VC (2006). "Estrogen-related receptors as emerging targets in cancer and metabolic disorders". Curr Top Med Chem. 6 (3): 203–15. doi:10.2174/1568026610606030203. PMID 16515477.
- ^ a b c Gennari L, Merlotti D, Stolakis K, Nuti R (April 2012). "Pharmacokinetic evaluation of toremifene and its clinical implications for the treatment of osteoporosis". Expert Opin Drug Metab Toxicol. 8 (4): 505–13. doi:10.1517/17425255.2012.665873. PMID 22356442. S2CID 19547631.
- ^ Anttila M, Valavaara R, Kivinen S, Mäenpää J (June 1990). "Pharmacokinetics of toremifene". J Steroid Biochem. 36 (3): 249–52. doi:10.1016/0022-4731(90)90019-o. PMID 2142247.
- ^ George M. Brenner; Craig Stevens (28 September 2017). Brenner and Stevens' Pharmacology E-Book. Elsevier Health Sciences. pp. 394–. ISBN 978-0-323-39172-6.
- ^ Georg F. Weber (22 July 2015). Molecular Therapies of Cancer. Springer. pp. 304–. ISBN 978-3-319-13278-5.
- ^ Philipp Y. Maximov; Russell E. McDaniel; V. Craig Jordan (23 July 2013). Tamoxifen: Pioneering Medicine in Breast Cancer. Springer Science & Business Media. pp. 170–. ISBN 978-3-0348-0664-0.
- ^ J. Elks (14 November 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. pp. 1222–. ISBN 978-1-4757-2085-3.
- ^ a b c Index Nominum 2000: International Drug Directory. Taylor & Francis. 2000. pp. 1048–. ISBN 978-3-88763-075-1.
- ^ I.K. Morton; Judith M. Hall (6 December 2012). Concise Dictionary of Pharmacological Agents: Properties and Synonyms. Springer Science & Business Media. pp. 277–. ISBN 978-94-011-4439-1.
- ^ a b c "Toremifene - Drugs.com". Drugs.com. Retrieved 2018-02-08.
- ^ Price N, Sartor O, Hutson T, Mariani S (2005). "Role of 5a-reductase inhibitors and selective estrogen receptor modulators as potential chemopreventive agents for prostate cancer". Clin Prostate Cancer. 3 (4): 211–4. doi:10.1016/s1540-0352(11)70089-0. PMID 15882476.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ "GTx's Phase III Clinical Development of ACAPODENE on Course Following Planned Safety Review" (Press release). GTx Inc. 2007-07-12. Retrieved 2006-07-14.
- ^ "GTx Announces Toremifene 80 mg NDA Accepted for Review by FDA" (Press release).
- ^ "GTx and Ipsen End Prostate Cancer Collaboration due to Costs of FDA-Requested Phase III Study". 2 Mar 2011.
- ^ "Toremifene - AdisInsight". adisinsight.springer.com. Retrieved 2018-02-08.
- ^ 톰슨 주니어, I.M., 리치, R., 전립선암과 전립선 상피내 종양: 사실, 사실, 그리고 무관한가요?J Clin Oncol, 2013; 31:515-6. https://ascopubs.org/doi/full/10.1200/JCO.2012.46.6151 = 2019년 7월 31일 취득
- ^ J.R.의 3년 전 임상시험에 등록된 고등급 상피내 신생물 분리 남성 중 타네자, S. S., M., 시버, P., 핸콕, M. 및 스타이너, M. 전립선암 진단.2019년 7월
- ^ Raghow, S., Hooshdaran, M. Z., Katiyar, S. 및 Steiner, M. S. Toremifene은 생쥐 전립선 모델의 트랜스제닉 선암에서 전립선암을 예방합니다.암 연구 2002; 62:1370-6.http://cancerres.aacrjournals.org/content/62/5/1370= 2019년 7월 31일 취득
추가 정보
- Taras TL, Wurz GT, Linares GR, DeGregorio MW (2000). "Clinical pharmacokinetics of toremifene". Clin Pharmacokinet. 39 (5): 327–34. doi:10.2165/00003088-200039050-00002. PMID 11108432. S2CID 26647296.
- Harvey HA, Kimura M, Hajba A (2006). "Toremifene: an evaluation of its safety profile". Breast. 15 (2): 142–57. doi:10.1016/j.breast.2005.09.007. PMID 16289904.
- Taneja SS, Smith MR, Dalton JT, Raghow S, Barnette G, Steiner M, Veverka KA (2006). "Toremifene--a promising therapy for the prevention of prostate cancer and complications of androgen deprivation therapy". Expert Opin Investig Drugs. 15 (3): 293–305. doi:10.1517/13543784.15.3.293. PMID 16503765. S2CID 29510508.
- Zhou WB, Ding Q, Chen L, Liu XA, Wang S (2011). "Toremifene is an effective and safe alternative to tamoxifen in adjuvant endocrine therapy for breast cancer: results of four randomized trials". Breast Cancer Res. Treat. 128 (3): 625–31. doi:10.1007/s10549-011-1556-5. PMID 21553116. S2CID 36985808.
- Gennari L, Merlotti D, Stolakis K, Nuti R (2012). "Pharmacokinetic evaluation of toremifene and its clinical implications for the treatment of osteoporosis". Expert Opin Drug Metab Toxicol. 8 (4): 505–13. doi:10.1517/17425255.2012.665873. PMID 22356442. S2CID 19547631.
- Mao C, Yang ZY, He BF, Liu S, Zhou JH, Luo RC, Chen Q, Tang JL (2012). "Toremifene versus tamoxifen for advanced breast cancer". Cochrane Database Syst Rev. 2021 (7): CD008926. doi:10.1002/14651858.CD008926.pub2. PMC 8407374. PMID 22786516.
- Vogel CL, Johnston MA, Capers C, Braccia D (2014). "Toremifene for breast cancer: a review of 20 years of data". Clin. Breast Cancer. 14 (1): 1–9. doi:10.1016/j.clbc.2013.10.014. PMID 24439786.
- Mustonen MV, Pyrhönen S, Kellokumpu-Lehtinen PL (2014). "Toremifene in the treatment of breast cancer". World J Clin Oncol. 5 (3): 393–405. doi:10.5306/wjco.v5.i3.393. PMC 4127610. PMID 25114854.


