지베렐린
Gibberellin이 기사에는 특정 사용자만 관심을 가질 수 있는 지나치게 복잡한 세부 정보가 포함될 수 있습니다.(2019년 9월 (이 및 ) |
지베렐린(GAs)은 줄기의 신장, 발아, 휴면, 개화, 꽃의 발달, 잎과 과일의 [1]노화를 포함한 다양한 발달 과정을 조절하는 식물 호르몬이다.GA는 식물 호르몬의 가장 오래된 종류 중 하나이다.GA 합성이 부족했던 작물 품종의 선택적 사육(비록 무의식적)이 1960년대 [2]녹색 혁명의 주요 원동력 중 하나였다고 생각된다.녹색 혁명은 [3]전 세계적으로 10억 명 이상의 생명을 구했다고 여겨진다.
역사
GAs에 대한 이해의 첫 번째 진출은 식물병리학 분야에서의 발전으로 쌀의 "바카나에" 즉, 바보 같은 모종병에 대한 연구를 통해 이루어졌다.미련한 모종병은 벼 줄기와 잎의 강한 연장을 유발하고 결국 쓰러지게 [4]한다.1926년, 일본의 과학자인 Eiichi Kurosawa는 바보 같은 묘목병이 Gibberella fujikuroi [4]균에 의해 발생한다는 것을 밝혀냈다.도쿄 대학의 연구 결과, 이 곰팡이에 의해 생성된 물질이 어리석은 모종병의 증상을 유발한다는 것이 밝혀졌고, 그들은 이 물질을 "기베렐린"[1][4]이라고 명명했다.
일본과 서양의 세계 대전 이후 증가한 통신과 임페리얼 화학 공업에서 UK[5]과 농무부 미국에서 미국(미국)[1]노동자들은 둘 다 독립적으로gibberellic acid[4]고립된(미국인들과 원래 r. 지베렐린의 영국(영국)에 대한 관심을 높였다eferringgibberellin-X라는 화학 약품을 영국식 명칭으로 사용하기 전에는 gibberellin3 A 또는3 GA로 알려져 있습니다.)[1]
지베렐린에 대한 지식은 상업적으로 중요한 다양한 식물에 사용될 가능성이 더욱 분명해지면서 전 세계로 퍼져나갔다.예를 들어, 1960년대 중반 캘리포니아 대학 데이비스에서 시작된 연구는 [6][clarification needed]1962년까지 캘리포니아 전역에서 톰슨 씨 없는 식탁용 포도를 상업적으로 사용하도록 이끌었다.알려진 지베렐린 생합성 억제제는 파클로부트라졸(PBZ)이며, 파클로부트라졸은 성장을 억제하고 초기 과일세트 및 시드세트를 유도한다.
만성적인 식량 부족은 1960년대 세계 인구의 급격한 증가 동안 우려되었다.이것은 고수익 품종의 쌀의 개발로 피할 수 있었다.이 반왜곡 쌀의 종류는 IR8이라고 불리며, sd1 [7]유전자의 돌연변이 때문에 키가 짧습니다.Sd1은 GA20ox를 부호화하므로 돌연변이 sd1은 GA [2]결핍과 일치하는 짧은 높이를 나타낼 것으로 예상된다.
화학
알려진 모든 지베렐린은 디터페노이드산으로 플라스틱의 테르페노이드 경로에 의해 합성된 후 생물학적 활성 [8]형태에 도달할 때까지 소포체 및 세포질에서 변형된다.모든 지베렐린은 ent-gibberellane 골격을 통해 유도되지만 ent-kaurene을 통해 합성된다.지베렐린은 발견 순서대로 GA에서n GA로1 명명됩니다.[9]GA는 구조상 최초로 지베렐린인 지베렐린이다3.[10]
2020년 [9]현재[update] 식물, 곰팡이,[1][10][9] 박테리아에서 확인된 GA는 136개이다.
지베렐린은 사환식 디테르펜산이다.19탄소와 20탄소의 유무에 따라 두 가지 클래스가 있습니다.지베렐린과 같은 19개 탄소 지베렐린은 탄소 20개를 잃었고, 그 자리에 탄소 4와 10을 연결하는 5개 멤버의 락톤 브릿지가 있다.19-탄소 형태는 일반적으로 생물학적 활성 지베렐린 형태입니다.히드록실화는 또한 지베렐린의 생물학적 활성에도 큰 영향을 미친다.일반적으로 생물학적으로 가장 활성화된 화합물은 디히드록실화 지베렐린으로 탄소3과 탄소13에 모두 수산기를 가지고 있다.지베렐산은 디히드록실화 지베렐린이다.[11]
생물 활성 GA
생체활성 GA는 GA, GA34, GA 및7 [12]GA입니다1.이러한 GA들 사이에는 세 가지 공통된 구조적 특성이 있다: C-3β의 히드록실기, C-6의 카르복실기, [12]C-4와 C-10 사이의 락톤.3β-히드록실기는 C-2 [12]및/또는 C-3 위치에서 다른 관능기와 교환될 수 있다.GA와56 GA는 C-3β에 [12]수산기가 없는 생물 활성 GA의 예이다.다양한 식물 종에서 GA의 존재는1 GA가 일반적인 생물 활성 [13]GA임을 시사한다.
- 지베렐산(GA3)
생물학적 기능
지베렐린은 휴면기를 깨는 자연 과정과 발아의 다른 측면에 관여한다.발아 초기에 광합성 장치가 충분히 발달하기 전에 녹말의 저장된 에너지 비축량이 묘목을 키운다.보통 발아 시, 씨앗이 [14]물에 노출된 직후에 배에서 전분이 포도당으로 분해되기 시작합니다.종자배아의 지베렐린은 알류론세포의 효소α-아밀라아제 합성을 유도함으로써 전분 가수분해를 신호화하는 것으로 여겨진다.α-아밀라아제 지베렐린 유도 생성 모델에서는 스쿠텔룸에서 생성된 지베렐린(GA로 표시)이 알류론 세포로 확산되어 분비물 α-아밀라아제를 [8]자극하는 것이 확인되었다.그리고 나서 α-아밀라아제는 많은 씨앗에 풍부한 전분을 포도당으로 가수분해하여 세포 호흡에 사용될 수 있고, 씨앗 배아를 위한 에너지를 생산한다.이 과정의 연구는 지베렐린이 α-아밀라아제 [11]효소를 코드하는 유전자의 더 높은 수준의 전사를 유발하여 α-아밀라아제 합성을 자극하는 것으로 나타났다.
지베렐린은 식물이 추운 온도에 노출될 때 더 많이 생산된다.그것들은 세포의 신장, 부서지고 싹트기, 씨앗이 없는 열매, 그리고 씨앗 발아를 자극합니다.지베렐린은 씨앗의 휴면기를 깨고 화학적 전달자 역할을 함으로써 씨앗 발아를 일으킨다.이 호르몬은 수용체에 결합하고 칼슘은 단백질 칼모듈린을 활성화하고 복합체는 DNA에 결합해 배아의 성장을 촉진하는 효소를 생성한다.
대사
생합성
GA는 보통 고등 식물의 [15]메틸에리톨인산(MEP) 경로에서 합성된다.이 경로에서 트랜스게라닐게라닐이인산(GGDP)[15]으로부터 생체활성 GA가 생성된다.MEP 경로에서 GGDP로부터 GA를 생성하기 위해 테르펜 합성(TPS), 시토크롬 P450 모노옥시게나아제(P450s) 및 2-옥소글루타르산 의존성 디옥시게나아제(2ODDS)[12]의 세 가지 종류의 효소가 사용된다.MEP [12]패스에는 8개의 스텝이 있습니다.
- GGDP는 엔트코팔릴이인산합성효소에 의해 엔트코팔릴이인산(ent-CPD)으로 변환된다.
- ent-CDP는 ent-kaurene 합성효소에 의해 ent-kaurene으로 변환된다
- 엔트카우렌은 엔트카우렌산화효소(KO)에 의해 엔트카우레놀로 변환된다.
- KO에 의해 ent-kaurenol이 ent-kaurenal로 변환된다.
- 엔트카우레날은 KO에 의해 엔트카우레노산으로 변환된다
- 엔트카우레노산은 엔트카우레네산산화효소(KAO)에 의해 엔트-7a-히드록시카우레노산으로 변환된다.
- KAO에 의해 ent-7a-히드록시카우레노산이 GA12-알데히드로 변환되는
- GA12-알데히드는 KAO에 의해 GA12로 변환된다.GA12는 C-20 및 C-3의 산화에 의해 생체활성 GA4로 처리되며, GA20-옥시다아제 및 GA3-옥시다아제 2개의 가용성 ODD로 이루어진다.
하나 또는 두 개의 유전자는 아라비도시스와 [12]쌀에서 GA 생합성의 첫 단계를 담당하는 효소를 코드한다.CPS, KS, KO를 코드하는 유전자의 눌 대립 유전자는 GA 결핍 아라비도시스 난쟁이를 [16]낳는다.멀티젠 계열은 GA의 형성을12 생체활성 [12]GA로4 촉매하는 2ODD를 부호화한다.
Arabidopsis에서 GA3ox를 코드하는 4개의 유전자 중 2개인 AtGA3ox1과 AtGA3ox2는 식물 [17]발달에 영향을 미친다.환경 자극은 씨앗 [18][19]발아 중 AtGA3ox1과 AtGA3ox2의 활성을 조절한다.아라비도시스에서는 GA20ox 과발현이 GA 농도의 [20][21]증가로 이어진다.
생합성 부위
대부분의 생물 활성 GA는 [15]식물에서 활발하게 성장하는 장기에 위치합니다.GA20ox 및 GA3ox 유전자(GA20-옥시다아제 및 GA3-옥시다아제를 코드하는 유전자)와 LINLER1 유전자(GA신호전달유전자)는 모두 쌀의 성장기관에서 발견되며,[22] 이는 생물활성 GA 합성이 식물의 성장기관에서 작용 부위에서 발생함을 시사한다.꽃이 발달하는 동안, 꽃꽂이의 태페툼은 GA [22][23]생합성의 주요 부위로 여겨진다.
균류와 하등식물의 생합성 차이
식물인 Arabidopsis와 균류인 Gibberella fujikuroi는 GA 경로와 효소가 [12]다르다.곰팡이의 P450은 식물의 [24]KAO 기능과 유사한 기능을 수행합니다.식물에서 CPS와 KS의 기능은 [25][26][27]균류에서 CPS/KS라는 단일 효소에 의해 수행된다.균류에서 GA 생합성 유전자는 하나의 염색체에서 발견되지만 식물에서는 여러 [28][29]염색체에서 무작위로 발견됩니다.식물은 적은 양의 GA를3 생산하기 때문에 GA는3 미생물에 의해 산업 목적으로 생산된다.공업적으로 지베렐산은 수중발효에 의해 제조될 수 있지만, 이 공정은 높은 생산비용과 높은 판매가치로 낮은 수율을 나타낸다.그러나 GA 생산비용을3 절감하기 위한 다른 대체 공정은 농업용 [30]잔류물을 사용할 수 있는 고체발효(SSF)이다.
이화 작용
GA를 비활성화하는 몇 가지 메커니즘이 확인되었다.2β-히드록실화는 GA를 비활성화하고 GA2-옥시다아제(GA2ox)[15]에 의해 촉매된다.기판으로서 C19-GA를 사용하는 GA2ox도 있고, C20-GA를 사용하는 [31][32]GA2ox도 있습니다.시토크롬 P450 모노산소화효소는 길쭉한 최상층 인터노드(의)에 의해 코드되며, GAs를 16α,17-에폭시드로 [33]변환한다.쌀 돌연변이는 높은 수준의 생체 활성 GA를 축적하는데, 이는 시토크롬 P450 모노 산소화효소가 [33]쌀에서 GA를 비활성화하는 주요 효소임을 시사한다.Gamt1 및 Gamt2 유전자는 GA의 [34]C-6 카르복실기를 메틸화하는 효소를 코드한다.gamt1 및 gamt2 돌연변이는 GA의 농도를 [34]증가시킨다.
항상성
피드백과 피드포워드 규제는 [35][36]발전소에서 생물 활성 GA의 수준을 유지한다.GA 결핍 환경에서 AtGA20ox1 및 AtGA3ox1 발현을 증가시키고, 생물활성 GA 첨가 [18][37][38][39][40]후 GA 첨가 [31]시 AtGA2ox1 및 AtGA2ox2의 발현을 증가시킨다.
규정
다른 호르몬에 의한 조절
옥신인돌-3-아세트산(IAA)은 [41]완두콩의 신장 인터노드에서 GA 농도를1 조절한다.옥신원인 첨두의 제거에 의한 IAA의 제거는 GA의1 농도를 감소시키고, IAA의 재도입은 이러한 효과를 역전시켜 [41]GA의1 농도를 증가시킨다.이 현상은 담배 [42]식물에서도 관찰되고 있다.옥신은 [43]보리의 GA3-산화를 증가시키고 GA2-산화를 감소시킨다.옥신은 또한 [44]완두콩에서 과일이 발달하는 동안 GA 생합성을 조절합니다.다른 식물 종에서 이러한 발견들은 GA 대사의 옥신 조절이 보편적인 메커니즘일 수 있다는 것을 암시한다.
에틸렌은 생물 활성 GA의 [45]농도를 낮춥니다.
환경 요인에 의한 규제
최근의 증거는 GA 농도의 변동이 광조절 종자 발아, 탈이탈 중 광형성, 줄기 신장 및 [12]개화의 광조작 조절에 영향을 미친다는 것을 시사한다.마이크로어레이 분석 결과, 약 4분의 1의 저온 반응 유전자가 GA 조절 유전자와 관련이 있는 것으로 나타났는데, 이는 GA가 저온에 [19]대한 반응에 영향을 미친다는 것을 암시한다.식물은 스트레스에 노출되면 성장률을 떨어뜨린다.GA 수치와 경험하는 스트레스 양 사이의 관계는 [46]보리에서 제안되었다.
시드 개발에서의 역할
생체활성 GAs와 아브시스산 수치는 반비례 관계를 가지며 종자의 발달과 [47][48]발아를 조절한다.아라비도시스 전사인자 FUS3의 수치는 ABA에 의해 상향 조절되고 GA에 의해 하향 조절되며, 이는 GA와 [49]ABA의 균형을 형성하는 조절 루프가 있음을 시사한다.
시그널링
리셉터
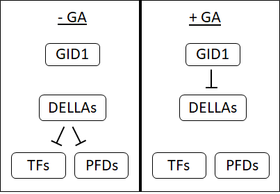
1990년대 초, 혈장 막에 위치한 귀리 씨앗에서 GA 수용체의 존재를 시사하는 여러 가지 증거가 있었다.그러나, 집중적인 연구에도 불구하고, 현재까지 막 결합 GA 수용체는 분리되지 않았다.이것은 수용성 수용체의 발견과 함께, GA 무감각 왜소 1(GID1)은 많은 사람들로 하여금 막 [1]결합 수용체가 존재하는지 의심하게 만들었다.
GID1은 쌀에서 처음[50] 확인되었으며, Arabidopsis에서는 GID1, AtGID1a, b 및 [1]c의 3가지 직교체가 있다. GID1은 생물활성 GA에 [50]대한 친화력이 높다. GID1의 특정 결합 포켓에 GA의 C3-hydroxyl이 [51][52]GID1의 결합 포켓에 접촉한다.GID1에 대한 GA 바인딩은 GID1 구조의 변화를 유발하여 GID1의 '리드'가 GA 바인딩 포켓을 덮게 합니다.이 뚜껑의 이동으로 인해 표면이 노출되어 GID1이 DELLA [51][52]단백질에 결합할 수 있습니다.
DELLA 단백질:억압자 억압
쌀의 SLR1이나 GAI, Arabidopsis의 RGA와 같은 DELL 단백질은 식물 발육을 억제한다.DELL은 씨앗의 발아, 씨앗의 성장, 개화를 억제하고 GA는 이러한 [53]효과를 반전시킵니다.DELLA 단백질은 DELLA 모티브(아스파르트산-글루탐산-류신-알라닌 또는 D-E-L-L-A)[54]의 존재로 특징지어진다.
GA가 GID1 수용체에 결합할 때, GID1과 DELLA 단백질 사이의 상호작용을 강화하여 GA-GID1-DELLA 복합체를 형성한다.GA-GID1-DELLA 복합체에서는 DELLA 단백질이 F박스 단백질에 결합할 수 있는 구조변화를 겪는 것으로 생각된다(아라비도시스의 SLY1 또는 [55][54][56]쌀의 GID2).F-box 단백질은 표적에 유비퀴틴의 첨가를 촉매한다.[55]DELLA 단백질에 유비퀴틴의 첨가는 26S-단백질을 [54]통해 단백질의 분해를 촉진한다.DELLA 단백질의 분해는 세포를 억제 효과로부터 해방시킨다.
DELLA 단백질의 표적
전사 계수
식별된 DELLA 단백질의 첫 번째 표적은 PHYTOCHROME Interacting Factors(PIF)였다.PIF는 빛의 신호 전달을 부정적으로 조절하는 전사 인자이며 신장 성장을 촉진하는 강력한 요인입니다.GA의 존재하에서는 DELLA가 분해되어 PIF가 [57]신장을 촉진할 수 있다.나중에 DELLA는 옥신, 브라시노스테로이드 및 에틸렌 [58][59]시그널링의 양성 조절 인자를 포함한 많은 다른 전사 인자를 억제한다는 것이 밝혀졌다.DELL은 DNA에 대한 결합을 멈추거나 [57]분해를 촉진함으로써 전사 인자를 억제할 수 있다.
프리폴딘 및 마이크로튜브 어셈블리
전사 인자를 억제하는 것 외에 DELLA는 프리폴딘(PFD)에도 결합합니다.PFD는 다른 단백질의 접힘을 돕는 분자 샤페론이다.PFD는 세포질에서 기능하지만 DELLA가 PFD에 결합하면 핵으로 제한된다.PFD의 중요한 기능은 β-튜브린의 접힘을 돕는 것이다.이와 같이 GA가 없는 경우(DELA 단백질이 높은 경우), PDF 기능이 저하되어 β-튜브린의 세포 풀이 낮아진다.GA가 존재할 때 DELLA가 분해되면 PDF가 세포질로 이동하여 β-튜브린의 접힘을 도울 수 있다.β-튜브린은 세포골격의 중요한 구성요소이다(미소관의 형태).이와 같이 GA는 세포골격의 재조직화와 [60]세포의 신장을 가능하게 한다.
또한 막 소포의 운반을 위해 미세관도 필요하다.여러 호르몬 운반체의 정확한 위치를 위해 막 소포 밀매가 필요하다.가장 잘 특징지어지는 호르몬 전달체 중 하나는 PIN 단백질로, 세포들 사이에서 호르몬 옥신이 움직이는 것을 담당합니다.GA가 없을 때 DELLA 단백질은 미소관의 수준을 감소시켜 막 소포트래픽을 억제한다.이것은 세포막에서의 PIN 단백질의 수치와 세포 내의 옥신 수치를 감소시킨다.GA는 이 과정을 역전시키고 세포막으로 PIN 단백질 전달을 허용하여 세포 [61]내 옥신 수준을 향상시킵니다.
레퍼런스
- ^ a b c d e f g Hedden P, Sponsel V (2015). "A Century of Gibberellin Research". Journal of Plant Growth Regulation. 34 (4): 740–60. doi:10.1007/s00344-015-9546-1. PMC 4622167. PMID 26523085.
- ^ a b Spielmeyer W, Ellis MH, Chandler PM (June 2002). "Semidwarf (sd-1), "green revolution" rice, contains a defective gibberellin 20-oxidase gene". Proceedings of the National Academy of Sciences of the United States of America. 99 (13): 9043–8. Bibcode:2002PNAS...99.9043S. doi:10.1073/pnas.132266399. PMC 124420. PMID 12077303.
- ^ "Norman Borlaug: A Billion Lives Saved". www.agbioworld.org. Retrieved 2018-05-11.
- ^ a b c d B B Stowe; Yamaki, and T. (1957). "The History and Physiological Action of the Gibberellins". Annual Review of Plant Physiology. 8 (1): 181–216. doi:10.1146/annurev.pp.08.060157.001145.
- ^ Mees, G.C.; Elson, G.W. (1978). "Chapter 7: The gibberellins". In Peacock, F.C. (ed.). Jealott's Hill: Fifty years of Agricultural Research 1928-1978. Imperial Chemical Industries Ltd. pp. 55–60. ISBN 0901747017.
- ^ Gibberellin and Flame Seedless Graps 2006-12-06년 데이비스 캘리포니아 대학의 Wayback Machine에서 아카이브
- ^ Sasaki A, Ashikari M, Ueguchi-Tanaka M, Itoh H, Nishimura A, Swapan D, Ishiyama K, Saito T, Kobayashi M, Khush GS, Kitano H, Matsuoka M (April 2002). "Green revolution: a mutant gibberellin-synthesis gene in rice". Nature. 416 (6882): 701–2. Bibcode:2002Natur.416..701S. doi:10.1038/416701a. PMID 11961544. S2CID 4414560.
- ^ a b Campbell N, Reec JB (2002). Biology (6th ed.). San Francisco: Benjamin Cummings. ISBN 9780805366242.
- ^ a b c Sponsel, Valerie M.; Hedden, Peter (2010), Davies, Peter J. (ed.), "Gibberellin Biosynthesis and Inactivation", Plant Hormones, Dordrecht: Springer Netherlands, pp. 63–94, doi:10.1007/978-1-4020-2686-7_4, ISBN 978-1-4020-2684-3, retrieved 2022-01-29
- ^ a b Hedden, Peter (2020-11-23). "The Current Status of Research on Gibberellin Biosynthesis". Plant and Cell Physiology. 61 (11): 1832–1849. doi:10.1093/pcp/pcaa092. ISSN 1471-9053. PMC 7758035. PMID 32652020.
- ^ a b "Gibberellins". AccessScience. doi:10.1036/1097-8542.289000.
- ^ a b c d e f g h i j Yamaguchi S (2008). "Gibberellin metabolism and its regulation". Annual Review of Plant Biology. 59: 225–51. doi:10.1146/annurev.arplant.59.032607.092804. PMID 18173378.
- ^ MacMillan J (December 2001). "Occurrence of Gibberellins in Vascular Plants, Fungi, and Bacteria". Journal of Plant Growth Regulation. 20 (4): 387–442. doi:10.1007/s003440010038. PMID 11986764. S2CID 44504525.
- ^ Davies PJ. "Plant growth". AccessScience. doi:10.1036/1097-8542.523000.
- ^ a b c d Hedden P, Thomas SG (May 2012). "Gibberellin biosynthesis and its regulation". The Biochemical Journal. 444 (1): 11–25. doi:10.1042/BJ20120245. PMID 22533671. S2CID 25627726.
- ^ Koornneef M, van der Veen JH (November 1980). "Induction and analysis of gibberellin sensitive mutants in Arabidopsis thaliana (L.) heynh". TAG. Theoretical and Applied Genetics. Theoretische und Angewandte Genetik. 58 (6): 257–63. doi:10.1007/BF00265176. PMID 24301503. S2CID 22824299.
- ^ Mitchum MG, Yamaguchi S, Hanada A, Kuwahara A, Yoshioka Y, Kato T, Tabata S, Kamiya Y, Sun TP (March 2006). "Distinct and overlapping roles of two gibberellin 3-oxidases in Arabidopsis development". The Plant Journal. 45 (5): 804–18. doi:10.1111/j.1365-313X.2005.02642.x. PMID 16460513.
- ^ a b Yamaguchi S, Smith MW, Brown RG, Kamiya Y, Sun T (December 1998). "Phytochrome regulation and differential expression of gibberellin 3beta-hydroxylase genes in germinating Arabidopsis seeds". The Plant Cell. 10 (12): 2115–26. doi:10.1105/tpc.10.12.2115. PMC 143973. PMID 9836749.
- ^ a b Yamauchi Y, Ogawa M, Kuwahara A, Hanada A, Kamiya Y, Yamaguchi S (February 2004). "Activation of gibberellin biosynthesis and response pathways by low temperature during imbibition of Arabidopsis thaliana seeds". The Plant Cell. 16 (2): 367–78. doi:10.1105/tpc.018143. PMC 341910. PMID 14729916.
- ^ Coles JP, Phillips AL, Croker SJ, García-Lepe R, Lewis MJ, Hedden P (March 1999). "Modification of gibberellin production and plant development in Arabidopsis by sense and antisense expression of gibberellin 20-oxidase genes". The Plant Journal. 17 (5): 547–56. doi:10.1046/j.1365-313X.1999.00410.x. PMID 10205907.
- ^ Huang S, Raman AS, Ream JE, Fujiwara H, Cerny RE, Brown SM (November 1998). "Overexpression of 20-oxidase confers a gibberellin-overproduction phenotype in Arabidopsis". Plant Physiology. 118 (3): 773–81. doi:10.1104/pp.118.3.773. PMC 34787. PMID 9808721.
- ^ a b Kaneko M, Itoh H, Inukai Y, Sakamoto T, Ueguchi-Tanaka M, Ashikari M, Matsuoka M (July 2003). "Where do gibberellin biosynthesis and gibberellin signaling occur in rice plants?". The Plant Journal. 35 (1): 104–15. doi:10.1046/j.1365-313X.2003.01780.x. PMID 12834406.
- ^ Itoh H, Tanaka-Ueguchi M, Kawaide H, Chen X, Kamiya Y, Matsuoka M (October 1999). "The gene encoding tobacco gibberellin 3beta-hydroxylase is expressed at the site of GA action during stem elongation and flower organ development". The Plant Journal. 20 (1): 15–24. doi:10.1046/j.1365-313X.1999.00568.x. PMID 10571861.
- ^ Rojas MC, Hedden P, Gaskin P, Tudzynski B (May 2001). "The P450-1 gene of Gibberella fujikuroi encodes a multifunctional enzyme in gibberellin biosynthesis". Proceedings of the National Academy of Sciences of the United States of America. 98 (10): 5838–43. Bibcode:2001PNAS...98.5838R. doi:10.1073/pnas.091096298. PMC 33300. PMID 11320210.
- ^ Kawaide H, Imai R, Sassa T, Kamiya Y (August 1997). "Ent-kaurene synthase from the fungus Phaeosphaeria sp. L487. cDNA isolation, characterization, and bacterial expression of a bifunctional diterpene cyclase in fungal gibberellin biosynthesis". The Journal of Biological Chemistry. 272 (35): 21706–12. doi:10.1074/jbc.272.35.21706. PMID 9268298.
- ^ Toyomasu T, Kawaide H, Ishizaki A, Shinoda S, Otsuka M, Mitsuhashi W, Sassa T (March 2000). "Cloning of a full-length cDNA encoding ent-kaurene synthase from Gibberella fujikuroi: functional analysis of a bifunctional diterpene cyclase". Bioscience, Biotechnology, and Biochemistry. 64 (3): 660–4. doi:10.1271/bbb.64.660. PMID 10803977.
- ^ Tudzynski B, Kawaide H, Kamiya Y (September 1998). "Gibberellin biosynthesis in Gibberella fujikuroi: cloning and characterization of the copalyl diphosphate synthase gene". Current Genetics. 34 (3): 234–40. doi:10.1007/s002940050392. PMID 9745028. S2CID 3021994.
- ^ Hedden P, Phillips AL, Rojas MC, Carrera E, Tudzynski B (December 2001). "Gibberellin Biosynthesis in Plants and Fungi: A Case of Convergent Evolution?". Journal of Plant Growth Regulation. 20 (4): 319–331. doi:10.1007/s003440010037. PMID 11986758. S2CID 25623658.
- ^ Kawaide H (March 2006). "Biochemical and molecular analyses of gibberellin biosynthesis in fungi". Bioscience, Biotechnology, and Biochemistry. 70 (3): 583–90. doi:10.1271/bbb.70.583. PMID 16556972. S2CID 20952424.
- ^ Lopes AL, Silva DN, Rodrigues C, Costa JL, Machado MP, Penha RO, Biasi LA, Ricardo C (2013). "Gibberellic acid fermented extract obtained by solid-state fermentation using citric pulp by Fusarium moniliforme: Influence on Lavandula angustifolia Mill. cultivated in vitro". Pak J Bot. 45: 2057–2064.
- ^ a b Thomas SG, Phillips AL, Hedden P (April 1999). "Molecular cloning and functional expression of gibberellin 2- oxidases, multifunctional enzymes involved in gibberellin deactivation". Proceedings of the National Academy of Sciences of the United States of America. 96 (8): 4698–703. Bibcode:1999PNAS...96.4698T. doi:10.1073/pnas.96.8.4698. PMC 16395. PMID 10200325.
- ^ Schomburg FM, Bizzell CM, Lee DJ, Zeevaart JA, Amasino RM (January 2003). "Overexpression of a novel class of gibberellin 2-oxidases decreases gibberellin levels and creates dwarf plants". The Plant Cell. 15 (1): 151–63. doi:10.1105/tpc.005975. PMC 143488. PMID 12509528.
- ^ a b Zhu Y, Nomura T, Xu Y, Zhang Y, Peng Y, Mao B, Hanada A, Zhou H, Wang R, Li P, Zhu X, Mander LN, Kamiya Y, Yamaguchi S, He Z (February 2006). "ELONGATED UPPERMOST INTERNODE encodes a cytochrome P450 monooxygenase that epoxidizes gibberellins in a novel deactivation reaction in rice". The Plant Cell. 18 (2): 442–56. doi:10.1105/tpc.105.038455. PMC 1356550. PMID 16399803.
- ^ a b Varbanova M, Yamaguchi S, Yang Y, McKelvey K, Hanada A, Borochov R, Yu F, Jikumaru Y, Ross J, Cortes D, Ma CJ, Noel JP, Mander L, Shulaev V, Kamiya Y, Rodermel S, Weiss D, Pichersky E (January 2007). "Methylation of gibberellins by Arabidopsis GAMT1 and GAMT2". The Plant Cell. 19 (1): 32–45. doi:10.1105/tpc.106.044602. PMC 1820973. PMID 17220201.
- ^ Hedden P, Phillips AL (December 2000). "Gibberellin metabolism: new insights revealed by the genes". Trends in Plant Science. 5 (12): 523–30. doi:10.1016/S1360-1385(00)01790-8. PMID 11120474.
- ^ Olszewski N, Sun TP, Gubler F (2002). "Gibberellin signaling: biosynthesis, catabolism, and response pathways". The Plant Cell. 14 Suppl (Suppl): S61–80. doi:10.1105/tpc.010476. PMC 151248. PMID 12045270.
- ^ Chiang HH, Hwang I, Goodman HM (February 1995). "Isolation of the Arabidopsis GA4 locus". The Plant Cell. 7 (2): 195–201. doi:10.1105/tpc.7.2.195. PMC 160775. PMID 7756830.
- ^ Matsushita A, Furumoto T, Ishida S, Takahashi Y (March 2007). "AGF1, an AT-hook protein, is necessary for the negative feedback of AtGA3ox1 encoding GA 3-oxidase". Plant Physiology. 143 (3): 1152–62. doi:10.1104/pp.106.093542. PMC 1820926. PMID 17277098.
- ^ Phillips AL, Ward DA, Uknes S, Appleford NE, Lange T, Huttly AK, Gaskin P, Graebe JE, Hedden P (July 1995). "Isolation and expression of three gibberellin 20-oxidase cDNA clones from Arabidopsis". Plant Physiology. 108 (3): 1049–57. doi:10.1104/pp.108.3.1049. PMC 157456. PMID 7630935.
- ^ Xu YL, Li L, Gage DA, Zeevaart JA (May 1999). "Feedback regulation of GA5 expression and metabolic engineering of gibberellin levels in Arabidopsis". The Plant Cell. 11 (5): 927–36. doi:10.1105/tpc.11.5.927. PMC 144230. PMID 10330476.
- ^ a b Ross JJ, O'Neill DP, Smith JJ, Kerckhoffs LH, Elliott RC (March 2000). "Evidence that auxin promotes gibberellin A1 biosynthesis in pea". The Plant Journal. 21 (6): 547–52. doi:10.1046/j.1365-313x.2000.00702.x. PMID 10758505.
- ^ Wolbang CM, Ross JJ (November 2001). "Auxin promotes gibberellin biosynthesis in decapitated tobacco plants". Planta. 214 (1): 153–7. doi:10.1007/s004250100663. PMID 11762165. S2CID 31185063.
- ^ Wolbang CM, Chandler PM, Smith JJ, Ross JJ (February 2004). "Auxin from the developing inflorescence is required for the biosynthesis of active gibberellins in barley stems". Plant Physiology. 134 (2): 769–76. doi:10.1104/pp.103.030460. PMC 344552. PMID 14730077.
- ^ Ngo P, Ozga JA, Reinecke DM (July 2002). "Specificity of auxin regulation of gibberellin 20-oxidase gene expression in pea pericarp". Plant Molecular Biology. 49 (5): 439–48. doi:10.1023/A:1015522404586. PMID 12090620. S2CID 22530544.
- ^ Achard P, Baghour M, Chapple A, Hedden P, Van Der Straeten D, Genschik P, Moritz T, Harberd NP (April 2007). "The plant stress hormone ethylene controls floral transition via DELLA-dependent regulation of floral meristem-identity genes". Proceedings of the National Academy of Sciences of the United States of America. 104 (15): 6484–9. Bibcode:2007PNAS..104.6484A. doi:10.1073/pnas.0610717104. PMC 1851083. PMID 17389366.
- ^ Vettakkorumakankav NN, Falk D, Saxena P, Fletcher RA (1999). "A Crucial Role for Gibberellins in Stress Protection of Plants". Plant and Cell Physiology. 40 (5): 542–548. doi:10.1093/oxfordjournals.pcp.a029575.
- ^ Batge SL, Ross JJ, Reid JB (1999). "Abscisic acid levels in seeds of the gibberellin-deficient mutant lh-2 of pea (Pisum sativum)". Physiologia Plantarum. 195 (3): 485–490. doi:10.1034/j.1399-3054.1999.105313.x.
- ^ White CN, Proebsting WM, Hedden P, Rivin CJ (April 2000). "Gibberellins and seed development in maize. I. Evidence that gibberellin/abscisic acid balance governs germination versus maturation pathways". Plant Physiology. 122 (4): 1081–8. doi:10.1104/pp.122.4.1081. PMC 58942. PMID 10759503.
- ^ Gazzarrini S, Tsuchiya Y, Lumba S, Okamoto M, McCourt P (September 2004). "The transcription factor FUSCA3 controls developmental timing in Arabidopsis through the hormones gibberellin and abscisic acid". Developmental Cell. 7 (3): 373–85. doi:10.1016/j.devcel.2004.06.017. PMID 15363412.
- ^ a b Ueguchi-Tanaka M, Nakajima M, Katoh E, Ohmiya H, Asano K, Saji S, Hongyu X, Ashikari M, Kitano H, Yamaguchi I, Matsuoka M (July 2007). "Molecular interactions of a soluble gibberellin receptor, GID1, with a rice DELLA protein, SLR1, and gibberellin". The Plant Cell. 19 (7): 2140–55. doi:10.1105/tpc.106.043729. PMC 1955699. PMID 17644730.
- ^ a b Murase K, Hirano Y, Sun TP, Hakoshima T (November 2008). "Gibberellin-induced DELLA recognition by the gibberellin receptor GID1". Nature. 456 (7221): 459–63. Bibcode:2008Natur.456..459M. doi:10.1038/nature07519. PMID 19037309. S2CID 16280595.
- ^ a b Shimada A, Ueguchi-Tanaka M, Nakatsu T, Nakajima M, Naoe Y, Ohmiya H, Kato H, Matsuoka M (November 2008). "Structural basis for gibberellin recognition by its receptor GID1". Nature. 456 (7221): 520–3. Bibcode:2008Natur.456..520S. doi:10.1038/nature07546. PMID 19037316. S2CID 205215510.
- ^ Achard P, Genschik P (2009). "Releasing the brakes of plant growth: how GAs shutdown DELLA proteins". Journal of Experimental Botany. 60 (4): 1085–92. doi:10.1093/jxb/ern301. PMID 19043067.
- ^ a b c Davière JM, Achard P (March 2013). "Gibberellin signaling in plants". Development. 140 (6): 1147–51. doi:10.1242/dev.087650. PMID 23444347.
- ^ a b Lechner E, Achard P, Vansiri A, Potuschak T, Genschik P (December 2006). "F-box proteins everywhere". Current Opinion in Plant Biology. 9 (6): 631–8. doi:10.1016/j.pbi.2006.09.003. PMID 17005440.
- ^ McGinnis KM, Thomas SG, Soule JD, Strader LC, Zale JM, Sun TP, Steber CM (May 2003). "The Arabidopsis SLEEPY1 gene encodes a putative F-box subunit of an SCF E3 ubiquitin ligase". The Plant Cell. 15 (5): 1120–30. doi:10.1105/tpc.010827. PMC 153720. PMID 12724538.
- ^ a b Zheng Y, Gao Z, Zhu Z (October 2016). "DELLA-PIF Modules: Old Dogs Learn New Tricks". Trends in Plant Science. 21 (10): 813–815. doi:10.1016/j.tplants.2016.08.006. PMID 27569991.
- ^ Oh E, Zhu JY, Bai MY, Arenhart RA, Sun Y, Wang ZY (May 2014). "Cell elongation is regulated through a central circuit of interacting transcription factors in the Arabidopsis hypocotyl". eLife. 3. doi:10.7554/eLife.03031. PMC 4075450. PMID 24867218.
- ^ Marín-de la Rosa N, Sotillo B, Miskolczi P, Gibbs DJ, Vicente J, Carbonero P, Oñate-Sánchez L, Holdsworth MJ, Bhalerao R, Alabadí D, Blázquez MA (October 2014). "Large-scale identification of gibberellin-related transcription factors defines group VII ETHYLENE RESPONSE FACTORS as functional DELLA partners". Plant Physiology. 166 (2): 1022–32. doi:10.1104/pp.114.244723. PMC 4213073. PMID 25118255.
- ^ Locascio A, Blázquez MA, Alabadí D (May 2013). "Dynamic regulation of cortical microtubule organization through prefoldin-DELLA interaction". Current Biology. 23 (9): 804–9. doi:10.1016/j.cub.2013.03.053. PMID 23583555.
- ^ Salanenka Y, Verstraeten I, Löfke C, Tabata K, Naramoto S, Glanc M, Friml J (April 2018). "Gibberellin DELLA signaling targets the retromer complex to redirect protein trafficking to the plasma membrane". Proceedings of the National Academy of Sciences of the United States of America. 115 (14): 3716–3721. doi:10.1073/pnas.1721760115. PMC 5889667. PMID 29463731.
외부 링크
- 농약 특성 데이터베이스(PPDB)의 지베렐린