에스트라무스틴 인산염
Estramustine phosphate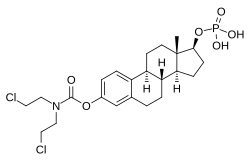 | |
 | |
| 임상자료 | |
|---|---|
| 상명 | 엠씨트, 에스트라시트 |
| 기타 이름 | EMP; Leo 299; NSC-89199; Ro 21-8837/001; Estradiol 3-노무스틴 17β-인산염; Estradiol 3-(bis(2-클로로에틸)카르바메이트) 17β-(다이수소 인산염) |
| AHFS/Drugs.com | 모노그래프 |
| 메드라인플러스 | a608046 |
| 라이센스 데이터 | |
| 임신 범주 |
|
| 경로: 행정 | 입으로 |
| 마약류 | 화학 요법 작용제; 에스트로겐; 에스트로겐 에스테르 |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 | |
| 약동학 데이터 | |
| 생체이용가능성 | 44~75% (에스트라마우스틴 및 에스트로무스틴으로)[1] |
| 단백질 결합 | • 에스트라디올: 98%[2] • 에스트론: 96%[2] |
| 신진대사 | 간, 창자[3][1][6] |
| 대사물 | • 에스트라무스틴[3][1] • 에스트로무스틴[3][1] • 에스트라디올[3][1] • 에스트론[3][1] • 인산[3][1] • 노무스틴[4] |
| 제거 반감기 | • EMP: 1.27시간[5] • 에스트로무스틴: 10~14시간[1] • 에스트론: 15~17시간[1] |
| 배설 | 담즙, 대변(2.9~4.8%)[1][6] |
| 식별자 | |
| |
| CAS 번호 | |
| 펍켐 CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 켐벨 | |
| CompTox 대시보드 (EPA) | |
| ECHA InfoCard | 100.023.193 |
| 화학 및 물리적 데이터 | |
| 공식 | C23H32CL2NO6P |
| 어금질량 | 520.38 g·190−1 |
| 3D 모델(JSmol) | |
| |
| |
에스트라무스틴 인산염(EMP, Estramustine phosphate, EMP)은 남성들의 전립선암 치료에 사용되는 이중 에스트로겐 및 화학요법 약물이다.[7][4][8][9][10][3][1][11][5][12] 하루에 여러 번 입으로 복용하거나 정맥에 주사하여 복용한다.[7][8][3][1][5][12]
EMP의 부작용으로는 메스꺼움, 구토, 자네운동, 여성화, 탈모, 성기능장애, 혈액응고, 심혈관 합병증이 있다.[3][9][13] EMP는 이중 세포성 물질이고 따라서 화학 요법 물질이며 에스트로겐 유형의 호르몬 항암 물질이다.[1][3][14][5] 시토스타틱 효과 면에서 에스트라무스틴과 에스트로무스틴을 프로드한 것이며 에스트로겐 효과와 관련하여 에스트라디올을 프로드한 것이다.[1][3] EMP는 대표적인 임상 용량에서 강력한 에스트로겐 효과를 가지고 있으며, 결과적으로 항원항산화 효과와 기능 항안드로겐 효과를 나타낸다.[4][1][3][14]
EMP는 1970년대 초에 의학용으로 도입되었다.[3] 그것은 미국, 캐나다, 영국, 다른 유럽 국가들과 세계 그 밖의 다른 곳에서 이용 가능하다.[15][16]
의학적 용법
EMP는 미국에서는 전이성 및/또는 진행성 전립선암의 완화적 치료에 대해,[6] 반면 영국에서는 반응이 없거나 재발하는 전립선암 치료에 대해 표시된다.[17][5][1][10] 이 약은 비록 일선일선일선일선요법으로 사용되어 왔지만, 보통 전립선암의 호르몬 퇴치 사례에 사용하기 위해 비축되어 있다.[3] 전립선암에서 EMP에 의한 반응률은 기존의 고선량 에스트로겐 요법과 동등하다고 한다.[18]
상대적으로 심각한 부작용과 독성 때문에 EMP는 전립선암 치료에 거의 사용되지 않았다.[4] 오늘날 서구 국가들에서는 특히 그렇다.[4] 그 결과, 또한 레우프로렐린과 같은 고나도트로핀 방출 호르몬 조절기(GnRH 조절기)의 희박한 부작용 때문에 EMP는 거의 버려졌다.[3] 그러나 임상 연구 결과를 장려함으로써 전립선암 치료에 대한 EMP의 새로운 관심을 갖게 되었다.[3]
EMP는 전립선암 치료에 하루 140~1400mg/일 경구 투여로 사용되어 왔다.[19] 그러나 구강 EMP는 560~640mg/day(하루 2회 2회)의 용량에서 가장 일반적으로 사용된다.[1] Emcyt의 식품의약국(FDA)[20] 라벨에 있는 경구 EMP의 권장 복용량은 체중의 kg 당 14mg(즉, 체중의 10kg 당 140mg 경구 캡슐 1개 또는 22lbs 당 1개)이다. 라벨에는 미국의 구강 EMP 연구 대상 환자 대부분이 kg당 10~16mg을 매일 복용하고 있다고 적혀 있다.[20] 90kg 또는 200lb 남성의 경우 하루에 약 900에서 1,440mg이 될 것이다.[20] 하루 280 mg/day와 같은 경구 EMP의 낮은 선량은 높은 선량으로 유사한 효과를 가지지만 허용성과 독성 감소를 가진 것으로 밝혀졌다.[4] 하루 140mg의 선량은 매우 낮은 용량으로 설명되어 왔다.[21] EMP는 하루 240~450mg/일의 정맥주사로 사용되어 왔다.[1]
EMP와 폴리페스트라디올 인산염과 에틸비닐레스트라디올과 같은 다른 에스트로겐은 GnRH 조절기, 아비라테론 아세테이트, 엔잘루타미드 같은 새로운 치료법보다 훨씬 저렴하다.[4][22][23] 또한, 에스트로겐은 뼈의 손실과 골절, 열 섬광, 인지 및 대사 상태와 같은 안드로겐 결핍 치료의 다른 수단보다 상당한 이점을 제공할 수 있다.[4][23]
EMP는 전립선암에 걸린 남성들에게 GnRH 작용제 치료를 시작할 때 테스토스테론 플레어를 예방하기 위해 사용되어 왔다.[24]
| 경로/형식 | 에스트로겐 | 복용량 | |
|---|---|---|---|
| 구강 | 에스트라디올 | 1-2mg/일 3배 | |
| 결합 에스트로겐 | 1.25–2.5 mg/일 3배 | ||
| 에틸비닐레스트라디올 | 0.15–3mg/day | ||
| 에틸비닐레스트라디올술폰산염 | 1-2mg/주 1x | ||
| 디틸스틸베스트롤 | 1일 3mg/일 | ||
| 디에네스트롤 | 1일 5mg | ||
| 헥세스트롤 | 1일 5mg | ||
| 포스페스트롤 | 100–105 mg 1–3x/일 | ||
| 클로로트리아니센 | 하루 12-48mg | ||
| 쿼드로실란 | 일 900mg/day | ||
| 에스트라무스틴 인산염 | 일 140–1400mg/day | ||
| 경피 패치 | 에스트라디올 | 100 μg/일 2-6배 스크루탈: 100μg/일 1배 | |
| IM 또는 주사. | 에스트라디올 벤조아테 | 1.66mg/주 3배 | |
| 에스트라디올 이프로피온산염 | 5 mg 1x/주 | ||
| 에스트라디올 발레리테 | 10-40mg/1-2주 | ||
| 에스트라디올 언사이레이트 | 100mg/4주 | ||
| 폴리에스트라디올 인산염 | 단독: 160–320mg/4주 경구 사용 시 : 40-80mg/4주 | ||
| 에스트론 | 2-4mg 2-3배/주 | ||
| IV 주사제 | 포스페스트롤 | 300–370 mg 1-7배/주 | |
| 에스트라무스틴 인산염 | 하루 240~450mg | ||
| 참고: 복용량이 반드시 같은 것은 아니다. 출처: 템플릿을 참조하십시오. | |||
사용 가능한 양식
EMP는 경구 투여용 캡슐(140mg, 280mg)과 정맥 주사용 수용액(300mg)[19][25][26][7]의 형태로 제공되거나 제공되어 왔다.
콘트라인커뮤니케이션
EMP는 어린이, 에스트로겐이나 질소 무스타드에 과민한 환자, 소화기내 궤양(소화기관 내 궤양), 간기능이 심각하게 손상된 환자, 심장근육이 약한 환자(심근 기능 저하라고도 함) 및 혈색소 장애 또는 관련 합병증을 가진 환자 등에 사용할 때 억제된다. 유체 [17]보유
부작용
EMP의 전반적인 부작용은 비교적 심각한 것으로 설명되어 왔다.[3] EMP의 가장 흔한 부작용은 메스꺼움, 구토, 설사 등의 위장 부작용이며, 남성의 40%에서 메스꺼움과 구토가 일어나는 것으로 보고되었다.[9][1] 그것들은 보통 경미하거나 심각성이 보통이며, 메스꺼움과 구토증은 예방적 항제약으로 관리할 수 있다.[9] 그럼에도 불구하고, EMP에 의한 위장 부작용의 심각한 경우는 투여량 감소나 치료 중단이 필요할 수 있다.[1] 메스꺼움과 구토가 EMP의 가장 흔한 부작용이라고 보고되었지만, 여성성 유방 발달(남성 유방 발달)은 EMP로 치료된 남성의 83%에서 발생하는 것으로 밝혀졌으며, 발기부전 발생은 여성성 질환의 위험과 비슷하거나 약간 덜 발생할 가능성이 있다.[3] 일반적으로 여성화, 지느러미 지방분포, 데마스쿨린화, 발기부전은 고선량 에스트로겐요법으로 치료받은 남성의 사실상 또는 거의 100%에서 발생한다고 한다.[13][27] EMP로 치료받은 남성들에서도 성행위가 줄어든 것으로 보고되었다.[1] 이러한 부작용은 높은 에스트로겐 수치와 낮은 테스토스테론 수치 때문이다.[1][3] 유방에 대한 예방적 조사는 에스트로겐이 있는 자네코마스티아의 발병률과 심각성을 감소시키는 데 사용될 수 있다.[13]
EMP의 심각한 부작용으로는 폐색전증, 심맥혈전증, 뇌졸중, 혈전증, 관상동맥질환(허혈성심장질환, 심근경색), 혈전증, 유체유지에 따른 울혈성 심부전 등 혈전증 및 심혈관 합병증이 있다.[9][1] EMP는 디에틸스틸베스트롤과 유사하지만 낮은 용량(예: 280mg/일 경구 EMP 대 1mg/일 경구 디에틸스틸베스트롤)에서 심혈관 독성을 생성한다.[3][28] 전립선암 질환 상태는 혈전증 위험도 높으며, 도카스텔과의 결합은 혈전증 위험도 악화시킬 수 있다.[9] 임상시험의 메타분석 결과 EMP가 없는 화학요법의 경우 0.4%에 비해 EMP가 있는 전체 혈전증 위험은 4~7%인 것으로 나타났다.[9][29] EMP.[30]Anticoagulant의 치료법은 아스피린, 와파린,unfractionated고는 저분자 헤파린, 그리고 비타민 K길항제 혈전 색전증의 EMP과 디에틸 스틸 베스트 롤과 ethinylestra 같은 다른 난포 호르몬과 위험을 감소시키는데 유용합니다 같은 약물 치료를 중단 Thromboembolism는 가장 큰 toxicity-related 원인이다.dioL.[9][31][4]
간기능 이상 검사는 EMP에서 흔히 볼 수 있지만, 간기능장애가 심한 경우는 드물다.[1] 중추신경계 부작용은 EMP를 매우 많이 투여(20–140mg/kg/일)한 원숭이에서 3~6개월 동안 확대된 심실 및 신경 색소 침착이 보고되었지만 EMP에서는 거의 볼 수 없다.[1] EMP는 정상 뇌 조직에서 세포성 효과를 가지지 않는 것으로 보인다.[1] 임상 연구에서 EMP로 치료된 여성들에서는 경미한 산부인과 출혈 사례가 몇 가지 관찰되었다.[1] EMP는 세포성 항소성 물질과 질소 무수화물 사이에서 비교적 잘 용인되는 것으로 설명되며 골수 억제(골수 억제), 위장 독성 또는 그러한 물질과 관련된 다른 두드러진 독성과 같은 유의미한 혈액학적 독성과 거의 관련되지 않거나 전혀 관련이 없다.[5][1][32] 흔히 골수압, 백혈구수 감소, 중성미자(중립구수 감소)를 일으키는 다른 대부분의 세포성 물질과는 대조적으로 EMP는 실제로 부작용으로 백혈구증(백혈구수 증가)을 생산한다.[33][34]
150일 동안 280mg/day 경구 EMP를 이용한 소규모 저선량 연구에서는 남성의 15%에서만 위장 자극이 일어나고 심한 심혈관 독성이나 심혈관 혈전증 발생이 없는 등 허용성이 크게 개선됐다.[3][4] 또 약간의 일시적인 상승 간 효소 외에 다른 부작용은 관찰되지 않았다.[3] 이러한 결과는 경구 EMP의 낮은 복용량이 전립선암 치료에 대한 높은 복용량보다 안전한 선택일 수 있음을 시사한다.[4] 그러나 이후 2004년 EMP와 함께 혈전증 사건에 대한 23개 연구의 메타 분석 결과 투여량에 관계 없이 혈전증 사건이 상당히 발생했으며 이러한 합병증의 위험이 있는 EMP 선량의 연관성은 발견되지 않았다.[29]
| 시스템 기관 클래스 | 매우 일반적임(≥10%) | 공통(1~10%) | 알c 수 없는 주파수 |
|---|---|---|---|
| 혈액 및 림프계 장애 | 빈혈; 백혈병 | 혈소판감소증 | |
| 면역계 장애 | 과민성 | ||
| 신진대사 및 영양 장애 | 유체보존 | ||
| 정신 질환 | 컨퓨션 상태; 우울증 | ||
| 신경계 장애 | 무기력; 두통 | ||
| 심장병 | 울혈성 심부전 | 심근경색 | 심근허혈증 |
| 혈관 장애 | 엠볼리즘 | 고혈압 | |
| 위장 장애 | 메스꺼움b, 구토b, 설사b | ||
| 간 담도 장애 | 비정상 간 기능 | ||
| 피부 및 피하조직 장애 | 혈관부종c; 알레르기성 피부염 | ||
| 근골격계 및 결합조직 장애 | 근육약 | ||
| 생식계통 및 유방질환 | 자네코마스티아 | 발기부전 | |
| 일반 장애 및 관리 사이트 상태 | 주입부위 혈전증(IV용액) | ||
| 각주: = 사용 가능한 데이터에서 추정할 수 없음. b =특히 치료 후 처음 2주 동안은. c = 혈관부종(정맥부종, 후두부종)이 발생할 수 있다. ACE 억제제와 결합하여 발생하는 경우가 많다. 혈관부종이 발생하면 EMP를 즉시 중단해야 한다. 출처: 템플릿을 참조하십시오. | |||
| 부작용 | 에스트라무스틴 인산염(도덕) 11.5~15.9mg/kg/일)(n = 93) (%) | 디틸스틸베스트롤(도덕) 3.0mg/일)(n = 93) (%) |
|---|---|---|
| 심혈관 및 호흡기 | ||
| 심정지 | 0 | 2 |
| 뇌혈관사고(행정) | 2 | 0 |
| 심근경색(심장마비) | 3 | 1 |
| 트롬보플레비티스 | 3 | 7 |
| 폐색전증 | 2 | 5 |
| 울혈성 심부전 | 3 | 2 |
| 부종 (식사) | 19 | 17 |
| 호흡곤란(호흡곤란) | 11 | 3 |
| 다리 경련 | 8 | 11 |
| 상부 호흡기 방전 | 1 | 1 |
| 호어센스 | 1 | 0 |
| 위장 | ||
| 메스꺼움 | 15 | 8 |
| 설사. | 12 | 11 |
| 경미한 위장 이상 | 11 | 6 |
| 거식증 (적폐손실) | 4 | 3 |
| 평탄도 | 2 | 0 |
| 구토 | 1 | 1 |
| 위장 출혈 | 1 | 0 |
| 불타는 목 | 1 | 0 |
| 갈증 | 1 | 0 |
| 인터게이티브 | ||
| 발진 | 1 | 4 |
| 프리리토스(고치) | 2 | 2 |
| 건조한 피부 | 2 | 0 |
| 색소 변화 | 0 | 3 |
| 쉬운 멍 | 3 | 0 |
| 플러싱 | 1 | 0 |
| 밤이슬 | 0 | 1 |
| 손가락 끝 피부 벗겨짐 | 1 | 0 |
| 가는머리 | 1 | 1 |
| 유방이 변하다. | ||
| 가슴의 부드러움 | 66 | 64 |
| 유방확대(자궁 또는 남성 유방발달) | ||
| 마일드 | 60 | 54 |
| 중간 | 10 | 16 |
| 표시됨 | 0 | 5 |
| 잡다한 | ||
| 무기력함만 | 4 | 3 |
| 우울증 | 0 | 2 |
| 감정노동성 | 2 | 0 |
| 불면증 | 3 | 0 |
| 두통 | 1 | 1 |
| 불안 | 1 | 0 |
| 가슴통증 | 1 | 1 |
| 핫플래시 | 0 | 1 |
| 눈의 통증 | 0 | 1 |
| 눈물(눈물) | 1 | 1 |
| 이명 | 0 | 1 |
| 실험실 이상 | ||
| 혈액학(혈액) | ||
| 백혈구(낮은 백혈구) | 4 | 2 |
| 혈소판(낮은 혈소판) | 1 | 2 |
| 간상(간상) | ||
| 빌리루빈만 | 1 | 5 |
| 빌리루빈과 | 0 | 1 |
| 빌리루빈과 | 2 | 1 |
| 빌리루빈, LDH, SGOT | 2 | 0 |
| LDH 및/또는 SGOT | 31 | 28 |
| 잡다한 | ||
| 일시적인 고칼슘(고칼슘) | 0 | 1 |
| 출처: [7] | ||
과다 복용
EMP의 과다복용에 대한 임상경험은 없었다.[7] EMP의 과다복용은 약물의 알려진 부작용의 현저한 발현을 초래할 수 있다.[7] EMP의 과다복용에 대한 구체적인 해독제는 없으며,[17] 과다복용 시 위액세포를 사용하여 필요에 따라 위 내용물을 배출하고, 치료는 증상 기반이며 보조적이어야 한다.[7][17] 위험할 정도로 적은 수의 적혈구, 백혈구 또는 혈소판의 경우 필요에 따라 전혈을 투여할 수 있다.[17] 간 기능은 EMP 과다 복용으로 모니터링해야 한다.[17] EMP를 과다 복용한 후 혈액학적 및 간상학적 파라미터는 최소 6주 동안 계속 모니터링해야 한다.[7]
EMP는 구강 경로로는 1일 1,260mg/일, 정맥주사로 240~450mg/일의 고선량에서 사용되어 왔다.[3][1]
상호작용
EMP는 아미트립티라인과 이미프라민 같은 삼발성 항우울제의 효능과 독성을 높이는 것으로 보고되었다.[17] 우유와 같은 유제품, 다양한 식품 영양 보충제, 제산제와 같은 칼슘, 알루미늄 및/또는 마그네슘을 함유한 제품을 EMP와 함께 섭취할 경우 EMP와 이러한 금속들 사이에 불용성 첼레이트 복합체/인산염이 형성될 수 있으며, 이는 흡수를 현저히 저해하고 따라서 경구 생체이용성을 저해할 수 있다. EMP.[3][1][17] ACE 억제제를 동시에 복용하는 경우 혈관부종의 위험이 증가할 수 있다.[17]
약리학
약리역학

에스트라디올 노르무스틴 인산염으로도 알려진 EMP는 에스트로겐 에스테르와 질소 머스타드 에스테르를 결합한 것이다.[1][3][14] 에스트로겐인 에스트라디올과 인산염 에스테르와 연결되어 있으며, 질소 머스타드인 노르무스틴의 에스테르로 구성되어 있다.[1][3][14] 약리학적 효과로 볼 때 EMP는 에스트라마우스틴, 에스트로무스틴, 에스트라디올의 프로드러그다.[1][3] 에스트라디올의 약물로써 EMP는 에스트로겐이고 따라서 에스트로겐 수용체의 작용제다.[1][2] EMP 자체는 에스트로겐 수용체에 대한 친화력이 매우 약할 뿐이다.[1] 이 약은 C3 노무스틴과 C17β 인산염 에스테르가 존재하기 때문에 에스트라디올보다 약 91% 높은 분자량이다.[35][15] EMP는 에스트라디올의 프로드약이기 때문에 에스트라무스틴과 에스트로무스틴을 통한 추가적인 시토스타틱 활성이 있기는 하지만 [14]자연적이고 생물학적인 형태의 에스트로겐으로 간주될 수 있다.[1][3]
EMP는 이중 작용 메커니즘에 의해 작용한다: 1) 여러 가지 작용을 통해 직접 세포질 활동을 하고 2) 에스트로겐 수용체 매개 항원항산화 효과와 기능 항안드로겐 효과를 통한 고선량 에스트로겐 치료의 한 형태로서 작용한다.[1][3][14] EMP의 항원 항안드로겐 효과와 기능 항안드로겐 효과는 생식 안드로겐 생산의 강력한 억제와 그에 따른 테스토스테론과 같은 안드로겐의 순환 수준, 성호르몬 구속 글로불린의 현저한 증가와 그에 따른 순환 내 자유 안드로겐의 감소, 그리고 직접적인 항안드로겐 작용으로 구성된다.s는 전립선 세포에 있다.[32][1][3][4][36][37][38] 경구형 EMP의 자유 안드로겐 지수는 난초 절제술보다 평균 4.6배 낮은 것으로 나타났다.[37] 이와 같이 EMP 치료는 난초 절제술보다 안드로겐 결핍이 상당히 심하다.[38] 에스트라무스틴, 에스트로무스틴, 에스트라디오올, 에스트론 등 EMP의 대사물은 임상적 의의는 알 수 없으나 안드로겐 수용체(EC50 = 0.5~3.1μM)의 약한 길항제 역할을 하는 것으로 밝혀졌다.[39][36][3][1]
EMP 치료 중에 극히 높은 수준의 에스트라디올과 에스트론이 발생한다.[3][4] EMP의 에스트로겐 대사물은 가장 흔한 부작용과 심혈관 독성에 책임이 있다.[1] EMP는 일부 간행물에서 에스트로겐 효과가 상대적으로 약한 것으로 설명되어 왔다.[5][32] 그러나, 그것은 본질적으로 에스트로겐 효과의 비율과 정도를 보여주었는데, 유방 연성, 자네마스티아, 심혈관계 독성, 간 단백질 합성의 변화, 테스토스테론 억제 등이 임상 연구에서 고선량 디에틸스틸베스트롤, 에티비닐스트라디올과 동일하다.[7][4][32][38][40] EMP가 상대적으로 에스트로겐 활성도가 약하다는 개념은 동물 연구에 근거했을 수 있는데, 이 연구는 EMP가 쥐의 에스트라디올보다 자궁근종 효과가 100배 낮다는 것을 발견했으며, 또한 인간에게 임상적으로 사용되는 EMP의 매우 높은 선량을 고려하지 않았을 수도 있다.[40][41]
EMP의 시토스타틱 효과의 작용 메커니즘은 복잡하고 부분적으로만 이해된다.[1] EMP는 주로 세포 주기의 유사화 단계에 관여하는 억제 메커니즘인 유사 억제제로 간주된다.[1][4] 구체적으로는 미세관류 관련 단백질 및/또는 튜불린에 결합하여 미세관(에스트라무스틴의 경우d K = 10–20 μM)의 고결성을 발생시켜 G/M상2(특히 은유효소)에서 세포분열이 고착되는 결과를 초래한다.[1][4][42] EMP는 원래 질소 머스타드인 노르무스틴의 프로드러그로서 세포성 효과를 중재하는 것으로 생각되었고, 따라서 알킬라잉 항소성 물질로 생각되었다.[3][10][5][14] 그러나 후속 연구에서는 EMP에 알킬링 작용이 없고, 마이크로튜브에 대한 EMP의 영향은 온전한 에스트라마스틴과 에스트로무스틴에 의해 매개되며, 노무스틴이나 에스트라디올만 해도 경미하거나 무시해도 될 정도의 효과만을 가지고 있다는 사실을 밝혀냈다.[1][3][43] 이와 같이, 이 estramustine과estromustine 구조의 특이한 속성, carbamate-ester 채권을 포함하는, EMP.[1]의 세포 유도, DNA합성과 간섭, nucl를 포함한 그것의 세포 분열 저지성의 행동에 게다가, 또한 EMP는 다른 세포 분열을 억제하는 효과를 만들어 낼 발견되고 있는 정균 효과가 책임 지는 것처럼 보인다.대r 매트릭스 상호작용, 세포막 변경, 활성 산소종(자유산소산소)의 유도 및 가능한 추가 메커니즘.[1][4] EMP는 전립선암과 교모세포에서 전파감소 효과가 있어 방사선치료에 대한 민감도도 개선된 것으로 나타났다.[1]
EMP의 세포 대사물은 전립선암 세포와 같이 선별적인 방법으로 조직에 축적된다.[5][1][4] 이는 전립선암, 교모종, 흑색종, 유방암 세포에서 검출된 전립선암 또는 전립선 분비 단백질(PSP)으로도 알려진 특정 에스트라무스틴 결합 단백질(EMBP)(Kd = 10–35nM)이 존재하기 때문일 수 있다.[1][4][44] 조직 선택성 때문에 EMP는 건강한 조직에서 최소한의 세포성 효과를 낸다고 하며, 조직 선택성은 전립선암 세포에 대한 치료적 세포성 효능을 담당할 수도 있다.[5][4][1]
EMP는 원래 에스트로겐 수용체에 대한 에스트로겐 계통의 친화성으로 인해 에스트로겐 표적 조직과 그에 따라 에스트로겐 수용체 양성 종양 세포에 선택적으로 축적되는 질소 머스타드 알킬링 항소성 물질로서 에스트로겐과 노르무스틴의 이중 에스테르 프로드러로 개발되었다.[4][14][2] 결과적으로, EMP는 알킬라팅 노무스틴 모이티를 이러한 조직에 우선적으로 공급할 것으로 생각되어 건강한 조직에서 세포성 효과를 감소시키고 따라서 효율성과 허용성을 개선했다.[4] 그러나 후속 연구에서는 노무스틴 에스테르의 갈라짐이 매우 제한적이고 느리며 EMP에는 알킬링 활성이 없다는 것을 발견했다.[4][1][3][32] 또한 에스트라무스틴과 에스트로무스틴이 에스트로겐 대상 조직에서 우선적으로 축적될 수 있는 것은 에스트로겐 수용체에 대한 친화력 때문이 아니라, 그 대신 뚜렷한 EMBP에 대한 친화력 때문인 것으로 보인다.[1][3]
극도로 높은 임신과 유사한 수준의 에스트라디올은 EMP로 치료된 개인에서 관찰되는 백혈구증(백혈구 수 증가)의 원인이 될 수 있다.[33][34] 이러한 부작용은 대부분의 다른 세포독성 물질과는 대조적으로 대신 골수 억제(골수 억제), 백혈구 감소(백혈구 수 감소), 중성미자(중립구 수 감소)를 일으킨다.[citation needed]
안티고나데오틱 효과
하루 섭취량 280mg/dL의 EMP는 남성들의 테스토스테론 수치를 20일 이내에 (30ng/dL까지) 그리고 30일 이내에 낮은 (10ng/dL까지)까지 억제하는 것으로 밝혀졌다.[3] 마찬가지로, 70 mg/day EMP 복용량은 4주 이내에 테스토스테론 수치를 거세 범위 내로 억제했다.[3]
약동학
| 매개변수 | IV 300mg | 경구 420mg |
|---|---|---|
| Cmax | 506 ± 61 ng/ml | 362 ± 38 ng/mL |
| Tmax | 2.6 ± 0.4시간 | 2.2 ± 0.2 시간 |
| t1/2 | 10.3 ± 0.95시간 | 13.6 ± 3.09시간 |
| AUC0–32 | 4.82 ± 0.62 | 2.88 ± 0.34 |
| 생체이용가능성 | 100.0% | 43.7% ± 4.6% |
| 출처: [32] | ||
| 대사물 | 플라즈마 | 비율 |
|---|---|---|
| 에스트라무스틴 | 20,000–23,000 pg/ml | 1:9.6–9.8 |
| 에스트로무스틴 | 191,000–267,000 pg/mL | |
| 에스트라디올 | 4,900–9,000 pg/ml | 1:9.4–11.8 |
| 에스트론 | 7만1000~8만5000pg/mL | |
| 출처: [32] | ||
경구 섭취 시 EMP는 위장관에서 첫 번째 통과 시 인산염에 의해 에스트라무스틴으로 빠르고 완전히 탈인산화된다.[1][4][5][45] 에스트라무스틴은 또한 첫 번째 패스 동안 17β-히드록시스테로이드 탈수소화에 의해 에스트로무스틴으로 부분적으로 그러나 상당히 산화된다.[5][1][12][46] 이와 같이 EMP는 에스트라무스틴과 에스트로무스틴으로 순환에 이르며, EMP의 주요 대사물은 에스트로무스틴이다.[1][12] 에스트라무스틴과 에스트로무스틴의 약 10~15%의 제한된 양은 노르무스틴 에스테르를 에스트라디오올과 에스트론으로의 가수분해를 통해 더욱 천천히 대사된다.[1][4][32] 이러한 반응은 책임 효소를 부호화하는 유전자가 특징지어지지는 않았지만 카바미다제에 의해 촉매작용을 하는 것으로 생각된다.[1][47][48] EMP에서 형성된 노르무스틴의 순환 수준은 미미하다.[43][49] 카르복실산 그룹의 갈라짐을 통해 노르무스틴에서 질소 머스터드 가스를 방출하는 것은 입증되지 않았으며 발생하지 않는 것으로 보인다.[42][32]
EMP의 경구 생체이용률은 낮은데, 이는 심오한 1차 통과 대사, 특히 EMP의 탈인산화 때문이다.[1] 특히 에스트라무스틴과 에스트로무스틴으로 EMP의 경구 생체이용률은 44~75%로 흡수가 불완전할 수 있음을 시사한다.[1] 어쨌든 EMP의 경구 투여량과 에스트라무스틴과 에스트로무스틴의 순환 수준 사이에는 선형 관계가 있다.[1] 경구 EMP와 함께 칼슘, 알루미늄 또는 마그네슘을 섭취하면 장으로부터의 흡수가 감소하여 생체이용성이 현저히 손상될 수 있으며, 이는 낮은 용량에서 치료 효과를 방해할 수 있다.[3][17]
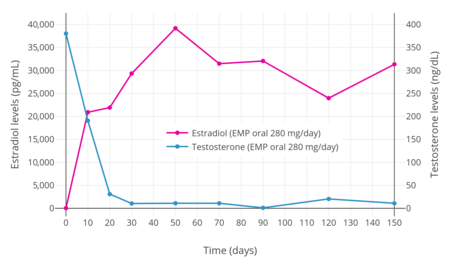
전립선암에 걸린 남성의 경우 420mg EMP 단회 경구 투여 후 에스트로무스틴의 최대 수치는 310~475ng/mL(47만5000pg/mL)로 2~3시간 후 발생했다.[1] 1일 280mg/day 경구 EMP의 에스트라디올 수치가 치료 1주일 이내에 매우 높은 농도로 증가하는 것으로 밝혀졌다.[3] 한 연구에서 에스트라디올 수치는 10일 후 2만 pg/mL 이상이었고, 30일 후 약 3만 pg/mL이었으며, 50일 후 약 4만 pg/mL로 정점을 찍었다.[3] 또 다른 연구는 560 mg/day 경구 EMP로 만성 치료 중 4,900 - 9,000 pg/mL의 에스트라디올 수치가 낮다는 것을 발견했다.[32] 추가 연구에서는 약 17,000 pg/mL, 140 mg/day 경구 EMP로 38,000 pg/mL의 에스트라디올 수치가 낮다는 것을 발견했다.[citation needed] EMP 치료 중 에스트라디올과 에스트론의 순환 수치는 남성의 정상 수준을 각각 100배, 1000배 이상 초과한 것으로 보고되었다.[4][32] 혈액순환 중 에스트라무스틴과 에스트라디오올의 농도는 각각 에스트로무스틴과 에스트론보다 현저하게 낮으며, 두 경우 모두 약 1:10의 비율이다.[1][32] 그럼에도 불구하고 EMP 치료 중 에스트라디올 수치는 5000~4만 pg/mL에 이르는 중후기 임신에서 발생하는 수치와 유사한 것으로 보인다.[50] 구강 투여의 순환에서는 변하지 않는 EMP가 보이지 않는다.[1]
EMP의 약동학은 정맥 주사와는 다르다.[1] 300 mg EMP의 정맥주사를 한 번 투여한 후, EMP의 수준은 처음 8시간 동안 대사물의 수준보다 높았다.[1] 이는 1차 통과 신진대사가 우회적으로 이뤄졌기 때문일 가능성이 높다.[1] 그러나 투여 후 24시간이 지나도록 순환에서 변하지 않은 EMP는 더 이상 검출될 수 없었다.[1] 혈장으로부터의 EMP 간극은 4.85 ± 0.684 L/h이다.[1] 정맥주사가 있는 EMP의 분포 용적은 작았다. 2개 구획 모델에서 중앙 구획의 분포 용적은 0.043 L/kg, 주변 구획의 분포 용적은 0.11 L/kg이었다.[1] EMP의 혈장 단백질 결합이 높다.[1] 에스트라무스틴은 종양 조직, 예를 들어 전립선암과 교모세포 조직에 축적되며, 이들 조직에서 혈장보다 에스트라무스틴 수치가 훨씬 높다(각각 6.3배, 15.9배).[1] 반대로 종양 대 혈장의 에스트로무스틴 수치는 비슷하다(각각 1.0배, 0.5배).[1] 에스트라무스틴과 에스트로무스틴은 지방조직에 축적되는 것처럼 보인다.[1]
구강 EMP로 에스트로무스틴의 제거 반감기는 평균 13.6시간이었으며, 범위는 8.8~22.7시간이었다.[1] 반대로 정맥주사를 맞은 에스트로무스틴의 반감기는 10.3시간으로 7.36~12.3시간 범위였다.[1] 비교를 위해, 에스트론의 해당 제거 반감기는 구강 투여와 정맥 투여에 각각 16.5시간과 14.7시간이었다.[1] 에스트라무스틴과 에스트로무스틴은 주로 담즙과 대변에 배설된다.[1][32] 그것들은 소변으로 배설되지 않는다고 믿어지지 않는다.[1]
화학
EMP는 에스트라디올 3-노르무스틴 17β-인산염 또는 에스트라디올 3-(bis(2-클로로에틸)카르바메이트) 17β-(다이수소 인산염)로 알려진 합성 에스트란 스테로이드 및 에스트라디올의 파생물질이다.[35][15] 에스트로겐 에스테르, 특히 EMP는 C3 노무스틴(질소 머스타드-카르바메이트 모이에티) 에스테르와 C17β 인산염 에스테르를 가진 에스트라디올의 다이테르다.[35][15] EMP는 나트륨 또는 메글루민 소금으로 제공된다.[35][15][25] EMP는 에스트라디올 황산염, 에스트라디올 발리트와 같은 다른 에스트라디올 에스테르와 화합물과 유사하지만, 질소 머스타드 에스테르 모이티가 존재한다는 점에서 차이가 있다.[35][15] EMP와 관련된 항소성 물질은 비록 시판되지는 않았지만 알레스트라마우스틴, 아트리무스틴, 시테롤 아세테이트, 에스트라디올 머스타드, ICI-85966, 페네스트롤 등이 있다.[35][15]
EMP는 친수성 인산염 에스테르 몰티 때문에 쉽게 수용 가능한 화합물이다.[51][52][53] 이것은 대부분의 다른 에스트라디올 에스테르와는 대조적인데, 지방산 에스테르와 지방질 화합물로서 물에 특별히 용해되지 않는다.[2] EMP와 달리 에스트라무스틴은 지방질이 강하고, 물에서 실제로 용해되지 않으며, 이온화 할 수 없다.[19] EMP의 인산염 에스테르는 물의 용해도를 높이고 정맥 투여를 허용하기 위해 분자에 통합되었다.[7]
EMP 나트륨의 분자 중량은 564.3 g/mol, EMP 메글루민은 715.6 g/mol, EMP는 520.4 g/mol, 에스트라무스틴은 440.4 g/mol, 에스트라디올은 272.4 g/mol이다.[54] 이러한 분자량 차이의 결과로 EMP는 약 52%, EMP 나트륨은 약 48%, EMP 메글루민은 동일한 질량의 에스트라디올과 마찬가지로 구조물 내 에스트라디올 양의 약 38%를 함유하고 있다.[54]
| 에스트로겐 | 구조 | 에스테르 | 상대적 mol. weight | 상대적 E2 내용물b | 로그c P | ||||
|---|---|---|---|---|---|---|---|---|---|
| 포지션 | 모이에트(ies) | 유형 | 길이a | ||||||
| 에스트라디올 | – | – | – | – | 1.00 | 1.00 | 4.0 | ||
| 에스트라디올 아세테이트 | C3 | 에타노산 | 스트레이트 체인 지방산 | 2 | 1.15 | 0.87 | 4.2 | ||
| 에스트라디올 벤조아테 | C3 | 벤젠카르복실산 | 방향족 지방산 | – (~4–5) | 1.38 | 0.72 | 4.7 | ||
| 에스트라디올 이프로피온산염 | C3, C17β | 프로파노산(×2) | 스트레이트 체인 지방산 | 3 (×2) | 1.41 | 0.71 | 4.9 | ||
| 에스트라디올 발레리테 | C17β | 펜타노산 | 스트레이트 체인 지방산 | 5 | 1.31 | 0.76 | 5.6–6.3 | ||
| 에스트라디올 벤조이트 부티레이트 | C3, C17β | 벤조산, 부티르산 | 혼합지방산 | – (~6, 2) | 1.64 | 0.61 | 6.3 | ||
| 에스트라디올 시피오네이트 | C17β | 사이클로펜틸프로파노산 | 방향족 지방산 | – (~6) | 1.46 | 0.69 | 6.9 | ||
| 에스트라디올 에난산염 | C17β | 헵타노산 | 스트레이트 체인 지방산 | 7 | 1.41 | 0.71 | 6.7–7.3 | ||
| 에스트라디올 디에난산염 | C3, C17β | 헵탄산(×2) | 스트레이트 체인 지방산 | 7 (×2) | 1.82 | 0.55 | 8.1–10.4 | ||
| 에스트라디올 언사이레이트 | C17β | 언데카노산 | 스트레이트 체인 지방산 | 11 | 1.62 | 0.62 | 9.2–9.8 | ||
| 에스트라디올 스타아레이트 | C17β | 옥타데카노산 | 스트레이트 체인 지방산 | 18 | 1.98 | 0.51 | 12.2–12.4 | ||
| 에스트라디올 디스트레이디어레이트 | C3, C17β | 옥타데카노산(×2) | 스트레이트 체인 지방산 | 18 (×2) | 2.96 | 0.34 | 20.2 | ||
| 황산 에스트라디올 | C3 | 황산 | 수용성 결합체 | – | 1.29 | 0.77 | 0.3–3.8 | ||
| 에스트라디올 글루쿠로니드 | C17β | 글루쿠론산 | 수용성 결합체 | – | 1.65 | 0.61 | 2.1–2.7 | ||
| 에스트라무스틴 인산염d | C3, C17β | 노르무스틴, 인산 | 수용성 결합체 | – | 1.91 | 0.52 | 2.9–5.0 | ||
| 폴리에스트라디올 인산염e | C3-C17β | 인산 | 수용성 결합체 | – | 1.23f | 0.81f | 2.9g | ||
| 각주: = 직선 체인 지방산의 경우 탄소 원자의 에스테르 길이 또는 방향족 지방산의 경우 탄소 원자의 에스테르 대략적인 길이 b = 체중별 상대 에스트라디올 함량(즉, 상대 에스트로겐 노출). c = 실험적이거나 예측된 옥탄올/수분 분할 계수(즉, 지방질/수분 분해성). PubChem, ChemSpider 및 Drug Bank에서 검색됨. d = 에스트라디올 노르무스틴 인산염이라고도 한다. e = 에스트라디올 인산염(~13회 반복 단위)의 폴리머. f = 반복 단위당 상대 분자량 또는 에스트라디올 함량 g = 반복 단위의 로그 P(즉, 에스트라디올 인산염). 출처: 개별 기사를 참조하십시오. | |||||||||
역사
EMP는 1960년대 중반에 처음 합성되어 1967년에 특허를 얻었다.[42] 처음에는 유방암 치료를 위해 개발되었다.[1] EMP에 대한 아이디어는 방사선을 바른 에스트로겐이 유방암 조직에 흡수되고 축적되는 것에서 영감을 받았다.[1] 그러나 유방암에 걸린 여성에서 EMP의 초기 임상 결과는 실망스러웠다.[1] 그 후, 방사선을 바른 EMP가 쥐 전립선에 흡수되어 축적된 것으로 밝혀졌고, 이 발견은 전립선암 치료를 위해 용도 변경되는 약에서 절정에 달했다.[1][3] EMP는 1970년대 초 이 질환의 치료에 의학용으로 도입되었으며, 1981년 미국에서 이 적응증 사용이 승인되었다.[1][3][55] EMP는 원래 정맥주사에 사용하기 위해 도입되었다.[32] 이어서 구강 제형이 도입되었고, 구강 판에 유리하게 정맥 준비는 거의 포기되었다.[32]
사회와 문화
일반 이름
EMP는 구강 투여를 위한 나트륨 소금으로 제공되며, 에스트라무스틴 인산나트륨()USAN과 에스트라무스틴 인산나트륨(,BANM )의 총칭이 있는 정맥 투여를 위한 메글루민 소금으로 제공되며, 에스트라무스틴 인산 메글루민이라는 총칭이 있다.[25][35][15][56][16] 그것은 에스트라마스틴 인산염이다.[35] 에스트라무스틴 인산염이라는 이름은 에스트라디오올 노르무스틴 인산염의 수축이다.[35][16] EMP는 또한 레오 299, 로 21-8837, 로 21-8837/001이라는 이전의 개발 코드 이름으로도 알려져 있다.[35][15][16]
브랜드명
EMP is most commonly marketed under the brand names Estracyt and Emcyt, but has also been sold under a number of other brand names, including Amsupros, Biasetyl, Cellmustin, Estramustin HEXAL, Estramustina Filaxis, Estranovag, Multosin, Multosin Injekt, Proesta, Prostamustin, and Suloprost.[15][16][25]
유용성
EMP는 미국,[57] 캐나다, 멕시코에서 Emcyt라는 상표명으로 판매되고 있는 반면, 이 약품은 영국과 다른 유럽 전역뿐만 아니라 아르헨티나, 칠레, 홍콩에서도 판매되고 있다.[15] 호주, 브라질, 아일랜드, 노르웨이 등 여러 나라에서 단종되었다.[58]
리서치
EMP는 교모종과 유방암과 같은 다른 암의 치료에서 연구되어 왔다.[1] 교모종이 있는 사람들의 삶의 질을 처음 3개월 동안 약간 향상시킨 것으로 밝혀졌다.[1]
참조
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bc bd be bf bg bh bi bj bk bl bm bn bo bp bq br bs bt bu bv bw bx by bz ca cb cc cd ce cf cg ch Bergenheim AT, Henriksson R (February 1998). "Pharmacokinetics and pharmacodynamics of estramustine phosphate". Clin Pharmacokinet. 34 (2): 163–72. doi:10.2165/00003088-199834020-00004. PMID 9515186. S2CID 1943973.
- ^ a b c d e Kuhl H (2005). "Pharmacology of estrogens and progestogens: influence of different routes of administration" (PDF). Climacteric. 8 Suppl 1: 3–63. doi:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar Kitamura T (February 2001). "Necessity of re-evaluation of estramustine phosphate sodium (EMP) as a treatment option for first-line monotherapy in advanced prostate cancer". Int. J. Urol. 8 (2): 33–6. doi:10.1046/j.1442-2042.2001.00254.x. PMID 11240822. S2CID 43384150.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z Inoue, Takahiro (2018). "Role of Estramustine Phosphate and Other Estrogens for Castration-Resistant Prostate Cancer". Hormone Therapy and Castration Resistance of Prostate Cancer. pp. 249–256. doi:10.1007/978-981-10-7013-6_26. ISBN 978-981-10-7012-9.
- ^ a b c d e f g h i j k l m Perry CM, McTavish D (July 1995). "Estramustine phosphate sodium. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic efficacy in prostate cancer". Drugs Aging. 7 (1): 49–74. doi:10.2165/00002512-199507010-00006. PMID 7579781. S2CID 36725810.
- ^ a b c "Emcyt (estramustine) dosing, indications, interactions, adverse effects, and more". Medscape Reference. WebMD. Retrieved 8 February 2014.
- ^ a b c d e f g h i j https://www.accessdata.fda.gov/drugsatfda_docs/label/2008/018045s023lbl.pdf
- ^ a b Qin Z, Li X, Zhang J, Tang J, Han P, Xu Z, Yu Y, Yang C, Wang C, Xu T, Xu Z, Zou Q (September 2016). "Chemotherapy with or without estramustine for treatment of castration-resistant prostate cancer: A systematic review and meta-analysis". Medicine (Baltimore). 95 (39): e4801. doi:10.1097/MD.0000000000004801. PMC 5265899. PMID 27684806.
- ^ a b c d e f g h Ravery V, Fizazi K, Oudard S, Drouet L, Eymard JC, Culine S, Gravis G, Hennequin C, Zerbib M (December 2011). "The use of estramustine phosphate in the modern management of advanced prostate cancer". BJU Int. 108 (11): 1782–6. doi:10.1111/j.1464-410X.2011.10201.x. PMID 21756277.
- ^ a b c Simpson, D; Wagstaff, AJ (2003). "Estramustine Phosphate Sodium". American Journal of Cancer. 2 (5): 373–390. doi:10.2165/00024669-200302050-00013. S2CID 70507026.
- ^ Hudes G (February 1997). "Estramustine-based chemotherapy". Semin. Urol. Oncol. 15 (1): 13–9. PMID 9050135.
- ^ a b c d Kreis W (1995). "Estramustine revisited". Cancer Treat. Res. Cancer Treatment and Research. 78: 163–84. doi:10.1007/978-1-4615-2007-8_8. ISBN 978-1-4613-5829-9. PMID 8595142.
- ^ a b c Galbraith SM, Duchesne GM (April 1997). "Androgens and prostate cancer: biology, pathology and hormonal therapy". Eur. J. Cancer. 33 (4): 545–54. doi:10.1016/S0959-8049(96)00444-3. PMID 9274433.
- ^ a b c d e f g h Michael Oettel; Ekkehard Schillinger (6 December 2012). Estrogens and Antiestrogens II: Pharmacology and Clinical Application of Estrogens and Antiestrogen. Springer Science & Business Media. pp. 540–. ISBN 978-3-642-60107-1.
- ^ a b c d e f g h i j k Index Nominum 2000: International Drug Directory. Taylor & Francis. January 2000. pp. 406–407. ISBN 978-3-88763-075-1.
- ^ a b c d e "Estramustine Uses, Side Effects & Warnings".
- ^ a b c d e f g h i j "Estracyt Capsules - Summary of Product Characteristics (SPC)". electronic Medicines Compendium. Pfizer Limited. 12 August 2013. Retrieved 8 February 2014.
- ^ Aurel Lupulescu (24 October 1990). Hormones and Vitamins in Cancer Treatment. CRC Press. pp. 40–. ISBN 978-0-8493-5973-6.
- ^ a b c Valentino Stella; Ronald Borchardt; Michael Hageman; Reza Oliyai, Hans Maag, Jefferson Tilley (12 March 2007). Prodrugs: Challenges and Rewards. Springer Science & Business Media. pp. 174–. ISBN 978-0-387-49782-2.
{{cite book}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ a b c https://www.accessdata.fda.gov/drugsatfda_docs/label/2008/018045s023lbl.pdf
- ^ Kitamura T, Suzuki M, Nishimatsu H, Kurosaki T, Enomoto Y, Fukuhara H, Kume H, Takeuchi T, Miao L, Jiangang H, Xiaoqiang L (January 2010). "Final report on low-dose estramustine phosphate (EMP) monotherapy and very low-dose EMP therapy combined with LH-RH agonist for previously untreated advanced prostate cancer". Aktuelle Urologie. 41 Suppl 1: S34–40. doi:10.1055/s-0029-1224657. PMID 20094950.
- ^ Sayed Y, Taxel P (2003). "The use of estrogen therapy in men". Curr Opin Pharmacol. 3 (6): 650–4. doi:10.1016/j.coph.2003.07.004. PMID 14644018.
- ^ a b Hedlund PO, Henriksson P (2000). "Parenteral estrogen versus total androgen ablation in the treatment of advanced prostate carcinoma: effects on overall survival and cardiovascular mortality. The Scandinavian Prostatic Cancer Group (SPCG)-5 Trial Study". Urology. 55 (3): 328–33. doi:10.1016/s0090-4295(99)00580-4. PMID 10699602.
- ^ Shimizu TS, Shibata Y, Jinbo H, Satoh J, Yamanaka H (1995). "Estramustine phosphate for preventing flare-up in luteinizing hormone-releasing hormone analogue depot therapy". Eur. Urol. 27 (3): 192–5. doi:10.1159/000475159. PMID 7541359.
- ^ a b c d Muller (19 June 1998). European Drug Index: European Drug Registrations, Fourth Edition. CRC Press. pp. 245, 454. ISBN 978-3-7692-2114-5.
- ^ Kenneth L. Becker (2001). Principles and Practice of Endocrinology and Metabolism. Lippincott Williams & Wilkins. pp. 2153–. ISBN 978-0-7817-1750-2.
- ^ Tammela T (November 2004). "Endocrine treatment of prostate cancer". J. Steroid Biochem. Mol. Biol. 92 (4): 287–95. doi:10.1016/j.jsbmb.2004.10.005. PMID 15663992. S2CID 25425351.
- ^ Cox RL, Crawford ED (December 1995). "Estrogens in the treatment of prostate cancer". J. Urol. 154 (6): 1991–8. doi:10.1016/S0022-5347(01)66670-9. PMID 7500443.
- ^ a b Lubiniecki GM, Berlin JA, Weinstein RB, Vaughn DJ (December 2004). "Thromboembolic events with estramustine phosphate-based chemotherapy in patients with hormone-refractory prostate carcinoma: results of a meta-analysis". Cancer. 101 (12): 2755–9. doi:10.1002/cncr.20673. PMID 15536625.
- ^ Fizazi K, Le Maitre A, Hudes G, Berry WR, Kelly WK, Eymard JC, Logothetis CJ, Pignon JP, Michiels S (2007). "Addition of estramustine to chemotherapy and survival of patients with castration-refractory prostate cancer: a meta-analysis of individual patient data". Lancet Oncol. 8 (11): 994–1000. doi:10.1016/S1470-2045(07)70284-X. PMID 17942366.
- ^ Petrioli R, Roviello G, Fiaschi AI, Laera L, Bianco V, Ponchietti R, Barbanti G, Francini E (October 2015). "Low-Dose Estramustine Phosphate and Concomitant Low-Dose Acetylsalicylic Acid in Heavily Pretreated Patients With Advanced Castration-Resistant Prostate Cancer". Clin Genitourin Cancer. 13 (5): 441–6. doi:10.1016/j.clgc.2015.03.004. PMID 25920994.
- ^ a b c d e f g h i j k l m n o p Gunnarsson PO, Forshell GP (June 1984). "Clinical pharmacokinetics of estramustine phosphate". Urology. 23 (6 Suppl): 22–7. doi:10.1016/S0090-4295(84)80093-X. PMID 6375076.
- ^ a b Alexander NC, Hancock AK, Masood MB, Peet BG, Price JJ, Turner RL, Stone J, Ward AJ (March 1979). "Estracyt in advanced carcinoma of the breast: a phase II study". Clin Radiol. 30 (2): 139–47. doi:10.1016/S0009-9260(79)80133-6. PMID 86404.
- ^ a b Daponte D, Sylvester R, De Pauw M, Fryszman A, Smith RM, Smith PH (August 1983). "Change in white cell count during treatment of advanced cancer of the prostate with estramustine phosphate and with stilboestrol". Br J Urol. 55 (4): 408–12. doi:10.1111/j.1464-410X.1983.tb03333.x. PMID 6349745.
- ^ a b c d e f g h i j J. Elks (14 November 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. pp. 502–503. ISBN 978-1-4757-2085-3.
- ^ a b Wang LG, Liu XM, Kreis W, Budman DR (May 1998). "Androgen antagonistic effect of estramustine phosphate (EMP) metabolites on wild-type and mutated androgen receptor". Biochem. Pharmacol. 55 (9): 1427–33. doi:10.1016/S0006-2952(97)00657-6. PMID 10076535.
- ^ a b Van Poppel H, Werbrouck PW, Baert L (1990). "Effect of estramustine phosphate on free androgens. A comparative study of the effect of orchiectomy and estramustine phosphate on free androgens in patients with prostatic cancer". Acta Urol Belg. 58 (4): 89–95. PMID 2093302.
- ^ a b c Karr JP, Wajsman Z, Kirdani RY, Murphy GP, Sandberg AA (August 1980). "Effects of diethylstilbestrol and estramustine phosphate on serum sex hormone binding globulin and testosterone levels in prostate cancer patients". J. Urol. 124 (2): 232–6. doi:10.1016/S0022-5347(17)55383-5. PMID 7190620.
- ^ Olson KB, Pienta KJ (May 2000). "Recent advances in chemotherapy for advanced prostate cancer". Curr Urol Rep. 1 (1): 48–56. doi:10.1007/s11934-000-0035-z. PMID 12084341. S2CID 31084737.
- ^ a b Daehlin L, Damber JE, von Schoultz B, Bergman B (August 1986). "The oestrogenic effects of ethinyl oestradiol/polyoestradiol phosphate and estramustine phosphate in patients with prostatic carcinoma. A comparative study of oestrogen sensitive liver proteins, gonadotrophins and prolactin". Br J Urol. 58 (4): 412–6. doi:10.1111/j.1464-410X.1986.tb09095.x. PMID 3092893.
- ^ 프레드홀름, B, 젠슨, G, 린드스코그, M, & 먼칭, J. (1974년 1월) 쥐의 DMBA 유도 유방종양 성장에 대한 에스트라마스틴 인산염(Estracyt)의 영향 Acta Pharmicalologica et Toxicologica (제35권, 페이지 28-28)에서 35 Norre Sogade, PO Box 2148, DK-1016 Cohencelf, 덴마크: Munksgaard IntPublish Ltd.
- ^ a b c Punzi JS, Duax WL, Strong P, Griffin JF, Flocco MM, Zacharias DE, Carrell HL, Tew KD, Glusker JP (March 1992). "Molecular conformation of estramustine and two analogues". Mol. Pharmacol. 41 (3): 569–76. PMID 1545778.
- ^ a b Hauser AR, Merryman R (May 1984). "Estramustine phosphate sodium". Drug Intell Clin Pharm. 18 (5): 368–74. doi:10.1177/106002808401800502. PMID 6373212. S2CID 25303747.
- ^ Tew KD, Stearns ME (1989). "Estramustine--a nitrogen mustard/steroid with antimicrotubule activity". Pharmacol. Ther. 43 (3): 299–319. doi:10.1016/0163-7258(89)90012-0. PMID 2682681.
- ^ Franco Cavalli; Stan B. Kaye; Heine H Hansen; James O Armitage; Martine Piccart-Gebhart (12 September 2009). Textbook of Medical Oncology, Fourth Edition. CRC Press. pp. 442–. ISBN 978-0-203-09289-7.
- ^ Gunnarsson O, Andersson SB, Johansson SA (1983). "The hydrolysis of estramustine phosphate; in vitro studies". Eur J Drug Metab Pharmacokinet. 8 (4): 395–402. doi:10.1007/BF03188772. PMID 6673977. S2CID 22105700.
- ^ a b Ozeki T, Takeuchi M, Suzuki M, Kitamura T, Takayanagi R, Yokoyama H, Yamada Y (October 2009). "Single nucleotide polymorphisms of 17beta-hydroxysteroid dehydrogenase type 7 gene: mechanism of estramustine-related adverse reactions?". Int. J. Urol. 16 (10): 836–41. doi:10.1111/j.1442-2042.2009.02374.x. PMID 19735314. S2CID 38350076.
- ^ a b Suzuki M, Muto S, Hara K, Ozeki T, Yamada Y, Kadowaki T, Tomita K, Kameyama S, Kitamura T (February 2005). "Single-nucleotide polymorphisms in the 17beta-hydroxysteroid dehydrogenase genes might predict the risk of side-effects of estramustine phosphate sodium in prostate cancer patients". Int. J. Urol. 12 (2): 166–72. doi:10.1111/j.1442-2042.2005.01004.x. PMID 15733111.
- ^ Gate, Laurent; Tew, Kenneth D. (2011). "Alkylating Agents". Cancer Management in Man: Chemotherapy, Biological Therapy, Hyperthermia and Supporting Measures. pp. 61–85. doi:10.1007/978-90-481-9704-0_4. ISBN 978-90-481-9703-3.
- ^ http://www.ilexmedical.com/files/PDF/Estradiol_ARC.pdf
- ^ Thorsteinn Loftsson (25 January 2014). Drug Stability for Pharmaceutical Scientists. Academic Press. pp. 77–. ISBN 978-0-12-411562-0.
- ^ S. Bernal (21 August 1997). Drug Resistance in Oncology. CRC Press. pp. 287–. ISBN 978-1-4200-0209-6.
- ^ Samuel J. Murff (20 February 2012). Safety and Health Handbook for Cytotoxic Drugs. Government Institutes. pp. 89–. ISBN 978-1-60590-705-5.
- ^ a b https://pubchem.ncbi.nlm.nih.gov/
- ^ William D. Figg; Cindy H. Chau; Eric J. Small (14 September 2010). Drug Management of Prostate Cancer. Springer Science & Business Media. pp. 402–. ISBN 978-1-60327-829-4.
- ^ I.K. Morton; Judith M. Hall (6 December 2012). Concise Dictionary of Pharmacological Agents: Properties and Synonyms. Springer Science & Business Media. pp. 114–. ISBN 978-94-011-4439-1.
- ^ "Drugs@FDA: FDA Approved Drug Products". United States Food and Drug Administration. Retrieved 29 January 2017.
- ^ Sweetman, S, ed. (12 February 2013). "Estramustine Sodium Phosphate". Martindale: The Complete Drug Reference. London, UK: Pharmaceutical Press. Retrieved 8 February 2014.
추가 읽기
- Tew KD (September 1983). "The mechanism of action of estramustine". Semin. Oncol. 10 (3 Suppl 3): 21–6. PMID 6364362.
- Hoisaeter PA, Bakke A (September 1983). "Estramustine phosphate (Estracyt): experimental and clinical studies in Europe". Semin. Oncol. 10 (3 Suppl 3): 27–33. PMID 6364363.
- Sandberg AA (September 1983). "Metabolic aspects and actions unique to Estracyt". Semin. Oncol. 10 (3 Suppl 3): 3–15. PMID 6364364.
- Haukaas SA (1984). "Immunological effects of diethylstilbestrol and estramustine phosphate". Scand J Urol Nephrol Suppl. 83: 1–32. PMID 6387896.
- Hauser AR, Merryman R (May 1984). "Estramustine phosphate sodium". Drug Intell Clin Pharm. 18 (5): 368–74. doi:10.1177/106002808401800502. PMID 6373212. S2CID 25303747.
- Sandberg AA (June 1984). "Metabolic parameters of Estracyt pertinent to its effects in prostatic cancer". Urology. 23 (6 Suppl): 11–21. doi:10.1016/S0090-4295(84)80092-8. PMID 6375075.
- Gunnarsson PO, Forshell GP (June 1984). "Clinical pharmacokinetics of estramustine phosphate". Urology. 23 (6 Suppl): 22–7. doi:10.1016/S0090-4295(84)80093-X. PMID 6375076.
- Forsgren B, Björk P (June 1984). "Specific binding of estramustine to prostatic proteins". Urology. 23 (6 Suppl): 34–8. doi:10.1016/S0090-4295(84)80095-3. PMID 6375077.
- Kalland T, Haukaas SA (June 1984). "Immunologic effects of estramustine phosphate". Urology. 23 (6 Suppl): 39–45. doi:10.1016/S0090-4295(84)80096-5. PMID 6375078.
- Høisaeter PA (June 1984). "Mode of action of Emcyt". Urology. 23 (6 Suppl): 46–8. doi:10.1016/S0090-4295(84)80097-7. PMID 6375079.
- Müntzing J, Gunnarsson K (June 1984). "Preclinical pharmacology and toxicology of estramustine phosphate". Urology. 23 (6 Suppl): 6–10. doi:10.1016/S0090-4295(84)80091-6. PMID 6375082.
- Slack NH, Murphy GP (June 1984). "Clinical toxicity and long-term results of Emcyt therapy for prostate cancer". Urology. 23 (6 Suppl): 73–7. doi:10.1016/S0090-4295(84)80103-X. PMID 6375085.
- Hedlund PO (1985). "Mode of action of estramustine phosphate in hormone dependent and hormone non-dependent prostate cancer". Prog. Clin. Biol. Res. 185A: 197–202. PMID 3898129.
- Hedlund PO (1987). "Estracyt--mode of action and clinical experience". Prog. Clin. Biol. Res. 243B: 215–9. PMID 3309981.
- Murphy GP (1987). "A current review of the clinical experience with Estracyt". Prog. Clin. Biol. Res. 243B: 221–5. PMID 3309982.
- Forsgren B (1988). "Estramustine-binding protein in rat and human prostate". Scand J Urol Nephrol Suppl. 107: 56–8. PMID 3287598.
- Tew KD, Stearns ME (1989). "Intracellular effects of estramustine (Estracyt/Emcyt)". Prog. Clin. Biol. Res. 303: 169–75. PMID 2674983.
- Tew KD, Stearns ME (1989). "Estramustine--a nitrogen mustard/steroid with antimicrotubule activity". Pharmacol. Ther. 43 (3): 299–319. doi:10.1016/0163-7258(89)90012-0. PMID 2682681.
- Könyves I (1989). "Estramustine phosphate (Estracyt) in the treatment of prostatic carcinoma". Int Urol Nephrol. 21 (4): 393–7. doi:10.1007/BF02559635. PMID 2693392. S2CID 9727646.
- Benson R, Hartley-Asp B (1990). "Mechanisms of action and clinical uses of estramustine". Cancer Invest. 8 (3–4): 375–80. doi:10.3109/07357909009012056. PMID 2207764.
- Van Poppel H, Baert L (1991). "The present role of estramustine phosphate in advanced prostate cancer". Prog. Clin. Biol. Res. 370: 323–41. PMID 1924466.
- Janknegt RA (1992). "Estramustine phosphate and other cytotoxic drugs in the treatment of poor prognostic advanced prostate cancer". Prostate Suppl. 4: 105–10. doi:10.1002/pros.2990210516. PMID 1574449. S2CID 40562112.
- Tew KD, Glusker JP, Hartley-Asp B, Hudes G, Speicher LA (December 1992). "Preclinical and clinical perspectives on the use of estramustine as an antimitotic drug". Pharmacol. Ther. 56 (3): 323–39. doi:10.1016/0163-7258(92)90023-S. PMID 1301594.
- Kreis W (1995). "Estramustine revisited". Cancer Treat. Res. Cancer Treatment and Research. 78: 163–84. doi:10.1007/978-1-4615-2007-8_8. ISBN 978-1-4613-5829-9. PMID 8595142.
- Perry CM, McTavish D (July 1995). "Estramustine phosphate sodium. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic efficacy in prostate cancer". Drugs Aging. 7 (1): 49–74. doi:10.2165/00002512-199507010-00006. PMID 7579781. S2CID 36725810.
- Hudes G (February 1997). "Estramustine-based chemotherapy". Semin. Urol. Oncol. 15 (1): 13–9. PMID 9050135.
- Bergenheim AT, Henriksson R (February 1998). "Pharmacokinetics and pharmacodynamics of estramustine phosphate". Clin Pharmacokinet. 34 (2): 163–72. doi:10.2165/00003088-199834020-00004. PMID 9515186. S2CID 1943973.
- Kitamura T (February 2001). "Necessity of re-evaluation of estramustine phosphate sodium (EMP) as a treatment option for first-line monotherapy in advanced prostate cancer". Int. J. Urol. 8 (2): 33–6. doi:10.1046/j.1442-2042.2001.00254.x. PMID 11240822. S2CID 43384150.
- Simpson, D; Wagstaff, AJ (2003). "Estramustine Phosphate Sodium". American Journal of Cancer. 2 (5): 373–390. doi:10.2165/00024669-200302050-00013. S2CID 70507026.
- Ravery V, Fizazi K, Oudard S, Drouet L, Eymard JC, Culine S, Gravis G, Hennequin C, Zerbib M (December 2011). "The use of estramustine phosphate in the modern management of advanced prostate cancer". BJU Int. 108 (11): 1782–6. doi:10.1111/j.1464-410X.2011.10201.x. PMID 21756277.
- Qin Z, Li X, Zhang J, Tang J, Han P, Xu Z, Yu Y, Yang C, Wang C, Xu T, Xu Z, Zou Q (September 2016). "Chemotherapy with or without estramustine for treatment of castration-resistant prostate cancer: A systematic review and meta-analysis". Medicine (Baltimore). 95 (39): e4801. doi:10.1097/MD.0000000000004801. PMC 5265899. PMID 27684806.
- Inoue, Takahiro (2018). "Role of Estramustine Phosphate and Other Estrogens for Castration-Resistant Prostate Cancer". Hormone Therapy and Castration Resistance of Prostate Cancer. pp. 249–256. doi:10.1007/978-981-10-7013-6_26. ISBN 978-981-10-7012-9.