아세트산아비라테론
Abiraterone acetate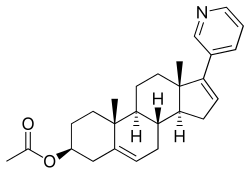 | |
 | |
| 임상 데이터 | |
|---|---|
| 발음 | a' bir a'ter one |
| 상호 | 지티가, 연사, 기타 |
| 기타 이름 | CB-7630;JNJ-212082;17-(3-피리디닐)안드로스타-5,16-디엔-3β-올아세테이트,아비라테론(BAN),아비라테론아세테이트(JAN),아비라테론아세테이트(USAN) |
| AHFS/Drugs.com | 모노그래프 |
| Medline Plus | a611046 |
| 라이선스 데이터 | |
| 임신 카테고리 |
|
| 루트 행정부. | 입으로[2][3] |
| 약물 클래스 | 항종양성 |
| ATC 코드 | |
| 법적 상태 | |
| 법적 상태 | |
| 약동학 데이터 | |
| 바이오 어베이러빌리티 | 알 수 없지만, 공복일[6] 경우 최대 50%일 수 있습니다. |
| 단백질 결합 | 애비라테론: 약 99.8% (알부민 및 [6][2][7]) |
| 대사 | 에스테라아제, CYP3A4, SLT2A1[7] |
| 대사물 | 아비라테론, 기타[2][6] |
| 반감기 제거 | 애비라테론: 12~24시간[2][6][3] |
| 배설물 | 대변: 88%[2][7] 소변: [2][7][3]5% |
| 식별자 | |
| |
| CAS 번호 |
|
| PubChem CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 첸블 | |
| CompTox 대시보드 (EPA ) | |
| ECHA 정보 카드 | 100.149.063 |
| 화학 및 물리 데이터 | |
| 공식 | C26H33NO2 |
| 몰 질량 | 391.555 g/g−1/g |
| 3D 모델(JSmol) | |
| 녹는점 | 144~145°C(291~293°F) |
| |
| |
| (표준) | |
아비라테론 아세테이트는 Zytiga라는 상표명으로 판매되고 있으며 전립선암 [9]치료에 사용되는 의약품이다.특히 전이성 거세 내성 전립선암(mCRPC) 및 전이성 고위험 거세 감수성 전립선암(mCSPC)[2][3]에 코르티코스테로이드와 함께 사용된다.고환 제거 후 또는 고나도트로핀 방출 호르몬([2]GnRH) 유사체와 함께 사용해야 합니다.입으로 [9]먹는 거예요.
일반적인 부작용으로는 피로감, 구토, 두통, 관절통, 고혈압, 붓기, 저혈중칼륨, 고혈당, 발작, 설사,[9][2] 기침 등이 있다.다른 심각한 부작용으로는 간부전과 부신피질부전이 [2]있을 수 있다.배우자가 임신할 수 있는 남성에게는 피임을 [2]권고한다.아세트산아비라테론으로 공급되어 체내에서 아비라테론으로 [2]변환됩니다.아세트산아비라테론은 안드로겐의 생성을 억제함으로써, 특히 CYP17A1을 억제함으로써 테스토스테론의 [9]생성을 감소시킵니다.이렇게 함으로써 전립선암에 [9]대한 호르몬의 영향을 예방할 수 있다.
아세트산아비라테론은 1995년에 설명되었으며,[10][2] 2011년에 미국과 유럽연합에서 의료용으로 승인되었다.그것은 세계보건기구의 필수 [11][12]의약품 목록에 있다.
의료 용도
전립선암
아세트산 아비라테론은 mCRPC(이전에는 호르몬 내성 또는 호르몬 분비성 [2][13][5][4]전립선암으로 불림) 치료제로 코르티코스테로이드인 프레드니손과 함께 사용된다.이는 안드로겐 수용체 길항제 치료나 일선 안드로겐 결핍 치료에 반응하지 않는 전립선암의 한 형태이다.아비라테론 아세테이트는 이 [2][13][5][4]표시에 대한 승인을 위해 식품의약국(FDA)(2011년 4월 28일), 유럽의약품청(EMA)(2011년 9월 23일), 의약품 및 의료제품 규제청(MHRA)(2011년 9월 5일) 및 치료용품청(TGA)(2012년 3월 1일)을 받았다.호주에서 이것은 보험 약제 이용할 때castration-resistant 전립선 암을 치료하는 그리고 prednisone/prednisolone와 조합에서 조건이 그 환자에게 현재 화학 요법을 받지 못한다면, 또는 docetaxel의 편협한 저항력이 대상이다 사용하는 것으로 덮여 있고,<>의 세계 보건 기구 성능 상태.2,PBS 보조 아비라테론 아세테이트 치료를 [14]시작한 이후 그의 병은 진행되지 않았다.)
아세트산아비라테론은 전립선암에 [15]걸린 남성의 GnRH 작용제 치료 개시 시 테스토스테론 플레어 예방에 유용할 수 있다.
이전에 Docetaxel로 치료받은 사람에서 생존 기간은 3.9개월 증가했다(위약의 [16]경우 10.9개월 대비 14.8개월).
거세-치환성 전립선암을 앓고 있지만 화학요법을 받지 않은 사람에서 아세트산아비라테론을 투여받은 사람은 플라시보 투여로 8.3개월이 아닌 16.5개월의 무진행 생존을 보였다.22.2개월의 중간 추적 기간 후, 아비라테론 아세테이트를 [17]투여했을 때 전반적인 생존이 더 좋았다.
2021년 말에 신약 조합으로 인한 극적인 개선이 발견되었다.비변형성 고위험 환자에서 ADT가 있는 Zytiga는 최근 생존율을 40+% 증가시키고 전이를 47% 감소시키는 것으로 나타났다.(https://www.renalandurologynews.com/home/news/urology/prostate-cancer/abiraterone-androgen-deprivation-reduce-prostate-cancer-metastasis-mortality/)
금지 사항
금기는 아세트산아비라테론에 대한 과민증을 포함한다.비록 서류에 임신 중이거나 [13][18]임신할 가능성이 있는 여성이 복용해서는 안 된다고 명시되어 있지만, 여성이 복용해야 할 의학적인 이유는 없다.임신한 여성은 장갑을 [18]끼지 않는 한 알약을 만지지 말아야 한다.다른 주의사항으로는 심각한 기준선 간 장애, 미네랄 피질 과다, 심부전과 고혈압을 포함한 심혈관 질환, 보정되지 않은 저칼륨혈증, 그리고 부신 피질 [19]부전이 포함된다.
부작용
매우 일반적인 (10% 이상의 주파수):
공통(1~10% 주파수):
- 고트리글리세리다혈증
- 패혈증
- 심부전
- 협심증
- 부정맥
- 심방 세동
- 빈맥
- 소화불량(소화불량)
- 발진
- 알라닌아미노전달효소 증가
- 아스파르트산아미노전달효소 증가
- 골절
- 혈뇨
일반(0.1~1%) :
희귀(0.1% 미만 주파수):
- 알레르기성 폐포
과다 복용
아비라테론 아세테이트 과다 복용 경험은 [2]제한적이다.아비라테론 아세테이트 과다 복용에 대한 특정 해독제는 없으며, 치료는 심장 및 간 [2]기능 모니터링을 포함한 일반적인 지원 조치로 구성되어야 한다.
상호 작용
아세트산아비라테론은 CYP3A4 기질이므로 케토코나졸, 이트라코나졸, 클라리트로마이신, 아타자나비르, 네파조돈, 사퀴나비르, 텔리트로마이신, 리토나비르, 인다비르피콘과 같은 강력한 CYP3A4 억제제와 동시에 투여해서는 안 된다.페노바르비탈.[19][18]또한 CYP1A2, CYP2C9 및 CYP3A4를 억제하므로 치료 지수가 좁은 [19][18]효소의 기질과 동시에 복용해서는 안 된다.
스피로노락톤은 일반적으로 항안드로겐 효과를 발휘하지만 안드로겐 결핍 환경에서 안드로겐 수용체 작용제로 작용하여 전립선암 [20]증식을 유도할 수 있다는 실험적 증거가 존재한다.이는 여러 사례 [21]보고서에 설명된 관찰에 의해 지원됩니다.
약리학
약역학


항안드로겐 활성
아세트산아비라테론의 활성대사물인 아비라테론은 17α-히드록실화효소(IC50[22][23]=2.5nM)와 17,20-리아제(=IC5015nM)의 두 가지 효소로 발현되는 CYP17A1을 억제한다(17,20-아드레날린 이상 17α-히드록실화효소 억제에 대한 선택성이 약 6배 높음).CYP17A1은 (a) 프레그네놀론 및 프로게스테론의 17α-히드록실화효소 활성에 의한 그들의 17α-히드록시 유도체로의 전환 및 (b) 각각 17,20-히드록시스테론(DHEA) [24]및 안드로스테디온의 후속 형성에 의한 두 가지 순차 반응을 촉매한다.DHEA와 안드로스테디온은 테스토스테론의 안드로겐과 전구체이다.따라서 아비라테론 아세테이트에 의한 CYP17A1 활성 억제는 DHA, 테스토스테론 및 디히드로테스토스테론(DHT)과 같은 안드로겐의 순환 수준을 감소시킨다.아비라테론 아세테이트는 아비라테론을 통해 [22][25]거세에 추가되었을 때 순환 테스토스테론 수치를 1ng/dL 미만으로 낮출 수 있는 능력이 있다.이러한 농도는 거세만으로 달성할 수 있는 농도보다 상당히 낮다(약 20 ng/[25]dL).아세트산아비라테론을 거세에만 [25]첨가하면 DHT는 85%, DHEA는 97~98%, 안드로스테디온은 77~78% 감소하는 것으로 나타났다.항안드로겐 작용에 따라 아세트산아비라테론은 전립선, 정낭 및 [26]고환의 무게를 감소시킨다.
아비라테론은 또한 안드로겐 수용체(AR)의 부분 길항제로서도 작용하며, 효소 3β-히드록시스테로이드 탈수소효소(3β-HSD), CYP11B1(스테로이드 11β-히드록실라아제), CYP21A2(스테로이드 21-히드록실라아제) 및 기타 CYP450E의 저해제로서도 작용한다.아비라테론 자체 외에도 약물의 활성 일부는 아비라테론에서 3β-HSD로 [30]형성되는 보다 강력한 활성대사물인 γ-아비라테론4(D4A)에 기인하는 것으로 밝혀졌다.D4A는 CYP17A1, 3β-히드록시스테로이드탈수소효소/II5-4 이성질화효소 및 5α-환원효소의 저해제이며, 잠재적인 길항제 엔잘루타미드에 [30]필적하는 AR의 경쟁적 길항제로서도 작용하는 것으로 확인되었다.단, D4A의 초기 5α 환원 대사물인 3-케토-5α-아비라테론은 AR의 작용제이며 전립선암 [31]진행을 촉진한다.효력이 있고 선택적인 5α 환원효소 [31]억제제인 두타스테리드의 동시 투여로 이 형성을 차단할 수 있다.
에스트로겐 활성
에스트로겐 [32]수치를 낮추는 능력 때문에 유방암 치료를 위해 아비라테론 아세테이트의 사용에 관심이 있어 왔다.그러나 아비라테론은 에스트로겐 수용체의 직접 작용제로 작용해 인체 유방암 세포의 [32]체외 증식을 유도하는 것으로 밝혀졌다.만약 아비라테론 아세테이트가 유방암 치료에 사용된다면, 그것은 풀베스트란트 [32]같은 에스트로겐 수용체 길항제들과 결합되어야 한다.아세트산아비라테론은 항안드로겐성 및 에스트로겐성 특성에도 불구하고 [33]부작용으로 여성유방증을 일으키지 않는 것으로 보인다.
기타 액티비티
글루코콜티코이드 생합성의 저해에 의해 아세트산아비라테론은 글루코콜티코이드 결핍, 미네랄콜티코이드 과다 및 [34]관련 부작용을 일으킬 수 있다.글루코콜티코이드 대체수단으로 미네랄코콜티코이드 [35]과잉을 막아주는 코르티코스테로이드인 프레드니손과 함께 복용하는 것도 이 때문이다.
아세트산아비라테론은 갈레톤과 함께 DHA 및 기타 내인성 스테로이드 및 화합물의 황화에 관여하는 술포트랜스퍼레이스(SULT2A1, SLT2B1b, SLT1E1)의i 억제제로서 확인되었으며, K 값은 아마이크로몰 [36]범위에 있다.
약동학
경구 투여 후 시판되는 프로드러그 형태인 아세트산아비라테론을 활성 형태인 아비라테론으로 변환한다.이 변환은 에스테라아제 매개일 가능성이 높으며 CYP 매개가 아닙니다.식품과 함께 투여하면 약물의 흡수가 증가하므로 노출이 증가하고 변동성이 매우 높을 수 있습니다. 약물은 음식 섭취 1시간 전 또는 2시간 후에 공복에 섭취해야 합니다.이 약물은 단백질 결합이 매우 높고(>99%), CYP3A4 및 SLT2A1에 의해 간에서 비활성 대사물로 대사된다.약물은 대변(~88%)과 소변(~5%)으로 배설되며, 말기 반감기는 12 ± 5시간이다.[18]
화학
17-(3-피리디닐)안드로스타-5,16-디엔-3β-ol 아세테이트라고도 알려진 아비라테론 아세테이트는 합성 안드로스테인 스테로이드이며, 내인성 및 로스테인 [37]페로몬인 안드로스테이드(안드로스타-5,16-디엔-3β-ol)의 유도체이다.특히 C17 위치에 피리딘 고리가 부착되고 C3β 하이드록실기에 [37]아세테이트 에스테르가 부착된 안드로스타디에놀의 유도체이다.아세트산아비라테론은 아비라테론의 [37]C3β 아세트산 에스테르이다.
역사
1990년대 초, 런던에 있는 암 연구소의 암 치료 센터를 위한 Mike Jarman, Elaine Barrie, Gerry Potter는 전립선암 치료제를 개발하기 시작했다.비스테로이드 안드로겐 합성 억제제 케토코나졸을 모델로 하여 아세트산아비라테론을 개발해 1993년 특허를 출원해 이듬해 첫 [10][38]논문을 발표했다.이 약의 상용화에 대한 권리는 영국에 본부를 둔 의료 전문 회사인 BTG에 할당되었다.이후 BTG는 쿠거 바이오테크놀로지에 이 제품을 라이선스했고, 쿠거 바이오테크놀로지는 이 제품을 [39]개발하기 시작했다.쿠가는 2009년 상용 제품을 개발해 판매하는 존슨앤드존슨에 인수돼 임상 활용 확대를 위해 [40]임상시험을 진행 중이다.
Abiraterone 아세테이트는 2011년 4월 28일 미국 식품의약국에 의해 mCRPC에 [41][42]대해 승인되었다.FDA 보도 자료에서는 아세트산 아비라테론 사용이 플라시보 사용 10.9개월에 비해 14.8개월의 중간 생존과 관련이 있는 III상 임상시험을 언급했다. 성공적인 [43]결과 때문에 연구가 조기에 중단되었다.아비라테론 아세테이트는 또한 유럽 의약품청에 [44]의해 허가되었다.2012년 5월까지 국립보건 및 임상 우수연구소(NICE)는 비용 효과의 이유로 NHS 내에서 이 약물의 사용을 권장하지 않았다.제조업체가 수정된 원가를 [45]제출했을 때 이러한 입장이 뒤바뀌었다.이 사용은 현재 이미 한 가지 독극물이 함유된 화학요법 [46][47]요법을 받은 남성으로 제한되어 있다.이후 2018년 [48]mCSPC 치료를 위해 승인되었다.
사회와 문화
이름
아비라테론은 아세테이트의 주요 활성대사물 아비라테론의 [49][50]및 및 이다.아세트산아비라테론은 아세트산아비라테론의 ,[49] 및 입니다.개발 코드명 CB-7630 및 JNJ-212082로도 알려져 있으며, CB-7598은 애비라테론의 [49][51]개발 코드명이었다.
Abiraterone 아세테이트는 Zytiga라는 브랜드명으로 [49]Jansen Biotece(Johnson & Johnson의 자회사)에 의해, Sun Pharmacical은 [49]Yonsa라는 브랜드명으로 판매되고 있습니다.
아비라테론 아세테이트의 일반 버전은 미국에서 [52]승인되었습니다.연사의 [53]일반 버전은 2019년 11월[update] 현재 제공되지 않습니다.2019년 5월 미국 연방순회항소법원은 존슨앤드존슨의 아세트산아비라테론에 [54]대한 특허를 무효로 하는 특허심판 및 항소위원회 결정을 확정했다.
인타스 제약은 Abiratas라는 브랜드로, 캐딜라 제약은 Abretone이라는 브랜드로, 글렌마크 제약은 Abirapro라는 [citation needed]브랜드로 판매한다.Sun Pharmacical Industries에서 Yonsa로 판매하고 있습니다(Churchill Pharmacuticals에서 라이선스).[55][56]
이용 가능한 폼
아세트산아비라테론은 [2][3]알약으로 사용할 수 있다.
Abiraterone 아세테이트는 미국, 캐나다, 영국, 아일랜드, 유럽, 호주, 뉴질랜드, 라틴 아메리카, 아시아 및 [49]이스라엘을 포함한 전 세계에서 널리 판매되고 있습니다.
경제학
2019년 [57]현재[update] 인도에서는 월 238달러의 가격으로 일반 버전을 구입할 수 있습니다.국립약리경제학센터는 당초 2012년 가격 기준으로 아비라테론 아세테이트가 비용 효과가 없다는 것을 발견했으나 2014년 [57][58]낮은 가격에 공급하기로 합의함에 따라 아세테이트가 받아들여졌다.2020년 [59]현재 인도에서는 월 230달러 이하의 가격으로 일반 Zytiga 버전을 구입할 수 있습니다.
조사.
Abiraterone 아세테이트는 유방암과 난소암 치료를 위해 개발 중이며, 2018년 3월 현재 이러한 [51]징후에 대한 2상 임상시험 중이다.또한 선천성 부신 과형성증 치료를 위해 조사 중이지만,[51] 이러한 잠재적 사용에 대한 추가 개발은 보고되지 않았다.
레퍼런스
- ^ "Abiraterone Use During Pregnancy". Drugs.com. 13 March 2020. Archived from the original on 25 November 2020. Retrieved 8 June 2020.
- ^ a b c d e f g h i j k l m n o p q r s t u "Zytiga- abiraterone acetate tablet, film coated". DailyMed. 13 June 2019. Archived from the original on 13 November 2014. Retrieved 15 November 2019.
- ^ a b c d e f "Yonsa- abiraterone acetate tablet". DailyMed. 5 June 2018. Archived from the original on 13 August 2020. Retrieved 15 November 2019.
- ^ a b c d "Zytiga abiraterone acetate product information" (PDF). TGA eBusiness Services. Janssen-Cilag Pty Ltd. 1 March 2012. Archived from the original on 24 November 2020. Retrieved 24 January 2014.
- ^ a b c d "Zytiga 500 mg film-coated tablets - Summary of Product Characteristics (SmPC)". electronic medicines compendium (emc). Datapharm. 4 March 2019. Archived from the original on 15 November 2019. Retrieved 15 November 2019.
- ^ a b c d Benoist GE, Hendriks RJ, Mulders PF, Gerritsen WR, Somford DM, Schalken JA, van Oort IM, Burger DM, van Erp NP (November 2016). "Pharmacokinetic Aspects of the Two Novel Oral Drugs Used for Metastatic Castration-Resistant Prostate Cancer: Abiraterone Acetate and Enzalutamide". Clin Pharmacokinet. 55 (11): 1369–1380. doi:10.1007/s40262-016-0403-6. PMC 5069300. PMID 27106175.
- ^ a b c d "Meeting Library - Meeting Library". meetinglibrary.asco.org. Archived from the original on 20 September 2016. Retrieved 9 September 2016.
- ^ Potter GA, Barrie SE, Jarman M, Rowlands MG (1995). "Novel Steroidal Inhibitors of Human Cytochrome P45017 alpha (17.alpha.-Hydroxylase-C17,20-lyase): Potential Agents for the Treatment of Prostatic Cancer". Journal of Medicinal Chemistry. 38 (13): 2463–2471. doi:10.1021/jm00013a022. ISSN 0022-2623. PMID 7608911.
- ^ a b c d e "Abiraterone Acetate Monograph for Professionals". Drugs.com. Archived from the original on 6 May 2012. Retrieved 15 November 2019.
- ^ a b Scowcroft H (21 September 2011). "Where did abiraterone come from?". Journal of Medicinal Chemistry. Cancer Research UK. 38 (13): 2463–2471. Archived from the original on 25 September 2011. Retrieved 28 September 2011.
- ^ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ World Health Organization (2021). World Health Organization model list of essential medicines: 22nd list (2021). Geneva: World Health Organization. hdl:10665/345533. WHO/MHP/HPS/EML/2021.02.
- ^ a b c d "Zytiga EPAR". European Medicines Agency (EMA). 13 March 2019. Archived from the original on 27 December 2020. Retrieved 15 November 2019.
- ^ "Pharmaceutical Benefits Scheme - Abiraterone". Pharmaceutical Benefits Scheme. Archived from the original on 2 December 2020. Retrieved 24 January 2014.
- ^ Pokuri VK, Nourkeyhani H, Betsy B, Herbst L, Sikorski M, Spangenthal E, Fabiano A, George S (July 2015). "Strategies to Circumvent Testosterone Surge and Disease Flare in Advanced Prostate Cancer: Emerging Treatment Paradigms". J Natl Compr Canc Netw. 13 (7): e49–55. doi:10.6004/jnccn.2015.0109. PMID 26150586.
- ^ de Bono JS, Logothetis CJ, Molina A, Fizazi K, North S, Chu L, Chi KN, Jones RJ, Goodman OB, Saad F, Staffurth JN, Mainwaring P, Harland S, Flaig TW, Hutson TE, Cheng T, Patterson H, Hainsworth JD, Ryan CJ, Sternberg CN, Ellard SL, Fléchon A, Saleh M, Scholz M, Efstathiou E, Zivi A, Bianchini D, Loriot Y, Chieffo N, Kheoh T, Haqq CM, Scher HI (May 2011). "Abiraterone and increased survival in metastatic prostate cancer". The New England Journal of Medicine. 364 (21): 1995–2005. doi:10.1056/NEJMoa1014618. PMC 3471149. PMID 21612468.
- ^ Ryan CJ, Smith MR, de Bono JS, Molina A, Logothetis CJ, de Souza P, Fizazi K, Mainwaring P, Piulats JM, Ng S, Carles J, Mulders PF, Basch E, Small EJ, Saad F, Schrijvers D, Van Poppel H, Mukherjee SD, Suttmann H, Gerritsen WR, Flaig TW, George DJ, Yu EY, Efstathiou E, Pantuck A, Winquist E, Higano CS, Taplin ME, Park Y, Kheoh T, Griffin T, Scher HI, Rathkopf DE (January 2013). "Abiraterone in metastatic prostate cancer without previous chemotherapy". The New England Journal of Medicine. 368 (2): 138–48. doi:10.1056/NEJMoa1209096. PMC 3683570. PMID 23228172.
- ^ a b c d e "Zytiga prescribing information" (PDF). Janssen Biotech. May 2012. Archived from the original (PDF) on 13 November 2014. Retrieved 4 March 2016.
- ^ a b c d e "Zytiga (abiraterone) dosing, indications, interactions, adverse effects, and more". Medscape Reference. WebMD. Archived from the original on 2 February 2014. Retrieved 24 January 2014.
- ^ Luthy IA, Begin DJ, Labrie F (November 1988). "Androgenic activity of synthetic progestins and spironolactone in androgen-sensitive mouse mammary carcinoma (Shionogi) cells in culture". Journal of Steroid Biochemistry. 31 (5): 845–52. doi:10.1016/0022-4731(88)90295-6. PMID 2462135.
- ^ Dhondt B, Buelens S, Van Besien J, Beysens M, De Bleser E, Ost P, Lumen N (2019). "Abiraterone and spironolactone in prostate cancer: a combination to avoid". Acta Clinica Belgica. 74 (6): 439–444. doi:10.1080/17843286.2018.1543827. PMID 30477405. S2CID 53738534.
- ^ a b Neidle S (30 September 2013). Cancer Drug Design and Discovery. Academic Press. pp. 341–342. ISBN 978-0-12-397228-6.
- ^ Fernández-Cancio M, Camats N, Flück CE, Zalewski A, Dick B, Frey BM, Monné R, Torán N, Audí L, Pandey AV (April 2018). "Mechanism of the Dual Activities of Human CYP17A1 and Binding to Anti-Prostate Cancer Drug Abiraterone Revealed by a Novel V366M Mutation Causing 17,20 Lyase Deficiency". Pharmaceuticals. 11 (2): 37. doi:10.3390/ph11020037. PMC 6027421. PMID 29710837.
- ^ Attard G, Belldegrun AS, de Bono JS (December 2005). "Selective blockade of androgenic steroid synthesis by novel lyase inhibitors as a therapeutic strategy for treating metastatic prostate cancer". BJU International. 96 (9): 1241–6. doi:10.1111/j.1464-410X.2005.05821.x. PMID 16287438. S2CID 36575315.
- ^ a b c Small EJ (November 2014). "Can targeting the androgen receptor in localized prostate cancer provide insights into why men with metastatic castration-resistant prostate cancer die?". Journal of Clinical Oncology. 32 (33): 3689–91. doi:10.1200/JCO.2014.57.8534. PMID 25311216.
Abiraterone acetate is a prodrug for abiraterone, a CYP17 inhibitor, which has the capacity to lower serum testosterone levels to less than 1 ng/dL (compared with levels closer to 20 ng/dL that are achieved with conventional ADT).19 [...] Relative to LHRHa alone, the addition of abiraterone resulted in an 85% decline in dihydrotestosterone (DHT) levels, a 97% to 98% decline in dehydroepiandrosterone (DHEA) levels, and a 77% to 78% decline in androstenedione levels.
- ^ Tindall DJ, James M (20 April 2009). Androgen Action in Prostate Cancer. Springer Science & Business Media. pp. 748–. ISBN 978-0-387-69179-4.
- ^ Yin L, Hu Q (January 2014). "CYP17 inhibitors--abiraterone, C17,20-lyase inhibitors and multi-targeting agents". Nature Reviews. Urology. 11 (1): 32–42. doi:10.1038/nrurol.2013.274. PMID 24276076. S2CID 7131777.
- ^ Malikova J, Brixius-Anderko S, Udhane SS, Parween S, Dick B, Bernhardt R, Pandey AV (November 2017). "CYP17A1 inhibitor abiraterone, an anti-prostate cancer drug, also inhibits the 21-hydroxylase activity of CYP21A2" (PDF). The Journal of Steroid Biochemistry and Molecular Biology. 174: 192–200. doi:10.1016/j.jsbmb.2017.09.007. PMID 28893623. S2CID 6270824. Archived (PDF) from the original on 4 December 2020. Retrieved 10 September 2020.
- ^ Udhane SS, Dick B, Hu Q, Hartmann RW, Pandey AV (September 2016). "Specificity of anti-prostate cancer CYP17A1 inhibitors on androgen biosynthesis". Biochemical and Biophysical Research Communications. 477 (4): 1005–1010. doi:10.1016/j.bbrc.2016.07.019. PMID 27395338.
- ^ a b Li Z, Bishop AC, Alyamani M, Garcia JA, Dreicer R, Bunch D, Liu J, Upadhyay SK, Auchus RJ, Sharifi N (July 2015). "Conversion of abiraterone to D4A drives anti-tumour activity in prostate cancer". Nature. 523 (7560): 347–51. Bibcode:2015Natur.523..347L. doi:10.1038/nature14406. PMC 4506215. PMID 26030522.
- ^ a b Li Z, Alyamani M, Li J, Rogacki K, Abazeed M, Upadhyay SK, Balk SP, Taplin ME, Auchus RJ, Sharifi N (May 2016). "Redirecting abiraterone metabolism to fine-tune prostate cancer anti-androgen therapy" (PDF). Nature. 533 (7604): 547–51. Bibcode:2016Natur.533..547L. doi:10.1038/nature17954. PMC 5111629. PMID 27225130. Archived (PDF) from the original on 4 November 2018. Retrieved 4 November 2018.
- ^ a b c Capper CP, Larios JM, Sikora MJ, Johnson MD, Rae JM (May 2016). "The CYP17A1 inhibitor abiraterone exhibits estrogen receptor agonist activity in breast cancer". Breast Cancer Research and Treatment. 157 (1): 23–30. doi:10.1007/s10549-016-3774-3. PMID 27083183. S2CID 9912289.
- ^ Alesini D, Iacovelli R, Palazzo A, Altavilla A, Risi E, Urbano F, Manai C, Passaro A, Magri V, Cortesi E (2013). "Multimodality treatment of gynecomastia in patients receiving antiandrogen therapy for prostate cancer in the era of abiraterone acetate and new antiandrogen molecules". Oncology. 84 (2): 92–9. doi:10.1159/000343821. PMID 23128186. S2CID 207547652.
- ^ Figg WD, Chau CH, Small EJ (14 September 2010). Drug Management of Prostate Cancer. Springer Science & Business Media. p. 97. ISBN 978-1-60327-829-4. Archived from the original on 22 February 2021. Retrieved 14 April 2018.
- ^ Rosenthal L, Burchum J (17 February 2017). Lehne's Pharmacotherapeutics for Advanced Practice Providers - E-Book. Elsevier Health Sciences. p. 936. ISBN 978-0-323-44779-9. Archived from the original on 22 February 2021. Retrieved 14 April 2018.
- ^ Yip CK, Bansal S, Wong SY, Lau AJ (April 2018). "Identification of Galeterone and Abiraterone as Inhibitors of Dehydroepiandrosterone Sulfonation Catalyzed by Human Hepatic Cytosol, SULT2A1, SULT2B1b, and SULT1E1". Drug Metabolism and Disposition. 46 (4): 470–482. doi:10.1124/dmd.117.078980. PMID 29436390.
- ^ a b c William Andrew Publishing (22 October 2013). Pharmaceutical Manufacturing Encyclopedia, 3rd Edition. Elsevier. pp. 12–. ISBN 978-0-8155-1856-3. Archived from the original on 8 June 2020. Retrieved 8 June 2020.
- ^ "A new way to treat prostate cancer: The story of abiraterone". The Institute of Cancer Research. 10 September 2012. Archived from the original on 9 July 2012. Retrieved 12 November 2012.
- ^ "Abiraterone Acetate (CB7630)". Cougar Biotechnology. Archived from the original on 7 September 2008. Retrieved 20 August 2008.
- ^ "Johnson & Johnson Announces Definitive Agreement to Acquire Cougar Biotechnology, Inc" (Press release). Cougar Biotechnology. 11 May 2009. Archived from the original on 29 May 2009. Retrieved 3 June 2009.
- ^ "Drugs@FDA - FDA Approved Drug Products - Zytiga". U.S. Food and Drug Administration (FDA). Archived from the original on 1 May 2017. Retrieved 4 March 2016.
- ^ "FDA approves Zytiga for late-stage prostate cancer" (Press release). Food and Drug Administration (FDA). 28 April 2011. Archived from the original on 12 January 2017.
- ^ "FDA Approval for Abiraterone Acetate". U.S. Department of Health and Human Services, National Institutes of Health, National Cancer Institute. Archived from the original on 28 July 2011. Retrieved 4 September 2011.
- ^ "EMA assessment of Zytiga (abiraterone)". European Medicines Agency. Archived from the original on 20 June 2018. Retrieved 6 July 2022.
- ^ "Prostate cancer (metastatic, castration resistant) - abiraterone (following cytoxic therapy): final appraisal determination guidance" (PDF). NICE guidance. 15 May 2012. Archived from the original (PDF) on 19 February 2013.
- ^ "NICE technology appraisal guidance [TA259]". NICE guidance. June 2012. Archived from the original on 19 February 2015. Retrieved 6 March 2015.
- ^ "NICE appraisal of earlier treatment with abiraterone for prostate cancer". NICE press release. 14 August 2014. Archived from the original on 2 April 2015. Retrieved 6 March 2015.
- ^ NCI Staff (15 February 2018). "Abiraterone Approved for Earlier Use in Men with Metastatic Prostate Cancer". National Cancer Institute (NCI). Archived from the original on 14 April 2018. Retrieved 14 April 2018.
- ^ a b c d e f "Abiraterone". Drugs.com. Archived from the original on 30 November 2014. Retrieved 14 April 2018.
- ^ "abiraterone". mednet-communities.net. Archived from the original on 29 August 2021. Retrieved 15 November 2019.
- ^ a b c "Abiraterone acetate - Johnson & Johnson". Adis Insight. Archived from the original on 20 December 2016. Retrieved 4 December 2016.
- ^ "Generic Zytiga Availability". Drugs.com. Archived from the original on 14 April 2018. Retrieved 14 April 2018.
- ^ "Generic Yonsa Availability". Drugs.com. Archived from the original on 18 November 2019. Retrieved 18 November 2019.
- ^ "BTG International Limited v. Amneal Pharmaceuticals LLC". United States Court of Appeals for the Federal Circuit. 14 May 2019. 19-1147. Archived from the original on 29 August 2021. Retrieved 17 November 2019.
- ^ "Sun Pharma Gets FDA Go-Ahead for Yonsa for Prostate Cancer". BioSpace. Archived from the original on 11 April 2019. Retrieved 16 May 2019.
- ^ "Sun Pharma Announces USFDA Approval of YONSA (abiraterone acetate) To Treat Metastatic Castration-Resistant Prostate Cancer In Combination With Methylprednisolone" (Press release). Sun Pharmaceutical Industries Limited/Churchill Pharmaceuticals. 23 May 2018. Archived from the original on 15 November 2019. Retrieved 14 November 2019 – via Business Wire.
- ^ a b "Proposal For The Inclusion Of Enzalutamide And Abiraterone Acetate In The Who Model List Of Essential Medicines For The Treatment Of Metastatic Castration Resistant Prostate Cancer" (PDF). pp. 22, 25. Archived (PDF) from the original on 29 August 2021. Retrieved 26 November 2019.
- ^ "Zytiga Generic (Abiraterone) - $250 Per Month Total Cost". Medixocentre.com. Archived from the original on 28 September 2020. Retrieved 1 August 2020.
- ^ "Abiraterone cost". India Medixo Centre. Archived from the original on 28 September 2020. Retrieved 1 August 2020.
외부 링크
- "Abiraterone acetate". Drug Information Portal. U.S. National Library of Medicine.


