지방산 합성
Fatty acid synthesis생화학에서 지방산 합성은 지방산 합성효소라고 불리는 효소의 작용을 통해 아세틸-CoA와 NADPH로부터 지방산을 생성하는 것이다.이 과정은 세포의 세포질에서 일어난다.지방산으로 전환되는 아세틸-CoA의 대부분은 해당과정을 통해 탄수화물로부터 유도된다.해당과정은 또한 세 개의 지방산이 (에스테르 결합을 통해) 결합되어 트리글리세리드(트리아실글리세롤이라고도 함)를 형성할 수 있는 글리세롤을 제공하여 지방 생성 과정의 최종 산물인 "산" 또는 단순히 "지방"과 구별합니다.두 개의 지방산만 글리세롤과 결합하고 세 번째 알코올기가 포스파티딜콜린과 같은 기와 인산화되면 인지질이 형성된다.인지질은 세포막을 구성하고 세포 내의 세포소기관(세포핵, 미토콘드리아, 소포체, 골지기구 등)을 둘러싸고 있는 지질양층층을 형성한다.
직쇄 지방산
직쇄 지방산은 포화 지방산과 불포화 지방산의 두 가지 유형으로 발생합니다.
포화 직쇄 지방산
β-산화와 마찬가지로 직쇄 지방산 합성은 16-탄소 팔미틴산이 [1][2]생성될 때까지 아래 6가지 반복 반응을 통해 이루어진다.
제시된 다이어그램은 지방산이 미생물에서 어떻게 합성되는지를 보여주고 [1]대장균에서 발견되는 효소를 나열합니다.이러한 반응은 일반적으로 하나의 복합체로 작용하는 여러 효소를 포함하는 지방산 합성효소 II(FASII)에 의해 수행된다.FASII는 미토콘드리아뿐만 아니라 원핵생물,[3] 식물, 곰팡이, 기생충에도 존재한다.
효모와 같은 일부 균류뿐만 아니라 동물에서도 이러한 같은 반응이 지방산을 만드는 데 필요한 모든 효소 활성을 가진 큰 이합체 단백질인 지방산 합성효소 I(FASI)에서 일어난다.FASII는 FASI보다 효율성이 떨어지지만, 조기 사슬 [3]종료를 통해 "중쇄" 지방산을 포함한 더 많은 분자를 형성할 수 있습니다.
16:0 탄소지방산이 형성되면 여러 가지 변형을 거쳐 탈포화 및/또는 신장될 수 있다.스테아린산염(18:0)으로 시작하는 신장은 주로 ER에서 여러 막결합 효소에 의해 이루어진다.신장 과정에 관여하는 효소 단계는 FAS에 의해 수행되는 것과 기본적으로 동일하지만, 신장 과정의 4가지 주요 연속 단계는 개별 단백질에 의해 수행되며, 이는 물리적으로 [4][5]연관될 수 있다.
| 걸음 | 효소 | 반응 | 묘사 |
|---|---|---|---|
| (a) | 아세틸 CoA:ACP 트랜스실라아제 | 말로닐-ACP와의 반응을 위해 아세틸 CoA를 활성화한다. | |
| (b) | 말로닐 CoA:ACP 트랜스실라아제 | 아세틸-ACP와의 반응을 위해 말로닐 CoA를 활성화한다. | |
| (c) | 3-케토아실-ACP합성효소 | ACP 결합 아실 사슬과 체인 확장 말로닐-ACP를 반응시킨다. | |
| (d) | 3-케토아실-ACP환원효소 | 카본3케톤을 하이드록실기로 환원한다. | |
| (e) | 3-히드록시아실 ACP탈수효소 | 물 제거 | |
| (f) | 에노일-ACP환원효소 | C2-C3 이중 결합을 줄입니다. | |
| 약어: ACP – 아실 캐리어 단백질, CoA – 코엔자임 A, NADP – 니코틴아미드 아데닌 디뉴클레오티드 인산염. | |||
지방합성 중 환원제는 NADPH인 반면, NAD는 베타 산화(지방산이 아세틸-CoA로 분해됨)의 산화제이다.이러한 차이는 NADPH가 생합성 반응 중에 소비되는 반면 NADH는 에너지 산출 [6]반응에서 생성된다는 일반적인 원리의 예이다(따라서 NADPH는 아세틸-CoA에서 콜레스테롤을 합성하는데도 필요하며, NADH는 해당과정 중에 생성된다).NADPH의 소스는 2배입니다.사과산염이 "NADP 연결 사과산 효소"에 의해 산화적으로 탈탄산되어 피루브산이 형성되면 CO2 및 NADPH가 형성된다.NADPH는 또한 포도당을 리보스로 변환하는 펜토오스 인산 경로에 의해 형성되며, 리보스는 뉴클레오티드와 핵산의 합성에 사용될 수 있으며 [6]피루브산으로 분해될 수 있다.
탄수화물의 지방산 전환
인간의 지방산은 수유 중 유선과 마찬가지로 간과 지방조직에서 주로 탄수화물로 형성된다.
해당과정에 의해 생성된 피루브산은 탄수화물이 지방산과 콜레스테롤로 [6]전환되는 중요한 매개체이다.이것은 미토콘드리아에서 피루브산이 아세틸-CoA로 변환됨으로써 발생한다.그러나, 이 아세틸 CoA는 지방산과 콜레스테롤의 합성이 일어나는 세포질로 운반되어야 한다.이것은 직접 발생할 수 없습니다.세포질 아세틸-CoA를 얻기 위해 구연산 회로에서 구연산(아세틸 CoA와 옥살아세트산)을 제거하고 미토콘드리아 내막을 통해 세포질로 [6]운반한다.여기서 그것은 ATP 구연산분해효소에 의해 아세틸-CoA와 옥살아세트산염으로 분해된다.옥살아세테이트는 (간에서) 글루코네제네이션에 사용될 수도 있고,[7] 말산염으로 미토콘드리아로 환원될 수도 있다.세포질 아세틸-CoA는 아세틸 CoA 카르복실화효소에 의해 말로닐 CoA로 카르복실화되며, 이는 지방산 [7][8]합성의 첫 번째 커밋된 단계이다.
동물은 지방산으로부터 탄수화물을 재합성할 수 없다
동물의 몸에 저장되는 주요 연료는 지방이다.젊은 성인 인간의 지방 저장량은 평균 약 15-20kg(33-44파운드)이지만, 나이, 성별, 개인의 [9]성향에 따라 크게 다릅니다.반대로, 인간의 몸은 약 400g(0.9lb)의 글리코겐만 저장하며, 그 중 300g(0.7lb)은 골격 근육 안에 잠겨서 전체적으로 사용할 수 없다.간에 저장된 글리코겐 100g(0.2lb) 정도는 [10]굶은 지 하루 만에 고갈됩니다.그 후 간에서 체조직에 의해 일반적으로 사용하기 위해 혈액으로 방출되는 포도당은 지방산을 [11]포함하지 않는 글루코겐성 아미노산 및 기타 몇 가지 글루코겐성 기질로부터 합성되어야 한다.
지방산은 미토콘드리아 내부의 베타 산화에 의해 아세틸-CoA로 분해되는 반면, 지방산은 미토콘드리아 외부의 세포질에서 아세틸-CoA로 합성된다.두 경로는 발생 위치뿐만 아니라 발생하는 반응 및 사용되는 기질에서도 구별됩니다.두 경로는 상호 억제되어 베타 산화에 의해 생성된 아세틸-CoA가 아세틸-CoA 카르복실화효소 [11]반응을 통해 합성 경로로 유입되는 것을 방지한다.또한 피루브산 탈탄산화 반응은 돌이킬 [10]수 없기 때문에 피루브산으로 전환될 수 없다.대신 옥살로아세테이트와 응축하여 구연산 회로로 들어갑니다.사이클의 각 회전 동안 2개의 탄소 원자는 이소질산탈수소효소 및 α-케토글루타르산탈수소효소에 의해 촉매되는 탈탄산화 반응에서 CO로서2 사이클을 남긴다.따라서 구연산 회로의 각 회전은 아세틸-CoA 단위를 산화시키는 동시에 아세틸-CoA가 원래 결합되어 구연산을 형성했던 옥살아세트산 분자를 재생한다.탈탄산화 반응은 사이클에서 말산이 형성되기 전에 일어난다.말산은 간이나 다른 [11]조직에서 포도당이나 글리코겐을 형성하기 위해 글루코겐 생성 경로로 들어가기 위해 미토콘드리아에서 제거될 수 있는 유일한 물질이다.그러므로 지방산이 포도당으로 순변환되는 일은 없을 것이다.
식물만이 아세틸-CoA를 옥살아세트산염으로 변환하는 효소를 가지고 있으며, 옥살아세트산염은 말산이 형성되어 궁극적으로 [11]포도당으로 전환될 수 있다.
- 규정
아세틸-CoA 카르복실화효소에 의해 아세틸-CoA가 말로닐-CoA로 형성되며, 이 때 말로닐-CoA는 지방산 합성경로에 공급된다.아세틸-CoA 카르복실화효소는 포화 직쇄 지방산 합성의 조절 지점이며, 인산화와 알로스테릭 조절을 모두 받는다.인산화 조절은 대부분 포유류에서 일어나는 반면, 알로스테릭 조절은 대부분의 유기체에서 일어난다.알로스테릭 제어는 팔미토일-CoA에 의한 피드백 억제 및 구연산염에 의한 활성화로 일어난다.포화지방산 합성의 최종 산물인 팔미토일-CoA의 농도가 높을 경우, 아세틸-CoA 카르복실화효소를 알로스테릭 불활성화하여 세포 내 지방산 축적을 방지합니다.구연산염은 높은 수치에서 아세틸-CoA 카르복실화효소를 활성화하는 역할을 하는데, 높은 수치는 크렙스 회로에 공급되고 에너지를 [12]보존하기에 충분한 아세틸-CoA가 있음을 나타내기 때문이다.
혈장 내 인슐린의 높은 혈장 수준(예: 식사 후)은 아세틸-CoA 카르복실화효소의 탈인화를 유발하여 아세틸-CoA에서 말로닐-CoA의 형성을 촉진하고 결과적으로 탄수화물의 지방산으로의 전환(기아 및 운동 중에 혈액으로 방출됨)을 일으킨다.이 효소의 인산화, 베타산 [6][8]산화를 통한 지방산 산화를 억제한다.
불포화 스트레이트 체인 지방산
혐기성 탈포화
많은 박테리아가 불포화 지방산을 합성하기 위해 혐기성 경로를 사용한다.이 경로는 산소를 이용하지 않으며 정상적인 지방산 합성 기구를 이용하여 신장하기 전에 이중 결합을 삽입하기 위해 효소에 의존합니다.대장균에서 이 경로는 잘 알려져 있다.
- FabA는 β-히드록시데카노일-ACP 탈수효소이며, 10-탄소 포화 지방산 합성 중간체(β-히드록시데카노일-ACP)에 특이적이다.
- FabA는 β-hydroxydecanoyl-ACP의 탈수를 촉매하여 물의 방출과 메틸 말단에서 C7과 C8 계수 사이의 이중 결합의 삽입을 일으킨다.이것에 의해, 트랜스-2 데세노일 중간체가 작성됩니다.
- 트랜스-2-데세노일 중간체는 FabB에 의해 정상 포화지방산 합성경로로 이행할 수 있으며 이중결합이 가수분해되어 최종생성물이 포화지방산이 되거나 FabA가 cis-3-데세노일 중간체로의 이성화를 촉매한다.
- FabB는 β-케토아실-ACP 합성효소이며, 중간생성물을 성장시켜 주요 지방산 합성 경로로 유도한다.FabB가 cis-decenoyl 중간체와 반응하면 신장 후 최종 생성물은 불포화지방산이 [13]된다.
- 만들어지는 두 가지 주요 불포화 지방산은 팔미톨레오일-ACP(16:177)와 시스-바세노일-ACP(18:177)[14]이다.
혐기성 탈포화를 겪는 대부분의 박테리아는 FabA와 FabB의 [15]상동성을 가지고 있다.클로스트리디아는 주요 예외입니다; 그것들은 시스 이중 [14]결합의 형성을 촉매하는 새로운 효소를 가지고 있습니다.
- 규정
이 경로는 FadR과 FabR에 의한 전사 조절을 거친다.FadR은 보다 광범위하게 연구된 단백질이며 2가지 기능적 특성으로 간주되어 왔다.FabA 및 FabB 전사의 활성제 및 β-산화 조절제의 억제제 역할을 한다.반대로 FabR은 fabA와 fabB의 [13]전사를 억제하는 역할을 한다.
호기성 탈포화
호기성 탈포는 불포화 지방산의 합성을 위한 가장 광범위한 경로이다.그것은 모든 진핵생물과 일부 원핵생물에 이용된다.이 경로는 불포화 지방산을 전신 포화 지방산 [16]기질로부터 합성하기 위해 불포화 지방산을 사용한다.모든 불포화효소는 산소를 필요로 하며, 비록 불포화효소가 산화 과정이지만 궁극적으로 NADH를 소비한다.불포화효소는 기질에 유도되는 이중 결합에 특이적이다.Bacillus subtilis에서 불포화효소인 δ-Des는5 δ5 위치에서 [7][16]cis-double 결합을 유도하기 위해 특이하다.사카로미세스 세레비시아에는 [7]δ에서9 cis-double 결합을 유도하는 하나의 불포화효소 Ole1p를 포함한다.
포유동물에서 호기성 탈포화는 3가지 막결합 효소(NADH-시토크롬5 b 환원효소, 시토크롬5 b 및 불포화효소)의 복합체에 의해 촉매된다.이 효소들은 분자 산소 O가
2 포화 지방 아실-CoA 사슬과 상호작용하여 이중 결합과 두 개의 물 분자
2 HO를 형성하도록 합니다.두 개의 전자는 NADH + H에서+
, 두 개의 전자는 지방산 [6]사슬의 단일 결합에서 온다.그러나 이러한 포유류의 효소는 지방산 사슬에서 C-9 이상의 탄소 원자에 이중 결합을 도입할 수 없다.[nb 1]따라서 포유류는 리놀레이트 또는 리놀렌산(C-12(= δ12) 또는 C-12 및 C-15(= δ129 및 δ15) 위치에서 각각 이중 결합을 가지며 리놀레이트로부터 유도되는 다불포화 20-탄소 아라키돈산을 합성할 수 없다.이것들은 모두 필수 지방산이라고 불리며, 이것은 유기체에 의해 요구되지만, 식단을 통해서만 공급될 수 있습니다. (아라키돈산은 국소 호르몬으로서 다양한 기능을 하는 프로스타글란딘의 전구체입니다.)[6]
홀수 사슬 지방산
홀수 사슬 지방산(OCFA)은 홀수 개수의 탄소 원자를 포함하는 지방산이다.가장 일반적인 OCFA는 포화 C15 및 C17 유도체이며, 각각 펜타데카노산과 [17]헵타데카노산이다.짝수 사슬 지방산 합성은 아세틸-CoA 전구체를 조립하여 이루어지지만, 긴 사슬 지방산과 홀수 탄소 [18]원자의 생합성을 위한 프라이머로는 아세틸-CoA 대신 프로피오닐-CoA가 사용된다.
- 규정
B. 서브틸리스에서 이 경로는 2성분 시스템에 의해 조절된다.DesK 및 DesR.DesK는 막 관련 키나제이며, DesR은 [7][16]des 유전자의 전사 조절제이다.온도 조절은 온도에 반응한다; 온도가 떨어지면, 이 유전자는 상향 조절된다.불포화 지방산은 막의 유동성을 증가시키고 낮은 온도에서 막이 안정되게 합니다.DesK는 온도가 내려가면 자동인산화하는 센서 단백질이다.DesK-P는 포스포릴기를 DesR로 이동시킨다.두 개의 DesR-P 단백질은 이합체를 형성하여 des 유전자의 DNA 촉진제에 결합하고 [7][16]전사를 시작하기 위해 RNA 중합효소를 모집할 것입니다.
히가시모나스아루기노사
일반적으로 혐기성 및 호기성 불포화지방산 합성은 동일한 계통 내에서 발생하지 않지만, Pseudomonas Aeruginosa 및 Vibrio ABE-1은 [19][20][21]예외이다.P. Aeruginosa는 주로 혐기성 탈포화를 겪지만, 두 가지 유산소 경로도 거친다.하나의 경로는 막 지질에서 이중 결합 형성을 촉매하는 δ-탈사포화효소9(DesA)를 이용한다.또 다른 경로는 포화지방산-CoA 분자에 이중 결합을 삽입하는 δ-탈포화효소로9 작용하기 위해 두 개의 단백질인 DesC와 DesB를 함께 사용한다.이 두 번째 경로는 억제 단백질 DesT에 의해 조절된다.또한 DesT는 외인성 불포화 지방산이 존재할 때 혐기성 탈포화를 위한 fabAB 발현 억제제이다.이것은 유기체 [20][22]내의 두 가지 경로의 발현을 조정하는 기능을 한다.
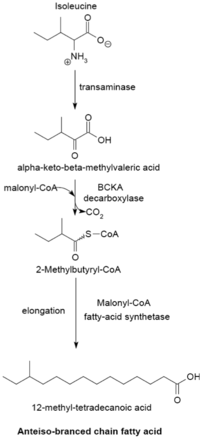
분기사슬지방산
분기된 사슬 지방산은 보통 포화 상태이며 두 개의 뚜렷한 계열인 iso-series와 preiso-series에서 발견됩니다.방선균류는 투베르쿨로스테릭산을 형성하는 것을 포함한 독특한 분기사슬 지방산 합성 메커니즘을 포함하고 있는 것으로 밝혀졌다.
분기사슬지방산합성시스템
α-케토산을 프라이머로 하는 분쇄지방산 합성 시스템.이 시스템은 짧은 사슬 아실-CoA 에스테르를 [23]프라이머로 사용하는 분기 사슬 지방산 합성효소와는 다르다.α-Keto 산성 프라이머 발린, 류신, 이소류신의 아미노기 전이와 카르복시 이탈에서 각각 2-methylpropanyl-CoA, 3-methylbutyryl-CoA, 2-Methylbutyryl-CoA을 도출한다.[24]2-Methylpropanyl-CoA 프라이머 발린에서 파생된14-methyl-pentadecanoic(isop 같은 짝수 iso-series 지방산을 생산하기 위해 길게 됩니다.알미틴)산 및 류신으로부터의 3-메틸부틸-CoA 프라이머는 13-메틸테트라데카노산 등의 홀수 번호의 이소 계열 지방산을 형성하기 위해 사용될 수 있다.이소류신으로부터의 2-메틸부틸-CoA 프라이머는 연장되어 탄소 원자의 홀수인 테트라데카노산 12-카노산 등의 전계열 지방산을 형성한다.프라이머 전구체의 탈탄산화효소는 분기사슬α-케토산탈탄산화효소(BCKA)를 통해 일어난다.지방산의 신장은 말로닐-CoA가 체인 [26]익스텐더로 사용되는 직쇄 지방산을 생성하는 데 사용되는 대장균의 생합성 경로와 동일한 경로를 따른다.주요 최종 산물은 12~17개의 탄소 분기 사슬 지방산이며, 그 구성은 많은 박테리아 [25]종에 대해 균일하고 특징적인 경향이 있다.
BCKA 탈탄산화효소 및 α-케토산 기질의 상대적 활성
BCKA 탈카르복실화효소는 사분자 구조22(AB)의 2개의 서브유닛으로 구성되며 분기 사슬 지방산의 합성에 필수적이다.발린, 류신, 이소류신의 아미노화에 의해 형성된 α-케토산의 탈탄산화를 담당하며 분기사슬 지방산 합성에 사용되는 프라이머를 생산한다.이 효소의 활성은 분기사슬 α-케토산 기질이 직선사슬 기질보다 훨씬 높으며, 바실러스 종에서 이소류신 유래 α-케토-β-메틸발레르산이 가장 높고, 이어서 α-케토이소카프로에이트와 [25][26]α-케토발레르산이 그 뒤를 잇는다.분기사슬α-케토산에 대한 효소의 높은 친화력을 통해 분기사슬 지방산 [26]합성효소의 프라이머 기증 시스템 역할을 할 수 있다.
| 기판 | BCKA 활동 | CO2 생성(nmol/min mg) | km(μM) | Vmax (nmol/min mg) |
|---|---|---|---|---|
| L-α-케토-β-메틸발라트 | 100% | 19.7 | 1 미만 | 17.8 |
| α-케토이소발라트 | 63% | 12.4 | 1 미만 | 13.3 |
| α-케토이소카프로에이트 | 38% | 7.4 | 1 미만 | 5.6 |
| 피루브산 | 25% | 4.9 | 51.1 | 15.2 |
체인 길이 및 패턴 분포에 영향을 미치는 요인
α-케토산 프라이머는 일반적으로 12~17개의 탄소 길이의 분기 사슬 지방산을 생성하는 데 사용된다.이러한 분기 사슬 지방산의 비율은 특정 세균 종에서 균일하고 일관된 경향이 있지만 말로닐-CoA 농도, 온도 또는 존재하는 [25]열안정인자(HSF)의 변화에 따라 변경될 수 있다.이러한 모든 인자는 사슬 길이에 영향을 미칠 수 있으며, HSF는 특정 α-케토산 기질에 대한 BCKA 탈탄산화효소의 특이성을 변화시켜 생성된 [25]분기 사슬 지방산의 비율을 변화시키는 것으로 입증되었다.말로닐-CoA 농도가 증가하면 말로닐-CoA의 최적 농도(m20μM)에 도달할 때까지 C17 지방산이 더 많이 생성되는 것으로 나타났다.또한 온도 저하로 인해 지방산 분포가 [23][25]바실러스 종에서 C17 지방산으로 약간 이동하는 경향이 있다.
분기사슬지방산합성효소
분기사슬 지방산 합성 시스템과 유사한 기능을 하지만 알파케토산 대신 짧은사슬 카르본산을 프라이머로 사용한다.일반적으로 이 방법은 알파케토 프라이머를 이용하여 분기사슬지방산계를 수행할 능력이 없는 세균에 의해 사용된다.대표적인 짧은 사슬 프라이머에는 이소발레이트, 이소낙산염 및 2-메틸낙산염이 있습니다.일반적으로, 이러한 프라이머에 필요한 산은 환경으로부터 흡수됩니다; 이것은 종종 반추 [27]박테리아에서 볼 수 있습니다.
전체적인 반응은 다음과 같습니다.
- 이소부틸-CoA + 6 말로닐-CoA + 12 NADPH + 12H+
→ 이소팔미트산 + 6 CO2 12 NADP + 5H2O + 7 CoA[23]
(직사슬) 지방산 합성효소와 분기사슬 지방산 합성효소의 차이는 아실-CoA와 [23]아실-ACP의 반응을 촉매하는 효소의 기질 특이성이다.
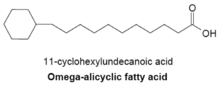
오메가 지방산
오메가 지방산은 전형적으로 오메가 말단 프로필 또는 부티릴 고리 그룹을 포함하고 여러 종류의 박테리아에서 발견되는 주요 막 지방산의 일부입니다.오메가 지방산 생성에 사용되는 지방산 합성효소는 또한 막 분기사슬 지방산 생성에도 사용된다.오메가 지방산을 주성분으로 하는 막이 있는 세균에서는 고리형 카르본산-CoA 에스테르 공급이 분기사슬 [23]프라이머보다 훨씬 많다.고리형 프라이머의 합성은 잘 알려져 있지 않지만, 메커니즘은 당을 시키미산으로 변환하는 것을 포함하며, 시키미산은 시클로헥실 카르본산-CoA 에스테르로 변환되어 오메가 지방산[27] 합성을 위한 프라이머 역할을 한다.
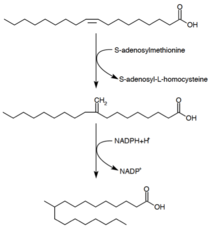
투베르쿨로스테아린산합성
투베르쿨로스테아린산(-D10-메틸스테아린산)은 마이코박테리움 spp.와 2종의 스트렙토미세스에 의해 생성되는 것으로 알려진 포화 지방산이다.그것은 전구체 올레산(단불포화지방산)[28]에서 형성된다.S-아데노실메티오닌은 올레산을 인지질로 에스테르화한 후 올레산의 [29]이중결합에 메틸기를 공여한다.이 메틸화 반응은 중간 10-메틸렌-옥타데카노얄을 형성한다.NADPH를 보조 인자로 하여 잔류물을 연속적으로 감소시키면 10-메틸스테아린산이[24] 생성된다.
「 」를 참조해 주세요.
- 필수 지방산
- 지방산 대사
- 지방산합성효소
- Thyme (데이터베이스) (2010)
각주
- ^ 지방산 내 탄소 원자의 위치는 COOH-(또는 카르복시) 말단 또는
3 -CH(또는 메틸) 말단에서 나타낼 수 있다.COOH의 끝에서 나타내는 경우는, C-1, C-2, C-3, ...(등) 표기가 사용됩니다(오른쪽 그림의 파란색 숫자, 여기서 C-1은 -COOH 탄소입니다).위치가 다른 위치인
3 -CH, 종료에서 카운트되면 위치가 θ-n 표기법(빨간색 숫자, 여기서 θ-1은 메틸카본)으로 나타난다.따라서 지방산 사슬에서 이중 결합의 위치는 C-n 또는 γ-n 표기를 사용하여 두 가지 방법으로 나타낼 수 있다.따라서 18개의 탄소지방산에서 C-12(또는 δ-7)와 C-13(또는 δ-6) 사이의 이중결합은 –COOH 말단에서 계수할 경우 δ12(또는 δ-6
3)로 보고되고, -CH 말단에서 계수할 경우 δ-6(또는 오메가-6)로 보고된다."는 그리스 문자 "델타"로, 로마 알파벳에서 "D" (이중 결합을 의미하는)로 번역된다.오메가())는 그리스 알파벳의 마지막 글자이고, 따라서 지방산 사슬에서 "마지막" 탄소 원자를 나타내기 위해 사용됩니다.γ-n 표기는 필수 지방산에서 -CH
3 말단에 가까운 이중 결합의 위치를 나타내기 위해 거의 독점적으로 사용되기 때문에, 동등한 δ-like 표기는 필요하지 않다. 즉, "γ-n" 표기의 사용은 항상 이중 결합의 위치를 의미한다.
레퍼런스
- ^ a b Dijkstra, Albert J.; Hamilton, R. J.; Hamm, Wolf (2008). "§1.4 Fatty Acid Biosynthesis". Trans Fatty Acids. Blackwell. p. 12. ISBN 9780470698075.
- ^ "MetaCyc pathway: superpathway of fatty acids biosynthesis (E. coli)". biocyc.org.
- ^ a b "Fatty Acids: Straight-chain Saturated, Structure, Occurrence and Biosynthesis". lipidlibrary.aocs.org. Lipid Library, The American Oil Chemists' Society. 30 April 2011. Archived from the original on 21 July 2011.
- ^ "MetaCyc pathway: stearate biosynthesis I (animals)". biocyc.org.
- ^ "MetaCyc pathway: very long chain fatty acid biosynthesis II". biocyc.org.
- ^ a b c d e f g Stryer, Lubert (1995). Biochemistry (Fourth ed.). New York: W.H. Freeman and Company. pp. 559–565, 614–623. ISBN 0-7167-2009-4.
- ^ a b c d e f Ferre, P.; Foufelle, F. (2007). "SREBP-1c Transcription Factor and Lipid Homeostasis: Clinical Perspective". Hormone Research. 68 (2): 72–82. doi:10.1159/000100426. PMID 17344645. Retrieved 30 August 2010.
this process is outlined graphically in page 73
- ^ a b Voet, Donald; Voet, Judith G.; Pratt, Charlotte W. (2006). Fundamentals of Biochemistry (2nd ed.). John Wiley and Sons, Inc. pp. 547, 556. ISBN 0-471-21495-7.
- ^ Sloan, A.W; Koeslag, J.H.; Bredell, G.A.G. (1973). "Body composition work capacity and work efficiency of active and inactive young men". European Journal of Applied Physiology. 32: 17–24. doi:10.1007/bf00422426. S2CID 39812342.
- ^ a b Stryer, Lubert (1995). Biochemistry (Fourth ed.). New York: W.H. Freeman and Company. pp. 581–602, 613, 775–778. ISBN 0-7167-2009-4.
- ^ a b c d Stryer, Lubert (1995). "Fatty acid metabolism". Biochemistry (Fourth ed.). New York: W.H. Freeman and Company. pp. 603–628. ISBN 0-7167-2009-4.
- ^ Diwan, Joyce J. (30 April 2011). "Fatty Acid Synthesis". Rensselaer Polytechnic Institute. Archived from the original on 7 June 2011.
- ^ a b Feng, Youjun; ECronan, John (2011). "Complex binding of the FabR repressor of bacterial unsaturated fatty acid biosynthesis to its cognate promoters". Molecular Microbiology. 80 (1): 195–218. doi:10.1111/j.1365-2958.2011.07564.x. PMC 4072462. PMID 21276098.
- ^ a b Zhu, Lei; et al. (2009). "Functions of the Clostridium acetobutylicium FabF and FabZ proteins in unsaturated fatty acid biosynthesis". BMC Microbiology. 9: 119. doi:10.1186/1471-2180-9-119. PMC 2700279. PMID 19493359.
- ^ Wang, Haihong; ECronan, John (2004). "Functional replacement of the FabA and FabB proteins of Escherichia coli fatty acid synthesis by Enterococcus faecalis FabZ and FabF homologues". Journal of Biological Chemistry. 279 (33): 34489–95. doi:10.1074/jbc.M403874200. PMID 15194690.
- ^ a b c d Mansilla MC, de Mendoza D (May 2005). "The Bacillus subtilis desaturase: a model to understand phospholipid modification and temperature sensing". Arch Microbiol. 183 (4): 229–35. doi:10.1007/s00203-005-0759-8. PMID 15711796. S2CID 26880038.
- ^ Pfeuffer, Maria; Jaudszus, Anke (2016). "Pentadecanoic and Heptadecanoic Acids: Multifaceted Odd-Chain Fatty Acids". Advances in Nutrition. 7 (4): 730–734. doi:10.3945/an.115.011387. PMC 4942867. PMID 27422507.
- ^ Smith, S. (1994). "The Animal Fatty Acid Synthase: One Gene, One Polypeptide, Seven Enzymes". The FASEB Journal. 8 (15): 1248–1259. doi:10.1096/fasebj.8.15.8001737. PMID 8001737. S2CID 22853095.
- ^ Wada M, Fukunaga N, Sasaki S (August 1989). "Mechanism of biosynthesis of unsaturated fatty acids in Pseudomonas sp. strain E-3, a psychrotrophic bacterium". J Bacteriol. 171 (8): 4267–71. doi:10.1128/jb.171.8.4267-4271.1989. PMC 210200. PMID 2753856.
- ^ a b Subramanian C, Rock CO, Zhang YM (January 2010). "DesT coordinates the expression of anaerobic and aerobic pathways for unsaturated fatty acid biosynthesis in Pseudomonas aeruginosa". J Bacteriol. 192 (1): 280–5. doi:10.1128/JB.00404-09. PMC 2798278. PMID 19880602.
- ^ Morita N, Gotoh M, Okajima N, Okuyama H, Hayashi H, Higashi S, Murata N (February 1992). "Both the anaerobic pathway and aerobic desaturation are involved in the synthesis of unsaturated fatty acids in Vibrio sp. strain ABE-1". FEBS Lett. 297 (1–2): 9–12. doi:10.1016/0014-5793(92)80316-9. PMID 1551444. S2CID 38970459.
- ^ Zhu K, Choi KH, Schweizer HP, Rock CO, Zhang YM (April 2006). "Two aerobic pathways for the formation of unsaturated fatty acids in Pseudomonas aeruginosa". Mol Microbiol. 60 (2): 260–73. doi:10.1111/j.1365-2958.2006.05088.x. PMID 16573679. S2CID 42341421.
- ^ a b c d e Kaneda T (June 1991). "Iso- and anteiso-fatty acids in bacteria: biosynthesis, function, and taxonomic significance". Microbiol Rev. 55 (2): 288–302. doi:10.1128/mr.55.2.288-302.1991. PMC 372815. PMID 1886522.
- ^ a b "Branched-chain Fatty Acids, Phytanic Acid, Tuberculostearic Acid Iso/anteiso- Fatty Acids". lipidlibrary.aocs.org. Lipid Library, The American Oil Chemists' Society. 1 May 2011. Archived from the original on 12 January 2010. Retrieved 8 March 2014.
- ^ a b c d e f Naik DN, Kaneda T (December 1974). "Biosynthesis of branched long-chain fatty acids by species of Bacillus: relative activity of three alpha-keto acid substrates and factors affecting chain length". Can J Microbiol. 20 (12): 1701–8. doi:10.1139/m74-263. PMID 4155346.
- ^ a b c Oku H, Kaneda T (December 1988). "Biosynthesis of branched-chain fatty acids in Bacillus subtilis. A decarboxylase is essential for branched-chain fatty acid synthetase". J Biol Chem. 263 (34): 18386–96. doi:10.1016/S0021-9258(19)81371-6. PMID 3142877.
- ^ a b Christie, William W. (5 April 2011). "Fatty Acids: Natural Alicyclic Structures, Occurrence, and Biochemistry" (PDF). lipidlibrary.aocs.org. Lipid Library, The American Oil Chemists' Society. Archived from the original (PDF) on 21 July 2011. Retrieved 2 May 2011.> 。
- ^ Ratledge, Colin; Stanford, John (1982). Physiology, identification and classification. The Biology of the Mycobacteria. Academic. ISBN 9780125823012. OCLC 248050385.
- ^ Kubica, George P.; Wayne, Lawrence G. (1984). The Mycobacteria: a Sourcebook. Dekker. ISBN 9780824719173.
외부 링크
- 렌셀라 폴리테크닉 인스티튜트의 개요
- 인디애나 주립대학교의 개요