피루브산탈수소효소
Pyruvate dehydrogenase| 피루브산탈수소효소(피루브산탈수소효소) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
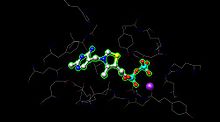
 피루브산탈수소효소(PDH)의 결정학적 구조.PH는 다른 색상으로 나타나는 α(파란색), α'(노란색), β(빨간색) 및 β'(청록색) 영역을 가진 6개의 도메인 이합체이다.티아민 피로인산염(TPP)은 회색 볼과 막대 형태로 나타나며, 보라색 중 마그네슘 이온 2개는 TPP와 금속 결속 중이고,[1] 주황색 중 칼륨 이온 2개는 칼륨 이온이다. | |||||||||
| 식별자 | |||||||||
| EC 번호 | 1.2.4.1 | ||||||||
| CAS 번호 | 9014-20-4 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 엔트리 | ||||||||
| ExPASy | NiceZyme 뷰 | ||||||||
| 케그 | KEGG 엔트리 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| 프라이머리 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBum | ||||||||
| 진 온톨로지 | AmiGO / QuickGO | ||||||||
| |||||||||
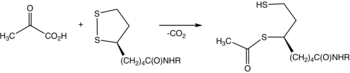
피루브산탈수소효소는 피루브산과 리포아미드의 반응을 촉매하여 아세틸화디히드로리포아미드와 이산화탄소를 생성하는 효소이다.변환에는 코엔자임 티아민 피로인산이 필요하다.
피루브산탈수소효소는 일반적으로 피루브산탈수소효소복합체(PDC)의 구성 요소로서 E1로 언급된다.PDC는 E2 및 E3로 불리는 다른 효소로 구성됩니다.E1-E3는 집합적으로 피루브산+, NAD, 조효소 A를 아세틸-CoA, CO2 및 NADH로 변환한다.아세틸-CoA는 세포 [2]호흡을 수행하기 위해 구연산 회로에서 사용될 수 있기 때문에 전환이 중요하다.이 효소와 PDC를 구별하기 위해 계통적으로 피루브산 탈수소효소(아세틸 전달)라고 한다.
메커니즘
티아민 피로인산염(TPP)은 탈양성자에 의해 일라이드로 전환된다.일라이드는 피루브산의 케톤기를 공격한다.그 결과 부가물은 탈탄산화된다.생성된 1,3-다이폴은 환원적으로 리포아미드-E2를 [2]아세틸화한다.
E1의 생화학 및 구조데이터는 보존된 수소결합을 글루탐산잔기(인간 E1의 글루59)로 형성하고 아미노피리미딘의 N4' 원자를 티아졸륨 C2 원자분자 내 수소결합에 가져오는 V-conformation을 부여함으로써 TPP 코엔자임 활성화 메커니즘을 밝혀냈다.TPP의 이 독특한 컨택과 컨피규레이션 조합은 결국 반응성 C2-카르바니온의 형성으로 이어집니다.보조인자 TPP가 피루브산을 탈탄산화한 후 아세틸부분은 TPP에 [1]공유결합된 히드록시에틸유도체가 된다.
구조.
E1은 다량체 단백질이다.인간 E1을 포함한 포유류 E1은 2개의 α 서브유닛과 [1]2개의 β 서브유닛으로 구성된 4중합체이다.대장균의 E1을 포함한 일부 박테리아 E1은 각각 α와 β의 [3]분자량 합만큼 큰 두 개의 유사한 서브 유닛으로 구성된다.
활성 사이트
E1은 2개의 촉매 부위를 가지며, 각각 보조 인자로 티아민 피로인산(TPP)과 마그네슘 이온을 제공한다.α 서브유닛은 마그네슘 이온과 피로인산 단편을 결합하고, β 서브유닛은 TPP의 피리미딘 단편을 결합하여 서브유닛의 [1]계면에서 촉매 부위를 형성한다.
피루브산 탈수소효소 활성 부위(PDB: 1NI4)는 마그네슘 이온(보라색 구)에 대한 금속 결합과 아미노산에 대한 수소 결합을 통해 TPP를 유지한다.활성부위에는 20개 이상의 아미노산이 존재하지만 활성부위에는 아미노산 Tyr 89, Arg 90, Gly 136, Val 138, Asp 167, Gly 168, Ala 169, Asn, 196 및 His 263이 실제로 수소결합에 관여하여 TPP와 피루브산(여기에는 표시되지 않음)을 보유한다.아미노산은 와이어로 표시되며 TPP는 볼과 스틱 형태입니다.활성 부위는 또한 TPP의 아실이 E2에서 [1]대기하는 리포아미드로 전달되는 데 도움이 됩니다.
규정
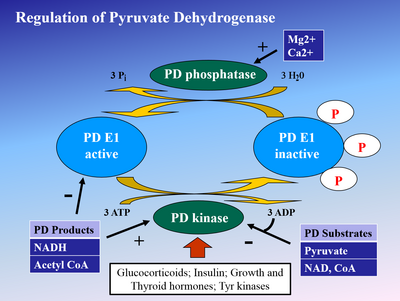
피루브산탈수소효소인산화효소(PDK)에 의한 E1의 인산화효소는 E1을 불활성화하고, 이어서 전체 복합체를 불활성화시킨다.디클로로아세트산과 피루브산에 의해 PDK가 억제되어 보다 많은 양의 활성 비인산 PDH가 [4]생성된다. 인산화는 인슐린, PEP 및 AMP에 의해 자극되지만 ATP, NADH 및 아세틸-CoA에 의해 경쟁적으로 억제되는 피루브산 탈수소효소 포스파타아제에 의해 역전된다.
병리학
피루브산 탈수소효소는 항미토콘드리아 항체(AMA)로 알려진 자가항원에 의해 표적이 되며, 이는 간의 작은 담관을 점진적으로 파괴하여 원발성 담도 간경화를 초래한다.이 항체들은 염증성 면역 반응에서 비롯된 산화 단백질을 인식하는 것으로 보인다.한 연구에서 급성 간부전 환자의 50% 이상이 조직 트랜스글루타미나제에 [5]대한 비미토콘드리아 자가항체를 나타냈기 때문에 이러한 염증 반응 중 일부는 글루텐 민감도와 관련이 있을 수 있다.기타 미토콘드리아 자가항체로는 항미토콘드리아 항체에 의해 인식되는 항원 옥소글루타르산탈수소효소 및 분기사슬 알파케토산탈수소효소복합체가 있다.
피루브산탈수소효소(PDH) 활성 증가는 노화를 [6]촉진할 뿐만 아니라 종양유도 세포 노화를 일으킬 수 있다.연령에 따른 미토콘드리아 PDH의 활동 감소는 심장뿐만 아니라 뇌의 특정 부위(조형물과 뇌간)[6]에서도 나타났다.
피루브산탈수소효소(PDH) 결핍증은 X 염색체에 위치한 피루브산탈수소효소복합체(PDC)의 돌연변이에 의해 발생하는 선천성 퇴행성 대사 질환이다.복합체의 세 가지 효소 모두에서 결함이 확인되었지만, E1-α 서브유닛이 주된 원인입니다.PDH 결핍에 의한 구연산 사이클의 이상에 의해 체내의 에너지가 상실되어 젖산염의 비정상적인 축적을 초래한다.PDH 결핍은 신생아의 젖산증의 일반적인 원인이며 심각한 무기력, 영양 부족, 빈호흡, 사망 사례가 종종 발생한다.[7]
예
피루브산탈수소효소 활성을 가진 인간 단백질은 다음과 같다.
|
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
관련 효소
박테리아에는 피루브산의 산화를 아세트산 및 이산화탄소로 연결하는 피루브산 탈수소효소(피루브산 산화효소, EC 1.2.2.2)의 형태가 존재한다.대장균에서 이 효소는 수두 B 유전자에 의해 암호화되며 단백질은 플라빈 보조 [8]인자를 가지고 있다.이 효소는 유산소 [9]조건 하에서 대장균의 성장 효율을 높입니다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c d e PDB: 1ni4;Ciszak EM, Korotchkina LG, Dominiak PM, Sidhu S, Patel MS (June 2003). "Structural basis for flip-flop action of thiamin pyrophosphate-dependent enzymes revealed by human pyruvate dehydrogenase". J. Biol. Chem. 278 (23): 21240–6. doi:10.1074/jbc.M300339200. PMID 12651851.
- ^ a b J. M. Berg; J. L. Tymoczko, L. Stryer (2007). Biochemistry (6 ed.). Freeman. ISBN 978-0-7167-8724-2.
{{cite book}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Arjunan P, Nemeria N, Brunskill A, Chandrasekhar K, Sax M, Yan Y, et al. (April 2002). "Structure of the pyruvate dehydrogenase multienzyme complex E1 component from Escherichia coli at 1.85 A resolution". Biochemistry. 41 (16): 5213–21. doi:10.1021/bi0118557. PMID 11955070.
- ^ Jaimes, R 3rd (Jul 2015). "Functional response of the isolated, perfused normoxic heart to pyruvate dehydrogenase activation by dichloroacetate and pyruvate". Pflügers Arch. 468 (1): 131–42. doi:10.1007/s00424-015-1717-1. PMC 4701640. PMID 26142699.
- ^ Leung PS, Rossaro L, Davis PA, et al. (2007). "Antimitochondrial antibodies in acute liver failure: Implications for primary biliary cirrhosis". Hepatology. 46 (5): 1436–42. doi:10.1002/hep.21828. PMC 3731127. PMID 17657817.
- ^ a b Veech RL, Bradshaw PC, King MT (2017). "Ketone bodies mimic the life span extending properties of caloric restriction". IUBMB Life. 69 (5): 305–314. doi:10.1002/iub.1627. PMID 28371201.
- ^ eMedicine에서의 피루브산탈수소효소복합체결핍증
- ^ Recny MA, Hager LP (1982). "Reconstitution of native Escherichia coli pyruvate oxidase from apoenzyme monomers and FAD". J. Biol. Chem. 257 (21): 12878–86. doi:10.1016/S0021-9258(18)33597-X. PMID 6752142.
- ^ Abdel-Hamid AM, Attwood MM, Guest JR (2001). "Pyruvate oxidase contributes to the aerobic growth efficiency of Escherichia coli". Microbiology. 147 (Pt 6): 1483–98. doi:10.1099/00221287-147-6-1483. PMID 11390679.
- Ochoa S (1954). "Enzymic mechanisms in the citric acid cycle". Advances in Enzymology and Related Areas of Molecular Biology. Advances in Enzymology and Related Subjects of Biochemistry. Advances in Enzymology - and Related Areas of Molecular Biology. Vol. 15. pp. 183–270. doi:10.1002/9780470122600.ch5. ISBN 9780470122600. PMID 13158180.
- Scriba P, Holzer H (1961). "Gewinnung von alphaHydroxyathyl-2-thiaminpyrophosphat mit Pyruvatoxydase aus Schweineherzmuskel". Biochem. Z. 334: 473–486.
- Perham RN (2000). "Swinging arms and swinging domains in multifunctional enzymes: catalytic machines for multistep reactions". Annual Review of Biochemistry. 69 (1): 961–1004. doi:10.1146/annurev.biochem.69.1.961. PMID 10966480.
외부 링크
- 피루브산+미국 국립의학도서관의 탈수소효소-E1(MeSH) 제목
- http://www.brookscole.com/chemistry_d/templates/student_resources/shared_resources/animations/pdc/pdc.html
- PDBe-KB는 인간 피루브산 탈수소효소(리포아미드) 알파 1에 대한 PDB에서 사용 가능한 모든 구조 정보에 대한 개요를 제공합니다.
- PDBe-KB는 인간 피루브산 탈수소효소(리포아미드) 베타에 대한 PDB에서 사용 가능한 모든 구조 정보에 대한 개요를 제공합니다.