단백질 카타볼리즘
Protein catabolism분자생물학에서 단백질 카타볼리즘은 단백질이 작은 펩타이드로 분해되고 궁극적으로 아미노산으로 분해되는 것이다. 단백질 분자증은 소화 과정의 주요 기능이다. 단백질 카타볼리즘은 종종 단백질을 폴리펩타이드로 변환하는 펩신으로부터 시작된다. 그리고 나서 이 폴리펩타이드들은 더욱 분해된다. 인간에서 췌장 단백질은 트립신, 키모트립신, 그리고 다른 효소를 포함한다. 장에서는 작은 펩타이드들이 혈류로 흡수될 수 있는 아미노산으로 분해된다. 이렇게 흡수된 아미노산은 아미노산 포타볼리즘을 겪을 수 있는데, 거기서 에너지원으로 활용되거나 새로운 단백질의 전구체로 활용된다.[1]
카타볼리즘에 의해 생성되는 아미노산은 새로운 단백질을 형성하기 위해 직접 재활용되거나, 다른 아미노산으로 변환되거나, 아미노산 카타볼리즘을 거쳐 크렙스 사이클을 통해 다른 화합물로 변환될 수 있다.[2]
다른 사이클과의 인터페이스
단백질 카타볼리즘은 세포의 에너지 수요를 충족시키기 위해 박테리아 단백질을 형성하거나 산화시키는 아미노산을 생성한다. 아미노산에 대한 여러 분해 과정으로는 탈염(아미노 그룹의 제거), 트랜스아미션(아미노 그룹의 전달), 데카복실화(카복실 그룹의 제거), 탈수(수소 제거) 등이 있다. Krebs/Citric Acid(TCA) 사이클의 연료로 처리할 수 있는 분해된 아미노산.[2]
단백질 분해
단백질 분해는 단백질 분해와 다르다. 단백질은 세포의 정상적인 작동의 일부로서 일상적으로 생산되고 파괴된다. 단백질 합성을 조절하는 데 도움이 되는 단백질인 전사 인자는 그러한 분해의 대상이다. 그들의 열화는 세포의 에너지 수요에 크게 기여하지 않는다.[3] 유비퀴틴(유비퀴틴)의 첨가는 프로테아솜을 통해 분해되는 단백질을 나타낸다.[4]
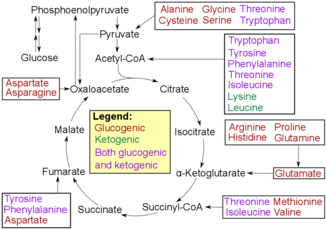
아미노산 분해
산화 제염은 아미노산을 분해하여 당으로 변환할 수 있도록 하는 첫 번째 단계다. 이 과정은 아미노산의 아미노 그룹을 제거하는 것으로 시작된다. 아미노군은 소실되면서 암모늄이 되고, 후에 요소 순환을 거쳐 간에서 요소요소가 된다. 그런 다음 혈류로 배출되어 신장으로 전달되어 요인을 소변으로 분비하게 된다.[5][6] 아미노산의 나머지 부분은 산화되어 알파케토산이 생긴다. 그런 다음 알파 케토산은 에너지를 생산하기 위해 TCA 사이클로 진행될 것이다. 이 산은 또한 글리콜리시스에도 들어갈 수 있으며, 그곳에서 결국 화농산염으로 변환될 것이다. 그런 다음 피루베이트는 아세틸-CoA로 변환되어 TCA 사이클로 들어가 원래의 피루베이트 분자를 ATP 또는 유기체에 사용할 수 있는 에너지로 변환할 수 있다.[7]
경화작용은 탈염과 같은 결과를 초래한다: 나머지 산은 글리콜리시스나 TCA 사이클을 거치면서 유기체의 신체가 다양한 용도로 사용할 에너지를 생산하게 될 것이다. 이 과정은 암모늄으로 변환될 아미노 그룹을 잃는 대신 아미노 그룹을 전달한다. 아미노 그룹은 알파-케토글루타레이트(alpha-ketoglutarate)로 전이되어 글루타민산(glutamate)으로 변환될 수 있다. 그리고 글루탐산염은 아미노 그룹을 옥살로아세트로 옮긴다. 이 전달은 옥살로아세테이트가 아스파테이트나 다른 아미노산으로 변환될 수 있도록 하기 위한 것이다. 결국 이 제품도 산화성 제염으로 진행돼 TCA 사이클을 거치게 될 알파케토산 알파케토산과 결국 요소 사이클을 거치게 되는 암모늄을 다시 한 번 생산하게 된다.[8]
트랜스아미노산은 트랜스아미션에서 일어나는 반응을 촉진시키는 효소다. 그들은 글루탐산염과 같은 원래 아미노산으로부터 알파-케토글루타산염으로 아미노군이 옮겨지는 지점에서 반응을 촉진시키는 데 도움을 주고, 또 다른 알파-케토아시드로 옮기기 위해 그것을 붙잡고 있다.[8]
단백질 반감기를 결정하는 요인
전반적인 비율을 결정하는 주요 요인으로는 단백질 반감기, pH, 온도 등이 있다.
단백질 반감기는 단백질의 강박증의 첫 단계를 지정하기 때문에 전반적인 비율을 결정하는 데 도움이 된다. 이 단계가 짧은지 긴지에 따라 나머지 신진대사 과정에도 영향을 미칠 것이다. 단백질 반감기를 결정하는 데 있어 한 가지 핵심 요소는 N-end 규칙에 기초한다. 이것은 단백질의 N-terminus에 존재하는 아미노산이 단백질의 반감기를 결정하는 데 도움이 된다고 말한다.[9]
추가 읽기
- Bojkowska, Karolina; Santoni de Sio, Francesca; Barde, Isabelle; Offner, Sandra; Verp, Sonia; Heinis, Christian; Johnsson, Kai; Trono, Didier (2011-06-24). "Measuring In Vivo Protein Half-Life". Chemistry & Biology. 18 (6): 805–815. doi:10.1016/j.chembiol.2011.03.014. PMID 21700215.
참고 항목
참조
- ^ Gurina, Tatyana S.; Mohiuddin, Shamim S. "Biochemistry, Protein Catabolism".
- ^ a b Bauman, Robert W.; Machunis-Masuoka, Elizabeth; Tizard, Ian R. (2004-01-01). Microbiology. Pearson/Benjamin Cummings. ISBN 9780805376524.
- ^ Cooper, G. M.; Sunderland, M. A. "Protein Degradation".
- ^ Kimura Y, Tanaka K (June 2010). "Regulatory mechanisms involved in the control of ubiquitin homeostasis". Journal of Biochemistry. 147 (6): 793–8. doi:10.1093/jb/mvq044. PMID 20418328.
- ^ "26.9: The Catabolism of Proteins". Chemistry LibreTexts. 2014-06-19. Retrieved 2016-10-25.
- ^ "Oxidative Deamination". chemistry.elmhurst.edu. Retrieved 2016-10-25.
- ^ "GLYCOLYSIS AND THE KREBS CYCLE". homepage.smc.edu. Retrieved 2016-11-08.
- ^ a b Miles, Bryant (April 9, 2003). "Protein Catabolism" (PDF). Archived from the original (PDF) on August 12, 2014.
- ^ Tasaki, Takafumi; Sriram, Shashikanth M.; Park, Kyong Soo; Kwon, Yong Tae (2012-06-04). "The N-End Rule Pathway". Annual Review of Biochemistry. 81 (1): 261–289. doi:10.1146/annurev-biochem-051710-093308. ISSN 0066-4154. PMC 3610525. PMID 22524314.