뉴클레오티드
Nucleotide| 시리즈의 일부 |
| 유전학 |
|---|
 |
뉴클레오티드는 뉴클레오시드와 인산염으로 이루어진 유기 분자입니다.그들은 핵산 중합체 – 디옥시리보핵산과 리보핵산의 단량체 역할을 하는데, 둘 다 지구상의 모든 생명체에서 필수적인 생체 분자입니다.뉴클레오티드는 식단에서 얻어지고 간에서 [1]일반적인 영양소로부터 합성된다.
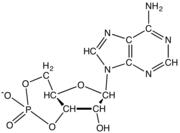
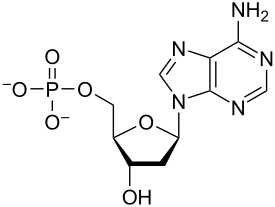
뉴클레오티드는 뉴클레오베이스, 5개의 탄소당(리보스 또는 디옥시리보스), 1개에서 3개의 인산염기로 이루어진 3개의 서브유닛 분자로 구성되어 있다.DNA의 네 가지 핵염기는 구아닌, 아데닌, 시토신, 티민이다. RNA에서는 티민 대신 우라실이 사용된다.
뉴클레오티드는 또한 기본적인 세포 수준에서 신진대사의 중심 역할을 합니다.그들은 아미노산, 단백질 및 세포막 합성을 포함한 많은 세포 기능을 위해 세포 전체에 화학 에너지(뉴클레오시드 삼인산, 아데노신 삼인산(ATP), 구아노신 삼인산(GTP), 시티딘 삼인산(CTP) 및 우리딘 삼인산(UTP)의 형태로 세포와 세포막 합성을 이동)를 제공한다.세포분열 [2]등또한 뉴클레오티드는 세포 시그널링(사이클릭 구아노신 일인산 또는 cGMP 및 고리형 아데노신 일인산 또는 cAMP)에 참여하고 효소 반응의 중요한 보조 인자(예를 들어 코엔자임 A, FAD, FMN, NAD 및 NADP+)에 통합된다.
실험 생화학에서 뉴클레오티드는 방사성핵종을 사용하여 방사성핵종을 생성해 방사상 라벨을 붙일 수 있다.
5-아크리드는 종종 효모 [3]추출물의 형태로 우마미 맛을 높이기 위해 식품 첨가물로 향미 증진제에 사용된다.
구조.
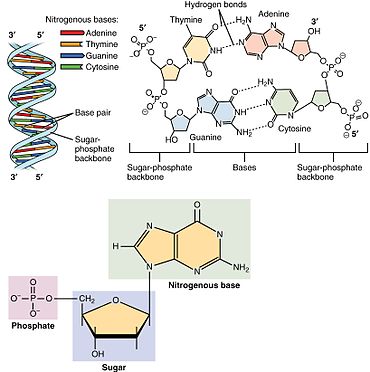
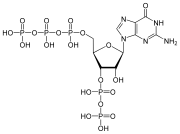
뉴클레오티드는 세 개의 구별되는 화학 서브 유닛으로 구성되어 있습니다: 5개의 탄소 당 분자, 핵염기(둘 다 뉴클레오사이드라고 불림), 그리고 하나의 인산염기로 구성됩니다.세 가지가 모두 결합된 상태에서, 뉴클레오티드는 인산기를 구성하는 인산염의 수에 따라 "뉴클레오시드 일인산", "뉴클레오시드 이인산" 또는 "뉴클레오시드 삼인산"으로도 불린다.
이 설탕 또는 설탕 디옥시리보오스는 deoxyribonucleotides 리보 오스는 핵산에서 nucleotides.[푸린과 피리미딘 base—i.e 있지만 이nucleobase 분자, 또한 질소 base—and로 알려진 ribonucleotides이라 칭해 진다.개인 인산 분자로 반복해서 핵산의 뉴클레오티드 각각 긴 사슬로 단말 간 연결하는 인접한 두 nucleotide 각각의 sugar-ring 분자를 연결한다.설탕과 인산 분자의 이 chain-joins 아니면 더블로 하시겠어요 주로 단선 또는 2선인 나선을 위한 'backbone의 가닥을 만들어 낸다.어떤 한 가닥에서 chain-joins의 화학적 오리엔테이션(지향성)은 5'말단에서3'-end 설탕 분자에 인접한 뉴클레오티드의 5개 탄소 사이트에(:5prime-end에 3prime-end을 읽)—referring에 뛰어간다.은 이중 나선에서 이 두 가닥을 서로 반대 방향을 향하는 base-pairs, 이 모든 것 또는을 옮겨 인코드 된 정보가 DNA에서 발견된 복제를 위해서 필수적이다 사이에 기지 짝 짓기와 상호 보완성을 허가해 지향하도록 합니다.
핵산은 핵산의 단량체인 뉴클레오티드에서 조립된 고분자 고분자이다.퓨린 염기인 아데닌과 구아닌과 피리미딘 염기인 시토신은 DNA와 RNA 모두에서 발생하는 반면, 피리미딘 염기인 티민과 유라실은 단 한 가지에서만 발생합니다.아데닌은 2개의 수소 결합을 가진 티민과 염기쌍을 형성하고, 구아닌은 3개의 수소 결합을 가진 시토신과 쌍을 이룬다.
핵산 중합체를 구성하기 위한 구성 요소일 뿐만 아니라, 단일 뉴클레오티드는 세포 에너지 저장 및 공급, 세포 신호 전달, 단백질 및 다른 신호 분자의 활성을 조절하는 데 사용되는 인산염기 공급원 및 종종 산화 환원 반응을 수행하는 효소 보조 인자로서 역할을 한다.시그널링 고리형 뉴클레오티드는 인산기를 같은 당분자에 2회 결합시켜 당의 [2]5'- 및 3'- 수산화기를 브리징함으로써 형성된다.일부 시그널링 뉴클레오티드는 표준 단일인산기 구성과 다르며,[4] 여러 인산기가 설탕의 다른 위치에 부착되어 있다.뉴클레오티드 보조인자는 니코틴아미드 및 플라빈을 포함한 글리코시드 결합을 통해 당에 부착된 광범위한 화학기를 포함하며, 후자의 경우 리보오스당은 다른 뉴클레오티드에서 볼 수 있는 고리를 형성하기보다는 선형이다.

합성
뉴클레오티드는 시험관내 및 생체내 모두에서 다양한 방법으로 합성될 수 있다.
시험관내에서는 뉴클레오티드의 실험실 생산 중에 보호기를 사용할 수 있다.정제된 뉴클레오시드를 보호하여 형광아미다이트를 생성하고, 이를 이용하여 자연에서 발견되지 않는 유사체를 얻거나 올리고뉴클레오티드를 합성할 수 있다.
생체 내에서는 뉴클레오티드가 신규로 합성되거나 회수 [1]경로를 통해 재활용될 수 있다.de novo nucleotide 합성에 사용되는 성분은 탄수화물 및 아미노산 대사의 생합성 전구체 및 암모니아와 이산화탄소로부터 파생됩니다.최근에는 세포 중탄산염 [5]대사가 mTORC1 시그널링에 의해 조절될 수 있다는 사실도 입증되었다.간은 네 개의 뉴클레오티드를 모두 합성하는 주요 기관이다.피리미딘과 퓨린의 데노보 합성은 두 가지 다른 경로를 따른다.피리미딘은 먼저 세포질 중 아스파르트산 및 카르바모일-인산으로부터 인산화 리보실 유닛이 공유결합된 공통 전구체 고리구조 오로틴산으로 합성된다.그러나 푸린은 고리 합성이 일어나는 당 템플릿에서 먼저 합성된다.예를 들어 푸린뉴클레오티드와 피리미딘뉴클레오티드의 합성은 특정 소기관 내가 아니라 세포질 내의 여러 효소에 의해 이루어진다.뉴클레오티드는 새로운 뉴클레오티드를 생성하기 위해 합성 반응에 유용한 부분이 재사용될 수 있도록 분해된다.
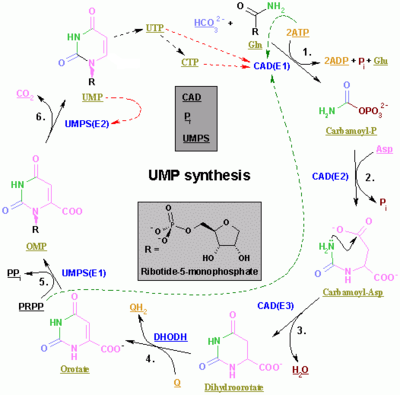
피리미딘리보뉴클레오티드합성
피리미딘 CTP와 UTP의 합성은 세포질에서 일어나 글루타민과 CO로부터2 카르바모일 인산염의 형성과 함께 시작된다.다음으로 아스파르트산카르바모일전달효소는 아스파르트산과 인산카르바모일과의 축합반응을 촉매하여 카르바모일아스파르트산을 형성하고 디히드로타아제에 의해 4,5-디히드로오로틴산으로 환산된다.후자는 디히드로오로틴산산화효소에 의해 오로틴산염으로 변환된다.최종 반응은 다음과 같습니다.
- (S)-디히드로오로테이트 + O2 → 오로테이트 + HO22
오로테이트는 인산화 리보실 단위와 공유 결합된다.리보스와 피리미딘 사이의 공유 결합은 피로인산을 포함하는 리보스 단위의 위치1[6] C와1 피리미딘 고리의 N에서 발생합니다.오로틴산 포스포리보실전달효소(PRP 전이효소)는 오로티딘 일인산(OMP)을 생성하는 순 반응을 촉매한다.
- 오로틴산+5-포스포α-D-리보스1-인산(PRPP)→오로티딘5'-인산+피로인산
오로티딘5'-1인산은 오로티딘5'-인산탈탄산화효소에 의해 탈탄산화되어 우리딘1인산(UMP)을 형성하고, PRPP전달효소는 리보실화 반응과 탈탄산화 반응을 모두 촉매하여 PRPP 존재 하에서 오로티딘산으로부터 UMP를 형성한다.다른 피리미딘 뉴클레오티드가 유도되는 것은 UMP로부터이다.UMP는 ATP와의 두 가지 순차적 반응을 통해 두 가지 키나아제로부터 우리딘3인산(UTP)으로 인산화된다.먼저 UDP에서 이인산이 생성되고, UTP는 UTP로 인산화됩니다. 두 단계는 모두 ATP 가수분해에 의해 촉진됩니다.
- ATP + UMP → ADP + UDP
- UDP + ATP → UTP + ADP
이어서 CTP 합성효소의 촉매 활성에 의한 UTP의 아미노화에 의해 CTP가 형성된다.글루타민은 NH 공여체이며3, 반응은 ATP 가수분해에도 의해 촉진된다.
- UTP + 글루타민 + ATP2 + HO → CTP + ADP + Pi
CMP(Cytidine monophosphate)는 CTP(Cytidine triphosphate)로부터 유도되며, 이후 2개의 [7][8]인산염이 손실된다.
푸린리보뉴클레오티드합성
퓨린 뉴클레오티드를 만드는 데 사용되는 원자는 다양한 소스로부터 나옵니다.
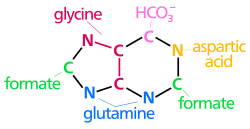 | 푸린 고리 원자의 생합성 기원 N은1 Asp의 아민기에서 발생한다. C와28 C는 포름산염에서 생성된다. N과39 N은 Gln의 아미드 그룹에 의해 기여된다. C4, C5 및7 N은 글리로부터 유도된다. C는6 HCO(CO2)에서3− 옵니다. |
이들 전구체가 퓨린 고리에 포함된 퓨린 뉴클레오티드의 탈노보 합성은 염기성 하이포산틴의 뉴클레오티드인 분기점 중간 IMP로 가는 10단계 경로를 통해 진행된다.AMP와 GMP는 이후 별도의 2단계 경로를 통해 이 중간체로부터 합성된다.따라서 푸린 부분은 처음에는 유리 염기가 아닌 리보뉴클레오티드의 일부로 형성된다.
6개의 효소가 IMP 합성에 관여한다.그 중 3개는 다기능입니다.
PRPS1은 PRPP의 형성과 함께 시작되는데, PRPS1은 주로 펜토스 인산 경로에서 형성되는 R5P를 ATP와 반응시켜 PRPP로 활성화시키는 효소이다.이 반응은 피로인산기가 ATP에서 R5P의1 C로 직접 전달되고 생성물이 C1에 대한 α 구성을 갖는다는 점에서 특이하다.이 반응은 Trp, His 및 피리미딘 뉴클레오티드의 합성을 위한 경로와도 공유된다.주요 대사 기로에 서 있고 많은 에너지가 필요하기 때문에 이 반응은 고도로 조절됩니다.
퓨린뉴클레오티드생합성에 고유한 첫 번째 반응에서 PPAT는 글루타민(N), 글리신(N&C), 아스파르트산(N), 엽산(C1) 또는2 CO로부터 기증된 아미드 질소에 의해 PRPP의 피로인산기i(PP)의 치환을 촉매한다.이것은 푸린 합성의 헌신적인 단계이다.리보오스1 C에 대한 배치가 역전되면서 반응이 일어나 β-5-포스포스포리보실아민(5-PRA)을 형성하고 미래 뉴클레오티드의 아노머 형태를 확립한다.
다음으로 ATP 가수분해에 의해 연료 공급되는 글리신을 배합하고 카르복실기는 앞서 도입한 NH에2 아민 결합을 형성한다.다음으로 치환된 글리신의 아미노기에 엽산조엔자임 N-포르밀-THF로부터의10 1탄소 단위를 첨가한 후 이미다졸 고리를 닫는다.다음으로 글루타민에서 글리신 단위의 제1탄소로 제2의2 NH기를 이동시킨다.글리신 단위의 제2탄소의 카르복실화를 병용한다.이 새로운 탄소는 세 번째2 NH 단위를 추가하여 수정되며, 이번에는 아스파르트산 잔류물에서 이동된다.마지막으로 포밀-THF로부터의 제2의 1탄소 단위를 질소기에 첨가하고, 고리를 공유적으로 닫아 공통의 푸린 전구체 이노신 일인산(IMP)을 형성한다.
이노신 일인산은 2단계에서 아데노신 일인산염으로 전환된다.우선 GTP 가수분해는 아데닐로숙신산합성효소에 의해 IMP에 아스파르트산염의 첨가를 촉진하고, 질소 대신 카르보닐산소를 치환하여 중간 아데닐로숙신산을 형성한다.그 후 푸마르산은 아데노신 일인산염으로 분해된다.이 단계는 아데닐숙신산염 분해효소에 의해 촉매된다.
이노신1인산은 크산틸레이트를 형성하는 IMP의 산화에 의해 구아노신1인산염으로 변환되며, 이어서 아미노기를 C에2 삽입한다.NAD는+ 산화반응에서의 전자수용체이다.글루타민으로부터의 아미드기 전달은 ATP 가수분해에 의해 촉진된다.
피리미딘 및 푸린 분해
사람의 경우 피리미딘 고리(C, T, U)는 CO와 NH3(요소 배설)로2 완전히 분해될 수 있다.그러나 푸린환(G, A)은 할 수 없다.대신 대사 불활성 요산으로 분해되어 체내에서 배출됩니다.요산은 GMP가 염기성 구아닌과 리보스로 분해될 때 형성된다.구아닌은 크산틴으로 탈아미네이트되고 크산틴은 요산으로 산화된다.이 마지막 반응은 되돌릴 수 없습니다.마찬가지로 AMP를 리보오스 단위가 제거된 IMP로 탈아미네이트 했을 때 요산을 형성할 수 있다.하이포산틴은 크산틴으로 산화되고 마지막으로 요산으로 산화된다.요산 분비 대신 구아닌과 IMP를 PRP와 아스파르트산(NH 공여체)의3 존재 하에서 재활용 및 핵산 합성에 사용할 수 있다.
뉴클레오티드의 생물전합성
생명의 기원에 대한 이론은 그럴듯한 사전 생물 조건 하에서 생명체의 핵심 구성 요소를 형성할 수 있는 화학적 경로에 대한 지식을 요구한다.RNA 세계 가설은 원시 수프 안에 리보뉴클레오티드가 존재했다고 주장하는데, 리보뉴클레오티드는 RNA를 형성하기 위해 직렬로 결합하는 기본 분자들이다. RNA와 같은 복잡한 분자들은 반응성이 물리 화학 작용에 의해 지배되는 작은 분자들로부터 생겨났을 것이다.RNA는 퓨린과 피리미딘 뉴클레오티드로 구성되는데, 이 두 가지 모두 신뢰할 수 있는 정보 전달에 필요하며, 따라서 다윈의 진화에 필요하다.Becker 등은 피리미딘 뉴클레오시드가 작은 분자와 리보오스로부터 어떻게 습식 [9]건조 사이클에 의해서만 합성될 수 있는지를 보여주었다.푸린뉴클레오시드는 유사한 경로를 통해 합성될 수 있다.또한 5'-모노 및 디인산염은 인산염 함유 미네랄에서 선택적으로 형성되며, 푸린염기와 피리미딘염기 양쪽에서 폴리리보뉴클레오티드를 동시에 형성할 수 있다.따라서 푸린과 피리미딘 RNA 구성 블록에 대한 반응 네트워크는 단순한 대기 또는 화산 [9]분자에서 시작하여 확립될 수 있습니다.
부자연스러운 베이스 페어(UBP)
부자연 염기쌍(UBP)은 실험실에서 생성되고 [10]자연에서는 발생하지 않는 DNA의 설계 서브유닛(또는 핵염기)이다.예를 들어 d5SICS 및 dNaM이 있습니다.소수성 핵산염을 가진 이러한 인공 뉴클레오티드는 DNA에서 ([11][12]d5SICS-dNaM) 복합체 또는 염기쌍을 형성하는 두 개의 융합 방향족 고리를 특징으로 한다. 대장균은 여러 세대를 [13]통해 UBP를 포함하는 플라스미드를 복제하도록 유도되었다.이것은 살아있는 유기체가 확장된 유전자 코드를 따라 다음 [11][14]세대에 전달되는 최초의 알려진 사례이다.
합성 뉴클레오티드의 의료 응용
몇몇 뉴클레오티드 유도체들은 간염과 [15][16]HIV에 대한 항바이러스제로 사용되어 왔다.Tenofovir disoproxil, Tenofovir alafenamide 및 Sofosbuvir는 간염에 사용되는 NRTI의 예이다.예를 들어, 메리시타빈, 라미부딘, 엔테카비르, 텔비부딘과 같은 특정 약물은 뉴클레오사이드이지만, 그것들은 인산화 과정을 통해 생물 활성 뉴클레오티드 형태로 대사된다.
길이 단위
뉴클레오티드(약칭 "nt")는 단일 가닥 핵산의 일반적인 길이 단위이며, 염기쌍이 이중 가닥 핵산의 길이 단위인 것과 유사하다.
퇴화 베이스의 약어 코드
IUPAC는 뉴클레오티드의 [17]기호를 지정했다.5개의 베이스(A, G, C, T/U)와는 별도로, 특히 PCR 프라이머를 설계하기 위해 축퇴 베이스가 사용되는 경우가 많다.이 뉴클레오티드 코드는 다음과 같습니다.일부 프라이머 배열은 또한 비표준 뉴클레오티드 이노신을 코드하는 문자 "I"를 포함할 수 있다.이노신은 tRNA에서 발생하며 아데닌, 시토신 또는 티민과 짝을 이룬다.단, 이 문자는 퇴화를 나타내지 않기 때문에 다음 표에 나타나지 않습니다.이노신은 퇴행성 "D"와 유사한 기능을 할 수 있지만, 필요한 각각의 가능한 쌍을 포함하는 뉴클레오티드의 혼합의 표현이라기 보다는 실제 뉴클레오티드이다.
| 기호[17] | 묘사 | 표시된 베이스 | ||||
|---|---|---|---|---|---|---|
| A | 아데닌 | A | 1 | |||
| C | 시토신 | C | ||||
| G | 구아닌 | G | ||||
| T | 티민 | T | ||||
| U | 우라실 | U | ||||
| W | 약하다 | A | T | 2 | ||
| S | 강렬. | C | G | |||
| M | 아미노 | A | C | |||
| K | 케토 | G | T | |||
| R | 푸린 | A | G | |||
| Y | 피리미딘 | C | T | |||
| B | A가 아니다(B는 A 뒤에 온다) | C | G | T | 3 | |
| D | C가 아님(D는 C 뒤에 있음) | A | G | T | ||
| H | G가 아님(H는 G 뒤에 있음) | A | C | T | ||
| V | T가 아님(V는 T와 U 뒤에 있음) | A | C | G | ||
| N | 임의의 베이스(갭이 아님) | A | C | G | T | 4 |
「 」를 참조해 주세요.
레퍼런스
- ^ a b Zaharevitz DW, Anderson LW, Malinowski NM, Hyman R, Strong JM, Cysyk RL (November 1992). "Contribution of de-novo and salvage synthesis to the uracil nucleotide pool in mouse tissues and tumors in vivo". European Journal of Biochemistry. 210 (1): 293–6. doi:10.1111/j.1432-1033.1992.tb17420.x. PMID 1446677.
- ^ a b Alberts B, Johnson A, Lewis J, Raff M, Roberts K & Walter P(2002).세포분자생물학 (제4판)갈랜드 사이언스ISBN 0-8153-3218-1. 페이지 120~121.
- ^ Abd El-Aleem, Fatma Sh; Taher, Mohamed S.; Lotfy, Shereen N.; El-Massry, Khaled F.; Fadel, Hoda H. M. (2017-12-18). "Influence of extracted 5-nucleotides on aroma compounds and flavour acceptability of real beef soup". International Journal of Food Properties. 20 (sup1): S1182–S1194. doi:10.1080/10942912.2017.1286506. S2CID 100497537.
- ^ Smith, A. D., ed. (2000). Oxford Dictionary of Biochemistry and Molecular Biology, Revised edition. Oxford: Oxford University Press. p. 460.
- ^ Ali E, Liponska A, O'Hara B, Amici D, Torno M, Gao P, Asara J, Yap M-N F, Mendillo M, Ben-Sahra I (June 2022). "The mTORC1-SLC4A7 axis stimulates bicarbonate import to enhance de novo nucleotide synthesis". Molecular Cell. 82 (1): 1–15. doi:10.1016/j.molcel.2022.06.008.
- ^ 탄소 잔류물 번호 부여에 대한 자세한 내용은 IUPAC 유기화학 명명법 참조
- ^ Jones ME (1980). "Pyrimidine nucleotide biosynthesis in animals: genes, enzymes, and regulation of UMP biosynthesis". Annual Review of Biochemistry. 49 (1): 253–79. doi:10.1146/annurev.bi.49.070180.001345. PMID 6105839.
- ^ McMurry JE, Begley TP (2005). The organic chemistry of biological pathways. Roberts & Company. ISBN 978-0-9747077-1-6.
- ^ a b Becker, Sidney; Feldmann, Jonas; Wiedemann, Stefan; Okamura, Hidenori; Schneider, Christina; Iwan, Katharina; Crisp, Antony; Rossa, Martin; Amatov, Tynchtyk; Carell, Thomas (2019-10-04). "Unified prebiotically plausible synthesis of pyrimidine and purine RNA ribonucleotides" (PDF). Science. 366 (6461): 76–82. doi:10.1126/science.aax2747. PMID 31604305. S2CID 203719976.
- ^ Malyshev DA, Dhami K, Quach HT, Lavergne T, Ordoukhanian P, Torkamani A, Romesberg FE (July 2012). "Efficient and sequence-independent replication of DNA containing a third base pair establishes a functional six-letter genetic alphabet". Proceedings of the National Academy of Sciences of the United States of America. 109 (30): 12005–10. Bibcode:2012PNAS..10912005M. doi:10.1073/pnas.1205176109. PMC 3409741. PMID 22773812.
- ^ a b Malyshev DA, Dhami K, Lavergne T, Chen T, Dai N, Foster JM, Corrêa IR, Romesberg FE (May 2014). "A semi-synthetic organism with an expanded genetic alphabet". Nature. 509 (7500): 385–8. Bibcode:2014Natur.509..385M. doi:10.1038/nature13314. PMC 4058825. PMID 24805238.
- ^ Callaway E (May 7, 2014). "Scientists Create First Living Organism With 'Artificial' DNA". Nature News. Huffington Post. Retrieved 8 May 2014.
- ^ Fikes BJ (May 8, 2014). "Life engineered with expanded genetic code". San Diego Union Tribune. Retrieved 8 May 2014.
- ^ Sample I (May 7, 2014). "First life forms to pass on artificial DNA engineered by US scientists". The Guardian. Retrieved 8 May 2014.
- ^ Ramesh, Deepthi; Vijayakumar, Balaji Gowrivel; Kannan, Tharanikkarasu (December 2020). "Therapeutic potential of uracil and its derivatives in countering pathogenic and physiological disorders". European Journal of Medicinal Chemistry. 207: 112801. doi:10.1016/j.ejmech.2020.112801. PMID 32927231. S2CID 221724578.
- ^ Ramesh, Deepthi; Vijayakumar, Balaji Gowrivel; Kannan, Tharanikkarasu (12 February 2021). "Advances in Nucleoside and Nucleotide Analogues in Tackling Human Immunodeficiency Virus and Hepatitis Virus Infections". ChemMedChem. 16 (9): 1403–1419. doi:10.1002/cmdc.202000849. PMID 33427377. S2CID 231576801. Retrieved 13 March 2021.
- ^ a b Nomenclature Committee of the International Union of Biochemistry (NC-IUB) (1984). "Nomenclature for Incompletely Specified Bases in Nucleic Acid Sequences". Retrieved 2008-02-04.
추가 정보
- Sigel A, Operschall BP, Sigel H (2017). "Chapter 11. Complex Formation of Lead(II) with Nucleotides and Their Constituents". In Astrid S, Helmut S, Sigel RK (eds.). Lead: Its Effects on Environment and Health. Metal Ions in Life Sciences. Vol. 17. de Gruyter. pp. 319–402. doi:10.1515/9783110434330-011. ISBN 9783110434330. PMID 28731304.
- Freisinger, E. & Sigel, R. K. (2007)뉴클레오티드에서 리보자임까지 - 이들의 금속 이온 결합 특성 비교.Coordination Chemistry Reviews, 251(13-14), 1834-1851.
외부 링크
- 핵산, 폴리뉴클레오티드 및 그 성분(IUPAC)의 약어 및 기호
- 2004년 잠정 권장사항(IUPAC)
- 뉴클레오티드 구조의 화학적 설명