에폭시드
Epoxide에폭시드는 3원자 고리를 가진 고리형 에테르이다.이 고리는 정삼각형에 가깝고, 이는 다른 에테르보다 더 팽팽하고, 따라서 반응성이 매우 높습니다.그것들은 많은 어플리케이션에서 대규모로 생산된다.일반적으로, 저분자량의 에폭시드는 무색 무극성으로 [1]종종 휘발성이 있다.
명명법
에폭시드 관능기를 포함하는 화합물은 에폭시, 에폭시, 옥시란 및 에톡실린이라고 할 수 있다.단순 에폭시드는 종종 산화물이라고 불린다.따라서 에틸렌(CH)의24 에폭시드는 산화 에틸렌(CHO)이다24.많은 화합물들은 간단한 이름을 가지고 있다. 예를 들어, 산화 에틸렌은 "옥시란"이라고 불린다.일부 이름은 1,2-헵텐 산화물이라고도 할 수 있는 화합물 1,2-에폭시헵탄과 같이 에폭시드 관능기의 존재를 강조한다.
에폭시드 전구체로 형성된 폴리머를 에폭시라고 하지만, 이러한 물질은 에폭시기를 포함하지 않습니다(또는 수지 생성 과정에서 반응하지 않은 일부 잔류 에폭시기만 포함합니다).
합성
산업적으로 지배적인 에폭시드는 에틸렌옥사이드와 프로필렌옥사이드로,[2] 각각 연간 약 1500만 톤과 300만 톤의 규모로 생산됩니다.
알케인의 불균일 촉매 산화
에틸렌의 에폭시드는 산소와 반응한다.1974년에 제안된[3] 반응 메커니즘에 따르면 에틸렌 산화물로 변환되는 6개마다 최소 1개의 에틸렌 분자가 완전히 산화됩니다.
- 722 HC = CH + 62 O → 624 CHO + 2 CO22 + 2 HO
산소와 알케인의 직접적인 반응은 이 에폭시드에만 유용하다.일반적으로 변형된 이종 은 촉매가 사용됩니다.[4]다른 알켄은 프로필렌도 유용하게 반응하지 못하지만 TS-1이 지원하는 Au 촉매는 [5]프로필렌 에폭시화를 선택적으로 수행할 수 있습니다.
유기과산화물 및 금속촉매를 이용한 올레핀(알켄)산화
산화 에틸렌을 제외하고, 대부분의 에폭시드는 단일 산소 원자를 제공하는 과산화물 함유 시약으로 알케인을 처리함으로써 생성됩니다.유기 과산화물은 자연 분해되거나 심지어 연소되기 쉽기 때문에 이러한 반응에 대한 안전 고려사항이 가중됩니다.
금속 착체는 과산화수소 및 알킬 하이드로페록시드를 포함하는 에폭시드에 유용한 촉매이다.더 친전자적인 과옥시카르본산은 금속 촉매의 개입 없이 알켄을 에폭시드로 변환합니다.특수한 용도에서는 디메틸디옥시란과 같은 다른 과산화물 함유 시약이 사용된다.반응 메커니즘 및 알켄 시작 물질의 형상에 따라 시스 및/또는 트랜스 에폭시드 디아스테레오머를 형성할 수 있다.또, 개시 재료에 다른 스테레오 중심이 존재하는 경우는, 에폭시화의 입체 화학에 영향을 줄 수 있다.금속 촉매 에폭시드는 Tert-Butyl hydroperoxide(TBHP)[6]를 사용하여 처음 연구되었다.TBHP와 금속(M)의 결합에 의해 무어기를 포함한 활성 금속 과산화 복합체가 생성되고, 무어기는 O 중심을 [7]알켄으로 전달합니다.
유기 과산화물은 프로필렌에서 프로필렌 산화물을 생산하는 데 사용됩니다.촉매도 필요합니다.산소원으로는 [8]t-부틸히드로페옥시드와 에틸벤젠히드로페옥시드를 사용할 수 있다.
페르옥시카르본산을 이용한 올레핀 과산화
보다 전형적으로 실험실 운영에서는 프릴레자예프 반응이 사용된다.[9][10]이 접근법은 알켄을 m-CPBA와 같은 과산화산으로 산화시키는 것을 포함한다.예를 들어 과벤조산과 함께 스티렌을 [11]산화스티렌으로 에폭시드화하는 것이 해당된다.
이 반응은 일반적으로 "나비날개 메커니즘"[12]으로 알려진 것을 통해 진행됩니다.과산화물은 친전자성 물질로, 알켄은 친핵 물질로 여겨진다.반응은 일치된 것으로 간주됩니다(아래 메커니즘의 수치는 단순화를 위한 것입니다).버터플라이 메커니즘은 C-C Pi 전자가 [13]공격할 수 있도록 O-O 시그마 별 궤도의 이상적인 위치를 제공합니다.2개의 결합이 파괴되어 에폭시드 산소에 형성되기 때문에, 이것은 정식으로 Coarctate 전이 상태의 한 예이다.
하이드로페록시드는 샤프리스 에폭시화 및 야콥센 에폭시화와 같은 촉매 에난티오 선택적 에폭시화에도 사용된다.이러한 반응은 Si 에폭시화와 함께 키랄 에폭시드의 에난티오 선택적 합성에 유용하다.옥사지리딘 시약은 알케인으로부터 에폭시드를 생성하는 데도 사용될 수 있다.
균질 촉매 비대칭 에폭시화
아렌산화물은 시토크롬 P450에 의한 아렌의 산화의 중간체이다.프로키랄렌(나프탈렌, 톨루엔, 벤조산염, 벤조피렌)의 경우 에폭시드가 높은 에난티오선택성으로 얻어지는 경우가 많다.
키랄 에폭시드는 종종 프로키랄 알케인으로부터 에난티오선택적으로 유도될 수 있다.많은 금속 복합체가 활성 촉매를 제공하지만, 가장 중요한 것은 티타늄,[14][15] 바나듐, 몰리브덴입니다.
샤프리스 에폭시화 반응은 대표적인 에난티오 선택적 화학 반응 중 하나이다.1차 [16][17]및 2차 알리알코올로부터 2,3-에폭시알코올을 제조하는 데 사용됩니다.
분자내N S2 치환
이 방법은 탈수로 할로겐화를 수반한다.이것은 윌리엄슨 에테르 합성의 변형이다.이때 알콕시드 이온이 염화물을 분자 내에서 치환한다.전구 화합물은 할로히드린이라고 불리며 알켄의 [19]할로하이드화를 통해 생성될 수 있습니다.프로필렌 클로로히드린을 시작으로 전 세계 프로필렌 산화물의 공급 대부분은 이 [8]경로를 통해 발생합니다.
분자내 에폭시드 형성 반응은 다르젠스 반응의 주요 단계 중 하나이다.
존슨-코리-차이코프스키 반응에서 에폭시드는 카르보닐기와 술포늄 일라이드로부터 생성된다.이 반응에서 염화물 대신 술포늄이 이탈군이다.
친핵성 에폭시화
에논 및 아크릴 유도체 등의 전자결핍 올레핀은 과산화물 등의 친핵성 산소화합물을 사용하여 에폭시화할 수 있다.반응은 2단계 메커니즘입니다.먼저 산소는 안정화된 카르바니온을 제공하기 위해 친핵성 결합첨가를 실시한다.그런 다음 이 카르보니온은 에폭시드 고리를 닫기 위해 동일한 산소 원자를 공격하여 이탈 그룹을 이동시킵니다.
생합성
에폭시드는 자연에서 드물다.그것들은 보통 시토크롬 P450의 [20]작용에 의해 알케인의 산소화를 통해 발생한다. (그러나 신호 전달 [21]분자로 작용하는 단수명 에폭시이코사트리엔산도 참조).및 유사한 에폭시도코사펜타엔산 및 에폭시이코사테트라엔산).
반응
고리를 여는 반응은 에폭시드의 반응성을 지배한다.
핵친위물의 가수분해 및 첨가
에폭시드는 알코올, 물, 아민, 티올, 그리고 심지어 할로겐화물과 같은 광범위한 핵 친화물과 반응합니다.에폭시드는 종종 거의 동일한 두 공격 부위에서 "주변 기질"[22]의 예입니다.비대칭 에폭시드의 고리 개방 반응의 위치선택성은 조건에 민감하며, 이 반응의 부류는 에폭시 접착제와 글리콜의 [18]생산의 기초이다.
중합 및 올리고머화
에폭시드의 중합은 폴리에테르를 만든다.예를 들어, 에틸렌옥시드가 중합되어 폴리에틸렌옥시드로도 알려진 폴리에틸렌글리콜이 생성됩니다.알코올 또는 페놀과 산화 에틸렌의 반응인 에톡실화는 계면활성제를 [23]생산하는 데 널리 사용됩니다.
- ROH + n CHO24 → R(OCH24)nOH
무수물과 함께 에폭시드는 폴리에스테르를 [24]만든다.
탈산소
에폭시드는 호산화성 시약을 사용하여 탈산소화할 수 있다.이 반응은 구성 [25]손실 또는 유지로 진행될 수 있습니다.육염화 텅스텐과 n-부틸리튬의 조합으로 [26]알켄이 생성됩니다.
기타 반응
- 수소화 알루미늄 또는 수소화 알루미늄과 함께 에폭시드를 환원하면 해당 [27]알코올이 생성됩니다.이 환원 과정은 수소화물(H−)의 친핵성 첨가에서 비롯된다.
- 에폭시드의 환원분열은 β-리티오알콕시드를 [28]생성한다.
- 육염화 텅스텐과 n-부틸리튬을 통한 환원 작용은[29] 알켄을 생성한다.
- 에폭시드는 고리 팽창 반응을 일으키는데, 이는 이산화탄소를 삽입하여 순환 탄산을 생성하는 것으로 설명된다.
- 티오 요소로 처리될 때, 에폭시드는 티아란이라고 불리는 에피술피드로 변환됩니다.
사용하다
산화 에틸렌은 에톡실화에 의해 세제 및 계면활성제를 생성하는 데 널리 사용된다.그것의 가수분해는 에틸렌 글리콜을 생성한다.또한 의료 기구 및 재료의 멸균에도 사용됩니다.
에폭시드와 아민의 반응은 에폭시 접착제 및 구조 재료의 형성의 기초가 된다.대표적인 아민경화제는 트리에틸렌테트라민(TETA)이다.
안전.
에폭시드는 알킬화제이며, 그 중 다수는 매우 [31]독성이 강합니다.
「 」를 참조해 주세요.
레퍼런스
- ^ Guenter Sienel; Robert Rieth; Kenneth T. Rowbottom. "Epoxides". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a09_531.
- ^ Siegfried Rebsdat; Dieter Mayer. "Ethylene Oxide". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a10_117.
- ^ Kilty P. A.; Sachtler W. M. H. (1974). "The mechanism of the selective oxidation of ethylene to ethylene oxide". Catalysis Reviews: Science and Engineering. 10: 1–16. doi:10.1080/01614947408079624.
- ^ Sajkowski, D. J.; Boudart, M. (1987). "Structure Sensitivity of the Catalytic Oxidation of Ethene by Silver". Catalysis Reviews. 29 (4): 325–360. doi:10.1080/01614948708078611.
- ^ Nijhuis, T. Alexander; Makkee, Michiel; Moulijn, Jacob A.; Weckhuysen, Bert M. (1 May 2006). "The Production of Propene Oxide: Catalytic Processes and Recent Developments". Industrial & Engineering Chemistry Research. 45 (10): 3447–3459. doi:10.1021/ie0513090. hdl:1874/20149. S2CID 94240406.
- ^ Indictor N., Brill W. F. (1965). "Metal Acetylacetonate Catalyzed Epoxidation of Olefins with t-Butyl Hydroperoxide". J. Org. Chem. 30 (6): 2074. doi:10.1021/jo01017a520.
- ^ Thiel W. R. (1997). "Metal catalyzed oxidations. Part 5. Catalytic olefin epoxidation with seven-coordinate oxobisperoxo molybdenum complexes: a mechanistic study". Journal of Molecular Catalysis A: Chemical. 117: 449–454. doi:10.1016/S1381-1169(96)00291-9.
- ^ a b Wiley-VCH, Weinheim의 2002년 울만의 산업화학 백과사전에 실린 Dietmar Kahlich, Uwe Wiechern, Jörg Lindner "Profilen Oxide"입니다.doi: 10.1002/14356007.a22_239
- ^ 1985년 3월, 제리고급 유기 화학, 반응, 메커니즘 및 구조.제3판John Wiley & Sons.ISBN 0-471-85472-7.
- ^ Nikolaus Prileschajew (1909). "Oxydation ungesättigter Verbindungen mittels organischer Superoxyde" [Oxidation of unsaturated compounds by means of organic peroxides]. Berichte der Deutschen Chemischen Gesellschaft (in German). 42 (4): 4811–4815. doi:10.1002/cber.190904204100.
- ^ Harold Hibbert and Pauline Burt (1941). "Styrene Oxide". Organic Syntheses.; Collective Volume, vol. 1, p. 494
- ^ Paul D. Bartlett (1950). "Recent work on the mechanisms of peroxide reactions". Record of Chemical Progress. 11: 47–51.
- ^ John O. Edwards (1962). Peroxide Reaction Mechanisms. Interscience, New York. pp. 67–106.
- ^ Berrisford D. J., Bolm C., Sharpless K. B. (2003). "Ligand-Accelerated Catalysis". Angew. Chem. Int. Ed. Engl. 95 (10): 1059–1070. doi:10.1002/anie.199510591.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Sheldon R. A. (1980). "Synthetic and mechanistic aspects of metal-catalysed epoxidations with hydroperoxides". Journal of Molecular Catalysis. 1: 107–206. doi:10.1016/0304-5102(80)85010-3.
- ^ Katsuki, T.; Sharpless, K. B. (1980). "The first practical method for asymmetric epoxidation". J. Am. Chem. Soc. 102 (18): 5974–5976. doi:10.1021/ja00538a077.
- ^ 힐, J. G., 샤프리스, K. B., 엑슨, C. M., 리제니, R. Org. 신스, 콜제7권, 제461쪽(1990년); 제63권, 제66쪽(1985년)(Wayback Machine에서 2013-09-27 문서
- ^ a b Pham, Ha Q.; Marks, Maurice J. (2005). "Epoxy Resins". Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a09_547.pub2. ISBN 978-3527306732.
- ^ Koppenhoefer, B.; Schurig, V. (1993). "(R)-Alkyloxiranes of High Enantiomeric Purity from (S)-2-Chloroalkanoic Acids via (S)-2-Chloro-1-Alkanols: (R)-Methyloxirane". Organic Syntheses.; Collective Volume, vol. 8, p. 434
- ^ Thibodeaux C. J. (2012). "Enzymatic Chemistry of Cyclopropane, Epoxide, and Aziridine Biosynthesis". Chem. Rev. 112 (3): 1681–1709. doi:10.1021/cr200073d. PMC 3288687. PMID 22017381.
- ^ Boron WF (2003). Medical Physiology: A Cellular And Molecular Approach. Elsevier/Saunders. p. 108. ISBN 978-1-4160-2328-9.
- ^ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, p. 517, ISBN 978-0-471-72091-1
- ^ Kosswig, Kurt (2002). "Surfactants". In Elvers, Barbara; et al. (eds.). Ullmann's Encyclopedia of Industrial Chemistry. Weinheim, GER: Wiley-VCH. doi:10.1002/14356007.a25_747. ISBN 978-3527306732.
- ^ Julie M. Longo; Maria J. Sanford; Geoffrey W. Coates (2016). "Ring-Opening Copolymerization of Epoxides and Cyclic Anhydrides with Discrete Metal Complexes: Structure–Property Relationships". Chem. Rev. 116 (24): 15167–15197. doi:10.1021/acs.chemrev.6b00553. PMID 27936619.
- ^ Takuya Nakagiri, Masahito Murai, and Kazuhiko Takai (2015). "Stereospecific Deoxygenation of Aliphatic Epoxides to Alkenes under Rhenium Catalysis". Org. Lett. 17 (13): 3346–9. doi:10.1021/acs.orglett.5b01583. PMID 26065934.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ K. Barry Sharpless, Martha A. Umbreit (1981). "Deoxygenation of Epoxides with Lower Valent Tungsten Halides: trans-Cyclododecene". Org. Synth. 60: 29. doi:10.15227/orgsyn.060.0029.
- ^ Bruce Rickborn and Wallace E. Lamke (1967). "Reduction of epoxides. II. The lithium aluminum hydride and mixed hydride reduction of 3-methylcyclohexene oxide". J. Org. Chem. 32 (3): 537–539. doi:10.1021/jo01278a005.
- ^ B. Mudryk; T. Cohen (1995). "1,3-Diols From Lithium Β-lithioalkoxides Generated By The Reductive Lithiation Of Epoxides: 2,5-dimethyl-2,4-hexanediol". Org. Synth. 72: 173. doi:10.15227/orgsyn.072.0173.
- ^ K. Barry Sharpless, Martha A. Umbreit, Marjorie T. Nieh, Thomas C. Flood (1972). "Lower valent tungsten halides. New class of reagents for deoxygenation of organic molecules". J. Am. Chem. Soc. 94 (18): 6538–6540. doi:10.1021/ja00773a045.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Sasaki, Hiroshi (February 2007). "Curing properties of cycloaliphatic epoxy derivatives". Progress in Organic Coatings. 58 (2–3): 227–230. doi:10.1016/j.porgcoat.2006.09.030.
- ^ Niederer, Christian; Behra, Renata; Harder, Angela; Schwarzenbach, René P.; Escher, Beate I. (2004). "Mechanistic approaches for evaluating the toxicity of reactive organochlorines and epoxides in green algae". Environmental Toxicology and Chemistry. 23 (3): 697–704. doi:10.1897/03-83. PMID 15285364. S2CID 847639.



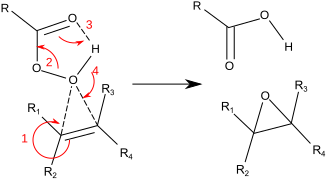







![3,4-Epoxycyclohexylmethyl-3’,4’-epoxycyclohexane carboxylate, precursor to coatings.[30]](http://upload.wikimedia.org/wikipedia/commons/thumb/0/0e/Diepoxyester.svg/175px-Diepoxyester.svg.png)




