지질
Lipid생물학과 생화학에서 지질(lipid)은 비극성 용매에 용해되는 거시적 생체분자다.[3]비극성 용제는 일반적으로 지방산, 왁스, 스테롤, 지방 수용성 비타민(비타민 A, D, E, K 등), 모노글리세리드, 디글리세리드, 트리글리세리드, 인지질을 포함하여 물에 용해되지 않는 다른 자연적으로 발생하는 탄화수소 지질 분자를 용해하는 데 사용되는 탄화수소들이다.
지질의 기능으로는 에너지 저장, 신호 전달, 세포막의 구조적 구성 요소 역할 등이 있다.[4][5]지질은 나노기술뿐만 아니라 화장품과 식품 산업에도 응용이 가능하다.[6]
과학자들은 때때로 지질들을 소수성 또는 앰프힐릭의 작은 분자로 정의한다; 몇몇 지질들의 앰프힐릭적인 성질은 그들이 수성 환경의 음파, 다성/단일성 지질, 또는 막과 같은 구조를 형성할 수 있게 한다.생물학적 지질들은 생화학적 서브유닛 또는 "건물-블록"의 두 가지 뚜렷한 형태인 케토아실 및 이솝렌 그룹에서 전적으로 또는 부분적으로 유래한다.[4]이 접근법을 사용하여 지질은 지방산, 글리세롤리피드, 글리세롤리피드, 스핑골리피드, 사카롤리피드, 폴리케티드(케토아실 서브유닛의 응축에서 파생됨)와 스테롤리피드와 혼리피드(이소프렌 서브유닛의 응축에서 파생됨)의 8가지 범주로 나눌 수 있다.[4]
비록 "lipid"라는 용어가 지방과 동의어로 사용되기도 하지만, 지방은 트리글리세리드라고 불리는 지질의 한 부분군이다.지질은 또한 지방산과 그 파생물과 같은 분자(트리, 디, 모노글리세리드, 인지질 포함)와 콜레스테롤과 같은 스테롤 함유 대사물을 포함한다.[7]비록 인간과 다른 포유류들이 지질을 분해하거나 합성하기 위해 다양한 생합성 경로를 이용하지만, 몇몇 필수 지질들은 이런 식으로 만들어질 수 없고 식단에서 얻어야만 한다.
역사
지질(Lipid)은 실제로 또는 잠재적으로 지방산과 관련이 있고 살아있는 세포가 사용하는 유기 용매(알코올, 에테르 등)에 용해되며, 물에서 비교적 불용성인 유기 물질로 간주될 수 있다.
1815년 앙리 브라콘노트는 지질(그레이스)을 수이프(고체 기름 또는 탈로우)와 후일(유체 기름)의 두 가지 범주로 분류했다.[8]1823년, Michel Eugene Chevreul은 오일, 그리스, 탈로우, 왁스, 레진, 발삼 및 휘발성 오일(또는 에센셜 오일)을 포함한 보다 상세한 분류법을 개발하였다.[9][10][11]
최초의 합성 트리글리세라이드는 1844년 테오필-쥘 펠루제(Téophile-Jules Pelouze)에 의해 보고되었는데, 이때 그는 농축 황산이 있는 곳에서 부티리산을 글리세린으로 처리하여 트리뷰티린을 생산하였다.[12]몇 년 후 펠루제의 제자 중 한 명인 마르첼린 베르테로트는 고온에서 염화 기체수소가 존재하는 상황에서 글리세린과 아날로그 지방산의 반응에 의해 트리스타린과 트리팔미틴을 합성했다.[13]
1827년 윌리엄 프라우트는 단백질("알부미닌"), 탄수화물("사카린")과 함께 지방("오일")을 인간과 동물의 중요한 영양소로 인정했다.[14][15]
한 세기 동안 화학자들은 '패트'를 지방산과 글리세롤(글리세라이드)으로 만든 단순한 지질로만 여겼으나, 이후 새로운 형태가 묘사되었다.테오도르 고블리(1847)는 포유류의 뇌와 암탉 알에서 "레시틴"으로 불리는 인지질을 발견했다.투시첨은 인간의 뇌에서 일부 인지질(세페할린), 글리콜리피드(세레브로사이드), 스핑골리피드(스핀고멜린)를 발견했다.[10]
리포이드, 리핀, 리피드, 리피드라는 용어는 작가마다 다양한 의미로 사용되어 왔다.[16]1912년 로젠블룸과 기스는 '립핀'에 의한 '립포이드'의 대체를 제안했다.[17]1920년에 블로어는 "지질"에 대한 새로운 분류법을 도입했다: 단순한 지질(기름과 왁스), 복합 지질(인산, 글리콜리포이드), 그리고 파생 지질(지방산, 알코올, 스테롤)이다.[18][19]
그리스어 ologicallyίος에서 어원적으로 유래한 리피드(lipide)라는 단어는 1923년 프랑스의 약리학자 가브리엘 베르트랑([20]Gabriel Bertrand)에 의해 소개되었다.베르트랑(Bertrand)은 그 개념에 전통적인 지방(glycerides)뿐만 아니라 복잡한 체질을 가진 "lipoids"도 포함시켰다.[10]리피드라는 단어는 1923년 7월 3일 본회의에서 소시에테 데 치미에 바이오로지크의 국제 위원회에서 만장일치로 승인되었다.리피드라는 단어는 나중에 발음 때문에 리피드로 영어화되었다.프랑스어에서는 고대 그리스어로부터 접미사 -ide('son of' 또는 'descendant'를 의미)가 항상 발음( (d)된다.
1947년 T. P. 힐디치는 "단순한 지질"을 기름과 왁스(진정한 왁스, 스테롤, 알코올)로 정의했다.
분류
지질은 Lipid MAPS 컨소시엄에[4] 의해 다음과 같이 8개 범주로 분류되었다.
지방산
지방산, 즉 지방산 잔류물은 지방산 합성이라고 하는 과정에서 아세틸-CoA 프라이머와 말론-CoA 또는 메틸말론-CoA 그룹을 연쇄적으로 결합하여 합성된 다양한 분자군이다.[21][22]그들은 탄화수소 사슬로 만들어져 카복실산 그룹과 결합한다; 이 배열은 분자를 극성, 친수성, 그리고 물에 용해되지 않는 비극성, 소수성 종말과 혼동시킨다.지방산 구조는 생물학적 지질의 가장 근본적인 범주 중 하나이며, 구조적으로 더 복잡한 지질의 빌딩 블록으로 흔히 사용된다.일반적으로 4개에서 24개 탄소의 길이 사이에 있는 탄소 체인은 [23]포화되거나 불포화될 수 있으며 산소, 할로겐, 질소 및 황을 포함하는 기능 그룹에 부착될 수 있다.지방산이 이중 결합을 함유하면 시스나 트랜스 기하학적 이소메르리즘의 가능성이 있어 분자의 구성에 큰 영향을 미친다.cis-double 결합은 지방산 체인을 구부리게 하는데, 이것은 체인의 더 많은 이중 결합과 함께 복합적으로 작용하는 효과다.식물성 태라코이드막의 가장 풍부한 지방-아킬 체인인 18-카본 리놀렌산에 3개의 이중결합이 있어 환경적 저온에도 불구하고 이 막들을 고도로 유동적으로 만들고 [24]또한 리놀렌산이 엽록체의 고해상도 13-C NMR 스펙트럼에서 지배적인 첨단을 이루게 한다.이것은 세포막의 구조와 기능에 중요한 역할을 한다.[25]: 193–5 대부분의 자연적으로 발생하는 지방산은 시스형이지만, 트랜스 형태는 일부 자연적이고 부분적으로 수소화된 지방과 오일에 존재한다.[26]
생물학적으로 중요한 지방산의 예로는 주로 아라키돈산과 에이코사펜타에노산(aicosanoids)에서 유래한 아이코사노이드(eicosanoids)가 있는데, 이 산에는 프로스타글란딘, 로이코트리엔, 트롬박스산 등이 포함된다.Docosahexaenoic acid는 생물학적 시스템, 특히 시력에 관해서도 중요하다.[27][28]지방산 카테고리의 다른 주요 지질학급으로는 지방 에스테르와 지방 아미드가 있다.지방 에스테르에는 왁스 에스테르, 지방산 티오에스터 코엔자임 A 유도체, 지방산 티오에스터 ACP 유도체, 지방산 카니틴 등 중요한 생화학 매개체가 포함된다.지방 아미드에는 카나비노이드 신경전달물질 아난다미드와 같은 N-아킬 에탄올아민이 포함된다.[29]
글리세롤리피스
글리세롤리피드는 모노, 디-, 3개 대체 글리세롤로 구성되는데,[30] 가장 잘 알려진 것은 트리글리세리드라고 불리는 글리세롤의 지방산 시험자들이다."트리라이슬글리세롤"이라는 단어는 때때로 "트리글리세라이드"와 동의어로 사용된다.이러한 화합물에서 글리세롤의 세 히드록실 그룹은 각각 에스테르화되며, 일반적으로 다른 지방산에 의해 결정된다.그것들은 에너지 저장소로 기능하기 때문에, 이 지질은 동물 조직에서 저장 지방의 대부분을 차지한다.중성지방의 에스테르 결합의 가수분해와 지방조직에서 글리세롤과 지방산을 방출하는 것은 지방을 대사하는 초기 단계다.[31]: 630–1
글리세롤리피드의 추가적인 하위 분류는 글리코실글리세롤로 표현되는데, 글리코시디드 연동을 통해 글리세롤에 하나 이상의 설탕 잔류물이 부착되어 있는 것이 특징이다.이 범주의 구조물의 예로는 식물막에서[32] 발견된 디갈락토실디글리세롤과 포유류 정자세포에서 나온 반올리피드가 있다.[33]
글리세로인스포리피스
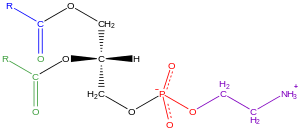
보통 인광질(spingomyelins는 인광질(phospholipids, spingylines)로도 분류되지만, 글리세로인산질체는 자연에서 어디에나 존재하며, 세포의 지질 빌레이어의 주요 성분이며,[34] 신진대사와 세포신호작용에 관여한다.[35]신경 조직(뇌 포함)은 비교적 많은 양의 글리세로인스포리피드를 함유하고 있으며, 그 성분의 변화는 다양한 신경 질환에 관련되어 있다.[36]글리세로인스포리피드는 진핵생물 및 에우박테리아에서 글리세롤 백본의 sn-3 위치에 있는 극성 두 그룹의 성질 또는 고고학박테리아의 경우 sn-1 위치에 기초하여 구별되는 등급으로 세분할 수 있다.[37]
생물학적 막에서 발견되는 글리세로인산염의 예로는 인산염(PC, GPCho 또는 레시틴이라고도 함), 인산염일타닐타놀아민(PE 또는 GPEtn), 인산염일세린(PS 또는 GPSer) 등이 있다.세포막의 주요 구성 요소와 세포내 및 세포간 단백질을 결합하는 부위의 역할을 하는 것 외에도, 인산염과 인산염산과 같은 진핵 세포의 일부 글리세로인산염은 세포에서 파생된 두 번째 전달체의 전구체 또는 그 자체다.[31]: 844 전형적으로 이들 히드록실 그룹 중 하나 또는 둘 다 긴 사슬 지방산으로 아틸화되지만, 알킬연계 및 1Z 알케닐연계(플라스몰로그인) 글리세로인스포리피드도 있고, 고고박테리아에서는 다이얼킬레터 변종도 있다.[38]
스핑골리피스
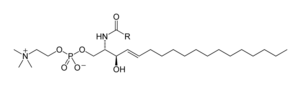
스핑골리피드는 공통의 구조적 특징을 공유하는 복잡한 화합물[39] 계열로 아미노산 세린에서 데노보 합성된 스핑고이드 베이스 백본과 롱체인 지방 아킬 CoA가 세라마이드, 인산염, 글리코스피돌리피드 및 기타 화합물로 변환된다.포유류의 주요 스핑고이드 베이스는 보통 스핑고신이라고 불린다.세라마이드(N-acyl-spingoid base)는 아미드 연계 지방산을 가진 스핑고이드 베이스 파생상품의 주요 하위종류다.지방산은 일반적으로 16개에서 26개까지의 탄소 원자의 연쇄 길이를 가진 포화 또는 단일 불포화물이다.[25]: 421–2
포유류의 주요 인지질균은 스핑고멜린(세라마이드인산염)[40]인데 반해 곤충은 주로 세라마이드인산염과[41] 곰팡이는 피토세라마이드인산염과 마노세 함유 두부군을 가지고 있다.[42]글리코스피싱골리피드는 글리코시드 결합을 통해 스핑고이드 베이스에 연결된 하나 이상의 설탕 잔류물로 구성된 다양한 분자군이다.이것들의 예로는 세레브로사이드와 강리오사이드와 같은 단순하고 복잡한 글리코스포싱올리피드가 있다.
스테롤스

콜레스테롤과 그 파생물과 같은 스테롤은 글리세로인스포리피드, 스핑고멜린과 함께 [43]막 지질의 중요한 성분이다.스테롤의 다른 예로는 담즙산과 그 결합체가 있는데,[44] 포유류에서는 콜레스테롤의 산화 유도체로서 간에서 합성된다.식물성 균류는 β-시토스테롤, 스티그마스테롤, 브라시카스테롤과 같은 피토스테롤이며, 후자는 녹조성장을 위한 바이오마커로도 사용된다.[45]곰팡이 세포막에서 지배적인 스테롤은 에르고스테롤이다.[46]
스테롤은 탄소 체인의 위치 3에서 수소 원자 중 하나가 히드록실 그룹으로 대체되는 스테로이드다.그들은 스테로이드와 동일한 융접된 4-링 코어 구조와 공통점을 가지고 있다.스테로이드제는 호르몬과 신호 분자로서 다른 생물학적 역할을 한다.18-탄소 스테로이드는 에스트로겐 계열을 포함하고 C19 스테로이드는 테스토스테론과 안드로스테론과 같은 안드로겐으로 구성된다.C21 하위 분류에는 프로게스테르균뿐만 아니라 글루코코르티코이드와 광물코르티코이드도 포함된다.[2]: 749 다양한 형태의 비타민 D로 구성된 세코스테로이드들은 핵심 구조의 B고리가 갈라진 것이 특징이다.[47]
프레놀스
프레놀 지질은 주로 메발론산(MVA) 경로를 통해 생산되는 이소펜테닐 디프인산(isopentenyl diphosphate)과 디메틸알릴 디프인산(dimethylallyl diphosphate) 5개 탄소단위 전구체에서 합성된다.[48]단순 이소프로노이드(선형 알코올, 인산염 등)는 C5 유닛의 연속적인 추가에 의해 형성되며, 이러한 테르펜 유닛의 수에 따라 분류된다.40개 이상의 탄소를 함유한 구조물은 폴리테르펜으로 알려져 있다.카로티노이드들은 산화방지제와 비타민 A의 전구체로서 기능하는 중요한 단순한 이소프로노이드들이다.[49]또 다른 생물학적으로 중요한 종류의 분자는 키니온과 하이드로퀴논에 의해 예시되는데, 키니오노이드 꼬리는 비이소프로노이드 기원의 키니노이드 코어에 부착된 이소프로노이드 꼬리를 포함하고 있다.[50]유비퀴논뿐만 아니라 비타민 E와 비타민 K도 이 등급의 예다.프로카리오테스는 산소에 부착된 단자 이소프레노이드 단위가 불포화 상태로 남아 있는 폴리페놀(일명 박토프레놀)을 합성하는 반면 동물성 폴리페놀(돌리콜)에서는 단자 이소프레노이드 단위가 감소한다.[51]
사카롤리피드
사카롤리피드는 지방산이 설탕 등뼈와 연결되어 막 빌레이어와 호환되는 구조를 형성하는 화합물을 묘사한다.사카롤리피드에서 단당류는 글리세롤리피드와 글리세로인스포리피드에 존재하는 글리세롤 백본을 대체한다.가장 친숙한 사카롤리피드는 그람 음성 박테리아 내 리포폴리사당 A 성분의 아틸화 글루코사민 전구체다.전형적인 지방질 A 분자는 7개의 지방-아킬 사슬로 파생된 글루코사민의 이당류다.대장균의 성장에 필요한 최소 리포폴리사당류는 글루코사민의 육각산 이당류인 Kdo-Lipid2 A로, 3데옥시-D-만노-옥툴로손산(Kdo) 잔류물 2개로 글리코실화된다.[52]
폴리케티데스
폴리케티드는 아세틸과 프로피오닐 서브유닛을 고전 효소에 의해 중합하는 것은 물론, 지방산 시네시스와 기계론적 특징을 공유하는 반복적·다모듈적 효소를 통해 합성된다.이들은 많은 2차 대사물과 동물, 식물, 박테리아, 곰팡이, 해양원료에서 얻은 천연물로 구성되며, 구조적 다양성이 크다.[53][54]많은 폴리케티드는 종종 글리코실화, 메틸화, 히드록시화, 산화 또는 다른 과정에 의해 등뼈가 추가로 변형되는 순환 분자다.흔히 사용되는 항미생물, 항기생성제, 항암제로는 에리트로마이신, 테트라사이클린, 에바실린, 항균에포틸론 등의 폴리케티드 또는 폴리케티드 유도체가 많다.[55]
생물학적 함수
생물막의 성분
진핵 세포는 다른 생물학적 기능을 수행하는 분리막 결합 유기체를 특징으로 한다.글리세로인스포리피드는 세포 혈장막과 세포내 세포막으로서 생물막의 주요 구조적 구성 요소로서 동물세포에서 혈장막은 세포내 구성 요소와 세포외 환경을 물리적으로 분리한다.[citation needed]글리세로인스포리피드는 에스테르 링크에 의한 두 지방산 유래 "꼬리"와 인산염 에스테르 연결에 의한 하나의 "머리" 그룹에 연결된 글리세롤 코어를 포함하는 암페타스 분자(수소성 및 소수성 영역 모두 포함)이다.[citation needed]글리세로인스포리피드는 생물막의 주요 성분인 반면, 스핑고멜린, 스테롤(주로 동물세포막의 콜레스테롤)과 같은 다른 비글리세리드 지질 성분도 생물막에서 발견된다.[56][2]: 329–331 식물과 해조류에서 인산염이 부족한 갈락토필디글리세롤과 [57][32]황화미노필디글리세롤은 엽록체와 관련 유기체의 막의 중요한 성분으로 고등식물, 해조류, 특정 박테리아 등 광합성 조직에서 가장 풍부한 지질이다.[citation needed]
식물 태일라코이드막은 모노갈락토실 디글리세리드(MGDG)[58]를 형성하는 비빌라이어 중 가장 큰 지질 성분과 작은 인광체를 가지고 있다. 이러한 독특한 지질 성분에도 불구하고 엽록체 태일라코이드막은 자기공명과 전자현미경 연구에서 밝혀진 바와 같이 동적 지질-빌라이어 매트릭스를 포함하고 있는 것으로 나타났다.
생물학적 막은 항성 위상 지질 빌레이어의 한 형태다.지질빌라이어의 형성은 위에서 설명한 글리세로인스포리피드가 수용성 환경에 있을 때 정력적으로 선호하는 과정이다.[2]: 333–4 이것은 소수성 효과로 알려져 있다.수용성 시스템에서, 지질들의 극지방의 두부는 극지방의 수용성 환경에 맞춰 정렬되는 반면, 소수성 꼬리는 물과 접촉을 최소화하고 함께 뭉쳐, 빈실을 형성하는 경향이 있다; 지질 농도에 따라, 이러한 생물물리학적 상호작용은 마이크로셀, 지질, 지질 또는 지질 빌레이어의 형성을 야기할 수 있다.다른 집적도 관찰되며 암페어(지질) 거동의 다형성의 일부를 형성한다.위상행동은 생물물리학 내 연구 영역으로 현재[when?] 학문 연구의 대상이다.[59][60]마이크로엘과 빌레이어는 소수성 효과라고 알려진 과정에 의해 극성 매체에서 형성된다.[61]극지 환경에서 지방질 또는 앰프힐릭 물질을 용해할 때, 극지 분자(즉, 수용액 속의 물)는 용해된 지방질 물질을 중심으로 더 순서가 잡히게 되는데, 이는 극지 분자가 앰프힐의 지방질 영역에 수소 결합을 형성할 수 없기 때문이다.그래서 수용성 환경에서, 물 분자는 용해된 지방 분자 주위에 질서 정연한 "피복율" 케이지를 형성한다.[62]
지질들을 프로토셀막으로 형성하는 것은 생명의 기원인 아비오젠시스의 모델에서 중요한 단계를 나타낸다.[63]
에너지 저장
지방 조직에 저장된 트리글리세라이드는 동물과 식물 모두에서 주요한 에너지 저장 형태다.그것들은 질량 당 글리코겐과 같은 탄수화물보다 두 배나 더 많은 다이옥시겐의 에너지를 방출하기 때문에 유산소 호흡에서 주요한 '출처'이다. 이것은 트리글리세리드의 산소 함량이 상대적으로 낮기 때문이다.[64]지방산의 완전한 산화는 약 38 kJ/g(9 kcal/g)를 방출하는데, 탄수화물과 단백질의 산화 분해에 대해서는 17 kJ/g(4 kcal/g)에 불과한 것과 비교된다.지방세포(adipocyte) 또는 지방세포는 동물의 트리글리세리드(triglyceride)를 연속적으로 합성하고 분해하도록 설계되었으며, 분해는 주로 호르몬에 민감한 효소 지질효소의 활성화에 의해 제어된다.[65]먹지 않고 먼 거리를 날아야 하는 철새들은 그들의 비행에 연료를 공급하기 위해 트리글리세리드를 사용한다.[2]: 619
신호
지질 신호는 세포 신호의 중요한 부분이라는 것을 보여주는 증거가 나타났다.[66][67][68][69]지질 신호는 G 단백질 결합 수용체나 핵 수용체의 활성화를 통해 발생할 수 있으며, 여러 가지 다른 지질 범주의 구성원은 신호 분자와 세포 전달자로 식별되었다.[70]이 sphingosine-1-phosphate, 그것은 강력한 메신저 분자는 sphingolipid실세라 미드에서 파생된 칼슘 mobilization,[71]세포 성장 조절에 관여하고, 세포,[72]디아실 글리세롤(DAG)과 포스파티딜 이노시톨 인산염(PIPs), 단백질 인산화 효소 C의calcium-mediated 활성화에 관련된, 현은 프로스타 그란 딘[73]을 포함한다.ch 하나이다염증과 면역력에 관여하는 지방산 유도 에코사노이드의 유형;[74] 생식과 신진대사, 혈압과 같은 많은 기능을 조절하는 에스트로겐, 테스토스테론, 코티솔과 같은 스테로이드 호르몬, 그리고 간X 수용체 작용제인 25-히드로옥시콜레스테롤과 같은 옥시스테롤.[75]인산염 지질은 세포나 세포 조각의 포고사이토시스 신호에 관여하는 것으로 알려져 있다.그들은 세포질 측면에만 그들을 두는 전구체의 불활성화 후 세포막의 세포외 표면에 노출되어 이것을 성취한다. 그리고 인광체의 방향을 왜곡시키는 스크램블레이즈의 활성화.이런 일이 일어난 후, 다른 세포들은 인산염 세라인을 인식하고 그들을 노출시키는 세포나 세포 조각들을 포고시토스화한다.[76]
기타 함수
이솝렌 기반의 지질인 "지방 용해성" 비타민(A, D, E, K)은 간 및 지방 조직에 저장되어 있는 필수 영양소로서 다양한 기능을 가지고 있다.아킬-카르니틴은 미토콘드리아 내외의 지방산의 운반과 신진대사에 관여하며, 그곳에서 베타 산화를 겪는다.[77]폴리프레놀과 그 인산화 유도체들은 또한 중요한 운송 역할을 하는데, 이 경우 막을 가로지르는 올리고당류의 운송이 그것이다.폴리페놀 인산염 당분과 폴리페놀 인산염 당분은 세포외 글리코실화 반응, 세포외 다당체 생합성(예를 들어 박테리아 내 펩티도글리칸 중합성), 진핵 단백질 N글리코실화에서 기능한다.[78][79]Cardiolipins는 내부 미토콘드리아 막에 특히 풍부한 4개의 아틸 사슬과 3개의 글리세롤 그룹을 포함하는 글리세로인스포리피드의 하위 등급이다.[80][81]그들은 산화인산화효소와 관련된 효소를 활성화시킨다고 믿어진다.[82]지질은 스테로이드 호르몬의 기초를 형성하기도 한다.[83]
신진대사
인간과 다른 동물들의 주요 식이 지질은 동물과 식물 트리글리세리드, 스테롤, 막인산화질소다.지질대사의 과정은 지질 저장소를 합성하고 분해하여 개별 조직의 구조적이고 기능적인 지질 특성을 생산한다.
생합성
동물에서는 식이 탄수화물이 과잉 공급되면 과잉 탄수화물이 트리글리세라이드로 전환된다.이것은 아세틸-CoA로부터 지방산을 합성하고 지방산의 에스테르화, 지방생성이라고 불리는 과정인 트리글리세리드 생산에 관여한다.[2]: 634 지방산은 중합된 후 아세틸-CoA 단위를 감소시키는 지방산 시네타스에 의해 만들어진다.지방산의 아킬 사슬은 아세틸 그룹을 첨가하고 알코올로 줄인 다음 알켄 그룹으로 탈수시킨 다음 알칸 그룹으로 다시 감소시키는 반응의 순환에 의해 확장된다.지방산 생합성의 효소는 두 그룹으로 나뉘는데, 동물과 곰팡이에서는 이러한 모든 지방산 신타아제 반응이 하나의 다기능 단백질에 의해 수행되는 반면,[84] 식물에서는 플라스티드와 박테리아 분리 효소가 경로의 각 단계를 수행한다.[85][86]지방산은 이후에 지단백질로 포장되어 간에서 분비되는 트리글리세라이드로 변환될 수 있다.
불포화 지방산의 합성은 만족 반응을 수반하며, 이중 결합을 통해 지방 아킬 체인에 도입된다.예를 들어, 인간에서 스테아로일-CoA 데스포라제-1에 의한 스테아리산의 탈성화는 올레산을 생성한다.이중 불포화지방산 리놀레산은 물론 삼중불포화 α-리놀렌산은 포유류 조직에서는 합성할 수 없으므로 필수 지방산이며 반드시 식단에서 얻어야 한다.[2]: 643
트리글리세리드 합성은 지방 아킬-코아스의 아킬 그룹이 글리세롤-3-인산염과 디아실글리세롤의 히드록실 그룹에 전달되는 대사 경로에 의해 내소성 망막에서 이루어진다.[2]: 733–9
카로티노이드 등을 포함한 테르페네와 이소프로노이드들은 반응성 전구체 이소펜테닐 피로인산염과 디메틸알릴 피로인산염으로부터 기증받은 이소프렌 단위의 조립과 개조에 의해 만들어진다.[48]이 전구체들은 다른 방법으로 만들어질 수 있다.동물과 고고학에서 메발론산염 통로는 아세틸-CoA로부터 이러한 화합물을 생성하며,[87] 식물과 박테리아에서는 비메발론산 통로는 피루브산염과 글리세랄알데히드 3-인산염을 기질로 사용한다.[48][88]이 활성 이솝렌 기증자를 이용하는 중요한 반응 중 하나는 스테로이드 생합성이다.여기서 이솝렌 단위는 함께 결합하여 스칼렌을 만든 다음 접어서 한 세트의 링으로 형성되어 라노스테롤을 만든다.[89]라노스테롤은 콜레스테롤이나 에르고스테롤과 같은 다른 스테로이드제로 전환될 수 있다.[89][90]
분해
베타 산화는 아세틸-CoA를 생성하기 위해 지방산을 미토콘드리아나 페록시솜에서 분해하는 대사 과정이다.대부분의 경우 지방산은 지방산 합성 과정의 역전과 유사하지만 동일하지는 않은 메커니즘에 의해 산화된다.즉, 탈수, 수화, 산화 단계를 거쳐 산의 카르복실 끝에서 순차적으로 2탄소 파편을 제거하여 베타케토산을 형성하고, 이 파편은 티올리분해에 의해 분열된다.그리고 나서 아세틸-CoA는 궁극적으로 구연산 사이클과 전자 운송 체인을 이용하여 ATP, CO2, HO로2 변환된다.따라서 포도당이 거의 없거나 없는 경우 에너지를 위해 지방을 분해할 때 구연산 주기는 아세틸-CoA에서 시작될 수 있다.지방산 팜티테이트의 완전 산화의 에너지 산출량은 106 ATP이다.[2]: 625–6 불포화 및 홀수 체인 지방산은 열화를 위해 추가적인 효소 단계를 필요로 한다.
영양과 건강
음식에서 발견되는 지방의 대부분은 트리글리세리드, 콜레스테롤, 인지질이다.지용성 비타민(A, D, E, K)과 카로티노이드의 흡수를 촉진하기 위해 일부 식이지방이 필요하다.[91]: 903 인간과 다른 포유류들은 리놀레산(오메가-6 지방산)과 알파리놀렌산(오메가-3 지방산)과 같은 특정 필수 지방산에 대한 식이 요건이 있는데, 이는 식단에서 단순한 전구체로부터 합성될 수 없기 때문이다.[2]: 643 이 두 지방산 모두 이중 결합의 수와 위치가 다른 18-탄소 다불포화 지방산이다.대부분의 식물성 기름에는 리놀레산(사플라워, 해바라기, 옥수수 오일)이 풍부하다.알파 리놀렌산은 식물의 녹색 잎과 일부 씨앗, 견과류, 콩류(특히 아마, 유채, 호두, 콩)에서 발견된다.[92]생선 기름은 특히 체인이 긴 오메가-3 지방산 아이코사펜타에노산(EPA)과 도코사헥사에노산(DHA)이 풍부하다.[91]: 388 많은 연구들이 오메가-3 지방산을 유아 발달, 암, 심혈관 질환, 그리고 다양한 정신 질환(우울증, 주의력 결핍 과잉행동 장애, 치매 등)에 소비하는 것과 관련된 긍정적인 건강 이점을 보여주었다.[93][94]
이와는 대조적으로, 부분적으로 수소화된 식물성 기름에 있는 것과 같은 트랜스 지방의 소비가 심혈관 질환의 위험 요소라는 것은 이제 잘 확립되었다.몸에 좋은 지방은 지질을 너무 익히는 부적절한 조리법에 의해 트랜스지방으로 변질될 수 있다.[95][96][97]
몇몇 연구 전체 식이 지방 섭취 비만[98][99]과 당뇨병의 위험을 증가시키는 것과 연관되어 진다;[100]그러나 매우 큰 연구의 여성 건강 계획'에서의 변경 재판, 49,000여성 8년간의 연구는 Nurses의 보건고, 보건 전문가 후속 대책을 연구 등 수많은 rev. 제안했다그런 ealed이 연구들 중 어느 것도 지방으로부터 오는 칼로리의 비율과 암, 심장병 또는 체중 증가의 위험 사이에 어떤 연관성도 제시하지 않았다.[101][102]하버드대 T. H. Chan 보건대 영양학과가 관리하는 웹사이트인 [103]영양 공급원은 식이 지방의 영향에 대한 현재의 증거를 요약한다: "세부한 연구 - 하버드대에서 행해진 많은 연구 - 식이 요법의 지방 총량은 체중이나 질병과 실제로 관련이 없다는 것을 보여준다."[104]
참고 항목
- 고체 지질 나노입자 – 신약 전달 시스템
- 심플 지질
- 에멀전 테스트
- 지질 마이크로도메인
- 막 지질 – 세포막의 지질 분자
- 지방 – 3개의 지방산 체인의 에스테르와 트리글리세라이드라고도 알려진 3개의 주요 마크롱루트리움 중 하나인 알코올 글리세롤
- 지질 신호
- 지질학
- 단백질-지질 상호작용
- 페놀 지질(Penolic Lipid)은 식물, 곰팡이, 박테리아에서 발생하는 긴 알리프틱 사슬과 페놀 링으로 구성된 천연물의 일종이다.
참조
- ^ Maitland J Jr (1998). Organic Chemistry. W W Norton & Co Inc (Np). p. 139. ISBN 978-0-393-97378-5.
- ^ a b c d e f g h i j Stryer L, Berg JM, Tymoczko JL (2007). Biochemistry (6th ed.). San Francisco: W.H. Freeman. ISBN 978-0-7167-8724-2.
- ^ IUPAC, 화학용어 종합편찬, 제2편.("금책")(1997년).온라인 수정 버전: (2006–) "lide". doi:10.1351/골드북.L03571
- ^ a b c d Fahy E, Subramaniam S, Murphy RC, Nishijima M, Raetz CR, Shimizu T, Spener F, van Meer G, Wakelam MJ, Dennis EA (April 2009). "Update of the LIPID MAPS comprehensive classification system for lipids". Journal of Lipid Research. 50 (S1): S9-14. doi:10.1194/jlr.R800095-JLR200. PMC 2674711. PMID 19098281.
- ^ Subramaniam S, Fahy E, Gupta S, Sud M, Byrnes RW, Cotter D, Dinasarapu AR, Maurya MR (October 2011). "Bioinformatics and systems biology of the lipidome". Chemical Reviews. 111 (10): 6452–90. doi:10.1021/cr200295k. PMC 3383319. PMID 21939287.
- ^ Mashaghi S, Jadidi T, Koenderink G, Mashaghi A (February 2013). "Lipid nanotechnology". International Journal of Molecular Sciences. 14 (2): 4242–82. doi:10.3390/ijms14024242. PMC 3588097. PMID 23429269.

- ^ Michelle A, Hopkins J, McLaughlin CW, Johnson S, Warner MQ, LaHart D, Wright JD (1993). Human Biology and Health. Englewood Cliffs, New Jersey, USA: Prentice Hall. ISBN 978-0-13-981176-0.
- ^ Braconnot H (31 March 1815). "Sur la nature des corps gras". Annales de chimie. 2 (XCIII): 225–277.
- ^ Chevreul ME (1823). Recherches sur les corps gras d'origine animale. Paris: Levrault.
- ^ a b c Leray C (2012). Introduction to Lipidomics. Boca Raton: CRC Press. ISBN 9781466551466.
- ^ Leray C (2015). "Introduction, History and Evolution.". Lipids. Nutrition and health. Boca Raton: CRC Press. ISBN 9781482242317.
- ^ Pelouze TJ, Gélis A (1844). "Mémoire sur l'acide butyrique". Annales de Chimie et de Physique. 10: 434.
- ^ 1853, 36, 27, 1854, 41, 216, 안날레스 데 치미에 등 체격의 콤프테스 렌두스 hebdomaders de l'Academie des séance de L'Academies, Paris, 1853, 36, 27; 안날레스 데 치미에 외 체격 1854, 41, 216
- ^ Leray C. "Chronological history of lipid center". Cyberlipid Center. Archived from the original on 2017-10-13. Retrieved 2017-12-01.
- ^ Prout W (1827). "On the ultimate composition of simple alimentary substances, with some preliminary remarks on the analysis of organised bodies in general". Phil. Trans.: 355–388.
- ^ Culling CF (1974). "Lipids. (Fats, Lipoids. Lipins).". Handbook of Histopathological Techniques (3rd ed.). London: Butterworths. pp. 351–376. ISBN 9781483164793.
- ^ Rosenbloom J, Gies WJ (1911). "Suggestion to teachers of biochemistry. I. A proposed chemical classification of lipins, with a note on the intimate relation between cholesterols and bile salts". Biochem. Bull. 1: 51–6.
- ^ Bloor WR (1920). "Outline of a classication of the lipids". Proc. Soc. Exp. Biol. Med. 17 (6): 138–140. doi:10.3181/00379727-17-75. S2CID 75844378.
- ^ Christie WW, Han X (2010). Lipid Analysis: Isolation, Separation, Identification and Lipidomic Analysis. Bridgwater, England: The Oily Press. ISBN 9780857097866.
- ^ Bertrand G (1923). "Projet de reforme de la nomenclature de Chimie biologique". Bulletin de la Société de Chimie Biologique. 5: 96–109.
- ^ Vance JE, Vance DE (2002). Biochemistry of Lipids, Lipoproteins and Membranes. Amsterdam: Elsevier. ISBN 978-0-444-51139-3.
- ^ Brown HA, ed. (2007). Lipodomics and Bioactive Lipids: Mass Spectrometry Based Lipid Analysis. Methods in Enzymology. Vol. 423. Boston: Academic Press. ISBN 978-0-12-373895-0.
- ^ Hunt SM, Groff JL, Gropper SA (1995). Advanced Nutrition and Human Metabolism. Belmont, California: West Pub. Co. p. 98. ISBN 978-0-314-04467-9.
- ^ Yashroy RC (1987). "13C NMR studies of lipid fatty acyl chains of chloroplast membranes". Indian Journal of Biochemistry and Biophysics. 24 (6): 177–178.
- ^ a b Devlin TM (1997). Textbook of Biochemistry: With Clinical Correlations (4th ed.). Chichester: John Wiley & Sons. ISBN 978-0-471-17053-2.
- ^ Hunter JE (November 2006). "Dietary trans fatty acids: review of recent human studies and food industry responses". Lipids. 41 (11): 967–92. doi:10.1007/s11745-006-5049-y. PMID 17263298. S2CID 1625062.
- ^ Furse S (2011-12-02). "A Long Lipid, a Long Name: Docosahexaenoic Acid". The Lipid Chronicles.
- ^ "DHA for Optimal Brain and Visual Functioning". DHA/EPA Omega-3 Institute.
- ^ Fezza F, De Simone C, Amadio D, Maccarrone M (2008). "Fatty acid amide hydrolase: a gate-keeper of the endocannabinoid system". Lipids in Health and Disease. Subcellular Biochemistry. Vol. 49. pp. 101–32. doi:10.1007/978-1-4020-8831-5_4. ISBN 978-1-4020-8830-8. PMID 18751909.
- ^ Coleman RA, Lee DP (March 2004). "Enzymes of triacylglycerol synthesis and their regulation". Progress in Lipid Research. 43 (2): 134–76. doi:10.1016/S0163-7827(03)00051-1. PMID 14654091.
- ^ a b van Holde KE, Mathews CK (1996). Biochemistry (2nd ed.). Menlo Park, California: Benjamin/Cummings Pub. Co. ISBN 978-0-8053-3931-4.
- ^ a b Hölzl G, Dörmann P (September 2007). "Structure and function of glycoglycerolipids in plants and bacteria". Progress in Lipid Research. 46 (5): 225–43. doi:10.1016/j.plipres.2007.05.001. PMID 17599463.
- ^ Honke K, Zhang Y, Cheng X, Kotani N, Taniguchi N (2004). "Biological roles of sulfoglycolipids and pathophysiology of their deficiency". Glycoconjugate Journal. 21 (1–2): 59–62. doi:10.1023/B:GLYC.0000043749.06556.3d. PMID 15467400. S2CID 2678053.
- ^ "The Structure of a Membrane". The Lipid Chronicles. 2011-11-05. Retrieved 2011-12-31.
- ^ Berridge MJ, Irvine RF (September 1989). "Inositol phosphates and cell signalling". Nature. 341 (6239): 197–205. Bibcode:1989Natur.341..197B. doi:10.1038/341197a0. PMID 2550825. S2CID 26822092.
- ^ Farooqui AA, Horrocks LA, Farooqui T (June 2000). "Glycerophospholipids in brain: their metabolism, incorporation into membranes, functions, and involvement in neurological disorders". Chemistry and Physics of Lipids. 106 (1): 1–29. doi:10.1016/S0009-3084(00)00128-6. PMID 10878232.
- ^ Ivanova PT, Milne SB, Byrne MO, Xiang Y, Brown HA (2007). "Glycerophospholipid identification and quantitation by electrospray ionization mass spectrometry". Lipidomics and Bioactive Lipids: Mass‐Spectrometry–Based Lipid Analysis. Methods in Enzymology. Vol. 432. pp. 21–57. doi:10.1016/S0076-6879(07)32002-8. ISBN 978-0-12-373895-0. PMID 17954212.
- ^ Paltauf F (December 1994). "Ether lipids in biomembranes". Chemistry and Physics of Lipids. 74 (2): 101–39. doi:10.1016/0009-3084(94)90054-X. PMID 7859340.
- ^ Merrill AH, Sandoff K (2002). "Chapter 14: Sphingolipids: Metabolism and Cell Signaling" (PDF). In Vance JE, Vance EE (eds.). Biochemistry of Lipids, Lipoproteins and Membranes (4th ed.). Amsterdam: Elsevier. pp. 373–407. ISBN 978-0-444-51138-6.
- ^ Hori T, Sugita M (1993). "Sphingolipids in lower animals". Progress in Lipid Research. 32 (1): 25–45. doi:10.1016/0163-7827(93)90003-F. PMID 8415797.
- ^ Wiegandt H (January 1992). "Insect glycolipids". Biochimica et Biophysica Acta (BBA) - Lipids and Lipid Metabolism. 1123 (2): 117–26. doi:10.1016/0005-2760(92)90101-Z. PMID 1739742.
- ^ Guan X, Wenk MR (May 2008). "Biochemistry of inositol lipids". Frontiers in Bioscience. 13 (13): 3239–51. doi:10.2741/2923. PMID 18508430.
- ^ Bach D, Wachtel E (March 2003). "Phospholipid/cholesterol model membranes: formation of cholesterol crystallites". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1610 (2): 187–97. doi:10.1016/S0005-2736(03)00017-8. PMID 12648773.
- ^ Russell DW (2003). "The enzymes, regulation, and genetics of bile acid synthesis". Annual Review of Biochemistry. 72: 137–74. doi:10.1146/annurev.biochem.72.121801.161712. PMID 12543708.
- ^ Villinski JC, Hayes JM, Brassell SC, Riggert VL, Dunbar R (2008). "Sedimentary sterols as biogeochemical indicators in the Southern Ocean". Organic Geochemistry. 39 (5): 567–588. doi:10.1016/j.orggeochem.2008.01.009.
- ^ Deacon J (2005). Fungal Biology. Cambridge, Massachusetts: Blackwell Publishers. p. 342. ISBN 978-1-4051-3066-0.
- ^ Bouillon R, Verstuyf A, Mathieu C, Van Cromphaut S, Masuyama R, Dehaes P, Carmeliet G (December 2006). "Vitamin D resistance". Best Practice & Research. Clinical Endocrinology & Metabolism. 20 (4): 627–45. doi:10.1016/j.beem.2006.09.008. PMID 17161336.
- ^ a b c Kuzuyama T, Seto H (April 2003). "Diversity of the biosynthesis of the isoprene units". Natural Product Reports. 20 (2): 171–83. doi:10.1039/b109860h. PMID 12735695.
- ^ Rao AV, Rao LG (March 2007). "Carotenoids and human health". Pharmacological Research. 55 (3): 207–16. doi:10.1016/j.phrs.2007.01.012. PMID 17349800.
- ^ Brunmark A, Cadenas E (1989). "Redox and addition chemistry of quinoid compounds and its biological implications". Free Radical Biology & Medicine. 7 (4): 435–77. doi:10.1016/0891-5849(89)90126-3. PMID 2691341.
- ^ Swiezewska E, Danikiewicz W (July 2005). "Polyisoprenoids: structure, biosynthesis and function". Progress in Lipid Research. 44 (4): 235–58. doi:10.1016/j.plipres.2005.05.002. PMID 16019076.
- ^ a b Raetz CR, Garrett TA, Reynolds CM, Shaw WA, Moore JD, Smith DC, et al. (May 2006). "Kdo2-Lipid A of Escherichia coli, a defined endotoxin that activates macrophages via TLR-4". Journal of Lipid Research. 47 (5): 1097–111. doi:10.1194/jlr.M600027-JLR200. hdl:10919/74310. PMID 16479018.

- ^ Walsh CT (March 2004). "Polyketide and nonribosomal peptide antibiotics: modularity and versatility". Science. 303 (5665): 1805–10. Bibcode:2004Sci...303.1805W. doi:10.1126/science.1094318. PMID 15031493. S2CID 44858908.
- ^ Caffrey P, Aparicio JF, Malpartida F, Zotchev SB (2008). "Biosynthetic engineering of polyene macrolides towards generation of improved antifungal and antiparasitic agents". Current Topics in Medicinal Chemistry. 8 (8): 639–53. doi:10.2174/156802608784221479. PMID 18473889.
- ^ Minto RE, Blacklock BJ (July 2008). "Biosynthesis and function of polyacetylenes and allied natural products". Progress in Lipid Research. 47 (4): 233–306. doi:10.1016/j.plipres.2008.02.002. PMC 2515280. PMID 18387369.
- ^ Coones RT, Green RJ, Frazier RA (July 2021). "Investigating lipid headgroup composition within epithelial membranes: a systematic review". Soft Matter. 17 (28): 6773–6786. Bibcode:2021SMat...17.6773C. doi:10.1039/D1SM00703C. ISSN 1744-683X. PMID 34212942. S2CID 235708094.
- ^ 하인츠 E. (1996년)."식물 글리콜리피드: 구조, 격리 및 분석", 지질 방법론, Vol. 3. W.W. Christie(편집)의 211–332페이지.기름진 프레스, 던디.ISBN 978-0-9514171-6-4
- ^ Yashroy RC (1990). "Magnetic resonance studies of dynamic organisation of lipids in chloroplast membranes". Journal of Biosciences. 15 (4): 281–288. doi:10.1007/BF02702669. S2CID 360223.
- ^ van Meer G, Voelker DR, Feigenson GW (February 2008). "Membrane lipids: where they are and how they behave". Nature Reviews Molecular Cell Biology. 9 (2): 112–24. doi:10.1038/nrm2330. PMC 2642958. PMID 18216768.
- ^ Feigenson GW (November 2006). "Phase behavior of lipid mixtures". Nature Chemical Biology. 2 (11): 560–3. doi:10.1038/nchembio1106-560. PMC 2685072. PMID 17051225.
- ^ Wiggins PM (December 1990). "Role of water in some biological processes". Microbiological Reviews. 54 (4): 432–49. doi:10.1128/MMBR.54.4.432-449.1990. PMC 372788. PMID 2087221.
- ^ Raschke TM, Levitt M (May 2005). "Nonpolar solutes enhance water structure within hydration shells while reducing interactions between them". Proceedings of the National Academy of Sciences of the United States of America. 102 (19): 6777–82. doi:10.1073/pnas.0500225102. PMC 1100774. PMID 15867152.
- ^ Segré D, Ben-Eli D, Deamer DW, Lancet D (2001). "The lipid world" (PDF). Origins of Life and Evolution of the Biosphere. 31 (1–2): 119–45. Bibcode:2001OLEB...31..119S. doi:10.1023/A:1006746807104. PMID 11296516. S2CID 10959497.
- ^ Rosen ED, Spiegelman BM (December 2006). "Adipocytes as regulators of energy balance and glucose homeostasis". Nature. 444 (7121): 847–53. Bibcode:2006Natur.444..847R. doi:10.1038/nature05483. PMC 3212857. PMID 17167472.
- ^ Brasaemle DL (December 2007). "Thematic review series: adipocyte biology. The perilipin family of structural lipid droplet proteins: stabilization of lipid droplets and control of lipolysis". Journal of Lipid Research. 48 (12): 2547–59. doi:10.1194/jlr.R700014-JLR200. PMID 17878492.
- ^ Malinauskas T, Aricescu AR, Lu W, Siebold C, Jones EY (July 2011). "Modular mechanism of Wnt signaling inhibition by Wnt inhibitory factor 1". Nature Structural & Molecular Biology. 18 (8): 886–93. doi:10.1038/nsmb.2081. PMC 3430870. PMID 21743455.
- ^ Malinauskas T (March 2008). "Docking of fatty acids into the WIF domain of the human Wnt inhibitory factor-1". Lipids. 43 (3): 227–30. doi:10.1007/s11745-007-3144-3. PMID 18256869. S2CID 31357937.
- ^ Wang X (June 2004). "Lipid signaling". Current Opinion in Plant Biology. 7 (3): 329–36. doi:10.1016/j.pbi.2004.03.012. PMID 15134755.
- ^ Dinasarapu AR, Saunders B, Ozerlat I, Azam K, Subramaniam S (June 2011). "Signaling gateway molecule pages--a data model perspective". Bioinformatics. 27 (12): 1736–8. doi:10.1093/bioinformatics/btr190. PMC 3106186. PMID 21505029.
- ^ Eyster KM (March 2007). "The membrane and lipids as integral participants in signal transduction: lipid signal transduction for the non-lipid biochemist". Advances in Physiology Education. 31 (1): 5–16. doi:10.1152/advan.00088.2006. PMID 17327576. S2CID 9194419.
- ^ Hinkovska-Galcheva V, VanWay SM, Shanley TP, Kunkel RG (November 2008). "The role of sphingosine-1-phosphate and ceramide-1-phosphate in calcium homeostasis". Current Opinion in Investigational Drugs. 9 (11): 1192–205. PMID 18951299.
- ^ Saddoughi SA, Song P, Ogretmen B (2008). "Roles of bioactive sphingolipids in cancer biology and therapeutics". Lipids in Health and Disease. Subcellular Biochemistry. Vol. 49. pp. 413–40. doi:10.1007/978-1-4020-8831-5_16. ISBN 978-1-4020-8830-8. PMC 2636716. PMID 18751921.
- ^ Klein C, Malviya AN (January 2008). "Mechanism of nuclear calcium signaling by inositol 1,4,5-trisphosphate produced in the nucleus, nuclear located protein kinase C and cyclic AMP-dependent protein kinase". Frontiers in Bioscience. 13 (13): 1206–26. doi:10.2741/2756. PMID 17981624.
- ^ Boyce JA (August 2008). "Eicosanoids in asthma, allergic inflammation, and host defense". Current Molecular Medicine. 8 (5): 335–49. doi:10.2174/156652408785160989. PMID 18691060.
- ^ Bełtowski J (2008). "Liver X receptors (LXR) as therapeutic targets in dyslipidemia". Cardiovascular Therapeutics. 26 (4): 297–316. doi:10.1111/j.1755-5922.2008.00062.x. PMID 19035881.
- ^ Biermann M, Maueröder C, Brauner JM, Chaurio R, Janko C, Herrmann M, Muñoz LE (December 2013). "Surface code--biophysical signals for apoptotic cell clearance". Physical Biology. 10 (6): 065007. Bibcode:2013PhBio..10f5007B. doi:10.1088/1478-3975/10/6/065007. PMID 24305041.
- ^ Indiveri C, Tonazzi A, Palmieri F (October 1991). "Characterization of the unidirectional transport of carnitine catalyzed by the reconstituted carnitine carrier from rat liver mitochondria". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1069 (1): 110–6. doi:10.1016/0005-2736(91)90110-t. PMID 1932043.
- ^ Parodi AJ, Leloir LF (April 1979). "The role of lipid intermediates in the glycosylation of proteins in the eucaryotic cell". Biochimica et Biophysica Acta (BBA) - Reviews on Biomembranes. 559 (1): 1–37. doi:10.1016/0304-4157(79)90006-6. PMID 375981.
- ^ Helenius A, Aebi M (March 2001). "Intracellular functions of N-linked glycans". Science. 291 (5512): 2364–9. Bibcode:2001Sci...291.2364H. doi:10.1126/science.291.5512.2364. PMID 11269317. S2CID 7277949.
- ^ Nowicki M, Müller F, Frentzen M (April 2005). "Cardiolipin synthase of Arabidopsis thaliana". FEBS Letters. 579 (10): 2161–5. doi:10.1016/j.febslet.2005.03.007. PMID 15811335. S2CID 21937549.
- ^ Gohil VM, Greenberg ML (February 2009). "Mitochondrial membrane biogenesis: phospholipids and proteins go hand in hand". The Journal of Cell Biology. 184 (4): 469–72. doi:10.1083/jcb.200901127. PMC 2654137. PMID 19237595.
- ^ Hoch FL (March 1992). "Cardiolipins and biomembrane function" (PDF). Biochimica et Biophysica Acta (BBA) - Reviews on Biomembranes. 1113 (1): 71–133. doi:10.1016/0304-4157(92)90035-9. hdl:2027.42/30145. PMID 1550861.
- ^ "Steroids". Elmhurst. edu. Archived from the original on 2011-10-23. Retrieved 2013-10-10.
- ^ Chirala SS, Wakil SJ (November 2004). "Structure and function of animal fatty acid synthase". Lipids. 39 (11): 1045–53. doi:10.1007/s11745-004-1329-9. PMID 15726818. S2CID 4043407.
- ^ White SW, Zheng J, Zhang YM (2005). "The structural biology of type II fatty acid biosynthesis". Annual Review of Biochemistry. 74: 791–831. doi:10.1146/annurev.biochem.74.082803.133524. PMID 15952903.
- ^ Ohlrogge JB, Jaworski JG (June 1997). "Regulation of fatty acid synthesis". Annual Review of Plant Physiology and Plant Molecular Biology. 48: 109–136. doi:10.1146/annurev.arplant.48.1.109. PMID 15012259. S2CID 46348092.
- ^ Grochowski LL, Xu H, White RH (May 2006). "Methanocaldococcus jannaschii uses a modified mevalonate pathway for biosynthesis of isopentenyl diphosphate". Journal of Bacteriology. 188 (9): 3192–8. doi:10.1128/JB.188.9.3192-3198.2006. PMC 1447442. PMID 16621811.
- ^ Lichtenthaler HK (June 1999). "The 1-dideoxy-D-xylulose-5-phosphate pathway of isoprenoid biosynthesis in plants". Annual Review of Plant Physiology and Plant Molecular Biology. 50: 47–65. doi:10.1146/annurev.arplant.50.1.47. PMID 15012203.
- ^ a b Schroepfer GJ (1981). "Sterol biosynthesis". Annual Review of Biochemistry. 50: 585–621. doi:10.1146/annurev.bi.50.070181.003101. PMID 7023367.
- ^ Lees ND, Skaggs B, Kirsch DR, Bard M (March 1995). "Cloning of the late genes in the ergosterol biosynthetic pathway of Saccharomyces cerevisiae--a review". Lipids. 30 (3): 221–6. doi:10.1007/BF02537824. PMID 7791529. S2CID 4019443.
- ^ a b Bhagavan NV (2002). Medical Biochemistry. San Diego: Harcourt/Academic Press. ISBN 978-0-12-095440-7.
- ^ Russo GL (March 2009). "Dietary n-6 and n-3 polyunsaturated fatty acids: from biochemistry to clinical implications in cardiovascular prevention". Biochemical Pharmacology. 77 (6): 937–46. doi:10.1016/j.bcp.2008.10.020. PMID 19022225.
- ^ Riediger ND, Othman RA, Suh M, Moghadasian MH (April 2009). "A systemic review of the roles of n-3 fatty acids in health and disease". Journal of the American Dietetic Association. 109 (4): 668–79. doi:10.1016/j.jada.2008.12.022. PMID 19328262.
- ^ Galli C, Risé P (2009). "Fish consumption, omega 3 fatty acids and cardiovascular disease. The science and the clinical trials". Nutrition and Health. 20 (1): 11–20. doi:10.1177/026010600902000102. PMID 19326716. S2CID 20742062.
- ^ Micha R, Mozaffarian D (2008). "Trans fatty acids: effects on cardiometabolic health and implications for policy". Prostaglandins, Leukotrienes, and Essential Fatty Acids. 79 (3–5): 147–52. doi:10.1016/j.plefa.2008.09.008. PMC 2639783. PMID 18996687.
- ^ Dalainas I, Ioannou HP (April 2008). "The role of trans fatty acids in atherosclerosis, cardiovascular disease and infant development". International Angiology. 27 (2): 146–56. PMID 18427401.
- ^ Mozaffarian D, Willett WC (December 2007). "Trans fatty acids and cardiovascular risk: a unique cardiometabolic imprint?". Current Atherosclerosis Reports. 9 (6): 486–93. doi:10.1007/s11883-007-0065-9. PMID 18377789. S2CID 24998042.
- ^ Astrup A, Dyerberg J, Selleck M, Stender S (2008), "Nutrition transition and its relationship to the development of obesity and related chronic diseases", Obes Rev, 9 (S1): 48–52, doi:10.1111/j.1467-789X.2007.00438.x, PMID 18307699, S2CID 34030743
- ^ Astrup A (February 2005). "The role of dietary fat in obesity". Seminars in Vascular Medicine. 5 (1): 40–7. doi:10.1055/s-2005-871740. PMID 15968579.
- ^ Astrup A (2008). "Dietary management of obesity". Journal of Parenteral and Enteral Nutrition. 32 (5): 575–7. doi:10.1177/0148607108321707. PMID 18753397.
- ^ Beresford SA, Johnson KC, Ritenbaugh C, Lasser NL, Snetselaar LG, Black HR, et al. (February 2006). "Low-fat dietary pattern and risk of colorectal cancer: the Women's Health Initiative Randomized Controlled Dietary Modification Trial". Journal of the American Medical Association. 295 (6): 643–54. doi:10.1001/jama.295.6.643. PMID 16467233.

- ^ Howard BV, Manson JE, Stefanick ML, Beresford SA, Frank G, Jones B, Rodabough RJ, Snetselaar L, Thomson C, Tinker L, Vitolins M, Prentice R (January 2006). "Low-fat dietary pattern and weight change over 7 years: the Women's Health Initiative Dietary Modification Trial". Journal of the American Medical Association. 295 (1): 39–49. doi:10.1001/jama.295.1.39. PMID 16391215.

- ^ "The Nutrition Source". T. H. Chan School of Public Health. Harvard University.
- ^ "Fats and Cholesterol: Out with the Bad, In with the Good — What Should You Eat? – The Nutrition Source". Harvard School of Public Health.
참고 문헌 목록
- Bhagavan NV (2002). Medical Biochemistry. San Diego: Harcourt/Academic Press. ISBN 978-0-12-095440-7.
- Devlin TM (1997). Textbook of Biochemistry: With Clinical Correlations (4th ed.). Chichester: John Wiley & Sons. ISBN 978-0-471-17053-2.
- Stryer L, Berg JM, Tymoczko JL (2007). Biochemistry (6th ed.). San Francisco: W.H. Freeman. ISBN 978-0-7167-8724-2.
- van Holde KE, Mathews CK (1996). Biochemistry (2nd ed.). Menlo Park, California: Benjamin/Cummings Pub. Co. ISBN 978-0-8053-3931-4.
외부 링크
| 무료 사전인 Wiktionary에서 지질학을 찾아봐. |
| 위키미디어 커먼즈에는 리피드와 관련된 미디어가 있다. |
소개
- 지질 관련 웹사이트 목록
- Nature Lipidomics Gateway – 최근 지질 연구의 개요 및 요약
- Lipid Library – 지질 화학 및 생화학에 대한 일반 참고 자료
- Cyberlipid.org – 지질을 위한 자료 및 역사.
- 분자 컴퓨터 시뮬레이션 – 지질막 모델링
- 지질, 막 및 베시클 밀매 – 생화학, 분자생물학 및 세포생물학 가상 도서관
명명법
데이터베이스
- LIPID MAPS – 포괄적인 지질 및 지질 관련 유전자/단백질 데이터베이스
- LipidBank – 지질 및 관련 특성, 스펙트럼 데이터 및 참조 자료의 일본 데이터베이스
일반
- ApoloLipids – 이상지질혈증과 심혈관 질환 예방 및 치료 정보 제공 및 지속적인 의료 교육 프로그램 제공
- 전국 지질학회 – 이상지질미증 및 기타 콜레스테롤 관련 장애로 인한 질병성 및 사망률을 예방하고자 하는 의료전문가를 위한 전문 의료교육기관.