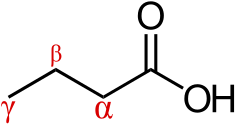
베타-하이드록시 베타-메틸부티르산
beta-Hydroxy beta-methylbutyric acid | |
 상단: β-히드록시 β-메틸부티르산 하단: β-히드록시 β-메틸부티레이트 | |
| 임상자료 | |
|---|---|
| 기타 이름 | 결합산 형태: β-hydroxyisovaleric 3산화옥시소발레르산 결합 기준 형식: 히드록시메틸부티레이트 |
| 경로: 행정 | 구강[1] 또는 비구강적[2] 사용 |
| ATC 코드 |
|
| 법적현황 | |
| 법적현황 |
|
| 약동학 데이터 | |
| 대사물 | HMB-CoA, HMG-CoA, 메발론산염, 콜레스테롤, 아세틸-CoA, 아세토아세테이트, β-히드록시부티레이트 |
| 행동 개시 | HMB-FA: 30~60분[1] HMB-Ca: 1~2시간[1] |
| 제거 반감기 | HMB-FA: 3시간[1] HMB-Ca: 2.5시간[1] |
| 배설 | 신장(10–40%)[1][3] |
| 식별자 | |
| |
| CAS 번호 | |
| 펍켐 CID | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| CompTox 대시보드 (EPA) | |
| ECHA InfoCard | 100.128.078 |
| 화학 및 물리적 데이터 | |
| 공식 | C5H10O3 |
| 어금질량 | 118.1987 g·190−1 |
| 3D 모델(JSmol) | |
| 밀도 | 20[4]°C에서 ~1.1 g/cm3 |
| 녹는점 | -80°C(-112°F) (유리)[5] |
| 비등점 | 7mmHg에서[4][6] 128°C(262°F) |
| |
| |
| (iii) | |
인간의 식사 보충 물과 근육에 사람들로 인해 낭비한다고 영양 지원을 제공하는 상처 회복을 촉진시키기 위한 것이다 특정한 의학적 음식에서 재료로 사용된다 β-Hydroxyβ-methylbutyric acid[노트 1](HMB), 포기하게 짝 염기, β-hydroxy β-methylbutyrate로 알려져 있는 자연적으로 발생된 물질이다. cance에r 또는 HIV/에이즈.[sources 1]건강한 성인의 경우 HMB로 보충하면 운동으로 인한 근육의 크기, 근력, 날씬한 체질량의 증가, 운동으로 인한 골격근손상 감소, 유산소운동 성능 향상, 운동복구가 촉진되는 것으로 나타났다.[sources 2]의학적인 검토와 메타 분석은 HMB 보충제가 나이와 관련된 근육 손실을 경험하는 개개인의 날씬한 신체 질량과 근력을 보존하거나 증가시키는 데에도 도움이 된다는 것을 보여준다.[note 2][11][12][13]HMB는 부분적으로 단백질의 생성을 자극하고 근육 조직에서 단백질의 분해를 억제함으로써 이러한 효과를 만들어 낸다.[11][14][15]성인의 식이요법 보조식품으로 장기간 사용해도 별다른 부작용은 발견되지 않았다.[16][17][18]
HMB는 하루에 3g을 복용할 때 매달 약 30~50달러의 비용으로 식이 보조제로 판매된다.[16][19][20]HMB는 또한 Sure, June, Myoplex의 특정 제형을 포함한 몇몇 영양 제품에도 포함되어 있다.[8][21]HMB는 또한 알팔파, 아스파라거스, 아보카도, 콜리플라워, 자몽, 메기와 같은 특정한 음식에도 미미한 양으로 존재한다.[22][23]
인체 골격근육에 대한 HMB의 영향은 Steven L에 의해 처음 발견되었다.1990년대 중반 아이오와 주립대학에서 닛센.[8][24]2018년 현재,[update] HMB는 미국 대학 운동 협회, 세계 도핑 금지 기구 또는 다른 저명한 국가 또는 국제 운동 기구로부터 금지되지 않았다.[25][26][27]2006년, 미국의 대학생 운동선수들 중 약 2%만이 HMB를 식이 보조제로 사용했다.[19][28]2017년 현재 HMB는 젊은 선수들 사이에서 인체유발 보충제로서 널리 사용되고 있는 것을 발견했다.[29]
사용하다
사용 가능한 양식
HMB는 자유산 형태인 β-하이드록시 β-메틸부티르산(HMB-FA)에서 처방전 없이 살 수 있는 식이요법 보조제로 판매되며, 콘게이트 베이스의 모노하이드레이트인 β-히드록시 β-메틸부티레이트 모노하이드레이트(HMB-Ca, CaHMB)로 판매된다.[19][20]HMB의 대사 전구체인 L-루신 중 극히 일부만이 HMB로 대사되기 때문에 혈장과 근육에 있는 화합물의 약리학적 활성 농도는 HMB를 직접 보충해야만 얻을 수 있다.[1][30][31]건강한 성인은 하루에 약 0.3g을 생산하는데 반해 보충 HMB는 보통 하루에 3~6g씩 복용한다.[17]HMB는 하루에 3그램의 선량으로 복용할 때 월 30-50달러의 비용으로 판매된다.[16]HMB는 아보트 연구소가 판매하는 여러 영양 제품 및 의료 식품에도 포함되어 있으며(예: 보증, 후베네, 미오플렉스 특정 제조법)[8][21] 알팔파, 아스파라거스, 아보카도, 콜리플라워, 자몽, 메기 등 특정 식품에는 미미한 양으로 존재한다.[22][23]
메디컬
보충 HMB는 근육낭비 상태, 특히 근관절벽증에서 날씬한 체중을 보존하기 위한 치료법으로 임상시험에 사용되어 왔으며, 저항운동과 연계한 부속치료법으로 임상시험에서 연구되어 왔다.[11][16][30]HMB 보충제는 두 차례의 의학적 검토와 일곱 번의 무작위 통제 실험에 대한 메타분석을 바탕으로 석관 노인들의 희박한 근육량과 근력을 보존하거나 증가시킬 수 있다.[note 2][11][12][13]HMB는 노인들의 지방질량에 큰 영향을 주지 않는 것으로 보인다.[11][12]예비 임상 증거에 따르면 HMB 보충제는 또한 침대 휴식 중 근육 위축을 예방할 수 있다.[11][29]증거들이 늘어나고;[16][30][32]결과적으로 임상 증거의 22016년 비평들의 저자들은 그 pr을 추천했다 HMB의 저감을 위한 영양 지원의 효율성, 또는 심지어 역전, 근육, 근육 기능 및 근력의 암 성악액질과 같은hypercatabolic 질병 상태에 발생하는 손실을 지원한다.eventiond 일반적으로 석관 및 근육낭비 치료는 HMB로 보충하는 것, 규칙적인 저항 운동, 고단백 식단의 섭취를 포함한다.[16][30]
근육 낭비를 치료하기 위해 HMB를 사용한 임상 실험은 다른 복용 요법으로 하루에 3g의 HMB를 투여했다.[16]한 리뷰에 따르면, 최적의 복용법은 하루 3회 1그램으로 투여하는 것인데, 이는 하루 동안 HMB의 혈장 농도를 증가시키기 때문이다.[16] 그러나[update] 2016년 현재, 근육 낭비 조건에 대한 최고의 복용법은 여전히 조사되고 있다.[30]
HMB(즉, Sure and Juven의 특정 제제)를 함유한 일부 브랜드 제품은 HIV/AIDS 또는 암으로 인한 근육 낭비를 가진 개인에 대한 의사의 관리 하에 영양 지원을 제공하거나, 수술이나 상해에 따른 상처 치유를 촉진하거나, 메디카에서 다른 방법으로 권고한 경우에 사용하고자 하는 의료 식품이다.전문직의[sources 3]2인분 당 3g, L-아르기닌 14g, L-글루타민 14g이 함유된 영양제 '후베네'는 AIDS와 암에 걸린 개인에서 임상실험을 하는 동안 류마티스성 가습증이 아닌 마른 체질을 개선하는 것으로 나타났다.[2][17][33][34]치료 효능을 적절히 판단하기 위해서는 수개월에 걸쳐 후베니아와 함께 암 캐쉬샤 치료와 관련된 추가 연구가 필요하다.[17][33]
성능 향상
적절한 운동 프로그램으로 하루 3g의 HMB를 섭취하는 식이보충제는 운동으로 인한 근육의 크기, 근력, 힘, 체중의 증가, 운동으로 인한 골격근손상 감소,[note 3] 고강도 운동으로부터 회복이 촉진되는 것으로 나타났다.[sources 2]제한된 임상 연구에 기초하여 HMB 보충은 또한 고강도의 인터벌 트레이닝과 결합할 때 유산소 운동 성능을 향상시키고 유산소 체력의 이득을 증가시킬 수 있다.[12][14]HMB의 이러한 효과는 고강도의 저항력이나 유산소 운동을 하는 훈련되지 않은 개인과 운동선수들에게서 더 뚜렷하게 나타난다.[1][12][14]저항력 훈련된 모집단에서는 HMB가 근력과 날씬한 체구에 미치는 영향은 제한적이다.[37]HMB는 근세동맥근단백합성을 자극하고 라파마이신 콤플렉스1(mTORC1)의 기계론적 표적 활성화, 골격근의 프로테아솜 매개 단백질 분해 억제 등 다양한 메커니즘을 통해 근육의 크기, 힘, 질량, 힘, 회복에 부분적으로 영향을 미친다.[14][15]
장시간 또는 고강도 운동으로 골격근 손상을 줄이기 위한 HMB 보충제의 효능은 운동과 관련된 시간에 의해 영향을 받는다.[1][36]단 한 번의 운동으로 인한 골격근 손상의 가장 큰 감소는 운동 1~2시간 전에 섭취하거나 운동 30~60분 전에 섭취했을 때 발생하는 것으로 나타났다.[1]
2006년, 미국의 대학생 운동선수들 중 약 2%만이 HMB를 식이 보조제로 사용했다.[19][28]2017년 현재 HMB는 선수들 사이에서 인체유발 보충제로서 널리 사용되고 있는 것을 발견했다.[29]2018년 현재,[update] HMB는 미국 대학 운동 협회, 세계 도핑 금지 기구 또는 다른 저명한 국가 또는 국제 운동 기구로부터 금지되지 않았다.[25][26][27]
부작용
성인 인간에서 HMB의 안전 프로파일은 인간과 동물 연구에서 임상 실험에서 나온 증거에 기초한다.[16][18]인간에게 있어서, HMB를 하루에 3그램씩 복용했을 때, 젊은 성인이나 노년층의 어떤 부작용도 보고되지 않았다.[16][17][18]성인들이 하루에 6그램의 HMB를 최대 2달 동안 복용하는 것에 대한 연구도 어떤 부작용도 보고되지 않았다.[17][18]성장기 어린 쥐와 가축에 대한 보충 HMB를 사용한 연구는 임상 화학 또는 관찰 가능한 특성에 근거하여 어떠한 부작용도 보고하지 않았다.[1][23] 18세 미만의 인간에게는 보충 HMB의 안전에 대한 제한된 데이터가 있다.[1]랫드 모델에서 확인된 NOAL(관찰되지 않는 역효과 수준)[note 4][18][23]에 대한 인체 등가선량은 하루에 약 0.4 g/kg의 체중이다.
두 동물 연구는 임신한 돼지의 HMB 보충제가 자손에게 미치는 영향을 조사했으며, 태아에게 어떠한 부작용도 보고하지 않았다.[23]임산부에 대한 보충적 HMB를 이용한 임상시험은 실시되지 않았으며,[38] 임산부와 수유 여성은 건강보조식품에 HMB를 포함시키기 위해 면허를 부여하는 회사인 Martha Technologies, Inc.에서 HMB를 복용하지 않는 것이 안전연구의 부족으로 권고되고 있다.[38]
약리학
• PA:인산
• mTOR: 라파마이신의 기계론적 표적
• AMP: 아데노신 단인산염
• ATP: 아데노신 3인산염
• AMPK: AMP 활성 단백질 키나아제
• PGC#1α: 과산화지질 증식기 활성 수용체 감마 활성제-1α
• S6K1: p70S6 키나제
• 4EBP1: 진핵 변환 시작 인자 4E 바인딩 단백질 1
• eIF4E: 진핵 변환 시작 인자 4E
• RPS6: 리보솜 단백질 S6
• eEF2: 진핵연장 인자 2
• RE: 저항 운동, EE: 지구력 운동
• Myo: myofibrillar, Mito: mitochondrial
• AA: 아미노산
• HMB: β-히드록시 β-메틸부티르산
• ↑은 활성화를 나타낸다.
• τ은 억제를 나타낸다.
약리역학
인체 골격근 단백질 합성의 HMB 유도 증가를 매개하는 신호 캐스케이드의 몇 가지 구성요소가 체내에서 확인되었다.[14][15]HMB의 물질 전구체, L-leucine과 비슷하게 HMB 인간의 골격에 붙은 근육에서 단백질 생합성에 휴대 리보솜에서 mTORC1의 즉각적인 목표의 인산화(즉 p70S6을 통해 이어진다rapamycin(mTOR)과 mTORC1의 이후 활성화의 기계적 목표의 인산화를 통해 단백질 합성을 증가시키는 것으로 나타났다.키나se 및 번역 억제 단백질 4EBP1).[note 5][15][39][41]몇몇 비인간의 동물 종에서 HMB로 보충하는 것은 알려지지 않은 메커니즘을 통해 성장 호르몬과 인슐린과 유사한 성장 인자 1(IGF-1)의 혈청 농도를 증가시키고, 다시 mTOR 인산화 증가를 통한 단백질 합성을 촉진하는 것으로 나타났다.[1][16][23]인간의 제한된 임상 증거를 바탕으로 보충 HMB는 저항운동에 반응하여 성장호르몬과 IGF-1의 분비를 증가시키는 것으로 보인다.[14]
2016년[update] 현재 HMB 유도 근육단백질 파괴 감소를 매개하는 신호 캐스케이드는 생체내 인간 프로테롤리시스를 감쇠시킨다는 것이 잘 확립되어 있지만 살아 있는 인간에게서는 확인되지 않고 있다.[11][15]L-루신과는 달리 HMB는 인체에서 인슐린에 의존하지 않는 방식으로 근육단백질을 감쇠시킨다.[note 6][15]HMB는 골격근의 유비퀴틴-단백질 계통의 19S와 20S 하위 단위를 억제하고, 정체불명의 메커니즘을 통해 골격근핵의 세포사멸을 억제함으로써 인간의 근육단백질 파괴를 감소시키는 것으로 여겨진다.[15][16][41]
동물 연구에 따르면, HMB는 골격근 내에서 콜레스테롤로 대사되는 것으로 보이며, 이것은 근육 세포막에 통합되어 막의 무결성과 기능을 강화시킬 수 있다.[34][35]근육 단백질 대사에 대한 HMB의 영향은 근육 세포 구조를 안정시키는데 도움을 줄 수 있다.[23]한 리뷰는 격렬한 운동을 한 후 인간의 근육 손상 바이오마커의 혈장 농도(즉, 크레아틴키나아제, 젖산탈수소효소 등의 근육 효소)에서 HMB가 관찰한 것은 근육 세포막 기능의 콜레스테롤 매개 개선 때문일 수 있다고 제안했다.[note 3][23]
HMB는 체외에서 골격근의 재생능력을 잠재적으로 증가시키는 인간 근위상세포의 증식, 분화, 융합을 특정 근위축 규제인자(예: myoD, myogenin)와 유전자 전사인자(예: MEF2)의 단백질 발현을 증가시켜 자극하는 것으로 나타났다.[1][17][42]체외에서 HMB 유도 인간 근위성 세포 증식은 미토겐 활성 단백질 키나제 ERK1과 ERK2의 인산화를 통해 매개된다.[17][23][42]인체 근위성에 의한 인체 근위상 분화와 체외 근육 조직으로의 근위상 세포의 가속화된 융합은 세린/트레오닌 특이 단백질 키나제인 Akt의 인산화를 통해 매개된다.[17][23][42]
약동학
HMB의 자유산()HMB-FA과 단수화칼슘소금() HMB-Ca형태는 약동학이 다르다.[1][20]HMB-FA는 혈류로 더 쉽게 흡수되며 HMB-Ca(2.5시간)에 비해 제거 반감기(3시간)가 길다.[1][20]HMB-FA의 조직 흡수 및 활용도는 HMB-Ca보다 25~40% 높다.[1][20]소변으로 배설되는 섭취된 선량의 분율은 두 형태 간에 차이가 없다.[1]
섭취 후, 내장의 칼슘 모이질이 분해된 후 β-하이드록시 β-메틸부티레이트로 변환된다.[1]HMB-Ca 투여량 양식을 섭취할 때 HMB의 최고 혈장 농도가 발생하는 크기와 시간은 투여량과 동시 섭취량에 따라 달라진다.[1]HMB-Ca 선량이 높을수록 흡수 속도가 증가하여, 선형 선량-반응 관계의 기대치보다 불균형적으로 크고 낮은 선량에 비해 더 빨리 발생하는 피크 플라즈마 HMB 수준(Cmax)이 발생한다.[note 7][1]당분이 함유된 HMB-Ca를 소비하면 HMB 흡수 속도가 느려져 나중에 발생하는 피크 플라즈마 HMB 수치가 낮아진다.[note 7][1]
HMB는 신장을 통해 제거되며, 섭취된 용량의 약 10~40%는 소변에서 변하지 않고 배설된다.[1][3]나머지 60~90%는 조직 내에 유지되거나 HMB 대사물로 배설된다.[1][3]소변에서 변하지 않은 HMB의 주어진 용량 중 분율은 용량에 따라 증가한다.[note 8][1]
신진대사
HMB의 신진대사는 β-히드록시 β-메틸부티릴-CoA(HMB-CoA)로 변환하는 특성화되지 않은 효소에 의해 촉매된다.[43][46]HMB-CoA는 β-메틸크로토닐-CoA(MC-CoA) 또는 히드록시메틸글루타릴-CoA(Hydroxymethyl glutaryl-CoA)를 생성하여 에노일-CoA 또는 또 다른 비특성 효소에 의해 대사된다.[3][46]그런 다음 MC-CoA는 메틸크로토닐-CoA 카르복실라아제 효소에 의해 메틸글루타코닐-CoA(MG-CoA)로 변환되며, 이후 메틸글루타코닐-CoA 하이드라타아제에 의해 HMG-CoA로 변환된다.[3][46][47]그런 다음 HMG-CoA는 HMG-CoA 라야제에 의해 아세틸-CoA와 아세토아세이트로 분해되거나 메발론산 경로를 통한 콜레스테롤 생성에 사용된다.[3][46]
생합성
HMB는 브랜치 체인 아미노산인 L-루신의 신진대사를 통해 인체 내에서 합성된다.[46]건강한 개인에서는 몇 시간 후 식이성 L-루신의 약 60%가 대사되며, 식이성 L-루신은 약 5%(2~10% 범위)가 HMB로 변환된다.[3][16][46]
L-루신 대사의 대부분은 처음에 α-케투아소카프로이트(α-KIC)를 생성하는 브랜딩 체인 아미노산 아미노트란스페라제 효소에 의해 촉매된다.[3][46]α-KIC는 대부분 미토콘드리아 효소 브랜치체인 α-케토아시드 탈수소효소에 의해 대사되어 이소발레릴-CoA로 전환된다.[3][46]이소발레릴-CoA는 이후 이소발레릴-CoA 탈수소효소에 의해 대사되어 MC-CoA로 변환되는데, 이는 아세틸-CoA와 다른 화합물의 합성에 사용된다.[46]바이오틴 결핍 시 에노일-코아 하이드라타아제와 알려지지 않은 티오에스테라아제 효소를 통해 MC-CoA로부터 HMB-CoA, HMB-CoA를 각각 HMB로 변환할 수 있다.[43][44][48][44]A relatively small amount of α-KIC is metabolized in the liver by the cytosolic enzyme 4-hydroxyphenylpyruvate dioxygenase (KIC dioxygenase), which converts α-KIC to HMB.[3][46][49] In healthy individuals, this minor pathway – which involves the conversion of L-leucine to α-KIC and then HMB – is the predominant route of HMB synthesis.[3][46]
화학
β-히드록시β-메틸부티르산은 단카르복시리β-히드록시산이며 분자식을 가진 천연산이다. CHO5103.[50][51] 상온에서 순수 β-하이드록시β-메틸부티르산은 물에 용해되는 투명하고 무색에서 연한 황색 액체로 발생한다.[6][52][53]β-히드록시β-메틸부티르산은 pK가a 4.4인 약한 산이다.[5]굴절률( = ){\mathrm은 1.42이다.[5]
화학구조
β-히드록시 β-메틸부티르산은 유기화합물의 카르복실산 계열의 일원이다.[50]베타카본에 위치한 히드록실 기능성 그룹과 메틸 대체물을 가진 부티르산의 구조 아날로그다.[50][54]확장하여 다른 구조 아날로그에는 β-히드록시부티르산 및 β-메틸부티르산이 포함된다.[50][54]
합성
β-히드록시 β-메틸부티르산으로의 다양한 합성 루트가 개발되었다.최초 보고된 화학 합성물은 알켄, 비시날 디올 및 알코올 전구체의 산화에 의해 HMB에 접근했다.
- 1877년 러시아 화학자 마이클과 알렉산더 자이체프는 2-메틸펜트-4-엔-2-올을 크롬산(HCRO24)으로 산화시켜 HMB를 준비한다고 보고했다.[55]
- 1880년과 1889년, Schirokoff과 Reformatsky(각각)이 근접한 디올 4-methylpentane-1,2,4-triol의 산패 칼륨과 산화적 난할 HMB[56][57]처럼 차가운 희석하다 KMnO4 그것은 산 KMnO4 furt 뜨거운 인접의 cis-diols에 알켄 oxidises 이 결과는 가장 가까운 첫번째 융합에 관련된 –(KMnO4)수익률 과망가 니즈산 보도했다.그녀의 oxidises는 카보닐-화합물에 연결되며, 알켄 산화에 뜨거운 산성 조건을 사용할 때는 diol 중간을 얻을 수 없다.[58]즉, 경주용 4-메틸펜탄-1,2,4-트리올은 2-메틸펜탄-4-엔-2-올의 파생상품이며, β-히드록시 β-메틸부티르산은 두 가지 모두의 파생상품이다.
- 1892년 콘다코우는 3-메틸부탄-1,3-다이올의 과망간산화에 의한 HMB의 준비를 보고했다.[59]
실험 조건에 따라 아세톤과 케틴을 첨가하면 β-isovalerolactone 또는 4,4-dimethyloxetan-2-1 중 하나가 생성되며,[60][61] 이 두 가지 모두 HMB의 결합 기반을 산출하기 위해 기본 조건에서 가수 분해된다.헤일로폼 반응은 하이포브롬산나트륨 또는 차아염소산나트륨을 함유한 디아세톤 알코올의 메틸-케톤 부위의 철저한 할로겐화와 관련된 HMB로의 또 다른 경로를 제공한다;[5][62][63] 디아세톤 알코올은 아세톤의 알돌 응축에서 쉽게 구할 수 있다.[62]HMB에 대한 유기측정학적 접근방식은 일산화탄소와 펜톤의 시약(과산화수소 및 철철)으로 테르트 부틸 알코올의 탄복제를 포함한다.[5][64]또는 균 갈락토미시스 reessi에 의한 β-메틸부티르산 미생물 산화를 통해 HMB를 준비할 수 있다.[65]
체액 감지
| 바이오유체 | 연령대 | 집중력 | 원천 | ||
|---|---|---|---|---|---|
| 평균 | 범위 | 단위 | |||
| 혈장 | 성인(18+) | 4.0 | 0–10.0 | μM | [50] |
| CSF | 성인(18+) | 4.0 | 2.0–6.0 | μM | [50] |
| 사르코플라스마 | 성인(21-23) | 7.0 | 4.0–10.0 | μM | [15] |
| 모유 | 성인(18+) | – | 42–164 | μg/L | [66] |
| 오줌 | 성인(18+) | – | 3.2–25.0 | μmol/mmol 크레아티닌 | [50] |
| 오줌 | 어린이(1–18) | – | 0–68 | μmol/mmol 크레아티닌 | [50] |
자연적으로 생성된 HMB의 농도는 핵자기 공명 분광법, 액체 크로마토그래피-질량 분광법, 기체 크로마토그래피-질량 분광법을 사용하여 여러 인체 체액에서 측정되었다.[66][50]건강한 성인의 혈장 및 뇌척수액(CSF)에서 HMB의 어금니 평균 농도는 4.0마이크로몰라(μM)로 측정되었고,[50] 21~23세의 건강한 남성의 근육내 유체 내 HMB의 평균 농도는 7.0μM으로 측정되었다.[15]어느 연령의 건강한 개인의 소변에서, HMB의 배설된 비뇨기 농도는 크레아티닌의 밀리몰(μmol/mmol) 당 0~68 마이크로몰의 범위에서 측정되었다.[50]건강한 젖먹이 여성의 모유에서 HMB와 L-루신은 42–164 μg/L과 2.1–88.5 mg/L의 범위에서 측정되었다.[66]이에 비해 HMB는 건강한 젖소의 우유에서 <20–29 μg/L> 농도로 검출되어 측정되었다.[67]이 농도는 혈장 내 화합물의 약리학적 활성 농도를 얻기 위해 HMB의 적절한 식이 공급원이 되기에는 너무 낮다.[67]
참가자들이 단식 중 순수 2.42g을 섭취한 연구에서 평균 혈장 HMB 농도는 30분 후 기준치 5.1에서 408μM으로 증가했다.[15]착상 후 150분 동안 참가자들의 평균 혈장 HMB 농도는 275μM이었다.[15]
소변과 혈장의 비정상적인 HMB 농도는 특히 대사 장애의 경우 진단 바이오마커 역할을 할 수 있는 여러 질병 상태에서 파악되었다.[50]다음 표에는 소변이나 혈장에서 검출된 관련 HMB 농도와 함께 이러한 질환의 일부가 나열되어 있다.[50]
| 의학적 상태 | 바이오유체 | 연령대 | 집중력 | 원천 | ||
|---|---|---|---|---|---|---|
| 평균 | 범위 | 단위 | ||||
| 바이오티니다아제 결핍증† | 피 | 성인(18+) | 9.5 | 0–19.0 | μM | [50] |
| 바이오티니다아제 결핍증† | 피 | 어린이(1-13) | 88.0 | 10.0–166.0 | μM | [50] |
| 바이오티니다아제 결핍증† | 오줌 | 어린이(1-13) | 275.0 | 50.0–500.0 | μmol/mmol 크레아티닌 | [50] |
| 3-메틸글루타콘산뇨증(타입 I)† | 오줌 | 어린이(1-13) | 200.0 | 150.0–250.0 | μmol/mmol 크레아티닌 | [50] |
| 어시노필성 식도염 | 오줌 | 어린이(1-13) | 247.4 | 0–699.4 | μmol/mmol 크레아티닌 | [50] |
| 위내식 역류성 질환 | 오줌 | 어린이(1-13) | 119.8 | 5.5–234.0 | μmol/mmol 크레아티닌 | [50] |
| HMG-CoA 리아제 결핍증† | 오줌 | 어린이(1-13) | 2030.0 | 60.0–4000.0 | μmol/mmol 크레아티닌 | [50] |
| MC-CoA 카르복실라제 결핍증† | 오줌 | 어린이(1-13) | 30350.0 | 1700.0–59000.0 | μmol/mmol 크레아티닌 | [50] |
| A는 그 의학적 상태가 대사 장애라는 것을 나타낸다. | ||||||
역사
HMB의 첫 번째 보고된 화학 합성은 1877년 러시아의 화학자 마이클과 알렉산더 자이체프에 의해 출판되었다.[55]HMB는 1941년 레오폴드 루지치카에 의해 에리트로필름 쿠밍가(마다가스카나 나무)의 껍질에서 격리되었다.[68]인간 대사물로서 HMB가 분리되었다고 가장 일찍 보고된 것은 1968년 다나카씨와 동료들이 이등변산혈증 환자와 격리시킨 것이다.[69][70]
인체 골격근육에 대한 HMB의 영향은 Steven L에 의해 처음 발견되었다.1990년대 중반 아이오와 주립대학에서 닛센.[8][24]닛센은 발견 당시 MTI(Martha Technologies, Inc.)라는 회사를 설립했는데, 이후 제조권을 라이선스하고 HMB를 식이 보조식품에 편입하는 데 사용한 HMB 관련 특허 6건을 취득했다.[24][71][72]1990년대 후반에 상업적으로 처음 출시되었을 때, HMB는 운동 보조제로만 판매되어 운동선수와 보디빌더들이 근육을 만들 수 있도록 도와주었다.[71]MTI는 그 후 2003년과 2008년에 각각 아보트 영양사가 시장권을 획득한 HMB 함유 제품인 후베네와 레비지를 개발했다.[8][71]이후 애보트는 후베인을 의료식품으로, 레비고 브랜드인 HMB를 운동선수용 식품(예: 마이오플렉스 특정제제제) 및 기타 의료식품(예:[8][21][71] 특정제제제제)의 활성 성분으로 마케팅했다.
참고 항목
메모들
- ^ 동의어와 대체 철자에는 베타-하이드록시 베타-메틸부티르산, 3-하이드록시-3-메틸부타노산(IUPAC 이름), 3-하이드록시소발레르산, 베타-하이드록시소발레르산이 포함된다.[7]
- ^ a b 메타분석 결과 노년층의 HMB 보충에 따른 근육량 증가량은 평균 0.35kg(0.77lb)으로 나타났다.[11]HMB 보충에 따른 근육량 증가 추정치에 대한 95% 신뢰 구간은 0.11-0.59kg(0.24–1.30lb)이다.[11]
메타분석에 포함된 7가지 무작위 통제 실험에는 HMB 치료군 노인과 대조군 노약자 140명이 포함됐다.[11]7번의 실험은 2-11개월의 기간을 가졌으며, 표본 크기에 따라 가중치를 둔 연구의 평균 기간은 약 6개월이었다.[11] - ^ a b HMB가 골격근 손상에 미치는 영향은 혈청 크레아틴 키나아제, 혈청 젖산탈수소효소, 요로요인 질소, 요로 3-메틸히스티딘의 4가지 다른 생체마커를 사용하는 사람에 대한 연구에서 평가되었다.[1][19][35]장거리 달리기나 점진적 과부하 등 골격근 손상의 원인이 될 정도로 운동 강도와 부피가 충분할 경우 HMB 보충제를 통해 이러한 바이오마커의 상승률을 20~60%[1][19][36] 약화시키는 것으로 입증되었다.
- ^ NOAEL은 다른 일일 투여량을 받은 여러 그룹의 Sprague-Dawley 쥐들이 참여한 3개월의 연구에 기초하여 설립되었다.[18][23] HMB를 받은 그룹에서는 어떠한 부작용도 관찰되지 않았기 때문에, 본 연구에서 투여된 HMB의 일일 투여량이 NOAEL로 확인되었다.[18][23]
- ^ 약 동일한 양의 순액(2.42g)과 L-루신(3.42g)은 살아있는 인간의 골격근에서 근세동백질의 분수합성에 의해 측정된 통계적으로 구별할 수 있는 아나볼릭 효과를 생성하지 않는다.[15][40]이러한 HMB-FA 용량과 L-루신은 한 연구에서 근육 단백질 합성을 각각 70%, 110%[15][40] 증가시켰다.
- ^ 식후 150분 동안, 한 연구에서 살아있는 인간의 골격근 단백질 분해량이 57%까지 2.42그램이었다.[15][40]근육 단백질 파괴에 대한 L-루신의 영향은 전적으로 인슐린 분비에 의존하며, 따라서 동일한 연구에서 측정되지 않았다.[15]이에 비해 L-루신, 탄수화물이 함유된 전체 식사에 따른 인슐린 의존성 근육 단백질 분해량은 평균 50%에 달한다.[15]
- ^ a b 한 연구에서 건강한 자원봉사자가 HMB-Ca 1g을 섭취하면 섭취 후 2시간 동안 최대 혈장 HMB 120이, 섭취 후 1시간 동안 HMB-Ca 3g을 섭취하면 최고 혈장 HMB 487μM이 나왔다.[1]
75그램의 포도당과 함께 3그램의 HMB-Ca를 소비하여 352 μM의 피크 플라즈마 HMB 수치가 낮아졌으며, 이는 섭취 후 2시간 후에 발생했다.[1] - ^ 한 연구에서 1g과 3g HMB 용량을 섭취하면 소변에서 각각 14%, 28%의 HMB를 HMB로 배설했다.[1]
- ^ 이 반응은 알려지지 않은 티오에스테라제 효소에 의해 촉매된다.[43][44]
참고 사항
참조
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai Wilson JM, Fitschen PJ, Campbell B, Wilson GJ, Zanchi N, Taylor L, Wilborn C, Kalman DS, Stout JR, Hoffman JR, Ziegenfuss TN, Lopez HL, Kreider RB, Smith-Ryan AE, Antonio J (February 2013). "International Society of Sports Nutrition Position Stand: beta-hydroxy-beta-methylbutyrate (HMB)". Journal of the International Society of Sports Nutrition. 10 (1): 6. doi:10.1186/1550-2783-10-6. PMC 3568064. PMID 23374455.
The [International Society of Sports Nutrition] has concluded the following. 1. HMB can be used to enhance recovery by attenuating exercise induced skeletal muscle damage in trained and untrained populations. ... 4. Thirty-eight mg·kg·BM−1 daily of HMB has been demonstrated to enhance skeletal muscle hypertrophy, strength, and power in untrained and trained populations when the appropriate exercise prescription is utilized. ... 8. HMB’s mechanisms of action include an inhibition and increase of proteolysis and protein synthesis, respectively. 9. Chronic consumption of HMB is safe in both young and old populations.
- ^ a b c "Product Information: Ensure Enlive Advanced Therapeutic Nutrition Shake" (PDF). Abbott Nutrition. 9 August 2016. Archived (PDF) from the original on 12 October 2016. Retrieved 22 August 2016.
• Use under medical supervision.
• HMB + protein for muscle health.
"Product Information: Juven" (PDF). Abbott Nutrition. 7 May 2016. Archived (PDF) from the original on 12 October 2016. Retrieved 22 August 2016.
• Administer orally or as a modular via feeding tube ...
• Use under medical supervision.
• Nutravigor® (CaHMB, calcium β-hydroxy-β-methylbutyrate) - ^ a b "Safety data sheet: 3-Hydroxy-3-methyl butyric acid". Alfa Aesar. 23 March 2005. Archived from the original on 17 September 2016. Retrieved 9 November 2016.
- ^ a b c d e Coffman DD, Cramer R, Mochel WE (June 1958). "Syntheses by Free-radical Reactions. V. A New Synthesis of Carboxylic Acids". Journal of the American Chemical Society. 80 (11): 2882–2887. doi:10.1021/ja01544a072.
- ^ a b "3-OH-isovaleric acid". ChemSpider. Royal Society of Chemistry. 2015. Archived from the original on 11 August 2016. Retrieved 10 August 2016.
Experimental Boiling Point: ... 128 °C / 7 mm ...
Experimental solubility:
Soluble in water - ^ "beta-Hydroxyisovaleric acid". PubChem Compound. United States National Library of Medicine – National Center for Biotechnology Information. 3 February 2018. Archived from the original on 6 February 2018. Retrieved 6 February 2018.
Chemical Names: Beta-Hydroxyisovaleric acid; 3-Hydroxy-3-methylbutanoic acid; ... 3-Hydroxyisovaleric acid; 3-Hydroxy-3-methylbutyric acid
- ^ a b c d e f g h Linn J (13 May 2013). "Proteins in Human Health and Performance". Iowa State University. Archived from the original on 27 August 2016. Retrieved 31 July 2016.
Dr. Nissen and his collaborator Dr. Naji N. Abumrad, Professor and Chair, Department of Surgery, Vanderbilt University, discovered beta-hydroxy-beta-methylbutyrate (HMB) and its beneficial effects on human health and performance. HMB is currently marketed nationally by Abbott Laboratories as Revigor™, which is a component of Ensure® Muscle Health, and Juven®, which is a nutritional beverage that is clinically shown to promote healing after injury or surgery.
- ^ a b Khamsi R (May 2013). "Rethinking the formula". Nature Medicine. 19 (5): 525–529. doi:10.1038/nm0513-525. PMID 23652097. S2CID 205379191.
The questions about what defines a medical food will likely grow as the market does—and that market now extends far beyond PKU and other inherited metabolic disorders. ... Abbott Nutrition's Juven provides nutrients to people with HIV or AIDS experiencing excessive weight loss due to disease
- ^ a b "JUVEN Added to Abbott Laboratories' Nutritional Product Line for People With Cancer, HIV/AIDS and Wounds/Pressure Ulcers". PR Newswire. Abbott Laboratories. 12 March 2004. Archived from the original on 20 December 2016. Retrieved 11 December 2016.
- ^ a b c d e f g h i j k l Wu H, Xia Y, Jiang J, Du H, Guo X, Liu X, Li C, Huang G, Niu K (September 2015). "Effect of beta-hydroxy-beta-methylbutyrate supplementation on muscle loss in older adults: a systematic review and meta-analysis". Archives of Gerontology and Geriatrics. 61 (2): 168–175. doi:10.1016/j.archger.2015.06.020. PMID 26169182.
Overall, this meta-analysis indicates that HMB can prevent lean body mass loss in older adults. But the effects of HMB on muscle strength and physical function appears to vary in different populations. Additional well-designed clinical studies are necessary to confirm the effectiveness of HMB in the prevention of loss of muscle strength and physical function. ... Mechanisms underlying the role of HMB in muscle regeneration have also been explored: results indicated that HMB enhances protein synthesis via upregulation of anabolic signaling pathways and attenuate proteolysis via downregulation of catabolic signaling pathways (Wilkinson et al., 2013).
- ^ a b c d e f Holeček M (August 2017). "Beta-hydroxy-beta-methylbutyrate supplementation and skeletal muscle in healthy and muscle-wasting conditions". Journal of Cachexia, Sarcopenia and Muscle. 8 (4): 529–541. doi:10.1002/jcsm.12208. PMC 5566641. PMID 28493406.
The reports summarized here indicate that HMB provides a number of benefits to subjects involved in strength-power and endurance sports. The effects on muscle mass and strength, particularly during resistance training, are likely related to the suppression of proteolysis and a positive effect on protein synthesis. Its benefits in aerobic performance are probably more associated with improved mitochondrial biogenesis and fat oxidation. Favourable effects on the recovery from exercise-induced damage may be related to the role of HMB as a precursor of cholesterol, which modulates membrane fluidity and affects ion channels, and membrane excitability. ... Studies have demonstrated that HMB can prevent the development of sarcopenia in elderly subjects and that the optimal action of HMB on muscle growth and strength occurs when it is combined with exercise.
- ^ a b Rossi AP, D'Introno A, Rubele S, Caliari C, Gattazzo S, Zoico E, Mazzali G, Fantin F, Zamboni M (October 2017). "The Potential of β-Hydroxy-β-Methylbutyrate as a New Strategy for the Management of Sarcopenia and Sarcopenic Obesity". Drugs & Aging. 34 (11): 833–840. doi:10.1007/s40266-017-0496-0. PMID 29086232. S2CID 4284897.
Clinical trials performed in older adults confirm that HMB can attenuate the progression of sarcopenia in elderly subjects. HMB supplementation results in an increase in skeletal muscle mass and strength in the elderly and its effect is even greater when combined with physical exercise.
- ^ a b c d e f g Silva VR, Belozo FL, Micheletti TO, Conrado M, Stout JR, Pimentel GD, Gonzalez AM (September 2017). "β-hydroxy-β-methylbutyrate free acid supplementation may improve recovery and muscle adaptations after resistance training: a systematic review" (PDF). Nutrition Research. 45: 1–9. doi:10.1016/j.nutres.2017.07.008. hdl:11449/170023. PMID 29037326.
HMB's mechanisms of action are generally considered to relate to its effect on both muscle protein synthesis and muscle protein breakdown (Figure 1) [2, 3]. HMB appears to stimulate muscle protein synthesis through an up-regulation of the mammalian/mechanistic target of rapamycin complex 1 (mTORC1), a signaling cascade involved in coordination of translation initiation of muscle protein synthesis [2, 4]. Additionally, HMB may have antagonistic effects on the ubiquitin–proteasome pathway, a system that degrades intracellular proteins [5, 6]. Evidence also suggests that HMB promotes myogenic proliferation, differentiation, and cell fusion [7]. ... Exogenous HMB-FA administration has shown to increase intramuscular anabolic signaling, stimulate muscle protein synthesis, and attenuate muscle protein breakdown in humans [2].
- ^ a b c d e f g h i j k l m n o p Wilkinson DJ, Hossain T, Hill DS, Phillips BE, Crossland H, Williams J, Loughna P, Churchward-Venne TA, Breen L, Phillips SM, Etheridge T, Rathmacher JA, Smith K, Szewczyk NJ, Atherton PJ (June 2013). "Effects of leucine and its metabolite β-hydroxy-β-methylbutyrate on human skeletal muscle protein metabolism". The Journal of Physiology. 591 (11): 2911–2923. doi:10.1113/jphysiol.2013.253203. PMC 3690694. PMID 23551944.
The stimulation of MPS through mTORc1-signalling following HMB exposure is in agreement with pre-clinical studies (Eley et al. 2008). ... Furthermore, there was clear divergence in the amplitude of phosphorylation for 4EBP1 (at Thr37/46 and Ser65/Thr70) and p70S6K (Thr389) in response to both Leu and HMB, with the latter showing more pronounced and sustained phosphorylation. ... Nonetheless, as the overall MPS response was similar, this cellular signalling distinction did not translate into statistically distinguishable anabolic effects in our primary outcome measure of MPS. ... Interestingly, although orally supplied HMB produced no increase in plasma insulin, it caused a depression in MPB (−57%). Normally, postprandial decreases in MPB (of ~50%) are attributed to the nitrogen-sparing effects of insulin since clamping insulin at post-absorptive concentrations (5 μU ml−1) while continuously infusing AAs (18 g h−1) did not suppress MPB (Greenhaff et al. 2008), which is why we chose not to measure MPB in the Leu group, due to an anticipated hyperinsulinaemia (Fig. 3C). Thus, HMB reduces MPB in a fashion similar to, but independent of, insulin. These findings are in-line with reports of the anti-catabolic effects of HMB suppressing MPB in pre-clinical models, via attenuating proteasomal-mediated proteolysis in response to LPS (Eley et al. 2008).
- ^ a b c d e f g h i j k l m Brioche T, Pagano AF, Py G, Chopard A (August 2016). "Muscle wasting and aging: Experimental models, fatty infiltrations, and prevention" (PDF). Molecular Aspects of Medicine. 50: 56–87. doi:10.1016/j.mam.2016.04.006. PMID 27106402.
In conclusion, HMB treatment clearly appears to be a safe potent strategy against sarcopenia, and more generally against muscle wasting, because HMB improves muscle mass, muscle strength, and physical performance. It seems that HMB is able to act on three of the four major mechanisms involved in muscle deconditioning (protein turnover, apoptosis, and the regenerative process), whereas it is hypothesized to strongly affect the fourth (mitochondrial dynamics and functions). Moreover, HMB is inexpensive (~30– 50 US dollars per month at 3 g per day) and may prevent osteopenia (Bruckbauer and Zemel, 2013; Tatara, 2009; Tatara et al., 2007, 2008, 2012) and decrease cardiovascular risks (Nissen et al., 2000). For all these reasons, HMB should be routinely used in muscle-wasting conditions especially in aged people. ... 3 g of CaHMB taken three times a day (1 g each time) is the optimal posology, which allows for continual bioavailability of HMB in the body (Wilson et al., 2013)
- ^ a b c d e f g h i Molfino A, Gioia G, Rossi Fanelli F, Muscaritoli M (December 2013). "Beta-hydroxy-beta-methylbutyrate supplementation in health and disease: a systematic review of randomized trials". Amino Acids. 45 (6): 1273–1292. doi:10.1007/s00726-013-1592-z. PMID 24057808. S2CID 8688823.
Normally, an individual metabolizes 60 g of L-LEU to obtain 3 g of HMB but a 70 kg person produces 0.2–0.4 g of HMB per day, depending on the dose of LEU in the diet (Van Koevering and Nissen 1992). ... The usual dose of 3 g/day may be routinely recommended to maintain or improve muscle mass and function in health and disease. The safety profile of HMB is unequivocal. ... These results show that HMB/ARG/GLN can be safely used to treat AIDS- and cancer-related muscle wasting
- ^ a b c d e f g Borack MS, Volpi E (December 2016). "Efficacy and Safety of Leucine Supplementation in the Elderly". The Journal of Nutrition. 146 (12): 2625S–2629S. doi:10.3945/jn.116.230771. PMC 5118760. PMID 27934654.
One study tested the safety of HMB for long-term use in rats. Fuller et al. (50) conducted a 91-d study with the use of Sprague-Dawley rats that tested the safety of β-hydroxy-β-methylbutyric free acid (HMBFA). This new form of HMB results in higher HMB serum concentrations than CaHMB. In this study, rats were administered an HMBFA intervention of 0%, 0.8%, 1.6%, or 4% of the diet by body weight. The highest dose is the equivalent of ~400 mg ⋅ kg−1 ⋅ d−1 for humans. No adverse advents were observed for any treatment group. Similarly, blood and urine analyses were within the normal range in all groups, with no group differences. The authors concluded that HMBFA was safe for consumption in a rat model. ... No serious side effects have been reported with leucine, EAA, or HMB supplementation; and the health risks associated with these supplements are few and predictable.
- ^ a b c d e f g Momaya A, Fawal M, Estes R (April 2015). "Performance-enhancing substances in sports: a review of the literature". Sports Medicine. 45 (4): 517–531. doi:10.1007/s40279-015-0308-9. PMID 25663250. S2CID 45124293.
Currently, HMB is available as an over-the-counter supplement. The drug is not tested for nor banned by any sporting organization. ... Wilson et al. [91] demonstrated that when non-resistance trained males received HMB pre-exercise, the rise of lactate dehydrogenase (LDH) levels reduced, and HMB tended to decrease soreness. Knitter et al. [92] showed a decrease in LDH and creatine phosphokinase (CPK), a byproduct of muscle breakdown, by HMB after a prolonged run. ... The utility of HMB does seem to be affected by timing of intake prior to workouts and dosage [97]. Further, chronic consumption of HMB appears safe [97]. ... No serious adverse effects from HMB consumption have been reported.
- ^ a b c d e Fuller JC, Sharp RL, Angus HF, Khoo PY, Rathmacher JA (November 2015). "Comparison of availability and plasma clearance rates of β-hydroxy-β-methylbutyrate delivery in the free acid and calcium salt forms". primary source. The British Journal of Nutrition. 114 (9): 1403–1409. doi:10.1017/S0007114515003050. PMID 26373270.
Recently, the free acid form of HMB (HMB-FA) has become commercially available in capsule form (gelcap). The current study was conducted to compare the bioavailability of HMB using the two commercially available capsule forms of HMB-FA and Ca-HMB. ... In conclusion, HMB-FA in capsule form improves clearance rate and availability of HMB compared with Ca-HMB in capsule form.
- ^ a b c "Abbott Nutrition Overview" (PDF). Abbott. Abbott Laboratories. Archived from the original (PDF) on 3 September 2016. Retrieved 3 September 2016.
- ^ a b Wilson GJ, Wilson JM, Manninen AH (January 2008). "Effects of beta-hydroxy-beta-methylbutyrate (HMB) on exercise performance and body composition across varying levels of age, sex, and training experience: A review". Nutrition & Metabolism. 5: 1. doi:10.1186/1743-7075-5-1. PMC 2245953. PMID 18173841.
- ^ a b c d e f g h i j k l Szcześniak KA, Ostaszewski P, Fuller JC, Ciecierska A, Sadkowski T (June 2015). "Dietary supplementation of β-hydroxy-β-methylbutyrate in animals – a review". Journal of Animal Physiology and Animal Nutrition. 99 (3): 405–417. doi:10.1111/jpn.12234. PMID 25099672.
Cholesterol is a major component of the cell membrane, and sarcolemma is the one that relies mainly on de novo synthesis of cholesterol. This is important under stressful conditions when muscle cells may lack the capacity to produce adequate amounts of the cholesterol that is essential to proper functioning of cell membranes. Many biochemical studies have shown that HMB may be a precursor of cholesterol synthesis (Bachhawat et al., 1955; Bloch et al., 1954; Coon et al., 1955; Adamson and Greenberg, 1955; Gey et al., 1957). According to pertinent literature, HMB carbon is incorporated into cholesterol. Therefore, increased intramuscular HMB concentrations may provide readily available substrate for the cholesterol synthesis that is needed to form and stabilize the sarcolemma. ... It is known that HMB supplementation decreases post-exercise levels of enzymes, indicating muscle damage, such as creatinine phosphokinase (CK) and lactate dehydrogenase (LDH), which suggests an enhancement of the muscle cell membrane function. This was shown in numerous studies in humans undergoing both resistance and endurance training (Wilson et al., 2013) ... In theory, HMB use as a precursor to cholesterol could aid in stabilizing muscle cell membranes; however, this has not been confirmed by research studies. The effect of HMB on protein metabolism may in fact help stabilize muscle structure more than any effect HMB may have on cholesterol metabolism in the cell.
- ^ a b c Fitzgerald M (May 2014). Diet Cults: The Surprising Fallacy at the Core of Nutrition Fads and a Guide to Healthy Eating for the Rest of Us. Pegasus Books. p. 148. ISBN 978-1-60598-595-4. Retrieved 31 July 2016.
HMB was discovered in the mid-1990s by Steve Nissen, a researcher at Iowa State University
- ^ a b Rippe JM (March 2013). "Beta-Hydroxy beta-methylbutyrate". Lifestyle Medicine (2nd ed.). CRC Press. p. 724. ISBN 978-1-4398-4544-8. Archived from the original on 22 March 2018. Retrieved 15 August 2016.
- ^ a b "Prohibited List (January 2018)" (PDF). World Anti-Doping Agency. Archived (PDF) from the original on 22 October 2017. Retrieved 17 December 2017.
- ^ a b "2018–19 NCAA Banned Drugs List". National Collegiate Athletic Association. 10 June 2015. Retrieved 22 August 2018.
- ^ a b The NCAA Research Staff (January 2006). "NCAA Study of Substance Use Habits of College Student-Athletes" (PDF). National Collegiate Athletic Association. p. 7. Archived (PDF) from the original on 10 May 2016. Retrieved 24 June 2016.
- ^ a b c Cruz-Jentoft AJ (2018). "Beta-hydroxy-beta-methyl butyrate (HMB): From experimental data to clinical evidence in sarcopenia". Current Protein & Peptide Science. 18 (7): 668–672. doi:10.2174/1389203718666170529105026. PMID 28554316.
HMB is widely used as an ergogenic supplement by young athletes. ... This study shows that in healthy older adult, HMB supplementation may preserve muscle mass during 10 days of bed rest. These results are encouraging, but need to be confirmed by other groups.
- ^ a b c d e Argilés JM, Campos N, Lopez-Pedrosa JM, Rueda R, Rodriguez-Mañas L (September 2016). "Skeletal Muscle Regulates Metabolism via Interorgan Crosstalk: Roles in Health and Disease". Journal of the American Medical Directors Association. 17 (9): 789–796. doi:10.1016/j.jamda.2016.04.019. PMID 27324808.
Studies suggest dietary protein and leucine or its metabolite β-hydroxy β-methylbutyrate (HMB) can improve muscle function, in turn improving functional performance. ... These have identified the leucine metabolite β-hydroxy β-methylbutyrate (HMB) as a potent stimulator of protein synthesis as well as an inhibitor of protein breakdown in the extreme case of cachexia. ... A growing body of evidence suggests HMB may help slow, or even reverse, the muscle loss experienced in sarcopenia and improve measures of muscle strength. ... However, dietary leucine does not provide a large amount of HMB: only a small portion, as little as 5%, of catabolized leucine is metabolized into HMB. ... Thus, although dietary leucine itself can lead to a modest stimulation of protein synthesis by producing a small amount of HMB, direct ingestion of HMB more potently affects such signaling, resulting in demonstrable muscle mass accretion. ... Indeed, a vast number of studies have found that supplementation of HMB to the diet may reverse some of the muscle loss seen in sarcopenia and in hypercatabolic disease. ... The overall treatment of muscle atrophy should include dietary supplementation with HMB, although the optimal dosage for each condition is still under investigation. ...
Figure 4: Treatments for sarcopenia. It is currently recommended that patients at risk of or suffering from sarcopenia consume a diet high in protein, engage in resistance exercise, and take supplements of the leucine metabolite HMB.{{cite journal}}:외부 링크 위치quote= - ^ Landi F, Calvani R, Tosato M, Martone AM, Ortolani E, Savera G, D'Angelo E, Sisto A, Marzetti E (May 2016). "Protein Intake and Muscle Health in Old Age: From Biological Plausibility to Clinical Evidence". Nutrients. 8 (5): 295. doi:10.3390/nu8050295. PMC 4882708. PMID 27187465.
HMB is an active leucine metabolite which activates the mTOR signaling pathway in muscle. Following its absorption, dietary leucine is converted into α-ketoisocaproate (KIC), which is further metabolized into either isovaleryl-CoA or HMB. Under normal conditions, the majority of KIC is converted into isovaleryl-CoA, while only approximately 5% of leucine is metabolized to HMB. This implies that, in order to reach pharmacological levels of HMB, this compound needs to be administered directly, rather than via increasing leucine dosage. ... HMB exerts its effects through protective, anticatabolic mechanisms and directly influences protein synthesis. HMB has also been shown to stabilize the muscle cell membrane, to modulate protein degradation and to up-regulate protein synthesis [68].
- ^ Mullin GE (February 2014). "Nutrition supplements for athletes: potential application to malnutrition". Nutrition in Clinical Practice. 29 (1): 146–147. doi:10.1177/0884533613516130. PMID 24336486.
There are a number of nutrition products on the market that are touted to improve sports performance. HMB appears to be the most promising and to have clinical applications to improve muscle mass and function. Continued research using this nutraceutical to prevent and/or improve malnutrition in the setting of muscle wasting is warranted.
- ^ a b Mochamat, Cuhls H, Marinova M, Kaasa S, Stieber C, Conrad R, Radbruch L, Mücke M (July 2016). "A systematic review on the role of vitamins, minerals, proteins, and other supplements for the treatment of cachexia in cancer: a European Palliative Care Research Centre cachexia project". Journal of Cachexia, Sarcopenia and Muscle. 8 (1): 25–39. doi:10.1002/jcsm.12127. PMC 5326814. PMID 27897391.
Looking at studies with proteins and other dietary supplements the combination of HMB, arginine, and glutamine showed interesting results ... In one study, 32 patients gained an average of about 2 kg of body weight.[21] This study was one of three studies confirming the positive effects of this combination in a variety of diagnoses/conditions such as HIV/AIDS patients and healthy adults.[40] Another study, on a far larger sample base of around 470 cancer patients, found no significant difference with regard to LBM after 8 weeks however a strong trend in the direction of an increase in LBM as measured by both bio-impedance and skin-fold measurements.[22] In summary, the effect of the combination of HMB, arginine, and glutamine on weight gain should be investigated in further studies on cancer patients investigating time periods of several months.
- ^ a b Rahman A, Wilund K, Fitschen PJ, Jeejeebhoy K, Agarwala R, Drover JW, Mourtzakis M (July 2014). "Elderly persons with ICU-acquired weakness: the potential role for β-hydroxy-β-methylbutyrate (HMB) supplementation?". Journal of Parenteral and Enteral Nutrition. 38 (5): 567–575. doi:10.1177/0148607113502545. PMID 24072740.
More than 20 publications in humans have demonstrated benefit with HMB supplementation associated with increased lean body mass without fat gain, improved markers of muscle strength, and decreased onset of muscle soreness with training and reduced markers of muscle damage. ... One proposed cellular mechanism for HMB is principally through stabilization of the cholesterol membrane in muscle cells. HMB is metabolized to β-hydroxy-β-methylglutaryl-coenzyme A (HMG-CoA) in the cytosol of muscle cells, which in turn is converted to cholesterol. ... Muscle produces its own cholesterol to maintain the integrity of the cell membrane, typically from HMG-CoA, because it cannot supply its cholesterol needs via absorption from the circulation.
- ^ a b c Luckose F, Pandey MC, Radhakrishna K (2015). "Effects of amino acid derivatives on physical, mental, and physiological activities". Critical Reviews in Food Science and Nutrition. 55 (13): 1793–1807. doi:10.1080/10408398.2012.708368. PMID 24279396. S2CID 22657268.
HMB, a derivative of leucine, prevents muscle damage and increases muscle strength by reducing exercise-induced proteolysis in muscles and also helps in increasing lean body mass. ... HMB is converted to HMB-CoA which is then used for the synthesis of cholesterol in muscle cells (Nissen and Abumrad, 1997). Cholesterol is needed for the growth, repair, and stabilization of cellular membranes during exercise (Chen, 1984). ... The meta analysis studies and the individual studies conducted support the use of HMB as an effective aid to increase body strength, body composition, and to prevent muscle damage during resistance training.
- ^ a b c Rahimi MH, Mohammadi H, Eshaghi H, Askari G, Miraghajani M (2018). "The Effects of Beta-Hydroxy-Beta-Methylbutyrate Supplementation on Recovery Following Exercise-Induced Muscle Damage: A Systematic Review and Meta-Analysis". Journal of the American College of Nutrition. 37 (7): 640–649. doi:10.1080/07315724.2018.1451789. PMID 29676656. S2CID 4991601.
The current evidence revealed a time-dependent effect of HMB in reducing LDH and CK serum levels among adults. HMB, therefore, may be seen as a priority muscle damage recovery agent in interventions.
- ^ Sanchez-Martinez J, Santos-Lozano A, Garcia-Hermoso A, Sadarangani KP, Cristi-Montero C (July 2018). "Effects of beta-hydroxy-beta-methylbutyrate supplementation on strength and body composition in trained and competitive athletes: A meta-analysis of randomized controlled trials". Journal of Science and Medicine in Sport. 21 (7): 727–735. doi:10.1016/j.jsams.2017.11.003. PMID 29249685. S2CID 25776302.
- ^ a b "Who should not take HMB?". Metabolic Technologies, Inc. 11 September 2014. Archived from the original on 26 August 2016. Retrieved 23 August 2016.
Pregnant or lactating women are advised against taking HMB because safety studies have not yet been conducted for these populations.
- ^ a b Brook MS, Wilkinson DJ, Phillips BE, Perez-Schindler J, Philp A, Smith K, Atherton PJ (January 2016). "Skeletal muscle homeostasis and plasticity in youth and ageing: impact of nutrition and exercise". Acta Physiologica. 216 (1): 15–41. doi:10.1111/apha.12532. PMC 4843955. PMID 26010896.
The mechanisms underlying the anabolic effects of food intake involve both the stimulation of MPS (Rennie et al. 1982) and suppression of MPB (Wilkes et al. 2009). The potent increase in MPS is driven almost entirely by essential amino acids (EAAs) (Smith et al. 1992), with the branched chain AA (BCAA: leucine, isoleucine and valine), in particular leucine [and its metabolite(s), e.g. β‐hydroxy β‐methylbutyric acid (HMB) (Van Koevering & Nissen 1992)] being central to these effects (Wilkinson et al. 2013). Although the mechanisms underlying the unique anabolic properties of leucine are incompletely defined, recent work in yeast and cultured mammalians cells has demonstrated that leucyl tRNA synthetase is upstream of activating the hitherto ‘cellular AA sensor’, the mechanistic target of rapamycin complex 1 (mTORC1) in response to leucine (Bonfils et al. 2012, Han et al. 2012). This was reaffirmed by experiments showing that of all the EAAs, leucine is the most effective EAA in increasing the activity (i.e. phosphorylation) of mTORC1 (Atherton et al. 2010b) and its substrates.
- ^ a b c Phillips SM (July 2015). "Nutritional supplements in support of resistance exercise to counter age-related sarcopenia". Advances in Nutrition. 6 (4): 452–460. doi:10.3945/an.115.008367. PMC 4496741. PMID 26178029.
- ^ a b c Kornasio R, Riederer I, Butler-Browne G, Mouly V, Uni Z, Halevy O (May 2009). "Beta-hydroxy-beta-methylbutyrate (HMB) stimulates myogenic cell proliferation, differentiation and survival via the MAPK/ERK and PI3K/Akt pathways". primary source. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1793 (5): 755–763. doi:10.1016/j.bbamcr.2008.12.017. PMID 19211028.
- ^ a b c "KEGG Reaction: R10759". Kyoto Encyclopedia of Genes and Genomes. Kanehisa Laboratories. Archived from the original on 1 July 2016. Retrieved 24 June 2016.
- ^ a b c Mock DM, Stratton SL, Horvath TD, Bogusiewicz A, Matthews NI, Henrich CL, Dawson AM, Spencer HJ, Owen SN, Boysen G, Moran JH (November 2011). "Urinary excretion of 3-hydroxyisovaleric acid and 3-hydroxyisovaleryl carnitine increases in response to a leucine challenge in marginally biotin-deficient humans". primary source. The Journal of Nutrition. 141 (11): 1925–1930. doi:10.3945/jn.111.146126. PMC 3192457. PMID 21918059.
Reduced activity of MCC impairs catalysis of an essential step in the mitochondrial catabolism of the BCAA leucine. Metabolic impairment diverts methylcrotonyl CoA to 3-hydroxyisovaleryl CoA in a reaction catalyzed by enoyl-CoA hydratase (22, 23). 3-Hydroxyisovaleryl CoA accumulation can inhibit cellular respiration either directly or via effects on the ratios of acyl CoA:free CoA if further metabolism and detoxification of 3-hydroxyisovaleryl CoA does not occur (22). The transfer to carnitine by 4 carnitine acyl-CoA transferases distributed in subcellular compartments likely serves as an important reservoir for acyl moieties (39–41). 3-Hydroxyisovaleryl CoA is likely detoxified by carnitine acetyltransferase producing 3HIA-carnitine, which is transported across the inner mitochondrial membrane (and hence effectively out of the mitochondria) via carnitine-acylcarnitine translocase (39). 3HIA-carnitine is thought to be either directly deacylated by a hydrolase to 3HIA or to undergo a second CoA exchange to again form 3-hydroxyisovaleryl CoA followed by release of 3HIA and free CoA by a thioesterase.
- ^ a b c d e f g h i j k l m Kohlmeier M (May 2015). "Leucine". Nutrient Metabolism: Structures, Functions, and Genes (2nd ed.). Academic Press. pp. 385–388. ISBN 978-0-12-387784-0. Archived from the original on 22 March 2018. Retrieved 6 June 2016.
Energy fuel: Eventually, most Leu is broken down, providing about 6.0kcal/g. About 60% of ingested Leu is oxidized within a few hours ... Ketogenesis: A significant proportion (40% of an ingested dose) is converted into acetyl-CoA and thereby contributes to the synthesis of ketones, steroids, fatty acids, and other compounds
그림 8.57: 웨이백 머신에서 2018년 3월 22일 L-루신아치의 대사 - ^ "Leucine metabolism". BRENDA. Technische Universität Braunschweig. Archived from the original on 17 August 2016. Retrieved 12 August 2016.
- ^ "KEGG Reaction: R04137". Kyoto Encyclopedia of Genes and Genomes. Kanehisa Laboratories. Archived from the original on 1 July 2016. Retrieved 24 June 2016.
- ^ "Homo sapiens: 4-hydroxyphenylpyruvate dioxygenase reaction". MetaCyc. SRI International. 20 August 2012. Retrieved 6 June 2016.
- ^ a b c d e f g h i j k l m n o p q r s t u Wishart, David S.; Djombou Feunang, Yannick; Marcu, Ana; Guo, An Chi; Liang, Kevin; Vázquez Fresno, Rosa; Sajed, Tanvir; Johnson, Daniel; Li, Carin; Karu, Naama; Sayeeda, Zinat; Lo, Elvis; Assempour, Nazanin; Berjanskii, Mark; Singhal, Sandeep; Arndt, David; Liang, Yonjie; Badran, Hasan; Grant, Jason; Serra Cayuela, Arnau; Liu, Yifeng; Mandal, Rupa; Neveu, Vanessa; Pon, Allison; Knox, Craig; Wilson, Michael; Manach, Claudine; Scalbert, Augustin. "Showing metabocard for 3-Hydroxyisovaleric acid (HMDB0000754)". Human Metabolome Database, HMDB. 4.0.
- ^ "3-hydroxyisovalerate". Chemical Entities of Biological Interest. European Bioinformatics Institute. 16 September 2014. Archived from the original on 1 December 2017. Retrieved 20 August 2016.
- ^ WO 애플리케이션 2015094925, White TO, 2015년 6월 25일 발행된 "베타-하이드록시-베타-메틸부티르산으로 구성된 견고한 액체 충전 하드 캡슐"이 Capsugel 벨기에 Nv에 할당됨
- ^ "Beta-Hydroxyisovaleric acid". ChemicalBook. Archived from the original on 21 August 2016. Retrieved 20 August 2016.
- ^ a b "3-hydroxyisovaleric acid". Chemical Entities of Biological Interest. European Bioinformatics Institute. 23 October 2015. Archived from the original on 12 March 2016. Retrieved 20 August 2016.
- ^ a b 2016년 9월 현재 렉시스 화학 데이터베이스에서 β-히드록시 β-메틸부티르산 합성에 대한 가장 이른 인용문은 다음과 같다.
Saytzeff M, Saytzeff A (1877). "Synthese des Allyldimethylcarbinols" [Synthesis of allyldimethylcarbinols]. Justus Liebig's Annalen der Chemie (in German). 185 (2–3): 151–169. doi:10.1002/jlac.18771850204. - ^ Schirokoff A (January 1881). "Ueber die β-Dipropyl- und β-Diäthyläthylenmilchsäure und über die Oxydation des Allyldimethylcarbinols und Diallylcarbinols mit übermangansaurem Kalium" [On the β-dipropyl- and β-diethylenyl-lactic acid, and on the oxidation of the allyl dimethylcarbinol and diallylcarbinol with excess potassium]. Journal für Praktische Chemie (in German). 23 (1): 196–208. doi:10.1002/prac.18810230115.
- ^ Reformatzky B (30 October 1889). "Synthese einiger Glycerine mittelst unterchloriger Säure" [Synthesis of some glycerol by hypochlorous acid]. Journal für Praktische Chemie (in German). 40 (1): 396–419. doi:10.1002/prac.18890400137.
- ^ McMurry, John E. (2010). "Oxidation of Alkenes: Epoxidation, Hydroxylation, and Cleavage". Fundamentals of Organic Chemistry (7th ed.). Cengage Learning. pp. 124–126, 142. ISBN 9781439049716.
- ^ Kondakow J(1892년)."미네랄 산의 dimethylallyls에서 액션에".Zhurnal Russkago Fiziko-Khimicheskago Obshchestva(저널이 러시아 Physico-Chemical 협회의)(러시아어로).1:508–513. Grosset(1893년)에 의해 망연하다."Ueber Einwirkung 폰 Mineralsauren auk Dimethylallen 죽"[미네랄 산의 dimethylallyls에서 액션에].Berichte 역사 Deutschen Chemischen 게젤샤프트(독일어로).26(4):96.doi:10.1002/cber.18930260412.
- ^ Gresham TL, Jansen JE, Shaver FW, Beears WL (January 1954). "β-Propiolactone. XIV. β-Isovalerolactone". Journal of the American Chemical Society. 76 (2): 486–488. doi:10.1021/ja01631a045.
- ^ WO 애플리케이션 2012140276, Noti C, Schmid L, Rittiner B, Handelmann P, Bierstedt A, "3-hydroxy-3-methylbutyric acid 또는 그 칼슘 염을 준비하기 위한 프로세스"가 론자 Ltd에 2013년 1월 10일 발행되었다.
- ^ a b Kohn M (September 1903). "Zur Kenntnis des Diacetonalkohols und des Mesityloxyds" [Knowledge of diacetone alkohols and mesityl oxide]. Monatshefte für Chemie und Verwandte Teile Anderer Wissenschaften. 24 (9): 765–772. doi:10.1007/BF01526057. S2CID 96317019.
- ^ Doraiswamy LK (February 2001). "Example 5.2". Organic Synthesis Engineering. New York: Oxford University Press. pp. 102–124. ISBN 978-0-19-509689-7.
- ^ Kochi JK (December 2012). "Homolytic Mechanism in Metal Catalysis". Organometallic Mechanisms and Catalysis: The Role of Reactive Intermediates in Organic Processes. New York: Elsevier. p. 67. ISBN 978-0-323-14410-0. Archived from the original on 22 March 2018.
- ^ Lee IY, Nissen SL, Rosazza JP (November 1997). "Conversion of beta-methylbutyric acid to beta-hydroxy-beta-methylbutyric acid by Galactomyces reessii". primary source. Applied and Environmental Microbiology. 63 (11): 4191–4195. Bibcode:1997ApEnM..63.4191L. doi:10.1128/AEM.63.11.4191-4195.1997. PMC 168736. PMID 9361403.
- ^ a b c Ehling S, Reddy TM (September 2015). "Direct Analysis of Leucine and Its Metabolites β-Hydroxy-β-methylbutyric Acid, α-Ketoisocaproic Acid, and α-Hydroxyisocaproic Acid in Human Breast Milk by Liquid Chromatography-Mass Spectrometry". primary source. Journal of Agricultural and Food Chemistry. 63 (34): 7567–7573. doi:10.1021/acs.jafc.5b02563. PMID 26271627.
- ^ a b Ehling S, Reddy TM (February 2014). "Investigation of the presence of β-hydroxy-β-methylbutyric acid and α-hydroxyisocaproic acid in bovine whole milk and fermented dairy products by a validated liquid chromatography-mass spectrometry method". primary source. Journal of Agricultural and Food Chemistry. 62 (7): 1506–1511. doi:10.1021/jf500026s. PMID 24495238.
- ^ Ružička L, Dalma G, Engel BG, Scott WE (1941). "Zur Kenntnis der Erythrophleum-Alkaloide. (5. Mitteilung). Identifizierung der niedermolekularen Spaltsäure des Coumingins" [Concerning erythrophleum alkaloids. (5th Communication). Identification of the low molecular weight cleavage acids from coumingin]. Helvetica Chimica Acta (in German). 24 (1): 1449–1458. doi:10.1002/hlca.194102401171.
- ^ Tanaka K, Orr JC, Isselbacher KJ (May 1968). "Identification of beta-hydroxyisovaleric acid in the urine of a patient with isovaleric acidemia". primary source. Biochimica et Biophysica Acta (BBA) - Lipids and Lipid Metabolism. 152 (3): 638–41. doi:10.1016/0005-2760(68)90107-0. PMID 5656832.
- ^ Tanaka K (1975). "Disorders of organic acid metabolism". In Gaull GE (ed.). Biology of Brain Dysfunction Volume 3. Boston, MA: Springer US. pp. 145–214. doi:10.1007/978-1-4684-2673-1_3. ISBN 978-1-4684-2675-5.
- ^ a b c d "The University of Iowa Economic Development Grow Iowa Values Fund Proposal: Fiscal Year 2011" (PDF). University of Iowa. pp. 13–16. Archived (PDF) from the original on 1 September 2016. Retrieved 1 September 2016.
- ^ "Patents Assigned to Metabolic Technologies, Inc". Justia Patent.
2018년 3월 현재,[update] 허가된 특허는 다음을 포함한다.US8815280, US9259430, US9539224, US9707241, US9770424.
외부 링크
| 위키미디어 커먼스는 베타-하이드록시 베타-메틸부티레이트 관련 매체를 보유하고 있다. |
- 미국 국립 의학 도서관(MSH)의 베타-히드록시소발레르산