크로마토그래피
Chromatography| 시리즈의 일부 |
| 연속체 역학 |
|---|
| 시리즈의 일부 |
| 화학 |
|---|
 |
화학 분석에서 크로마토그래피는 혼합물을 성분으로 분리하는 실험실 기술이다.혼합물은 이동상이라고 불리는 유체 용제(가스 또는 액체)에 용해되어 고정상이라고 불리는 물질이 고정된 시스템(기둥, 모세관, 플레이트 또는 시트)을 통해 운반됩니다.혼합물의 다른 성분은 정지상에 대해 다른 친화력을 갖는 경향이 있고 표면 부위와의 상호작용에 따라 다른 시간 동안 유지되기 때문에, 구성 요소는 이동 유체 내에서 다른 겉보기 속도로 이동하며 분리된다.이 분리는 모바일 상과 정지 상 사이의 차등 분할에 기초하고 있습니다.화합물의 분할 계수의 미묘한 차이는 정지상에서의 차분 유지를 초래하여 분리에 영향을 미칩니다.[1]
크로마토그래피는 준비적이거나 분석적일 수 있다.준비 크로마토그래피의 목적은 혼합물의 성분을 나중에 사용하기 위해 분리하는 것이며,[2][3] 따라서 일종의 정제이다.이 공정은 [4][5]생산 방식에 따라 비용이 높아집니다.분석 크로마토그래피는 일반적으로 적은 양의 물질로 이루어지며 혼합물에서 분석 물질의 상대적 비율을 측정하거나 존재 여부를 확인하기 위한 것이다.이 두 가지 유형은 [6]서로 배타적이지 않습니다.
어원과 발음
Chromatography, pronounced /ˌkroʊməˈtɒɡrəfi/, is derived from Greek χρῶμα chroma, which means "color", and γράφειν graphein, which means "to write".이 두 용어의 조합은 [7]색소를 분리하기 위해 처음 사용된 기술의 발명으로부터 직접 계승되었다.
역사
크로마토그래피는 1900년 [8]이탈리아 태생의 과학자 미하일 츠베트에 의해 러시아에서 처음 발명되었다.그는 20세기 첫 10년 동안 주로 엽록소, 카로틴, 크산토필과 같은 식물 색소의 분리를 위해 이 기술을 개발하고 크로마토그래피라는 용어를 만들었다.이러한 구성 요소는 다른 색상의 띠(각각 녹색, 주황색 및 노란색)로 구분되기 때문에 기술 이름에 직접적인 영감을 주었습니다.1930년대와 1940년대에 개발된 새로운 형태의 크로마토그래피는 이 기술을 많은 분리 [9]과정에 유용하게 만들었다.
크로마토그래피 기술은 1940년대와 1950년대에 Archer John Porter Martin과 Richard Laurence Millington Synge의 연구로 크게 발전했고, 그들은 1952년 노벨 [10]화학상을 수상했다.그들은 분할 크로마토그래피의 원리와 기본 기술을 확립했고, 그들의 연구는 종이 크로마토그래피, 가스 크로마토그래피, 그리고 고성능 액체 크로마토그래피로 알려지게 되는 몇 가지 크로마토그래피 방법의 빠른 개발을 장려했다.그 이후로, 그 기술은 빠르게 발전했다.연구원들은 Tsvet의 크로마토그래피의 주요 원리가 아래에 설명된 다양한 크로마토그래피의 결과로 많은 다른 방법으로 적용될 수 있다는 것을 발견했다.진보로 크로마토그래피의 기술적 성능이 지속적으로 향상되어 점점 더 유사한 분자를 분리할 수 있게 되었습니다.
크로마토그래피 용어
- 분석물 – 크로마토그래피 중에 분리되는 물질.그것은 또한 일반적으로 혼합물에서 필요한 것이다.
- 분석 크로마토그래피 – 크로마토그래피를 사용하여 샘플 내 분석물질의 존재 및 농도를 결정합니다.
- 결합상 – 기둥 튜브의 내벽 또는 지지 입자에 공유 결합되는 고정상.
- 크로마토그램 – 크로마토그래프의 시각적 출력.최적 분리의 경우 크로마토그램 상의 다른 피크 또는 패턴은 분리된 혼합물의 다른 성분에 대응한다.

 X축에는 유지시간이 표시되며 Y축에는 시스템에서 나오는 분석물질에 의해 생성된 응답에 대응하는 신호(예를 들어 분광광도계, 질량분석계 또는 기타 다양한 검출기에 의해 얻어진 신호)가 표시된다.최적 시스템의 경우 신호는 분리된 특정 분석물의 농도에 비례합니다.
X축에는 유지시간이 표시되며 Y축에는 시스템에서 나오는 분석물질에 의해 생성된 응답에 대응하는 신호(예를 들어 분광광도계, 질량분석계 또는 기타 다양한 검출기에 의해 얻어진 신호)가 표시된다.최적 시스템의 경우 신호는 분리된 특정 분석물의 농도에 비례합니다. - 크로마토그래프 – 가스 크로마토그래피 또는 액체 크로마토그래피 분리와 같이 정교한 분리를 가능하게 하는 장치입니다.
- 크로마토그래피 – 두 개의 상(정지상)을 분리하기 위해 구성요소를 분배하는 물리적 분리 방법. 하나는 정지상(정지상)이고 다른 하나는 일정한 방향으로 이동상(이동상)입니다.
- 용리액(용리액이라고도 함) – 용출 크로마토그래피에서 사용되는 용제 또는 용제 고정액으로,[11] 이동상과 동일합니다.
- 용출 – [11]칼럼에서 나오는 용질(엘루이트 참조)과 용제(엘루엔트 참조)의 혼합물.
- 유출물 – 크로마토그래피 컬럼에서 흘러나오는 흐름.실제로는 용출과 동의어로 사용되지만, 보다 정확하게는 분리에 관계없이 발생하는 [11]흐름을 의미한다.
- Eluite – 용질 또는 분석 물질의 보다 정확한 용어입니다.크로마토그래피 [11]컬럼을 떠나는 샘플 성분입니다.
- 엘루오트로픽 시리즈 – 용제의 용출력에 따라 순위가 매겨진 용제 목록.
- 고정상 – 지지 입자 또는 칼럼 튜브의 내벽에 고정되는 고정상.
- 모바일 단계: 일정한 방향으로 이동하는 단계.액체(LC 및 캐피럴리 일렉트로크로마토그래피(CEC)), 가스(GC) 또는 초임계 유체(초임계 유체 크로마토그래피, SFC)일 수 있습니다.이동 단계는 분리/분석되는 시료와 컬럼을 통해 시료를 이동하는 용매로 구성됩니다.HPLC의 경우 이동상은 정상상 헥산 등의 비극성 용매 또는 역상 크로마토그래피의 메탄올 등의 극성 용매로 구성되며 시료는 분리된다.이동상은 시료가 정지상과 상호작용하여 분리되는 크로마토그래피 컬럼(정지상)을 통과합니다.
- 준비 크로마토그래피 – 분석보다는 물질의 충분한 양을 정제하기 위해 크로마토그래피를 사용한다.
- 유지 시간 – 특정 분석 물질이 설정된 조건에서 (칼럼 입구에서 검출기로) 시스템을 통과하는 데 걸리는 특성 시간.참고 항목: Kovats 유지 지수
- 샘플 – 크로마토그래피로 분석되는 물질.단일 성분으로 구성되거나 성분 혼합일 수 있습니다.분석 중에 샘플을 처리하는 경우, 해당 분석물질을 포함하는 단계 또는 단계를 표본이라고 하며, 분석 전 또는 분석 과정에서 표본에서 분리된 모든 것을 폐기물이라고 합니다.
- 용질 – 파티션 크로마토그래피의 샘플 성분.
- 용제 – 다른 물질, 특히 액체 크로마토그래피에서 액체 이동상을 가용화할 수 있는 물질.
- 정지상 – 크로마토그래피 절차를 위해 고정된 물질.예를 들어 얇은 층 크로마토그래피의 실리카 층을 포함한다.
- 검출기(Detector) – 분리 후 분석물질의 정성적 및 정량적 검출에 사용되는 기기.
크로마토그래피는 분할계수의 개념에 기초한다.용해되지 않는 두 용제 사이의 모든 용질 파티션.하나의 용매를 (고체 서포트 매트릭스에 흡착하여) 움직이지 않게 하고 다른 용매를 이동시키면 크로마토그래피의 가장 일반적인 응용이 됩니다.매트릭스 지지체 또는 정지상이 극성(예: 종이, 실리카 등)인 경우 전방상 크로마토그래피이며, 비극성(C-18)인 경우 역상입니다.
크로마토그래피 베드 형태에 의한 기술
컬럼 크로마토그래피
컬럼 크로마토그래피는 고정층이 튜브 안에 있는 분리 기술이다.고체 정지상 또는 액체 정지상으로 코팅된 서포트는 튜브의 전체 부피를 채우거나 튜브의 중간 부분에서 이동상에 대한 개방적이고 제한 없는 경로를 남기면서 튜브 내부 벽(충전 기둥)에 집중될 수 있습니다.매체를 통한 이동 속도의 차이는 [12][13]샘플의 다른 유지 시간에 따라 계산됩니다.1978년, W. Clark Still은 플래시 컬럼 크로마토그래피([14][15]플래시)라고 불리는 컬럼 크로마토그래피의 변형된 버전을 선보였다.이 기술은 용제가 양압을 가하여 칼럼을 통해 구동된다는 점을 제외하면 기존의 컬럼 크로마토그래피와 매우 유사합니다.이를 통해 대부분의 분리를 20분 이내에 수행할 수 있었으며, 이전 방식에 비해 분리가 개선되었습니다.최신 플래시 크로마토그래피 시스템은 미리 포장된 플라스틱 카트리지로 판매되며, 용제는 카트리지를 통해 펌핑됩니다.시스템은 자동화를 제공하는 검출기 및 분수 수집기와 연결될 수도 있다.경사 펌프의 도입으로 분리가 빨라지고 용제 사용이 감소했습니다.
확장층 흡착에서는 패킹베드로 이루어진 고상이 아닌 유동층을 사용한다.이렇게 하면 손상된 세포의 배양액이나 슬러리에 대해 원심 분리 및 여과와 같은 초기 제거 단계를 생략할 수 있습니다.
포스포셀룰로오스 크로마토그래피는 포스포셀룰로오스에 대한 많은 DNA 결합 단백질의 결합 친화력을 이용한다.단백질과 DNA의 상호작용이 강할수록,[16] 그 단백질을 용출하기 위해 필요한 염분 농도는 높아진다.
평면 크로마토그래피
평면 크로마토그래피는 정지상이 평면 또는 평면상에 존재하는 분리 기술이다.평면은 고정층(종이 크로마토그래피)과 같은 물질 또는 유리판(박층 크로마토그래피)과 같은 지지대 위에 펼쳐지는 고체 입자 층에 의해 함침되는 종이가 될 수 있습니다.시료 혼합물의 다른 화합물은 이동상과 비교하여 정지상과 얼마나 강하게 상호작용하느냐에 따라 서로 다른 거리를 이동합니다.각 화학물질의 특정 유지 계수(Rf)를 사용하여 미지의 물질을 식별할 수 있습니다.
종이 크로마토그래피
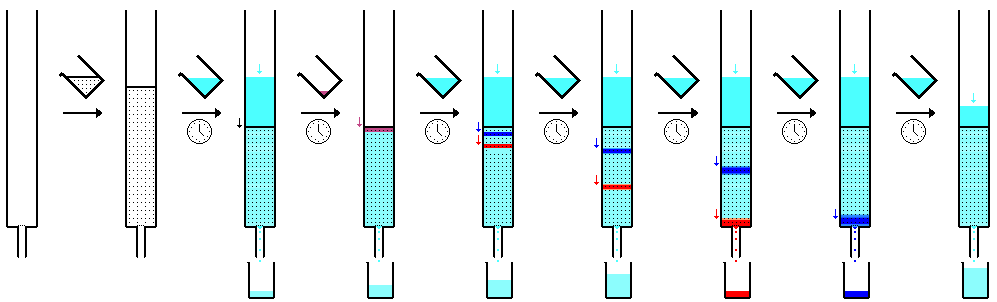
종이 크로마토그래피는 크로마토그래피 종이 조각 위에 작은 점이나 샘플 용액 라인을 놓는 기술이다.용제가 얕은 용기에 용지를 넣어 밀봉합니다.용제가 용제를 통과하면서 샘플 혼합물과 만나 용제와 함께 용지를 위로 이동하기 시작합니다.이 종이는 극성 물질인 셀룰로오스로 만들어졌으며, 극성이 낮으면 혼합물 내의 화합물이 더 멀리 이동한다.더 많은 극성 물질이 셀룰로오스 종이와 더 빨리 결합되므로 멀리까지 이동하지 않습니다.
박층 크로마토그래피(TLC)
박층 크로마토그래피(TLC)는 정지상 및 이동상에 대한 상대적인 인력에 기초하여 서로 다른 생화학물질을 분리하는 데 널리 사용되는 실험실 기술이다.그것은 종이 크로마토그래피와 비슷하다.그러나 정지상을 사용하는 대신 평탄하고 불활성 기판 위에 실리카겔, 알루미나 또는 셀룰로오스와 같은 얇은 흡착제 층의 정지상을 포함한다.TLC는 매우 다용도적이며, 여러 샘플을 동일한 층에서 동시에 분리할 수 있으므로 약물 수준 및 물 [17]순도 테스트와 같은 선별 애플리케이션에 매우 유용합니다.각각의 분리는 새로운 층에서 이루어지기 때문에 교차 오염 가능성은 낮다.종이와 비교하여 더 빠른 실행, 더 나은 분리, 더 나은 정량적 분석, 그리고 다른 흡착제 간의 선택이라는 장점이 있습니다.보다 높은 분해능과 보다 적은 용매를 사용하는 빠른 분리를 위해 고성능 TLC를 사용할 수 있습니다.오래된 대중적인 용도는 겔의 거리를 관찰하여 염색체를 구별하는 것이었다(의 분리는 별도의 단계였다).
치환 크로마토그래피
치환 크로마토그래피의 기본 원리는 크로마토그래피 매트릭스(디스플레이서)에 대한 친화력이 높은 분자가 결합 부위를 위해 효과적으로 경쟁하고,[18] 따라서 친화력이 낮은 모든 분자를 치환하는 것이다.변위와 용출 크로마토그래피 사이에는 뚜렷한 차이가 있다.용출 모드에서는 일반적으로 좁은 가우스 피크의 컬럼에서 물질이 나타납니다.최대한의 정화를 위해 가급적 기준선보다 피크의 광범위한 분리가 바람직하다.혼합물의 성분이 용출 모드에서 열을 따라 이동하는 속도는 여러 요인에 따라 달라집니다.그러나 두 물질이 서로 다른 속도로 이동하고 그에 따라 분해되기 위해서는 생체 분자와 크로마토그래피 매트릭스 사이의 상호작용에 상당한 차이가 있어야 한다.조작 파라미터는 이 차이의 효과를 최대화하기 위해 조정됩니다.대부분의 경우 경사 용출과 낮은 기둥 하중을 통해서만 피크의 기준선 분리를 달성할 수 있다.따라서, 용출 모드 크로마토그래피의 두 가지 단점은, 특히 준비 스케일에서, 구배 용매 펌핑으로 인한 운용 복잡성과 낮은 컬럼 부하로 인한 낮은 throughput이다.치환 크로마토그래피는 성분들이 "피크"가 아닌 순수한 물질의 연속된 구역으로 분해된다는 점에서 용출 크로마토그래피보다 장점이 있습니다.이 공정은 등온선의 비선형성을 이용하기 때문에 정제성분을 상당히 높은 농도로 회수하여 주어진 컬럼 상에서 더 큰 컬럼 피드를 분리할 수 있다.
모바일 단계의 물리적 상태에 따른 기술
가스 크로마토그래피
기액 크로마토그래피(GLC)라고도 하는 가스 크로마토그래피(GC)는 이동상이 기체인 분리 기술입니다.가스 크로마토그래피 분리는 항상 "포장" 또는 "모낭"으로 이루어진 컬럼으로 수행됩니다.충전된 컬럼은 가스 크로마토그래피의 일상적인 작업마로, 더 저렴하고 사용하기 쉬우며 종종 적절한 성능을 제공합니다.모세관 기둥은 일반적으로 훨씬 뛰어난 분해능을 제공하며, 특히 복합 혼합물에 더 많은 비용이 사용되고 있습니다.또한 캐피럴리 컬럼은 다공질층 개방관(PLOT), 벽코팅 개방관(WCOT) 및 지지코팅 개방관(SCOT) 컬럼의 3가지 클래스로 나눌 수 있다.PLOT 기둥은 고정 위상이 기둥 벽에 흡착되는 방식으로 독특하지만 WCOT 기둥은 벽에 화학적으로 결합되는 고정 위상이 있습니다.SCOT 기둥은 기둥 벽에 부착된 지지 입자를 갖는 방식으로 언급된 두 가지 유형의 조합이지만, 이러한 입자는 [19]액상을 화학적으로 결합합니다.두 기둥 모두 비흡착성 및 화학 불활성 재료로 만들어집니다.스테인리스강과 유리는 충전 기둥과 석영 또는 모세관 기둥의 용융 실리카의 일반적인 재료입니다.
가스 크로마토그래피는 고체 또는 점성이 있는 액체 정지상(종종 액체 실리콘 기반 물질)과 이동식 가스(종종 헬륨) 사이의 분석 물질의 분할 평형에 기초한다.정지상은 소경(일반적으로 내경 0.53~0.18mm) 글라스나 퓨즈 실리카 튜브(모관 기둥) 또는 대형 금속 튜브(포장 기둥) 내부의 고체 매트릭스 내부에 부착됩니다.GC에서 사용되는 고온으로 인해 생화학에서 자주 발생하는 고분자 생체고분자 또는 단백질(열 변성)에 적합하지 않지만 석유화학, 환경 모니터링 및 교정, 산업 화학 분야에서 사용하기에 매우 적합합니다.그것은 또한 화학 연구에서도 광범위하게 사용된다.
액체 크로마토그래피
액체 크로마토그래피(LC)는 이동상이 액체인 분리 기술입니다.열 또는 평면 중 하나로 수행될 수 있습니다.일반적으로 매우 작은 패킹 입자와 비교적 높은 압력을 사용하는 오늘날의 액체 크로마토그래피는 고성능 액체 크로마토그래피(HPLC)라고 불립니다.
HPLC에서 샘플은 비정형 또는 구형 입자로 이루어진 고정상, 다공질 모노리식층 또는 다공질 막으로 채워진 기둥을 통해 고압의 액체(이동상)에 의해 강제된다.모노리스(monolith)는 "스펀지 같은 크로마토그래피 매체"[20]로 유기 또는 무기 부품의 끝없는 블록으로 구성되어 있습니다.HPLC는 지금까지 모바일 단계와 정지 단계의 극성에 따라2개의 다른 서브 클래스로 분할되어 있었습니다.정지상이 이동상보다 극성이 높은 방법(예를 들어 이동상 톨루엔, 정지상 실리카)을 정상 액체 크로마토그래피(NPLC)라고 하고, 그 반대(예를 들어 이동상으로서의 물-메탄올 혼합물, 정지상으로서의 C18(옥타데실릴릴)을 역상 크롬이라고 한다.아토그래피(RPLC)
이 넓은 제목 아래 구체적인 기술은 다음과 같습니다.
어피니티 크로마토그래피
어피니티[21] 크로마토그래피는 분석물과 특정 분자 사이의 선택적 비공유 상호작용에 기초한다.그것은 매우 구체적이지만,[22] 그다지 견고하지는 않다.그것은 종종 생화학에서 태그에 결합된 단백질의 정화에 사용된다.이러한 융합 단백질은 특히 정상상에 결합하는 His-tag, 비오틴 또는 항원과 같은 화합물로 라벨링됩니다.정제 후 보통 이들 태그를 제거하고 순수 단백질을 얻는다.
친화성 크로마토그래피는 종종 금속(Zn, Cu, Fe 등)에 대한 생체분자의 친화성을 이용한다.열은 종종 수동으로 준비됩니다.전통적인 친화력 열은 원치 않는 생체 분자를 제거하기 위한 준비 단계로 사용됩니다.
그러나 친화성 크로마토그래피 특성을 이용하는 액체 크로마토그래피 기술이 존재한다.고정화 금속친화성 크로마토그래피(IMAC)[23][24]는 금속에 대한 상대적 친화성에 기초하여 상기 분자를 분리하는 데 유용하다.종종 이러한 기둥은 다른 금속으로 로드되어 표적 친화력을 가진 기둥을 만들 수 있습니다.[25]
초임계 유체 크로마토그래피
초임계 유체 크로마토그래피는 이동상이 임계 온도와 압력에 상대적으로 가까운 유체인 분리 기술이다.
분리 메커니즘에 의한 기술
이온 교환 크로마토그래피
이온 교환 크로마토그래피(일반적으로 이온 크로마토그래피라고 함)는 이온 교환 메커니즘을 사용하여 각각의 전하를 기반으로 분석 물질을 분리합니다.일반적으로 열에서 수행되지만 평면 모드에서도 유용합니다.이온 교환 크로마토그래피는 음이온, 양이온, 아미노산, 펩타이드, 단백질을 포함한 하전 화합물을 분리하기 위해 대전된 정지상을 사용합니다.기존 방법에서 정상상은 이온 교환 수지로, 하전된 관능기를 가지고 있으며, 이 작용기는 반대 방향으로 대전된 화합물과 상호작용하여 유지된다.이온 교환 크로마토그래피에는 양이온 교환과 음이온 교환의 두 가지 유형이 있습니다.양이온-교환 크로마토그래피에서 정상상은 음전하를 가지며 교환 가능한 이온은 양이온인 반면, 음이온-교환 크로마토그래피에서는 정상상은 양전하를 가지며 교환 가능한 이온은 [26]음이온이다.이온 교환 크로마토그래피는 일반적으로 FPLC를 사용하여 단백질을 정제하는 데 사용됩니다.
크기 제외 크로마토그래피
크기 제외 크로마토그래피(SEC)는 겔 투과 크로마토그래피(GPC) 또는 겔 여과 크로마토그래피라고도 하며 크기에 따라(또는 유체역학적 직경 또는 유체역학적 체적에 따라 더 정확하게) 분자를 분리한다.더 작은 분자는 매체의 기공으로 들어갈 수 있으며, 따라서 분자는 이동상의 흐름에서 포착되어 제거된다.모공에서의 평균 체류 시간은 분석물 분자의 유효 크기에 따라 달라집니다.그러나 패킹의 평균 모공 크기보다 큰 분자는 제외되어 기본적으로 유지되지 않는다. 이러한 종은 용출된 첫 번째 종이다.이것은 일반적으로 저해상도 크로마토그래피 기술이며, 따라서 종종 정화의 마지막 "광택" 단계를 위해 남겨집니다.정제 단백질의 3차 구조와 4차 구조를 결정하는 데도 유용하며, 특히 천연 용액 조건에서 수행될 수 있기 때문이다.
확장된 바닥 흡착 크로마토그래피 분리
생화학적 분리공정용 확장층 크로마토그래피 흡착(EBA) 컬럼은 확장층 바닥의 다공질 차단 체판 아래에 자기세척 기능을 가진 압력균등화액 분배기와 확장층 상부에 역류세척 기능을 가진 상부 노즐 조립체, 를 갖춘다.확장된 베드에 첨가된 공급 원료 액체의 더 나은 분배를 보장하여 확장된 베드층을 통과한 오일이 피스톤 흐름 상태를 나타내도록 한다.확장된 베드 층은 피스톤 흐름 상태를 표시합니다.확장베드 크로마토그래피 분리칼럼은 확장베드의 분리효율을 높일 수 있는 장점이 있습니다.
확장상 흡착(EBA) 크로마토그래피는 정제되지 않은 조시료에서 직접 단백질을 포획하기 위한 편리하고 효과적인 기술이다.EBA 크로마토그래피에서는 우선 평형버퍼의 상향류에 의해 침전층이 팽창한다.수용성 단백질, 오염 물질, 세포, 세포 파편의 혼합물인 조잡한 사료는 확장된 바닥을 통해 위로 전달된다.표적 단백질은 미립자와 오염물질이 통과하는 동안 흡착제에서 포착된다.상향 흐름을 유지하면서 용출 버퍼로 변화하면 확장 베드 모드에서 표적 단백질이 탈착된다.또는 흐름이 역전되면 흡착된 입자가 빠르게 침하되어 용출 버퍼에 의해 단백질을 탈착할 수 있다.용출에 사용되는 모드(확장 침대 대 정착 침대)는 피드의 특성에 따라 달라집니다.용출 후 미리 정의된 CIP(Cleaning-in-Place) 용액으로 흡착제를 세척한 후 컬럼 재생(추가 사용을 위해) 또는 보관합니다.
특수 기술
역상 크로마토그래피
역상 크로마토그래피(RPC)는 이동상이 정지상보다 훨씬 극성이 높은 액체 크로마토그래피 절차입니다.정상상 액체 크로마토그래피에서는 이동상이 정지상보다 극성이 현저히 낮기 때문에 이러한 이름이 붙었다.이동상의 소수성 분자는 상대적으로 소수성 정지상에 흡착하는 경향이 있다.이동상 친수성 분자가 먼저 용출되는 경향이 있다.분리기둥은 일반적으로 실리카 입자 기질에 결합된 C8 또는 C18 탄소사슬을 포함한다.
소수성 상호작용 크로마토그래피
소수성 상호작용 크로마토그래피(HIC)는 분석물질과 크로마토그래피 매트릭스 사이의 소수성 상호작용에 기초하여 단백질과 같은 분석물질을 분리하는 정제 및 분석 기술이다.이것은 역상 분리에 대한 비변성 직교 접근방식을 제공할 수 있으며, 고유 구조와 잠재적으로 단백질 활성을 보존할 수 있다.소수성 상호작용 크로마토그래피에서 매트릭스 재료를 소수기로 가볍게 치환한다.이러한 그룹은 메틸기, 에틸기, 프로필기,[27] 부틸기, 옥틸기 또는 페닐기로 분류될 수 있습니다.높은 염분 농도에서 단백질 표면에 있는 무극성 측쇄는 소수성 그룹과 "상호작용"한다. 즉, 두 가지 유형의 그룹은 극성 용매에 의해 제외된다(소수성 효과는 이온 강도의 증가에 의해 증가한다).따라서 시료는 극성이 높은 완충재 내의 컬럼에 적용되어 분석물질의 소수성 패치와 정지상의 연관성을 구동한다.용리액은 일반적으로 염분 농도가 감소하거나 (소수성 상호작용을 방해하는) 세제의 농도가 증가하거나 pH의 변화가 있는 수성 완충제입니다.중요한 것은 사용되는 소금의 종류이며, Hofmeister 시리즈에 의해 정의된 바와 같이 더 많은 코스모트로피성 염류가 분자 주위에 가장 많은 물 구조를 제공하고 결과적으로 소수성 압력을 제공합니다.이를 위해 황산암모늄이 자주 사용된다.유기 용제 또는 극성이 낮은 다른 성분을 추가하면 분해능을 개선하는 데 도움이 될 수 있습니다.
일반적으로 소수성 상호작용 크로마토그래피(HIC)는 샘플이 pH 변화나 다른 유형의 크로마토그래피에서 일반적으로 사용되는 거친 용제에 민감하지만 염분 농도가 높지 않은 경우에 유리하다.일반적으로 완충제 내의 염분량이 다양합니다.2012년 뮐러와 프란츠레브는 네 가지 유형의 소수성 수지와 함께 BSA(Bovine Serum Albumin)를 사용하여 온도가 HIC에 미치는 영향을 설명했습니다.그 연구는 매트릭스에 BSA의 결합 친화성에 영향을 미치도록 온도를 변화시켰다.50도에서 10도 사이의 온도를 순환하는 것은 매트릭스에서 모든 BSA를 효과적으로 씻어내기에 충분하지 않지만 컬럼을 몇 [28]번만 사용할 경우 매우 효과적일 수 있다는 결론을 내렸다.온도를 사용하여 변화를 일으키면 연구소는 소금 구입 비용을 절감하고 비용을 절감할 수 있습니다.
높은 염분 농도와 온도 변동을 방지하려면 보다 소수성을 사용하여 표본과 경쟁하여 용출할 수 있습니다.[출처]HIC의 이른바 염분 의존형 방법은 인간면역글로불린G(IgG)를 혈청에서 직접 분리하여 양호한 수율로 보였으며,[29] 매트릭스에서 IgG를 치환하기 위한 경쟁자로 베타-시클로덱스트린을 사용했다.이것은 높은 염분 농도가 단백질을 침전시키는 것을 알고 있기 때문에 소금에 민감한 샘플에 HIC를 사용할 수 있는 가능성을 크게 열어줍니다.
유체역학적 크로마토그래피
유체역학적 크로마토그래피(HDC)는 큰 물방울이 [30]작은 물방울보다 빠르게 움직이는 현상을 관찰한 결과다.기둥에서는 큰 물방울의 질량 중심이 전체적인 [31]크기가 크기 때문에 작은 물방울만큼 기둥의 측면에 가까이 가지 못하기 때문에 이러한 현상이 발생합니다.큰 물방울은 먼저 기둥 중앙에서 용출되고 작은 물방울은 기둥 측면에 부착되어 마지막으로 용출됩니다.이러한 형태의 크로마토그래피는 광산란 검출기, 점도계,[32] 굴절계와 함께 사용할 경우 분석물질을 몰 질량, 크기, 모양, 구조별로 분리하는 데 유용합니다.HDC의 두 가지 주요 유형은 개방 튜브와 패킹 칼럼입니다.개방형 튜브는 작은 입자의 빠른 분리 시간을 제공하는 반면, 충전된 컬럼 HDC는 분해능을 높일 수 있으며 평균 분자량이 5 10[33] 달톤보다 큰 입자에 적합합니다.HDC는 다른 유형의 크로마토그래피와 달리 분리는 충전된 [34]컬럼의 입자 주위 및 입자 사이의 부피인 간질 부피에서만 이루어지기 때문입니다.
HDC는 SEC(Size Exclusion Chromotography)와 동일한 용출 순서를 공유하지만 두 과정은 여전히 여러 [33]가지 면에서 다릅니다.두 가지 유형의 분리를 비교한 연구에서 이센버그, 브루어, 코테 및 스트리겔은 다당류 특성화에 두 가지 방법을 모두 사용했으며, HDC와 다중각도 빛 산란(MALS)이 결합된 몰 질량 분포가 SEC보다 훨씬 짧은 [35]시간에 더 정확한 몰 질량 분포를 달성한다는 결론을 내렸다.이는 주로 SEC가 더 파괴적인 기술이기 때문인데, 이는 컬럼의 모공이 분리 중에 분석물을 분해하여 질량 [35]분포에 영향을 미치는 경향이 있기 때문입니다.그러나 HDC의 주요 단점은 분석물 피크 분해능이 낮다는 점이며, 이는 SEC가 쉽게 분해되지 않고 빠른 용출이 [36]중요하지 않은 화학 물질과 함께 사용될 때 보다 실행 가능한 옵션이 됩니다.
HDC는 미세 유체 공학 분야에서 특히 중요한 역할을 합니다.HDC-on-a-chip 시스템을 위한 첫 번째 성공적인 장치는 Chmela 등에 의해 [37]2002년에 제안되었습니다.설계에서는 지름 26~110nm의 입자에 대해 3분의 시간 척도로 80mm 길이의 채널을 사용하여 분리할 수 있었지만 저자들은 보존 및 분산 매개변수를 [37]개선할 필요가 있다고 밝혔다.Jellema, Markestejn, Westerweel 및 Verpoorte의 2010년 출판물에서 재순환 양방향 흐름으로 HDC를 구현하면 3mm 길이의 [38]채널만으로 고해상도, 크기 기반 분리가 실현되었습니다.이전 연구들이 80mm [37]길이의 채널을 사용했다는 점을 고려할 때, 이러한 짧은 채널과 높은 해상도를 가진 것은 특히 인상적이었다.생물학적 응용으로 2007년 Huh 등은 HDC와 중력에 기반한 미세 유체 선별 장치를 제안했는데,[39] 이는 초음파에서 조영제를 주입할 때 직경 6미크론 이상의 잠재적으로 위험한 입자가 혈류로 유입되는 것을 방지하는 데 유용했다.이 연구는 또한 흐름을 주도하는 외부 전자 장치의 부족으로 인해 미세 유체 공학에서 환경 지속 가능성에 대한 진보를 이루었으며, 이는 중력 기반 장치를 사용하는 장점으로 다가왔다.
2차원 크로마토그래피
경우에 따라서는 하나의 컬럼을 사용함으로써 얻을 수 있는 선택성이 복잡한 샘플에서 분석물질의 분해능을 제공하기에 불충분할 수 있다.2차원 크로마토그래피는 서로 다른 물리화학([40][41]화학적 분류) 특성을 가진 두 번째 열을 사용하여 이러한 피크의 분해능을 높이는 것을 목표로 합니다.이 새로운 고체 지지체에서의 유지 메커니즘은 1차원 분리와는 다르기 때문에 1차원 크로마토그래피로 구별할 수 없는 2차원 크로마토그래피로 화합물을 분리할 수 있다.또, 제2 차원에서의 분리가 제1 [40]차원보다 빠르다.2차원 TLC 분리의 예로는 샘플이 정사각형 플레이트의 한쪽 모서리에서 포착되어 현상, 공기 건조, 90° 회전하며 보통 두 번째 용매 시스템에서 재개발되는 것입니다.GC 또는 LC [40][41]분리에 2차원 크로마토그래피를 적용할 수 있다.이 분리 방법은 첫 번째 차원에 대한 특정 관심 영역을 두 번째 차원에 의해 분리하도록 선택하는 심장 절개 [42]접근법이나 첫 번째 차원의 모든 분석 물질이 두 번째 차원 분리를 겪는 포괄적인 [40][41]접근법에서도 사용할 수 있다.
이동상 크로마토그래피 시뮬레이션
시뮬레이션 이동층(SMB) 기술은 고성능 액체 크로마토그래피의 변형으로, 달리 분해하기 어렵거나 불가능한 입자 및/또는 화합물을 분리하는 데 사용됩니다.이 분리 증가는 정지상을 무한히 연장하기 위해 사용되는 밸브와 칼럼 배열에 의해 발생합니다.준비 크로마토그래피의 이동층 기법은 사료 입력과 분석물 회수가 동시에 연속적이지만, 연속 이동층이 현실적으로 어렵기 때문에 시뮬레이션 이동층 기법이 제안되었다.침대를 이동시키는 대신 시료 입구 및 분석물 출구 위치를 연속적으로 이동시켜 이동 침대의 느낌을 주는 모의 이동 침대 기술이다.진정한 이동층 크로마토그래피(TMBC)는 이론적인 개념일 뿐입니다.시뮬레이션 SMBC는 다양한 컬럼을 직렬로 사용하고 복잡한 밸브 배치를 통해 달성되며, 샘플과 용매 공급을 제공하며, 또한 컬럼의 적절한 위치에서 분석물과 폐기물 테이크아웃을 제공하여 샘플 엔트리를 한 방향으로 정기적으로 전환할 수 있습니다. 즉, 반대쪽의 용매 엔트리입니다.분석물과 폐기물 배출 위치도 적절히 변경하는 동시에 방향도 고려해야 합니다.
열분해 가스 크로마토그래피
열분해-가스 크로마토그래피-질량분석법은 샘플을 가열하여 분해하여 가스 크로마토그래피에 의해 분리되고 질량분석법에 의해 검출되는 더 작은 분자를 생성하는 화학분석법이다.
열분해는 불활성 대기 또는 진공상태에서 물질의 열분해이다.샘플은 백금 와이어와 직접 접촉하거나 석영 샘플 튜브에 넣은 후 600–1000°C로 빠르게 가열됩니다.용도에 따라서는 더 높은 온도가 사용됩니다.실제 열융착기에는 세 가지 가열 기법이 사용됩니다.백금 필라멘트를 사용한 등온로, 유도 가열(Quie Point 필라멘트), 저항 가열.큰 분자는 가장 약한 부분에서 갈라져 작고 휘발성이 더 높은 파편을 만들어냅니다.이 조각들은 가스 크로마토그래피로 분리될 수 있다.열분해 GC 크로마토그램은 다양한 분해 생성물이 형성되기 때문에 일반적으로 복잡하다.데이터는 재료 정체성을 증명하기 위한 지문으로 사용하거나 GC/MS 데이터를 사용하여 구조 정보를 얻기 위해 개별 단편을 식별할 수 있다.극성 조각의 휘발성을 높이기 위해 다양한 메틸화 시약을 열분해 전에 시료에 첨가할 수 있다.
전용 열분해조 사용 외에, 고형 및 액체 샘플의 열분해 GC는 빠른 가열(최대 30 °C/s)과 600 – 650 °C의 높은 최대 온도를 제공하는 프로그램 가능한 온도 기화기(PTV) 인젝터 내부에서 직접 수행할 수 있습니다.이는 일부 열분해 용도에 충분합니다.주요 장점은 전용 기기를 구입할 필요가 없으며 정기적인 GC 분석의 일부로 열분해 작업을 수행할 수 있다는 것입니다.이 경우 석영 GC 인렛 라이너를 사용해야 합니다.정량 데이터를 취득할 수 있어 PTV 인젝터 내에서의 유도체화의 양호한 결과도 공표된다.
고속 단백질 액체 크로마토그래피
고속 단백질 액체 크로마토그래피(FPLC)는 단백질 혼합물을 분석하거나 정제하는 데 자주 사용되는 액체 크로마토그래피의 한 형태이다.다른 형태의 크로마토그래피와 마찬가지로 혼합물의 서로 다른 성분이 두 가지 물질, 즉 움직이는 유체(이동상)와 다공질 고체(정지상)에 대해 서로 다른 친화력을 가지기 때문에 분리가 가능하다.FPLC에서 모바일 위상은 수용액 또는 "버퍼"입니다.버퍼 유량은 양변위 펌프에 의해 제어되며 일반적으로 일정하게 유지되며, 버퍼의 구성은 두 개 이상의 외부 저장소에서 다른 비율로 유체를 흡입하여 변경할 수 있습니다.정지상은 보통 가교된 아가로스 비즈로 구성된 수지로 원통형 유리 또는 플라스틱 기둥에 포장됩니다.FPLC 수지는 용도에 따라 다양한 비드 크기와 표면 배위자로 사용할 수 있습니다.
역류 크로마토그래피
역류 크로마토그래피(CCC)는 액체 크로마토그래피의 일종으로 정지상 및 이동상 모두 액체이며 액체 정지상은 강한 원심력에 의해 정체된 상태로 유지된다.
유체역학적 역류 크로마토그래피(CCC)
CCC 계측기의 작동 원리는 보빈 주위에 감긴 개방형 튜브로 구성된 칼럼이 필요합니다.보빈은 이중 축 회전 운동(심장 운동)으로 회전하므로 회전할 때마다 가변 중력(G)장이 칼럼에 작용합니다.이 동작으로 인해 사용된 두 불용액상 사이의 분할 계수로 인해 컬럼에 회전당 분할 단계가 1개씩 표시되며 샘플의 구성요소가 컬럼 내에서 분리됩니다.현재 이용 가능한 CCC는 여러 종류가 있습니다.여기에는 HSCC(High Speed CCC) 및 HPCC(High Performance CCC)가 포함됩니다.HPCCC는 현재 이용 가능한 최신 버전의 계측입니다.
원심분할크로마토그래피(CPC)
CPC(중심분할크로마토그래피 또는 정수역류크로마토그래피) 기구에서 컬럼은 로터에 부착된 덕트로 상호 연결된 일련의 셀로 구성된다.이 로터는 중심축을 중심으로 회전하여 정지상을 유지하는 데 필요한 원심장을 생성합니다.CPC에서의 분리 과정은 오직 정지상과 이동상 사이의 용질 분할에 의해 제어되며, 용질의 분할 계수(KD)를 사용하여 메커니즘이 쉽게 설명될 수 있다.CPC 계측기는 약 10밀리리터부터 10리터 부피까지 다양한 크기의 컬럼을 가진 실험실, 파일럿 및 산업용 스케일 분리에 사용할 수 있습니다.
주기적 역류 크로마토그래피
역류 크로마토그래피(위 참조)와 달리 주기적 역류 크로마토그래피(PCC)는 고체 정지상 및 액체 이동상만을 사용한다.따라서 이것은 현재의 크로마토그래피보다 기존의 친화성 크로마토그래피와 훨씬 더 유사하다.PCC는 여러 열을 사용하며, 로드 단계 동안 이 열은 일렬로 연결됩니다.이 모드에서는 수지가 완전히 포화되기 전에 이미 컬럼을 관통하는 제품을 잃지 않고 이 시리즈의 첫 번째 컬럼을 오버로드할 수 있습니다.획기적인 제품이 다음 열에 캡처됩니다.다음 단계에서는 열이 서로 연결 해제됩니다.첫 번째 열은 세척되고 용출되며 다른 열은 로드됩니다.(처음) 첫 번째 컬럼이 다시 평형화되면 로드 스트림에 다시 도입되지만 마지막 컬럼으로 사용됩니다.그런 다음 프로세스는 주기적인 방식으로 계속됩니다.
키랄 크로마토그래피
키랄 크로마토그래피는 입체 이성질체의 분리를 포함한다.에난티오머의 경우 3차원 거울상 이외에는 화학적, 물리적 차이가 없습니다.기존의 크로마토그래피나 다른 분리 과정에서는 이들을 분리할 수 없다.키랄 분리를 수행하려면 이동 위상 또는 정지 위상 자체를 키랄로 만들어 분석 물질 간에 다른 친화력을 제공해야 합니다.정상상 및 역상 모두에서 키랄 크로마토그래피 HPLC 컬럼(키랄 정지상 포함)을 시판할 수 있습니다.
수성 정상 크로마토그래피
수성 정상상(ANP) 크로마토그래피는 물이 이동상 용제계 성분 중 하나인 고전적인 정상상 모드(즉 이동상이 정지상보다 극성이 현저히 낮은 경우)의 용출 거동에 의해 특징지어진다.유지 메커니즘이 [43]분할이 아닌 흡착에 의한 것이라는 점에서 친수성 상호작용 액체 크로마토그래피(HILIC)와 구별된다.
적용들
크로마토그래피는 제약 산업, 식음료 산업, 화학 산업, 법의학, 환경 분석, [44]병원을 포함한 많은 분야에서 사용된다.
「 」를 참조해 주세요.
레퍼런스
- ^ McMurry J (2011). Organic chemistry: with biological applications (2nd ed.). Belmont, CA: Brooks/Cole. pp. 395. ISBN 9780495391470.
- ^ González-González, Mirna; Mayolo-Deloisa, Karla; Rito-Palomares, Marco (1 January 2020), Matte, Allan (ed.), "Chapter 5 - Recent advances in antibody-based monolith chromatography for therapeutic applications", Approaches to the Purification, Analysis and Characterization of Antibody-Based Therapeutics, Elsevier, pp. 105–116, doi:10.1016/b978-0-08-103019-6.00005-9, ISBN 978-0-08-103019-6, S2CID 226450210, retrieved 31 January 2022
- ^ 대체 바이오세파레이션 작업: 포장상 크로마토그래피 T.M. Przybycien, N.S. Pujar 및 L.M. 이상의 생명.Steel Curr Opin Biotechnol, 15(5)(2004), 469-478페이지
- ^ Ongkudon, Clarence M.; Kansil, Tamar; Wong, Charlotte (2014). "Challenges and strategies in the preparation of large-volume polymer-based monolithic chromatography adsorbents". Journal of Separation Science. 37 (5): 455–464. doi:10.1002/jssc.201300995. ISSN 1615-9314. PMID 24376196.
- ^ González-González, Mirna; Mayolo-Deloisa, Karla; Rito-Palomares, Marco (1 January 2020), Matte, Allan (ed.), "Chapter 5 - Recent advances in antibody-based monolith chromatography for therapeutic applications", Approaches to the Purification, Analysis and Characterization of Antibody-Based Therapeutics, Elsevier, pp. 105–116, doi:10.1016/b978-0-08-103019-6.00005-9, ISBN 978-0-08-103019-6, S2CID 226450210, retrieved 31 January 2022
- ^ Hostettmann K, Marston A, Hostettmann M (1998). Preparative Chromatography Techniques Applications in Natural Product Isolation (Second ed.). Berlin, Heidelberg: Springer Berlin Heidelberg. p. 50. ISBN 9783662036310.
- ^ Harper, Douglas. "chromatography". Online Etymology Dictionary.
- ^ Ettre LS, Zlatkis A, eds. (26 August 2011). 75 Years of Chromatography: A Historical Dialogue. Elsevier. ISBN 978-0-08-085817-3.
- ^ Ettre LS, Sakodynskii KI (March 1993). "M. S. Tswett and the discovery of chromatography II: Completion of the development of chromatography (1903–1910)". Chromatographia. 35 (5–6): 329–338. doi:10.1007/BF02277520. S2CID 97052560.
- ^ "The Nobel Prize in Chemistry 1952". nobelprize.org. Retrieved 25 August 2016.
- ^ a b c d Borman, Stu (1987). "Eluent, Effluent, Eluate, and Eluite". Analytical Chemistry. 59 (2): 99A. doi:10.1021/ac00129a735.
- ^ Ettre LS (1993). "Nomenclature for chromatography (IUPAC Recommendations 1993)". Pure and Applied Chemistry. 65 (4): 819–872. doi:10.1351/pac199365040819.
- ^ Manish T. "How does column chromatography work?". BrightMags. Archived from the original on 21 April 2017. Retrieved 7 April 2017.
- ^ Still WC, Kahn M, Mitra A (1978). "Rapid chromatographic technique for preparative separations with moderate resolution". J. Org. Chem. 43 (14): 2923–2925. CiteSeerX 10.1.1.476.6501. doi:10.1021/jo00408a041.
- ^ Harwood LM, Moody CJ (1989). Experimental organic chemistry: Principles and Practice (Illustrated ed.). WileyBlackwell. pp. 180–185. ISBN 978-0-632-02017-1.
- ^ Bourgeois S, Pfahl M (1976). "Repressors". In Anfinsen CB, Edsall JT, Richards FM (eds.). Advances in Protein Chemistry. Vol. 30. Academic Press. pp. 6–7. doi:10.1016/S0065-3233(08)60478-7. ISBN 978-0-12-034230-3. PMID 779429.
- ^ Bernard F (2003). Handbook of Thin-Layer Chromatography. Marcel Dekker Inc. ISBN 978-0824748661. OCLC 437068122.
- ^ 치환 크로마토그래피 101 2008년 9월 15일 웨이백 머신에 보관.사셈오스틴, TX 78737
- ^ Rahman, M.; El-Aty, A.M.A.; Choi, J.-H.; Shin, H.-C.; Shin, S.-C.; Shim, J.-H. (November 2015). "Chapter 3 Basic Overview on Gas Chromatography Columns". Analytical Separation Science. pp. 823–834. ISBN 9783527333745.
- ^ González-González, Mirna; Mayolo-Deloisa, Karla; Rito-Palomares, Marco (1 January 2020), Matte, Allan (ed.), "Chapter 5 - Recent advances in antibody-based monolith chromatography for therapeutic applications", Approaches to the Purification, Analysis and Characterization of Antibody-Based Therapeutics, Elsevier, pp. 105–116, doi:10.1016/b978-0-08-103019-6.00005-9, ISBN 978-0-08-103019-6, S2CID 226450210, retrieved 31 January 2022
- ^ Wilchek M, Chaiken I (2000). "An overview of affinity chromatography". In Bailon P, Ehrlich GK, Fung WJ, Berthold W (eds.). Affinity Chromatography. Methods in Molecular Biology. Vol. 147. Humana Press. pp. 1–6. doi:10.1007/978-1-60327-261-2_1. ISBN 978-1-60327-261-2. PMID 10857080.
- ^ Urh, Marjeta; Simpson, Dan; Zhao, Kate (2009). "Chapter 26 Affinity Chromatography". Guide to Protein Purification, 2nd Edition. Methods in Enzymology. Vol. 463. pp. 417–438. doi:10.1016/S0076-6879(09)63026-3. ISBN 9780123745361. PMID 19892186.
- ^ Singh NK, DSouza RN, Bibi NS, Fernández-Lahore M (2015). "Direct Capture of His6-Tagged Proteins Using Megaporous Cryogels Developed for Metal-Ion Affinity Chromatography". In Reichelt S (ed.). Affinity Chromatography. Methods in Molecular Biology. Vol. 1286. pp. 201–12. doi:10.1007/978-1-4939-2447-9_16. ISBN 978-1-4939-2447-9. PMID 25749956.
- ^ Gaberc-Porekar V, Menart V (October 2001). "Perspectives of immobilized-metal affinity chromatography". Journal of Biochemical and Biophysical Methods. 49 (1–3): 335–60. doi:10.1016/S0165-022X(01)00207-X. PMID 11694288.
- ^ Mahmoudi Gomari, Mohammad; Saraygord-Afshari, Neda; Farsimadan, Marziye; Rostami, Neda; Aghamiri, Shahin; Farajollahi, Mohammad M. (December 2020). "Opportunities and challenges of the tag-assisted protein purification techniques: Applications in the pharmaceutical industry". Biotechnology Advances. 45: 107653. doi:10.1016/j.biotechadv.2020.107653. ISSN 0734-9750. PMID 33157154. S2CID 226276355.
- ^ Ninfa AJ (2009). Fundamental Laboratory Approaches for Biochemistry and Biotechnology. ISBN 978-0-470-47131-9.
- ^ Ninfa AJ, Ballou DP, Benore M (2010). Fundamental Laboratory Approaches for Biochemistry and Biotechnology. Hoboken, NJ: John Wiley.
- ^ Müller TK, Franzreb M (October 2012). "Suitability of commercial hydrophobic interaction sorbents for temperature-controlled protein liquid chromatography under low salt conditions". Journal of Chromatography A. 1260: 88–96. doi:10.1016/j.chroma.2012.08.052. PMID 22954746.
- ^ Ren J, Yao P, Chen J, Jia L (November 2014). "Salt-independent hydrophobic displacement chromatography for antibody purification using cyclodextrin as supermolecular displacer". Journal of Chromatography A. 1369: 98–104. doi:10.1016/j.chroma.2014.10.009. PMID 25441076.
- ^ Song H, Tice JD, Ismagilov RF (February 2003). "A microfluidic system for controlling reaction networks in time". Angewandte Chemie. 42 (7): 768–72. doi:10.1002/anie.200390203. PMID 12596195.
- ^ Small H, Langhorst MA (1 July 1982). "Hydrodynamic Chromatography". Analytical Chemistry. 54 (8): 892A–898A. doi:10.1021/ac00245a724. ISSN 0003-2700.
- ^ Brewer AK, Striegel AM (April 2011). "Characterizing string-of-pearls colloidal silica by multidetector hydrodynamic chromatography and comparison to multidetector size-exclusion chromatography, off-line multiangle static light scattering, and transmission electron microscopy". Analytical Chemistry. 83 (8): 3068–75. doi:10.1021/ac103314c. PMID 21428298.
- ^ a b Stegeman G, van Asten AC, Kraak JC, Poppe H, Tijssen R (1994). "Comparison of Resolving Power and Separation Time in Thermal Field-Flow Fractionation, Hydrodynamic Chromatography, and Size-Exclusion Chromatography". Analytical Chemistry. 66 (7): 1147–1160. doi:10.1021/ac00079a033. ISSN 0003-2700.
- ^ Small H (1 July 1974). "Hydrodynamic chromatography a technique for size analysis of colloidal particles". Journal of Colloid and Interface Science. 48 (1): 147–161. Bibcode:1974JCIS...48..147S. doi:10.1016/0021-9797(74)90337-3. ISSN 0021-9797.
- ^ a b Isenberg SL, Brewer AK, Côté GL, Striegel AM (September 2010). "Hydrodynamic versus size exclusion chromatography characterization of alternan and comparison to off-line MALS". Biomacromolecules. 11 (9): 2505–11. doi:10.1021/bm100687b. PMID 20690593.
- ^ Striegel AM, Brewer AK (19 July 2012). "Hydrodynamic chromatography". Annual Review of Analytical Chemistry. 5 (1): 15–34. Bibcode:2012ARAC....5...15S. doi:10.1146/annurev-anchem-062011-143107. PMID 22708902.
- ^ a b c Chmela E, Tijssen R, Blom MT, Gardeniers HJ, van den Berg A (July 2002). "A chip system for size separation of macromolecules and particles by hydrodynamic chromatography". Analytical Chemistry. 74 (14): 3470–5. doi:10.1021/ac0256078. PMID 12139056.
- ^ Jellema LJ, Markesteijn AP, Westerweel J, Verpoorte E (May 2010). "Tunable hydrodynamic chromatography of microparticles localized in short microchannels". Analytical Chemistry. 82 (10): 4027–35. doi:10.1021/ac902872d. PMID 20423105.
- ^ Huh D, Bahng JH, Ling Y, Wei HH, Kripfgans OD, Fowlkes JB, et al. (February 2007). "Gravity-driven microfluidic particle sorting device with hydrodynamic separation amplification". Analytical Chemistry. 79 (4): 1369–76. doi:10.1021/ac061542n. PMC 2527745. PMID 17297936.
- ^ a b c d Prebihalo SE, Berrier KL, Freye CE, Bahaghighat HD, Moore NR, Pinkerton DK, Synovec RE (January 2018). "Multidimensional Gas Chromatography: Advances in Instrumentation, Chemometrics, and Applications". Analytical Chemistry. 90 (1): 505–532. doi:10.1021/acs.analchem.7b04226. PMID 29088543.
- ^ a b c Stoll DR, Carr PW (January 2017). "Two-Dimensional Liquid Chromatography: A State of the Art Tutorial". Analytical Chemistry. 89 (1): 519–531. doi:10.1021/acs.analchem.6b03506. PMID 27935671.
- ^ Tranchida PQ, Sciarrone D, Dugo P, Mondello L (February 2012). "Heart-cutting multidimensional gas chromatography: a review of recent evolution, applications, and future prospects". Analytica Chimica Acta. A selection of papers presented at the 12th International Symposium on Extraction Technologies (ExTech 2010). 716: 66–75. doi:10.1016/j.aca.2011.12.015. PMID 22284880.
- ^ Kulsing C, Nolvachai Y, Marriott PJ, Boysen RI, Matyska MT, Pesek JJ, Hearn MT (February 2015). "Insights into the origin of the separation selectivity with silica hydride adsorbents". The Journal of Physical Chemistry B. 119 (7): 3063–9. doi:10.1021/jp5103753. PMID 25656442.
- ^ "Chromatography: Definition, Working, and Importance in Various Industries". www.researchdive.com. Retrieved 25 February 2022.








 큰 입자에 적합합니다.HDC는 다른 유형의 크로마토그래피와 달리 분리는 충전된
큰 입자에 적합합니다.HDC는 다른 유형의 크로마토그래피와 달리 분리는 충전된 



