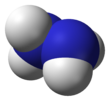
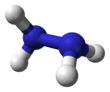
히드라진
Hydrazine
| | |||
| | |||
 하이드라진 수화물 | |||
| 이름 | |||
|---|---|---|---|
| 시스템 IUPAC 이름 히드라진[2] | |||
| 기타 이름 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 3 DMet | |||
| 878137 | |||
| 체비 | |||
| 첸블 | |||
| 켐스파이더 | |||
| ECHA 정보 카드 | 100.005.560 | ||
| EC 번호 |
| ||
| 190 | |||
| 케그 | |||
| 메쉬 | 히드라진 | ||
PubChem CID | |||
| RTECS 번호 |
| ||
| 유니 | |||
| UN 번호 | 2029 | ||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| N 2H 4 | |||
| 몰 질량 | 32.0452 g/120−1 | ||
| 외모 | 무색, 발연, 유성[3] 액체 | ||
| 냄새 | 암모니아 유사[3] | ||
| 밀도 | 1.021 g·cm−3 | ||
| 녹는점 | 2 °C, 35 °F, 275 K | ||
| 비등점 | 114°C, 237°F, 387K | ||
| 혼재[3] | |||
| 로그 P | 0.67 | ||
| 증기압 | 1kPa(30.7°C에서) | ||
| 산도(pKa) | 8.10 (N2H5+)[4] | ||
| 기본성(pKb) | 5.90 | ||
| 켤레산 | 히드라지늄 | ||
굴절률(nD) | 1.46044(22°C) | ||
| 점성 | 0.876 cP | ||
| 구조. | |||
| N의 삼각형 피라미드 | |||
| 1.85 D[5] | |||
| 열화학 | |||
표준 어금니 엔트로피 (S | 121.52 J·K−1·mol−1 | ||
표준 엔탈피/ 형성 (δHf⦵298) | 50.63 kJ/mol−1 | ||
| 위험 요소 | |||
| GHS 라벨링: | |||
     | |||
| 위험. | |||
| H226, , , , , , , , | |||
| P201, , , , , , | |||
| NFPA 704(파이어 다이아몬드) | |||
| 플래시 포인트 | 52 °C (126 °F, 325 K) | ||
| 24 ~ 270 °C (75 ~518 °F, 297 ~543 K) | |||
| 폭발 한계 | 1.8–99.99% | ||
| 치사량 또는 농도(LD, LC): | |||
LD50(중간선량) | 59~60mg/kg (쥐, 쥐의 [6]구강) | ||
LC50(중간 농도) | 260 ppm (rat, 4시간) 630ppm (rat, 1시간) 570 장/분(rat, 4시간) 252ppm (표준, 4시간)[7] | ||
| NIOSH(미국 건강 노출 제한): | |||
PEL(허용) | TWA 1ppm (1.3mg/m3) [피부][3] | ||
REL(권장) | Ca C 0.03ppm (0.04mg/m3) [2시간][3] | ||
IDLH(즉시 위험) | Ca [50ppm][3] | ||
| 안전 데이터 시트(SDS) | ICSC 0281 | ||
| 관련 화합물 | |||
기타 음이온 | 테트라플루오로히드라진 과산화수소 디포스판 이인 4요오드화물 | ||
기타 캐티온 | 유기 히드라진 | ||
관련 바이너리 아잔 | 암모니아 트리아잔 | ||
관련 화합물 | 디아젠 트리아젠 테트라젠 디포스펜 | ||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
히드라진은 화학식을 가진 무기 화합물이다. NH24. 단순한 피닉토겐 수소화물이며 암모니아와 유사한 냄새를 가진 무색 인화성 액체입니다.
히드라진은 예를 들어 히드라진 하이드레이트(NHNH22 · xHO2)와 같이 용액에서 취급하지 않는 한 독성이 강하다.2015년 [update]현재 세계 하이드라진 하이드레이트 시장은 3억 [8]5천만 달러에 달한다.히드라진은 고분자 발포제 제조에 주로 사용되지만, 중합 촉매, 의약품 및 농약의 전구체로서의 용도 및 우주선 내 추진용 장기 저장성 추진제로서의 용도도 포함한다.
2015년에는 약 200만 톤의 히드라진 하이드레이트가 발포제에 사용되었습니다.또한 히드라진은 각종 로켓 연료에 사용되며 에어백에 사용되는 가스 전구체를 제조하기 위해 사용된다.히드라진은 [9]부식을 줄이기 위해 산소 스캐빈저로 원자력 발전소 및 재래식 발전소 증기 사이클 내에서 사용됩니다.
히드라진은 히드라진 중 하나 이상의 수소 원자를 유기기로 [10]치환하여 얻은 유기 물질의 종류를 말한다.
사용하다
가스 발생기 및 추진제
히드라진은 대부분 취입제의 전조물질로 사용된다.특정 화합물로는 아조디카보나미드와 전구체 g당 100~200 mL의 가스를 생성하는 아조비시소부티로니트릴이 있다.이와 관련하여 에어백 내 가스형성제인 아지드화나트륨은 [10]아질산나트륨과 반응하여 히드라진에서 제조된다.
히드라진은 또한 케레스, 베스타로 가는 여명 미션과 같은 탑승 우주선에서 장기간 저장 가능한 추진체로 사용되며, 대형 산업용 보일러에 사용되는 물의 용존 산소 농도를 낮추고 pH를 제어하는 데에도 사용됩니다.F-16 전투기, 유로파이터 타이푼,[citation needed] 우주왕복선, U-2 정찰기는 보조 동력 [11]장치에 연료를 공급하기 위해 히드라진을 사용한다.
살충제 및 의약품의 전구체
히드라진은 몇몇 의약품과 살충제의 선구자이다.종종 이러한 애플리케이션은 히드라진을 피라졸 및 피리다진과 같은 복소환 고리로 변환하는 것을 포함한다.상용화된 생체활성 히드라진 유도체로는 세파졸린, 리자트리프탄, 아나스트로졸, 플루코나졸, 메타미트론, 메트리부진, 파클로부트라졸, 디클로부트라졸, 프로피코나졸, [12]황산히드라진, 다이미드, 트리아디메폰 [10]및 디벤조일라진 등이 있다.
히드라진 화합물은 살충제, 진드기, 네마티사이드, 살균제, 항바이러스제, 유인제, 제초제 또는 식물성장조절제 [13]등의 다른 농약과 혼합되거나 혼합되어 유효성분으로 효과적일 수 있다.
소규모, 틈새 및 연구
이탈리아 촉매 제조업체 액타(화학 회사)는 연료 전지에 수소를 대체할 수 있는 물질로 히드라진을 사용할 것을 제안했다.히드라진을 사용하는 주된 장점은 비싼 백금 [14]촉매를 사용하지 않고도 유사한 수소 전지보다 200mW/cm2 이상 더 많은 양을 생산할 수 있다는 것입니다.연료는 상온에서 액체이기 때문에 수소보다 쉽게 취급하고 저장할 수 있다.이중 결합 탄소-산소 카르보닐이 가득 찬 탱크에 히드라진을 저장함으로써 연료는 반응하여 히드라존이라는 안전 고체를 형성합니다.그 후 탱크를 온수로 플러싱함으로써 액체 하이드라진을 방출한다.히드라진은 1.56V로 수소 1.23V에 비해 기전력이 높다.히드라진은 세포 내에서 분해되어 산소와 결합하는 질소와 수소를 형성하고 [14]물을 방출한다.히드라진은 1960년대 우주 위성에 전력을 공급한 것을 포함하여 Alis-Chalmers사가 제조한 연료 전지에 사용되었다.
63%의 히드라진, 32%의 질산 히드라진, 5%의 물의 혼합물은 실험용 벌크 장전 액체 추진제 포병의 표준 추진제입니다.위의 추진제 혼합물은 가장 예측 가능하고 안정적인 것 중 하나이며, 연소 시 압력 프로파일이 평탄합니다.실화는 보통 부적절한 점화 때문에 발생합니다.잘못 점화된 후 셸의 이동은 더 큰 점화 표면적을 가진 큰 기포를 유발하며, 가스 생성 속도가 더 높으면 때로는 치명적인 튜브 고장(즉,[15] 폭발)을 포함한 매우 높은 압력을 유발합니다.1991년 1월부터 6월까지 미국 육군 연구소는 전기 열화학 추진 [15]프로그램과의 관련성을 위해 초기 벌크 장전 액체 추진제 총 프로그램의 검토를 실시했다.
미 공군(USAF)은 제너럴 다이내믹스 F-16 '파이팅 팔콘' 전투기와 록히드 U-2 '드래곤 레이디' 정찰기를 동원한 작전에 70%의 히드라진 30%의 혼합수인 H-70을 사용한다.싱글 제트 엔진 F-16은 히드라진을 이용해 비상 전력 장치(EPU)를 작동시켜 엔진 화염 발생 시 비상 전력 및 유압 전력을 공급합니다.비상 비행 제어를 제공하기 위해 EPU는 유압 또는 전력 손실이 발생할 경우 자동으로 또는 수동으로 작동합니다.단일 제트 엔진 U-2는 히드라진을 이용해 비상 시동 시스템(ESS)에 동력을 공급합니다. 비상 시동 시스템은 정지 [16]시 엔진을 재시동할 수 있는 매우 안정적인 방법을 제공합니다.
로켓 연료

히드라진은 제2차 세계대전 당시 로켓 연료의 성분으로 처음 사용되었다.메탄올 57%(독일 루프트바페에서는 M-Stoff)와 물 13%를 혼합한 것을 독일인들은 [17]C-Stoff라고 불렀다.이 혼합물은 Messerschmitt Me 163B 로켓 추진 전투기에 동력을 공급하기 위해 사용되었으며, 독일 고시험 과산화물 T-Stoff는 산화제로 사용되었다.혼합되지 않은 히드라진은 독일군에 의해 B-Stopf로 불렸으며, 나중에 V-2 [18]미사일의 에탄올/물 연료로도 사용되었다.
히드라진은 우주선 추진기의 저출력 모노로퍼로 사용되며, 우주왕복선의 보조 동력장치(APU)에 동력을 공급하는데 사용되었다.게다가, 단일 추진제인 히드라진을 연료로 하는 로켓 엔진은 종종 우주선의 말단 하강 시에 사용된다.이 엔진은 1970년대 바이킹 프로그램 착륙선뿐만 아니라 화성 착륙선 피닉스(2008년 5월), 큐리오시티(2012년 8월), 인티어런스(2021년 2월)에도 사용되었다.
위험한 성질 때문에 악마의 [19]독으로 알려진 소련의 우주 프로그램에서 히드라진과 붉은 연기를 내뿜는 질산의 혼합물이 사용되었다.
모든 히드라진 모노 추진제 엔진에서 히드라진은 표면적이 높은 알루미나(산화알루미늄)에 의해 지지된 이리듐 금속 등의 촉매 위에 통과되며, 이 촉매는 [20]다음과 같은 반응에 따라 암모니아, 질소 가스 및 수소 가스로 분해된다.
첫 번째 두 가지 반응은 매우 발열적이며(촉매 챔버는 [21]밀리초 이내에 800°C에 도달할 수 있음), 적은 양의 [22]액체에서 대량의 뜨거운 가스를 생성하므로 히드라진은 약 220초의 진공 [23]특정 임펄스를 가진 상당히 효율적인 스러스터 추진제입니다.반응 2는 가장 발열성이 높지만 반응 1보다 적은 수의 분자를 생성한다.반응 3은 흡열성이며 반응 2의 효과를 반응 1과 동일한 효과로 되돌립니다(낮은 온도, 더 많은 분자의 수).촉매 구조는 반응 3에서 분리되는 NH의3 비율에 영향을 미친다. 로켓 추진기에는 더 높은 온도가 바람직하지만, 반응이 더 많은 양의 [citation needed]가스를 생성하려는 경우에는 더 많은 분자가 바람직하다.
히드라진은 2°C 미만의 고체이기 때문에 군사용 범용 로켓 추진제로는 적합하지 않다.로켓 연료로 사용되는 다른 변형 히드라진으로는 모노메틸히드라진(CH3)NH(NH)가2 있으며, MMH(mp: -52°C)라고도 알려져 있으며, 비대칭 디메틸히드라진(CH3)2N(NH2)은 UDMH(mp: -57°C)라고도 알려져 있습니다.이러한 파생 상품 2성분형 로켓 연료로 종종 함께 이질소 4산화물, N2O4으로 사용된다.하이드라진과 unsymmetrical의 무게에 의한 합작 회사를 혼합은 타이탄 IIICBMs에 Aerozine 50으로 알려져 있어 사용되었다.[17]이러한 반응이나 소각은 또한 자연성의(가 타는 듯한 어떤 외부의 점화 없이 시작한다)발열이 있다.[24]
항공우주산업에서는 히드라진과 다른 고독성 물질을 대체하려는 노력이 계속되고 있다.유망한 대안으로는 질산히드록실암모늄, 2-디메틸아미노에틸라지드(DMAZ)[25] 및 에너지 이온성 [citation needed]액체가 있다.
직업상의 위험
건강에 미치는 영향
히드라진 노출의 잠재적 경로에는 피부, 눈, 흡입 및 [26]섭취가 포함된다.
히드라진 노출은 피부 자극/접촉 피부염 및 화상, 눈/코/목마름, 메스꺼움/욕구, 호흡곤란, 폐부종, 두통, 어지럼증, 중추신경계 우울증, 무기력, 일시 실명, 발작 및 혼수 상태를 유발할 수 있습니다.노출은 또한 간, 신장, 중추신경계에 [26][27]장기 손상을 일으킬 수 있다.히드라진은 최초 [28]노출 후 히드라진 유도체에 대한 교차감작 가능성이 있는 강한 피부감작제로 기록되었다.위에서 검토한 직업적 용도 외에도 담배 연기로 [27]인해 소량의 히드라진에 노출될 수도 있습니다.
발암물질인 히드라진에 대한 미국의 공식 지침은 엇갈리지만, 일반적으로 잠재적인 발암 효과에 대한 인식이 있다.국립산업안전보건연구소(NIOSH)는 이 물질을 "잠재적인 산업발암물질"로 분류하고 있다.NTP(National Toxicology Program)는 "인간의 발암물질로 합리적으로 예측된다"고 밝혔다.미국정부산업위생사회의(ACGIH)는 히드라진을 "A3-인간과 관련이 없는 것으로 확인된 동물 발암물질"로 등급을 매겼다.미국 환경보호청(EPA)은 이 물질을 [29]"B2(동물 연구 증거에 기초한 사람 발암 가능성 물질)"로 등급을 매긴다.
IARC(International Agency for Cancer)는 히드라진을 "2A-아마 사람에게 발암성"으로 평가하며 히드라진 노출과 폐암 [30]사이에서 양성 연관성이 관찰된다.코호트와 직업적 히드라진 피폭 단면 연구를 바탕으로, 국립과학원 위원회는 히드라진 피폭과 폐암 사이의 연관성에 대한 암시적 증거가 있으며, 다른 현장의 [31]암과의 연관성에 대한 증거는 불충분하다고 결론지었다.유럽위원회의 직업적 노출 제한에 관한 과학위원회(SCOEL)는 히드라진을 발암 물질인 "그룹 B"로 분류한다.위원회가 인용한 유전독성 메커니즘은 히드라진의 반응과 내인성 포름알데히드 및 DNA메틸화제 [32]형성을 참조한다.
NIOSH는 히드라진 노출과 관련된 응급상황이 발생할 경우 오염된 의류를 즉시 제거하고 비누와 물로 피부를 세척하며, 눈 노출을 위해 콘택트 렌즈를 제거하고 물로 눈을 씻어내는 것을 최소 15분 이상 권장한다.NIOSH는 또한 히드라진에 노출될 가능성이 있는 사람은 가능한 [26]한 빨리 치료를 받을 것을 권고한다.노출 후 검사실이나 의료 이미징 권장 사항은 없으며, 의료 검사는 증상의 유형과 심각도에 따라 달라질 수 있습니다.세계보건기구(WHO)는 잠재적 노출을 잠재적 폐 및 간 손상에 특히 주의를 기울여 증상적으로 치료할 것을 권장합니다.과거 히드라진 노출 사례는 피리독신([28]비타민 B6) 치료의 성공을 입증했다.
직업상 피폭 한계
- NIOSH 권장 노출 제한(REL): 0.03ppm (0.04mg/m3)2시간 상한[29]
- OSHA 허용 노출 한계(PEL): 1ppm(1.3mg/m3) 8시간 평균 시간[29]
- ACGIH Threshold Limit Value (TLV; 임계값 제한값): 0.01ppm (0.013mg/m3)8시간 평균 가중치[29]
히드라진의 냄새 임계값은 3.7ppm이므로 작업자가 암모니아성 냄새를 맡을 수 있다면 노출 한계를 초과할 수 있습니다.단, 이 냄새 임계값은 크게 다르므로 잠재적으로 위험한 [33]노출을 결정하는 데 사용해서는 안 된다.
항공우주 담당자를 위해 USAF는 미국 국립독물학아카데미 위원회가 개발한 긴급노출지침(SPEGL)을 사용한다.이 지침은 일반인의 비상노출지침(National Academy of Science Committience on Toxicology)에 이용되며, 이를 단기 공중긴급노출지침(SPEGL)이라고 한다.SPEGL은 직업상 피폭에 적용되지 않으며, 일반 대중의 예상치 못한 단일 단기 비상 피폭에 허용되는 피크 농도로 정의되며, 작업자의 일생 동안 드문 피폭을 나타낸다.히드라진의 경우 1시간 SPEGL은 2ppm,[34] 24시간 SPEGL은 0.08ppm입니다.
취급 및 의료 감시
히드라진에 대한 완전한 감시 프로그램에는 생물학적 모니터링, 의료 스크리닝 및 질병/사망 정보의 체계적인 분석이 포함되어야 한다.CDC는 감독자와 근로자를 위해 감시 요약과 교육을 제공할 것을 권고한다.사전 배치 및 정기적인 의학 검사는 눈, 피부, 간, 신장, 조혈,[26] 신경 및 호흡 시스템의 기능에 대한 히드라진의 잠재적 영향에 초점을 맞춰 실시해야 한다.
히드라진에 사용되는 공통 제어 장치에는 프로세스 인클로저, 국소 배기 가스 환기 및 개인 보호 장비(PPE)[26]가 포함됩니다.히드라진 PPE에 대한 지침은 비투과성 장갑과 의류, 간접 환기 비산 방지 고글, 페이스 실드 및 경우에 따라서는 [33]인공호흡기를 포함한다.히드라진 처리를 위한 인공호흡기 사용은 작업자 노출을 제어하는 마지막 수단이 되어야 한다.호흡기가 필요한 경우 적절한 호흡기를 선택하고 OSHA 지침에 부합하는 완전한 호흡 보호 프로그램을 구현해야 [26]한다.
USAF 요원의 경우, 공군 직업안전보건(AFOSH) 표준 48-8, 부가자료 8은 미사일, 항공기 및 우주선 시스템에서 히드라진에 대한 직업상 피폭에 대한 고려사항을 검토한다.노출 대응에 대한 구체적인 지침에는 필수 비상 샤워 및 세안소 및 보호복 오염 제거 프로세스가 포함된다.또한 이 지침은 적절한 PPE, 직원 교육, 의료 감시 및 비상 [34]대응에 대한 책임과 요건을 부여한다.히드라진 사용이 필요한 USAF 기지는 일반적으로 안전한 히드라진 사용과 비상 대응을 위한 현지 요건을 관리하는 특정 기본 규정을 가지고 있다.
분자 구조
각 HN-N2 서브유닛은 피라미드형이다.N-N 단일 결합 거리는 1.45Ω(145pm)이며, 분자는 고슈 배열을 [35]채택한다.회전 장벽은 에탄보다 두 배나 높습니다.이러한 구조적 특성은 과산화수소 가스의 특성과 유사하며, 이는 "스퀴드" 반사슬리너 구조를 채택하며 강력한 회전 장벽을 경험합니다.
합성 및 생산
다양한 루트가 [10]개발되었습니다.핵심 단계는 질소-질소 단일 결합의 생성이다.많은 경로는 염소 산화제를 사용하는 경로와 사용하지 않는 경로로 나눌 수 있습니다.
과산화물로부터의 옥사지리딘을 통한 암모니아 산화
히드라진은 과산화수소 및 암모니아로부터 케톤 촉매(페키네-우긴-쿨만 과정이라고도 함)로 합성될 수 있다.PCUK 사이클 또는 케타진 프로세스).[10]순반응은 다음과 같습니다.[36]
이 경로에서 케톤과 암모니아는 먼저 응축하여 옥사지리딘에 과산화수소에 의해 산화되는 이민을 탄소, 산소 및 질소를 포함한 3원 고리인 옥사지리딘으로 만든다.다음으로 옥사지리딘은 암모니아 처리를 통해 히드라존을 부여하고, 이 과정에서 질소-질소 단결합을 생성한다.이 히드라존은 케톤을 하나 더 응축시켜요
생성된 아진은 가수분해되어 히드라진을 생성하고 케톤인 메틸에틸케톤을 재생합니다.
대부분의 다른 공정과 달리, 이 접근법은 소금을 부산물로 [37]생산하지 않는다.
염소계 산화
1907년에 처음 발표된 올린 라시그 공정은 케톤 촉매를 사용하지 않고 차아염소산나트륨(많은 표백제의 활성 성분)과 암모니아로부터 히드라진을 생산합니다.이 방법은 모노클로로민과 암모니아를 반응시켜 질소-질소 단일 결합과 염화수소 [12]부산물을 생성한다.
Raschig 공정과 관련하여 암모니아 대신 요소가 산화될 수 있습니다.다시 차아염소산나트륨이 산화제 역할을 한다.순반응은 [38]다음과 같습니다.
이 과정은 상당한 부산물을 생성하며 주로 아시아에서 [10]시행됩니다.
Bayer Ketazine 공정은 과산화물 공정의 전신이다.과산화수소 대신 차아염소산나트륨을 산화제로 사용한다.모든 차아염소산염 기반 경로와 마찬가지로, 이 방법은 히드라진 [10]당량에 대해 소금 등가물을 생성한다.
반응
산염기 거동
히드라진은 무수물보다 밀도가 높은 일수화물(1.032g/cm3)을 형성한다.히드라진은 [39]암모니아에 버금가는 기본적인 (알칼리) 화학적 성질을 가지고 있습니다.
( × - K_}= 105})의
디프로토네이트는 [40]어렵습니다.
레독스 반응
이상적으로는 산소에서 히드라진이 연소하면 질소와 물이 생성됩니다.
산소가 과다하면 일산화질소와 이산화질소를 포함한 질소산화물이 생성됩니다.
산소(공기)에서 히드라진의 연소 열은 19.41 MJ/kg(8345 BTU/lb)[41]입니다.
히드라진은 부산물이 전형적으로 질소 가스와 물이기 때문에 편리한 환원제입니다.이 성질은 온수 보일러 및 난방 시스템의 항산화제, 산소 소거제 및 부식 방지제로 유용합니다.또한 무전해 니켈 도금 및 원자로 폐기물에서 플루토늄 추출을 통해 금속 염분과 산화물을 순수한 금속으로 환원하는 데도 사용됩니다.일부 컬러 사진 공정에서는 염료 커플러와 반응하지 않은 할로겐화은을 소거하기 때문에 안정 세척제로 히드라진의 약한 용액을 사용합니다.히드라진은 열수처리를 [42]통해 그래핀 산화물(GO)을 환원 그래핀 산화물(rGO)로 전환하는 데 사용되는 가장 흔하고 효과적인 환원제이다.
히드라지늄염
히드라진은 미네랄산으로 처리함으로써 모노프로톤화되어 히드라지늄 양이온(NH25+)의 다양한 고체염을 형성할 수 있다.일반적인25 소금은 [43]황산히드라진이라고도 불리는 황산히드라진, [NH4]HSO입니다.황산히드라진(Hydrazine sulfate)은 암으로 인한 악액증 치료제로 조사되었으나 효과가 [44]없는 것으로 판명되었다.
이중 양성자화는 다양한 염류가 [45]알려진 히드라지늄 디케이션(HNNH)을332+ 제공한다.
유기화학
히드라진은 많은 유기 합성물의 일부이며, 종종 의약품(용도 섹션 참조), 섬유 염료 및 [10]사진 분야에서 실용적으로 중요하다.
히드라진은 히드라존 중간체를 통해 케톤의 카르보닐기를 메틸렌 브릿지(또는 알데히드기를 메틸기로 변환하는 반응)인 볼프-키슈너 환원에 사용된다.히드라진 유도체로부터 매우 안정적인 디니트로겐을 생산하는 것은 반응을 촉진하는 데 도움을 준다.
2개의 아민을 가진 2관능성 히드라진은 다양한 이관능성 전자 친위체와의 축합을 통해 많은 복소환 화합물을 제조하기 위한 핵심 구성 요소이다.2,4-펜탄디온을 사용하면 3,5-디메틸피라졸이 [46]응축됩니다.아인혼-브러너 반응에서 히드라진은 이미드와 반응하여 트리아졸을 생성한다.
좋은 친핵성 물질인 NH는24 살포닐 할로겐화물과 아실 [47]할로겐화물을 공격할 수 있다.토실히드라진은 또한 카르보닐로 처리될 때 히드라존을 형성한다.
히드라진은 N-알킬화 프탈리미드 유도체를 분해하는 데 사용된다.이 스크리션 반응은 프탈이미드 음이온을 가브리엘 [48]합성에서 아민 전구체로 사용할 수 있게 한다.
히드라존 생성
단순 카르보닐에 의한 히드라진의 축합 예로는 디이소프로필리덴히드라진(아세톤아진)을 얻기 위한 프로파논과의 반응을 들 수 있다.후자는 히드라진과 더 반응하여 히드라존을 [49]생성한다.
프로파논 아진은 아토피나-PCUK 과정의 중간체이다.염기가 존재하는 상태에서 할로겐화 알킬과 히드라진을 직접 알킬화하면 알킬 치환 히드라진이 생성되지만, 치환 수준의 제어가 잘 되지 않아 반응이 비효율적이다(일반 아민과 동일).히드라존을 히드라진으로 환원하는 것은 1,1-다이알킬화 히드라진을 생산하는 깨끗한 방법이다.
관련 반응에서 2-시아노피리딘은 히드라진과 반응하여 아미드 하이드라지드를 형성하고, 이는 1,2-디케톤을 사용하여 트리아진으로 전환될 수 있다.
생화학
히드라진은 암모니아([50]아나목스) 과정의 혐기성 산화의 중간체이다.그것은 일부 효모와 외양 세균인 아나목스(Brocadia anamoxidans)[51]에 의해 생산된다.가짜 모렐은 대사 과정에 의해 모노메틸히드라진으로 전환되는 히드라진의 유기 유도체인 독가이로미트린을 생성한다.가장 인기 있는 식용버섯인 아가리쿠스 비스포러스도 아미노산의 히드라진 유도체인 아가리틴과 자이로미트린을 [52][53]포함한 유기 히드라진 유도체를 생산한다.
역사
"히드라진"이라는 이름은 에밀 피셔에 의해 1875년에 만들어졌다; 그는 단일 치환 히드라진으로 [54]구성된 유기 화합물을 생산하려고 시도하고 있었다.1887년까지, 테오도르 커티우스는 유기 디아지드를 희황산으로 처리함으로써 황산 히드라진을 생산했지만, 반복적인 [55][56][57]노력에도 불구하고 순수한 히드라진을 얻을 수 없었다.순수 무수 히드라진은 [58][59][60]1895년 네덜란드의 화학자 로브리 드 브윈에 의해 처음 제조되었다.
「 」를 참조해 주세요.
- 다이미드 – 화합물:H–N=N–H
- 황산 히드라진
- 스토프 목록 – 제2차 세계대전 독일 연료 및 산화제 코드
- 아산화질소 연료 혼합 – 액체 로켓 추진제 등급
- USA-193 – 군사 위성
레퍼런스
- ^ "NIOSH Guide—Hydrazine". Centers for Disease Control. Retrieved 16 Aug 2012.
- ^ a b "hydrazine—PubChem Public Chemical Database". The PubChem Project. USA: National Center for Biotechnology Information.
- ^ a b c d e f NIOSH Pocket Guide to Chemical Hazards. "#0329". National Institute for Occupational Safety and Health (NIOSH).
- ^ Hall HK, et al. (1957). "Correlation of the Base Strengths of Amines1". J. Am. Chem. Soc. 79 (20): 5441. doi:10.1021/ja01577a030.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Martel B, Cassidy K, et al. (2004). Chemical Risk Analysis: A Practical Handbook. Amsterdam: Butterworth–Heinemann. p. 361. ISBN 9781903996652. OCLC 939257974.
- ^ "Hydrazine". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ "Hydrazine Hydrate Market Size—Industry Share Report 2024". www.gminsights.com.
- ^ Tsubakizaki S, Takada M, Gotou H, et al. (2009). "Alternatives to Hydrazine in Water Treatment at Thermal Power Plants" (PDF). Mitsubishi Heavy Industries Technical Review. 6 (2): 43–47.
- ^ a b c d e f g h Schirmann, Jean-Pierre; Bourdauducq, Paul (2001). "Hydrazine". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a13_177.
- ^ Suggs, HJ; Luskus, LJ; Kilian, HJ; Mokry, JW (1979). "Exhaust Gas Composition of the F-16 Emergency Power Unit" (technical report). USAF. SAM-TR-79-2. Archived from the original on 4 March 2016. Retrieved 23 Jan 2019.
- ^ a b Adams R, Brown BK (1922). "Hydrazine Sulfate". Org. Synth. 2: 37. doi:10.15227/orgsyn.002.0037.
- ^ Toki, T; Koyanagi, T; Yoshida, K; et al. (1994). "Hydrazine compounds useful as pesticides" (US patent). Ishihara Sangyo Kaisha Ltd (original assignee). US5304657A.
- ^ a b "Liquid asset". The Engineer. Centaur Media plc. 15 Jan 2008. Retrieved 23 Jan 2019.
- ^ a b Knapton, JD; Stobie, IC; Elmore, L (Mar 1993). "A Review of the Bulk-Loaded Liquid Propellant Gun Program for Possible Relevance to the Electrothermal Chemical Propulsion Program" (PDF). Army Research Laboratory. ADA263143. Archived (PDF) from the original on March 7, 2020.
- ^ "Ground Servicing of Aircraft and Static Grounding/Bonding" (PDF). USAF (technical manual). 13 Mar 2017. TO 00-25-172. Retrieved 23 Nov 2018.
- ^ a b Clark JD (1972). Ignition! An Informal History of Liquid Rocket Propellants (PDF). New Brunswick, New Jersey: Rutgers University Press. p. 13 37 39. ISBN 978-0-8135-0725-5.
- ^ T. W. Price; D. D. Evans. Technical Report 32-7227 The Status of Monopropellant Hydrazine Technology (PDF) (Report). National Aeronautics and Space Administration (NASA). p. 1. Retrieved 22 February 2022.
- ^ "The Nedelin Catastrophe, Part 1". 28 October 2014. Archived from the original on 15 February 2022. Retrieved 15 February 2022.
- ^ Haws JL, Harden DG (1965). "Thermodynamic Properties of Hydrazine". Journal of Spacecraft and Rockets. 2 (6): 972–974. Bibcode:1965JSpRo...2..972H. doi:10.2514/3.28327.
- ^ Vieira R, Pham-Huu C, Kellera N, et al. (2002). "New carbon nanofiber/graphite felt composite for use as a catalyst support for hydrazine catalytic decomposition". Chem. Comm. 44 (9): 954–955. doi:10.1039/b202032g. PMID 12123065.
- ^ Chen X, Zhang T, Xia L, et al. (Apr 2002). "Catalytic Decomposition of Hydrazine over Supported Molybdenum Nitride Catalysts in a Monopropellant Thruster". Catal. Lett. 79: 21–25. doi:10.1023/A:1015343922044. S2CID 92094908.
- ^ "BIG-IP logout page". www.eso-io.com. Archived from the original on June 23, 2008. Retrieved May 20, 2020.
- ^ Mitchell MC, Rakoff RW, Jobe TO, et al. (2007). "Thermodynamic analysis of equations of state for the monopropellant hydrazine". Journal of Thermophysics and Heat Transfer. 21 (1): 243–246. doi:10.2514/1.22798.
- ^ Heister, S (28 Sep 2004). "Rocket Propellant Development Efforts at Purdue University" (slideshow presentation). World Wide Energy Conference. Retrieved 21 Apr 2013.
- ^ a b c d e f "Occupational Safety and Health Guideline for Hydrazine—Potential Human Carcinogen" (PDF). NIOSH. 1988. Retrieved 23 Nov 2018.
- ^ a b "Hydrazine 302-01-2" (PDF). US EPA. Retrieved 23 Nov 2018.
- ^ a b "International Programme on Chemical Safety—Health and Safety Guide No. 56—Hydrazine". IPCS INCHEM. Geneva: WHO. 1991. Retrieved 24 Nov 2018.
- ^ a b c d "Occupational Chemical Database—Hydrazine". www.osha.gov. OSHA. Retrieved 24 Nov 2018.
- ^ "Hydrazine" (PDF). IARC. Jun 2018. Retrieved 23 Nov 2018.
- ^ Institute of Medicine (2005). "Ch. 9: Hydrazines and Nitric Acid". Gulf War and Health: Fuels, Combustion Products, and Propellants. Vol. 3. Washington, DC: The National Academies Press. p. 347. doi:10.17226/11180. ISBN 9780309095273.
- ^ "Recommendation from the Scientific Committee on Occupational Exposure Limits for Hydrazine" (PDF). European Commission. Aug 2010. Retrieved 23 Nov 2018.
- ^ a b "Hazardous Substance Fact Sheet—Hydrazine" (PDF). New Jersey Department of Public Health. Nov 2009. Retrieved 23 Nov 2018.
- ^ a b "Air Force Occupational Safety and Health (AFOSH) Standard 48-8" (PDF). USAF. 1 Sep 1997. Retrieved 23 Nov 2018.
- ^ Miessler GL, Tarr DA (2004). Inorganic Chemistry (3rd ed.). Pearson Prentice Hall. ISBN 9780130354716.
- ^ Matar S, Hatch LF (2001). Chemistry of Petrochemical Processes (2nd ed.). Burlington: Gulf Professional Publishing. p. 148. ISBN 9781493303465. OCLC 990470096 – via Elsevier.
- ^ Riegel ER, Kent JA (2003). "Hydrazine". Riegel's handbook of industrial chemistry (10th ed.). New York: Springer Science & Business Media. p. 192. ISBN 9780306474118. OCLC 55023601.
- ^ "Hydrazine: Chemical product info". chemindustry.ru. Archived from the original on 22 January 2018. Retrieved 8 Jan 2007.
- ^ Handbook of Chemistry and Physics (83rd ed.). CRC Press. 2002.
- ^ Holleman AF, Wiberg E, Wiberg N (2001). Inorganic chemistry (1st Eng. ed.). San Diego: Academic Press. ISBN 9780123526519. OCLC 813400418.
- ^ "Hydrazine—Chemical Hazard Properties Table" (PDF). NOAA.gov. 1999.
- ^ Stankovich S, Dikin DA, Piner RD, et al. (2007). "Synthesis of graphene-based nanosheets via chemical reduction of exfoliated graphite oxide". Carbon. 45 (7): 1558–1565. doi:10.1016/j.carbon.2007.02.034.
- ^ "HYDRAZINE SULFATE". hazard.com. Retrieved 22 Jan 2019.
- ^ Gagnon B, Bruera E (May 1998). "A review of the drug treatment of cachexia associated with cancer". Drugs. 55 (5): 675–88. doi:10.2165/00003495-199855050-00005. PMID 9585863. S2CID 22180434.
- ^ "Diazanediium". CharChem. Retrieved 22 Jan 2019.
- ^ Wiley RH, Hexner PE (1951). "3,5-Dimethylpyrazole". Org. Synth. 31: 43. doi:10.15227/orgsyn.031.0043.
- ^ Friedman L, Litle RL, Reichle WR (1960). "p-Toluenesulfonyl Hydrazide". Org. Synth. 40: 93. doi:10.15227/orgsyn.040.0093.
- ^ Weinshenker NM, Shen CM, Wong JY (1977). "Polymeric Carbodiimide. Preparation". Org. Synth. 56: 95. doi:10.15227/orgsyn.056.0095.
- ^ Day AC, Whiting MC (1970). "Acetone Hydrazone". Organic Syntheses. 50: 3. doi:10.15227/orgsyn.050.0003.
- ^ Strous M, Jetten MS (2004). "Anaerobic Oxidation of Methane and Ammonium". Annu Rev Microbiol. 58: 99–117. doi:10.1146/annurev.micro.58.030603.123605. PMID 15487931.
- ^ Handwerk, Brian (9 Nov 2005). "Bacteria Eat Human Sewage, Produce Rocket Fuel". National Geographic. Retrieved 12 Nov 2007 – via Wild Singapore.
- ^ Hashida C, Hayashi K, Jie L, et al. (1990). "[Quantities of agaritine in mushrooms (Agaricus bisporus) and the carcinogenicity of mushroom methanol extracts on the mouse bladder epithelium]". Nippon Koshu Eisei Zasshi (in Japanese). 37 (6): 400–5. PMID 2132000.
- ^ Sieger AA, ed. (1 Jan 1998). "Spore Prints #338". Bulletin of the Puget Sound Mycological Society. Retrieved 13 Oct 2008.
- ^ Fischer E (1875). "Ueber aromatische Hydrazinverbindungen" [On aromatic hydrazine compounds]. Ber. Dtsch. Chem. Ges. 8: 589–594. doi:10.1002/cber.187500801178.
- ^ Curtius T (1887). "Ueber das Diamid (Hydrazin)" [On diamide (hydrazine)]. Ber. Dtsch. Chem. Ges. 20: 1632–1634. doi:10.1002/cber.188702001368.
- ^ Curtius T, Jay R (1889). "Diazo- und Azoverbindungen der Fettreihe. IV. Abhandlung. Ueber das Hydrazin" [Diazo- and azo- compounds of alkanes. Fourth treatise. On hydrazine.]. In Erdmann OL (ed.). Journal für praktische Chemie. Vol. 147. Verlag von Johann Ambrosius Barth. On p. 129, Curtius admits: "Das freie Diamid NH2-NH2 ist noch nicht analysirt worden." [Free hydrazine hasn't been analyzed yet.]
{{cite book}}: CS1 유지보수: 포스트스크립트(링크) - ^ Curtius T, Schulz H (1890). "Ueber Hydrazinehydrat und die Halogenverbindungen des Diammoniums" [On hydrazine hydrate and the halogen compounds of diammonium]. Journal für praktische Chemie. Vol. 150. pp. 521–549.
- ^ Lobry de Bruyn CA (2010). "Sur l'hydrazine (diamide) libre" [On free hydrazine (diamide)]. Recl. Trav. Chim. Pays-Bas. 13 (8): 433–440. doi:10.1002/recl.18940130816.
- ^ Lobry de Bruyn CA (1895). "Sur l'hydrate d'hydrazine" [On the hydrate of hydrazine]. Recl. Trav. Chim. Pays-Bas. 14 (3): 85–88. doi:10.1002/recl.18950140302.
- ^ Lobry de Bruyn CA (1896). "L'hydrazine libre I" [Free hydrazine, Part 1]. Recl. Trav. Chim. Pays-Bas. 15 (6): 174–184. doi:10.1002/recl.18960150606.











![{\displaystyle {\ce {N2H4 + H2O -> [N2H5]^+ + OH-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ef02d7cc8519ded31bae36408d7f1461c64195b7)


![{\displaystyle {\ce {[N2H5]+ + H2O -> [N2H6]^2+ + OH-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/58d05df88d00c82f17bb6b59cf2a7d07696dc980)




![{\displaystyle {\ce {2 (CH3)2CO + N2H4 -> 2 H2O + [(CH3)2C=N]2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8036d601adcf4a13ee6b912eb05bc55994ab952a)
![{\displaystyle {\ce {[(CH3)2C=N]2 + N2H4 -> 2 (CH3)2C=NNH2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/183b956f5ae1e22d5ada6e751b42ace50f85e25d)


