리보시클리브
Ribociclib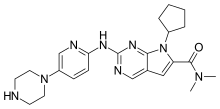 | |
| 임상 데이터 | |
|---|---|
| 상호 | 키스칼리 |
| 기타 이름 | LE 011 |
| AHFS/Drugs.com | 모노그래프 |
| Medline Plus | a617008 |
| 라이선스 데이터 |
|
| 루트 행정부. | 입으로 (태블릿) |
| ATC 코드 | |
| 법적 상태 | |
| 법적 상태 | |
| 약동학 데이터 | |
| 바이오 어베이러빌리티 | 알 수 없는 |
| 단백질 결합 | ~70% |
| 대사 | 간(CYP3A4) |
| 반감기 제거 | 32.0 (29.7 ~54.7)시간 |
| 배설물 | 대변 69%, 소변 23% |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 첸블 | |
| ECHA 정보 카드 | 100.234.566 |
| 화학 및 물리 데이터 | |
| 공식 | C23H30N8O |
| 몰 질량 | 434.548 g/120−1 |
| 3D 모델(JSmol) | |
| |
| |
Ribociclib은 [2][3]Kisqali와 Kryxana라는 브랜드명으로 판매되며 사이클린 D1/CDK4와 CDK6의 억제제로 특정 종류의 유방암 [4]치료에 사용된다.리보시클리브는 호르몬 수용체(HR) 양성, 인간 표피 성장인자 수용체(HER2) 음성 진행 또는 전이성 유방암을 가진 폐경 전/페리머 또는 폐경 후 여성의 치료를 위한 아로마타아제 억제제와 조합하여 나타나는 키나제 억제제이다.초기 내분비 기반 치료법으로서 또는 내분비 [5]치료에 대한 질병 진행을 따르는 HR 양성, HER2 음성 진행 유방암을 가진 폐경 후 여성의 nt.그것은 또한 다른 내약품성 [6]암의 치료제로도 연구되고 있다.그것은 노바티스와 아스텍스 [7]제약에 의해 개발되었다.Ribociclib은 현재 갱년기 상태 또는 치료 [8][unreliable medical source?]라인에 관계없이 서로 다른 내분비 치료 파트너와 함께 MONALEESA 임상 프로그램의 3단계 III 모두에서 전반적인 생존에 대한 검증된 이점을 가진 유일한 CDK4/6 억제제이다.유럽의료종양학회(ESMO)는 키스칼리에게 '[9][failed verification]임상 유익성 척도'에서 가장 높은 점수를 부여했다.
의료 용도
리보시클리브는 2017년 [10]3월 미국 식품의약국(FDA)의 승인을 받았다.2017년 [11]8월에 유럽 의약품청(EMA)에 의해 승인되었다.2021년 [2][12]2월에 NICE에 의해 NHS에서 사용이 승인되었다.HR 양성,[10][11][13] HER2 음성 진행 또는 전이성 유방암을 치료하기 위해 방향분해효소 억제제(예: 레트로졸)와 함께 사용할 수 있다.
의약품 승인과 관련된 임상시험에서 리보시클리브는 암이 악화되지 않은 기간인 무진행 생존(PFS)을 유의하게 개선했다.플라시보 플러스 레트로졸을 투여받은 환자의 경우, PFS는 평균 16개월이었고, 리보시클리브 플러스 레트로졸의 경우 2017년 1월 [11]분석 기준 PFS는 25개월이었다.이 연구는 2020년 [14]9월까지 진행될 예정이다.
부작용
연구에서 가장 일반적인 부작용은 혈구 수 감소, 주로 호중구 감소(위약 하에서 5%에 비해 환자의 75%)였지만 빈혈(18% 대 5%)도 있었다.위장 장애도 흔한데, 예를 들어 메스꺼움(52% 대 29%)과 설사(35% 대 22%)는 탈모증(33% 대 16%)과 같았다.이 약은 또한 QT 간격과 간 효소(알라닌 트랜스아미나아제, 아스파르트산 트랜스아미나아제)[4][11]를 증가시킨다.
상호 작용
리보시크립은 주로 간 효소 CYP3A4에 의해 대사되기 때문에 리보시크립의 억제제는 체내 농도를 증가시켜 부작용과 독성을 증강시킬 수 있다.이러한 억제제의 예로는 케토코나졸 및 유사한 항진균제, 리토나비르, 클라리트로마이신 및 자몽이 있다.반대로 리팜피신과 세인트존스워트와 같이 CYP3A4를 유도하는 약물은 리보시클리브 [4][11]농도를 낮출 수 있다.
리보시크립 자체는 중간에서 강한 CYP3A4 억제제이므로 미다졸람에서 보여지듯이 이 대사를 공유하는 다른 약물의 농도를 증가시킬 수 있다.그것은 또한 많은 운반체 단백질을 억제하고 따라서 이론적으로 체내 다른 약물의 운반을 방해할 수 있다.그것은 또한 항부정맥제, 클라리트로마이신, 할로페리돌과 [4][11]같은 다른 약물의 QT 연장을 증폭시킬 수 있다.
약리학
작용 메커니즘
사이클린 의존성 키나아제(CDKs) 4와 6은 정상 세포와 암 세포 모두에서 세포 분열과 증식을 촉진하는 것으로 나타난 효소이다.많은 암세포가 CDK의 활성을 증가시켜 특정 종양 억제 유전자의 [6][15]불활성화를 초래하는 이상을 보여 왔다.
리보시크립은 ALK, MEK 억제제 등 다른 약물과 병용하면 상승 효과가 있어 반응이 [16][17]개선되는 것으로 나타났다.이것은, 시그널링 패스간의 「크로스톡」의 결과일 가능성이 있습니다.단순히 암 종양 발생의 한 경로를 차단하는 것은 때때로 종양이 생존하기 위한 다른 경로를 이용하여 막힌 신호 경로를 보상하는 "종양 보상"을 초래할 수 있다.동시에 여러 경로를 차단함으로써 종양이 보상 능력이 떨어진다고 생각되며, 종종 더 큰 항종양 반응이 관찰된다.리보시크립을 다른 약제와 함께 사용하면 이러한 [6]약제에 대한 내성의 발달을 줄일 수 있는 것으로 나타났다.즉, 리보시리브를 치료제에 첨가함으로써 암의 약물 내성 발달을 완화할 수 있다.
약동학
장에 흡수되는 리보시크립의 비율은 아직 정해지지 않았다.혈장 농도는 1시간에서 4시간 후에 최고치에 이르며, 반복 투여 후에는 약 8일 후에 정상 농도에 도달한다.음식 섭취는 흡수율에 영향을 미치지 않는다.혈류에서 리보시크립의 약 70%는 혈장 [4][11]단백질과 결합한다.
이 물질은 주로 CYP3A4에 의해 대사되며, 그 후 다양한 II상 효소에 의해 대사되어 많은 대사물이 생성된다.사람의 혈장 농도가 가장 높은 것을 CCI284(불특정 N-히드록실화 생성물), LEQ803(N-탈메틸화 생성물), M1(글루쿠로니드)이라고 한다.모든 대사물은 무시해도 될 정도의 임상 [4][11]활동을 가지고 있다.
리보시클리브는 체내에 약간 축적되는 경향이 있습니다.평균 생물학적 반감기는 32시간이며 대부분 대변을 통해(69%) 제거되지만 소변을 통해(23%) 제거된다.변하지 않은 약물은 대변 속 물질의 17%, 소변 속 물질의 12%를 차지하며 나머지는 대사물이다.[4][11]
조사.
이 섹션은 업데이트해야 합니다.(2020년 7월) |
2017년 9월[update] 현재 리보시클리브는 지방육종,[18] 자궁내막암[19], [20]전두엽 신경내분비종양 등 여러 징후를 위해 II상 개발 중에 있다.
화학
리보시클리브는 주석산염의 형태로 사용된다.약간 흡습성이 있는 노란색에서 갈색 결정성 분말로, [21]수산에 용해됩니다.
「 」를 참조해 주세요.
- 유사한 메커니즘과 징후를 가진 약물인 Palbociclib
레퍼런스
- ^ "Search Page - Drug and Health Product Register". 23 October 2014.
- ^ a b "Thousands of breast cancer patients to have routine access to NICE-approved drug combination News and features News". NICE. Retrieved 2021-03-08.
- ^ "KRYXANA Price in India Buy Generic Ribociclib Drugs To treat Breast Cancer Available in USA UK Vietnam, Philippines Ireland". cancermedicinesnetwork.com. Retrieved 2021-08-24.
- ^ a b c d e f g FDA의 Kisqali에 대한 전문 의약품 정보입니다.2017-09-08에 접속.
- ^ "KISQALI® (ribociclib) Treatment: HR+/HER2- mBC HCP". www.hcp.novartis.com. Retrieved 2021-08-24.
- ^ a b c Samson K (2014). "LEE011 CDK Inhibitor Showing Early Promise in Drug-Resistant Cancers". Oncology Times. 36 (3): 39–40. doi:10.1097/01.COT.0000444043.33304.c1.
- ^ "Novartis LEE011 (ribociclib) granted FDA Priority Review for first-line treatment of HR+/HER2- advanced breast cancer". Novartis. 2016-11-01.
- ^ "Novartis presents new Kisqali® data showing longest median overall survival ever reported in HR+/HER2- advanced breast cancer". Novartis. Retrieved 2021-10-19.
- ^ ESMO. "ESMO-Magnitude of Clinical Benefit Scale". www.esmo.org. Retrieved 2021-10-19.
- ^ a b FDA, 노바티스 키스칼리 유방암 복합치료 승인2017년 3월
- ^ a b c d e f g h i "Kisqali: EPAR – Product Information" (PDF). European Medicines Agency. 2017-08-31.
- ^ "Life-extending drug for incurable breast cancer approved for NHS use". the Guardian. 2021-02-26. Retrieved 2021-03-08.
- ^ "Ribociclib (Kisqali) Cancer information Cancer Research UK". www.cancerresearchuk.org. Retrieved 2021-03-08.
- ^ 임상시험번호 NCT01958021 '폐경 후 유방암 여성에 대한 LE011의 효능과 안전성 연구'(MONALEESA-2)" (ClinicalTrials.gov )
- ^ Kim S, Loo A, Chopra R, Caponigro G, Huang A, Vora S, et al. (2014). "Abstract PR02: LEE011: An orally bioavailable, selective small molecule inhibitor of CDK4/6- Reactivating Rb in cancer". Molecular Cancer Therapeutics. 12 (11_Supplement): PR02. doi:10.1158/1535-7163.TARG-13-PR02.
- ^ Sosman JA, Kittaneh M, Lolkema MP, Postow MA, Schwartz G, Franklin C, et al. (2014). "A phase 1b/2 study of LEE011 in combination with binimetinib (MEK162) in patients with NRAS-mutant melanoma: Early encouraging clinical activity". Journal of Clinical Oncology. 32 (15 Suppl): 9009. doi:10.1200/jco.2014.32.15_suppl.9009.
- ^ Wood AC, Krytska K, Ryles H, Sano R, Li N, King F, et al. (2014). "Abstract 1000: Combination CDK4/6 and ALK inhibition demonstrates on-target synergy against neuroblastoma". Cancer Research. 74 (19 Supplement): 1000. doi:10.1158/1538-7445.AM2014-1000.
- ^ 임상시험번호 NCT03096912 '진행우물/분화지방육종 환자의 리보시클리브 효과 및 안전성 평가 연구' : ClinicalTrials.gov
- ^ 임상시험번호 NCT03008408 "진행 또는 재발 자궁내막암 환자의 Ribociclib (LEE011), Everolimus, Letrozole 연구" (ClinicalTrials.gov )
- ^ 임상시험번호 NCT02420691 "전두엽 유래 신경내분비종양의 LE011" (ClinicalTrials.gov )
- ^ "Kisqali: EPAR – Public assessment report" (PDF). European Medicines Agency. 2017-08-31.
외부 링크
- "Ribociclib". Drug Information Portal. U.S. National Library of Medicine.
- "Ribociclib succinate". Drug Information Portal. U.S. National Library of Medicine.


