방사선 치료
Radiation therapy| 방사선 치료 | |
|---|---|
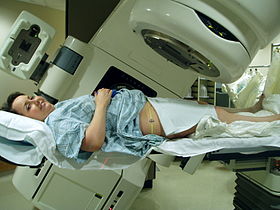 Varian Clinac iX 선형 가속기를 사용한 골반 방사선 치료.정확한 위치를 결정하기 위해 레이저와 다리 밑에 있는 곰팡이를 사용합니다. | |
| ICD-10-PCS | D |
| ICD-9-CM | 92.2~92.3 |
| 메쉬 | D011878 |
| OPS-301 코드 | 8–52 |
| Medline Plus | 001918 |
방사선 치료 또는 방사선 치료(RT, RTx 또는 XRT)는 이온화 방사선을 이용한 치료로, 일반적으로 악성 세포를 제어하거나 죽이는 암 치료의 일부로 제공되며 일반적으로 선형 가속기에 의해 전달된다.방사선 치료는 신체의 한 부위에 국한되면 여러 종류의 암을 치료할 수 있다.또한 원발성 악성 종양(예: 유방암 초기)을 제거하는 수술 후 종양 재발을 방지하기 위해 보조 요법의 일부로 사용될 수 있습니다.방사선 치료는 화학요법과 상승작용이 있으며, 화학요법 전, 화학요법 중, 화학요법 후 감수성 암에서 사용되어 왔다.방사선 치료와 관련된 종양학의 하위 전문을 방사선 종양학이라고 한다.이 하위 전문분야에서 개업하는 의사는 방사선 종양학자이다.
방사선 치료는 세포 성장을 조절하는 능력 때문에 일반적으로 암 종양에 적용된다.이온화 방사선은 세포사망으로 이어지는 암 조직의 DNA를 손상시킴으로써 작용한다.정상 조직(종양을 치료하기 위해 방사선이 통과해야 하는 피부 또는 장기 등)을 보호하기 위해, 형태 방사선 빔은 여러 노출 각도에서 종양을 교차하도록 조준되어 주변 건강한 조직보다 훨씬 더 큰 흡수 선량을 제공한다.종양 자체 외에도, 방사선장이 종양에 임상적으로 또는 방사선학적으로 관여하거나, 또는 잠재의식 악성 확산의 위험이 있다고 생각되는 경우, 방사선장은 또한 배수 림프절을 포함할 수 있다.일상적인 설정 및 내부 종양 움직임에 불확실성을 허용하기 위해 종양 주위에 정상 조직의 여백을 포함할 필요가 있습니다.이러한 불확실성은 내부 움직임(예: 호흡 및 방광 채우기)과 종양 위치에 상대적인 외부 피부 표시의 움직임으로 인해 발생할 수 있습니다.
방사선 종양학은 방사선 처방에 관련된 의학 전문 분야로 방사선학, 의료 영상 및 진단에서의 방사선 사용과는 다릅니다.방사선은 치료("치료") 또는 보조 요법을 목적으로 방사선 종양학자에 의해 처방될 수 있다.또한 완화를 위한 치료(치료가 불가능하고 국소적인 질병 통제나 증상 완화를 목적으로 하는 경우) 또는 치료적 치료(치료가 생존에 도움이 되고 치료가 가능한 경우)로 사용될 수 있다.방사선 요법을 수술, 화학 요법, 호르몬 요법, 면역 요법 또는 이 네 가지를 혼합하여 사용하는 것도 일반적입니다.대부분의 일반적인 암은 어떤 식으로든 방사선 치료로 치료될 수 있다.
정확한 치료 의도(치료적, 보조적, 신주반트 치료적 또는 완화적)는 환자의 일반적인 건강뿐만 아니라 종양 유형, 위치 및 단계에 따라 달라집니다.전신 방사선 조사(TBI)는 골수 이식을 받기 위해 몸을 준비하는 데 사용되는 방사선 치료 기술입니다.치료가 필요한 부위의 내부나 옆에 방사성 선원을 배치하는 완치요법은 유방암, 전립선, 기타 장기의 암을 치료하는 과정에서 건강한 조직에 대한 노출을 최소화하는 방사선 치료의 또 다른 형태이다.방사선 치료는 삼차신경통, 청각신경종, 중증 갑상선 눈병, 익상구, 색소성 융모조성 활막염의 치료, 켈로이드 흉터 성장, 혈관 재협착 및 이소성 골화 방지와 같은 비악성 질환에서 여러 가지 응용이 있다.비악성 조건에서의 방사선 치료의 사용은 방사선 유발 암의 위험에 대한 우려로 인해 부분적으로 제한된다.
의료 용도

방사선 치료에는 암마다 [1][2][3]반응이 다르다.
방사선에 대한 암의 반응은 방사선 감수성으로 설명된다.방사선 감수성이 매우 높은 암세포는 적은 양의 방사선에 의해 빠르게 죽는다.이것은 백혈병, 대부분의 림프종 그리고 생식세포 종양을 포함한다.대부분의 상피암은 중간 정도의 방사선 감수성일 뿐이며, 급진적 완치를 위해 상당히 높은 방사선량(60-70 Gy)을 필요로 한다.어떤 종류의 암은 눈에 띄게 방사선 저항성이 있다. 즉, 임상 실무에서 안전한 것보다 훨씬 더 많은 선량이 급진적인 치료제를 생산하기 위해 필요하다.신장세포암과 흑색종은 일반적으로 방사선 저항성으로 간주되지만 방사선 치료는 여전히 전이성 흑색종 환자들에게 완화의 선택이다.방사선 요법과 면역 요법을 결합하는 것은 활발한 연구 분야이며 흑색종과 다른 [4]암에 대한 가능성을 보여주었다.
특정 종양의 방사선 민감도를 어느 정도 실험실 척도로서 실제 임상 실무에서 암의 방사선 "치유성"과 구별하는 것이 중요하다.예를 들어 백혈병은 체내에 퍼지기 때문에 방사선 치료로는 일반적으로 치료할 수 없다.림프종은 신체의 한 부위에 국소화되면 근본적으로 치료될 수 있다.마찬가지로, 많은 일반적이고 중간 정도의 방사선 반응성 종양은 초기 단계인 경우 방사선 치료의 치료 선량을 통해 일상적으로 치료된다.예를 들어 비흑색종 피부암, 두경부암, 유방암, 비소세포 폐암, 자궁경부암, 항문암, 전립선암 등이 있습니다.전이성 암은 전신을 치료할 수 없기 때문에 방사선 치료로는 치료할 수 없습니다.
현대의 방사선 치료는 종양과 주변의 정상 구조를 식별하고 복잡한 방사선 치료 계획을 작성하기 위한 선량 계산을 수행하기 위해 CT 스캔에 의존한다.환자에게는 치료 [5]영역의 배치를 안내하는 작은 피부 마크가 있습니다.이 단계에서는 환자를 각 시술 중에 동일한 위치에 배치해야 하므로 환자 위치가 중요합니다.환자에게 성형할 수 있는 마스크와 쿠션을 포함하여 많은 환자 위치 고정 장치가 이러한 목적으로 개발되었습니다.IGRT(영상 유도 방사선 치료)는 영상을 사용하여 각 치료 세션의 위치 오류를 수정하는 방법입니다.
방사선 치료에 대한 종양의 반응도 그 크기와 관련이 있다.복잡한 방사선 생물학 때문에 매우 큰 종양은 작은 종양이나 현미경 질환보다 방사선에 덜 반응한다.이 효과를 극복하기 위해 다양한 전략이 사용됩니다.가장 일반적인 기술은 방사선 치료 전에 외과적 절제술이다.이것은 광범위한 국소 절제술이나 유방 절제술에 이은 보조 방사선 치료로 유방암 치료에 가장 흔하게 나타난다.또 다른 방법은 래디컬 방사선 치료 전에 네오어드주반트 화학요법으로 종양을 수축시키는 것이다.세 번째 기술은 방사선 치료 과정에서 특정 약물을 투여함으로써 암의 방사선 감수성을 높이는 것이다.방사선 감수성 약물의 예로는 시스플라틴, 니모라졸, 세턱시맙 [6]등이 있다.
방사선 치료의 영향은 암의 종류와 [7]그룹에 따라 다르다.예를 들어, 유방암 치료 후 유방암의 [8]경우 방사선 치료를 통해 재발률이 절반으로 감소하는 것으로 밝혀졌다.
부작용
방사선 치료는 그 자체로 통증이 없다.많은 저용량 완화 치료(예: 골전이에 대한 방사선 치료)는 치료 후 며칠 안에 치료 부종의 신경 압박으로 인해 단기적인 통증 확대가 나타날 수 있지만, 부작용을 최소화하거나 전혀 유발하지 않는다.높은 용량으로 인해 치료 중(급성 부작용), 치료 후 몇 달 또는 몇 년 후(장기 부작용), 또는 재치료 후(누적 부작용) 다양한 부작용이 발생할 수 있습니다.부작용의 특성, 심각도 및 수명은 방사선을 받는 기관, 치료 자체(방사선 유형, 선량, 분류, 동시 화학요법) 및 환자에 따라 달라집니다.
대부분의 부작용은 예측 가능하고 예상할 수 있다.방사선에 의한 부작용은 일반적으로 치료 중인 환자의 신체 부위로 제한됩니다.부작용은 용량에 따라 달라진다. 예를 들어 고선량의 머리와 목 방사선은 심혈관 합병증, 갑상선 기능 장애, 뇌하수체 축 [9]기능 장애와 연관될 수 있다.현대의 방사선 치료는 부작용을 최소화하고 환자가 피할 수 없는 부작용을 이해하고 대처할 수 있도록 돕는 것을 목적으로 한다.
보고된 주요 부작용은 가벼운 햇볕에 탄 것처럼 피로와 피부 자극이다.피로는 종종 치료 도중에 나타나며 치료 종료 후 몇 주 동안 지속될 수 있습니다.자극받은 피부는 치유되겠지만 [10]예전처럼 탄력적이지 않을 수 있다.
급성 부작용
- 메스꺼움과 구토
- 이것은 방사선 치료의 일반적인 부작용이 아니며, 기계적으로 위나 복부의 치료(일반적으로 치료 후 몇 시간 후에 반응) 또는 특정 두경부 종양의 치료 동안 머리의 메스꺼움을 유발하는 구조에 대한 방사선 치료와 관련이 있습니다. 내이[11]다른 괴로운 치료와 마찬가지로, 일부 환자는 방사선 치료 중에 즉시 또는 심지어 그것을 예상하여 구토를 하지만, 이것은 심리적인 반응으로 간주된다.어떤 이유로든 메스꺼움은 [12]항토제로 치료할 수 있다.
- 상피 표면[13] 손상
- 상피 표면이 방사선 치료로 인해 손상될 수 있습니다.시술 부위에 따라 피부, 구강 점막, 인두, 장 점막 및 요관이 포함될 수 있습니다.손상의 시작과 회복 속도는 상피세포의 회전율에 따라 달라진다.일반적으로 피부는 치료 후 몇 주 동안 분홍색으로 변하고 통증이 생기기 시작합니다.방사선 치료 종료 후 최대 1주일 동안 치료 중 반응이 더 심해지고 피부가 망가질 수 있습니다.이 습기찬 박리는 불편하지만, 대개 회복이 빠릅니다.피부 반응은 여성의 가슴 아래, 귀 뒤, 사타구니 등 피부에 자연스러운 주름이 있는 부위에서 더 심해지는 경향이 있다.
- 입, 목, 복통
- 머리와 목 부위를 치료하면 입과 [14]목에 일시적인 통증과 궤양이 흔히 발생한다.심할 경우 삼키는 데 영향을 미칠 수 있으며, 환자는 진통제와 영양 보조 식품이 필요할 수 있습니다.식도는 또한 직접적으로 치료되거나, 흔히 발생하는 것처럼 폐암 치료 중에 부수적인 방사선량을 받는다면, 아프게 될 수 있다.간 악성종양 및 전이를 치료할 때, 부수적인 방사선이 위, 위 또는 십이지장 궤양을[15][16] 일으킬 수 있습니다. 이러한 부수적인 방사선은 일반적으로 [17]주입된 방사성 물질의 비표적 전달(역류)에 의해 발생합니다.이러한 유형의 부작용 [18]발생을 줄이기 위한 방법, 기법 및 장치를 사용할 수 있다.
- 장내 불쾌감
- 하부 장은 방사선 치료(직장암 또는 항문암 치료)로 직접 치료되거나 방사선 치료를 통해 다른 골반 구조(프로스테이트, 방광, 여성 생식기)에 노출될 수 있습니다.대표적인 증상은 통증, 설사, 메스꺼움이다.영양 중재는 방사선 [19]치료와 관련된 설사에 도움이 될 수 있다.원발성 골반암 항암 치료의 일환으로 골반 방사선 치료를 받은 사람들을 대상으로 한 연구에서 방사선 치료 중 식이 지방, 섬유 및 유당의 변화가 [19]치료 종료 시 설사를 감소시키는 것으로 나타났다.
- 붓기
- 일반적으로 발생하는 염증의 일부로서, 방사선 치료 중에 연조직의 붓기가 문제를 일으킬 수 있습니다.이는 뇌종양과 뇌 전이 치료 중 우려되는 사항이며, 특히 기존에 두개내 압력이 상승했거나 종양이 내강(예: 기관 또는 주 기관지)의 거의 완전한 폐색을 일으키고 있는 경우이다.방사선 치료를 하기 전에 외과적 개입을 고려할 수 있습니다.수술이 불필요하거나 부적절하다고 판단될 경우 방사선 치료 중에 붓기를 줄이기 위해 스테로이드제를 투여할 수 있습니다.
- 불임
- 생식선(난소와 고환)은 방사선에 매우 민감합니다.대부분의 정상 치료 선량에 직접 피폭된 후에는 배우자를 생성하지 못할 수 있다.모든 신체 부위의 치료 계획은 생식선이 주요 치료 부위가 아닌 경우 생식선에 대한 선량을 완전히 제외하지는 않더라도 최소화할 수 있도록 설계되었습니다.
후발 부작용
늦은 부작용은 치료 후 수개월에서 수년 사이에 발생하며 일반적으로 치료된 부위로 제한됩니다.그들은 종종 혈관과 결합 조직 세포의 손상으로 인해 발생한다.많은 지연 효과는 처리를 더 작은 부분으로 분류함으로써 감소됩니다.
- 섬유증
- 조사된 조직은 확산성 흉터 과정으로 인해 시간이 지남에 따라 탄력성이 떨어지는 경향이 있다.
- 에필레이션
- 탈모(탈모)는 1 Gy 이상의 용량을 가진 모발에 발생할 수 있다.방사선 영역 내에서만 발생합니다.탈모는 10 Gy의 단일 선량으로 영구적일 수 있지만, 선량을 세분화할 경우 선량이 45 Gy를 초과할 때까지 영구 탈모가 발생하지 않을 수 있다.
- 건조.
- 침샘과 눈물샘의 방사선 허용량은 2 Gy 분율에서 약 30 Gy로 대부분의 급진적인 두경부암 치료에서 초과된다.구강건조증(건조증)과 안구건조증(건조증)은 장기적인 문제가 되고 환자의 삶의 질을 심각하게 떨어뜨릴 수 있습니다.마찬가지로, 처리된 피부의 땀샘(예: 겨드랑이)은 작동을 멈추는 경향이 있으며, 자연적으로 촉촉한 질 점막은 골반 조사 후에 종종 건조해진다.
- 림프부종
- 림프부종은 국소적인 체액 유지와 조직 부종의 질환으로 방사선 치료 중에 지속된 림프계의 손상으로 인해 발생할 수 있다.그것은 겨드랑이 [20]림프절을 제거하는 수술 후에 보조 액와 방사선 치료를 받는 유방 방사선 치료 환자들에게 가장 흔하게 보고된 합병증이다.
- 암
- 방사선은 암의 잠재적 원인이며, 일부 환자에게서 2차 악성종양이 나타난다.암 생존자는 생활습관 선택, 유전학, 이전의 방사선 치료 등 여러 가지 요인 때문에 이미 일반 인구보다 악성 종양에 걸릴 가능성이 높다.단일 원인에서 이러한 2차 암의 비율을 직접 정량화하는 것은 어렵다.연구 결과 방사선 치료가 소수의 [21][22]환자들에게만 2차 악성 종양의 원인이라는 것이 밝혀졌다.건강한 조직에 대한 선량을 줄이는 것을 목표로 하는 양성자 빔 치료와 탄소 이온 방사선 치료와 같은 새로운 기술은 이러한 [23][24]위험을 낮출 것이다.일부 혈액학적 악성종양은 3년 이내에 발생할 수 있지만 치료 후 4 - 6년 후에 발생하기 시작한다.대부분의 경우, 이러한 위험은 2차 [25]악성종양의 부담이 더 큰 소아 악성종양에서도 1차 암을 치료함으로써 주어지는 위험 감소보다 훨씬 크다.
- 심혈관 질환
- 방사선은 이전의 유방암 RT [26]요법에서 관찰된 바와 같이 심장병과 사망의 위험을 증가시킬 수 있다.치료용 방사선은 후속 심혈관 사건(즉, 심장마비 또는 뇌졸중)의 위험을 사람의 정상 비율의 1.5 - 4배 증가시키며,[27] 악화 요인도 포함된다.증가량은 RT의 선량 강도, 용량 및 위치와 관련된 선량에 따라 달라진다.
- 심혈관계 말기 부작용은 방사선유발심장질환(RIHD)과 방사선유발혈관질환(RIVD)[28]으로 불린다.증상은 용량에 따라 다르며 심근증, 심근 섬유증, 판막 심장병, 관상동맥 질환, 심장 부정맥 및 말초동맥 질환을 포함한다.방사선 유도 섬유증, 혈관 세포 손상 및 산화 스트레스는 이러한 부작용 및 기타 늦은 부작용 [28]증상으로 이어질 수 있다.대부분의 방사선 유도 심혈관 질환은 치료 후 10년 이상 경과하면 발생하므로 인과관계를 판단하기가 [27]더 어렵다.
- 인지 저하
- 머리에 방사선 치료를 할 경우 인지능력이 저하될 수 있습니다.인지력 감퇴는 특히 5세에서 11세 사이의 어린 아이들에게서 두드러졌다.예를 들어, 5세 아이들의 IQ는 치료 후 매년 [29]몇 가지 IQ 포인트씩 감소하는 것을 발견했습니다.
- 방사선 장질환
- 복부 및 골반 방사선 치료 [30]후 위장관이 손상될 수 있습니다.위축, 섬유화 및 혈관 변화는 회장 관련으로 흔히 발견되는 담즙산 설사와 비타민 B12 흡수 불량과 함께 흡수 불량, 설사, 지방질 및 출혈을 일으킨다.골반 방사선 질환에는 방사선 항문염, 출혈, 설사, 긴급 [31]등이 있으며, 방광이 영향을 받으면 방사선 방광염을 일으킬 수 있습니다.
- 방사선에 의한 다발성 뉴로파시
- 신경 조직도 방사선에 [32]민감하기 때문에 방사선 치료는 대상 부위 근처 또는 분만 경로 내의 신경을 손상시킬 수 있습니다.이온화 방사선에 의한 신경 손상은 미세혈관 손상, 모세혈관 손상, 신경 탈수 [33]등의 초기 단계에서 발생한다.방사선에 [33]의해 야기되는 제어되지 않은 섬유조직 성장으로 인한 혈관 수축 및 신경 압박으로 인해 후속 손상이 발생합니다.방사선 유도 다발성 신경병증(ICD-10-CM Code G62.82)은 방사선 [33][32]치료를 받는 사람의 약 1~5%에서 발생한다.
- 조사 영역에 따라 중추신경계(CNS) 또는 말초신경계(PNS)에서 후발효과 신경장애가 발생할 수 있다.예를 들어, CNS에서 두개골 신경 손상은 일반적으로 [33]치료 후 1~14년 후 시력 상실로 나타난다.PNS에서는 치료 [33]후 최대 30년 후에 나타나는 방사선 유도성 팔신경총증 또는 방사선 유도성 요골신경총증으로 총상 손상이 나타난다.
- 방사선 괴사
- 방사선 괴사는 방사선 조사 부위 근처의 건강한 조직이 사망하는 것이다.방사선이 해당 부위의 혈관을 직간접적으로 손상시켜 나머지 건강한 조직으로의 혈액 공급을 감소시켜 허혈성 [34]뇌졸중과 유사한 허혈로 사망에 이르게 하기 때문에 발생하는 응고 괴사의 일종이다.치료의 간접적인 효과이기 때문에 방사선 [34]피폭 후 수개월에서 수십 년 후에 발생합니다.
누적 부작용
이 과정의 누적 효과는 장기적 영향과 혼동해서는 안 된다. 단기적 영향이 사라지고 장기적 영향이 무의미할 경우 재방사선은 여전히 문제가 [35]될 수 있다.이러한 선량은 방사선 종양학자에 의해 계산되며, 후속 방사선이 발생하기 전에 많은 요인이 고려된다.
재생산에 미치는 영향
수정 후 첫 2주 동안 방사선 치료는 치명적이지만 기형적인 [36]것은 아니다.임신 중 높은 방사선량은 이상, 성장 장애 및 지적 장애를 유발하며,[36] 소아 백혈병 및 기타 종양의 위험이 증가할 수 있다.
이전에 방사선 치료를 받은 남성의 경우 치료 [36]후 임신한 자녀에게 유전적 결함이나 선천적 기형이 증가하지 않는 것으로 보인다.그러나 보조 생식 기술과 미세 조절 기술의 사용은 이러한 [36]위험을 증가시킬 수 있다.
뇌하수체에 미치는 영향
저피루티타증은 일반적으로 셀라 및 부세포 종양, 뇌종양, 머리와 목 종양에 대한 방사선 치료,[37] 전신 악성 종양에 대한 전신 조사 후에 발병한다.방사선 유도성 저감소증은 주로 성장 호르몬과 생식선 [37]호르몬에 영향을 미친다.반면 부신피질영양호르몬(ACTH)과 갑상선자극호르몬(TSH) 결핍은 방사선 유도 저피질영양호르몬([37]TSH)이 있는 사람들 사이에서 가장 흔하지 않다.프로락틴 분비의 변화는 보통 경미하며,[37] 방사선의 결과로서 바소프레신 결핍은 매우 드문 것으로 보인다.
방사선 치료 사고
환자에게 방사선 치료의 우발적 과다 노출 위험을 최소화하기 위한 엄격한 절차가 마련되어 있다.그러나 실수가 종종 발생한다. 예를 들어 방사선 치료기 Therac-25는 1985년과 1987년 사이에 환자에게 의도된 선량의 100배까지 투여된 최소 6건의 사고에 책임이 있었다. 두 명이 방사선 과다복용으로 직접 사망했다.2005년부터 2010년까지 미주리의 한 병원은 새로운 방사선 장비가 [38]잘못 설치되었기 때문에 5년 동안 76명의 환자(대부분 뇌종양 환자)를 과다 노출시켰다.
의료 오류는 극히 드물지만 방사선 종양학자, 의료 물리학자 및 방사선 치료 팀의 다른 구성원들이 이를 제거하기 위해 노력하고 있습니다.아스트로는 무엇보다도 전국적으로 오류를 기록하여 의사들이 모든 실수로부터 배우고 이러한 실수가 발생하지 않도록 하는 것을 목표로 하는 Target Safety라는 안전 계획을 시작했다.ASTRO는 또한 모든 치료가 가능한 [39]한 안전한지 확인하기 위해 환자들이 의사에게 방사선 안전에 대해 물어볼 수 있는 질문 목록을 공개한다.
비암성 질환에 사용
방사선 치료는 초기 두푸이트렌병과 레더호스병을 치료하기 위해 사용된다.Dupuytren병이 결절 단계이고 코드나 손가락의 변형이 최소 단계인 10도 미만일 때는 방사선 치료를 통해 병의 진행을 막는다.병의 진행을 막기 위해 수술 후 방사선 치료를 사용하는 경우도 있다.저선량은 일반적으로 5일 동안 3회색 방사선을 사용하며, 3개월의 휴식 후 5일 [40]동안 3회색 방사선을 사용한다.
기술.
작용 메커니즘
방사선 치료는 암세포의 DNA를 손상시킴으로써 효과가 있다.이 DNA 손상은 두 종류의 에너지, 광자 또는 하전 입자에 의해 발생합니다.이 손상은 DNA 사슬을 구성하는 원자의 직접 또는 간접 이온화입니다.간접 이온화는 물의 이온화의 결과로 일어나 유리기, 특히 수산화기를 형성하고 DNA를 손상시킵니다.
광자 치료에서 방사선 효과의 대부분은 유리기를 통해 이루어진다.세포는 단일 가닥 DNA 손상과 이중 가닥 DNA 손상을 복구하는 메커니즘을 가지고 있다.하지만, 이중 가닥 DNA 파괴는 복구하기가 훨씬 더 어렵고, 극적인 염색체 이상과 유전자 결실을 초래할 수 있습니다.이중가닥 절단을 목표로 하면 세포가 세포사멸할 확률이 높아집니다.암세포는 일반적으로 분화가 덜 되고 줄기세포와 유사하다; 그들은 대부분의 건강한 분화 세포보다 더 많이 번식하고 치사하 손상을 회복하는 능력이 감소한다.단일 가닥 DNA 손상은 세포 분열을 통해 전달된다; 암세포의 DNA 손상은 암세포가 죽거나 더 느리게 번식하는 것을 야기하면서 축적된다.
광자 방사선 치료의 주요 한계 중 하나는 고형 종양의 세포에 산소가 부족해지는 것이다.고형 종양은 혈액 공급을 초과하여 저산소증으로 알려진 저산소 상태를 야기할 수 있다.산소는 DNA를 손상시키는 활성산소를 형성함으로써 주어진 방사선량의 효과를 증가시키는 강력한 방사선감작제이다.저산소 환경의 종양 세포는 일반 산소 [41]환경의 종양 세포보다 방사선 손상에 대한 내성이 2~3배 더 높을 수 있습니다.저산소증을 극복하기 위해 많은 연구가 이루어졌는데, 여기에는 고압 산소 탱크, 온열 요법(종양 부위까지 혈관을 확장시키는 열 치료), 증가된 산소를 운반하는 혈액 대체제, 미소니다졸과 메트로니다졸과 같은 저산소 세포감작제, 그리고 저산소 사이토톡신(문제 독극물),티라파자민처럼요트랜스나트륨 크로세틴산염(TSC)과 같은 산소 확산 증강 화합물의 방사능 감작제 [42]사용에 대한 임상 전 연구 및 임상 연구를 포함하여 새로운 연구 접근법이 현재 연구되고 있다.
양성자와 붕소, 탄소, 네온 등 하전입자는 고LET(선형 에너지 전달)를 통해 암세포 DNA에 직접 손상을 입힐 수 있고, 주로 직접 에너지 전달을 통해 작용하기 때문에 종양 산소 공급과 무관하게 항종양 효과를 낸다.상대적으로 질량이 크기 때문에 양성자와 다른 하전 입자는 조직에 측면 산란이 거의 없다. 즉, 빔은 크게 넓어지지 않고 종양 모양에 집중하며 주변 조직에 작은 선량 부작용을 전달한다.그들은 또한 브래그 피크 효과를 사용하여 종양을 더 정확하게 겨냥한다.강도 변조 방사선 치료(IMRT)와 하전 입자 치료의 다른 영향에 대한 좋은 예는 양성자 치료를 참조하십시오.이 절차는 하전 입자 방사선원과 종양 사이의 건강한 조직에 대한 손상을 줄이고 종양 도달 후 조직 손상에 대한 제한된 범위를 설정합니다.대조적으로, IMRT의 무전하 입자의 사용은 그것이 몸 밖으로 나갈 때 건강한 세포를 손상시킨다.이 유출되는 손상은 치료 효과가 없고, 치료 부작용을 증가시킬 수 있으며, 2차 암 [43]유도의 확률을 높입니다.이 차이는 다른 기관의 근접으로 인해 이탈 이온화가 매우 해로운 경우(예: 두경부 암)에 매우 중요합니다.이러한 X선 노출은 특히 어린이에게 좋지 않다. 왜냐하면 그들의 몸이 성장하기 때문이고, 여러 요인에 따라 다르지만,[44] 그들은 성인들에 비해 방사선 치료 후 2차 악성 종양 발생에 약 10배 더 민감하다.
양
광자 방사선 치료에 사용되는 방사선량은 회색(Gy)으로 측정되며, 치료 중인 암의 유형과 단계에 따라 다르다.완치의 경우, 고형 상피 종양의 일반적인 선량은 60 - 80 Gy이며, 림프종은 20 - 40 Gy로 치료된다.
예방(보조) 선량은 일반적으로 (유방암, 두부암 및 목암의 경우) 1.8-2 Gy 분율에서 약 45–60 Gy이다.방사선 종양학자는 환자가 항암치료를 받고 있는지 여부, 환자의 동반치료를 받고 있는지 여부, 수술 전 또는 후에 방사선치료를 하고 있는지 여부, 수술 성공 정도를 포함하여 방사선 종양학자가 선량을 선택할 때 많은 다른 요인을 고려한다.
소정의 선량의 전달 파라미터는 치료계획(선량측정 일부) 중에 결정된다.치료 계획은 일반적으로 전문 치료 계획 소프트웨어를 사용하여 전용 컴퓨터에서 수행됩니다.방사선 전달 방법에 따라 필요한 총 선량을 합하기 위해 여러 각도 또는 선원을 사용할 수 있다.계획자는 종양에 균일한 처방량을 전달하고 주변의 건강한 조직에 대한 투여량을 최소화하는 계획을 설계하려고 노력할 것입니다.
방사선 치료에서 3차원 선량 분포는 겔 선량 [45]측정으로 알려진 선량 측정 기법을 사용하여 평가할 수 있다.
구분
총 선량은 몇 가지 중요한 이유로 분류된다(시간에 따라 확산된다).분획은 정상 세포가 회복하는 시간을 허용하지만 종양 세포는 일반적으로 분획 사이의 복구에 덜 효율적입니다.분획은 또한 한 치료 동안 세포 주기의 비교적 내방사능 단계에 있던 종양 세포가 다음 분획이 주어지기 전에 주기의 민감한 단계로 순환할 수 있도록 한다.마찬가지로 만성 또는 급성 저산소(따라서 더 많은 방사선 저항제)였던 종양 세포는 분율 사이에 다시 산소가 생성되어 종양 세포 [46]사멸을 개선할 수 있다.
분류 요법은 다른 방사선 치료 센터 간, 심지어 개인 의사 간에도 개별화된다.북미, 호주 및 유럽에서 성인의 일반적인 분류 일정은 1일 1.8 - 2 Gy, 일주일에 5일입니다.일부 암종에서는 분획일정을 너무 오래 연장하면 종양이 다시 생기기 시작할 수 있으며, 두경부 편평상피암 및 자궁경부 편평상피암을 포함한 이러한 종양종류에서는 방사선 치료가 일정 시간 내에 완료되는 것이 바람직하다.어린이의 경우, 분율 크기가 작을 경우 정상 조직에서 발생률 및 후발 부작용의 심각도가 감소하기 때문에 일반적인 분율 크기는 하루에 1.5 - 1.8 Gy가 될 수 있다.
경우에 따라서는 치료 과정이 끝날 무렵에 하루에 두 개의 분수가 사용됩니다.이 스케줄은 동반 부스트 요법 또는 과분열로 알려져 있으며, 크기가 작을 때 더 빨리 재생되는 종양에 사용됩니다.특히, 머리와 목의 종양은 이러한 행동을 보여준다.
복잡하지 않은 뼈 전이를 치료하기 위해 완화 방사선을 받는 환자는 단일 부분 이상의 [47]방사선을 받아서는 안 된다.단일 치료는 다분열 치료와 비슷한 통증 완화 및 질병률 결과를 제공하며, 기대 수명이 제한된 환자의 경우 단일 치료가 환자의 [47]편안함을 향상시키기에 가장 좋습니다.
구분 스케줄
점점 더 많이 사용되고 연구되고 있는 분류 스케줄 중 하나는 저분할이다.총 방사선량을 큰 용량으로 나누는 방사선 치료입니다.대표적인 선량은 2.2 Gy/fraction에서 20 Gy/fraction까지 암 유형에 따라 크게 다르며, 후자는 두개골 하부 병변에 대한 정위적 치료(정위적 절제체 방사선 치료 또는 SABR - SBRT 또는 정위적 신체 방사선 치료라고도 함)의 전형이다.저회절의 근거는 클로노제닉 세포가 번식하는 데 필요한 시간을 거부함으로써 국소 재발 확률을 낮추고 일부 [48]종양의 방사선 감수성을 이용하는 것이다.특히, 입체 치료는 일상적인 방사선 치료와 같이 클로노겐 세포 분할 과정을 반복적으로 중단(아포토시스)하기보다는 클로노겐 세포를 직접 파괴하려는 선량 전달을 통해 클로노겐 세포를 파괴하는 것을 의도한다.
표적 민감도에 기초한 선량 추정
암의 종류에 따라 방사선 감도가 다르다.생체검사 검체의 게놈 또는 단백질 분석에 기초한 민감도를 예측하는 것은 [49][50]어려운 것으로 입증되었지만, 내재 세포 방사선 감수성의 게놈 시그니처로부터 개별 환자에 대한 방사선 영향의 예측은 [51]임상 결과와 관련이 있는 것으로 나타났다.미생물의 방사선 방지가 망간과 작은 유기 대사물의 [52]비효소 복합체에 의해 제공된다는 발견으로 유전체학 및 단백질학에 대한 대체 접근법이 제시되었다.망간의 함량과 변화(전자 상사성 공명으로 측정 가능)는 방사선 감수성의 좋은 예측 변수이며, 이 발견은 인간의 [53]세포로도 확장된다.총 세포 망간 함량과 그 변화, 그리고 다른 종양 세포에서 임상적으로 추론된 방사선 반응성 사이의 연관성이 확인되었으며, 이는 보다 정밀한 방사선 영상과 암 [54]환자의 치료 개선에 유용할 수 있는 발견이다.
종류들
역사적으로 방사선 치료의 세 가지 주요 부문은 다음과 같다.
이러한 차이는 방사선원의 위치와 관련이 있다. 외부는 신체 외부에 있고, 완치요법은 치료 중인 부위에 정확히 배치된 밀폐된 방사선원을 사용하며, 전신 방사성 동위원소는 주입 또는 경구 섭취에 의해 제공된다.완치요법은 방사성 선원의 일시적 또는 영구적 위치를 사용할 수 있다.임시 소스는 보통 애프터 로딩이라고 불리는 기술로 배치됩니다.애프터 로딩 시에는 중공관 또는 어플리케이터를 외과적으로 피치료 기관에 배치하고, 어플리케이터를 이식한 후 어플리케이터에 소스를 로드한다.이를 통해 의료진에 대한 방사선 노출을 최소화할 수 있습니다.
입자 치료는 입자가 양성자 또는 무거운 이온인 외부 빔 방사선 치료의 특별한 경우입니다.
외부 빔 방사선 치료
다음 세 절에서는 X선을 사용한 치료에 대해 설명합니다.
기존 외부 빔 방사선 치료
기존 외부 빔 방사선 치료(2DX)RT=고에너지 X-레이를 만들고 2차원 빔 kilovoltage 치료 X선 장치를 사용하여, 의료 선형 가속기, 또는 외모의 선형 가속기를 사용하기도 있지만, 위에 나온 것처럼 밀폐된 방사능 소스 사용 유사한 기계를 통해 배달되었다.[55][56]2DXRT 주로 방사선의 단일 빔에 공급되는 사례로 구성되어 있다.여러 방향의 환자: 종종 앞이나 뒤, 그리고 양쪽에서.
기존 치료법은 선형 가속기 작용(또는 때로는 눈으로)을 재현하기 때문에 시뮬레이터로 알려진 특수 보정 진단 X선 기계에서 치료법이 계획되거나 시뮬레이션되는 방식을 말하며, 원하는 계획을 달성하기 위해 일반적으로 잘 확립된 방사선 빔의 배치를 말한다.시뮬레이션의 목적은 처리할 볼륨을 정확하게 타겟팅하거나 국소화하는 것입니다.이 기술은 잘 확립되어 있으며 일반적으로 빠르고 신뢰할 수 있습니다.우려되는 것은 일부 고용량 치료제가 목표 종양 부피에 가까운 건강한 조직의 방사선 독성 용량에 의해 제한될 수 있다는 것이다.
이 문제의 예는 전립선 방사선에서 볼 수 있으며, 인접한 직장의 민감도는 2DX를 사용하여 안전하게 처방할 수 있는 선량을 제한한다.종양 조절이 쉽지 않을 수 있는 범위까지 RT 계획을 수립합니다.CT가 발명되기 전, 의사와 물리학자들은 암 조직과 건강한 조직 모두에 전달되는 진정한 방사선량에 대해 제한된 지식을 가지고 있었다.이 때문에 3차원 입체 방사선 치료는 거의 모든 종양 부위의 표준 치료가 되었다.최근에는 MRI, PET, SPECT 및 초음파를 [57]포함한 다른 형태의 이미징이 사용되고 있습니다.
입체 방사선
입체 방사선은 외부 빔 방사선 치료의 특수 유형입니다.매우 상세한 영상 스캔을 사용하여 잘 정의된 종양을 대상으로 하는 집중 방사선 빔을 사용합니다.방사선 종양학자는 종종 뇌나 척추의 종양에 대해 신경외과 의사의 도움을 받아 입체 치료를 수행합니다.
입체 방사선은 두 가지 종류가 있습니다.입체방사선수술(SRS)은 의사가 뇌나 척추의 단일 또는 여러 개의 입체방사선 치료를 사용하는 것을 말한다.SBRT(입체방사선치료)는 [58]폐와 같은 신체를 이용한 하나 이상의 입체방사선 치료를 말합니다.
일부 의사들은 정위 치료의 장점이 종종 6주에서 11주가 걸리는 기존의 치료법보다 짧은 시간에 적절한 양의 방사선을 암에 전달한다는 것이라고 말한다.또한 치료법은 매우 정확하게 제공되며, 이는 건강한 조직에 대한 방사선의 영향을 제한해야 한다.입체 치료의 한 가지 문제는 특정 작은 종양에만 적합하다는 것이다.
많은 병원들이 치료제를 SRS 또는 SBRT라고 부르지 않고 제조사 이름으로 부르기 때문에 입체 치료는 혼란스러울 수 있습니다.Axese, Cyberknife, Gamma Knife, Novalis, Primatom, Synergy, X-Knife, TomoTherapy, Trubeam [59]등이 이러한 치료제의 브랜드 이름입니다.이 목록은 장비 제조업체들이 암을 치료하기 위한 전문화된 새로운 기술을 계속 개발함에 따라 변경됩니다.
가상 시뮬레이션 및 3차원 등각 방사선 치료
특수 CT 및/또는 MRI 스캐너와 계획 [60]소프트웨어를 사용하여 종양과 인접한 정상 구조를 3차원으로 묘사할 수 있는 능력으로 방사선 치료의 계획이 혁신되었습니다.
계획의 가장 기본적인 형태인 가상 시뮬레이션을 사용하면 연조직 구조가 사정하기 어렵고 정상 조직이 보호되기 어려운 기존 X선을 사용하는 것보다 방사선 빔의 정확한 배치를 할 수 있다.
가상 시뮬레이션의 강화는 3차원 등각방사선치료(3DCRT)로, 다엽 콜리메이터(MLC)와 가변수의 빔을 사용하여 빔의 시선(BEV)에서 타깃의 프로파일에 맞도록 각 방사선빔의 프로파일이 성형된다.치료량이 종양의 형태와 일치하면 주변 정상 조직에 대한 방사선의 상대적 독성이 감소하여 종양이 허용하는 [5]것보다 더 많은 양의 방사선이 종양으로 전달될 수 있다.
강도 변조 방사선 치료(IMRT)
강도 변조 방사선 치료(IMRT)는 차세대 [61]3DCRT인 첨단 유형의 고정밀 방사선입니다.IMRT는 또한 종양이 척수나 주요 장기 또는 [62]혈관과 같은 취약한 구조 주위에 감겨 있을 때 치료량을 오목한 종양 모양으로 [5]적합시키는 능력을 향상시킵니다.컴퓨터로 제어되는 X선 가속기는 악성 종양이나 종양 내의 특정 부위에 정확한 방사선량을 분배합니다.방사선 전달 패턴은 최적화 및 치료 시뮬레이션(치료 계획)을 수행하기 위해 고도로 맞춤화된 컴퓨팅 애플리케이션을 사용하여 결정됩니다.방사선량은 방사선 빔의 강도를 조절하거나 조절하여 종양의 3D 모양과 일치합니다.방사선량 강도는 총 종양 부피 부근에서 증가하며, 인접한 정상 조직 간의 방사선은 감소하거나 완전히 회피한다.이것은 심지어 3DCRT보다 더 나은 종양 표적화, 부작용 감소, 그리고 더 나은 치료 결과를 가져옵니다.
3DCRT는 여전히 많은 신체 부위에서 광범위하게 사용되고 있지만 IMRT의 사용은 CNS, 머리와 목, 전립선, 유방, 폐와 같은 더 복잡한 신체 부위에서 증가하고 있다.안타깝게도 IMRT는 숙련된 의료진의 추가 시간이 필요하기 때문에 한계가 있습니다.이는 의사들이 전체 질병 부위에서 한번에 하나의 CT 영상으로 종양을 수동으로 묘사해야 하기 때문에 3DCRT 준비보다 훨씬 더 오랜 시간이 걸릴 수 있기 때문입니다.그런 다음, 실행 가능한 치료 계획을 수립하기 위해 의료 물리학자 및 선량 측정사가 참여해야 한다.또한 IMRT 기술은 1990년대 후반부터 가장 발달된 암센터에서도 상업적으로만 사용되어 왔기 때문에 레지던트 프로그램의 일부로 배우지 않은 방사선 종양학자는 IMRT를 구현하기 전에 추가적인 교육원을 찾아야 한다.
기존 방사선 치료(2DX)보다 이 두 가지 기술 중 하나를 통해 생존 효과가 향상되었다는 증거RT)는 많은 종양 부위에서 성장하고 있지만, 독성을 감소시키는 능력은 일반적으로 인정된다.이것은 특히 영국 왕립 마스덴 병원의 크리스토퍼 누팅 교수가 수행한 일련의 중추적인 실험에서 두경부암의 경우이다.두 기법 모두 선량 증가를 가능하게 하여 잠재적으로 유용성을 증가시킨다.방사선에 대한 [63]정상 조직의 노출 증가와 그에 따른 2차 악성종양의 가능성에 대해 특히 IMRT에 대한 우려가 있었다.영상의 정확성을 지나치게 확신하면 계획 스캔에서 보이지 않거나(따라서 치료 계획에 포함되지 않음) 치료 도중 또는 호흡 또는 부적절한 환자 고정화로 인해 병변이 누락될 가능성이 증가할 수 있습니다.이러한 불확실성을 더 잘 제어하기 위한 새로운 기법들이 개발되고 있다. 예를 들어, 치료 빔의 실시간 조정과 결합된 실시간 영상 촬영이 그것이다.이 새로운 기술은 이미지 유도 방사선 치료 또는 4차원 방사선 치료라고 불립니다.
또 다른 기술은 종양 내부 또는 종양 근처에 이식된 하나 이상의 소형 이식형 전기 장치를 실시간으로 추적하고 국재화하는 것입니다.이를 위해 사용되는 다양한 유형의 의료용 이식 장치가 있습니다.여러 개의 전송 코일에 의해 생성된 자기장을 감지한 다음 측정값을 위치 [64]결정 시스템으로 다시 전송하는 자기 트랜스폰더일 수 있습니다.이식 가능한 장치는 RF 신호를 보내는 소형 무선 송신기일 수도 있습니다. RF 신호는 센서 어레이에 의해 수신되어 종양 [65][66]위치의 위치 파악 및 실시간 추적에 사용됩니다.
IMRT에 대해 잘 연구된 문제는 겹치는 MLC([67]다엽 콜리메이터) 잎의 확장된 혀와 홈을 통해 조사하기 때문에 원치 않는 과소 투여를 초래하는 "혀와 홈 효과"입니다.이 문제에 대한 해결책은 TG 효과를 무시할 수 있는 양으로 줄이거나 완전히 제거하는 것이지만, IMRT를 사용하는 방법에 따라 다르며, 그들 [67]중 일부는 자체 비용을 부담한다.일부 텍스트는 개구부의 양쪽 또는 한쪽이 [68]막힘으로써 "언어 및 그루브 오류"와 "언어 또는 그루브 오류"를 구분합니다.
체적변조아크치료(VMAT)
체적변조 아크 치료법(VMAT)은 2007년에 도입된 방사선[69] 기술로, 표적 체적 범위와 정상 조직의 절약에 대해 매우 적합한 선량 분포를 달성할 수 있다.이 기법의 특수성은 시술 중에 세 가지 파라미터를 수정하는 것입니다.VMAT는 갠트리(일반적으로 하나 이상의 호가 있는 360° 회전 필드), MLC(다엽 콜리메이터) 및 의료용 선형 가속기의 플루언스 출력 속도(선량 속도)를 사용하여 빔의 속도와 모양을 변경하여 방사선을 전달합니다.VMAT는 기존의 정적 [70][71]전계 강도 변조 방사선 치료(IMRT)에 비해 방사선 전달 시간이 단축되는 환자 치료에 유리하다.건강한 조직과 위험 장기(OAR)를 절약하기 위한 VMAT와 기존 IMRT 간의 비교는 암 유형에 따라 다르다.비인두암, 구강암 및 저인두암 치료에서 VMAT는 위험에 처한 장기(OAR)[69][70][71]에 동등하거나 더 나은 보호를 제공한다.전립선암 치료에서 OAR 보호 결과는 VMAT를 선호하는 일부 연구와 IMRT를 [72]선호하는 다른 연구와 혼합된다[69].
TFRT(Temporal Featheral Radio Therapy)
TFRT(Temporaly feathered radiation therapy)는 종양에 전달된 선량에 영향을 주지 않고 이러한 조직을 절약하기 위해 정상 조직 수복에 내재된 비선형성을 사용하는 것을 목표로 하는 2018년에 도입된[73] 방사선 기술이다.아직 자동화되지 않은 이 기법의 적용은 부서의 수행 능력을 향상시키기 위해 신중하게 설명되었으며, 2021년에는 그 효과가 아직 공식적으로 연구되지 않았지만 소규모 임상 [74]시험에서 실현 가능하다고 보고되었다.
자동 계획
자동화된 치료 계획은 방사선 치료 계획에 통합된 부분이 되었다.자동화 계획에는 일반적으로 두 가지 접근 방식이 있습니다.어디 치료 계획 시스템의 위험에 기관의 목표와dose-volume 히스토그램을 예측할 수 있고 높은 품질의 계획의 도서관 1)지식 기반을 두고 계획.[75]2) 다른 접근 방법 일반적으로 그리고 a을 통해 치료 계획 시스템을 둔 노련한 치료 계획을 흉내 내려고 했 프로토콜 기반 계획이라고 불린다n 반복 프로세스는 프로토콜에 [76][77][78][79]따라 계획 품질을 평가한다.
입자 요법
입자 요법(프로톤 요법)에서는 에너지 이온화 입자(프로톤 또는 탄소 이온)가 대상 종양을 향한다.[80]입자가 조직을 관통하는 동안 선량은 입자 범위의 끝 부근에서 발생하는 최대치(브래그 피크)까지 증가하며, 그 후 거의 0으로 떨어집니다.이 에너지 증착 프로파일의 장점은 표적 조직을 둘러싼 건강한 조직에 축적되는 에너지가 적다는 것입니다.
오거 요법
오거 요법(AT)은 원자 규모로 분자 변형을 제공하는 상황에서 매우 높은[81] 선량의 이온화 방사선을 사용한다.AT는 여러 측면에서 기존의 방사선 치료와 다르다. 세포 차원에서 세포 방사선 손상을 일으키기 위해 방사성 핵에 의존하지 않으며, 표적 조직/장기 위치 밖의 선량이 감소된 표적 영역에 선량을 전달하기 위해 다른 방향에서 영점까지 여러 개의 외부 연필 빔을 결합하지 않는다.대신 AT를 이용한 매우 높은 선량의 현장 전달은 해당 분자 구조와 관련된 세포 대사 기능뿐만 아니라, 분자 파괴 및 분자 재배열을 포함한 현장 분자 변형을 목표로 한다.
움직임 보정
많은 유형의 외부 빔 방사선 치료에서 움직임은 대상 조직을 의도된 빔 경로 밖으로 이동하거나 다른 건강한 조직으로 이동함으로써 치료 전달에 부정적인 영향을 미칠 수 있습니다.치료 중 신체의 큰 움직임을 방지하기 위해 어떤 형태의 환자 고정화가 일반적이지만, 예를 들어 호흡의 결과로 인해 모든 움직임을 막을 수는 없습니다.이와 [82][83]같은 움직임을 설명하기 위해 몇 가지 기술이 개발되었습니다.딥 인스펙션 호흡 홀드(DIBH)는 심장에 방사선을 조사하는 것을 피하는 것이 중요한 유방 치료에 일반적으로 사용됩니다.DIBH에서 환자는 숨을 들이마신 후 숨을 참으며 치료 빔이 켜질 수 있는 안정적인 위치를 제공합니다.이 작업은 회전 속도계나 카메라 및 [84]마커와 같은 외부 모니터링 시스템을 사용하여 자동으로 수행할 수 있습니다.환자가 자유롭게 호흡하고 빔이 호흡 [85]주기의 특정 지점에서만 체결되는 호흡 동기 치료에도 4DCT 영상과 동일한 모니터링 기법이 적용될 수 있습니다.다른 기법으로는 4DCT 영상을 사용하여 움직임을 설명하는 여백과 함께 시술 소파(빔)의 능동적인 움직임, [86]즉 움직임을 따르는 치료를 계획하는 방법이 있습니다.
접촉 X선 완골 요법
컨택트 엑스레이 브라키테라피("CXB", "전자 브라키테라피" 또는 "파필론 기술")는 직장암을 치료하기 위해 종양 가까이에 적용된 킬로볼륨 엑스레이를 사용하는 방사선 치료의 일종이다.이 과정은 항문을 통해 직장으로 X선 관을 삽입하고 그것을 암 조직에 대는 것을 포함하며, 그러면 높은 양의 X선이 2주 간격으로 종양으로 직접 방출됩니다.일반적으로 [87][88][89]수술 대상이 아닐 수 있는 환자의 조기 직장암 치료에 사용됩니다.2015년 NICE 리뷰에서 주요 부작용은 약 38%의 사례에서 발생한 출혈과 27%의 [87]사례에서 발생한 방사선 유도 궤양으로 나타났다.
완치요법(봉합원 방사선 치료)
완치요법은 방사선원을 치료가 필요한 부위의 내부 또는 옆에 배치함으로써 전달된다.브라키테라피는 [90]자궁경부암,[91] 전립선암, 유방암,[92] 피부암에[93] 대한 효과적인 치료법으로 흔히 사용되며 다른 많은 신체 [94]부위의 종양 치료에도 사용될 수 있습니다.
완치요법에서는 방사선원을 암종양 부위에 정확히 배치한다.이는 방사선이 매우 국소적인 영역에만 영향을 미친다는 것을 의미한다. 즉, 선원에서 멀리 떨어진 건강한 조직의 방사선에 대한 노출이 감소한다.이러한 브라키테라피의 특성은 외부 빔 방사선 치료보다 이점을 제공한다. 종양은 매우 높은 국부 방사선량으로 치료될 수 있는 동시에 주변의 건강한 [94][95]조직에 대한 불필요한 손상 가능성을 감소시킬 수 있다.완치요법 코스는 다른 방사선 치료 기술보다 짧은 시간 내에 완료될 수 있습니다.이는 각 방사선 치료 [95]용량 사이의 간격으로 암세포가 분열하고 성장할 가능성을 감소시키는 데 도움이 될 수 있다.
유방 완두치료의 국소적 성질의 한 예로서, SAVI 장치는 각각 개별적으로 제어할 수 있는 여러 카테터를 통해 방사선량을 전달한다.이 접근법은 외부 빔 방사선 치료와 유방 완치 [96]치료의 오래된 방법 모두에 비해 건강한 조직의 노출과 그에 따른 부작용을 감소시킨다.
방사성핵종 치료
방사성핵종 치료(시스템 방사성 동위원소 치료, 방사선 의약품 치료 또는 분자 방사선 치료라고도 함)는 표적 치료의 한 형태이다.표적은 다른 신체 장기보다 갑상선에 의해 수천 배 더 잘 흡수되는 방사성 요오드 같은 동위원소의 화학적 특성 때문일 수 있다.방사성 동위원소를 표적 조직으로 유도하기 위해 다른 분자 또는 항체에 부착함으로써 표적화도 가능하다.방사성 동위원소는 주입(혈류 내) 또는 섭취를 통해 공급된다.예를 들어 신경아세포종 치료를 위한 메타요오드벤질구아니딘(MIBG), 갑상선암 또는 갑상선독성증 치료를 위한 구강요오드-131 및 신경내분비종 치료를 위한 호르몬 결합 루테튬-177 및 이트륨-90의 주입(펩타이드 수용체 방사성핵종 치료)이 있다.
또 다른 예는 간동맥에 방사성 이트륨-90 또는 홀뮴-166 마이크로스피어를 주입하여 간종양이나 간전이를 방사화하는 것이다.이러한 미세구는 선택적 내부 방사선 치료로 알려진 치료 접근법에 사용됩니다.미세구는 지름이 약 30 µm(인간의 머리카락의 약 3분의 1)이며 종양에 혈액을 공급하는 동맥으로 직접 전달됩니다.이러한 치료는 카테터를 다리의 대퇴동맥을 통해 위로 유도하고, 원하는 대상 부위로 이동하여 치료를 시행하는 것으로 시작합니다.종양을 채우는 혈액은 미세구를 종양으로 직접 운반하여 기존의 전신 화학요법보다 더 선별적인 접근을 가능하게 합니다.현재 세 가지 종류의 마이크로스피어가 있습니다. SIR-Spees, TheraSphere 및 QuiremSpees입니다.
전신 방사성 동위원소 요법의 주요 용도는 암으로 인한 뼈 전이 치료에 있다.방사성 동위원소는 골격 손상 부위로 선택적으로 이동하며 손상되지 않은 정상적인 뼈를 확보합니다.뼈 전이 치료에 일반적으로 사용되는 동위원소는 라듐-223,[97] 스트론튬-89 및 사마륨(153Sm) 렉시드로남이다.[98]
2002년 미국 식품의약국(FDA)은 이트륨-90에 [99]결합된 항CD20 모노클로널 항체인 이브리투모맙 티우세탄(제발린)을 승인했다.2003년 FDA는 라벨이 부착된 요오드-131과 라벨이 부착되지 않은 항CD20 모노클로널 [100]항체의 조합인 토시투맵/요오드(131I) 토시투모맵 레지멘(Bexar)을 승인했다.이 약물들은 방사선 면역 요법으로 알려진 최초의 약제였고, 그것들은 난치성 비호지킨 림프종 치료에 승인되었다.
수술 중 방사선 치료
수술중 방사선치료(IORT)는 암종양과 같은 대상 부위에 치료용 수준의 방사선을 적용하는 것으로 수술 [101]중 해당 영역이 노출된다.
근거
IORT의 근거는 IORT 동안 대체되거나 차폐되는 주변 조직의 노출을 최소화하면서 목표 영역에 정확하게 높은 선량의 방사선을 전달하는 것이다.종양의 외과적 제거 후 외부 빔 방사선 치료(EBRT)와 같은 기존 방사선 기법에는 다음과 같은 몇 가지 단점이 있습니다.현대의 방사선 치료 계획을 사용해도 상처강의 국소화가 복잡하기 때문에 가장 높은 선량을 적용해야 하는 종양상을 놓치는 경우가 많다.또한 종양의 외과적 제거와 EBRT 사이의 통상적인 지연은 종양 세포의 재수입을 허용할 수 있다.이러한 잠재적인 유해한 영향은 대상 조직에 방사선을 보다 정확하게 전달하여 잔류 종양 세포의 즉각적인 멸균을 유도함으로써 피할 수 있습니다.또 다른 측면은 상처액이 종양세포에 자극적인 영향을 준다는 것이다.IORT는 상처액의 [102]자극적인 효과를 억제하는 것으로 밝혀졌다.
역사

의학은 100년 이상 암 치료제로 방사선 치료를 사용해 왔으며, 최초의 뿌리는 1895년 빌헬름 뢴트겐에 [103]의해 X선이 발견된 것에서 유래했다.시카고의 에밀 그루브는 아마도 [104]1896년부터 암 치료에 엑스레이를 사용한 최초의 미국인 의사였을 것이다.
방사선 치료 분야는 1898년 방사성 원소인 폴로늄과 라듐을 발견한 노벨상 수상 과학자 마리 퀴리의 획기적인 연구로 1900년대 초에 성장하기 시작했다.이것은 치료와 [103]연구에 새로운 시대를 열었다.1920년대에는 방사선 피폭의 위험이 이해되지 않았고 방호 장치가 거의 사용되지 않았다.라듐은 넓은 치료력을 가지고 있다고 믿어졌고 방사선 치료는 많은 질병에 적용되었다.
제2차 세계대전 이전에는 방사선 치료를 위한 유일한 실질적인 방사선 공급원은 라듐, 라돈 가스 및 X선 튜브였다.외부 빔 방사선 치료(텔레테라피)는 21세기 초에 비교적 낮은 전압(150 kV 미만)의 X선 기계로 시작되었다.표면 종양은 저전압 X선으로 치료할 수 있지만, 체내 종양에 도달하기 위해서는 보다 투과적이고 높은 에너지 빔이 필요하여 더 높은 전압을 필요로 하는 것으로 밝혀졌다.200~500kV의 튜브 전압을 사용한 직교 전압 X선은 1920년대에 사용되기 시작했다.개입된 피부와 조직을 위험한 방사선량에 노출시키지 않고 가장 깊이 묻힌 종양에 도달하려면 "메가볼트"라고 불리는 1 MV 이상의 에너지를 가진 광선이 필요했다.메가볼트 X선을 생성하려면 X선 튜브에 3백만에서 5백만 볼트의 전압이 필요했고, 이는 엄청난 비용이 드는 설치가 필요했다.메가볼트 X선 장치는 1930년대 후반에 처음 제작되었지만 비용 때문에 일부 기관에 국한되었습니다.세인트루이스에 설치된 첫 번째 장치 중 하나. 1937년 런던에서 1960년까지 사용된 바르톨로뮤의 병원은 30피트 길이의 X선 튜브를 사용했으며 무게는 10톤이었다.라듐은 메가볼트 감마선을 발생시켰지만 광석 발생이 적기 때문에 매우 드물고 비쌌다.1937년에 방사선 치료를 위한 라듐의 전 세계 공급량은 50그램이었고, 그 가치는 80만 파운드, 2005년에는 5천만 달러였다.
제2차 세계대전 중 맨해튼 프로젝트의 원자로 발명으로 방사선 치료를 위한 인공 방사성 동위원소 생산이 가능해졌다.코발트 치료기, 코발트-60이 방출하는 메가볼트 감마선을 이용한 텔레테라피기, 코발트 치료기는 1950년대부터 1980년대 초 사이에 이 분야에 혁명을 일으켰다.코발트 기계는 5.27년의 반감기로 인해 약 5년마다 코발트를 교체해야 했지만 비교적 저렴하고 견고하며 사용이 간편했습니다.
1940년대부터 개발된 의료용 선형 입자 가속기는 1980년대에 X선과 코발트 단위를 대체하기 시작했고, 이러한 오래된 치료법은 현재 쇠퇴하고 있다.최초의 의료용 선형 가속기는 [56]1953년 런던의 해머스미스 병원에서 사용되었다.선형 가속기는 더 높은 에너지를 생산할 수 있고, 더 많은 시준된 빔을 가질 수 있으며, 방사성 동위원소 치료와 같은 부수적인 처리 문제와 함께 방사성 폐기물을 생성하지 않는다.
1971년 Godfrey Hounsfield의 컴퓨터 단층 촬영(CT) 발명과 함께, 3차원 계획이 가능해졌고 2-D에서 3-D 방사선 전달로 전환되었다.CT 기반 계획을 통해 의사는 환자 해부학의 Axial 단층 촬영 영상을 사용하여 선량 분포를 보다 정확하게 결정할 수 있습니다.1970년대 자기공명영상(MRI)과 1980년대 양전자방출단층촬영(PET) 등 새로운 영상기술의 등장으로 방사선 치료는 3D 준거에서 강도변조방사선치료(IMRT)와 영상유도방사선치료(IGRT)로 옮겨갔다.이러한 진보를 통해 방사선 종양학자는 종양을 더 잘 보고 목표로 삼을 수 있었고, 이는 더 나은 치료 결과, 더 많은 장기 보존, 그리고 [105]더 적은 부작용을 낳았다.
전 세계적으로 방사선 치료 접근성이 개선되고 있지만,[106] 2017년 현재 저소득 및 중산층 국가의 환자 중 절반 이상이 여전히 방사선 치료를 이용할 수 없다.
「 」를 참조해 주세요.
레퍼런스
- ^ CK 봄포드, IH 쿤클러, J 월터월터와 밀러의 방사선 치료 교과서 (제6판), p311
- ^ GP 노트북의 '방사능 감응성' http://www.gpnotebook.co.uk/simplepage.cfm?ID=2060451853
- ^ patient.co.uk의 "방사선 치료 - GP가 알아야 할 사항" http://patient.info/doctor/radiotherapy
- ^ Maverakis E, Cornelius LA, Bowen GM, Phan T, Patel FB, Fitzmaurice S, et al. (May 2015). "Metastatic melanoma - a review of current and future treatment options". Acta Dermato-Venereologica. 95 (5): 516–24. doi:10.2340/00015555-2035. PMID 25520039.
- ^ a b c Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ(Eds) 암관리: 다원적 접근법. 2008년 11월호.
- ^ Falls KC, Sharma RA, Lawrence YR, Amos RA, Advani SJ, Ahmed MM, Vikram B, Coleman CN, Prasanna PG (September 2018). "Radiation-Drug Combinations to Improve Clinical Outcomes and Reduce Normal Tissue Toxicities: Current Challenges and New Approaches: Report of the Symposium Held at the 63rd Annual Meeting of the Radiation Research Society, 15-18 October 2017; Cancun, Mexico". Radiation Research. Europe PMC. 190 (4): 350–360. Bibcode:2018RadR..190..350F. doi:10.1667/rr15121.1. PMC 6322391. PMID 30280985.
- ^ Seidlitz A, Combs SE, Debus J, Baumann M (2016). "Practice points for radiation oncology". In Kerr DJ, Haller DG, van de Velde CJ, Baumann M (eds.). Oxford Textbook of Oncology. Oxford University Press. p. 173. ISBN 9780191065101.
- ^ Darby S, McGale P, Correa C, Taylor C, Arriagada R, Clarke M, et al. (November 2011). "Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death: meta-analysis of individual patient data for 10,801 women in 17 randomised trials". Lancet. 378 (9804): 1707–16. doi:10.1016/S0140-6736(11)61629-2. PMC 3254252. PMID 22019144.
- ^ Mahmood SS, Nohria A (July 2016). "Cardiovascular Complications of Cranial and Neck Radiation". Current Treatment Options in Cardiovascular Medicine. 18 (7): 45. doi:10.1007/s11936-016-0468-4. PMID 27181400. S2CID 23888595.
- ^ "Radiation Therapy for Breast Cancer: Possible Side Effects". Rtanswers.com. 2012-03-15. Archived from the original on 2012-03-01. Retrieved 2012-04-20.
- ^ Lee VH, Ng SC, Leung TW, Au GK, Kwong DL (September 2012). "Dosimetric predictors of radiation-induced acute nausea and vomiting in IMRT for nasopharyngeal cancer". International Journal of Radiation Oncology, Biology, Physics. 84 (1): 176–82. doi:10.1016/j.ijrobp.2011.10.010. PMID 22245210.
- ^ "Archived copy". Archived from the original on 2012-03-30. Retrieved 2012-05-02.
{{cite web}}: CS1 maint: 제목으로 보관된 복사(링크) 일반적인 방사선 부작용 - ^ "Radiation Therapy Side Effects and Ways to Manage them". National Cancer Institute. 2007-04-20. Retrieved 2012-05-02.
- ^ Hall, Eric J. (2000). Radiobiology for the radiologist. Philadelphia: Lippincott Williams Wilkins. p. 351. ISBN 9780781726498.
- ^ Carretero C, Munoz-Navas M, Betes M, Angos R, Subtil JC, Fernandez-Urien I, et al. (June 2007). "Gastroduodenal injury after radioembolization of hepatic tumors" (PDF). The American Journal of Gastroenterology. 102 (6): 1216–20. doi:10.1111/j.1572-0241.2007.01172.x. hdl:10171/27487. PMID 17355414. S2CID 121385.
- ^ Yip D, Allen R, Ashton C, Jain S (March 2004). "Radiation-induced ulceration of the stomach secondary to hepatic embolization with radioactive yttrium microspheres in the treatment of metastatic colon cancer". Journal of Gastroenterology and Hepatology. 19 (3): 347–9. doi:10.1111/j.1440-1746.2003.03322.x. PMID 14748889. S2CID 39434006.
- ^ Murthy R, Brown DB, Salem R, Meranze SG, Coldwell DM, Krishnan S, et al. (April 2007). "Gastrointestinal complications associated with hepatic arterial Yttrium-90 microsphere therapy". Journal of Vascular and Interventional Radiology. 18 (4): 553–61, quiz 562. doi:10.1016/j.jvir.2007.02.002. PMID 17446547.
- ^ Arepally A, Chomas J, Kraitchman D, Hong K (April 2013). "Quantification and reduction of reflux during embolotherapy using an antireflux catheter and tantalum microspheres: ex vivo analysis". Journal of Vascular and Interventional Radiology. 24 (4): 575–80. doi:10.1016/j.jvir.2012.12.018. PMID 23462064.
- ^ a b Henson, Caroline C; Burden, Sorrel; Davidson, Susan E; Lal, Simon (2013-11-26). "Nutritional interventions for reducing gastrointestinal toxicity in adults undergoing radical pelvic radiotherapy". Cochrane Database of Systematic Reviews (11): CD009896. doi:10.1002/14651858.cd009896.pub2. ISSN 1465-1858. PMID 24282062.
- ^ Meek AG (December 1998). "Breast radiotherapy and lymphedema". Cancer. 83 (12 Suppl American): 2788–97. doi:10.1002/(SICI)1097-0142(19981215)83:12B+<2788::AID-CNCR27>3.0.CO;2-I. PMID 9874399. S2CID 23963700.
- ^ Kamran SC, Berrington de Gonzalez A, Ng A, Haas-Kogan D, Viswanathan AN (June 2016). "Therapeutic radiation and the potential risk of second malignancies". Cancer. 122 (12): 1809–21. doi:10.1002/cncr.29841. PMID 26950597.
- ^ Dracham CB, Shankar A, Madan R (June 2018). "Radiation induced secondary malignancies: a review article". Radiation Oncology Journal. 36 (2): 85–94. doi:10.3857/roj.2018.00290. PMC 6074073. PMID 29983028.
At present after surviving from a primary malignancy, 17%–19% patients develop second malignancy. ... [Radiotherapy] contributes to only about 5% of the total treatment related second malignancies. However the incidence of only radiation on second malignancies is difficult to estimate...
- ^ Mohamad O, Tabuchi T, Nitta Y, Nomoto A, Sato A, Kasuya G, et al. (May 2019). "Risk of subsequent primary cancers after carbon ion radiotherapy, photon radiotherapy, or surgery for localised prostate cancer: a propensity score-weighted, retrospective, cohort study". The Lancet. Oncology. 20 (5): 674–685. doi:10.1016/S1470-2045(18)30931-8. PMID 30885458. S2CID 83461547.
- ^ Facoetti A, Barcellini A, Valvo F, Pullia M (September 2019). "The Role of Particle Therapy in the Risk of Radio-induced Second Tumors: A Review of the Literature". Anticancer Research. 39 (9): 4613–4617. doi:10.21873/anticanres.13641. PMID 31519558. S2CID 202572547.
- ^ Ohno T, Okamoto M (June 2019). "Carbon ion radiotherapy as a treatment modality for paediatric cancers". The Lancet Child & Adolescent Health. 3 (6): 371–372. doi:10.1016/S2352-4642(19)30106-3. PMID 30948250. S2CID 96433438.
- ^ Taylor CW, Nisbet A, McGale P, Darby SC (December 2007). "Cardiac exposures in breast cancer radiotherapy: 1950s-1990s". International Journal of Radiation Oncology, Biology, Physics. 69 (5): 1484–95. doi:10.1016/j.ijrobp.2007.05.034. PMID 18035211.
- ^ a b Weintraub NL, Jones WK, Manka D (March 2010). "Understanding radiation-induced vascular disease". Journal of the American College of Cardiology. 55 (12): 1237–9. doi:10.1016/j.jacc.2009.11.053. PMC 3807611. PMID 20298931.
- ^ a b Klee NS, McCarthy CG, Martinez-Quinones P, Webb RC (November 2017). "Out of the frying pan and into the fire: damage-associated molecular patterns and cardiovascular toxicity following cancer therapy". Therapeutic Advances in Cardiovascular Disease. 11 (11): 297–317. doi:10.1177/1753944717729141. PMC 5933669. PMID 28911261.
- ^ "Late Effects of Treatment for Childhood Cancer". National Cancer Institute. 12 April 2012. Retrieved 7 June 2012.
- ^ Hauer-Jensen M, Denham JW, Andreyev HJ (August 2014). "Radiation enteropathy--pathogenesis, treatment and prevention". Nature Reviews. Gastroenterology & Hepatology. 11 (8): 470–9. doi:10.1038/nrgastro.2014.46. PMC 4346191. PMID 24686268.
- ^ Fuccio L, Guido A, Andreyev HJ (December 2012). "Management of intestinal complications in patients with pelvic radiation disease". Clinical Gastroenterology and Hepatology. 10 (12): 1326–1334.e4. doi:10.1016/j.cgh.2012.07.017. PMID 22858731.
- ^ a b Christian Custodio; Cody Christian Andrews (August 1, 2017). "Radiation Plexopathy". American Academy of Physical Medicine and Rehabilitation.

- ^ a b c d e Delanian S, Lefaix JL, Pradat PF (December 2012). "Radiation-induced neuropathy in cancer survivors". Radiotherapy and Oncology. 105 (3): 273–82. doi:10.1016/j.radonc.2012.10.012. PMID 23245644.
- ^ a b "Radiation Necrosis: Background, Pathophysiology, Epidemiology". 2019-11-09.
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ Nieder C, Milas L, Ang KK (July 2000). "Tissue tolerance to reirradiation". Seminars in Radiation Oncology. 10 (3): 200–9. doi:10.1053/srao.2000.6593. PMID 11034631.
- ^ a b c d Arnon J, Meirow D, Lewis-Roness H, Ornoy A (2001). "Genetic and teratogenic effects of cancer treatments on gametes and embryos". Human Reproduction Update. 7 (4): 394–403. doi:10.1093/humupd/7.4.394. PMID 11476352. [1]
- ^ a b c d Fernandez A, Brada M, Zabuliene L, Karavitaki N, Wass JA (September 2009). "Radiation-induced hypopituitarism" (PDF). Endocrine-Related Cancer. 16 (3): 733–72. doi:10.1677/ERC-08-0231. PMID 19498038.
- ^ Bogdanich W, Ruiz RR (25 February 2010). "Missouri Hospital Reports Errors in Radiation Doses". The New York Times. Retrieved 26 February 2010.
- ^ "What Questions Should I Ask My Doctor?: Questions to ask after treatment ends". Rtanswers.com. 2010-09-22. Archived from the original on 2012-04-12. Retrieved 2012-04-20.
- ^ Eaton C, Seegenschmiedt MH, Bayat A, Gabbiani G, Werker P, Wach W (2012). Dupuytren's Disease and Related Hyperproliferative Disorders: Principles, Research, and Clinical Perspectives. Springer. pp. 355–364. ISBN 978-3-642-22696-0.
- ^ Harrison LB, Chadha M, Hill RJ, Hu K, Shasha D (2002). "Impact of tumor hypoxia and anemia on radiation therapy outcomes". The Oncologist. 7 (6): 492–508. doi:10.1634/theoncologist.7-6-492. PMID 12490737. S2CID 46682896.
- ^ Sheehan JP, Shaffrey ME, Gupta B, Larner J, Rich JN, Park DM (October 2010). "Improving the radiosensitivity of radioresistant and hypoxic glioblastoma". Future Oncology. 6 (10): 1591–601. doi:10.2217/fon.10.123. PMID 21062158.
- ^ Curtis RE, Freedman DM, Ron E, Ries LAG, Hacker DG, Edwards BK, Tucker MA, Fraumeni JF 주니어(eds)암 생존자의 새로운 악성 종양: SEER 암 등록부, 1973-2000.국립 암 연구소NIH Publ.05-5302호Bethesda, MD, 2006.
- ^ Dracham, Chinna Babu; Shankar, Abhash; Madan, Renu (30 June 2018). "Radiation induced secondary malignancies: a review article". Radiation Oncology Journal. 36 (2): 85–94. doi:10.3857/roj.2018.00290. PMC 6074073. PMID 29983028.
- ^ Baldock C, De Deene Y, Doran S, Ibbott G, Jirasek A, Lepage M, et al. (March 2010). "Polymer gel dosimetry". Physics in Medicine and Biology. 55 (5): R1-63. Bibcode:2010PMB....55R...1B. doi:10.1088/0031-9155/55/5/r01. PMC 3031873. PMID 20150687.
- ^ Ang, K. Kian (October 1998). "Altered fractionation trials in head and neck cancer". Seminars in Radiation Oncology. 8 (4): 230–236. doi:10.1016/S1053-4296(98)80020-9. PMID 9873100.
- ^ a b 그 이유는 다음과 같습니다American Academy of Hospice and Palliative Medicine, "Five Things Physicians and Patients Should Question", Choosing Wisely: an initiative of the ABIM Foundation, American Academy of Hospice and Palliative Medicine, retrieved August 1, 2013.
- Lutz S, Berk L, Chang E, Chow E, Hahn C, Hoskin P, et al. (March 2011). "Palliative radiotherapy for bone metastases: an ASTRO evidence-based guideline". International Journal of Radiation Oncology, Biology, Physics. 79 (4): 965–76. doi:10.1016/j.ijrobp.2010.11.026. PMID 21277118.
- ^ [폴락, 앨런, 만수르 아흐메드]저분할:과학적 개념과 임상 경험. 첫 번째.엘리콧시티: LimiText Publishing, 2011]
- ^ Scott JG, Berglund A, Schell MJ, Mihaylov I, Fulp WJ, Yue B, et al. (February 2017). "A genome-based model for adjusting radiotherapy dose (GARD): a retrospective, cohort-based study". The Lancet. Oncology. 18 (2): 202–211. doi:10.1016/S1470-2045(16)30648-9. PMC 7771305. PMID 27993569.
- ^ Lacombe J, Azria D, Mange A, Solassol J (February 2013). "Proteomic approaches to identify biomarkers predictive of radiotherapy outcomes". Expert Review of Proteomics. 10 (1): 33–42. doi:10.1586/epr.12.68. PMID 23414358. S2CID 39888421.
- ^ Scott JG, Sedor G, Ellsworth P, Scarborough JA, Ahmed KA, Oliver DE, et al. (August 2021). "Pan-cancer prediction of radiotherapy benefit using genomic-adjusted radiation dose (GARD): a cohort-based pooled analysis". The Lancet. Oncology. 22 (9): 1221–1229. doi:10.1016/S1470-2045(21)00347-8. PMID 34363761.
- ^ Daly MJ (March 2009). "A new perspective on radiation resistance based on Deinococcus radiodurans". Nature Reviews. Microbiology. 7 (3): 237–45. doi:10.1038/nrmicro2073. PMID 19172147. S2CID 17787568.
- ^ Sharma A, Gaidamakova EK, Grichenko O, Matrosova VY, Hoeke V, Klimenkova P, et al. (October 2017). "2+, gauged by paramagnetic resonance". Proceedings of the National Academy of Sciences of the United States of America. 114 (44): E9253–E9260. doi:10.1073/pnas.1713608114. PMC 5676931. PMID 29042516.
- ^ Doble PA, Miklos GL (September 2018). "Distributions of manganese in diverse human cancers provide insights into tumour radioresistance". Metallomics. 10 (9): 1191–1210. doi:10.1039/c8mt00110c. PMID 30027971.
- ^ Hill R, Healy B, Holloway L, Kuncic Z, Thwaites D, Baldock C (March 2014). "Advances in kilovoltage x-ray beam dosimetry". Physics in Medicine and Biology. 59 (6): R183-231. Bibcode:2014PMB....59R.183H. doi:10.1088/0031-9155/59/6/R183. PMID 24584183. S2CID 18082594.
- ^ a b Thwaites DI, Tuohy JB (July 2006). "Back to the future: the history and development of the clinical linear accelerator". Physics in Medicine and Biology. 51 (13): R343-62. Bibcode:2006PMB....51R.343T. doi:10.1088/0031-9155/51/13/R20. PMID 16790912. S2CID 7672187.
- ^ Lagendijk JJ, Raaymakers BW, Van den Berg CA, Moerland MA, Philippens ME, van Vulpen M (November 2014). "MR guidance in radiotherapy". Physics in Medicine and Biology. 59 (21): R349-69. Bibcode:2014PMB....59R.349L. doi:10.1088/0031-9155/59/21/R349. PMID 25322150. S2CID 2591566.
- ^ "American Society for Radiation Oncology" (PDF). Astro.org. Archived from the original (PDF) on 2010-06-13. Retrieved 2012-04-20.
- ^ "Treatment Types: Stereotactic Radiation Therapy". Rtanswers.com. 2010-01-04. Archived from the original on 2012-05-09. Retrieved 2012-04-20.
- ^ Bucci MK, Bevan A, Roach M (2005). "Advances in radiation therapy: conventional to 3D, to IMRT, to 4D, and beyond". CA: A Cancer Journal for Clinicians. 55 (2): 117–34. doi:10.3322/canjclin.55.2.117. PMID 15761080.
- ^ Galvin JM, Ezzell G, Eisbrauch A, Yu C, Butler B, Xiao Y, et al. (April 2004). "Implementing IMRT in clinical practice: a joint document of the American Society for Therapeutic Radiology and Oncology and the American Association of Physicists in Medicine". International Journal of Radiation Oncology, Biology, Physics. 58 (5): 1616–34. doi:10.1016/j.ijrobp.2003.12.008. PMID 15050343.
- ^ "Intensity Modulated Radiation Therapy". Irsa.org. Retrieved 2012-04-20.
- ^ Hall EJ, Wuu CS (May 2003). "Radiation-induced second cancers: the impact of 3D-CRT and IMRT". International Journal of Radiation Oncology, Biology, Physics. 56 (1): 83–8. doi:10.1016/S0360-3016(03)00073-7. PMID 12694826.
- ^ Maleki T, Papiez L, Ziaie B (August 2010). "Magnetic tracking system for radiation therapy". IEEE Transactions on Biomedical Circuits and Systems. 4 (4): 223–31. doi:10.1109/TBCAS.2010.2046737. PMID 23853368. S2CID 25639614.
- ^ M. Pourhomayoun; M. L. Fowler; Z. Jin. "A Novel Method for Tumor Localization and Tracking in Radiation Therapy". IEEE Asilomar Conference on Signals, Systems and Computers, 2012.
- ^ M. Pourhomayoun; M. L. Fowler; Z. Jin. "Robustness Analysis of Sparsity Based Tumor Localization under Tissue Configuration Uncertainty". IEEE Signal Processing in Medicine and Biology Symposium (SPMB12), 2012.
- ^ a b S. Webb (1 October 2004). Contemporary IMRT: Developing Physics and Clinical Implementation. CRC Press. pp. 77–80. ISBN 978-1-4200-3453-0.
- ^ Mikhail J. Atallah; Marina Blanton (20 November 2009). Algorithms and Theory of Computation Handbook, Volume 2: Special Topics and Techniques. CRC Press. p. 7. ISBN 978-1-58488-821-5.
- ^ a b c Teoh M, Clark CH, Wood K, Whitaker S, Nisbet A (November 2011). "Volumetric modulated arc therapy: a review of current literature and clinical use in practice". The British Journal of Radiology. 84 (1007): 967–96. doi:10.1259/bjr/22373346. PMC 3473700. PMID 22011829.
- ^ a b Bertelsen A, Hansen CR, Johansen J, Brink C (May 2010). "Single Arc Volumetric Modulated Arc Therapy of head and neck cancer". Radiotherapy and Oncology. 95 (2): 142–8. doi:10.1016/j.radonc.2010.01.011. PMID 20188427.
- ^ a b Van Gestel D, van Vliet-Vroegindeweij C, Van den Heuvel F, Crijns W, Coelmont A, De Ost B, et al. (February 2013). "RapidArc, SmartArc and TomoHD compared with classical step and shoot and sliding window intensity modulated radiotherapy in an oropharyngeal cancer treatment plan comparison". Radiation Oncology. 8 (37): 37. doi:10.1186/1748-717X-8-37. PMC 3599972. PMID 23425449.
- ^ Biegała M, Hydzik A (2016). "Analysis of dose distribution in organs at risk in patients with prostate cancer treated with the intensity-modulated radiation therapy and arc technique". Journal of Medical Physics. 41 (3): 198–204. doi:10.4103/0971-6203.189490. PMC 5019039. PMID 27651567.
- ^ Lopez-Alfonso JC, Parsai S, Joshi N, Godley A, Shah C, Koyfman SA, Caudell JJ, Fuller CD, Enderling H, Scott JG (July 2018). "Temporally feathered intensity-modulated radiation therapy: A planning technique to reduce normal tissue toxicity". Medical Physics. 45 (7): 3466–3474. Bibcode:2018MedPh..45.3466L. doi:10.1002/mp.12988. PMC 6041138. PMID 29786861.
- ^ Parsai S, Qiu LJ, Qi P, Sedor G, Fuller CD, Murray E, Majkszak D, Dorio N, Koyfman SA, Woody N, Joshi N, Scott JG (August 2021). "In vivo assessment of the safety of standard fractionation Temporally Feathered Radiation Therapy (TFRT) for head and neck squamous cell carcinoma: An R-IDEAL Stage 1/2a first-in-humans/feasibility demonstration of new technology implementation". Radiotherapy and Oncology. 163: 39–45. doi:10.1016/j.radonc.2021.07.023. PMID 34333086. S2CID 236776179.
- ^ Fogliata A, Belosi F, Clivio A, Navarria P, Nicolini G, Scorsetti M, et al. (December 2014). "On the pre-clinical validation of a commercial model-based optimisation engine: application to volumetric modulated arc therapy for patients with lung or prostate cancer". Radiotherapy and Oncology. 113 (3): 385–91. doi:10.1016/j.radonc.2014.11.009. PMID 25465726.
- ^ Hazell I, Bzdusek K, Kumar P, Hansen CR, Bertelsen A, Eriksen JG, et al. (January 2016). "Automatic planning of head and neck treatment plans". Journal of Applied Clinical Medical Physics. 17 (1): 272–282. doi:10.1120/jacmp.v17i1.5901. PMC 5690191. PMID 26894364.
- ^ Hansen CR, Bertelsen A, Hazell I, Zukauskaite R, Gyldenkerne N, Johansen J, et al. (December 2016). "Automatic treatment planning improves the clinical quality of head and neck cancer treatment plans". Clinical and Translational Radiation Oncology. 1: 2–8. doi:10.1016/j.ctro.2016.08.001. PMC 5893480. PMID 29657987.
- ^ Hansen CR, Nielsen M, Bertelsen AS, Hazell I, Holtved E, Zukauskaite R, et al. (November 2017). "Automatic treatment planning facilitates fast generation of high-quality treatment plans for esophageal cancer". Acta Oncologica. 56 (11): 1495–1500. doi:10.1080/0284186X.2017.1349928. PMID 28840767.
- ^ Roach D, Wortel G, Ochoa C, Jensen HR, Damen E, Vial P, Janssen T, Hansen CR (2019-04-01). "Adapting automated treatment planning configurations across international centres for prostate radiotherapy". Physics and Imaging in Radiation Oncology. 10: 7–13. doi:10.1016/j.phro.2019.04.007. PMC 7807573. PMID 33458261.
- ^ Laurance, Jeremy (12 January 2009). "Brain tumor patient 'unaware' treatment was available on NHS". The Independent. Archived from the original on 22 June 2009. Retrieved 10 April 2009.
- ^ Kereiakes JG, Rao DV (1992). "Auger electron dosimetry: report of AAPM Nuclear Medicine Committee Task Group No. 6". Medical Physics. 19 (6): 1359. Bibcode:1992MedPh..19.1359K. doi:10.1118/1.596925. PMID 1461197.
- ^ Bert, C; Durante, M (21 August 2011). "Motion in radiotherapy: particle therapy". Physics in Medicine and Biology. 56 (16): R113–R144. Bibcode:2011PMB....56R.113B. doi:10.1088/0031-9155/56/16/R01. PMID 21775795. S2CID 22259256.
- ^ Guckenberger, Matthias; Richter, Anne; Boda-Heggemann, Judit; Lohr, Frank (2012). "Motion Compensation in Radiotherapy". Critical Reviews in Biomedical Engineering. 40 (3): 187–197. doi:10.1615/critrevbiomedeng.v40.i3.30. PMID 22694199.
- ^ Latty, Drew; Stuart, Kirsty E.; Wang, Wei; Ahern, Verity (March 2015). "Review of deep inspiration breath‐hold techniques for the treatment of breast cancer". Journal of Medical Radiation Sciences. 62 (1): 74–81. doi:10.1002/jmrs.96. PMC 4364809. PMID 26229670.
- ^ Mageras, G; Yorke, E (January 2004). "Deep inspiration breath hold and respiratory gating strategies for reducing organ motion in radiation treatment". Seminars in Radiation Oncology. 14 (1): 65–75. doi:10.1053/j.semradonc.2003.10.009. PMID 14752734.
- ^ Boda-Heggemann, Judit; Knopf, Antje-Christin; Simeonova-Chergou, Anna; Wertz, Hansjörg; Stieler, Florian; Jahnke, Anika; Jahnke, Lennart; Fleckenstein, Jens; Vogel, Lena; Arns, Anna; Blessing, Manuel; Wenz, Frederik; Lohr, Frank (March 2016). "Deep Inspiration Breath Hold—Based Radiation Therapy: A Clinical Review". International Journal of Radiation Oncology, Biology, Physics. 94 (3): 478–492. doi:10.1016/j.ijrobp.2015.11.049. hdl:11380/1172411. PMID 26867877.
- ^ a b "Contact X-ray Brachytherapy for early rectal cancer". National Institute for Health and Care Excellence. September 2015.
- ^ Sun Myint A, Gerard J, Myerson RJ (2014). "Contact X-Ray Brachytherapy for Rectal Cancer". In Longo WE, Reddy V, Audisio RA (eds.). Modern Management of Cancer of the Rectum. Springer. pp. 109ff. ISBN 9781447166092.
- ^ American Association of Physicists in Medicine (February 2009). "The 2007 AAPM response to the CRCPD request for recommendations for the CRCPD's model regulations for electronic brachytherapy" (PDF). American Association of Physicists in Medicine. Retrieved 17 April 2010.
- ^ Gerbaulet A, et al. (2005). "Cervix carcinoma". In Gerbaulet A, Pötter R, Mazeron J, Limbergen EV (eds.). The GEC ESTRO handbook of brachytherapy. Belgium: ACCO.
- ^ Ash D, et al. (2005). "Prostate cancer". In Gerbaulet A, Pötter R, Mazeron J, Limbergen EV (eds.). The GEC ESTRO handbook of brachytherapy. Belgium: ACCO.
- ^ Van Limbergen E, et al. (2005). "Breast cancer". In Gerbaulet A, Pötter R, Mazeron J, Limbergen EV (eds.). The GEC ESTRO handbook of brachytherapy. Belgium: ACCO.
- ^ Van Limbergen E, et al. (2005). "Skin cancer". In Gerbaulet A, Pötter R, Mazeron J, Limbergen EV (eds.). The GEC ESTRO handbook of brachytherapy. Belgium: ACCO.
- ^ a b Gerbaulet A, et al. (2005). "General aspects". In Gerbaulet A, Pötter R, Mazeron J, Limbergen EV (eds.). The GEC ESTRO handbook of brachytherapy. Belgium: ACCO.
- ^ a b Stewart AJ; et al. (2007). "Radiobiological concepts for brachytherapy". In Devlin P (ed.). Brachytherapy. Applications and Techniques. Philadelphia: LWW.
- ^ Yashar CM, Blair S, Wallace A, Scanderbeg D (2009). "Initial clinical experience with the Strut-Adjusted Volume Implant brachytherapy applicator for accelerated partial breast irradiation". Brachytherapy. 8 (4): 367–72. doi:10.1016/j.brachy.2009.03.190. PMID 19744892.
- ^ Parker C, Nilsson S, Heinrich D, Helle SI, O'Sullivan JM, Fosså SD, et al. (July 2013). "Alpha emitter radium-223 and survival in metastatic prostate cancer". The New England Journal of Medicine. 369 (3): 213–23. doi:10.1056/NEJMoa1213755. PMID 23863050.
- ^ Sartor O (2004). "Overview of samarium sm 153 lexidronam in the treatment of painful metastatic bone disease". Reviews in Urology. 6 Suppl 10 (Suppl 10): S3–S12. PMC 1472939. PMID 16985930.
- ^ FDA, 2009년 1월 19일 웨이백 머신에서 보관된 비호지킨 림프종 치료를 위한 최초의 방사선 의약품 승인
- ^ Tositumomab 및 Iood I 131 Tositumomab – 제품 승인 정보 – 라이선스 액션은 2009년 5월 13일 Wayback Machine에서 아카이브되었습니다.
- ^ Dutta SW, Showalter SL, Showalter TN, Libby B, Trifiletti DM (April 2017). "Intraoperative radiation therapy for breast cancer patients: current perspectives". Breast Cancer: Targets and Therapy. 9: 257–263. doi:10.2147/BCTT.S112516. PMC 5402914. PMID 28458578.
- ^ Belletti B, Vaidya JS, D'Andrea S, Entschladen F, Roncadin M, Lovat F, et al. (March 2008). "Targeted intraoperative radiotherapy impairs the stimulation of breast cancer cell proliferation and invasion caused by surgical wounding". Clinical Cancer Research. 14 (5): 1325–32. doi:10.1158/1078-0432.CCR-07-4453. PMID 18316551.
- ^ a b "University of Alabama at Birmingham Comprehensive Cancer Center, History of Radiation Oncology". Archived from the original (from the Wayback Machine) on 2008-01-05.
- ^ "News of Science". Science. New Series. 125 (3236): 18–22. January 1957. Bibcode:1957Sci...125T..18.. doi:10.1126/science.125.3236.18. JSTOR 1752791. PMID 17835363.
- ^ "History of Radiation Therapy: The Evolution of Therapeutic Radiology". Rtanswers.com. 2010-03-31. Archived from the original on 2012-03-01. Retrieved 2012-04-20.
- ^ "Closing in on cancer". The Economist. 16 September 2017. Retrieved 25 September 2017.
추가 정보
- Ash D, Dobbs J, Barrett, A (1999). Practical radiation therapy planning. London: Arnold. ISBN 978-0-340-70631-2.
{{cite book}}: CS1 maint: 여러 이름: 작성자 목록(링크) - Lawrence Chin, MD and William Regine, MD, Editors (2008). Principles of Stereotactic Surgery. Berlin: Springer. ISBN 978-0-387-71069-3.
{{cite book}}:author=범용명(도움말)이 있습니다.CS1 유지: 여러 이름: 작성자 목록(링크) - Mayles, P; Rosenwald, JC; Nahum, A (2007). Handbook of Radiation therapy Physics: Theory and Practice. Taylor & Francis. ISBN 978-0-7503-0860-1.
- 맥게리, M(2002년).치료에서의 방사선 치료.AUSG 북스
- Williams JR, Thwaites DI (1993). Radiation therapy physics in practice. Oxford [Oxfordshire]: Oxford University Press. ISBN 978-0-19-963315-9.
외부 링크
- 정보
- 인간 건강 캠퍼스 방사능 의학 전문가들을 위한 국제 원자력 기구의 공식 웹사이트.이 사이트는 핵과학 및 응용학과 인간보건과에서 관리한다.
- RT Answers – ASTRO: 환자 정보 사이트
- 양성자 방사선 치료
- 방사선 치료 종양학 그룹: 방사선 종양학 연구 기관
- 방사선학정보 - 환자를 위한 방사선 정보 리소스: 방사선 치료
- 암줄기세포의 방사선 저항력은 유튜브에 설명됐다.
- 암 관리 핸드북: 방사선 치료 원리
- 생물학적 등가 선량 계산기
- 방사선 생물학 치료 간격 보상기 계산기
- 직업에 대해서
- 소아 방사선 종양 학회
- 미국 방사선 종양학회 – ASTRO: 방사선 종양학자를 위한 공식 사이트
- PACT: 방사선 치료를 통해 개발도상국에서 암 치료 능력과 포괄적인 암 통제를 확립하기 위한 암 치료를 위한 행동 프로그램
- 유럽 방사선 치료 및 종양 학회
- 방사선 종양학에서는 누가 뭘 하죠?– 미국 방사선 종양학 내 다양한 담당자의 책임
- 방사선 기사 협회(영국)
- 사고 및 QA







