폐색전증
Pulmonary embolism| 폐색전증 | |
|---|---|
 | |
| 폐색전증을 신체의 다른 부위에서 이동한 혈전(혈전)으로 묘사한 폐 그림은 폐 기관지 동맥의 폐색을 유발하여 왼쪽 폐의 상엽과 하엽의 동맥 혈전증을 유발합니다. | |
| 전문 | 혈액학, 심장학, 폐학 |
| 증상 | 호흡곤란, 가슴통증, 기침으로[1] 피가 차오릅니다. |
| 합병증 | 기절, 비정상적 저혈압, 급사;[2] 만성 혈전색전성 폐고혈압(장기 합병증) |
| 통상발병 | 고령[3] |
| 위험요소 | 암, 장시간 침상 안정, 둔기 외상, 흡연, 뇌졸중, 특정 유전적 조건, 에스트로겐 기반 약물, 임신, 비만, 수술[3] 후 |
| 진단법 | 증상에 따라 D-dimer, CT 폐혈관조영술, 폐환기/관류스캔[4] |
| 치료 | 항응고제 (헤파린, 와파린, DOACs)[5] |
| 빈도수. | 연간 450,000명(미국), 430,000명(유럽)[6][7][8] |
| 사망자 | >연간 10~12,000명(미국),[9] 연간 30~40,000명(유럽)[10] |
폐색전증(PE)은 혈류(색전증)를 통해 몸의 다른 곳에서 이동한 물질에 의해 폐의 동맥이 막히는 것입니다.[6] PE의 증상은 호흡 곤란, 특히 숨을 들이마실 때의 가슴 통증, 기침으로 피를 토하는 것을 포함할 수 있습니다.[1] 다리가 빨갛게 달아오르고, 따뜻하고, 부어오르고, 아픈 다리와 같이 다리에 혈전이 생기는 증상도 나타날 수 있습니다.[1] PE의 징후는 낮은 혈중 산소 수치, 빠른 호흡, 빠른 심박수, 그리고 때때로 미열을 포함합니다.[11] 심한 경우에는 기절, 비정상적으로 낮은 혈압, 폐쇄성 쇼크, 급사 등으로 이어질 수 있습니다.[2]
PE는 일반적으로 폐로 이동하는 다리의 혈전으로 인해 발생합니다.[6] 혈전의 위험은 고령, 암, 장기간의 침상 안정 및 고정, 흡연, 뇌졸중, 4시간 이상의 장거리 여행, 특정 유전적 조건, 에스트로겐 기반 약물, 임신, 비만, 외상 또는 뼈 골절 및 일부 유형의 수술 후에 증가합니다.[3][12] 적은 비율의 경우 공기, 지방 또는 양수의 색전 때문입니다.[13][14] 진단은 검사 결과와 결합하여 징후와 증상을 기반으로 합니다.[4] 위험도가 낮으면 D-dimer로 알려진 혈액 검사에서 이 상태가 배제될 수 있습니다.[4] 그렇지 않으면 CT 폐혈관조영술, 폐환기/관류 스캔 또는 다리 초음파 검사에서 진단이 확인될 수 있습니다.[4] 심부정맥혈전증과 PE를 함께 정맥혈전색전증(VTE)이라고 합니다.[15]
PE를 예방하기 위한 노력으로는 수술 후 가능한 한 빨리 움직이기 시작하기, 앉은 시간 동안 하퇴 운동하기, 어떤 종류의 수술 후 혈액 희석제 사용하기 등이 있습니다.[16] 치료는 헤파린, 와파린과 같은 항응고제 또는 직접 작용하는 경구 항응고제(DOAC) 중 하나입니다.[5] 최소 3개월 이상 권장됩니다.[5] 하지만 출혈 위험이 높은 사람은 물론 신부전이 있는 사람에게도 항응고제를 사용한 치료는 권장되지 않습니다.[17] 중증의 경우 정맥 또는 카테터를 통해 투여되는 조직 혈장 활성제(tPA)와 같은 약물을 사용한 혈전 용해가 필요할 수 있으며, 일부는 수술(폐혈전절제술)이 필요할 수 있습니다.[18] 혈액 희석제가 적절하지 않은 경우에는 임시 대정맥 필터를 사용할 수 있습니다.[18]
폐색전증은 유럽에서 매년 약 43만 명에게 영향을 미칩니다.[8] 미국에서는 매년 300,000~60,000건의 사례가 발생하며,[6][7] 이로 인해 최소 40,000명이 사망합니다.[9] 남성과 여성의 비율은 비슷합니다.[3] 사람들이 나이가 들수록 더 흔해집니다.[3]
징후 및 증상
폐색전증의 증상은 일반적으로 갑자기 나타나며 호흡 곤란(호흡 곤란), 빈호흡(빠른 호흡), 흉막염(호흡에 의해 악화), 기침 및 토혈(피를 빨아먹는 것) 중 하나 또는 여러 가지를 포함할 수 있습니다.[19] 더 심한 경우에는 청색증(주로 입술과 손가락의 청색 변색), 쓰러짐, 폐를 통한 혈류 감소 및 심장의 좌측으로의 순환 불안정과 같은 징후가 포함될 수 있습니다. 모든 급사 사례의 약 15%가 PE 때문입니다.[2] PE가 syncope와 함께 나타날 수 있지만, syncope 사례의 1% 미만이 PE로 인한 것입니다.[20]
신체 검사에서 폐는 보통 정상입니다. 때때로 흉막 마찰 마찰 마찰이 폐의 영향을 받는 부위(대부분 경색이 있는 PE에서)에서 들리는 경우가 있습니다. 흉막 유출은 때때로 삼출성이 있으며, 타악기 음의 감소, 가청 호흡음, 그리고 보컬 공명으로 감지할 수 있습니다. 우심실에 대한 변형은 좌측 복강 내 심음, 제2 심음의 큰 폐 성분 및/또는 상승된 경정맥 압력으로 감지될 수 있습니다.[2] 특히 폐출혈이나 경색과 관련된 경우 저등급 발열이 있을 수 있습니다.[21]
작은 폐색전증은 부수적인 순환 없이 더 많은 말초 부위에 머무르는 경향이 있기 때문에 폐경색과 작은 유출(둘 다 고통스럽지만 저산소증, 호흡곤란 또는 빈맥과 같은 혈역학적 불안정성은 유발하지 않습니다. 중앙에 위치하는 경향이 있는 더 큰 PE는 일반적으로 호흡곤란, 저산소증, 저혈압, 빠른 심박수 및 실신을 유발하지만, 측부 순환으로 인한 폐경색이 없기 때문에 통증이 없는 경우가 많습니다. 흉막염성 통증, 호흡곤란 및 빈맥이 있는 PE에 대한 고전적인 표현은 크고 작은 PE를 모두 유발하는 큰 파편화된 색전증에 의해 발생할 수 있습니다. 따라서 작은 PE는 다른 소견 없이 단독으로 흉막염성 통증을 유발하기 때문에 자주 놓치고 큰 PE는 통증이 없고 다른 상태를 모방하기 때문에 종종 심전도 변화와 트로포닌 및 뇌 영양 펩티드 수치의 작은 상승을 유발하기 때문에 자주 놓칩니다.[22]
PE는 임상 징후와 증상에 따라 질량이 큰, 질량이 작은, 질량이 없는 것으로 설명되기도 합니다. 이들에 대한 정확한 정의는 불분명하지만, 대규모 PE에 대한 허용된 정의는 혈역학적 불안정성이 있는 정의입니다. 이는 지속적인 저혈압, 심박수 둔화 또는 맥빠짐으로 나타나는 폐쇄성 쇼크의 원인입니다.[23]
위험요소

색전증의 약 90%는 근위 DVT라고 불리는 무릎 위에 위치한 심부정맥 혈전증에서 비롯되며, 여기에는 장골 DVT가 포함됩니다.[24] 희귀 정맥 흉부 출구 증후군도 DVT의 원인이 될 수 있으며, 특히 중요한 위험 인자가 없는 젊은 남성의 경우 더욱 그렇습니다.[25] DVT는 폐 순환으로 제거되고 이동할 위험이 있습니다. 이 상태는 일반적으로 정맥혈전색전증(VTE)으로 알려진 연속체로 간주됩니다.[citation needed]
VTE는 면역력이 저하된 개인뿐만 아니라 다음과 같은 동반 질환을 가진 개인에게 훨씬 더 흔합니다.
- 예방 없이 고관절 이하에서 정형외과 수술을 받는 분들.[26]
- 수술 중 또는 수술 후 움직이지 않는 것은 물론 수술 중 정맥 손상 때문입니다.[26]
- 췌장암 및 대장암 환자(다른 형태의 암도 요인이 될 수 있지만 가장 일반적입니다.)[26]
- 고등급 종양[26] 환자
- 임산부[26]
- 몸이 "과응고 가능한 상태"라고 알려진 상태에 놓이면서 출산 중 출혈의 위험이 감소하고 인자 VII, VIII, X, Von Willebrand 및 fibrinogen의 발현 증가에 의해 조절됩니다.[26]
- 에스트로겐 약을[26][27][28][29] 복용하는 사람들.
혈전증의 발생은 고전적으로 Virchow's triad(혈류의 변화, 혈관벽의 요인, 혈액의 특성에 영향을 미치는 요인)라는 이름의 원인 그룹에 기인합니다. 종종 두 가지 이상의 위험 요소가 존재합니다.[citation needed]
- 혈류의 변화: 고정화(수술 후, 장거리 비행), 부상, 임신(또한 응고 촉진제), 비만(또한 응고 촉진제), 암(또한 응고 촉진제)
- 혈관벽의 요인: 수술, 직접적인 손상을 유발하는 카테터 삽입("내피 손상")
- 혈액의 특성에 영향을 미치는 인자(응고 상태):
대부분의 폐색전증은 근위 DVT의 결과이지만 폐색전증을 유발할 수 있는 다른 많은 위험 요소가 있습니다.
근본적인 원인
첫 번째 PE 이후에는 일반적으로 2차 원인을 찾는 것이 짧습니다. 두 번째 PE가 발생할 때만, 그리고 특히 항응고 치료 중인 상태에서 이것이 발생할 때, 근본적인 상태에 대한 추가적인 탐색이 수행됩니다. 여기에는 Factor V Leiden 돌연변이, 항인지질 항체, 단백질 C 및 S 및 항트롬빈 수준, 그리고 나중에 프로트롬빈 돌연변이, MTHFR 돌연변이, Factor VIII 농도 및 더 드문 유전성 응고 이상에 대한 테스트("혈전증 스크린")가 포함됩니다.[31]
진단.
폐색전증을 진단하려면 검사의 필요성을 판단하기 위한 임상 기준을 검토하는 것이 좋습니다.[32] 저위험군, 50세 미만, 분당 심박수 100회 미만, 실내 공기 중 산소 농도 94% 이상, 다리 부종이 없거나 최근 4주 동안 피가 차거나 외상이 있거나 이전 혈전이 있거나 에스트로겐 사용이 없는 경우 일반적으로 추가 검사가 필요하지 않습니다.[33]
위험이 높은 개인이 더 많은 상황에서는 추가 테스트가 필요합니다. CT 폐혈관 조영술(CTPA)은 투여가 쉽고 정확하기 때문에 폐색전증 진단에 선호되는 방법입니다.[34] CTPA가 선호되지만 수행할 수 있는 다른 테스트도 있습니다. 예를 들어, 근위 하지 압박 초음파(CUS)가 사용될 수 있습니다.[34] 이것은 주로 확진 검사로 사용되는 검사로, 폐색전증의 유무 또는 의심되는 것을 보여주는 이전의 분석을 확인하는 것을 의미합니다.[34] 단면 연구에 따르면 CUS 검사는 민감도 41%, 특이도 96%[34]입니다.
우려가 있는 경우 영상 검사를 통해 진단을 확인할 수 있는 가능성을 확인하고 다른 검사에서 PE 진단 가능성이 있는 경우 영상 검사를 수행합니다.[32][35][36]
PE의 진단은 전형적인 임상 증상(호흡 곤란, 흉통)이 흉통 및 호흡 곤란의 다른 원인과 확실히 구별될 수 없기 때문에 선택적 테스트와 결합된 검증된 임상 기준에 주로 기초합니다. 의료 영상을 수행하는 결정은 임상적 추론, 즉 병력, 증상 및 신체 검사 소견을 기반으로 한 후 임상적 개연성에 대한 평가가 뒤따릅니다.[2]
확률 테스트
임상 확률을 예측하는 데 가장 일반적으로 사용되는 방법인 Wells 점수는 임상 예측 규칙으로, 여러 버전을 사용할 수 있어 사용이 복잡합니다. 1995년 필립 스티븐 웰스(Philip Steven Wells)는 처음에 임상 기준을 기반으로 DVT의 가능성을 예측하는 예측 규칙(문헌 검색을 기반으로 함)을 개발했습니다.[37] PE에 대한 새로운 예측 점수는 1998년에[38] 생성되었습니다. 이 예측 규칙은 2000년에 Wells 등에 의해 수정되었습니다.[39] 2000년 간행물에서 Wells는 동일한 예측 규칙으로 2 또는 4의 컷오프를 사용하는 두 가지 다른 점수 시스템을 제안했으며 저확률 환자의 PE 배제에 D-dimer 테스트도 포함했습니다.[39] 2001년, 웰스는 세 가지 범주를 만들기 위해 보다 보수적인 컷오프 2를 사용한 결과를 발표했습니다.[40] 추가 버전인 "수정된 확장 버전"은 최근 컷오프된 2를 사용하지만 웰스의 초기 연구[37][38] 결과를 포함하여 제안되었습니다.[41] 가장 최근에 추가적인 연구는 Wells가 초기에 4점의[39] 컷오프를 사용하여 두 개의 범주만 만든 것으로 거슬러 올라갑니다.[42]
Geneva 규칙과 같은 PE에 대한 추가 예측 규칙이 있습니다. 더 중요한 것은 규칙을 사용하는 것이 반복적인 혈전색전증의 감소와 관련이 있다는 것입니다.[43]
- 임상적으로 의심되는 DVT – 3.0점
- 대체 진단 가능성이 PE보다 낮음 – 3.0점
- 빈맥(심박수 > 100) – 1.5점
- 지난 4주간의 고정화(≥ 3d)/surgery – 1.5점
- DVT 또는 PE 이력 – 1.5점
- 혈액투석 – 1.0점
- 악성 종양(6개월 이내 치료 포함) 또는 완화 – 1.0점
- 점수 >6.0 – 높음(풀링된 데이터를 기준으로 59% 확률)[35]
- 점수 2.0 ~ 6.0 – 중간(풀링된 데이터를 기준으로 확률 29%)[35]
- 점수 <2.0 – 낮음(풀링된 데이터를 기준으로 확률 15%)[35]
- 점수 > 4 – PE 가능성이 높습니다. 진단 영상을 고려합니다.
- 점수 4점 이하 – PE 가능성은 낮습니다. D-dimer를 고려하여 PE를 배제합니다.
PIOPED 조사자들은 진단 알고리즘에 대한 권장 사항을 발표했지만 이러한 권장 사항은 64 슬라이스 MDCT를 사용한 연구를 반영하지 않습니다.[35] 이 조사관들은 다음과 같이 권고했습니다.
- 임상 확률이 낮습니다. 음의 D-dimer인 경우 PE는 제외됩니다. D-dimer 양성인 경우 MDCT를 획득하고 결과에 따라 기저 치료를 합니다.
- 임상적으로 적당한 확률입니다. 음의 D-dimer인 경우 PE는 제외됩니다. 그러나 저자들은 이 설정에서 음의 D-dimer를 가진 음의 MDCT가 거짓일 확률이 5%라는 것에 대해 우려하지 않았습니다. 아마도 64 슬라이스 MDCT가 더 일반적으로 사용됨에 따라 5% 오류율이 떨어질 것입니다. D-dimer 양성인 경우 MDCT를 획득하고 결과에 따라 기저 치료를 합니다.
- 임상 확률이 높습니다. MDCT로 이동합니다. 양성이면 치료하고 음성이면 PE를 제외하기 위해 더 많은 검사가 필요합니다. 750 ug/L 미만의 D-dimer는 고위험자의 PE를 배제하지 않습니다.[46]
폐색전증 배제 기준
폐색전증 배제 기준(PERC)은 폐색전증이 의심되지만 가능성이 낮은 사람을 평가하는 데 도움이 됩니다. PE가 의심되는 사람을 위험 계층화하기 위한 임상 예측 규칙인 Wells 점수 및 Geneva 점수와 달리 PERC 규칙은 의사가 PE를 저위험 범주로 이미 계층화했을 때 사람의 PE 위험을 배제하도록 설계되었습니다.[47][45]
이러한 기준이 없는 저위험군에 속하는 사람들은 PE에 대한 더 이상의 검사를 받지 않을 수 있습니다: 낮은 산소 포화도 – SaO2 < 95%, 일방적인 다리 붓기, 기침하는 피, 이전 DVT 또는 PE, 최근 수술 또는 외상, 나이 > 50세, 호르몬 사용, 빠른 심박수. 이 결정의 근거는 추가 검사(특히 흉부 CT 혈관 조영)가 PE의 위험보다 (방사선 노출 및 조영제로 인한) 더 많은 해를 끼칠 수 있다는 것입니다.[48] PERC 규칙은 97.4%의 민감도와 21.9%의 특이도를 가지며, 위음성 비율은 1.0%(16/1666)입니다.[47]
혈액검사
PE의 의심이 낮거나 중간 정도인 사람의 경우 정상 D-dimer 수준(혈액 검사에 표시됨)은 혈전성 PE의 가능성을 배제하기에 충분하며 3개월 동안 혈전색전증이 발생할 위험은 0.14%[49]입니다. D-dimer는 민감도가 높지만 특이성은 없습니다(특이도 50% 내외). 다시 말해, 긍정적인 D-dimer는 PE와 동의어가 아니지만, 부정적인 D-dimer는 확실성이 높은 PE가 없다는 것을 나타냅니다.[50] 낮은 사전 테스트 확률은 PE를 배제하는 데에도 가치가 있습니다.[51] 일반적인 컷오프는 500μg/L이지만 이는 분석에 따라 다릅니다.[52] 단, 50세 이상에서는 컷오프값에 10μg/L(사용된 분석의 계정)을 곱한 나이로 변경하는 것이 PE의 추가 사례를 놓치지 않고 위양성 검사 수를 줄이기 때문에 권장됩니다.[33][52][53]
PE가 의심되는 경우 PE의 중요한 2차 원인을 배제하기 위해 여러 혈액 검사를 수행합니다. 여기에는 전체 혈액 수, 응고 상태(PT, aPTT, TT) 및 일부 선별 검사(적혈구 침강 속도, 신장 기능, 간 효소, 전해질)가 포함됩니다. 이 중 하나가 비정상적인 경우 문제에 대한 추가 조사가 필요할 수 있습니다.[54]
트로포닌 수치는 폐색전증과 함께 16%에서 47% 사이에서 증가합니다.[55]
이미징
PE의 위험이 높은 것으로 알려져 있지 않은 일반적인 사람들의 경우, 단순한 1차 검사를 사용한 후에 PE 진단을 확인하거나 제외하는 데 이미징이 도움이 됩니다.[32][35][56] 의학회에서는 우선 D-dimer와 같은 검사에서 영상검사의 필요성을 뒷받침하는 증거를 제시하고, 다른 검사에서 PE 진단을 뒷받침할 증거를 찾을 가능성이 중간 또는 높은 것으로 확인되면 영상검사를 시행할 것을 권장합니다.[35][56]
CT 폐혈관 조영술은 대부분의 사람들에게 권장되는 1차 진단 영상 검사입니다.[57]
다리의 초음파는 PE의 존재를 확인할 수 있지만 배제할 수는 없습니다.[58]
CT 폐혈관조영술
CT 폐혈관 조영술(CTPA)은 우측 심장 카테터가 아닌 방사선 조영술과 함께 컴퓨터 단층 촬영(CT)을 사용하여 얻은 폐혈관 조영술입니다. 정확하고, 비침습적이며, 더 자주 이용할 수 있으며, 폐색전증이 없는 경우 다른 폐질환을 확인할 수 있다는 장점이 있습니다. CTPA의 정확성과 비침습적인 특성으로 인해 임신한 사람들에게도 유리합니다.[59]
- CT 스캔에서 폐색전증은 동맥 트리를 따라 수준에 따라 분류할 수 있습니다.
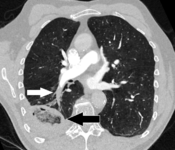
- 양측의 분절성 및 하위 분절성 폐색전
- 양측 로바 동맥의 혈전 부담과 주 폐동맥의 분기점에서 "슬레드 색전증"을 보이는 CT 폐혈관 조영술.
CT 폐혈관 조영술의 정확도를 평가하는 것은 MDCT(다중 검출기 CT) 기계에서 사용할 수 있는 검출기 행 수의 급격한 변화로 인해 방해를 받습니다.[60] 코호트 연구에 따르면, 단일 슬라이스 나선형 CT는 폐색전증이 의심되는 사람들 사이에서 발견을 진단하는 데 도움이 될 수 있습니다.[61] 이번 연구에서 민감도는 69%, 특이도는 84%였습니다. 검출 유병률이 높았던 이 연구에서는 32%, 양성 예측값 67.0%, 음성 예측값 85.2%였습니다. 그러나 CT 스캔이 폐색전증 환자의 최종 진단 도구였기 때문에 이 연구의 결과는 통합 편향으로 인해 편향될 수 있습니다. 저자들은 음성 단일 슬라이스 CT 스캔만으로는 폐색전증을 배제하기에 부족하다고 언급했습니다. 4개의 슬라이스 스캐너와 16개의 슬라이스 스캐너를 혼합한 별도의 연구에서는 83%의 민감도와 96%의 특이도를 보고하였는데, 이는 영상에서 폐색전증이 보이지 않을 경우 폐색전증을 배제하기 위한 좋은 검사이며, 폐색전증이 보일 경우 폐색전증이 있음을 확인하는 데 매우 우수하다는 것을 의미합니다. 이 연구는 임상 확률이 영상 결과와 일치하지 않을 때 추가 검사가 필요하다는 점에 주목했습니다.[62] CTPA는 VQ 스캐닝에 비해 성능이 떨어지며 VQ 스캐닝에 비해 (반드시 결과를 개선하지 않고) 더 많은 색전을 식별합니다.[63]
환기/관류 스캔

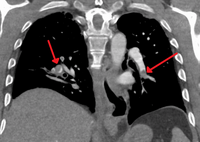
(A) 20 mCi의 제논-133 가스를 흡입한 후 후방 투영에서 섬광 영상을 얻어 폐까지 균일한 환기를 보여주었습니다.
(B) 테크네튬-99m 표지 알부민 4mCi를 정맥 주사한 후, 여기 후방 프로젝션에 표시된 섬광 영상. 이것과 다른 견해는 여러 지역에서 활동이 감소한 것으로 나타났습니다.
환기/관류 스캔(또는 V/Q 스캔 또는 폐 신티그래피)은 폐의 일부 영역이 환기되지만 혈액으로 관류되지 않는 것을 보여줍니다(응고에 의한 폐색 때문).[19] 이러한 유형의 검사는 다중 슬라이스 CT만큼 정확하지만 CT 기술의 가용성이 높기 때문에 덜 사용됩니다. 요오드화 조영제에 알레르기가 있거나 신장 기능이 손상되었거나 임신 중인 사람에게 특히 유용합니다(CT에 비해 방사선 노출이 낮기 때문).[64][65][66] 이 테스트는 평면 2차원 이미징 또는 3차원 이미징을 가능하게 하는 단일 광자 방출 컴퓨터 단층 촬영(SPEC)으로 수행할 수 있습니다.[57] SPECT와 CT(SPECT/CT)를 결합한 하이브리드 장치를 사용하면 모든 이상에 대한 해부학적 특성을 더욱 파악할 수 있습니다.[67]
낮은 확률의 진단검사/비진단검사
PE에 민감하지는 않지만 진단이 가능한 검사를 자주 수행합니다.
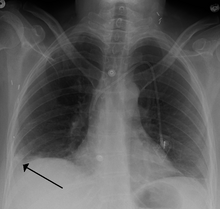
- 흉부 엑스레이는 종종 울혈성 심부전, 갈비뼈 골절과 같은 다른 원인을 배제하기 위해 호흡 곤란을 겪는 사람들에게 시행됩니다. PE의 흉부 X선은 거의 정상이 [68]아니지만 일반적으로 PE의 진단을 시사하는 징후(예: Westermark sign, Hampton's hump)가 부족합니다.
- 깊은 정맥 혈전증(DVT)을 찾기 위한 다리 초음파 검사, 다리 도플러(leg doppler)라고도 합니다. 다리 초음파 검사에서 볼 수 있듯이 DVT의 존재는 그 자체로 V/Q 또는 나선형 CT 스캔을 필요로 하지 않고 항응고를 보장하기에 충분합니다(DVT와 PE 사이의 강한 연관성 때문). 이것은 임신 중에 유효한 접근법일 수 있는데, 다른 방식들이 태아의 선천적 장애의 위험을 증가시킬 수 있습니다. 그러나 음성 스캔이 PE를 배제하는 것은 아니며, 산모가 폐색전증에 걸릴 위험이 높다고 판단되는 경우 저방사선량 스캔이 필요할 수 있습니다. 따라서 다리 초음파 검사의 주요 용도는 심부정맥 혈전증을 시사하는 임상 증상이 있는 사람에게 있습니다.[66]
투시폐혈관조영술

역사적으로 진단의 금본위제는 형광 투시법에 의한 폐혈관 조영술이었지만, 이는 유사한 진단 정확도를 제공하는 비침습적 기술의 가용성이 증가하면서 사용되지 않게 되었습니다.[69]
심전도

심전도의 주요 용도는 흉통의 다른 원인을 배제하는 것입니다.[70] 심전도(ECG)는 흉통이 있는 사람에게 일상적으로 수행되어 흉통이 있는 개인의 중요한 감별 진단인 심근경색(심근경색)을 신속하게 진단합니다. PE에서 특정 ECG 변화가 발생할 수 있지만 진단을 배제할 만큼 충분히 구체적이거나 민감한 것은 없습니다.[70] 심전도는 큰 PE의 경우 오른쪽 심장에 무리가 있거나 급성 폐포성의 징후를 나타낼 수 있습니다. 대표적인 징후는 납 I에서 큰 S파, 납 III에서 큰 Q파, 납 III(S1Q3T3)에서 반전된 T파이며, 이는 진단을 받은 사람의 12-50%에서 발생하지만 진단을 받지 않은 사람의 12%에서도 발생합니다.[71][72]
이는 때때로 존재하지만(최대 20%의 사람에게서 발생) 다른 급성 폐 질환에서도 발생할 수 있으므로 진단적 가치가 제한적입니다. 심전도에서 가장 흔히 볼 수 있는 징후는 동빈맥, 오른쪽 축 편차 및 오른쪽 번들 분기 블록입니다.[73] 그러나 동빈맥은 여전히 PE를 가진 사람들의 8-69%에서만 발견됩니다.[74]
폐색전증과 관련된 심전도 소견은 심전도에서 RV 변형(심박수 > 분당 100회, S1Q3T3, 리드 V1-V4에서 반전된 T파, VR에서 ST 상승, 완전한 우측 번들 분기 블록)으로 확인된 6개의 소견이 더 나쁜 예후를 시사할 수 있습니다. 심방세동)은 순환 쇼크 및 사망 위험 증가와 관련이 있습니다.[75]
리드 V에서1-3 T가 반전된 경우는 PE 또는 열등한 심근경색이 의심됩니다. PE 사례는 리드 II와 aV에서F 반전된 T파를 보여주지만 열등한 심근경색 사례는 II와 aV에서F 반전된 T파를 보여주지 않습니다.[76]
심장 초음파 검사
질량이 크고 질량이 큰 PE에서는 심장초음파에서 심장의 오른쪽 기능장애가 보일 수 있는데, 이는 폐동맥이 심하게 막혀 있고 압력이 낮은 펌프인 우심실이 압력을 맞출 수 없다는 것을 의미합니다. 일부 연구(아래 참조)는 이 결과가 혈전 용해의 징후일 수 있음을 시사합니다. 폐색전증이 의심되는 모든 사람이 심장 초음파 검사를 필요로 하는 것은 아니지만 심장 트로포닌 또는 뇌 영양 펩티드의 상승은 심장 긴장을 나타내며 심장 초음파 검사를 보증할 [77]수 있으며 예후에 중요합니다.[78]
맥코넬 부호는 심장초음파에서 우심실의 구체적인 모습을 말합니다. 이것은 중간 자유 벽의 운동성을 발견했지만 정점의 정상적인 움직임입니다. 이 현상은 우심실 기능 장애 설정에서 급성 폐색전증 진단에 77%의 민감도와 94%의 특이도를 가지고 있습니다.[79]

예방
폐색전증은 위험인자가 있는 사람들에게서 예방할 수 있습니다. 병원에 입원한 사람들은 비분획 헤파린, 저분자량 헤파린(LMWH) 또는 폰다파린룩스를 포함한 예방 약물과 다리의 DVT 위험을 줄이고 폐로 이동할 수 있는 항혈전 스타킹을 받을 수 있습니다.[81]
이전 PE를 가진 사람들에게 항응고제를 완료한 후, 장기간 아스피린은 재발을 예방하는 데 유용합니다.[5]
치료
항응고 요법은 치료의 주축입니다. 급성으로 산소나 진통제와 같은 보조적인 치료가 필요할 수 있습니다. 사람들은 종종 치료 초기에 병원에 입원하고 INR이 치료 수준에 도달할 때까지(와파린을 사용하는 경우) 입원 치료를 받는 경향이 있습니다. 그러나 저위험 사례는 DVT 치료에서 이미 일반적인 방식으로 집에서 관리되고 있습니다.[5][82] 한 가지 접근 방식과 다른 접근 방식을 지지하는 증거는 약합니다.[83][needs update]
항응고
항응고 요법은 치료의 주축입니다. 수년 동안 비타민 K 길항제(와파린 또는 덜 일반적으로 아세노쿠마롤 또는 펜프로쿠몬)가 주춧돌이었습니다. 비타민K 길항제는 즉시 작용하지 않기 때문에 초기 치료는 빠르게 작용하는 주사형 항응고제인 비분획 헤파린(UFH), 저분자량 헤파린(LMWH) 또는 폰다파린룩스를 사용하는 반면, 경구 비타민K 길항제는 (일반적으로 입원 병원 치료의 일환으로) 개시되고 국제 표준화 비율로 적정됩니다. 용량을 [5]결정하는 검사 LMWH는 주사형 치료 측면에서 UFH에 비해 폐색전증 환자의 출혈을 줄일 수 있습니다.[84] 같은 리뷰에 따르면 LMWH는 헤파린에 비해 재발성 혈전성 합병증의 발생을 줄이고 혈전 크기를 줄였습니다. LMWH로 치료한 참가자와 비분획 헤파린으로 치료한 참가자 간의 전체 사망률에는 차이가 없었습니다.[84] 비타민K 길항제는 잦은 용량 조정과 국제정규화비율(INR) 모니터링이 필요합니다. PE에서는 일반적으로 2.0에서 3.0 사이의 INR이 이상적인 것으로 간주됩니다.[5] 와파린 치료 중에 PE의 다른 에피소드가 발생하는 경우 INR 창이 2.5–3.5(억제가 없는 한)[citation needed]로 증가하거나 항응고제가 LMWH와 같은 다른 항응고제로 변경될 수 있습니다.[5]
최근 몇 년 동안 와파린과 유사하지만 INR에 적정할 필요가 없는 많은 항응고제가 소개되었습니다. 직접 작용하는 경구 항응고제로 알려진 이러한 치료법은 현재 미국 전문 지침에 따라 비타민 K 길항제보다 선호됩니다.[5] 이 중 두 가지(리바록사반과 아픽사반)는 초기 헤파린이나 폰다파리눅스 치료가 필요하지 않은 반면 다비가트란과 에독사반은 필요합니다.[5] Cochrane 리뷰에 따르면 경구 DTI(다비가트란, 리바록사반, 에독사반, 아픽사반)와 표준 항응고제 간에 재발성 폐색전증 예방에 차이가 있다는 증거가 없습니다.[85]
폐색전증이 발생하는 암 환자의 경우 와파린이나 다른 경구 항응고제보다 LMWH 과정의 치료가 선호됩니다.[5][86] 마찬가지로 임신부도 와파린의 알려진 기형 유발 효과를 피하기 위해 분만 후까지 저분자량 헤파린으로 치료하지만, 특히 임신 초기에는 모유 수유 중에 사용할 수 있습니다.[66]
항응고 요법은 일반적으로 3-6개월 동안 계속되거나 이전에 DVT 또는 PE가 있거나 일반적인 일시적 위험 인자가 없는 경우 "평생" 계속됩니다.[5][86] 원인을 알 수 없는 경우에는 2년의 치료가 6개월보다 나을 수 있습니다.[87] 소규모 PE(subsegmental PE로 알려져 있음)를 가진 사람들의 경우 항응고 효과는 2020년 현재 제대로 연구되지 않았기 때문에 알려지지 않았습니다.[88]
혈전용해
혈역학적 불안정성을 유발하는 대규모 PE(충격 및/또는 저혈압, 수축기 혈압 <90 mmHg 또는 새로운 발병 부정맥, 저혈량증 또는 패혈증으로 인한 것이 아닌 경우 15분 이상 40 mmHg의 압력 강하로 정의됨)는 혈전 용해, 약물로 혈전을 효소적으로 파괴하는 징후입니다. 이러한 상황에서 금기가 없는 사람들에게 사용 가능한 최고의 치료법이며 임상 지침의 지원을 받습니다.[36][86][89] 알려진 PE가 있는 심정지 환자에게도 권장됩니다.[90] 카테터 유도 혈전 용해(CDT)는 대규모 PE에 비교적 안전하고 효과적인 것으로 밝혀진 새로운 기술입니다. 이것은 카테터를 사타구니의 정맥에 넣고 폐 순환에서 PE 옆에 위치할 때까지 투시 영상을 사용하여 정맥을 통해 안내함으로써 정맥 시스템에 접근하는 것을 포함합니다. 혈전을 분해하는 약물은 최고 농도가 폐색전 바로 옆에 있도록 카테터를 통해 배출됩니다. CDT는 중재적 방사선사 또는 혈관 외과 의사에 의해 수행되며, CDT를 제공하는 의료 센터에서는 1차 치료로 제공될 수 있습니다.[91] 카테터 기반 초음파 보조 혈전 용해를 조사하고 있습니다.[92]
비-질량 PE에서 혈전 용해의 사용은 여전히 논쟁 중입니다.[93][94] 이 치료법이 사망 위험을 낮추고 두개내 출혈을 포함한 출혈 위험을 높인다는 연구 결과도 있습니다.[95] 다른 사람들은 사망 위험이 감소하지 않는 것을 발견했습니다.[94]
하대정맥 필터

하대정맥 필터가 유리한 것으로 간주되는 경우와 항응고 요법이 금지된 경우(예: 주요 수술 직후) 또는 항응고에도 불구하고 폐색전증이 있는 경우 두 가지 상황이 있습니다.[86] 이러한 경우, 새로운 또는 기존 DVT가 폐동맥으로 들어가 기존의 막힌 부분과 결합하는 것을 방지하기 위해 이식될 수 있습니다.[86] 폐색전증을 예방한다는 이 장치의 이론적 이점에도 불구하고, 그 효과를 뒷받침하는 증거가 부족합니다.[96]
하대정맥 필터는 항응고제 사용을 시작하는 것이 안전해지면 즉시 제거해야 합니다.[86] 최신 필터는 회수할 수 있도록 되어 있지만, 합병증으로 인해 일부가 제거되지 않을 수 있습니다. 필터를 몸 안에 영구히 남겨두는 장기적인 안전성 프로파일은 알려지지 않았습니다.[96]
수술.
급성 폐색전증(폐혈전절제술)의 수술적 관리는 흔하지 않으며 장기적인 결과가 좋지 않아 대부분 폐기되었습니다. 그런데 최근에 수술 기법이 개정되면서 부활을 해서 특정인들에게 혜택이 될 것으로 생각이 되고 있습니다.[97] 폐고혈압을 유발하는 만성 폐색전증(만성 혈전색전증)은 폐혈전절제술로 알려진 수술 절차로 치료됩니다.[98]
예후

증상이 있는 PE의 5~10% 미만은 증상이 발생한 후 1시간 이내에 치명적입니다.[36][90]
위험 계층화에 사용되는 여러 표지자가 있으며, 이 표지자들은 부작용을 예측하는 독립적인 예측 변수이기도 합니다. 여기에는 저혈압, 심장성 쇼크, 실신, 오른쪽 심장 기능 장애의 증거 및 심장 효소 상승이 포함됩니다.[36] S1Q3T3를 포함한 일부 심전도 변화는 더 나쁜 단기 예후와도 상관관계가 있습니다.[23] COPD 및 만성 심부전과 같은 다른 환자 관련 요인도 예후에 역할을 하는 것으로 생각됩니다.[36]
예후는 영향을 받는 폐의 양과 다른 의학적 조건의 공존에 따라 달라집니다. 폐에 대한 만성 색전증은 폐 고혈압을 유발할 수 있습니다. 대규모 PE 검사 후, 환자가 생존하려면 색전증이 어떻게든 해결되어야 합니다. 혈전성 PE에서 혈전은 섬유소 용해에 의해 분해되거나 혈전을 통해 새로운 채널이 형성되도록 조직화되고 재촉매될 수 있습니다. 혈류는 PE 후 첫날 또는 이틀 안에 가장 빠르게 회복됩니다.[99] 이후 개선이 느려지고 일부 적자는 영구적일 수 있습니다. 소규모 분절 PE가 치료가 필요한지에[100] 대해서는 논란이 있으며 분절 PE를 가진 환자가 치료 없이 잘 할 수 있다는 일부 증거가 존재합니다.[62][101]
항응고제를 한 번 중단하면 치명적인 폐색전증 위험은 연간 0.5%입니다.[102]
치료되지 않은 PE로 인한 사망률은 26%라고 합니다. 이 수치는 1960년 바릿(Barrit)과 조던(Jordan)이 발표한 실험에서 나온 것으로, PE 관리를 위해 위약에 대한 항응고제를 비교했습니다. 배릿과 조던은 1957년 브리스톨 왕립 의무실에서 연구를 수행했습니다.[103] 이 연구는 PE 치료에서 항응고제의 위치를 조사한 유일한 위약 대조 시험인데, 그 결과는 매우 설득력이 있어서 시험이 한 번도 반복된 적이 없을 정도로 비윤리적인 것으로 여겨졌습니다.[citation needed] 즉, 플라시보 그룹에서 보고된 26%의 사망률은 그날의 기술이 심각한 PE만을 발견했을 수도 있다는 점을 감안할 때 아마도 과장된 표현일 것입니다.[104]
사망률 예측
PESI 및 sPESI(= 단순화 폐색전증 중증도 지수) 점수 도구를 사용하여 환자의 사망률을 추정할 수 있습니다. 제네바 예측 규칙과 Wells 기준은 환자가 폐색전증을 가진 사람을 예측할 수 있는 사전 테스트 확률을 계산하는 데 사용됩니다. 이 점수는 진단 검사 및 치료 유형을 결정할 때 임상적 판단과 함께 사용할 수 있는 도구입니다.[105] PESI 알고리즘은 일상적으로 사용 가능한 11개의 임상 변수로 구성됩니다.[106] 피험자를 5개 클래스(I–V) 중 하나로 분류하며, 30일 사망률은 1.1%에서 24.5%입니다. Ⅰ, Ⅱ급은 저위험군, Ⅲ-Ⅴ급은 고위험군입니다.[106]
역학
폐색전증은 연간 약 1,000만 건이 발생합니다.[26] 미국에서 폐색전증은 연간 최소 10,000~12,000명의 사망의 주요 원인이며 연간 최소 30,000~40,000명의 사망 원인입니다.[9] 폐색전증과 관련된 진정한 발병률은 부검 전까지 진단되지 않거나 눈에 띄지 않는 경우가 많기 때문에 알 수 없습니다.[26] 1993년부터 2012년까지 폐색전증으로 인한 병원 입원이 증가하여 인구 10만 명당 23건에서 인구 10만 명당 65건으로 급증했습니다.[26] 이러한 증가에도 불구하고, 발생한 의학 발전으로 인해 같은 기간 동안 사망률이 감소했습니다.[26]
일반적인 위험인자인 정맥혈전색전증(VTE)은 70세 이상에서 훨씬 높은 비율로 존재합니다(45세에서 69세에 비해 3배 높음).[26] 이는 일반적으로 노인들 사이에서 활동 수준이 낮아서 움직이지 못하고 비만하는 비율이 높기 때문일 수 있습니다.[26] VTE는 치명률이 크고 지속적으로 증가하고 있습니다.[26] 이 비율은 30일 후 약 10%, 3개월 후 15%, 1년 후 최대 20%입니다.[26] 폐색전증 단독(입원으로 인한 경우)의 경우 치사율이 약 5%에서 10%이므로 VTE는 색전증의 중증도에 큰 역할을 할 수 있습니다.[26]
모든 경우를 살펴보면, 미국에서 지난 25년 동안 치명적인 폐색전증의 비율은 6%에서 2%로 감소했습니다.[107] 유럽에서는 2013년에서 2015년 사이에 폐색전증을 주요 원인으로 하는 연간 평균 약 40,000명의 사망자가 보고되었으며, 이는 잠재적인 과소 진단으로 인한 보수적인 추정치입니다.[10]
참고문헌
- ^ a b c "What Are the Signs and Symptoms of Pulmonary Embolism?". NHLBI. July 1, 2011. Archived from the original on 9 March 2016. Retrieved 12 March 2016.
- ^ a b c d e Goldhaber SZ (2005). "Pulmonary thromboembolism". In Kasper DL, Braunwald E, Fauci AS, et al. (eds.). Harrison's Principles of Internal Medicine (16th ed.). New York: McGraw-Hill. pp. 1561–65. ISBN 978-0-07-139140-5.
- ^ a b c d e "Who Is at Risk for Pulmonary Embolism?". NHLBI. July 1, 2011. Archived from the original on 15 February 2016. Retrieved 12 March 2016.
- ^ a b c d "How Is Pulmonary Embolism Diagnosed?". NHLBI. July 1, 2011. Archived from the original on 7 April 2016. Retrieved 12 March 2016.
- ^ a b c d e f g h i j k l Kearon C, Akl EA, Ornelas J, Blaivas A, Jimenez D, Bounameaux H, et al. (February 2016). "Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report". Chest. 149 (2): 315–52. doi:10.1016/j.chest.2015.11.026. PMID 26867832.
- ^ a b c d "What Is Pulmonary Embolism?". NHLBI. July 1, 2011. Archived from the original on 12 March 2016. Retrieved 12 March 2016.
- ^ a b Rahimtoola A, Bergin JD (February 2005). "Acute pulmonary embolism: an update on diagnosis and management". Current Problems in Cardiology. 30 (2): 61–114. doi:10.1016/j.cpcardiol.2004.06.001. PMID 15650680.
- ^ a b Raskob GE, Angchaisuksiri P, Blanco AN, Buller H, Gallus A, Hunt BJ, et al. (November 2014). "Thrombosis: a major contributor to global disease burden". Arteriosclerosis, Thrombosis, and Vascular Biology. 34 (11): 2363–71. doi:10.1161/atvbaha.114.304488. PMID 25304324.
- ^ a b c Barco S, Valerio L, Ageno W, Cohen AT, Goldhaber SZ, Hunt BJ, et al. (October 2020). "Age-sex specific pulmonary embolism-related mortality in the USA and Canada, 2000–18: an analysis of the WHO Mortality Database and of the CDC Multiple Cause of Death database". The Lancet. Respiratory Medicine. 9 (1): 33–42. doi:10.1016/S2213-2600(20)30417-3. PMC 7550106. PMID 33058771.
- ^ a b Barco S, Mahmoudpour SH, Valerio L, Klok FA, Münzel T, Middeldorp S, et al. (March 2020). "Trends in mortality related to pulmonary embolism in the European Region, 2000–15: analysis of vital registration data from the WHO Mortality Database". The Lancet. Respiratory Medicine. 8 (3): 277–87. doi:10.1016/S2213-2600(19)30354-6. hdl:1887/3637096. PMID 31615719. S2CID 204740186.
- ^ Tintinalli JE (2010). Emergency Medicine: A Comprehensive Study Guide (Emergency Medicine (Tintinalli)) (7 ed.). New York: McGraw-Hill Companies. p. 432. ISBN 978-0-07-148480-0.
- ^ Di Nisio, Marcello; Van Es, Nick; Büller, Harry R. (30 June 2016). "Deep vein thrombosis and pulmonary embolism". The Lancet. 388 (10063): 3060–3073. doi:10.1016/S0140-6736(16)30514-1. PMID 27375038. S2CID 25712161. Retrieved 18 November 2022.
- ^ "What Causes Pulmonary Embolism?". NHLBI. July 1, 2011. Archived from the original on 7 April 2016. Retrieved 12 March 2016.
- ^ Pantaleo G, Luigi N, Federica T, Paola S, Margherita N, Tahir M (2014). "Amniotic fluid embolism: review". Current Pharmaceutical Biotechnology. 14 (14): 1163–67. doi:10.2174/1389201015666140430161404. PMID 24804726.
- ^ "Other Names for Pulmonary Embolism". July 1, 2011. Archived from the original on 16 March 2016. Retrieved 12 March 2016.
- ^ "How Can Pulmonary Embolism Be Prevented?". NHLBI. July 1, 2011. Archived from the original on 7 April 2016. Retrieved 12 March 2016.
- ^ Tarbox, Abigail K; Swaroop, Mamta (2013). "Pulmonary Embolism". International Journal of Critical Illness and Injury Science. nternational Journal of Critical Illness and Injury Science. 3 (1): 69–72. doi:10.4103/2229-5151.109427. PMC 3665123. PMID 23724389.
- ^ a b "How Is Pulmonary Embolism Treated?". NHLBI. July 1, 2011. Archived from the original on 9 March 2016. Retrieved 12 March 2016.
- ^ a b Lewis S, Dirksen S, Heitkemper M, Bucher L (2014). Medical-surgical nursing: Assessment and management of clinical problems (9 ed.). St. Louis, MO: Elsevier Mosby. p. 552. ISBN 978-0-323-08678-3.
- ^ Oqab Z, Ganshorn H, Sheldon R (April 2018). "Prevalence of pulmonary embolism in patients presenting with syncope. A systematic review and meta-analysis". The American Journal of Emergency Medicine. 36 (4): 551–55. doi:10.1016/j.ajem.2017.09.015. PMID 28947223. S2CID 5012417.
- ^ Stein PD, Sostman HD, Hull RD, Goodman LR, Leeper KV, Gottschalk A, et al. (March 2009). "Diagnosis of pulmonary embolism in the coronary care unit". The American Journal of Cardiology. 103 (6): 881–86. doi:10.1016/j.amjcard.2008.11.040. PMC 2717714. PMID 19268750.
- ^ 프레게슨 DB, 퀵 에센셜 : 응급의학, 4판 EMresource.org[ISBN missing][page needed]
- ^ a b Jaff MR, McMurtry MS, Archer SL, Cushman M, Goldenberg N, Goldhaber SZ, et al. (April 2011). American Heart Association Council on Cardiopulmonary, Critical Care, Perioperative and Resuscitation, American Heart Association Council on Peripheral Vascular Disease, American Heart Association Council on Arteriosclerosis, Thrombosis, and Vascular Biology. "Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American Heart Association". Circulation. 123 (16): 1788–830. doi:10.1161/CIR.0b013e318214914f. PMID 21422387.
- ^ Ferri F (2012). Ferri's Clinical Advisor. St. Louis: Mosby's.
- ^ Saleem T, Baril DT (2021). "Paget Schroetter Syndrome". StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. PMID 29494023.
- ^ a b c d e f g h i j k l m n o p q r s Turetz M, Sideris AT, Friedman OA, Triphathi N, Horowitz JM (June 2018). "Epidemiology, Pathophysiology, and Natural History of Pulmonary Embolism". Seminars in Interventional Radiology. 35 (2): 92–98. doi:10.1055/s-0038-1642036. PMC 5986574. PMID 29872243.
- ^ a b Archer DF, Oger E (June 2012). "Estrogen and progestogen effect on venous thromboembolism in menopausal women". Climacteric. 15 (3): 235–240. doi:10.3109/13697137.2012.664401. PMID 22612609. S2CID 43061502.
- ^ a b Tchaikovski SN, Rosing J (July 2010). "Mechanisms of estrogen-induced venous thromboembolism". Thrombosis Research. 126 (1): 5–11. doi:10.1016/j.thromres.2010.01.045. PMID 20163835.
- ^ a b Nolan BJ, Cheung AS (September 2020). "Estradiol Therapy in the Perioperative Period: Implications for Transgender People Undergoing Feminizing Hormone Therapy". The Yale Journal of Biology and Medicine. 93 (4): 539–548. PMC 7513447. PMID 33005118.
- ^ a b c d Toplis E, Mortimore G (January 2020). "The diagnosis and management of pulmonary embolism". British Journal of Nursing. 29 (1): 22–26. doi:10.12968/bjon.2020.29.1.22. hdl:10545/624428. PMID 31917939. S2CID 210131969.
- ^ "Pulmonary embolus". MedlinePlus Medical Encyclopedia. Archived from the original on 25 April 2017. Retrieved 24 April 2017.
- ^ a b c American College of Radiology. "Five Things Physicians and Patients Should Question" (PDF). Choosing Wisely: an initiative of the ABIM Foundation. American College of Radiology. Archived (PDF) from the original on April 16, 2012. Retrieved August 17, 2012.
- ^ a b Raja AS, Greenberg JO, Qaseem A, Denberg TD, Fitterman N, Schuur JD (November 2015). "Evaluation of Patients With Suspected Acute Pulmonary Embolism: Best Practice Advice From the Clinical Guidelines Committee of the American College of Physicians". Annals of Internal Medicine. 163 (9): 701–11. doi:10.7326/M14-1772. PMID 26414967.
- ^ a b c d Ullah S, Jan SU, Rehman HU, Butt NI, Rauf MA, Shah S, Jan MY (March 2019). "Research productivity in Pakistan heart journal from 2005 to 2018: a scientometric study". Pakistan Heart Journal. 52 (2). doi:10.47144/phj.v52i2.1763 (inactive 31 January 2024).
{{cite journal}}: CS1 메인트: DOI 2024년 1월 기준 비활성화 (링크) - ^ a b c d e f g Stein PD, Woodard PK, Weg JG, Wakefield TW, Tapson VF, Sostman HD, et al. (January 2007). "Diagnostic pathways in acute pulmonary embolism: recommendations of the PIOPED II Investigators". Radiology. 242 (1): 15–21. doi:10.1148/radiol.2421060971. PMID 17185658.
- ^ a b c d e Konstantinides SV, Torbicki A, Agnelli G, Danchin N, Fitzmaurice D, Galiè N, et al. (November 2014). "2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism". European Heart Journal. 35 (43): 3033–69, 3069a–69k. doi:10.1093/eurheartj/ehu283. PMID 25173341.
- ^ a b Wells PS, Hirsh J, Anderson DR, Lensing AW, Foster G, Kearon C, et al. (May 1995). "Accuracy of clinical assessment of deep-vein thrombosis". Lancet. 345 (8961): 1326–30. doi:10.1016/S0140-6736(95)92535-X. PMID 7752753. S2CID 23107192.
- ^ a b Wells PS, Ginsberg JS, Anderson DR, Kearon C, Gent M, Turpie AG, et al. (December 1998). "Use of a clinical model for safe management of patients with suspected pulmonary embolism". Annals of Internal Medicine. 129 (12): 997–1005. doi:10.7326/0003-4819-129-12-199812150-00002. PMID 9867786. S2CID 41389736.
- ^ a b c d e Wells PS, Anderson DR, Rodger M, Ginsberg JS, Kearon C, Gent M, et al. (March 2000). "Derivation of a simple clinical model to categorize patients probability of pulmonary embolism: increasing the models utility with the SimpliRED D-dimer". Thrombosis and Haemostasis. 83 (3): 416–20. doi:10.1055/s-0037-1613830. PMID 10744147. S2CID 10013631.
- ^ a b Wells PS, Anderson DR, Rodger M, Stiell I, Dreyer JF, Barnes D, et al. (July 2001). "Excluding pulmonary embolism at the bedside without diagnostic imaging: management of patients with suspected pulmonary embolism presenting to the emergency department by using a simple clinical model and d-dimer". Annals of Internal Medicine. 135 (2): 98–107. doi:10.7326/0003-4819-135-2-200107170-00010. PMID 11453709. S2CID 2708155.
- ^ Sanson BJ, Lijmer JG, Mac Gillavry MR, Turkstra F, Prins MH, Büller HR (February 2000). "Comparison of a clinical probability estimate and two clinical models in patients with suspected pulmonary embolism. ANTELOPE-Study Group". Thrombosis and Haemostasis. 83 (2): 199–203. doi:10.1055/s-0037-1613785. PMID 10739372. S2CID 26531577.
- ^ a b van Belle A, Büller HR, Huisman MV, Huisman PM, Kaasjager K, Kamphuisen PW, et al. (January 2006). "Effectiveness of managing suspected pulmonary embolism using an algorithm combining clinical probability, D-dimer testing, and computed tomography". JAMA. 295 (2): 172–79. doi:10.1001/jama.295.2.172. PMID 16403929.
- ^ Roy PM, Meyer G, Vielle B, Le Gall C, Verschuren F, Carpentier F, et al. (February 2006). "Appropriateness of diagnostic management and outcomes of suspected pulmonary embolism". Annals of Internal Medicine. 144 (3): 157–64. CiteSeerX 10.1.1.1032.7193. doi:10.7326/0003-4819-144-3-200602070-00003. PMID 16461959. S2CID 38894349.
- ^ Neff MJ (August 2003). "ACEP releases clinical policy on evaluation and management of pulmonary embolism". American Family Physician. 68 (4): 759–60. PMID 12952389. Archived from the original on 2007-09-26.
- ^ a b Yap KS, Kalff V, Turlakow A, Kelly MJ (September 2007). "A prospective reassessment of the utility of the Wells score in identifying pulmonary embolism". The Medical Journal of Australia. 187 (6): 333–6. doi:10.5694/j.1326-5377.2007.tb01274.x. PMID 17874979. S2CID 17476982.
- ^ van Es N, van der Hulle T, Büller HR, Klok FA, Huisman MV, Galipienzo J, Di Nisio M (February 2017). "Is stand-alone D-dimer testing safe to rule out acute pulmonary embolism?". Journal of Thrombosis and Haemostasis. 15 (2): 323–28. doi:10.1111/jth.13574. PMID 27873439.
- ^ a b Kline JA, Courtney DM, Kabrhel C, Moore CL, Smithline HA, Plewa MC, et al. (May 2008). "Prospective multicenter evaluation of the pulmonary embolism rule-out criteria". Journal of Thrombosis and Haemostasis. 6 (5): 772–80. doi:10.1111/j.1538-7836.2008.02944.x. PMID 18318689. S2CID 25488146.
- ^ Kline JA, Mitchell AM, Kabrhel C, Richman PB, Courtney DM (August 2004). "Clinical criteria to prevent unnecessary diagnostic testing in emergency department patients with suspected pulmonary embolism". Journal of Thrombosis and Haemostasis. 2 (8): 1247–55. doi:10.1111/j.1538-7836.2004.00790.x. PMID 15304025. S2CID 19311896.
- ^ Carrier M, Righini M, Djurabi RK, Huisman MV, Perrier A, Wells PS, et al. (May 2009). "VIDAS D-dimer in combination with clinical pre-test probability to rule out pulmonary embolism. A systematic review of management outcome studies". Thrombosis and Haemostasis. 101 (5): 886–92. doi:10.1160/TH-08-10-0689. PMID 19404542. S2CID 23851417.
- ^ Schrecengost JE, LeGallo RD, Boyd JC, Moons KG, Gonias SL, Rose CE, Bruns DE (September 2003). "Comparison of diagnostic accuracies in outpatients and hospitalized patients of D-dimer testing for the evaluation of suspected pulmonary embolism". Clinical Chemistry. 49 (9): 1483–90. doi:10.1373/49.9.1483. PMID 12928229.
- ^ Crawford F, Andras A, Welch K, Sheares K, Keeling D, Chappell FM, et al. (Cochrane Vascular Group) (August 2016). "D-dimer test for excluding the diagnosis of pulmonary embolism". The Cochrane Database of Systematic Reviews. 2016 (8): CD010864. doi:10.1002/14651858.CD010864.pub2. PMC 6457638. PMID 27494075.
- ^ a b Schouten HJ, Geersing GJ, Koek HL, Zuithoff NP, Janssen KJ, Douma RA, et al. (May 2013). "Diagnostic accuracy of conventional or age adjusted D-dimer cut-off values in older patients with suspected venous thromboembolism: systematic review and meta-analysis". BMJ. 346: f2492. doi:10.1136/bmj.f2492. PMC 3643284. PMID 23645857.
- ^ van Es N, van der Hulle T, van Es J, den Exter PL, Douma RA, Goekoop RJ, et al. (August 2016). "Wells Rule and d-Dimer Testing to Rule Out Pulmonary Embolism: A Systematic Review and Individual-Patient Data Meta-analysis". Annals of Internal Medicine. 165 (4): 253–61. doi:10.7326/m16-0031. PMID 27182696. S2CID 207538572.
- ^ Werman HA, Karren K, Mistovich J (2014). "Other Conditions That Cause Respiratory Distress: Pulmonary Embolism". In Howard WA, Mistovich J, Karren K (eds.). Prehospital Emergency Care, 10e. Pearson Education, Inc. p. 456.
- ^ Söhne M, Ten Wolde M, Büller HR (November 2004). "Biomarkers in pulmonary embolism". Current Opinion in Cardiology. 19 (6): 558–62. doi:10.1097/01.hco.0000138991.82347.0e. PMID 15502498. S2CID 39899682.
- ^ a b Torbicki A, Perrier A, Konstantinides S, Agnelli G, Galiè N, Pruszczyk P, et al. (September 2008). "Guidelines on the diagnosis and management of acute pulmonary embolism: the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC)". European Heart Journal. 29 (18): 2276–315. doi:10.1093/eurheartj/ehn310. PMID 18757870.
- ^ a b Stein PD, Freeman LM, Sostman HD, Goodman LR, Woodard PK, Naidich DP, et al. (December 2009). "SPECT in acute pulmonary embolism". Journal of Nuclear Medicine (Review). 50 (12): 1999–2007. doi:10.2967/jnumed.109.063958. PMID 19949025.
- ^ Da Costa Rodrigues J, Alzuphar S, Combescure C, Le Gal G, Perrier A (September 2016). "Diagnostic characteristics of lower limb venous compression ultrasonography in suspected pulmonary embolism: a meta-analysis". Journal of Thrombosis and Haemostasis. 14 (9): 1765–72. doi:10.1111/jth.13407. PMID 27377039.
- ^ van Mens TE, Scheres LJ, de Jong PG, Leeflang MM, Nijkeuter M, Middeldorp S, et al. (Cochrane Vascular Group) (January 2017). "Imaging for the exclusion of pulmonary embolism in pregnancy". The Cochrane Database of Systematic Reviews. 1 (1): CD011053. doi:10.1002/14651858.CD011053.pub2. PMC 6464730. PMID 28124411.
- ^ Schaefer-Prokop C, Prokop M (November 2005). "MDCT for the diagnosis of acute pulmonary embolism". European Radiology. 15 (Suppl 4): D37–41. doi:10.1007/s10406-005-0144-3. PMID 16479644. S2CID 6074.
- ^ Van Strijen MJ, De Monye W, Kieft GJ, Pattynama PM, Prins MH, Huisman MV (January 2005). "Accuracy of single-detector spiral CT in the diagnosis of pulmonary embolism: a prospective multicenter cohort study of consecutive patients with abnormal perfusion scintigraphy". Journal of Thrombosis and Haemostasis. 3 (1): 17–25. doi:10.1111/j.1538-7836.2004.01064.x. PMID 15634261. S2CID 38746246.
- ^ a b Stein PD, Fowler SE, Goodman LR, Gottschalk A, Hales CA, Hull RD, et al. (June 2006). "Multidetector computed tomography for acute pulmonary embolism". The New England Journal of Medicine. 354 (22): 2317–27. doi:10.1056/NEJMoa052367. PMID 16738268.
- ^ Anderson DR, Kahn SR, Rodger MA, Kovacs MJ, Morris T, Hirsch A, et al. (December 2007). "Computed tomographic pulmonary angiography vs ventilation-perfusion lung scanning in patients with suspected pulmonary embolism: a randomized controlled trial". JAMA. 298 (23): 2743–53. doi:10.1001/jama.298.23.2743. PMID 18165667.
- ^ Scarsbrook AF, Gleeson FV (February 2007). "Investigating suspected pulmonary embolism in pregnancy". BMJ. 334 (7590): 418–19. doi:10.1136/bmj.39071.617257.80. PMC 1804186. PMID 17322258. Archived from the original on 2007-09-04.
- ^ Leung AN, Bull TM, Jaeschke R, Lockwood CJ, Boiselle PM, Hurwitz LM, et al. (November 2011). "An official American Thoracic Society/Society of Thoracic Radiology clinical practice guideline: evaluation of suspected pulmonary embolism in pregnancy". American Journal of Respiratory and Critical Care Medicine. 184 (10): 1200–08. doi:10.1164/rccm.201108-1575ST. PMID 22086989.
- ^ a b c Thomson AJ, Greer IA (April 2015). "Thrombosis and Embolism during Pregnancy and the Puerperium, the Acute Management of (Green-top Guideline No. 37b)". Royal College of Obstetricians & Gynaecologists. Retrieved 4 June 2018.
- ^ Mortensen J, Gutte H (May 2014). "SPECT/CT and pulmonary embolism". European Journal of Nuclear Medicine and Molecular Imaging. 41 (Suppl 1): S81–S90. doi:10.1007/s00259-013-2614-5. PMC 4003400. PMID 24213621.
- ^ Worsley DF, Alavi A, Aronchick JM, Chen JT, Greenspan RH, Ravin CE (October 1993). "Chest radiographic findings in patients with acute pulmonary embolism: observations from the PIOPED Study". Radiology. 189 (1): 133–36. doi:10.1148/radiology.189.1.8372182. PMID 8372182.
- ^ Konstantinides SV, Torbicki A, Agnelli G, Danchin N, Fitzmaurice D, Galiè N, et al. (November 2014). "2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism". European Heart Journal. 35 (43): 3033–69, 3069a–69k. doi:10.1093/eurheartj/ehu283. PMID 25173341.
Pulmonary angiography has for decades remained the 'gold standard' for the diagnosis or exclusion of PE but is rarely performed now as less-invasive CT angiography offers similar diagnostic accuracy.
- ^ a b Brown G, Hogg K (October 2005). "Best evidence topic report. Diagnostic utility of electrocardiogram for diagnosing pulmonary embolism". Emergency Medicine Journal. 22 (10): 729–30. doi:10.1136/emj.2005.029041. PMC 1726554. PMID 16189038.
- ^ Mattu A, Goyal D, eds. (2007). Emergency medicine avoiding the pitfalls and improving the outcomes. Malden, Mass.: Blackwell Pub./BMJ Books. p. 9. ISBN 978-0470755174. Archived from the original on 2017-09-08.
- ^ McGinn S, White PD (1935). "Acute cor pulmonale resulting from pulmonary embolism". J Am Med Assoc. 104 (17): 1473–80. doi:10.1001/jama.1935.02760170011004.
- ^ Rodger M, Makropoulos D, Turek M, Quevillon J, Raymond F, Rasuli P, Wells PS (October 2000). "Diagnostic value of the electrocardiogram in suspected pulmonary embolism". The American Journal of Cardiology. 86 (7): 807–09, A10. doi:10.1016/S0002-9149(00)01090-0. PMID 11018210.
- ^ Amal Mattu; Deepi Goyal; Barrett, Jeffrey W.; Joshua Broder; DeAngelis, Michael; Peter Deblieux; Gus M. Garmel; Richard Harrigan; David Karras; Anita L'Italien; David Manthey (2007). Emergency medicine: avoiding the pitfalls and improving the outcomes. Malden, Mass: Blackwell Pub./BMJ Books. p. 10. ISBN 978-1-4051-4166-6.
- ^ Shopp JD, Stewart LK, Emmett TW, Kline JA (October 2015). "Findings From 12-lead Electrocardiography That Predict Circulatory Shock From Pulmonary Embolism: Systematic Review and Meta-analysis". Academic Emergency Medicine. 22 (10): 1127–37. doi:10.1111/acem.12769. PMC 5306533. PMID 26394330.
- ^ Kosuge M, Ebina T, Hibi K, Tsukahara K, Iwahashi N, Gohbara M, et al. (December 2012). "Differences in negative T waves among acute coronary syndrome, acute pulmonary embolism, and Takotsubo cardiomyopathy". European Heart Journal - Acute Cardiovascular Care. 1 (4): 349–57. doi:10.1177/2048872612466790. PMC 3760560. PMID 24062927.
- ^ Kucher N, Goldhaber SZ (November 2003). "Cardiac biomarkers for risk stratification of patients with acute pulmonary embolism". Circulation. 108 (18): 2191–94. doi:10.1161/01.CIR.0000100687.99687.CE. PMID 14597581.
- ^ Lankeit M, Jiménez D, Kostrubiec M, Dellas C, Hasenfuss G, Pruszczyk P, Konstantinides S (December 2011). "Predictive value of the high-sensitivity troponin T assay and the simplified Pulmonary Embolism Severity Index in hemodynamically stable patients with acute pulmonary embolism: a prospective validation study". Circulation. 124 (24): 2716–24. doi:10.1161/CIRCULATIONAHA.111.051177. PMID 22082681.
- ^ McConnell MV, Solomon SD, Rayan ME, Come PC, Goldhaber SZ, Lee RT (August 1996). "Regional right ventricular dysfunction detected by echocardiography in acute pulmonary embolism". The American Journal of Cardiology. 78 (4): 469–73. doi:10.1016/S0002-9149(96)00339-6. PMID 8752195.
- ^ a b "UOTW #2 Answer - Ultrasound of the Week". Ultrasound of the Week. 16 June 2014. Archived from the original on 12 January 2017. Retrieved 27 May 2017.
- ^ 국립 보건 임상 우수성 연구소. 임상지침 92: 정맥혈전색전증: 위험도 감소: 입원환자 정맥혈전색전증(심부정맥혈전증, 폐색전증) 위험도 감소 런던, 2010년 1월.
- ^ Vinson DR, Zehtabchi S, Yealy DM (November 2012). "Can selected patients with newly diagnosed pulmonary embolism be safely treated without hospitalization? A systematic review". Annals of Emergency Medicine. 60 (5): 651–662.e4. doi:10.1016/j.annemergmed.2012.05.041. PMID 22944455.
- ^ Yoo HH, Queluz TH, El Dib R (January 2016). "Anticoagulant treatment for subsegmental pulmonary embolism". The Cochrane Database of Systematic Reviews (1): CD010222. doi:10.1002/14651858.CD010222.pub3. PMC 7004894. PMID 26756331.
- ^ a b Robertson L, Jones LE (February 2017). "Fixed dose subcutaneous low molecular weight heparins versus adjusted dose unfractionated heparin for the initial treatment of venous thromboembolism". The Cochrane Database of Systematic Reviews. 2017 (2): CD001100. doi:10.1002/14651858.CD001100.pub4. PMC 6464611. PMID 28182249.
- ^ Li M, Li J, Wang X, Hui X, Wang Q, Xie S, et al. (April 2023). "Oral direct thrombin inhibitors or oral factor Xa inhibitors versus conventional anticoagulants for the treatment of pulmonary embolism". The Cochrane Database of Systematic Reviews. 2023 (4): CD010957. doi:10.1002/14651858.CD010957.pub3. PMC 10103165. PMID 37057837.
- ^ a b c d e f 국립 보건 임상 우수성 연구소. 임상 가이드라인 144: 정맥혈전색전 질환: 정맥혈전색전 질환의 관리 및 혈전증 검사의 역할 런던, 2012.
- ^ Mai V, Guay CA, Perreault L, Bonnet S, Bertoletti L, Lacasse Y, et al. (June 2019). "Extended Anticoagulation for VTE: A Systematic Review and Meta-Analysis". Chest. 155 (6): 1199–1216. doi:10.1016/j.chest.2019.02.402. PMID 31174635. S2CID 182950850.
- ^ Yoo HH, Nunes-Nogueira VS, Fortes Villas Boas PJ (February 2020). "Anticoagulant treatment for subsegmental pulmonary embolism". The Cochrane Database of Systematic Reviews. 2020 (2): CD010222. doi:10.1002/14651858.CD010222.pub4. PMC 7004894. PMID 32030721.
- ^ Ucar EY (June 2019). "Update on Thrombolytic Therapy in Acute Pulmonary Thromboembolism". The Eurasian Journal of Medicine. 51 (2): 186–190. doi:10.5152/eurasianjmed.2019.19291. PMC 6592452. PMID 31258361.
- ^ a b Lavonas EJ, Drennan IR, Gabrielli A, Heffner AC, Hoyte CO, Orkin AM, et al. (November 2015). "Part 10: Special Circumstances of Resuscitation: 2015 American Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care". Circulation. 132 (18 Suppl 2): S501–S518. doi:10.1161/cir.0000000000000264. PMID 26472998. S2CID 207614432.
- ^ Kuo WT, Gould MK, Louie JD, Rosenberg JK, Sze DY, Hofmann LV (November 2009). "Catheter-directed therapy for the treatment of massive pulmonary embolism: systematic review and meta-analysis of modern techniques". Journal of Vascular and Interventional Radiology. 20 (11): 1431–1440. doi:10.1016/j.jvir.2009.08.002. PMID 19875060.
- ^ Engelberger RP, Kucher N (March 2014). "Ultrasound-assisted thrombolysis for acute pulmonary embolism: a systematic review". European Heart Journal. 35 (12): 758–764. doi:10.1093/eurheartj/ehu029. PMID 24497337.
- ^ Zuo Z, Yue J, Dong BR, Wu T, Liu GJ, Hao Q (April 2021). "Thrombolytic therapy for pulmonary embolism". The Cochrane Database of Systematic Reviews. 2021 (4): CD004437. doi:10.1002/14651858.CD004437.pub6. PMC 8092433. PMID 33857326.
- ^ a b Nakamura S, Takano H, Kubota Y, Asai K, Shimizu W (July 2014). "Impact of the efficacy of thrombolytic therapy on the mortality of patients with acute submassive pulmonary embolism: a meta-analysis". Journal of Thrombosis and Haemostasis. 12 (7): 1086–1095. doi:10.1111/jth.12608. PMID 24829097. S2CID 21881585.
- ^ Chatterjee S, Chakraborty A, Weinberg I, Kadakia M, Wilensky RL, Sardar P, et al. (June 2014). "Thrombolysis for pulmonary embolism and risk of all-cause mortality, major bleeding, and intracranial hemorrhage: a meta-analysis". JAMA. 311 (23): 2414–2421. doi:10.1001/jama.2014.5990. PMID 24938564.
- ^ a b Young T, Sriram KB (October 2020). "Vena caval filters for the prevention of pulmonary embolism". The Cochrane Database of Systematic Reviews. 10 (12): CD006212. doi:10.1002/14651858.CD006212.pub5. PMC 8971091. PMID 33027844. S2CID 222216149.
- ^ Augustinos P, Ouriel K (August 2004). "Invasive approaches to treatment of venous thromboembolism". Circulation. 110 (9 Suppl 1): I27–34. doi:10.1161/01.CIR.0000140900.64198.f4. PMID 15339878.
- ^ Madani MM (2016). "50. Pulmonary Thromboendarterectomy". In Peacock AJ, Naeije R, Rubin LJ (eds.). Pulmonary Circulation: Diseases and Their Treatment (Fourth ed.). CRC Press. p. 541. ISBN 978-1-4987-1991-9.
- ^ Walker RH, Goodwin J, Jackson JA (October 1970). "Resolution of pulmonary embolism". British Medical Journal. 4 (5728): 135–39. doi:10.1136/bmj.4.5728.135. PMC 1819885. PMID 5475816.
- ^ Le Gal G, Righini M, Parent F, van Strijen M, Couturaud F (April 2006). "Diagnosis and management of subsegmental pulmonary embolism". Journal of Thrombosis and Haemostasis. 4 (4): 724–31. doi:10.1111/j.1538-7836.2006.01819.x. PMID 16634736. S2CID 20515117.
- ^ Perrier A, Bounameaux H (June 2006). "Accuracy or outcome in suspected pulmonary embolism". The New England Journal of Medicine. 354 (22): 2383–85. doi:10.1056/NEJMe068076. PMID 16738276.
- ^ White RH (October 2008). "Risk of fatal pulmonary embolism was 0.49 per 100 person-years after discontinuing anticoagulant therapy for venous thromboembolism". Evidence-Based Medicine. 13 (5): 154. doi:10.1136/ebm.13.5.154. PMID 18836122. S2CID 29062377.
- ^ Barritt DW, Jordan SC (June 1960). "Anticoagulant drugs in the treatment of pulmonary embolism. A controlled trial". Lancet. 1 (7138): 1309–1312. doi:10.1016/S0140-6736(60)92299-6. PMID 13797091.
- ^ Cugell DW, Buckingham WB, Webster JR, Kettel LJ (January 1967). "The limitations of laboratory methods in the diagnosis of pulmonary embolism". The Medical Clinics of North America. 51 (1): 175–184. doi:10.1016/s0025-7125(16)33092-9. PMID 4869238.
- ^ Jiménez D, Yusen RD, Otero R, Uresandi F, Nauffal D, Laserna E, et al. (July 2007). "Prognostic models for selecting patients with acute pulmonary embolism for initial outpatient therapy". Chest. 132 (1): 24–30. doi:10.1378/chest.06-2921. PMID 17625081.
- ^ a b Zhou XY, Ben SQ, Chen HL, Ni SS (December 2012). "The prognostic value of pulmonary embolism severity index in acute pulmonary embolism: a meta-analysis". Respiratory Research. 13 (1): 111. doi:10.1186/1465-9921-13-111. PMC 3571977. PMID 23210843.
- ^ Kumar V, Abbas AK, Fausto N, Mitchell RN (2010). Basic Pathology. New Delhi: Elsevier. p. 98. ISBN 978-81-312-1036-9.
외부 링크
- 컬리 폐색전증
- Wells 기준 폐색전증 온라인 계산기 Archived 2016-11-21 at the Wayback Machine
- 임상 예측 웹사이트 – 폐색전증에 대한 Wells 기준
 위키미디어 커먼즈 폐색전증 관련 매체
위키미디어 커먼즈 폐색전증 관련 매체- "Pulmonary Embolism". MedlinePlus. U.S. National Library of Medicine.