핵수용체
Nuclear receptor분자생물학 분야에서 핵수용체는 스테로이드, 갑상선 호르몬, 콜레스테롤, 비타민을 감지하는 단백질의 한 종류이다.이 수용체들은 특정 유전자의 발현을 조절하기 위해 다른 단백질들과 함께 작용하여 유기체의 발달, 항상성, 그리고 신진대사를 조절합니다.
핵 수용체는 인접한 유전자의 발현을 조절하는 DNA에 직접 결합하기 때문에 이러한 수용체는 전사 [2][3]인자로 분류된다.핵 수용체에 의한 유전자 발현 조절은 종종 수용체의 행동에 영향을 미치는 분자인 배위자의 존재 하에서 일어난다.핵수용체에 대한 리간드 결합은 수용체를 활성화하는 구조 변화를 초래한다.그 결과 유전자 발현을 업 또는 다운 조절한다.
다른 종류의 수용체와 구별되는 핵 수용체의 독특한 특성은 게놈 DNA에 대한 직접적인 통제이다.핵 수용체는 태아의 발달과 성인의 항상성에 중요한 역할을 한다.핵수용체는 아래와 같이 메커니즘이나 [6][7]호몰로지에 따라[4][5] 분류된다.
종 분포
핵 수용체는 메타조아(동물)에 특유하며, 원생동물, 조류, 곰팡이, [8]식물에서는 발견되지 않는다.염기서열된 게놈을 가진 초기 분기 동물 계통 중 2개는 스펀지 암피메돈 퀸즐랜디카에서, 2개는 플라코조아 트리코플락스[9] 아드헤렌스에서,[10] 17개는 크니다리아 네마토스테라 벡텐시스에서 보고되었다.회충 케노하브디티스 [11]엘레강스에만 270개의 핵수용체가 있으며 초파리와 다른 [12]곤충에 21개,[13] 제브라피쉬에 73개가 있다.인간, 쥐, 쥐는 각각 [14]48, 49, 47개의 핵 수용체를 가지고 있다.
리간드
핵수용체와 결합하고 활성화하는 리간드는 내인성 호르몬, 비타민 A, D, 이생체 호르몬과 같은 친유성 물질을 포함한다.많은 유전자의 발현이 핵 수용체에 의해 조절되기 때문에, 이러한 수용체를 활성화시키는 리간드는 유기체에 깊은 영향을 미칠 수 있다.이러한 조절된 유전자 중 많은 것들이 다양한 질병과 연관되어 있는데, 이는 미국 식품의약국(FDA)이 승인한 약 13%의 분자 표적이 핵 [15]수용체를 목표로 하는 이유를 설명해준다.
고아 [16]수용체라고 불리는 많은 핵 수용체들은 알려진(또는 적어도 일반적으로 합의된) 내인성 리간드를 가지고 있지 않다.FXR, LXR 및 PPAR과 같은 이러한 수용체 중 일부는 비교적 낮은 친화력으로 지방산, 담즙산 및/또는 스테롤과 같은 다수의 대사 중간체와 결합한다.따라서 이 수용체들은 대사 센서로 기능할 수 있다.CAR 및 PXR과 같은 다른 핵 수용체는 이러한 이종 생물 물질을 [17]대사하는 시토크롬 P450 효소의 발현을 상향 조절하는 이종 생물 센서로서 기능하는 것으로 보인다.
구조.
대부분의 핵 수용체는 5만에서 10만 달톤 사이의 분자량을 가지고 있다.
핵수용체는 구조적으로 모듈화되어 있으며 다음 도메인을 [18][19]포함한다.
- (A-B) N 터미널 규제 구역:리간드의 [20]존재와 무관한 작용을 하는 활성화 기능 1(AF-1)을 포함한다.AF-1의 전사 활성화는 일반적으로 매우 약하지만, E-도메인(아래 참조)의 AF-2와 시너지 작용하여 보다 강력한 유전자 발현 상향 조절을 생성한다.A-B 도메인은 다양한 핵 수용체들 사이에서 순서적으로 매우 가변적이다.
- (C) DNA 결합 도메인(DBD): 호르몬 반응 요소(HRE)라고 불리는 DNA의 특정 배열에 결합하는 2개의 아연 핑거를 포함하는 고도로 보존된 도메인.최근 기생 편형동물 NR에서 새로운 아연 핑거 모티브(CHC2)가 식별된다.[21]
- (D) 힌지 영역:DBD와 LBD를 연결하는 유연한 도메인이라고 생각됩니다.표적 펩타이드 배열로 세포 내 밀매 및 세포 내 분포에 영향을 미칩니다.
- (E) 리간드 결합 도메인(LBD): 다양한 핵수용체 사이의 구조를 적절히 보존하고 순서대로 보존한다.LBD의 구조는 3개의 반평행 알파 나선형(샌드위치 채우기)이 한쪽에 2개의 알파 나선형, 다른 한쪽에 3개의 알파 나선형(빵형)으로 측면되어 있는 알파 나선형(alpha helic) 샌드위치 폴드라고 한다.리간드 결합 공동은 LBD 내부와 3개의 반평행 알파 나선 샌드위치 "충전" 바로 아래에 있습니다.DBD와 함께 LBD는 수용체의 이합체 계면에 기여하고, 또한 공활성제와 코어프레서 단백질을 결합시킨다.LBD는 또한 활성 함수 2(AF-2)를 포함하고 있으며, 그 작용은 나선 12(H12)[20]의 배치에 의해 제어되는 결합 배위자의 존재에 의존한다.
- (F) C 터미널 도메인:다양한 핵 수용체들 사이에서 순서적으로 매우 가변적입니다.
N 말단(A/B), DNA 결합(C) 및 리간드 결합(E) 도메인은 독립적으로 잘 접혀져 구조적으로 안정되어 있는 반면 힌지 영역(D) 및 옵션의 C 말단(F) 도메인은 구조적으로 유연하고 [22]무질서할 수 있습니다.도메인의 상대적인 방향은 3개의 기존의 멀티 도메인 결정 구조를 비교함으로써 매우 다릅니다.그 중 2개는 DR1에 바인딩(1bp로 [1][23]분리된 DBD), 1개는 DR4에 바인딩(4bp에 [24]의해 바인딩)입니다.
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
작용 메커니즘
핵수용체는 그들의 동족배위자의 신호를 변환하는 다기능 단백질이다.핵수용체(NR)는 리간드가 없을 때 작용 메커니즘과 세포내 분포에 따라 크게 두 가지 등급으로 분류될 수 있다.
천연 호르몬과 같은 작은 친유성 물질은 세포막을 통해 확산되어 세포의 세포(타입 I NR) 또는 핵(타입 II NR)에 위치한 핵 수용체에 결합한다.결합은 수용체의 등급에 따라 유전자 발현을 업 또는 다운 조절하는 결과를 초래하는 DNA 전사 조절 부위로 NR을 유도하는 일련의 다운스트림 이벤트를 촉발하는 수용체의 구조 변화를 일으킨다.그들은 일반적으로 호모/[27]헤테로디머 역할을 한다.또한 타입 I의 변종인 타입 III와 모노머로서 DNA를 결합하는 타입 IV의 두 가지 추가 클래스도 확인되었다.[4]
따라서 핵수용체는 다음의 4가지 [4][5]역학적 분류로 세분될 수 있다.
타입 I
세포질에서 타입 I 핵 수용체에 결합하는 리간드는 열충격 단백질의 해리, 호모 이량화, 세포질에서 세포핵으로의 전위(즉, 활성 수송)를 초래하고 호르몬 반응 요소(HREs)로 알려진 DNA의 특정 배열에 결합한다.I형 핵수용체는 DNA의 가변 길이로 분리된 두 개의 반사이트로 구성된 HRE에 결합하고, 두 번째 반사이트는 첫 번째 반사이트(반전 반복)에서 반전된 염기서열을 가진다.I형 핵수용체에는 안드로겐 수용체, 에스트로겐 수용체, 글루코콜티코이드 수용체 및 프로게스테론 [28]수용체 등의 서브패밀리 3의 구성원이 포함된다.
일부 NR 서브패밀리2 핵수용체는 역반복 HRE 대신 직접반복에 결합할 수 있다.또한 수용체의 단일 DNA 결합 도메인이 단일 반쪽 부위 HRE에 결합하는 일부 핵 수용체.이러한 핵 수용체들은 내인성 리간드가 아직 알려져 있지 않기 때문에 고아 수용체로 간주된다.
핵 수용체/DNA 복합체는 그 후 HRE에서 메신저 RNA로 DNA를 전사하는 다른 단백질을 모집하고, 결국 세포 기능의 변화를 일으킨다.
타입 II
타입 I와 대조적으로 타입 II 수용체는 리간드 결합 상태에 관계없이 핵에 유지되며,[27] 추가적으로 DNA에 대한 헤테로 이합체(일반적으로 RXR과 함께)로서 결합된다.배위자가 없을 때, 타입 II 핵 수용체는 종종 코어프레서 단백질과 복합된다.핵수용체에 대한 리간드 결합은 코어프레서의 해리와 공동활성화 단백질의 공급을 일으킨다.이어서 RNA 중합효소를 포함한 추가 단백질이 메신저 RNA에 DNA를 전사하는 NR/DNA 복합체에 도입된다.
II형 핵수용체에는 주로 레티노인산수용체, 레티노이드X수용체 및 갑상선호르몬수용체 [29]등의 서브패밀리1이 포함된다.
타입 III
타입 III 핵수용체(주로 NR 서브패밀리 2)는 두 종류 모두 호모디머로 DNA에 결합한다는 점에서 타입 I 수용체와 유사하다.그러나 III형 핵수용체는 I형과 달리 역반복 HRE 대신 직접반복에 결합한다.
타입 IV
타입 IV 핵 수용체는 단량체 또는 이합체 중 하나로 결합하지만 수용체의 단일 DNA 결합 도메인만이 단일 절반 부위 HRE에 결합한다.타입 IV 수용체의 예는 대부분의 NR 서브패밀리에서 발견된다.
이량화
인간 핵 수용체는 특정 [30][31][27]상호작용에 초점을 맞춘 문헌의 대규모 Y2H 실험과 텍스트 마이닝 노력에서 알 수 있듯이 많은 다른 핵 수용체와 함께 이량화(동형 이량화)할 수 있다.다만, 같은 서브 패밀리의 멤버에게는 매우 유사한 NR 다이머라이제이션파트너가 있어 기반이 되는 다이머라이제이션네트워크에는 접속성이 높은 허브(RXR 및 SHP)[27]의 존재 등 특정 토폴로지 기능이 있습니다.
코어조절단백질
호르몬 반응 요소에 결합된 핵 수용체는 연관된 표적 유전자의 mRNA로의 [32][33]전사를 촉진하거나 억제하는 상당한 수의 다른 단백질(전사 조절기라고 함)을 모집한다.이러한 코어 조절기의 기능은 다양하며 염색질 리모델링(표적 유전자가 전사에 더 또는 덜 접근할 수 있게 함) 또는 다른 코어 조절 단백질의 결합을 안정시키는 브리징 기능을 포함한다.핵수용체는 많은 코어조절기 단백질에 특이적으로 결합할 수 있으며, 따라서 신호 전달의 세포 메커니즘에 직접적이든 [34]간접적이든 영향을 미칠 수 있다.
코액티베이터
작용제 리간드(아래 섹션 참조)가 핵수용체에 결합하면 공활성화 단백질을 우선적으로 결합하는 수용체의 배합이 유도된다.이러한 단백질들은 종종 히스톤의 DNA에 대한 연결을 약화시키고, 따라서 유전자 전사를 촉진하는 내재적 히스톤 아세틸전달효소(HAT) 활성을 가지고 있다.
코어프레서
이와는 대조적으로 길항제 리간드가 핵수용체에 결합하는 것은 코어프레서 단백질을 우선적으로 결합하는 수용체의 배합을 유도한다.이 단백질들은 차례로 히스톤 탈아세틸라아제(HDACs)를 모집하는데, 이것은 DNA에 대한 히스톤의 연결을 강화하고, 따라서 유전자 전사를 억제한다.
작용 vs 길항
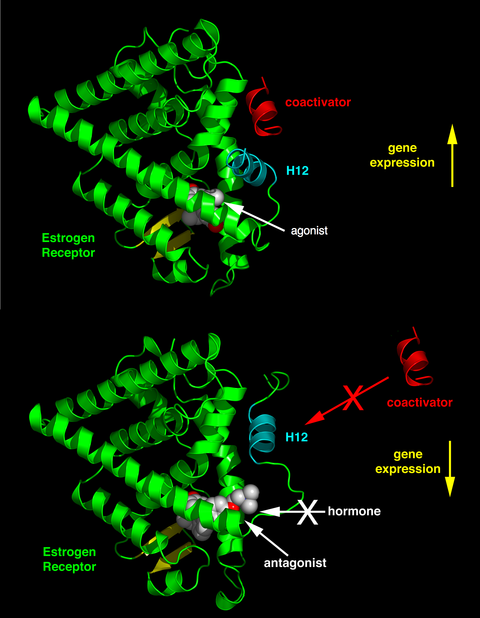
관련된 수용체, 리간드의 화학구조 및 영향을 받는 조직에 따라 핵수용체 리간드는 작용작용에서 길항작용,[37] 역작용까지 스펙트럼에서 극적으로 다양한 효과를 나타낼 수 있다.
어거니스트
내인성 리간드(예: 에스트라디올 및 테스토스테론 호르몬)의 동질 핵 수용체에 결합될 때 활동은 일반적으로 유전자 발현을 상향 조절한다.배위자에 의한 유전자 발현의 이러한 자극을 작용제 반응이라고 한다.내인성 호르몬의 작용제 효과는 특정 합성 리간드(예: 글루코콜티코이드 수용체 항염증제 덱사메타손)에 의해서도 모방될 수 있다.작용제 배위자는 공활성제 결합을 선호하는 수용체의 배합을 유도함으로써 작용한다(오른쪽 그림 윗부분 참조).
대항마
다른 합성 핵 수용체 리간드는 내인성 리간드가 없는 경우 유전자 전사에 명백한 영향을 미치지 않는다.그러나 그들은 핵 수용체에서 동일한 결합 부위에 대한 경쟁적 결합을 통해 작용제의 효과를 차단한다.이러한 배위자를 길항제라고 합니다.길항핵수용체 약물의 예로는 글루코콜티코이드 수용체와 프로게스테론 수용체에 결합하여 내인성 호르몬인 코르티솔과 프로게스테론의 활성을 각각 차단하는 미페프리스톤이 있다.길항제 리간드는 공활성제를 방지하고 코어프레서 결합을 촉진하는 수용체의 배합을 유도함으로써 작용한다(오른쪽 그림 하단 절반 참조).
역작용제
마지막으로, 일부 핵 수용체는 작용제가 없을 때 낮은 수준의 유전자 전사를 촉진한다.핵 수용체에서 이러한 기본적인 활동 수준을 감소시키는 합성 리간드는 역작용제로 [38]알려져 있다.
선택적 수용체 변조기
핵수용체를 통해 작용하는 많은 약물은 일부 조직에서는 작용제 반응을 보이고 다른 조직에서는 길항제 반응을 나타낸다.이러한 행동은 바람직하지 않은 부작용을 최소화하면서 약물의 바람직한 유익한 치료 효과를 유지할 수 있기 때문에 상당한 이점을 가질 수 있다.이러한 혼합 작용제/안타고니스트 작용 프로파일을 가진 약물을 선택적 수용체 변조제(SRM)라고 한다.예로는 Selective Androgen Receptor Modulators(SARM), SERM(Selective Estrogen Receptor Modulators) 및 SPRM(Selective Progesterone Receptor Modulators)이 있습니다.SRM의 작용 메커니즘은 리간드와 관련된 수용체의 화학 구조에 따라 달라질 수 있지만, 많은 SRM은 작용 작용과 길항 작용 사이에 밀접하게 균형을 이룬 수용체의 배합을 촉진함으로써 작용한다고 생각된다.코액티베이터 단백질의 농도가 코어프레서보다 높은 조직에서는 평형이 작용제 방향으로 이동한다.반대로 코어프레셔가 지배적인 조직에서는 리간드가 [39]길항제 역할을 한다.
대체 메커니즘

트랜스프레션
핵수용체 작용의 가장 일반적인 메커니즘은 핵수용체가 DNA 호르몬 반응 요소에 직접 결합하는 것을 포함한다.이 메커니즘을 트랜스액티베이션이라고 합니다.그러나 일부 핵 수용체는 DNA에 직접 결합할 수 있을 뿐만 아니라 다른 전사 인자와도 결합할 수 있는 능력을 가지고 있다.이 바인딩에 의해 트랜스프레스로 [40]알려진 프로세스에서 두 번째 전사 계수가 비활성화되는 경우가 많습니다.트랜스프레스가 가능한 핵수용체의 한 예는 글루코콜티코이드 수용체(GR)이다.또한 선택적 글루코콜티코이드 수용체 작용제(SEGRA)로 알려진 특정 GR 리간드는 GR이 트랜스활성화보다 강하게 트랜스프레스를 억제하는 방식으로 GR을 활성화할 수 있다.이러한 선택성은 이러한 선택적 글루코코르티코이드의 바람직한 항염증 효과와 바람직하지 않은 대사 부작용 사이의 분리를 증가시킨다.
비게놈
유전자 조절에 대한 핵 수용체의 전통적인 직접적인 영향은 핵 수용체 활성화와 단백질 발현 수준의 변화 사이의 많은 중간 단계 때문에 세포에서 기능적 효과가 나타나기 전에 보통 몇 시간이 걸린다.그러나 이온 채널 활성의 변화와 같은 핵 호르몬 적용의 많은 영향은 몇 분 이내에 발생하며 이는 핵 수용체 작용의 전통적인 메커니즘과 일치하지 않는다.핵 수용체의 이러한 비 게놈 효과에 대한 분자 표적은 결정적으로 입증되지 않았지만, 세포나 핵에 국재하는 대신 막과 연관된 핵 수용체의 변이가 있다는 가설이 있다.또한 이들 막 관련 수용체는 유전자 [41][42]조절을 수반하지 않는 대체 신호 전달 메커니즘을 통해 기능한다.
핵호르몬에 대한 여러 막 관련 수용체가 있다는 가설이 있지만, 많은 빠른 효과들은 표준 핵 [43][44]수용체를 필요로 하는 것으로 나타났다.그러나 유전자 발현에 대한 직접적인 영향을 방해하지 않고 수용체의 돌연변이에 의해 차단될 수 있는 비게놈 효과에 대한 특정 분자 메커니즘의 부재로 인해 생체 내 게놈 및 비게놈 메커니즘의 상대적 중요성이 시험되는 것이 방지되었다.
핵갑상선 호르몬 수용체 TRβ를 통한 비게놈 시그널링을 위한 분자 메커니즘은 포스파티딜이노시톨 3-키나아제(PI3K)[45]를 포함한다.이 시그널링은 직접 유전자 [46]조절을 방해하지 않고 TRβ에서 단일 티로신 대 페닐알라닌 치환에 의해 차단될 수 있다.TRβ의 [46]단일 보존적 아미노산 치환으로 생쥐를 만들었을 때, 해마의 시냅스 성숙과 가소성은 갑상선 호르몬 [47]합성을 완전히 차단하는 것과 거의 비슷하게 손상되었다.이 메커니즘은 모든 포유동물에서 보존되는 것으로 보이지만 TRα나 다른 핵 수용체에서는 보존되지 않는다.따라서 TRβ와 PI3K의 포스포티로신 의존성 결합은 갑상선 호르몬 및 수용체 티로신 키나제에 의한 발달 및 대사 조절을 통합하기 위한 잠재적 메커니즘을 제공한다.또한 PI3K를 통한 갑상선 호르몬 시그널링은 유전자 [48]발현을 변화시킬 수 있다.
가족 구성원
다음은 시퀀스 호몰로지에 [6][7]따라 분류된 48개의 알려진 인간 핵 수용체(및 다른 [14][49]종에 있는 그들의 맞춤법)의 목록이다.목록에는 인간 맞춤법이 없는 선택된 패밀리도 포함됩니다(노란색으로 강조 표시된 NRNC 기호).
| 서브패밀리 | 그룹. | 멤버 | ||||||
|---|---|---|---|---|---|---|---|---|
| NRNC[6] 기호 | 줄임말 | 이름. | 진 | 리간드 | ||||
| 1 | 갑상선호르몬수용체양 | A | 갑상선호르몬수용체 | NR1A1 | TRα | 갑상선호르몬수용체α | 스라 | 갑상선 호르몬 |
| NR1A2 | TRβ | 갑상선호르몬수용체β | 스러비 | |||||
| B | 레티노인산수용체 | NR1B1 | RARα | 레티노인산수용체α | 라라 | 비타민 A 및 관련 화합물 | ||
| NR1B2 | RARβ | 레티노인산수용체β | RARB | |||||
| NR1B3 | RAR r | 레티노인산 수용체 매개성의 | RARG | |||||
| C | 페르옥시좀증식제활성화수용체 | NR1C1 | PPARα | 페르옥시좀증식제활성화수용체α | PPARA | 지방산, 프로스타글란딘 | ||
| NR1C2 | PPAR-β/γ | 페르옥시좀증식제활성화수용체β/γ | PPARD | |||||
| NR1C3 | PPAR p | 페르옥시좀증식제활성화수용체γ | PPARG | |||||
| D | Rev-ErbA | NR1D1 | Rev-ErbAα | Rev-ErbAα | NR1D1 | 헴 | ||
| NR1D2 | Rev-ErbAβ | Rev-ErbAα | NR1D2 | |||||
| E | E78C와 같은 (절지동물, 손떨림동물, 물오스크, 선충)[49][50] | NR1E1 | Eip78C | 엑디손유도단백질78C | Eip78C | |||
| F | RAR관련고아수용체 | NR1F1 | RORα | RAR관련고아수용체α | 로라 | 콜레스테롤, ATRA | ||
| NR1F2 | RORβ | RAR관련고아수용체β | 회전하다 | |||||
| NR1F3 | ROR r | RAR 관련 고아수용체 매개체 | RORC | |||||
| G | CNR14 라이크(선충)[49] | NR1G1 | 성별 1 | 스테로이드 호르몬 수용체 cnr14[51] | 성별 1 | |||
| H | 간X수용체양 | NR1H1 | EcR | Ecdysone수용체, EcR(절지동물) | EcR | 엑시스테로이드 | ||
| NR1H2 | LXRβ | 간X수용체β | NR1H2 | 옥시스테롤 | ||||
| NR1H3 | LXRα | 간X수용체α | NR1H3 | |||||
| NR1H4 | FXR | 파르네소이드X수용체 | NR1H4 | |||||
| NR1H5[52] | FXR-β | 파르네소이드X수용체β (인간의 동종) | NR1H5P | |||||
| I | 비타민D수용체양 | NR1I1 | VDR | 비타민D수용체 | VDR | 비타민D | ||
| NR1I2 | PXR | 베그난X수용체 | NR1I2 | 이종생물학 | ||||
| NR1I3 | 차 | 구성 안드로스탄 수용체 | NR1I3 | 안드로스테인 | ||||
| J | Hr96[49] 라이크 | NR1J1 | Hr96/Daf-12 | 핵호르몬수용체 HR96 | Hr96 | 콜레스트롤/다파크론산[53] | ||
| NR1J2 | ||||||||
| NR1J3 | ||||||||
| K | Hr1과[49] 같은 | NR1K1 | Hr1 | 핵호르몬수용체 HR1 | ||||
| 2 | 레티노이드X수용체양 | A | 간세포핵인자-4 | NR2A1 | HNF4α | 간세포핵인자-4-α | HNF4A | 지방산 |
| NR2A2 | HNF4† | 간세포핵인자-4-γ | HNF4G | |||||
| B | 레티노이드X수용체 | NR2B1 | RXRα | 레티노이드X수용체α | RXRA | 레티노이드 | ||
| NR2B2 | RXRβ | 레티노이드X수용체β | RXRB | |||||
| NR2B3 | RXR rx | 레티노이드 X 수용체 매개성의 | RXRG | |||||
| NR2B4 | USP | 초박형 단백질(절지동물) | 사용하다 | 인지질[54] | ||||
| C | 고환수용체 | NR2C1 | TR2 | 고환수용체2 | NR2C1 | |||
| NR2C2 | TR4 | 고환수용체 4 | NR2C2 | |||||
| E | TLX/PNR | NR2E1 | TLX | 드로소필라 꼬리 없는 유전자의 상동성 | NR2E1 | |||
| NR2E3 | PNR | 광수용체세포특이핵수용체 | NR2E3 | |||||
| F | 쿱/이어 | NR2F1 | coup-tfi | 치킨 오발부민 업스트림 프로모터 전사인자 I | NR2F1 | |||
| NR2F2 | 쿠페 | 닭 오발부민 상류 프로모터 전사인자 II | NR2F2 | 레티노인산(약)[55] | ||||
| NR2F6 | EAR-2 | V-erbA 관련 | NR2F6 | |||||
| 3 | 에스트로겐 수용체 유사 | A | 에스트로겐수용체 | NR3A1 | ERα | 에스트로겐수용체α | ESR1 | 에스트로겐 |
| NR3A2 | ERβ | 에스트로겐수용체β | ESR2 | |||||
| B | 에스트로겐관련수용체 | NR3B1 | ERRα | 에스트로겐관련수용체α | ESRRA | |||
| NR3B2 | 에러베타 | 에스트로겐관련수용체β | ESRB | |||||
| NR3B3 | 에러 † | 에스트로겐 관련 수용체 매개체 | ESRG | |||||
| C | 3-케토스테로이드수용체 | NR3C1 | GR | 글루코콜티코이드수용체 | NR3C1 | 코르티솔 | ||
| NR3C2 | 미스터 | 미네랄콜티코이드수용체 | NR3C2 | 알도스테론 | ||||
| NR3C3 | 홍보 | 프로게스테론수용체 | PGR | 프로게스테론 | ||||
| NR3C4 | AR | 안드로겐수용체 | AR | 테스토스테론 | ||||
| D | 에스트로겐 수용체 유사 (lophotrochozoa에서)[56] | NR3D | ||||||
| E | 에스트로겐 수용체 유사 (cnidaria에서)[57] | NR3E | ||||||
| F | 에스트로겐 수용체 유사 (플라스코조아)[57] | NR3F | ||||||
| 4 | 신경증식인자 IB양 | A | NGFIB/NURR1/NOR1 | NR4A1 | NGFIB | 신경성장인자 IB | NR4A1 | |
| NR4A2 | NURR1 | 핵수용체 관련 1 | NR4A2 | |||||
| NR4A3 | NOR1 | 뉴런유래고아수용체1 | NR4A3 | |||||
| 5 | 스테로이드 유발 인자 유사 | A | SF1/LRH1 | NR5A1 | SF1 | 스테로이드 유발 인자 1 | NR5A1 | 포스파티딜이노시톨류 |
| NR5A2 | LRH-1 | 간수용체 호몰로그-1 | NR5A2 | 포스파티딜이노시톨류 | ||||
| B | Hr39와 같은 | NR5B1[49] | HR39/FTZ-F1 | 핵호르몬수용체 후시타라즈인자I 베타 | Hr39 | |||
| 6 | 생식세포 핵인자 유사 | A | GCNF | NR6A1 | GCNF | 생식세포핵인자 | NR6A1 | |
| 7 | 2개의 DNA 결합[49][58] 도메인을 가진 NR (평형동물, 연체동물, 절지동물) | A | 2DBD-NRα | NR7A1 | ||||
| B | 2DBD-NRβ | NR7B1 | ||||||
| C | 2DBD-NR † | NR7C1 | 절지동물 'α/β' | |||||
| 8 | NR8[59](eumetazoa) | A | NR8A | NR8A1 | CgNR8A1 | 핵수용체 8 | AKG49571 | |
| 0 | 기타(LBD 또는 DBD가 부족함) | A | knr/knrl/egon[49](절지동물) | NR0A1 | KNI | 접합간극단백질날개 | knl | |
| B | DAX/SHP | NR0B1 | DAX1 | 용량에 민감한 성역전, 부신저형성 임계부위, X염색체, 유전자 1 | NR0B1 | |||
| NR0B2 | SHP | 소규모 헤테로다이머 파트너 | NR0B2 | |||||
두 개의 0 패밀리 중 0A는 패밀리 1과 같은 DBD를 가지며 0B는 매우 고유한 LBD를 가집니다.패밀리 7의 두 번째 DBD는 패밀리1 DBD와 관련이 있을 수 있습니다.Biompalaria glabrata의 3개의 패밀리 1 NR은 패밀리 0B 유사 LBD와 [49]함께 DBD를 보유한다.C. elegans nhr-1(Q21878)의 배치는 논란의 여지가 있습니다.대부분의 소스에서는 NR1K1로 [49]되어 있습니다만, WormBase의 수동 주석에서는 NR2A의 [60]멤버로 간주됩니다.이전에는 Drosophila HR78/NR1D1(Q24142)과 Orthologes가 유일한 2D 그룹이 있었으나, 유사성이 높아 나중에 그룹 2C로 병합되어 "그룹 2C/D"[49]가 형성되었다. 생쥐와 초파리에 대한 녹아웃 연구는 이러한 합병 [61]그룹을 뒷받침한다.
진화
논쟁의 주제는 배위자 결합 또는 고아 수용체로서의 조상 핵 수용체의 정체성에 관한 것이었다.이 논쟁은 포유류의 스테로이드와 갑상선 [62]호르몬으로 확인된 25년도 더 전에 시작되었다.그 직후, 드로소필라의 엑디손 수용체 식별은 핵 수용체가 나노몰 친화력으로 리간드와 결합하는 호르몬 수용체라는 생각을 도입했다.당시 알려진 3가지 핵수용체 리간드는 스테로이드, 레티노이드, 갑상선 호르몬으로 스테로이드와 레티노이드 모두 테르페노이드 대사의 산물이었다.따라서, 조상 수용체는 테르페노이드 [63]분자에 의해 결합되었을 것으로 가정되었다.
1992년, 알려진 모든 핵 수용체의 DNA 결합 도메인을 비교한 결과, 모든 핵 수용체가 공통 [64]조상을 공유한다는 것을 나타내는 핵 수용체의 계통수 구축이 이루어졌다.그 결과, 첫 번째 핵 수용체 상태를 밝혀내기 위한 노력이 증가하였고, 1997년까지 대안 가설이 제시되었다. 즉, 조상 핵 수용체는 고아 수용체였으며 시간이 지남에 따라[7] 리간드 결합 능력을 획득하였다. 이 가설은 다음과 같은 주장을 바탕으로 제안되었다.
- 초기 메타조안(Cnidarians 및 Schistosoma)에서 확인된 핵 수용체 배열은 모두 수용체의 COUP-TF, RXR, FTZ-F1 그룹의 구성원이었다.COUP-TF와 FTZ-F1은 모두 고아 수용체이며, RXR은 척추동물에서만 [65]리간드와 결합하는 것으로 확인되었다.
- 고아 수용체는 절지동물 호몰로지를 알고 있었지만, 척추동물 외부에서 끈이 있는 척추동물 수용체의 직교체는 확인되지 않았으며, 이는 고아 수용체가 끈이 있는 [66]수용체보다 나이가 더 많다는 것을 시사한다.
- 고아 수용체는 핵 수용체의 6개 아족 모두에서 발견되며, 리간드 의존 수용체는 [7]3개 아족에서 발견됩니다.따라서, 리간드 의존성 수용체는 주로 최근의 아족에 속하는 것으로 생각되었기 때문에, 그들이 독립적으로 리간드를 결합할 수 있는 능력을 얻은 것은 논리적으로 보였다.
- 나무 내에서 주어진 핵 수용체의 계통발생학적 위치는 DNA 결합 영역 및 이량체화 능력과 관련이 있지만, 배위자 의존성 핵 수용체와 배위자의 화학적 성질 사이에는 확인된 관계가 없다.이와 더불어 리간드 의존성 수용체 사이의 진화적 관계는 전혀 다른 생합성 경로(예: TRs 및 RARs)에서 유래한 아족 결합 리간드의 밀접하게 관련된 수용체로서 별로 의미가 없었다.한편, 진화적으로 관련이 없는 아족은 유사한 리간드를 결합한다(RAR과 RXR은 각각 [66]all-trans와 9-cis 레티노인산을 결합한다).
- 1997년, 핵 수용체는 정적인 오프 및 배치에서 존재하지 않지만, 배위자가 두 상태 사이의 평형을 바꿀 수 있다는 것이 발견되었다.또한 핵 수용체는 인산화 또는 다른 번역 후 수정을 통해 배위자 비의존적인 방식으로 조절될 수 있는 것으로 밝혀졌다.따라서, 이것은 조상 고아 수용체가 어떻게 배위자 비의존적인 방식으로 조절되는 메커니즘을 제공하고, 왜 배위자 결합 도메인이 [66]보존되는지를 설명했다.
이후 10년 동안 이 가설을 테스트하기 위한 실험이 수행되었고 곧 반론이 대두되었다.
- 핵 수용체는 가장 오래된 메타조아 문인 폴리페라(Porifera) 멤버인 데모폰지 암피메돈 퀸즐랜디카의 새로 배열된 게놈에서 확인되었다.A. queenslandica 게놈은 AqNR1과 AqNR2로 알려진 두 개의 핵 수용체를 포함하고 있으며, 둘 다 결합하고 [67]배위자에 의해 조절되는 특성이 있었다.
- 리간드 의존 척추동물 수용체에 대한 호몰로지는 연체동물과 편모충에서 척추동물 외부에서 발견되었다.또한, cnidarians에서 발견된 핵 수용체는 포유류에서 구조적인 배위자를 가지고 있는 것으로 밝혀졌으며, 이는 조상 상황을 반영할 수 있다.
- HNF4 수용체와 USP 수용체는 구조분석과 질량분석 분석을 통해 [54]각각 지방산과 인지질을 결합하는 것으로 밝혀졌다.
- 핵 수용체와 배위자는 이전에 생각했던 것보다 훨씬 덜 특이적인 것으로 밝혀졌다.레티노이드는 PPAR, RORb 또는 COUP-TFII와 같은 RAR 및 RXR 이외의 포유류의 수용체와 결합할 수 있다.또한 RXR은 레티노이드, 지방산 및 인지질을 [68]포함한 광범위한 분자에 민감하다.
- 스테로이드 수용체 진화에 대한 연구는 조상 스테로이드 수용체가 배위자 에스트라디올과 결합할 수 있다는 것을 밝혀냈다.반대로 연체동물에서 발견되는 에스트로겐 수용체는 체질적으로 활성화되어 에스트로겐 관련 호르몬과 결합하지 않는다.따라서, 이것은 조상 배위자 의존성 수용체가 어떻게 [69]배위자 결합 능력을 잃을 수 있는지를 보여주는 예를 제공했다.
이 최근의 증거의 조합과 핵수용체 리간드 결합 도메인의 물리적 구조에 대한 심층적인 연구는 핵수용체의 조상 상태에 관한 새로운 가설의 출현으로 이어졌다.이 가설은 조상 수용체가 비록 약하지만 레티노이드, 스테로이드, 헴, 지방산과 같은 몇 가지 다른 소수성 분자와 결합할 수 있는 능력을 가진 지질 센서 역할을 할 수 있다는 것을 암시합니다.다양한 화합물과 상호작용하는 능력으로, 이 수용체는 복제를 통해 배위자 의존적 활성의 능력을 잃거나 특정 [68]분자에 대한 매우 특정한 수용체에 특화될 것이다.
역사
다음은 핵 수용체 [70]연구 역사상 주요 사건의 간단한 선택이다.
- 1905 – 어니스트 스탈링이 호르몬이라는 단어를 만들었다.
- 1926년 – 에드워드 캘빈 켄달과 타데우스 라이히스타인은 코티손과 티록신의 구조를 분리하여 결정하였다.
- 1929년 – 아돌프 부테난트와 에드워드 아델베르 도이시 – 독립적으로 분리하여 에스트로겐 구조를 결정
- 1958 – Elwood Jensen – 에스트로겐 수용체 분리
- 1980년대 – 피에르 챔본, 로날드 에반스 및 비욘 벤스트롬에 의한 에스트로겐, 글루코콜티코이드 및 갑상선 호르몬 수용체 복제
- 2004년 – 피에르 챔본, 로날드 에반스, 엘우드 젠슨은 노벨 의학상 이전에 자주 수여되는 알베르 라스카 기초 의학 연구상을 수상했습니다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b PDB: 3E00;Chandra V, Huang P, Hamuro Y, Raghuram S, Wang Y, Burris TP, Rastinejad F (November 2008). "Structure of the intact PPAR-gamma-RXR- nuclear receptor complex on DNA". Nature. 456 (7220): 350–6. doi:10.1038/nature07413. PMC 2743566. PMID 19043829.
- ^ Evans RM (May 1988). "The steroid and thyroid hormone receptor superfamily". Science. 240 (4854): 889–95. Bibcode:1988Sci...240..889E. doi:10.1126/science.3283939. PMC 6159881. PMID 3283939.
- ^ Olefsky JM (October 2001). "Nuclear receptor minireview series". The Journal of Biological Chemistry. 276 (40): 36863–4. doi:10.1074/jbc.R100047200. PMID 11459855. S2CID 5497175.
- ^ a b c Mangelsdorf DJ, Thummel C, Beato M, Herrlich P, Schütz G, Umesono K, Blumberg B, Kastner P, Mark M, Chambon P, Evans RM (December 1995). "The nuclear receptor superfamily: the second decade". Cell. 83 (6): 835–9. doi:10.1016/0092-8674(95)90199-X. PMC 6159888. PMID 8521507.
- ^ a b Novac N, Heinzel T (December 2004). "Nuclear receptors: overview and classification". Current Drug Targets. Inflammation and Allergy. 3 (4): 335–46. doi:10.2174/1568010042634541. PMID 15584884.
- ^ a b c Nuclear Receptors Nomenclature Committee (April 1999). "A unified nomenclature system for the nuclear receptor superfamily". Cell. 97 (2): 161–3. doi:10.1016/S0092-8674(00)80726-6. PMID 10219237. S2CID 36659104.
- ^ a b c d Laudet V (December 1997). "Evolution of the nuclear receptor superfamily: early diversification from an ancestral orphan receptor". Journal of Molecular Endocrinology. 19 (3): 207–26. doi:10.1677/jme.0.0190207. PMID 9460643. S2CID 16419929.
- ^ Escriva H, Langlois MC, Mendonça RL, Pierce R, Laudet V (May 1998). "Evolution and diversification of the nuclear receptor superfamily". Annals of the New York Academy of Sciences. 839 (1): 143–6. Bibcode:1998NYASA.839..143E. doi:10.1111/j.1749-6632.1998.tb10747.x. PMID 9629140. S2CID 11164838.
- ^ Reitzel AM, Pang K, Ryan JF, Mullikin JC, Martindale MQ, Baxevanis AD, Tarrant AM (February 2011). "Nuclear receptors from the ctenophore Mnemiopsis leidyi lack a zinc-finger DNA-binding domain: lineage-specific loss or ancestral condition in the emergence of the nuclear receptor superfamily?". EvoDevo. 2 (1): 3. doi:10.1186/2041-9139-2-3. PMC 3038971. PMID 21291545.
- ^ Bridgham JT, Eick GN, Larroux C, Deshpande K, Harms MJ, Gauthier ME, Ortlund EA, Degnan BM, Thornton JW (October 2010). "Protein evolution by molecular tinkering: diversification of the nuclear receptor superfamily from a ligand-dependent ancestor". PLOS Biology. 8 (10): e1000497. doi:10.1371/journal.pbio.1000497. PMC 2950128. PMID 20957188.
- ^ Sluder AE, Maina CV (April 2001). "Nuclear receptors in nematodes: themes and variations". Trends in Genetics. 17 (4): 206–13. doi:10.1016/S0168-9525(01)02242-9. PMID 11275326.
- ^ Cheatle Jarvela AM, Pick L (2017). "The Function and Evolution of Nuclear Receptors in Insect Embryonic Development". Current Topics in Developmental Biology. 125: 39–70. doi:10.1016/bs.ctdb.2017.01.003. ISBN 9780128021729. PMID 28527580.
- ^ Schaaf MJ (2017). "Nuclear receptor research in zebrafish". Journal of Molecular Endocrinology. 59 (1): R65–R76. doi:10.1530/JME-17-0031. PMID 28438785.
- ^ a b Zhang Z, Burch PE, Cooney AJ, Lanz RB, Pereira FA, Wu J, Gibbs RA, Weinstock G, Wheeler DA (April 2004). "Genomic analysis of the nuclear receptor family: new insights into structure, regulation, and evolution from the rat genome". Genome Research. 14 (4): 580–90. doi:10.1101/gr.2160004. PMC 383302. PMID 15059999.
- ^ Overington JP, Al-Lazikani B, Hopkins AL (December 2006). "How many drug targets are there?". Nature Reviews. Drug Discovery. 5 (12): 993–6. doi:10.1038/nrd2199. PMID 17139284. S2CID 11979420.
- ^ Benoit G, Cooney A, Giguere V, Ingraham H, Lazar M, Muscat G, Perlmann T, Renaud JP, Schwabe J, Sladek F, Tsai MJ, Laudet V (December 2006). "International Union of Pharmacology. LXVI. Orphan nuclear receptors". Pharmacological Reviews. 58 (4): 798–836. doi:10.1124/pr.58.4.10. PMID 17132856. S2CID 2619263.
- ^ Mohan R, Heyman RA (2003). "Orphan nuclear receptor modulators". Current Topics in Medicinal Chemistry. 3 (14): 1637–47. doi:10.2174/1568026033451709. PMID 14683519.
- ^ Kumar R, Thompson EB (May 1999). "The structure of the nuclear hormone receptors". Steroids. 64 (5): 310–9. doi:10.1016/S0039-128X(99)00014-8. PMID 10406480. S2CID 18333397.
- ^ Klinge CM (May 2000). "Estrogen receptor interaction with co-activators and co-repressors". Steroids. 65 (5): 227–51. doi:10.1016/S0039-128X(99)00107-5. PMID 10751636. S2CID 41160722.
- ^ a b Wärnmark A, Treuter E, Wright AP, Gustafsson JA (October 2003). "Activation functions 1 and 2 of nuclear receptors: molecular strategies for transcriptional activation". Molecular Endocrinology. 17 (10): 1901–9. doi:10.1210/me.2002-0384. PMID 12893880.
- ^ Wu W, LoVerde PT (2021). "Identification and evolution of nuclear receptors in Platyhelminths". PLOS ONE. 16(8): e0250750 (8): e0250750. Bibcode:2021PLoSO..1650750W. doi:10.1371/journal.pone.0250750. PMC 8363021. PMID 34388160.
- ^ Weatherman RV, Fletterick RJ, Scanlan TS (1999). "Nuclear-receptor ligands and ligand-binding domains". Annual Review of Biochemistry. 68: 559–81. doi:10.1146/annurev.biochem.68.1.559. PMID 10872460.
- ^ Chandra V, Huang P, Potluri N, Wu D, Kim Y, Rastinejad F (March 2013). "Multidomain integration in the structure of the HNF-4α nuclear receptor complex". Nature. 495 (7441): 394–8. Bibcode:2013Natur.495..394C. doi:10.1038/nature11966. PMC 3606643. PMID 23485969.
- ^ Lou X, Toresson G, Benod C, Suh JH, Philips KJ, Webb P, Gustafsson JA (March 2014). "Structure of the retinoid X receptor α-liver X receptor β (RXRα-LXRβ) heterodimer on DNA". Nature Structural & Molecular Biology. 21 (3): 277–81. doi:10.1038/nsmb.2778. PMID 24561505. S2CID 23226682.
- ^ PDB: 2C7A; Roemer SC, Donham DC, Sherman L, Pon VH, Edwards DP, Churchill ME (December 2006). "Structure of the progesterone receptor-deoxyribonucleic acid complex: novel interactions required for binding to half-site response elements". Molecular Endocrinology. 20 (12): 3042–52. doi:10.1210/me.2005-0511. PMC 2532839. PMID 16931575.
- ^ PDB: 3L0L; Jin L, Martynowski D, Zheng S, Wada T, Xie W, Li Y (May 2010). "Structural basis for hydroxycholesterols as natural ligands of orphan nuclear receptor RORgamma". Molecular Endocrinology. 24 (5): 923–9. doi:10.1210/me.2009-0507. PMC 2870936. PMID 20203100.
- ^ a b c d Amoutzias GD, Pichler EE, Mian N, De Graaf D, Imsiridou A, Robinson-Rechavi M, Bornberg-Bauer E, Robertson DL, Oliver SG (July 2007). "A protein interaction atlas for the nuclear receptors: properties and quality of a hub-based dimerisation network". BMC Systems Biology. 1: 34. doi:10.1186/1752-0509-1-34. PMC 1971058. PMID 17672894.
- ^ Linja MJ, Porkka KP, Kang Z, Savinainen KJ, Jänne OA, Tammela TL, Vessella RL, Palvimo JJ, Visakorpi T (February 2004). "Expression of androgen receptor coregulators in prostate cancer". Clinical Cancer Research. 10 (3): 1032–40. doi:10.1158/1078-0432.CCR-0990-3. PMID 14871982. S2CID 8038717.
- ^ Klinge CM, Bodenner DL, Desai D, Niles RM, Traish AM (May 1997). "Binding of type II nuclear receptors and estrogen receptor to full and half-site estrogen response elements in vitro". Nucleic Acids Research. 25 (10): 1903–12. doi:10.1093/nar/25.10.1903. PMC 146682. PMID 9115356.
- ^ Rual, Jean-François; Venkatesan, Kavitha; Hao, Tong; Hirozane-Kishikawa, Tomoko; Dricot, Amélie; Li, Ning; Berriz, Gabriel F.; Gibbons, Francis D.; Dreze, Matija; Ayivi-Guedehoussou, Nono; Klitgord, Niels (2005-10-20). "Towards a proteome-scale map of the human protein-protein interaction network". Nature. 437 (7062): 1173–1178. Bibcode:2005Natur.437.1173R. doi:10.1038/nature04209. ISSN 1476-4687. PMID 16189514. S2CID 4427026.
- ^ Albers, Michael; Kranz, Harald; Kober, Ingo; Kaiser, Carmen; Klink, Martin; Suckow, Jörg; Kern, Rainer; Koegl, Manfred (February 2005). "Automated yeast two-hybrid screening for nuclear receptor-interacting proteins". Molecular & Cellular Proteomics. 4 (2): 205–213. doi:10.1074/mcp.M400169-MCP200. ISSN 1535-9476. PMID 15604093. S2CID 14876486.
- ^ Glass CK, Rosenfeld MG (January 2000). "The coregulator exchange in transcriptional functions of nuclear receptors". Genes & Development. 14 (2): 121–41. doi:10.1101/gad.14.2.121. PMID 10652267. S2CID 12793980.
- ^ Aranda A, Pascual A (July 2001). "Nuclear hormone receptors and gene expression". Physiological Reviews. 81 (3): 1269–304. doi:10.1152/physrev.2001.81.3.1269. hdl:10261/79944. PMID 11427696. S2CID 5972234.
- ^ Copland JA, Sheffield-Moore M, Koldzic-Zivanovic N, Gentry S, Lamprou G, Tzortzatou-Stathopoulou F, Zoumpourlis V, Urban RJ, Vlahopoulos SA (June 2009). "Sex steroid receptors in skeletal differentiation and epithelial neoplasia: is tissue-specific intervention possible?". BioEssays. 31 (6): 629–41. doi:10.1002/bies.200800138. PMID 19382224. S2CID 205469320.
- ^ Brzozowski AM, Pike AC, Dauter Z, Hubbard RE, Bonn T, Engström O, Ohman L, Greene GL, Gustafsson JA, Carlquist M (October 1997). "Molecular basis of agonism and antagonism in the oestrogen receptor". Nature. 389 (6652): 753–8. Bibcode:1997Natur.389..753B. doi:10.1038/39645. PMID 9338790. S2CID 4430999.
- ^ Shiau AK, Barstad D, Loria PM, Cheng L, Kushner PJ, Agard DA, Greene GL (December 1998). "The structural basis of estrogen receptor/coactivator recognition and the antagonism of this interaction by tamoxifen". Cell. 95 (7): 927–37. doi:10.1016/S0092-8674(00)81717-1. PMID 9875847. S2CID 10265320.
- ^ Gronemeyer H, Gustafsson JA, Laudet V (November 2004). "Principles for modulation of the nuclear receptor superfamily". Nature Reviews. Drug Discovery. 3 (11): 950–64. doi:10.1038/nrd1551. PMID 15520817. S2CID 205475111.
- ^ Busch BB, Stevens WC, Martin R, Ordentlich P, Zhou S, Sapp DW, Horlick RA, Mohan R (November 2004). "Identification of a selective inverse agonist for the orphan nuclear receptor estrogen-related receptor alpha". Journal of Medicinal Chemistry. 47 (23): 5593–6. doi:10.1021/jm049334f. PMID 15509154.
- ^ Smith CL, O'Malley BW (February 2004). "Coregulator function: a key to understanding tissue specificity of selective receptor modulators". Endocrine Reviews. 25 (1): 45–71. doi:10.1210/er.2003-0023. PMID 14769827.
- ^ Pascual G, Glass CK (October 2006). "Nuclear receptors versus inflammation: mechanisms of transrepression". Trends in Endocrinology and Metabolism. 17 (8): 321–7. doi:10.1016/j.tem.2006.08.005. PMID 16942889. S2CID 19612552.
- ^ Björnström L, Sjöberg M (June 2004). "Estrogen receptor-dependent activation of AP-1 via non-genomic signalling". Nuclear Receptor. 2 (1): 3. doi:10.1186/1478-1336-2-3. PMC 434532. PMID 15196329.
- ^ Zivadinovic D, Gametchu B, Watson CS (2005). "Membrane estrogen receptor-alpha levels in MCF-7 breast cancer cells predict cAMP and proliferation responses". Breast Cancer Research. 7 (1): R101–12. doi:10.1186/bcr958. PMC 1064104. PMID 15642158.
- ^ Kousteni S, Bellido T, Plotkin LI, O'Brien CA, Bodenner DL, Han L, Han K, DiGregorio GB, Katzenellenbogen JA, Katzenellenbogen BS, Roberson PK, Weinstein RS, Jilka RL, Manolagas SC (March 2001). "Nongenotropic, sex-nonspecific signaling through the estrogen or androgen receptors: dissociation from transcriptional activity". Cell. 104 (5): 719–30. doi:10.1016/S0092-8674(01)00268-9. PMID 11257226. S2CID 10642274.
- ^ Storey NM, Gentile S, Ullah H, Russo A, Muessel M, Erxleben C, Armstrong DL (March 2006). "Rapid signaling at the plasma membrane by a nuclear receptor for thyroid hormone". Proceedings of the National Academy of Sciences of the United States of America. 103 (13): 5197–201. Bibcode:2006PNAS..103.5197S. doi:10.1073/pnas.0600089103. PMC 1458817. PMID 16549781.
- ^ Storey NM, O'Bryan JP, Armstrong DL (January 2002). "Rac and Rho mediate opposing hormonal regulation of the ether-a-go-go-related potassium channel". Current Biology. 12 (1): 27–33. doi:10.1016/S0960-9822(01)00625-X. PMID 11790300. S2CID 8608805.
- ^ a b Martin NP, Marron Fernandez de Velasco E, Mizuno F, Scappini EL, Gloss B, Erxleben C, Williams JG, Stapleton HM, Gentile S, Armstrong DL (September 2014). "A rapid cytoplasmic mechanism for PI3 kinase regulation by the nuclear thyroid hormone receptor, TRβ, and genetic evidence for its role in the maturation of mouse hippocampal synapses in vivo". Endocrinology. 155 (9): 3713–24. doi:10.1210/en.2013-2058. PMC 4138568. PMID 24932806.
- ^ Gilbert ME (January 2004). "Alterations in synaptic transmission and plasticity in area CA1 of adult hippocampus following developmental hypothyroidism". Brain Research. Developmental Brain Research. 148 (1): 11–8. doi:10.1016/j.devbrainres.2003.09.018. PMID 14757514.
- ^ Moeller LC, Broecker-Preuss M (August 2011). "Transcriptional regulation by nonclassical action of thyroid hormone". Thyroid Research. 4 Suppl 1: S6. doi:10.1186/1756-6614-4-S1-S6. PMC 3155112. PMID 21835053.
- ^ a b c d e f g h i j k Kaur S, Jobling S, Jones CS, Noble LR, Routledge EJ, Lockyer AE (7 April 2015). "The nuclear receptors of Biomphalaria glabrata and Lottia gigantea: implications for developing new model organisms". PLOS ONE. 10 (4): e0121259. Bibcode:2015PLoSO..1021259K. doi:10.1371/journal.pone.0121259. PMC 4388693. PMID 25849443.
- ^ Crossgrove K, Laudet V, Maina CV (February 2002). "Dirofilaria immitis encodes Di-nhr-7, a putative orthologue of the Drosophila ecdysone-regulated E78 gene". Molecular and Biochemical Parasitology. 119 (2): 169–77. doi:10.1016/s0166-6851(01)00412-1. PMID 11814569.
- ^ "sex-1 (gene)". WormBase : Nematode Information Resource.
- ^ Otte K, Kranz H, Kober I, Thompson P, Hoefer M, Haubold B, Remmel B, Voss H, Kaiser C, Albers M, Cheruvallath Z, Jackson D, Casari G, Koegl M, Pääbo S, Mous J, Kremoser C, Deuschle U (February 2003). "Identification of farnesoid X receptor beta as a novel mammalian nuclear receptor sensing lanosterol". Molecular and Cellular Biology. 23 (3): 864–72. doi:10.1128/mcb.23.3.864-872.2003. PMC 140718. PMID 12529392.
- ^ "FlyBase Gene Report: Dmel\Hr96". FlyBase. Retrieved 14 August 2019.
- ^ a b Schwabe JW, Teichmann SA (January 2004). "Nuclear receptors: the evolution of diversity". Science's STKE. 2004 (217): pe4. doi:10.1126/stke.2172004pe4. PMID 14747695. S2CID 20835274.
- ^ Kruse SW, Suino-Powell K, Zhou XE, Kretschman JE, Reynolds R, Vonrhein C, et al. (September 2008). "Identification of COUP-TFII orphan nuclear receptor as a retinoic acid-activated receptor". PLOS Biology. 6 (9): e227. doi:10.1371/journal.pbio.0060227. PMC 2535662. PMID 18798693.
- ^ Markov GV, Gutierrez-Mazariegos J, Pitrat D, Billas IM, Bonneton F, Moras D, et al. (March 2017). "Origin of an ancient hormone/receptor couple revealed by resurrection of an ancestral estrogen". Science Advances. 3 (3): e1601778. Bibcode:2017SciA....3E1778M. doi:10.1126/sciadv.1601778. PMC 5375646. PMID 28435861.
- ^ a b Khalturin K, Billas I, Chebaro Y, Reitzel AM, Tarrant AM, Laudet V, Markov GV (November 2018). "NR3E receptors in cnidarians : a new family of steroid receptor relatives extends the possible mechanisms for ligand binding". J Steroid Biochem Mol Biol. 184: 11–19. doi:10.1016/j.jsbmb.2018.06.014. PMC 6240368. PMID 29940311.
- ^ Wu W, Niles EG, Hirai H, LoVerde PT (February 2007). "Evolution of a novel subfamily of nuclear receptors with members that each contain two DNA binding domains". BMC Evolutionary Biology. 7: 27. doi:10.1186/1471-2148-7-27. PMC 1810520. PMID 17319953.
- ^ Huang W, Xu F, Li J, Li L, Que H, Zhang G (August 2015). "Evolution of a novel nuclear receptor subfamily with emphasis on the member from the Pacific oyster Crassostrea gigas". Gene. 567 (2): 164–72. doi:10.1016/j.gene.2015.04.082. PMID 25956376.
- ^ "nhr-1 (gene)". WormBase : Nematode Information Resource.
- ^ Marxreiter S, Thummel CS (February 2018). "Adult functions for the Drosophila DHR78 nuclear receptor". Developmental Dynamics. 247 (2): 315–322. doi:10.1002/dvdy.24608. PMC 5771960. PMID 29171103.
- ^ Evans RM (May 1988). "The steroid and thyroid hormone receptor superfamily". Science. 240 (4854): 889–95. Bibcode:1988Sci...240..889E. doi:10.1126/science.3283939. PMC 6159881. PMID 3283939.
- ^ Moore DD (January 1990). "Diversity and unity in the nuclear hormone receptors: a terpenoid receptor superfamily". The New Biologist. 2 (1): 100–5. PMID 1964083.
- ^ Laudet V, Hänni C, Coll J, Catzeflis F, Stéhelin D (March 1992). "Evolution of the nuclear receptor gene superfamily". The EMBO Journal. 11 (3): 1003–13. doi:10.1002/j.1460-2075.1992.tb05139.x. PMC 556541. PMID 1312460.
- ^ Escriva H, Safi R, Hänni C, Langlois MC, Saumitou-Laprade P, Stehelin D, Capron A, Pierce R, Laudet V (June 1997). "Ligand binding was acquired during evolution of nuclear receptors". Proceedings of the National Academy of Sciences of the United States of America. 94 (13): 6803–8. Bibcode:1997PNAS...94.6803E. doi:10.1073/pnas.94.13.6803. PMC 21239. PMID 9192646.
- ^ a b c Escriva H, Delaunay F, Laudet V (August 2000). "Ligand binding and nuclear receptor evolution". BioEssays. 22 (8): 717–27. doi:10.1002/1521-1878(200008)22:8<717::AID-BIES5>3.0.CO;2-I. PMID 10918302. S2CID 45891497.
- ^ Bridgham JT, Eick GN, Larroux C, Deshpande K, Harms MJ, Gauthier ME, Ortlund EA, Degnan BM, Thornton JW (October 2010). "Protein evolution by molecular tinkering: diversification of the nuclear receptor superfamily from a ligand-dependent ancestor". PLOS Biology. 8 (10): e1000497. doi:10.1371/journal.pbio.1000497. PMC 2950128. PMID 20957188.
- ^ a b Markov GV, Laudet V (March 2011). "Origin and evolution of the ligand-binding ability of nuclear receptors". Molecular and Cellular Endocrinology. Evolution of Nuclear Hormone Receptors. 334 (1–2): 21–30. doi:10.1016/j.mce.2010.10.017. PMID 21055443. S2CID 33537979.
- ^ Thornton JW, Need E, Crews D (September 2003). "Resurrecting the ancestral steroid receptor: ancient origin of estrogen signaling". Science. 301 (5640): 1714–7. Bibcode:2003Sci...301.1714T. doi:10.1126/science.1086185. PMID 14500980. S2CID 37628350.
- ^ Tata JR (June 2005). "One hundred years of hormones". EMBO Reports. 6 (6): 490–6. doi:10.1038/sj.embor.7400444. PMC 1369102. PMID 15940278.
외부 링크
- 미국 국립 의학 도서관(MeSH)의 핵+수용체
- Vincent Laudet (2006). "The IUPHAR Compendium of the Pharmacology and Classification of the Nuclear Receptor Superfamily 2006E". Nuclear Receptor Compendium. The International Union of Basic and Clinical Pharmacology. Retrieved 2008-02-21.
- "Nuclear Receptor online journal". Home page. published by BioMed Central (no longer accepting submissions since May 2007). Retrieved 2008-02-21.
- "Nuclear Receptor Resource". Georgetown University. Archived from the original on 2008-05-11. Retrieved 2008-02-21.
- "Nuclear Receptor Signaling Atlas (Receptors, Coactivators, Corepressors and Ligands)". The NURSA Consortium. Retrieved 2008-02-21.
an NIH-funded research consortium and database; includes open-access PubMed-indexed journal, Nuclear Receptor Signaling
- "Nuclear Receptor Resource". Jack Vanden Heuvel. Retrieved 2009-09-21.









